Method Article
Измерения взаимодействий шаровых и волокнистых белков спектроскопия ядерного магнитного резонанса (ЯМР) и микромасштабной Thermophoresis (MST)
В этой статье
Резюме
Здесь мы представляем собой протокол для производства и очистки белков, которые помечены с стабильных изотопов и последующая характеристика белок белковых взаимодействий с помощью ядерного магнитного резонанса (ЯМР) спектроскопии и микромасштабной Thermophoresis (MST) эксперименты.
Аннотация
Волокнистых белков, таких как виментин предоставляют Организации внутри клетки, обеспечивая структурный леску с сайтами, которые связывают белки, содержащие plakin повторяется. Здесь протокол для обнаружения и измерения такого взаимодействия описываются с помощью шаровых plakin повторить домен envoplakin и спирально катушка виментин. Это обеспечивает основу для определения ли протеин связывает виментин (или аналогичных волокнистых белков), а также для измерения соответствия взаимодействия. Глобулярных белков интерес помечены 15N и титруют с виментин белка в растворе. Двумерный спектр ЯМР приобретается для обнаружения взаимодействия путем наблюдения изменений в пик формы или химические сдвиги и для выяснения последствий решения условий, включая соли, которые влияют виментин четвертичной структуры. Если протеин интереса связывает нитчатые лиганд, привязки взаимодействия количественно по MST, с использованием очищенных белков. Этот подход является простым способом для определения ли протеин интереса связывает нити и оценки, как изменения, например мутации или условий урегулирования, влияют на взаимодействие.
Введение
Взаимодействие между белками позволяют создание молекулярных машин, которые создают порядок внутри клетки. Отдельные взаимодействия часто слабы, но обычно способствуют многовалентных комплексов, которые могут быть совместные и динамически регулируемых. Чувствительные анализы, которые обеспечивают атомной резолюции и количественной информации о таких сложных взаимодействий необходимо вывести механизмов и разработка мероприятий таких наркотиков, как молекулы. ЯМР-спектроскопия является эффективным методом для получения такой информации о взаимодействии белков, а также используется для быстрого скрининга для лигандов, включая те, которые связывают слабо1. NMR методах можно разделить на те, которые следует соблюдать белка или наблюдать лиганда. Эта рукопись использует первый подход, в котором приобретается спектр стабильный изотоп, помечены белок, который является сравнительно небольшой (обычно под 20 кДа) и титруют немеченого лиганда. Это позволило помечены остатков участвующих во взаимодействии сопоставляемых в благоприятных случаях. После сложных форм, есть изменения в химических сред взаимодействующих остатков, которые проявляются как изменения в химический сдвиг и форма их NMR сигналов. Степень таких изменений коррелирует со степенью участия этих групп в области взаимодействия. Химический сдвиг возмущений (CSP) может измеряться путем сравнения серии NMR спектров белка, собранных в отсутствие и наличие различную лиганд. Для более крупных лигандами или сложных взаимодействий изменения в пик формы или интенсивности может быть измерена вывести взаимодействий.
Наиболее распространенными 2D эксперимент, используется для обнаружения взаимодействия лигандов- 15N-гетероядерных одного квантовые корреляции (HSQC) эксперимент2. Это требует, чтобы один белок равномерно помечены 15N, который обычно достигается путем выражения их как сродство тегами версий в E. coli бактериальных культурах, выращиваемых в 15N-обогащенного СМИ. Привязка является очевидной, когда накладываются спектры HSQC, собранных в ходе титрования, показывая изменения пик для подмножества остатков, участвует в формировании комплекса. Взаимодействие может происходить в режиме быстрого обмена, где сигналы свободной и лиганд насыщенный состояния свернуть в одной популяции в среднем пик. Кроме того в случае медленного обмен между государствами, как сигналы наблюдаются с интегралов, которые представляют собой их относительной суммы. В то время как ЯМР lineshape анализ может использоваться для оценки привязки сходство в некоторых случаях, такие методы, как MST также оказались удобной и обеспечивают перекрестной проверки подлинного взаимодействия.
Приведенный пример имеет двух белков, обнаруженных в пределах десмосом. Они посредником соединения между поверхностями клеток и цитоскелета и разносторонним взаимодействие между машинами адгезии клеток и промежуточные филаменты для поддержания целостности кожи и ткани сердца и выдерживать из перерезывающих сил. Заболевания может привести при desmosomal белков, таких как десмоплакином или виментин скомпрометированы мутации или аутоантител, привело к дестабилизации ячеек развязок, и поэтому их взаимодействия имеют решающее значение3. Структурной основой Связывание лиганда desmosomal белков может характеризоваться ЯМР спектроскопии, в то время как взаимодействия могут быть количественно в MST. Здесь методы были использованы для описания взаимодействия между plakin повторить домены (PRDs), которые часто присутствуют как тандемные наборы, которые предлагают основные канавки и виментин, промежуточного накаливания, который взаимодействует через мультикислотный поверхностный, предлагаемых его винтовой Комплект4. Эти комплексы формируются на клеточные мембраны, где они якорь для промежуточных филаментов цитоскелета клетки к десмосомы, которые подключаются к смежных ячеек, формируя таким образом сеть клей облигаций, которые излучает всей ткани.
протокол
1. рекомбинантных белков
-
Выражение Envoplakin ПДР (E-ОД) и 99 виментин-249 (VimRod)
- Трансформировать E. coli BL21(DE3) клетки с плазмида, содержащий нужный ген. Распространение на плиты агара, содержащие 100 мкг/мл ампициллин ячейки. Инкубируйте пластины при 37 ° C на ночь.
- Выбрать один колонии и прививать потрясающий бульона (ТБ) 20 мл раствора, содержащего 100 мкг/мл ампициллин выбрать для плазмида. Растут культуры при 37 ° C при встряхивании (180 об/мин) на ночь.
- Передача культуры всего 20 мл до 1 Л ТБ, содержащий ампициллина 50 мкг/мл. Инкубировать культуры при 37 ° C с встряхивания на 180 об/мин до од600 = 0,6-0,8.
- Снизить температуру на 18 ° C и побудить выражение протеина, добавив изопропиловым β-D-1-тиогалактопиранозид (IPTG) до конечной концентрации 1 мм. Продолжать инкубации при 18 ° C с встряхивания на 160 об/мин на ночь чтобы позволить выражения протеина.
- Урожай клетки центрифугированием культуры на 8000 x g 15 мин Decant и удалить супернатант.
- Мыть собранный клетки, resuspending клетки Пелле в приблизительно 40 мл фосфата буфер солевой раствор (PBS: 20 мм фосфатного буфера, рН 7,4, 120 мм NaCl). Передать ресуспендирования Тюбик 50 мл. Центрифуга снова на 8000 x g за 15 мин.
- Декантируют и удалить супернатант. Немедленно начать очищение протокол или заморозить гранулы клеток при-20 ° C для использования в будущем.
-
Выражение гетерогенны помечены белка
- Трансформировать E. coli BL21(DE3) клеток и подготовить 20 мл закваски как 1.1.1-1.1.2.
- Передача культуры всего 20 мл до 1 Л обогащенного ТБ, содержащий дополнительные 4.0 g Триптон, 5,0 г NaCl и 100 мкг/мл ампициллина. Инкубировать культуры при 37 ° C при встряхивании в 160 об/мин до од600 = 1,6-1.9.
- Урожай 1 Л культура центрифугированием в 8000 x g 15 мин Decant и удалить супернатант.
- Помыть лепешка клеток, осторожно resuspending в примерно 40 мл PBS и передачи ресуспендирования Тюбик 50 мл.
- Центрифуга снова на 8000 x g 15 мин Decant и удалить супернатант.
- Ресуспензируйте Пелле клеток в 20 мл M9 минимальные средства массовой информации (Таблица 1) и передать оставшуюся часть 950 мл M9 минимальные средства массовой информации, содержащий ампициллина 100 мкг/мл.
- Добавьте 50 мл питательной смеси фильтр стерилизованные (таблицы 2 и 3).
- Акклиматизировать культуры до 18 ° C на 30 минут перед добавлением IPTG в конечной концентрации 1 мм.
- Инкубируйте на ночь на 18 ° C с встряхивания на 160 об/мин.
- Урожай клетки как в разделе 1.1.4-1.1.6.
2. иммобилизованные метал близость хроматографии (ИАЦ) очистки VimRod и E-PRD
-
Очистка His6-меткой VimRod
- Ресуспензируйте Пелле клеток в 5 мл/г PBS, содержащий ингибитор протеазы коктейль не хватает ЭДТА. Однородный с 12 ударов в Dounce ткани гомогенизатор для улучшения лизиса клеток в следующем шаге.
- На льду sonicate суспензию клеток на импульса 1/1 сек выкл, 80% амплитуды для в общей сложности 1,5 мин повторить sonication два дополнительных раз, осторожно закрученного на льду между запусками для предотвращения перегрева.
- Центрифугуйте образцы на 75 000 x g 45 мин Decant и фильтр супернатанта, с помощью шприца фильтра (0,45 мкм).
- Сбалансировать столбец IMAC 5 мл с 5 томов (CV) столбец привязки буфера (20 мм HEPES, рН 7,5, 500 мм NaCl, 10 мм имидазола) со скоростью потока с помощью жидкостной хроматографии (ПСОК) системы быстро белок 1 мл/мин.
- Загрузите отфильтрованные супернатант на столбец со скоростью потока 0,5 мл/мин.
- Промойте колонку с 5 резюме мыть буфера (20 мм HEPES, рН 7,5, 500 мм NaCl, 50 мм имидазола) со скоростью потока 1 мл/мин.
- Элюировать белка с 3 CV Элюирующий буфер (20 мм HEPES, рН 7,5, 500 мм NaCl, 350 мм имидазола) фракции 0,5 мл/мин собирать 1,5 мл со скоростью потока. Если доступно, выберите режим элюции вверх потока для повышения концентрации eluted белка.
- Идентифицировать фракции от Хроматограмма ПСОК, которые содержат протеин интереса SDS-PAGE и использовать стандартные методы для измерения концентрации белка5.
- Бассейн и сконцентрировать элюции фракций, содержащих высокий количество белка, используя устройство центробежного ультрафильтрации (MWCO 3 кДа, 5 мл) 2 мл. Центрифуга в 21000 g x, чтобы удалить любой преципитат и пройти через фильтр 0,22 мкм.
- Сбалансировать 120 мл размер исключения хроматографии (S) столбец с 2 CV S буфера (20 мм HEPES, 150 мм NaCl, pH 7.5, 0,5 мм TCEP) со скоростью потока 1 мл/мин с помощью ПСОК.
- Привнести концентрированных белков от 2.1.9 на столбец, а элюировать с 1 CV S буфера со скоростью потока 0,5 мл/мин, сбора фракций 1 мл.
- Выявления фракций, содержащих протеин интереса как раньше.
- Бильярд фракций, содержащих высокий белок суммы.
- Хранить при 4 ° C для краткосрочного использования, или добавить глицерин в 20% и хранить при температуре-80 ° C в небольших аликвоты.
-
Очистка E-PRD белка с тегом His6 удален
- Следуйте инструкциям в 2.1.1-2.1.8 для очистки His6-меткой E-PRD белка. Бассейн пик фракций и определить концентрацию белка.
- Добавить табак etch протеазы вируса (TEV) (1 мг/мл) по 2 мкл/мг белка пула. Передача для диализа трубки (6 кДа) и dialyze в буфере S на ночь при 4 ° C. Этот шаг позволяет расщепления His6 тега и удаления имидазола, которая будет конфликтовать со связыванием в Ni-НТА смолу на следующем шаге.
- Сбалансировать 5 мл Ni-НТА смолы в столбце гравитации с 3 резюме S буфера. Слейте излишки буфер из смолы.
- Залейте рассеченного E-PRD белка на смолы и инкубировать 1 час на платформу качания позволить uncleaved His6-меткой E-PRD и рассеченного His6 тега привязки. Протеазы ТэВ также His6-тегами и будет привязать смолы. Собирать через поток, который содержит тег бесплатный E-PRD. Вымойте смолы с 2 CV S буфера, чтобы гарантировать все E-PRD восстанавливается.
- Концентрат E-PRD потока через по 2 мл с помощью центробежных ультрафильтрации устройство (MWCO 3 кДа, 5 мл). Центрифуга на 21 000 x g удалить любой преципитат и пройти через фильтр 0,22 мкм.
- Сбалансировать 120 мл S столбец с 2 CV S буфера (20 мм HEPES, 150 NaCl, pH 7.5, 0,5 мм TCEP MST или 20 мм трис-HCl, 1 DTT, pH 7 для ЯМР) со скоростью потока 1 мл/мин с помощью ПСОК.
- Привнести концентрированных белков E-PRD от 2.2.5 на столбец, а элюировать с 1 CV S буфера со скоростью потока 0,5 мл/мин, сбора фракций 1 мл.
- Выявления фракций, содержащих протеин интереса как раньше.
- Бильярд фракций, содержащих высокий белок суммы.
- Хранить при 4 ° C для краткосрочного использования, или добавить глицерин в 20% и хранить при температуре-80 ° C в небольших аликвоты.
3. ЯМР методы
- Подготовка образца ЯМР
- Очищайте 15N-меченых одичал типа или R1914E E-PRD белка как описывалось ранее, с помощью 20 мм трис-HCl, 1 DTT, рН 7 как S буфер для шага 2.2.6. Белка акций решения обычно варьируются в пределах от 0,3 до 1 мм с объемами около 1 мл.
Примечание: Белка может быть сосредоточено на > 100 мкм с использованием MWCO 3 кДа, 5 мл центробежные ультрафильтрации устройство довести концентрацию в подходящий диапазон для пробоподготовки. - Очищайте образец немеченого VimRod протеина используя 20 мм трис-HCl, 1 DTT, рН 7 как S буфер для шага 2.1.10.
- В окончательном объеме 500 мкл, добавить одичал тип или мутант E-PRD белка в конечной концентрации 100µM, окись дейтерия (D2O) до конечной концентрации 10% (v/v), и DSS (4,4-dimethyl-4-silapentane-1-sulfonic кислота) до конечной концентрации 20 мкм. Принесите объем образца до 500 мкл с использованием 20 мм трис-HCl, 1 мм DTT, рН 7. Подготовка репрезентативной выборки описаны в таблице 4.
Примечание: 0 ppm резонанс DSS используется для калибровки химических сдвигов 1H, а также для косвенных ссылок на 15N химические сдвиги белок6. D2O используется для блокировки сигнала дейтерия держать спектрометр, работающих на постоянном магнитном поле чистой. - Составляют второй образец E-PRD, Д2O и DSS, как и предыдущий шаг и добавьте VimRod в конечной концентрации 50 мкм до чего объемом до 500 мкл.
- Передать 500 мкл образцы 5 мм широкий пробирки для NMR для эксперимента.
- Очищайте 15N-меченых одичал типа или R1914E E-PRD белка как описывалось ранее, с помощью 20 мм трис-HCl, 1 DTT, рН 7 как S буфер для шага 2.2.6. Белка акций решения обычно варьируются в пределах от 0,3 до 1 мм с объемами около 1 мл.
- Экспериментальная установка ЯМР
- Включите воздушного потока с извлечь команду «Эдж»; Это будет воспитывать образца от магнита. Теперь поместите образец в spinner поверх магнита, открытия и вставьте с командой «ij». Подождите, пока образец располагается внутри магнита перед продолжением.
- Создание нового набора данных с помощью команды «edc» и загрузить стандартные 1H ЯМР параметры, выбрав эксперимент «ZGPR» (рис. 1). Заполните имя, поля PROCNO (номер папки обработанных данных) и EXPNO (эксперимент номер). Выберите растворителя в поле «Набор растворителя» и нажмите на «Execute «getprosol»», чтобы прочитать параметры зависит от растворителя (prosol) и стандартных probehead.
- Замок образец транс растворителей, т.е., D2O, с помощью команды «блокировка» и подождите, пока он закончен Подметальные и достигает блокировки.
- Исправьте частоты резонанса магнита, тюнинг образца с помощью автоматической настройки команды «Атма». Контролировать колебания кривой до завершения автоматической настройки.
- Оболочку магнитного поля с помощью TOPSHIM (команда «topshim»). Шиммирования — процесс изменения магнитного поля для достижения единообразия вокруг образца. Это хорошая практика для хранения значений ШИМ с командой «wsh» и прочитать их с помощью «rsh» перед topshim, при использовании же или аналогичные образцы.
- Настройка усиления приемника с помощью команды «ПГА» для достижения максимальной соотношение сигнал-шум.
- Поместите центр спектра на смещение воды резонанс (o1) и задайте Протон пульс 90 градусов (p1) при высокой мощности, используя «calibo1p1».
- Собирать Протон спектра с помощью нулевого идти процесса с «efp», которая включает в себя экспоненциального умножения («ет»), спад свободной индукции (FID) включения расширения линии, «ft» и команда «ЖГ» преобразование Фурье FID и «pk», чтобы применить фазы Коррекция.
- Примените автоматический фаза коррекции «АПК» и автоматическая коррекция базовой линии «АБСН» с помощью многочлена без вариант интеграции.
- Создайте новый набор данных (как в 3.2.2) для эксперимента SOFAST HMBC, выбрав «SFHMQC3GPPH» в эксперименте.
- Копия оптимизирован P1 и O1 из спектра Протон и заполнения P1 зависит от импульсов с помощью команды «getprosol 1H p1 plw1», где p1 — это оптимизированная значение P1 и plw1 уровень мощности для P1.
- Оптимизировать константа CNST54 установить смещение для Амида химический сдвиг и CNST55 для определения пропускной способности для того, чтобы охватить спектральный областей интереса, который позволяет усиления приемника, чтобы быть оптимизированы (рис. 2). Чтобы выбрать эти параметры, извлечь первый FID (спад свободной индукции) из двумерных спектра и найдите наблюдаемых сигнала для их определения. Кроме того различаются релаксации задержки (D1), количество проверок (NS) и Макетные сканирования (DS) для получения приемлемого сигнал чувствительности с командой «gs», которая позволяет идти и сканирования для контроля качества данных в режиме реального времени.
- Запишите спектры с использованием нуля идти «ЖГ».
- Обработка данных ЯМР
- Задайте параметры обработки размер прямого F2 (1H) и косвенные F1 (15N) размеры с помощью спектра «SI F2 = 2048, F1 = 512» с Факультативным линейное предсказание в косвенные измерения (рис. 3).
- Выберите «QSINE» как функции окна и введите синус Белл сдвиг (SSB) 2 для обработки двумерных спектра.
- Введите команду «xfb» для обработки данных в обоих направлениях с окна функция и Фурье преобразованием.
- Используйте команду «apk2d» для выполнения автоматического фаза коррекции в обоих направлениях. Если автоматический процесс не достичь удовлетворительного уровня фаза коррекции, экстракт FIDs с командой «rser», рассчитать значения фазы 1D обработка и применить их к 2D данных.
- Измените базовый с функцией коррекции Автоматическое вычитание базовой линии «abs2» для 2D-данных. Это применяется полиномиальная функция между ppm значения, определенные в параметрах обработки и будет производить 2D спектра для дальнейшего анализа.
- Если планирование для выполнения последовательной обработки для сравнения данных взаимодействия с другой молекулой, хранить параметры обработки с командой «wpar» и вызывать их с «ЭОНР». Таким образом, все наборы данных будут обрабатываться с же параметры и варианты будут вводиться не из-за обработки различия.
- Анализ данных ЯМР
- Введите команду «pp» начать процесс сбора пик.
- Определите ppm диапазона и минимальная интенсивность/максимальное количество вершин, на основе ожидаемого пика (рис. 4). Нажмите на кнопку ОК и проверьте результаты путем визуального осмотра. При необходимости, повторите этот процесс до тех пор, пока результаты являются удовлетворительными, базируясь на спектры качества.
- Создание peaklist с командой «РР».
Примечание: Этот peaklist содержит сведения о данных высота/пика интенсивности по умолчанию и могут быть экспортированы в последующих спектров и могут быть прочитаны другими программами. - Наблюдаете изменения в интенсивности пик или движения в химически переносы в спектры HSQC белка, определяющие взаимодействие с другой молекулой. Если взаимодействующие молекула является большой, ожидаете сокращения пиковых значений силы наряду с исчезновением некоторых вершин.
- Импортируйте список пик на следующий набор данных, щелкнув на закладке «пики» и выбрав команду «Импорт» с правой кнопкой мыши в окне пиков.
- Визуализировать вершины над спектра и, если необходимо перенести их на новые позиции. Нажмите на «сброс интенсивности» для «полной таблицы» для создания peaklist для спектра с интенсивностью (рис. 5). Этот список пик будут перенесены данные позиции из списка хранимых пик.
- Экспорт списков пик из различных наборов данных в электронную таблицу или другие математические программы для анализа, выбрав функцию «Экспорт».
- Расчет изменения в интенсивности пик с функцией «пика интенсивности в сложных спектра/пика интенсивности в спектре белка» для каждого пика. Значения могут быть преобразованы в процентах путем умножения 100. Обратите внимание, что пик тома также являются полезными, хотя пика интенсивности проще для измерения пиков, которые расположены близко друг к другу, как это обычно бывает для белков с высокой плотностью относительно широкой пиков.
4. микромасштабной Thermophoresis (MST)
-
Подготовка лигандом белка E-PRD
- Обмен лиганд в MST совместимый буфер dialyzing до 800 мкл белка в мини-диализа 3.5 кДа, приостановлено в 1 Л 20 мм HEPES, рН 7,5, 10 мм NaCl, помешивая медленно при температуре 4 ° C на ночь.
- Концентрат лиганда с помощью центробежных ультрафильтрации (3 кДа MWCO) центрифугированием на 14 000 x g 10 мин передачи концентрированных белков в чистой трубку.
- Центрифуга лиганд в 21 000 x g 10 мин и тщательно передать новой трубки для удаления осажденный белки супернатант. Определить концентрацию лиганда с помощью поглощения в 280 Нм и коэффициент вымирания лиганда. Добавить 10% Tween-20 дать окончательный 0,015% концентрации. Tween-20 добавляется в Пробирной буфер для предотвращения адсорбции капилляров. Окончательный анализ буфера, который используется для экспериментов MST-20 мм HEPES, рН 7,5, 10 мм NaCl, 0,015% Tween-20.
-
Подготовка красителя меченых целевого белка VimRod
- Воссоздать краска красно трис НТА, добавляя 50 мкл 1 x, указанный PBS-T с красно трис НТА дать в концентрации 5 мкм. Обойтись в 200 мкл пробирки 2 мкл аликвоты и хранить при температуре от-20 ° C.
- Разбавьте целевого белка до 0,34 мкм с аналитического буфера. Добавьте 58 мкл цели 2 мкл Алиготе красно трис НТА красителя и Инкубируйте 30 мин при комнатной температуре. Конечная концентрация краситель меченых цели — 0,33 мкм. Центрифуга обозначенные цели на 21 000 x g 10 мин и тщательно передать новой трубки для удаления любой преципитат супернатант. Краситель красный трис НТА связывается с белками через тег His6 и имеет Константа диссоциации привязки (DK) в суб наномолярных диапазоне. Это фактически 100% обязан целевого белка, так что без дальнейших очистки требуется.
- Включите инструмент MST и откройте программное обеспечение управления. Выберите параметр красный краситель красный трис НТА. Включите контроль температуры до 25 ° C.
- Выберите предтестовая для проверки маркировки целевого и проверьте для агрегирования или адсорбции кюветы. Оценки этих параметров предоставляется автоматически.
- Mix 17 мкл аналитического буфера и 3 мкл целевого белка и микс, закупорить. Заполните два стандартных капилляров путем погружения их в разреженных целевой и составление жидкость в центр капилляра. Место капилляров в лотке и в инструменты. Старт измерения.
- Просмотрите результаты ищет достаточный уровень флюоресценции и никаких признаков адсорбции (искажения в форме капиллярной линии) или агрегации (искажения в трассировке MST), которые будут отмечены в анализ программного обеспечения. Если результаты являются позитивным шагом к лигандом шаги, если не различные буфера должен быть судим или количество Tween-20 может быть увеличено до 0,05% или выше.
-
Подготовка два раза разрежения серии E-PRD лиганда
- Подготовить серию разрежения, снабдив 16, 200 мкл трубки из 1-16.
- Добавьте 17 мкл лиганд в 1.17 x большей концентрации, чем концентрация максимальный лиганд, желал Tube1. Этот объем является дважды необходимое количество (8,5 мкл) как Алиготе будет затем передан следующей трубы в серии. Окончательный объем assay настолько 10 мкл до 1 x 8,5 мкл 1,17 x концентрации лиганда будет разбавлена добавлением 1,5 мкл целевого белка, VimRod. Эта максимальная концентрация выбрали должно быть по крайней мере 20 раз расчетное значение KD .
- Добавьте в Tubes2-16, используя новый наконечник пипетки для каждого Алиготе 8.5 мкл аналитического буфера. Повторное использование наконечники могут повлиять на точность (для консультации по точного дозирования см с инструкциями производителя). Передача 8.5 мкл лигандом от Tube1 до Tube2 медленно выпускать решения в assay buffer без формирования пузырьков. Смешайте лиганда и буфера, закупорить вверх и вниз по крайней мере 6 раз, опять же без формирования пузырьков. E-ПДР в наиболее концентрированным трубка была 1,5 мм и помечены VimRod присутствовал на заключительном концентрации 50 Нм.
- Передавать 8.5 мкл лиганда с Tube2 на Tube3 и смешать с аналитического буфера. Повторите серийный разбавления до тех пор, пока все трубы имели лигандом добавил. Отменить 8,5 мкл от Tube16, так что все трубы содержат 8,5 мкл лиганд в серию разведений два раза.
-
Подготовка обязательной реакции и MST эксперимента
- Добавить 1,5 мкл помечены целевого белка в каждой из трубок и смешайте нежно закупорить вверх и вниз, стараясь избежать пузырей. Инкубируйте 15 мин.
- Выберите режим эксперта для привязки пробирного и введите в параметрах серию последовательных разрежения. Убедитесь, что регулятор температуры установлен до 25 ° C, мощность возбуждения имеет значение 40% и власть MST до среднего. Эти параметры должны быть оптимизированы для других партнеров привязки изучается.
- Заполните капилляров с реакции связывания и место в капиллярной лоток. Загрузить лоток в инструмент, ждать температуры восстановить 25 ° C и начать измерение.
-
Анализ данных
- Откройте файл пробирного привязки в программное обеспечение для анализа сходства. Обзор капиллярного сканирования; Флуоресценции уровни не должны варьироваться более чем на 10% от среднего, не агрегации или адсорбции должно быть обнаружено, как описано в разделе 3.6.
- Выберите анализ MST на правой панели и перетащите пробирного данных в наборе анализа. Если существует несколько запусков же цель лиганд привязки assay при одинаковых условиях они могут быть объединены путем перетаскивания в одном наборе. Кроме того каждый запуск может быть удален в анализ самостоятельно.
- Перейдите на вкладку дозы ответ подходят для графа данных. Выберите модель KD , если ожидается одной привязки сайта. Хилл модель также является вариантом для нескольких сайтов связывания с совместных поведение. Останец точки, которые не прошли контроль качества могут быть удалены из fit на данном этапе. Слияние наборов с несколько анализов будет среднем и ошибки рассчитываются как стандартное отклонение.
- Откройте вкладку окончательный и сравнить результаты всех участков на одном графике. Получить результаты установки для каждой кривой из таблицы, которая создается. Экспортируйте данные или кривых в другие презентации или анализ программного обеспечения, при необходимости.
Результаты
E-PRD домен (остатки 1822-2014 клонирован в pProEX-HTC) ген человеческого envoplakin и домен VimRod (остатки клонирован в pET21a 99-249) человека виментин4 были выражена с His6 Теги и очищены. Рисунок 6 и 7 цифра продемонстрировать уровень чистоты VimRod (18.8 кДа) и E-PRD (21,8 кДа), полученные из этого метода очистки белков. Удаление тега из E-PRD конструкция имеет важное значение для MST экспериментов, как белок VimRod размечается с помощью His6 тег привязки красителя и любой E-PRD, сохраняя его His6 тег может конкурировать за связывание красителя His6. Во второй колонке ИМАК после расщепления тега с ТэВ протеазы удаляет ТэВ протеазы, рассеченного тег и любой uncleaved His6-E-PRD, остались. Последним шагом полировки очистки является размер гель-проникающей хроматографии. Несмотря на обоих белков аналогичного размера, VimRod elutes из столбца на 51 мл в то время как E-PRD элюции пик центрируется в 72 мл, где было бы ожидать белка мономера этого размера. Явное увеличение размера VimRod вероятно из-за его характеристики, как нитчатые длинный стержень в форме белка как аналитически ультрацентрифуги эксперименты показали, что VimRod мономерные4. Снижению урожайности белка получены из культур, выращенных в M9, чем те из богатых бульон из-за меньшее количество клеток, производится в минимальной СМИ. Первоначальный рост больших стартерных культур для подготовки M9 в ТБ позволяет Улучшение доходности клеток при сохранении в размере 15N маркировки необходимыми для ЯМР экспериментов.
15N -1H HSQCs были приобретены для дикого типа и мутантов R1914E E-ПДР в наличие или отсутствие VimRod (рис. 8A-8 D). Спектр E-PRD в 8А рисунок показывает ожидаемое количество хорошо решен пиков, свидетельствует о правильно сложенный протеин. При наличии VimRod (Рисунок 8B) спектр показывает расширение обширной линии и исчезновение пик, соответствующую привязку между E-PRD и VimRod. Эта привязка теряется мутации R1914E свидетельством сравнения Рисунок 8 c и 8 D. Мало изменений наблюдается в спектре при добавлении VimRod к R1914E мутант, что указывает на отсутствие привязки между этот мутант E-PRD и VimRod. E-PRD пика интенсивности в присутствие/отсутствие VimRod были по сравнению и как относительной пика интенсивности в рисунке 8E, который указывает диапазон пик расширения в комплексе E-PRD. R1914E мутант E-PRD (не показан) сохранили около 97% пиков на 20% или выше пика интенсивности в присутствии VimRod, по сравнению с приблизительно 20% для дикого типа (Рисунок 8E). Это представляет потери функции точки мутант, с дополнительной мутантов, имеющие промежуточных эффекты также были изучены4.
Для проверки и quantitate привязки VimRod и E-PRD MST анализа с помощью His6-VimRod помечены Флюоресцентная краска красно трис НТА как цель, смешанные с уменьшением концентраций лигандов E-PRD из 1,28 мм до 39,1 Нм были выполнены. Были проведены три привязки титрования и результаты являются в среднем и показано на рисунке 9. Данные были соответствовать стандартной модели привязки одного сайт лиганда и дал KD 25.7 ± 2,1 мкм. Оценка привязки между VimRod и E-PRD поверхностного плазмон резонанса дал аналогичные значение KD 19.1 ± 1,3 мкм4.

Рисунок 1: экран захвата установки NMR эксперимент. Окно, показанное используется для настройки стандартного эксперимент для сбора HSQC dataset. Эксперимент параметры считываются в прилегающих к эксперимент. Эксперимент ZGPR показано выбирается в качестве первоначального эксперимента для загрузки параметров стандартных и растворителя зависит от протона. В окне название используется для ввода экспериментальной детали для учета целей. Чтобы собрать HSQC спектра ZGPR эксперимент заменяется SFHMQC3GPPH. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
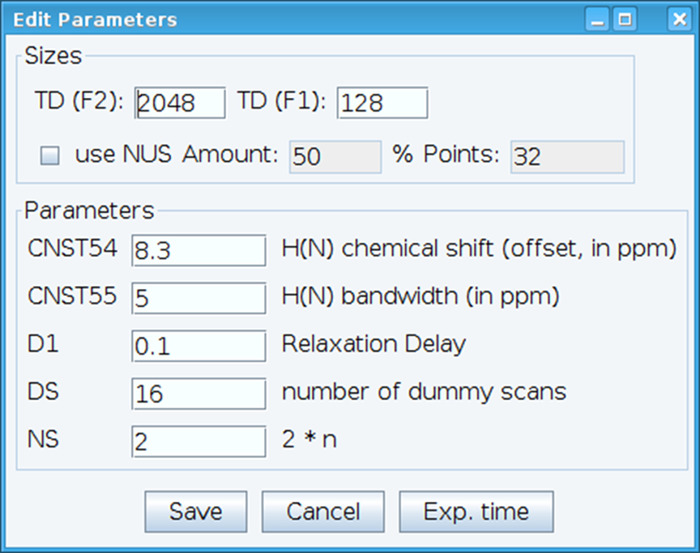
Рисунок 2: корректировка ЯМР экспериментальной параметров. Показано окно используется для ввода основных параметров для ЯМР последовательности импульсов для оптимизации сигнала. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: обработка данных ЯМР. Параметры, используемые для обработки каждого из двух измерений спектра ЯМР показали, с указанием тех, которые обычно настраиваются стрелками. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
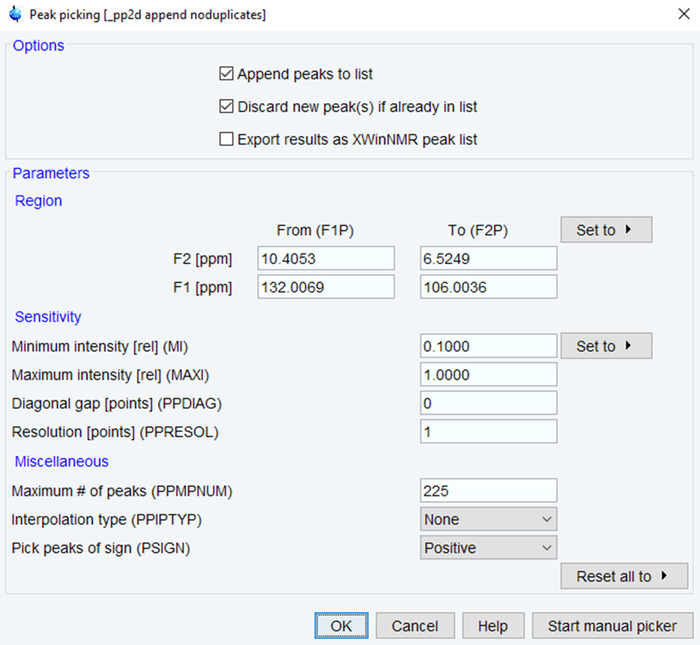
Рисунок 4: параметры для ЯМР пик собирание. Параметры, используемые для выбора ЯМР пиков в обработанных NMR спектр показаны типичные значениями. Отрегулируйте диапазон ppm, интенсивности и количество вершин для оптимизации спектры. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
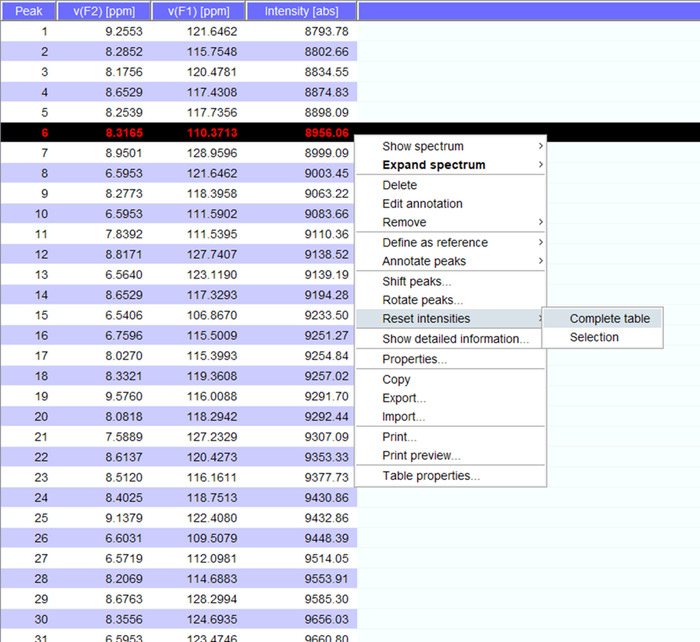
Рисунок 5: представитель Peaklist с интенсивностью. Каждый пик, который выбирается в спектре ЯМР дается ряд и 1H и 15N химические сдвиги и интенсивности сигнала отображаются. Этот peaklist может затем использоваться для сравнения спектров в присутствие/отсутствие взаимодействия партнера. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
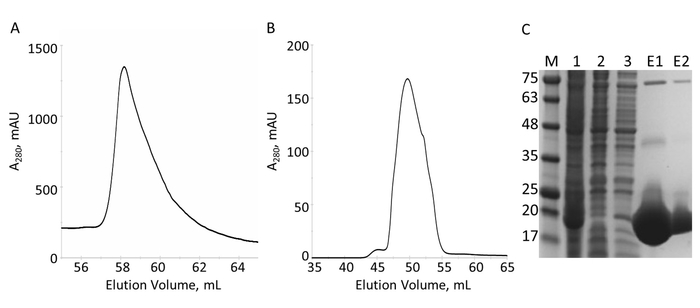
Рисунок 6: Очистка His6-тегами VimRod IMAC и с. а. Хроматограмма для элюции в столбце IMAC показывает один из основных пик VimRod. Б. Хроматограмма для элюции в столбце S показывает один основной пик. C. SDS-PAGE фракций, собранных в течение очистки: стандарты МВт с МВт указывалось в кДа слева гель (M), lysate клетки (1), IMAC проточный (2), мыть (3), Объединенный элюции (E1), объединили S элюции (E2). Полос видны на более высокой молекулярной массой в майнах E1 и E2, олигомеров чистого VimRod, что подтверждается Вестерн-блот (данные не показаны). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
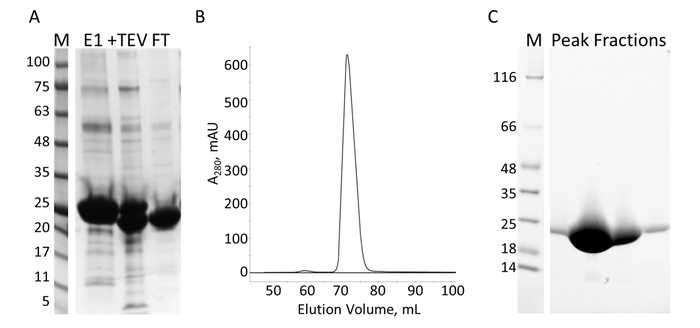
Рисунок 7: Очистка E-PRD, IMAC и с. а. SDS-PAGE очистки IMAC, показаны молекулярный вес стандартов с МВт указывается в кДа слева от геля (M) и элюата из первого столбца IMAC (E1), TEV расщепления продуктов (+ ТэВ) и через поток из второго столбца IMAC (FT). B. хроматографом в столбце S показывает один основной пик. C. SDS-PAGE молекулярный вес стандартов (M) и дроби от S пика. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
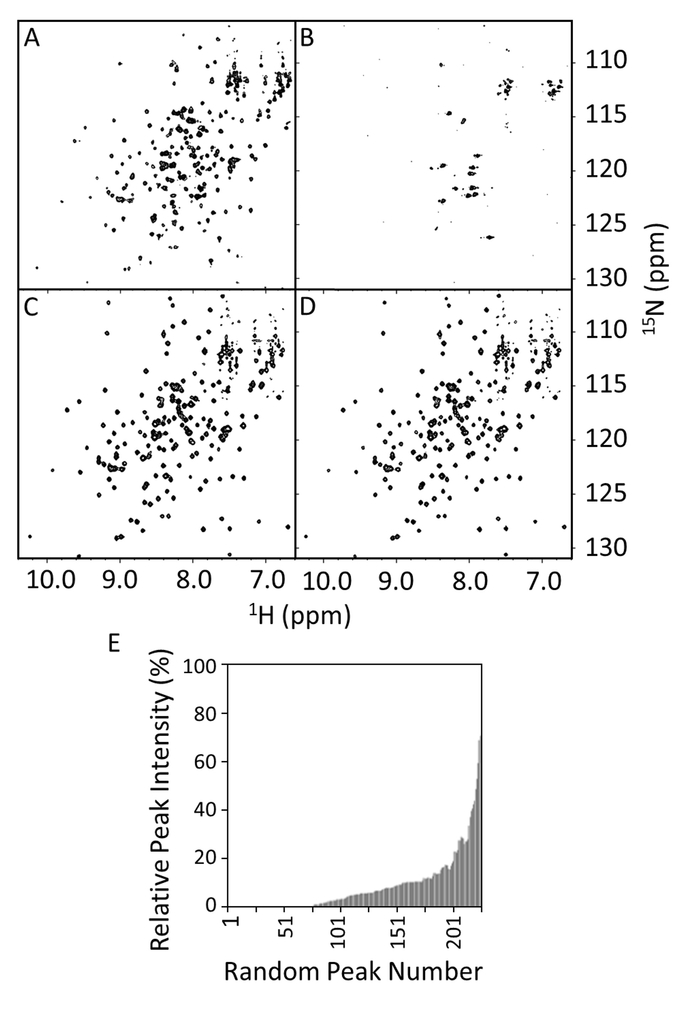
Рисунок 8: спектры HSQC одичал типа и мутантов R1914E E-ПДР в присутствии и отсутствии VimRod. Спектры HSQC Показать одичал тип E-PRD (100 мкм) в 20 мм трис-HCl, 150 мм NaCl, 1 мм DTT, pH 7 в отсутствие (A) или наличие 50 мкм VimRod (B). Панели, C и D являются спектры HSQC мутант R1914E (100µM) в отсутствие или наличие 50 мкм VimRod, соответственно. В панели E относительная 1H -15N пик интенсивности E-PRD, с или без VimRod привязки отображаются как функции на пик номер, который назначается произвольно и не основывается на последовательности позиции. Эти значения могут использоваться для определения значения отсечки для снижения интенсивности пик при добавлении лиганда. Если назначения доступны, значительные ценности часто можно увидеть для сопоставления в области привязки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
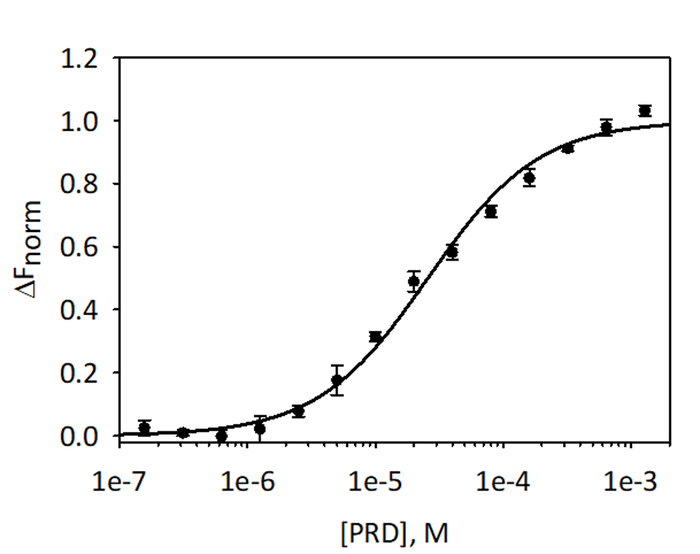
Рисунок 9: привязка E-ПДР в VimRod. E-PRD был разведен в серии два раза разведениях от 1,28 мм до 39,1 Нм и инкубировали с надписью VimRod перед выполнением анализа MST. Данные из трех независимых анализов были объединены. Данные были подходят KD модели, давая KD 25.7 мкм с уверенностьюD K ± 2,1 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Реагент | Количество |
| Натрия фосфат двухосновной (безводный) | 6,0 g |
| Калия фосфат, монокальций (безводный) | 3.0 g |
| Натрия хлорид | 0.5 g |
| H2O | До 950 мл |
Таблица 1. M9 СМИ для изотопного маркировки.
| Реагент | Количество |
| 15 NH4Cl | 1.0 g |
| Глюкоза (или 13C-глюкоза) | 2,0 g |
| 1 М MgSO4 | 2 мл |
| 50 мм CaCl2 | 4 мл |
| Тиамин 20 мг/мл | 1,0 мл |
| 3 мм FeCl3 | 400 МКЛ |
| Металлический Mix (таблица 3) | 500 МКЛ |
| H2O | До 50 мл |
Таблица 2. Питательные смеси добавок M9 СМИ.
| Реагент | Количество |
| 4 мм ZnSO4 | 323 мг |
| 1 мм MnSO4 | 75,5 мг |
| 4.7 мм H3Бо3 | 145 мг |
| 0,7 мм CuSO4 | 55.9 мг |
| H2O | До 500 мл |
Таблица 3. Металлический Mix добавка для обогащения MT питательной смеси.
| Пример | 1 мм E-PRD в буфер A1 (мкл) | 1 мм VimRod в буфере (мкл) | Буфер (мкл) | 200 мкм DSS в D2O (мкл) | Буфера B2 (мкл) | Общий объем (мкл) |
| E-PRD только | 50 | 0 | 50 | 50 | 350 | 500 |
| E-PRD + VimRod | 50 | 50 | 0 | 50 | 350 | 500 |
| 1 Буфера A: 20 мм трис-HCl, 1 мм DTT, рН 7 | ||||||
| 2 Буфера B: 23-мм трис-HCl, 1,14 мм DTT, рН 7 | ||||||
Таблица 4. Подготовка образца ЯМР.
Обсуждение
2D 15N-решена NMR эксперимент является одним из наиболее широко используемых методов, чтобы показать, как две молекулы взаимодействуют. Это наиболее информационно насыщенное метод, который позволяет обоим партнерам сигналы постоянно контролироваться на протяжении эксперимента титрования в государстве решения. Хотя обычно качественные в случае крупных комплексов, метод может также использоваться в благоприятных случаях для определения привязки сходство где NMR сигналов могут быть отслежены в высоким разрешением спектры. Где можно удобно сделал назначения, такие как в случае многих белков под 20 кДа в размер, сайтов связывания могут также быть сопоставлены. Дополнительные анализы как MST обеспечить количественную информацию о взаимодействии в решении и требуют меньше белка в неподписанном государствах. Сравнение мутант привязки данных является полезным для предоставления элементов управления для обеспечения подлинного взаимодействия подтверждается ЯМР линии расширения и не артефакты, например, агрегации или вязкости изменений.
Выражение протеина
Упорядочение процесса выражение уменьшает объем производства труда интенсивного белка. Частью этого процесса оптимизации включает в себя выявление соответствующих штамма E. coli рекомбинантных выражения протеина. Штамм предпочтений зависит от элементов, включая характер вектора в использовании и, более конкретно, конечная стабильность рекомбинантных белков, выразил7. Риск деградации гетерологичных белка, эндогенного E. coli протеаз может быть уменьшено использование протеазы несовершенным E. coli например BL21 штамма. Для генов, содержащих редких кодонов штамм например BL21-CodonPlus (DE3) RIPL может быть предпочтительным. Этот штамм сочетает протеазы несовершенным характер деформации BL21 дополнительные эндогенного копии редких кодон tRNAs аргинин, изолейцин, пролина и лейцин. В качестве альтернативы редкие кодонов, которые могут подорвать гиперэкспрессия может избежаться путем заказа кодон оптимизированная конструкция из коммерческих источников. Многие штаммы кишечной палочки доступны для экспрессии рекомбинантных генов, каждый оптимизированный для обхода конкретной проблемы во время выражения7. В случае этого исследования Стандартный протеазы несовершенным штамм BL21(DE3) производства достаточного количества растворимого белка для последующей очистки и анализа.
Очистка белков
Протокол очистки для данного белка часто является уникальным в том смысле, что каждый белок остается стабильной и растворимые в различных условиях, таких как температура, концентрация соли или рН. Общая эффективность очистки посредством Хромотография сродства также чувствительны к концентрации элюирующие видов, таких как имидазол на различные шаги во время процесса очистки. В этой работе условия критические буфера для IMAC были pH для E-PRD и концентрация имидазола для VimRod. PH 7.5 был обязан избегать осадков E-PRD, после первоначального элюции в столбце IMAC. Для очистки IMAC VimRod повышение концентрации имидазола от 30 до 50 мм на этапе стирки столбца было установлено значительное улучшение в чистоте окончательного элюции фракций. Для элюции шага повышение концентрации имидазола от 250 до 350 мм также было установлено улучшить доходность окончательного элюции. Первоначальные попытки элюировать протеина используя имидазол 250 мм привели к неполной элюции VimRod как показали окончательного 1 M имидазола полоса столбце (данные не показаны). Повышение концентрации имидазола до 350 мм для элюции было достаточно, чтобы восстановить все белка, привязанное к столбцу. S может служить двойной цели, потому что она действует как полировки шаг для очистки белков одновременно выполняя буфера обмена. Буфер обмена является важным шагом для анализа последующих привязки, так как она удаляет имидазола, используемый для элюировать белка His6-тегами. Он также служит возможность изменить условия, такие как концентрация соли или рН, которые могут повлиять на эффективность некоторых течению методы или анализов. Белки теплового сдвига (PTS) могут быть использованы для выявления оптимального буферы для вниз по течению анализов, особенно для тех, которые требуют стабильного белка для длительных периодов времени на комнатной температуре8,9.
Анализ привязки
Белок, подается свежеприготовленный имеет решающее значение для точной привязки анализов, хотя замороженных белка также может быть использован до тех пор, как сравниваются результаты. Волокнистых белков, таких как виментин multimerize в соли и рН зависит от моды, и поэтому решение состояние нужно быть оптимизированы и олигомерные состояние оценивается с помощью метода, например SEC10,11, Динамическое рассеяние света 12 или аналитических ultracentrifugation13,14,15. ЯМР-спектроскопия хорошо подходит для измерения взаимодействия лигандов малых белков в атомной резолюции. Однако, когда белок взаимодействует с большие молекулы, наступает медленнее упасть, и это приводит к потере сигналов, которые могут подтвердить привязки, хотя это не обязательно позволяет отображение привязки сайтов, которые также потребует уступки по крайней мере позвоночника резонансов. В этом случае ЯМР эксперименты не позволяют идентифицировать сайта взаимодействия. Поэтому сайт направлен мутагенеза применяется для выявления критических остатков, необходимые для привязки. Поэтому такие мутанты не проявляют потери сигнала. В этом протоколе мутант форме с заменой в позиции 1914 сохраняет пика интенсивности в присутствии VimRod и поэтому подтверждает нарушение взаимодействия E-PRD и VimRod. Уступка позвоночника и sidechain резонансов бы добавить значение в этот подход, особенно как структура для бесплатный E-PRD была решена путем рентгеноструктурного4. Будущие приложения ЯМР включают характеристика сложных взаимодействий между больших молекул и выиграют от ультра высокой поля магнитов и использование других наблюдаемых групп например, 13C-меченых и трифтор метильных групп как журналисты.
MST имеет ряд преимуществ для изучения привязки взаимодействия16. Привязки партнерами являются бесплатными в растворе и не иммобилизованные. Анализ качества образцов встроен в программное обеспечение с контроля качества отчетности агрегации, адсорбции капилляров или недостаточно люминесцентные маркировки целевой молекулы. Обычно используется небольшое количество целевого, концентрация обозначенные цели, как правило, между 20-50 Нм в 10-20 мкл объем/реакции. Этот протокол использует очень маленькие реакции томов (10 мкл) увеличить концентрацию лиганд, которое может быть достигнуто в титрования, позволяя слабое связывание взаимодействия, чтобы охарактеризовать. Это требует точное дозирование и тщательность во избежание введения пузыри пока еще тщательно смешивания. Надлежащее смешивание имеет решающее значение для точной, последовательной флуоресценции измерений вдоль набор серийных разведений. Количество Tween-20 в MST экспериментов было сокращено с стандартной 0,05% до 0,015% снизить тенденцию создавать пузыри и улучшить смешивание.
Краситель красный-трис-НТА обеспечивает быстрый, простой и удобный способ дневно обозначить любой белок, который имеет свой тег. Маркировки фактически завершена только 30 минут и является очень жесткой, так что не процедура удаления красителя необходимых. Изменения не вносятся аминокислотных остатков в белок, который может изменять свойства привязки лиганда. Предостережение, что только белок, чтобы быть помечены должны иметь тег His6. Это потребовало расщепления тега из белков лиганд, E-PRD и удаление тега и uncleaved E-PRD с второй шаг столбец IMAC. Если возможно, следует подготовить лигандом белок без использования его тег. Кроме того белки могут быть ковалентно помечены с Флюорофор через Амин, муфты для остатков лизина или тиоловых муфты для остатков цистеина. Однако необходимо позаботиться при использование таких систем с ковалентной вложение Флюорофор может повлиять на электростатических или полярной привязки взаимодействия, опираясь на остатков лизина или цистеина. Количественное определение привязки сходства между VimRod и E-PRD, MST был необычайно чувствительны к концентрации соли. Эта проблема несколько смягчается первоначально dialyzing как целевых, так и лиганд в той же партии аналитического буфера. Тем не менее насыщенность MST привязки кривой будет невозможно при выполнении MST assay присутствии 150 мм NaCl из-за сложного поведения VimRod. Надежный, полный данные были получены после того, как концентрация NaCl был снижен до 10 мм, позволяя точный расчет KD. Следовательно тщательной оптимизации условий решения и сравнение с дополнительных анализов рекомендуется для достижения надежных результатов. Кроме того MST может использоваться для количественного определения соль зависимость для данного взаимодействия, количественно стехиометрическим свойства взаимодействия протеина, монитор сворачивание белков и зонд в Кинетика энзима17.
Раскрытие информации
Авторы раскрывают отсутствие конфликта интересов.
Благодарности
Этот проект был поддержан Сенти-RGPIN-2018-04994, кампус Альберта инновационной программы (RCP-12-002 C) и Альберта прионных научно-исследовательский институт / Альберта инновационную био решения (201600018), награжден МО и геном Канады и Канадский фонд для Инновации, гранты для метаболомики инновационный центр (TMIC) и NANUC.
Материалы
| Name | Company | Catalog Number | Comments |
| Monolith NT.115, includes control and analysis software | NanoTemper Technologies | MO-G008 | Instrument for microscal thermophoresis |
| His-Tag Labeling Kit RED-Tris-NTA | NanoTemper Technologies | MO-L008 | RED-tris-NTA dye for MST |
| Standard capillaries | NanoTemper Technologies | MO-K022 | capillaries for MST |
| HisTrap HP, 5 mL | GE Healthcare | 17524801 | IMAC column |
| HisPur Ni-NTA resin, 100 mL | Thermo Fisher Scientific | 88222 | IMAC resin |
| HiLoad 16/600 Superdex 75 pg | GE Healthcare | 28989333 | SEC column |
| TEV protease | Sigma Aldrich | T4455 | cleavage of his tag from E-PRD |
| BL21(DE3) Competent E. coli | New England Biolabs | C2527H | cells for protein expression |
| cOmplete Protease Inhibitor Cocktail Tablets EDTA-Free | Sigma Aldrich | 11873580001 | protease inhibitors for protein purification by IMAC |
| TCEP, Tris(2-carboxyethyl)phosphine hydrochloride | Sigma Aldrich | C4706 | reducing agent for protein purification |
| Reagents (HEPES, NaCl, etc) | Sigma Aldrich | various | Preparation of media and buffers |
| Ammonium chloride (15N, 99%) | Cambridge Isotope Laboratories | NLM-467 | isotope labelling for NMR |
| D2O, Deuterium Oxide (D, 99.8%) | Cambridge Isotope Laboratories | DLM-2259 | NMR sample preparation |
| DSS, Sodium 2,2-dimethyl-2-silapentane-5-sulfonate-D6 (D,98%) | Cambridge Isotope Laboratories | DLM-8206 | reference for NMR |
| Precision 5 mm NMR Tubes, 7” long | SJM/Deuterotubes | BOROECO-5-7 | NMR tubes |
| NMR spectrometer (14.1 Tesla) | Bruker | acquisition of NMR data | |
| TCI 5mm z-PFG cryogenic probe | Bruker | acquisition of NMR data | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Bruker TopSpin 4.0.1 | Bruker | processing of NMR data | |
| MO.Control | NanoTemper Technologies | included with Monlith NT.115 | |
| MO.Affinity Analysis | NanoTemper Technologies | included with Monlith NT.115 |
Ссылки
- Vinogradova, O., Qin, J. NMR as a unique tool in assessment and complex determination of weak protein-protein interactions. Topics in Current Chemistry. 326, 35-45 (2012).
- McKercher, M. A., Wuttke, D. S. NMR Chemical Shift Mapping of SH2 Peptide Interactions. Methods in Molecular Biology. 1555, 269-290 (2017).
- Al-Jassar, C., Bikker, H., Overduin, M., Chidgey, M. Mechanistic Basis of Desmosome-Targeted Diseases. Journal of Molecular Biology. 425 (21), 4006-4022 (2013).
- Fogl, C., et al. Mechanism of intermediate filament recognition by plakin repeat domains revealed by envoplakin targeting of vimentin. Nature Communications. 7, (2016).
- Walker, J. M. . The Protein Protocols Handbook. , (2002).
- Wishart, D. S., et al. 1H, 13C and 15N chemical shift referencing in biomolecular NMR. J. Biomol. NMR. 6, 135-140 (1995).
- Casali, N. Escherichia coli Host Strains. E. coli Plasmid Vectors. , 27-48 (2003).
- Ericsson, U. B., Hallberg, B. M., DeTitta, G. T., Dekker, N., Nordlund, P. Thermofluor-based high-throughput stability optimization of proteins for structural studies. Analytical Biochemistry. 357 (2), 289-298 (2006).
- Kozak, S., et al. Optimization of protein samples for NMR using thermal shift assays. Journal of Biomolecular Nmr. 64, 281-289 (2016).
- Burgess, R. R. A brief practical review of size exclusion chromatography: Rules of thumb, limitations, and troubleshooting. Protein Expression and Purification. , (2018).
- Kunji, E. R. S., Harding, M., Butler, P. J. G., Akamine, P. Determination of the molecular mass and dimensions of membrane proteins by size exclusion chromatography. Methods. 46 (2), 62-72 (2008).
- Stetefeld, J., McKenna, S. A., Patel, T. R. Dynamic light scattering: a practical guide and applications in biomedical sciences. Biophysical Reviews. 8 (4), 409-427 (2016).
- Patel, T. R., Winzor, D. J., Scott, D. J. Analytical ultracentrifugation: A versatile tool for the characterisation of macromolecular complexes in solution. Methods. 95, 55-61 (2016).
- Pearson, J. Z., Cole, J. L., et al. Chapter One - Next-Generation AUC Adds a Spectral Dimension: Development of Multiwavelength Detectors for the Analytical Ultracentrifuge. Methods in Enzymology. 562, 1-26 (2015).
- Gorbet, G. E., Pearson, J. Z., Demeler, A. K., Cölfen, H., Demeler, B., Cole, J. L. Chapter Two - Next-Generation AUC: Analysis of Multiwavelength Analytical Ultracentrifugation Data. Methods in Enzymology. 562, 27-47 (2015).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1, 100 (2010).
- Jerabek-Willemsen, M., et al. MicroScale Thermophoresis: Interaction analysis and beyond. Journal of Molecular Structure. 1077, 101-113 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены