Method Article
טיהור וניתוח של נוגדן חד שבטיים מן הסינית שחלות אוגר תאים באמצעות מערכת Microbioreactor חקן אוטומטי
In This Article
Summary
פרוטוקול מפורט לטיהור וניתוח מאוחר יותר של נוגדן חד שבטיים מתוך נוזל שנקטפו לתרבות התא (HCF) של microbioreactors חקנים אוטומטיים תוארה. השימוש בניתוח כדי לקבוע תכונות איכות קריטיות (CQAs) ולמקסם את נפח מדגם מוגבל כדי לחלץ מידע חיוני מוצג גם.
Abstract
נוגדנים חד-שבטיים (mAbs) הם אחד המוצרים הנפוצים ביותר ומאופיין היטב המיוצרים כיום. המיוצר בדרך כלל באמצעות שחלות האוגר הסיני (צ'ו) תאים, התרבות והתהליכים התהליך חייב להיות ממוטב כדי למקסם את הנוגדן משפר ולהשיג פרופילי איכות היעד. בדרך כלל, מיטוב זה משתמש ביוריאקטורים אוטומטיים (15 mL) כדי להקרין תנאי תהליך מרובים במקביל. קריטריוני אופטימיזציה כוללים ביצועי תרבות ותכונות באיכות קריטית (CQAs) של מוצר נוגדן חד שבטיים (mAb), אשר עשוי להשפיע על יעילותה ובטיחות. מדדי ביצועי התרבות כוללים צמיחת תאים וצריכת חומרים מזינים, ואילו ה-CQAs כוללים את ה-N-הגליקוציה ופרופילי הצבירה של mAb, משתני טעינה ומשקל מולקולרי. פרוטוקול מפורט זה מתאר כיצד לטהר ולנתח לאחר מכן דגימות HCF המיוצרים על ידי מערכת microbioreactor חקן אוטומטית כדי להשיג מדדי ביצועים יקרי ערך ותפוקות. ראשית, חלבון אוטומטי חלבון מהיר כרומטוגרפיה נוזלית (FPLC) השיטה משמשת כדי לטהר את mAb מדגימות של תרבות התא שנקטפו. ברגע שהוא מרוכז, הפרופילים הגלינורים מנתחים על ידי ספקטרומטר מסה באמצעות פלטפורמה ספציפית (עיין בטבלת החומרים). משקולות מולקולרים ופרופילי צבירה נקבעים באמצעות גודל הדרה כרומטוגרפיה-מספר פיזור אור זווית (SEC-דוליטל), בעוד משתנים החיוב נותחו באמצעות אלקטרופורזה באזור נימי-שבב (mCZE). בנוסף מדדים ביצועי התרבות שנתפסו במהלך תהליך ביוריאקטור שחקן (כלומר, הכדאיות התרבותית, ספירת תאים, מטבוליטים נפוצים כולל גלוטמין, גלוקוז, לקטט, ו אמוניה), מדיה בילה מנותח כדי לזהות הגבלת חומרים מזינים כדי ל לשפר את אסטרטגיות ההזנה ועיצוב התהליך הכולל. לכן, פרוטוקול מפורט לקוונפיקציה מוחלטת של חומצות אמינו על ידי מדיה כרומטוגרפיה נוזלית המוניים (LC-MS) של המדיה המושקע מתואר גם. השיטות המשמשות בפרוטוקול זה מנצלות פלטפורמות של תפוקה גבוהה התואמות למספר גדול של דגימות של אמצעי אחסון קטן.
Introduction
Therapeutics חלבונים משמשים לטיפול במגוון גדל של מצבים רפואיים כולל סיבוכים השתלת רקמות, הפרעות אוטואימוניות, סרטן1. מאז 2004, ארצות הברית מינהל המזון והתרופות (usfda) תיעד חלק הולך וגובר של יישומי רישיון יולוגי (בלאס) של כל האישורים מוסדר על ידי המרכז להערכת הסמים ומחקר (cder), עם בלאס חשבונאות עבור מעל 25% ב 2014 ו 20152.
בהתחשב בשוק המתרחב הזה, היצרנים הביופרמקולוגיה מאותגרים במהירות באספקת מוצר רב יותר באיכות עקבית. המאמצים להגדיל את תפוקת המוצר יש התמקדו הנדסת תאים CHO ו קו הייצור ההקרנה, למרות השיפורים המשמעותיים ביותר הם בשל ההתקדמות במדיה/הזנה אופטימיזציה אסטרטגיה ושולט הסביבה תרבות התאים1, מיכל שלוש , ד , 5 במהלך תהליך הייצור.
מאז mAbs מיוצרים במערכת ביולוגית, יכול להיות שינויים בחלבון הטבועה. הרכב הנוגדן יכול להשתנות לאחר השינוי, כגון גליקוזילציה או מושפע השפלה או תגובות אנזימטיות. אלה וריאציות מבניים עלול לעורר תגובות החיסונית מסוכן או לשנות את כריכת נוגדנים, אשר בתורו יכול להפחית או לחסל את הפונקציה טיפולית מיועדת5. כך, תכונות איכות קריטית (CQAs) של נוגדנים חד-שבטיים-פרופיל N-גליקן, הפצה משתנה התשלום, ואת אחוז הנוגדן בטופס monomeric-מנוטרים באופן סדיר נשלט כחלק איכות על ידי עיצוב (QbD) גישה במהלך תהליכי ייצור1,6. בסביבת ייצור מוסדרת, חלבונים טיפוליים חייבים לעמוד בתנאי קבלה כדי להיות מורשה כמוצר תרופה מסחרית מאושרת7. השיטות המוצגות במסמך זה היו בדרך כלל חלק מתהליך אפיון האיכות עבור נוגדן7,8, וכל מדען חלבון יהיה מכיר את השימוש שלהם.
בעבודה מוקדמת9, היישום והתפעול של microbioreactors חקנים עבור הקרנת תפוקה גבוהה של מצבי תרבות תאים בזרם ביורובינג כבר תוארה. המוצר הטהור שהתקבל מתנאי המדיה השונים נתון לניתוח N-גליקן באמצעות lc-ms דפוסי הגליסיציה של חלבונים טיפוליים ניתן לזהות ומאופיין באמצעות טכניקות lc-MS10,11, ואת ה נוכחות של מינים גליניים שונים נקשר לפרמטרים ביורוחיים כגון אסטרטגיית הזנה, pH, וטמפרטורה12. ההשפעה של תנאי מדיה שונים על איכות המוצר, המצוין על ידי אחוז igg שהתקבל בטופס monomeric, מוערך גם עם גודל הדרה כרומטוגרפיה-רב זווית פיזור אור (SEC-דוליטל)13,14 , 15. פרופיל משתנה החיוב מייצג מספר שינויים16 שעלולים להשפיע על הפונקציה של מוצר. אלקטרופורזה באזור מיקרונימי (mCZE) היא טכניקה המציעה זמן ניתוח מהיר במידה ניכרת לעומת החלפת קטיון מסורתית (CEX) כרומטוגרפיה ומיקוד נימי (cIEF) שיטות המשמשות לניתוח משתנה החיוב17 ,18. בילה ביוריאקטור חקן מדיה נותחו כדי לעקוב אחר צריכת חומצת אמינו במהלך ייצור החלבון כפי שהוא מתייחס לשינויים בתכונות הזיהוי של הנוגדן19,20,21,22 , . עשריםואחד
ניתוח חלבונים מאפשר לנו לזהות פרמטרים של תהליכים קריטיים (CPPs) בהתבסס על קשרי הגומלין בין כניסות לתהליכים ושינויים ב-CQAs. במהלך פיתוח ביו-התקדמות, זיהוי ומדידת CPPs מדגים באופן מהותי בקרת תהליך ומבטיח כי המוצר לא השתנה, אשר חיוני בסביבות ייצור מוסדר ביותר. במאמר זה, טכניקות אנליטיות למדוד חלק מהמאפיינים הביוכימיים של החלבון הרלוונטי ביותר למוצר CQAs (פרופיל N-גליקן, משתני טעינה, וגודל הומוגניות) מוצגים.
Protocol
1. טיהור נוגדנים
הערה: מאגר השפה של הנוגדן בבית הוא 25 מ"מ Tris, 100 מ"מ הנאל, pH 7.5. המאגר המשמש לשימוש הוא חומצה אצטית 0.1 M. המאגרים והשרף (חלבון A) תלויים בנוגדן המסוים שטוהר. נפח העמודה שווה ערך לגובה המיטה של השרף. כמות השלב הנייד שבשימוש נקבעת במונחים של נפח עמודה.
- מאתחל את מערכת הטיהור
- פתח את התוכנה המצורפת למערכת הטיהור. באמצעות הוראות ידניות, השווה את העמודה עם מאגר השפה בקצב זרימה של 2 מ"ל/min עבור 40 דקות. עצור את ההפעלה הידנית לאחר שיעור.
- באספן שבר, מקום 15 מ"ל שפופרות חרוט לאסוף נוגדנים מטוהרים משחרל ו 50 mL שפופרות חרוט לאסוף זרימה-דרך במהלך שטיפת מלח גבוה. ודא שאספן השברים מאופס למיקום ההתחלה על-ידי פתיחה וסגירה של מלקט השבר לפני תחילת ההפעלה. אספן השברים נשמר ב -7 ° c.
הערה: ניתן לאפס את מלקט השבר באופן ידני תחת הכרטיסיה ' אספן שבר ' בהגדרות, עבור שני מנורות mL ו-50 ml.
- הזרקת דגימה
הערה: נוזל התרבות תאים שנקטפו בשימוש בהליכים הבאים התקבל מן הסינית תאים שחלות אוגר תרבותי במיקרו-bioreactors חקנים אוטומטיים9.- הוסף את נוזל הקציר מסוננים 0.22 יקרומטר של הגידול למזרק ריק משנת 12 mL שקצה הזרבובית שלו מוככה.
- הכניסו את המזרק עם הזרבובית הפונה כלפי מטה, הכנס את המזרק עד שחלק קטן מהבוכנה בפנים. וודא כי הנוזל אינו דולף, לסובב את המזרק עם הזרבובית פונה כלפי מעלה ולהסיר את הכובע.
- עדיין מחזיק את המזרק עם הזרבובית הפונה כלפי מעלה, לדחוף את הצילינדר כדי לפזר את כל האוויר עד שהנוזל של תרבות התא הוא בקצה הזרבובית. הכנס את זרבובית המזרק לתוך יציאת ההזרקה הידנית במערכת הטיהור ופיתול כדי להדק.
- לחץ על הבוכנה עד שכל המדגם מוזרק והוא גלוי בלולאה המצורפת של 10 מ"ל לדוגמה בנפח גדול.
- פתח את קובץ השיטה שנשמר. שמור את קובץ התוצאות במיקום הדרוש וציין את שם הקובץ כשתתבקש. הכה לרוץ לאחר המדגם הוזרק לתוך לולאה גדולה לדוגמה נפח.
- הפעלת שיטת הטיהור
- בחר את השיטה השמורה ולחץ על הפעל כאשר תתבקש על-ידי תוכנת מכשיר (step 1.2.5).
הערה: המערכת מוגדרת להפעיל את השלבים הבאים. המשתמש אינו צריך לעשות דבר כאשר המכשיר פועל. - השפה הכוללת שלושה אמצעי אחסון של עמודות (קורות חיים) של מאגר משקל בקצב זרימה של 2 mL/min. לאחר שהעמודה מעורפלת, המערכת, המשתמשת בלולאה הגדולה לדוגמה, תזריק את המדגם אל העמודה בקצב הזרימה של 1 mL/min.
- ירידה באות UV ב 280 ננומטר מציין כי המדגם הוא סיים טעינה. שטוף את הטור בעזרת מאגר השפה בקצב זרימה של 2 מ"ל/min עד שהאות UV יורד מתחת ל -25 מאו.
- השתמש ארבע קורות חיים של מיני טריס 25 מ"מ עם 1 M הנאל ב-pH 7.5 לבצע שטיפת מלח גבוהה משנית בקצב הזרימה של 2 מ"ל/min. אספן שבר מערכת תאסוף כל חלבון/דנ א שיורד העמודה במהלך שטיפת מלח בצינורות 50 mL.
- החלת חמש קורות חיים של מאגר הימנעות בקצב זרימה של 1 mL/min כדי להוריד את הנוגדן מהעמודה. לאסוף את להתחמק 15 צינורות mL מבוסס על אות UV; כאשר האות UV 280 מעל 35 מאו, אוסף מתחיל; האוסף מסתיים כאשר האות יורד מתחת 50 מאו; זה נקרא שיא החיתוך.
הערה: חיתוך השיא מבטיח נורמליזציה של פרופילי משחררות וכלה להימנע ממעקב אחר שיא שעשוי להכיל אגרגטים חלבונים24. - שטוף את הטור באמצעות שלוש קורות חיים של מאגר שיווציה. הריצה נגמרת לאחר. שלב השטיפה
- לאחר הימנעות מיד לנטרל את חלבון מטוהרים באמצעות 1 בסיס טריס M ל-pH של ~ 5.5. למדוד את ריכוז החלבון באמצעות מיקרוvolume UV-Vis ספקטרוסקופיה ב 280 nm ו 260 nm ולאחסן ב 4 ° c.
- רכז את הנוגדן הטהור באמצעות יחידות צנטריפוגלי (שלב 2). לאחר מכן הנושא את הנוגדן מטוהרים כדי גליקן ניתוח באמצעות LC-MS ואחרי פרופיל הצבירה לנתח באמצעות SEC-דוליטל (שלבים 3 & 4).
הערה: הנוגדן הטהור לא צריך להיות קפוא ללא החלפת מאגר נוספת כמו תכופים הקפאת ההפשרה מחזורים יכול לגרום צבירה ומשקעים.
- בחר את השיטה השמורה ולחץ על הפעל כאשר תתבקש על-ידי תוכנת מכשיר (step 1.2.5).
2. ריכוז של נוגדנים מטוהרים
הערה: החוצץ טריס-אצטט הוא 0.1 M חומצה אצטית מנוטרל עם 1 בסיס טריס M ל-pH של ~ 5.5.
- הכנס 100 מסנני kDa לצינורות צנטריפוגה.
- לשטוף את המסננים עם 500 μL של מים כפולים מזוקקים. צנטריפוגה עבור 10 דקות ב 14,000 x g בטמפרטורת החדר (RT). חזור על שלב זה פעמיים. מחק filtrate.
- העבר את מסנני שוטפים לצינורות צנטריפוגה טריים ולהוסיף 500 μL של דגימה לכל מסנן. צנטריפוגה עבור 10 דקות ב 14,000 x g.
- הפוך את המסנן לשפופרת ספין חדשה. צנטריפוגה עבור 2 דקות ב 1,000 x g כדי לאסוף את המדגם מרוכז.
- לקבוע את ריכוזי לדוגמה באמצעות ספקטרוסקופיה UV-Vis. לסרק את הספקטרוסקופיה באמצעות פתרון של מאגר אצטט-Tris. השתמש מקדם השמדת חלבון של 1.37 mL • (mg • ס מ) -1 ב 280 nm עבור 1% (% m/v) פתרון igg.
- השתמש במדגם מרוכז כדי להכין 12.5 μL של 2 mg/mL עובד פתרון לניתוח גליקן ו 30 μL של 3.5 mg/mL פתרון העבודה עבור SEC-דוליטל.
הערה: ניתן להשהות את הפרוטוקול כאן. הדוגמאות אמורות להיות מקורר ב -4 ° c. בריכוז 2 מ"ג/mL, דוגמאות אלה אמורות להיות יציבות למשך שלושה חודשים לפחות ב -4 ° c בעוד שריכוזים גבוהים יותר עלולים לזרז.
3. אנליזה של N-גליקנים באמצעות ספקטרוסקופיית מסה
- התוויות והבידוד של N-גליקן
- התחל עם ריכוזי נוגדנים של 2 מ"ג/mL במאגר המתאים כגון נתרן פוספט ניטרלי, ציטראט או מאגר HEPES. הכן תקן mAb שלם (כגון רופא ממ) ב 2 מ"ג/mL כדי לעבד לצד דגימות ניסיוני לשמש שליטה חיובית.
הערה: על הנוגדנים להיות במאגר הסופי המכיל לא SDS ופחות מ-0.1 מ"מ נוקלאופילים (כגון טריס, DTT, גליצין או histidine). יש להסיר SDS במאגר המדגם. אם נוקלאופילים נמצאים במאגר, לאחר מכן לדלל אותם או לבצע חילופי מאגר מאז הם יפריעו הערכה. הפרוטוקול הכללי מסופק עם ערכת גליקן. - לדלל 7.5 μL של נוגדנים עם 15.3 μL של מים LC-MS-כיתה 1 בצינורות mL שסופקו עם הערכה ולאחר מכן באמצעות שימוש 6 μL של 5% הפתרון של האנזים ידידותי וטרשת נפוצה MS-ידידותית ב 90 ° c עבור 3 דקות.
- לצנן את הדגימות עבור 3 דקות לטמפרטורת החדר (RT). לאחר מכן, הוסף 1.2 μL של PNGase F ו-דגירה עבור 5 דקות ב 50 ° c.
- לאחר הקירור 3 דקות כדי RT, התווית את N-גליקנים ביקקים על ידי הוספת 12 μL של תיוג פלורסנט מומס התפרקה באמצעות הידרומטר diמתילאומיד (DMF) ולחכות 5 דקות. לדלל את התערובת N-גליקן עם 358 μL של acetonitrile (ACN).
- מניחים כרומטוגרפיה של אינטראקציה הידרופיפילית (HILIC) צלחת ביריעה ואקום עם שימים ומגש פסולת. השתמש בפיפטה רב-ערוצית עבור מספר רב של דגימות.
- מצב בארות עם 200 μL של מים, איפה הוואקום מותאם כך הנוזל ייקח 15-30 s לעבור דרך שרף HILIC. משקל עם 200 μL של 85% ACN לפני טעינת התערובת התווית ACN-מדולל מתויג (400 μL), החלת ואקום לאחר כל נוזל חדש מתווסף הבארות. לשטוף את שרף עם 600 μl של 1% החומצה פורמית (פא)/90% acn פעמיים.
- החלף את מגש הפסולת בעזרת צינורות אוסף של 600 μL. אליוט מתויג N-גליפחיות עם מאגר משחררן של SPE (3 שעות של 30 μL כל אחד) לתוך צינורות האוסף. לדלל את המאגר עם 310 μL של DMF/ACN לדוגמה מדלל. פיפטה את הדגימות לתוך בדיקות הסמפלר אוטומטית כדי להיות מוכן לניתוח פלואורסצנטית (FLR)-MS.
הערה: דגימות אלה יציבות כאשר הם מאוחסנים ב-80 ° c לפחות 1 חודש. אחסן את הצלחת HILIC באריזה המקורית שלה, סגור מודבק בתוך desiccator לשימוש עתידי.
- התחל עם ריכוזי נוגדנים של 2 מ"ג/mL במאגר המתאים כגון נתרן פוספט ניטרלי, ציטראט או מאגר HEPES. הכן תקן mAb שלם (כגון רופא ממ) ב 2 מ"ג/mL כדי לעבד לצד דגימות ניסיוני לשמש שליטה חיובית.
- ניתוח LC-MS של מתויג N-גליקנים
- לנתח את התווית N-גליקן שכותרתו על מערכת ביצועים כרומטוגרפיה נוזלית במיוחד בשילוב לגלאי הזריחה ולפי ארבעה הזמן של הטיסה (Q-תוף) ספקטרומטר מסה. השתמש בעמודה המאושרת להפרדת כרומטוגרפית של הגליקנים המסומנים בתווית וחום ל-60 ° צ' במהלך הפרדות.
הערה: יש לרוקן את העמודה עם 60% acetonitrile ו-40% H2O לפני השימוש: 50 קורות חיים לפני השימוש הראשון או 20 קורות החיים אם העמודה כבר בשימוש.- השימוש 50 mM אמוניום (AmF) (עשה עם להתרכז שלב נייד) ו 100% LC-MS-כיתה ACN עבור שלבים ניידים. AmF רגיש לשינויי pH והוא שמיש עבור 1 חודש לאחר ערבוב. הגדר את קצב הזרימה הראשונית ל 0.4 mL/min, עם מעבר LC המספק AmF הגוברת במהלך השלב להתחמק.
- הגדר את גלאי FLR כדי למדוד ב-לשעבר 265/EM 425 ננומטר עם קצב דגימה של 2 Hz. הגדר את Q-תוף למצב רגישות יון חיובי MS1, עם טווח מסה של 100-2000 daltons (Da), זמן סריקה של 0.25 שניות והמשכיות הנתונים הרצף. השתמש לוקיצין enkephalin (2 ng/μL ב 50% ACN/0.1% FA) עבור ההפניה ההמונית הפנימית, במצב "אל תחיל תיקון".
הערה: תיקון ההפניה ההמונית הפנימית יוחל במועד מאוחר יותר במהלך עיבוד נתונים. - מחדש להשעות את סולם תוספי ברצף ב 22.5 μl של H2O, 25 μl של dmf ו 52.5 μl של acn. הכינו 10 μL לאחסון ב-80 ° c, מכיוון שהסולם אינו יציב במשך יותר מ -24 שעות בטמפרטורות גבוהות יותר (טמפרטורת החדר, 4 ° c). סולם דטרן מתפעל אחרי יותר ממחזור אחד של ההפשרה.
- מניחים את הדגימות בדוגם האוטומטי שנקבעו ל-10 ° c. טען בקבוקון של סולם דקטרן יחד עם דגימות, מאחר שפרטי זמן ההחזקה של הסולם ישמשו להקצאות בזמן שהמידע ההמוני המשמש לאימות זהויות. השתמש בזריקות של 10 μL עבור הדגימות וזריקות ה7.5 μL עבור הסולם. . הכנס דגימות בטרילקאט הפעל את השיטה שנטענה.
- לנתח את התווית N-גליקן שכותרתו על מערכת ביצועים כרומטוגרפיה נוזלית במיוחד בשילוב לגלאי הזריחה ולפי ארבעה הזמן של הטיסה (Q-תוף) ספקטרומטר מסה. השתמש בעמודה המאושרת להפרדת כרומטוגרפית של הגליקנים המסומנים בתווית וחום ל-60 ° צ' במהלך הפרדות.
- מזהה N-גליקן לנתוני LC-MS
- לבצע עיבוד נתונים עם תוכנית אופטימיזציה עבור אינטראקציה ידרופילי כרומטוגרפיה המסה של המוני ספקטרומטריה (hilic-flr-MS) נתונים.
- החל תיקונים פנימיים של הפניות המונים בתוך התוכנית. ציין את הזרקות סולם תוספי כ-"סטנדרטי " במידע לדוגמה. בשיטת הניתוח, הגדר את זמני ההחזקה של מתחם ההפרדה לאלה של תרכובות הסולם שזוהו במהלך ההפעלה.
- כדי להבטיח שאזור% יוחזר עבור גליקנים מזוהים, שנה את שיטת הניתוח: תחת הכרטיסיה עיבוד , לחץ על הגדרות כימות הנתונים-כיול וקבע "סוג התאמה של עקומת כיול" ל-"תגובה יחסית (%).
4. ניתוח צבירת נוגדנים באמצעות SEC-דוליטל
- הכנה לדוגמא
- העבר את 3.5 mg/mL (שלב 2) חלבון מדולל במבחנה עם הוספת משקה 150 מזכוכית μL. השתמש ג'ל טעינת עצה כדי להפוך את הפעמון התחתון של הכנס כדי למנוע את המבוא של בועות.
- כסה את הבקבוקון עם כובע הספטטה ולאחר מכן בצע ניתוח מיידי. אחסן ב-4 ° צ' אם תנתח מאוחר יותר.
- דוליטל הגדרת תצורה ושיווציה
הערה: צבירת מנתחים ב-SEC-דוליטל מוגדרת באמצעות כרומטוגרפיה נוזלית בעלת לחץ גבוה במיוחד (UHPLC) עם מזהה דוליטל וגלאי מדד השבירה הנשלטים על ידי תוכנת דוליטל.- קביעת תצורה של קובץ שיטה בתוכנת UHPLC לשליטה במערכת UHPLC, הגדרת קצב הזרימה ל 0.4 mL/min עם שלב נייד של מלוחים באגירה של 1x פוספט (PBS) (מדולל מ 10x), נפח ההזרקה ל-5 μL, טמפרטורת העמודה עד 25 ° c , ואת גלאי מערך דיודות (אבא) כדי לנטר 280 ננומטר. קבע זמן ריצה ל-20 דקות. לפחות לפני כל ניתוח לדוגמה.
- הממשק בין UHPLC ו-Multi זווית פיזור אור-מדד השבירה (דוליטל-RI) גלאי דורש שימוש בפלט אנלוגי על אבא. הגדר את הנחת אבא כדי 1,000 מאו בקובץ השיטה אבא ו-AU/UV הגדרה 1 (כלי UV ≫ ערוצים ≫ ערוץ 1).
- הפעל את המנורה אבא 30 דקות לפני הניתוח ההתחלתי ולהגדיר את אורך הגל כדי 280 ננומטר. במקביל, נקה את תא ההפניה של מדד השבירה (RI) עבור 15 דקות או עד שתוכנית הבסיס יציבה ולאחר מכן סגור את תא ההפניה.
- קביעת תצורה של רצף התוכנה SEC-דוליטל, הגדרת זמן האיסוף עד 12 דקות, נפח ההזרקה ל-5 μl, ה-dn/dc ל-0.185 ml/g, מקדם הכחדה A280 אם נקבע בעבר או 1.37 ml * (mg * ס"מ)-1, וריכוז ה דוגמה. לחץ על הפעל והמתן עד שתיבת הדו "המתנה להזריק" תופיע על המסך.
הערה: מקדם ההשמדה של A280 הוא ספציפי לחלבון הריבית והוא צריך להיות מוגדר לניסויים. - הגדר רשימה לדוגמה בתוכנת UHPLC בסדר זהה לזו שבתוכנת דוליטל-RI והגשה.
הערה: חשוב להפעיל בדיקת התאמה למערכת לפני ואחרי הפעלה. אלבומין סרום בדרך כלל משמש לבדיקת הרחבת השיא, סימן לכך שהעמודה SEC עשויה להזדקק לניקוי או להחלפה. ניתן להשתמש באותה הזרקת תקן BSA כדי לציין יישור אותות, הרחבת שיא ונרמול גלאי.
-
ניתוח מצטבר באמצעות תוכנת דוליטל
- לחצו על הפרוצדורות המסומנות בלשונית. ציין את רמת הביטול המינימלית הנדרשת; אף אחד לא מספיק בדרך כלל.
- ודא שתוכניות בסיסיות צוירו כראוי והתאימו במידת הצורך, לערוצי LS1, LS2, LS3, RI ו-UV. הגדר את אזור השיא של הריבית.
- סקור את התפלגות המסה המולקולרית כדי לוודא שהפסגות הנקראות מכילות חלקיקים בגודל דומה.
5. ניתוח משתנה מחייב
- הכנה לדוגמה ותיוג
- התחל עם 80 μL של פתרון נוגדן mg/mL של 3.5. Desalt המדגם באמצעות 0.5 mL התפלה עמודה (7k MWCO). הכן את העמודה על ידי הצמדה תחילה את הפקק התחתון, ולאחר מכן התרופפה את הפקק העליון, והצבתו בשפופרת מיקרו-1.7 mL. צנטריפוגה את העמודה התפלה עבור 1 דקות ב 1,500 x g.
הערה: סמן את החלק החיצוני של העמודה בנקודה כך שניתן יהיה להניחה בכיוון המקורי של השלבים הבאים. - העבר את העמודה לשפופרת מיקרו-צנטריפוגה חדשה. הוסף את 80 μL של חלבון מדולל לראש הטור. יישר את העמודה לכיוון המקורי. צנטריפוגה עבור 2 דקות ב 1,500 x g. הסר את הדגימה מהצנטריפוגה, מחק את העמודה התפלה וערבב היטב את המדגם.
הערה: התפלה נדרש רק אם מטריצה המדגם מכילה amines ראשי, ילוי שperturb את האלקטרופורזה במדגם, או חומרים אחרים שאינם תואמים. - לדלל את המדגם לריכוז הסופי של 2 מ"ג/mL בנפח של 25 μL ולהוסיף 5 μL של מאגר תיוג (ראה טבלת חומרים: משתנה החיוב ערכת מגיב) בצלחת 96-ובכן. הכינו את התיוג המגיב על ידי דילול הכמות הדרושה של תיוג מגיב (ראה טבלת חומרים: משתנה חיוב ערכה מגיב) 1:30 בדימתילמיד. מודאת המדגם במשך 10 דקות בטמפרטורת החדר הרחק מן האור.
הערה: חשוב להפשיר ולאחר מכן להשתמש באופן מיידי זה מגיב ולהשתמש בו בתוך 10 דקות של ערבוב עם DMF. - לאחר הדגירה, להוסיף 60 μL של מים בכיתה מגיב ומערבבים היטב על ידי ליטוף. לכסות את הצלחת עם חותם צלחת וצנטריפוגה את הצלחת ב 1,000 x g עבור 1 דקות.
- התחל עם 80 μL של פתרון נוגדן mg/mL של 3.5. Desalt המדגם באמצעות 0.5 mL התפלה עמודה (7k MWCO). הכן את העמודה על ידי הצמדה תחילה את הפקק התחתון, ולאחר מכן התרופפה את הפקק העליון, והצבתו בשפופרת מיקרו-1.7 mL. צנטריפוגה את העמודה התפלה עבור 1 דקות ב 1,500 x g.
- הכנת שבב משתנה הטעינה
- הכינו את שבב משתנה המטען על ידי הסרת פתרון האחסון ושטיפת בארות 1, 3, 4, 7, 8, ו -10 עם מים. לאחר מכן להחליף את המים עם pH 7.2 פועל מאגר (ראה טבלת חומרים: החיוב משתנה ערכת מגיב).
- הוסף 750 μL של pH 7.2 הפעלת מאגר לתוך צינור המאגר ולמקם את צינור המאגר במקום המצוין בפינה השמאלית העליונה של מגש המדגם. עכשיו להסיר את חותם הצלחת מלוחית 96-ובכן, לחץ על בטל טעינה על ממשק המשתמש במכשיר, והכנס את הצלחת לתוך מגש המדגם gxii.
הערה: מאגרי pH 7.2 שימשו לניתוח זה. השימוש ב-pH 5.6-7.2 מאגרים עשוי לשמש בהתאם לחלבון pI. בעת שימוש במאגרי pH נמוכים יותר, ייתכן שיידרשו שעות הפעלה לדוגמה ארוכות יותר. - לחץ על לחצן בטל טעינה של שבב בממשק המשתמש. ודא שהאלקטרודות חופשיות מכל החלקיקים, ואם לא, יש לנקות עם מנקי המוך. כאשר מכניס את השבב לוודא כי החלון במרכז השבב הוא ללא חלקיקים או כתמים. אם יש צורך, נקו במטלית רכה ונטולת סיבים.
הערה: בעבודה עם שבבי אלקטרופורזה קפידית, הסירו מאגר על ידי שאיפה ואקום, ואחריו התוספת המיידית של הפתרון הבא כדי למנוע מבארות להתייבש. כדי למזער את הקדמה של בועות, לתרגל הפוך טכניקת ליטוף. כאשר הטיפול השבב, להיות מודע של נימי שברירי הארכת מהחלק התחתון של השבב, וודא כי זה לא להתייבש ואינו לשבור דרך טיפול מחוספס. - סגור את המכסה אל תא השבב ובחר את הערך של משתנה החיוב בחלבון HT . לחץ על לחצן הפעלה. בצע את ההנחיות כדי לבחור את הבארות לדוגמה, סוג הלוח, זמן הטיפול (68, 90, או 100 s) ושם הקובץ. לחץ על התחל בסוף ההנחיות.
- ניקוי שבב דורש שטיפת כל טוב 2x עם מים, ואחריו תוספת של מאגר האחסון (ראה טבלת חומרים: המטען מגיב משתנה ערכה). ברגע שאגור במאגר האחסון, החלף את השבב בכלי וכשתתבקש, בחר את הערך של חיוב החלבון HT. במסך הראשי בחר ' שטוף ' בממשק המשתמש. לאחר השלמתו, להסיר את השבב, לנגב את האלקטרודות עם מים ומנקי מוך, ולאחסן את השבב ב 4 ° c.
- ניתוח משתנים מגובים
- פתח את תוכנת ניתוח המכשיר. יבא את ההפעלה על-ידי הולך לקובץ ≫ ייבוא קובץ נתונים... ולחיצה על הקובץ הרצוי *. gxd. רק השם יבוצע על התוכנה, כך שינוי שם הבארות הוא יתרון (כלים ≫ עורך שם לדוגמה). בחר את הקבצים לייצוא על-ידי החזקת מקש shift למטה בעת בחירת הקבצים. לחץ על קובץ ≫ ייצוא. .. ובחר את תיבת הנתונים הגולמיים ולאחר מכן את התיבה תבנית AIA .
- פתח את הכרטיסיה עיון בפרוייקטים בתוך תוכנת הניתוח. לחץ על מסד נתונים ≫ ייבוא נתונים ובחר את המיוצא *. קבצי CDF.
- לאחר ייבוא, נווט אל הכרטיסיה זריקות , בחר את הקבצים שנותחו, לחץ לחיצה ימנית ועבור לתהליך.. . בחלון שיצוץ, בחר בתיבת הסימון הסמוכה לתהליך ובחר בתיבת הרדיו "השתמש בשיטת עיבוד שצוינה" ובשיטת העיבוד הרצויה מהתיבה הנפתחת. בתיבה הנפתחת מתחת לתווית "כיצד:" בחר באפשרות כיול ו-קוונטייט. לאחר עיבוד, נווט לכרטיסיה תוצאות ובדוק את השילוב של כרומטוגרמות.
הערה: יש לוודא את שיטת העיבוד עבור כל אחת מהשיטות. כנקודת התחלה, הפרמטרים המשמשים עבור שיטת העיבוד הנוכחית נכללים בקובץ ' משלים '.
הערה: ניתן לבצע ייצוא של הנתונים בצורת דוח או לייצא רק את הקוונפיקציה של השיא. אלה יכולים להתבצע באותו זמן כמו עיבוד או מחלון התוצאות.
6. אנליזת חומצת אמינו
- הגדרת העקומה הסטנדרטית לקוונפיקציה חומצת אמינו מוחלטת על ידי LC-MS
- להכין את חומצת אמינו מורחבת (EAA) תערובת ידי המסת 59.45 מ"ג של Asn, 59.00 mg של Hyp, 65.77 mg של Gln, ו 91.95 mg של Trp ב 25 מ ל של 0.1 N HCl. הריכוז הסופי של כל חומצת אמינו בתערובת אאה הוא 18 nmol/μL.
- להכין את התקן הפנימי (ISTD) פתרון מניות על ידי המסת 58.58 מ"ג של צפון ו44.54 mg של Sar ב 50 mL של HCl.
- להכין את הסטנדרטים חומצות אמינו מלאה על ידי שילוב של הפתרון מלאי חומצות אמינו המכיל Ala, Asp, Arg, Cys, לגלו, בגסות, שלו, איל, Leu, נפגשו, פה, Pro, Ser, מלאו, Trp, וואל ב 1 nmol/μL כל אחד עם תערובת EAA עבור ריכוזי חומצות אמינו 900 הסופי של , 225, 90, 22.5, ו 9 pmol/μL. להוסיף את מלאי ISTD מוכן לסטנדרטים חומצות אמינו לריכוז הסופי של או 90 pmol/μL או 900 pmol/μL כדי ליצור "נמוך" ו-"high" סטנדרטים פנימיים להשתמש כפקדים חיוביים עבור השיטה.
- מניחים את ריכוזי חומצת האמינו בבקבוקונים לדוגמה בתוך הדגם האוטומטי של הבנק. צור עקומת כיול (9 עד 900 pmol/μL) בתוכנת המכשיר המבוססת על ריכוזי החומצות האמינו באמצעות ההוראות הבאות.
- השתמש ב-Q-תוף בתרסיס ליינון (ESI) רגישות חיובית מצמידים ל-MC לניתוח של חומצות אמינו שלמות. עבור הפרדה כרומטוגרפית, השתמש בעמודת פאזה רגילה העשויה עבור הפרדות של חומצת אמינו. הכינו את המאגרים הבאים עם ריאגנטים המוני כיתות המסה: A = acetonitrile + 0.1% החומצה פורמית ו-B = 100 mM אמוניום. הגדר את קצב הזרימה מסוג LC ל-0.6 mL/min וטמפרטורת עמודה ל-40 ° c.
- השתמש בתנאי הדרגתי הבאים של 15 דקות עבור הפרדות של חומצות אמינו: 14% B (0-3 דקות), 14-100% B (3-10 דקות), 100% B (10-13 דקות), 100-8% B (13-14 דקות), 8% B (14-15 דקות).
- השתמש ברישומי העמודות "סוג לדוגמה" ו-"Conc A" בתוכנית הרכישה של MS כדי ליצור עקומת כיול לניתוח עתידי של מדיה ביוריאקטור גסה בתוכנית הקוונטור. כדי לגרום לעמודות אלה להופיע בתוכנית הרכישה, השתמש בפקודה התאמה אישית של הצג. ...
- סוג המדגם לתקני חומצת האמינו יהיה "סטנדרטי" בזמן שדגימות המדיה יהיו "אנליטה". מלא את העמודה "Conc A" עם הריכוזים המספריים של התקנים ביחידות הנדרשות (ex: pmol/μL).
- הפעל את ריכוזי החומצות האמינו המוכנות לפחות פעמיים. ודא שכלי ה-, וספקטרומטר המסה פועלים כראוי על-ידי בדיקת פסגות ה-ISTD.
- השתמש באפשרות "ערוך שיטה" ביישום הקוונ, כדי ליצור את שיטת הקוונ, (קובץ *. mdb). הגדר את כל חומצות האמינו המעניינות ביישום כימות, כגון שם המתחם, ערך m/z וזמן השמירה הצפוי. שנה את פרמטרי השילוב עבור השיטה כאן.
- השתמש בשיטת חומצת האמינו שנוצרה בדגימות הסטנדרטיות כדי ליצור את עקומת הכיול. ניתן לייצא עיקול זה לקובץ *. cdb לשימוש עם דגימות המדיה באמצעות הפקודה ' ייצוא > כיול. ..
- ביישום כימות הדרך, שמור את הפריסה הרצויה לקובץ *. qlt כדי להחיל על ערכות נתונים עתידיות באמצעות "שמירת פריסה כ...". שם (שם הזרקה), אזור ו-Conc הם עמודות הפלט החשובות ביותר.
- חומצות אמינו בדיקת מדיה ביוריאקטור גולמי על ידי LC-MS
- צנטריפוגה גולמי מדיה ביוריאקטור חקן ב 1,962 x g עבור 5 דקות ולעבור דרך מסנן 0.22 יקרומטר.
- מעקב עם perchloric חומצה ניקוי להסיר חומר חלבון וחלקיקים: לערבב את מדיה מסוננים ביוריאקטור חקן עם 0.4 N hclo4 ביחס 1:1 וצנטריפוגה ב 14,700 x g עבור 5 דקות ב-RT. לאסוף את המדיה הבהירה בבקבוקונים דוגם אוטומטי.
הערה: כוונן את עוצמת ההזרקה לפי הצורך כדי להפוך את ריכוזי חומצת האמינו לנופלים בטווח הכיול. בהתאם לכלי, נפח ההזרקה ניתן לכוונן בין 0.1 μL ו-10 μL. - הפעל דגימות מדיה בטריליטה על-ידי LC-MS. השתמש ב"דגימות תהליך" תחת תוכנית הקוונט יחד עם השיטה (*. mdb) וקובץ הכיול (*. cdb). השיטה ועקומת הכיול יוחלו באופן אוטומטי על דגימות המדיה הגולמי על-ידי יישום הקוונ, ברגע שכל הזריקות יושלמו.
- כדי לייצא נתונים לצורך ניתוח בתוכנית אחרת (כגון גיליון אלקטרוני), השתמש בפקודה "Print" וצור קובץ *. xps או *. pdf.
תוצאות
נוזל התרבות תאים שנקטפו מן המיקרו מיקרופרקטור אוטומטית הוא מטוהר באמצעות חלבון מהיר כרומטוגרפיה נוזלית (FPLC), כפי שנראה באיור 1 ואת החלבונים מטוהרים ' איכות קריטית (CQAs) התאפיין בתכונות שונות שיטות אנליטיות במורד הזרם. זהו יתרון מרכזי של מערכת המיקרוביוריאקטור האוטומטית; הבדלים CQAs ניתן להעריך במהירות על פני מגוון רחב של תנאים. N-גליקן נתונים מ-CHO המיוצר mAbs כי הם מעובדים על ידי ספקטרומטר מסה צריך להיראות כמו chromatograms המוצג באיור 2. הדמות מתארת השוואה בין שני כרומטוגרמות המראים כי מנוז 5 שיא (M5) ממדגם אחד נמוך במידה ניכרת. אם רק בסיס רועש נצפה במקום בפסגות, ייתכן שפירוש הדבר שכיוונון הכרומטוגרפיה פגום או שההליך אינו מוצלח. באמצעות פקדים, פתרון בעיות יכול להיות פשוט יותר. ראשית, העריכו את פסגות FLR מסולם דקטרן; פסגות אלה מציינות כי מערכת הכרומטוגרפית פועלת כהלכה. לאחר מכן, השווה את הפסגות המתקבלות מהניסויים עם אלה שהתקבלו מתקן mAb מעובד שניזוק. אם הפסגות מהסטנדרט גלויות, אך לא זוהו פסגות מדגם, אזי דגימות mAb לא עובדו כראוי. זה עשוי לנבוע SDS או נוכחות נוקלאופיל בתוך החוצץ מפריעה עם התוויות N-גליקן וטיהור.
SEC-דוליטל ניתן להשתמש כדי להעריך שני CQAs יותר: פרופיל הצבירה ואת המשקל המולקולרי של הנוגדן. נציג שניה-דוליטל chromatogram הוא דומה לזו המוצגת באיור 3. התפלגות המסה המולקולרית והמשקל המולקולרי המוחלט נקבעו באמצעות התוכנה הדרושה עם מקדם השמדה של 1.37 mL * (mg * ס"מ)-1 ו- dn/dc של 0.185 ml/g. ככל שקריאה לשיא והגדרת התוכנית הבסיסית בתוכנה מבוצעת באופן ידני, התוצאות עשויות להשתנות מעט מהמשתמש למשתמש. המשקל המולקולרי המוחלט של monomeric IgG1 מתוך איור 3 הוא 1.504 x 105 Da ± 0.38% (כחול) ואת מורכבות הסדר הגבוה הוא 7.799 x 105 Da ± 3.0% (אדום). מידת הפיזור של האגרגטים גדולה הרבה יותר מזו של המונומר, כפי שמצוין על ידי התפלגות המסת הטוחנת האדומה של שיא 1 (איור 3). הכמות הקטנה של המדגם והחשיבות של הצבירה כ-CQA הופכים טכניקה זו לכלי אנליטי רב ערך משלים למערכת המיקרוביוריאקטור האוטומטית.
התוצאה של mCZE הוא electropherogram, כגון באיור 4, אשר מציג את הפרופיל משתנה המטען עבור נוגדן חד שבטיים. הפרופיל הוא חתימה ייחודית עבור החלבון נחקר והוא רגיש מאוד ל-pH ההפעלה. כמו כן, ניתן לראות את השיא החופשי משמאל לפרופיל משתנה הטעינה. בעת יצירת pH הפעלה, יש כמה שיקול דעת למפעיל כדי לאזן את הרזולוציה ואת האות; בנוסף, על המפעיל להבטיח הפרדה טובה מפסגת הצבע החופשי הנודד ב-~ 30. המדגם יכול להיות התפלה לאחר התוויות כדי להסיר את השיא הזה, למרות שזה מוביל לאובדן משמעותי באות. לאחר הקמת pH הפעלה, ניתן להשוות את הפרופילים לדוגמה. בעוד באופן כללי עקבי, שינויים ביעילות תיוג או הבדלים ילוי יכול להוביל הבדלים משניים בהגירה של מדגם ואת משתנה הטעינה פרופיל הפיכת electropherograms קשה להשוות ישירות. במקום זאת, שיטת ההשוואה מבוססת בדרך כלל על אחוזי המינים הבסיסיים, העיקריים והחומציים. במקרה זה, ניתן לזהות הבדלים יחסיים קטנים כמו 1-2% באמצעות mCZE.
צריכת חומצת אמינו ניתן לפקח כדי לקבוע אם דלדול גורם שינויים CQAs. ניתן להשתמש בכלי הקריאה של כרומוטוגרמה מספקטרומטר המסה כדי להעריך את היצירה המוצלחת של עקומת כיול לקוונפיקציה מוחלטת של חומצות אמינו בדגימות מדיה ביוריאקטור גולמי. איור 5 מתאר שני כרומטוגרמות יון כוללת (TIC) ואחד מופק ion כרומטוגרם (XIC) כתוצאות מייצגות במהלך תהליך זה. באיור 5A, טיק המוצג מתארת את אות הרקע ממערכת המאגר כמו רק הוזרק מים ריקים. איור 5 ב מתאר מייצג TIC של תקן חומצת אמינו שבו, כאשר בהשוואה למים ריקים, פסגות קטנות המתאימות המינים בודדים חומצת אמינו ניתן לצפות (כגון ליזין ב 7.96 דקות). כדי לשלב את השיא ולהקל על הכמת של אזור השיא (ולכן את הריכוז), XIC משמש שבו רק את האות מתוך "חלון מסה chromatogram מוגדר" מוצג. בהתאם לרגישות המכשיר ולאיכות ההפרדה הכרוגרפית, יהיה על המשתמש לקבוע את חלון המסה האופטימלי. בדוגמה זו (איור 5ג), XIC של ליזין (m/z = 147.1144) עם חלון המוני של 10 דפים לדקה מוצג כאשר ליזין בתקן חומצת אמינו מוריד את הטור בשעה 8.03 דקות.
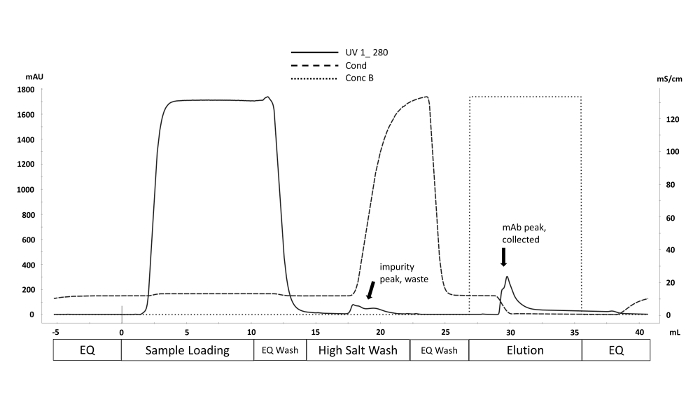
איור 1 . הנציגה chromatogram של ערכת הטיהור באמצעות הטכניקה מהירה חלבון כרומטוגרפיה (FPLC). שלבים של שיטות טיהור המתאימים לאמצעי אחסון (mL) מסומנים לאורך ציר ה-x. ספיגת UV ב 280 nm (מאו y-ציר, קו מלא) מנוטרים במהלך מחזור טיהור. זיהומים שאינם מאוגדים במיוחד הם עקורים על ידי הגדלת מוליכות (mS/cm-ציר y, קו מקווקו) במהלך שטיפת מלח גבוה. הנוגדן הוא שופר מן חלבון עמודה עם המבוא של מאגר הימנעות (Conc B, קו מנוקד) כאשר ה-pH פוחתת ל 4 (לא מוצג). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
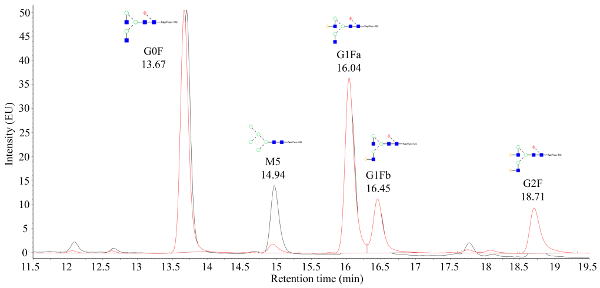
איור 2. כרומטוגרם פלואורסצנטית מייצג שהתקבל מ מתויג גליקנים כי הם מאומתים המונים. ציר ה-x הוא זמן שמירה (דקות) כאשר ציר ה-y הוא עוצמת אות. השיא ב 14.94 דקות מייצג את מנוז 5 (M5) גליקן, שבו הבדל גדול בין עוצמת האות M5 ניתן להבחין בין שתי הדגימות כי הם מצופים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
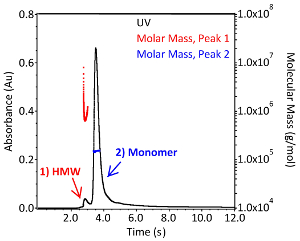
איור 3. IgG1 מולקולרית משקל התפלגות נוגדן חד שבטיים. כרומאטוגרמה של נוגדן שIgG1 חד שבטיים מופרדים על ידי כרומטוגרפיה הדרה בגודל 1x PBS (pH 7.4). הספיגה מפוקחת ב-280 ננומטר (שחור; ציר שמאלי) ופיזור אור וגלאי שבירה שימשו לחישוב המשקל המולקולרי המוחלט של כל שיא (אדום וכחול; הציר הימני). מינים מולקולאריים גבוהים מסומנים בשיא המסומן "HMW". אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4 . פרופיל משתנה של מטען של נוגדן IgG1 שבטיים. Electropherogram זה נוצר על פלטפורמת mCZE. שיא חופשי לצבוע נודד ב-~ 30 והוא מופרד היטב מ-IgG1. כדי לכמת, הפסגות התחלקו למינים בסיסיים, עיקריים וחומציים באמצעות תוכנת ניתוח נתונים של מכשירים. הקו האדום מתווה את אזורי השיא המשולבים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
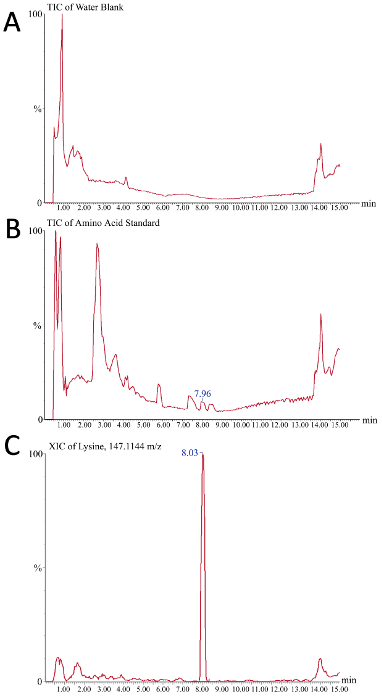
איור 5. תוצאות מייצגות של כרומטוגרמות היונים לניתוח חומצת אמינו מבוססת-ספקטרומטריה של מדיה ביוריאקטור גולמי. ציר ה-x הוא זמן (דקות) בעוד ציר ה-y הוא עוצמת האות (A) ריק מים משמש כפקד שלילי וחושף את אות הרקע שנצפה במהלך המעבר כרומטוגרפיה נוזלי (ב) 225 Pmol/μl חומצת אמינו תקן משמש כאן בתור שליטה חיובית, כמו פסגות בודדות שנצפו זה הכולל יון chromatogram מייצגים את חומצות אמינו שונות של התמהיל הסטנדרטי להיות כרומטוגרפית נפתרה (ג) נציג מופק כרומוטוגרמה יון עבור m /z 147.1144, שהוא ליזין. שיא 7.96 דקות ב-B מקביל לשיא 8.03 C של ליזין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
הבכצ מכיל פסולת וחלקיקים גדולים שיכולים לסתום ולהרוס מיכשור יקר, ולכן הבהרה בתרבות נחוצה לפני הצורך בתהליך הזרם. צנטריפוגה היא בדרך כלל הגישה הראשונה לתאים נפרדים וחלקיקים מסיסים אחרים מחלבונים ואחריהם סינון. מסונן זה מסוננים אז נתון חלבון מהיר כרומטוגרפיה נוזלית (FPLC) עבור טיהור. טיהור של הבכצ מיקרוביורינים אוטומטיים כדי להשיג את המוצר הוא צעד חשוב בעיבוד הזרם. כאן, מערכת FPLC של שחקן הספסל עם חלבון עמודה משמשת להשגת נוגדנים חד-שבטיים מ-HCF. הניתוח לתהליכי במעלה הזרם יכול לספק תובנה שימושית להתנהגות התא ועיצוב ביוביואלי, המסייע בהשגת מוצר איכותי ואמין. בנוסף, הניתוח מאפשר לנו לקשר את תכונות האיכות הקריטיות (CQAs) לתהליכי הזרם ולמטה. להלן ארבע מובאות שמשמשות בדרך כלל לאפיון נוגדנים חד-שבטיים. טכניקות אלה הן איתנות, אמין, ניתן לפריסה בקלות עבור תהליך וניתוח מוצר מתוך מגוון של מקורות במעלה אשר מטוהרים חלקית בלבד ועשויים עדיין להכיל שיורית רמות של DNA ו HCP.
בעת ניקוי דגימות עבור ניתוח, יש ליצור איזון חשוב בין יצירת מדגם הנקי מספיק לניתוח תוך שמירה על השונות הקיימת בביוריאקטור. שני המזהמים הנפוצים ביותר להשפיע על המוצר הם דנ א ו HCP, אשר ניתן לבדוק על ידי מדידת היחס ספיגת ב260/280 ננומטר ו באמצעות SDS-עמוד או μCE-SDS. הנושא המוצג כאן אינו רגיש לרמות נמוכות של תוכן ה-DNA. טוהר המוצר הוא > 95% טהור, כפי שנקבע על ידי μCE-SDS.
ניתוח משתנה מחייב עם מערכת אלקטרופורזה במיקרוקפילר מספק שיטה בעלת תפוקה גבוהה כדי לזהות משתני חיוב, עם אסימונים וריאגנטים שקל יחסית ליישם. טבעו של הטכניקה ואת הכימיה של תיוג מגיב הן רגישות לילוי ו amines הראשי אחרים, ובכך דורשים צעד התפלה עבור רוב המדגם מטריצות. מניסיון, רמות נמוכות של DNA להעביר שיתוף עם הצבע החופשי מתגובת תיוג ואינם משפיעים על איכות התוצאות. בעוד ששונות של כימות השיא הבסיסי, העיקרי והחומצי היא בדרך כלל < 1%, רמות גבוהות יותר של דנ א ומזהמים אחרים יכולים להגביר את השונות של האפשרות. חשוב מאוד להיות עקבי עם תיוג חלבון ולהבטיח את השימוש ההנחיה של DMF לאחר הסרת מן הבקבוק ולהיות מעורבב עם הצבע. תקני ליזין ו/או היסטידין מומלצים כפקדי תיוג. במשך הזמן ובהתאם לאיכות המדגם, צ'יפס יכול להיות עבירה או לאבד את הציפוי על הערוצים מיקרופלואידיקה המוביל רעש גדול יותר, נוכחות של פסגות רפאים, וריאציה יותר לדוגמה לדוגמה. כדי לזהות מופע זה, ריקים ותקן התאמה למערכת (כלומר NISTmAb) נותחו בו עם דגימות במרווחי זמן קבועים. כאשר מתעוררות בעיות שבב, ניתן לשטוף את האסימונים בעזרת פתרון האחסון או להחליפו.
השיטות המשמשות לניתוח גליטליות של גליקורופנים טיפוליות מערבת בעיקר כרומטוגרפיה נוזלית (LC) ו/או ספקטרומטר מסה (MS), עם ניתוח microarray מיקרוטין צובר פופולריות כאופציה שלישית25. השיטה המתוארת במאמר זה משתמשת הן LC ו-MS, אשר יש יתרונות וחסרונות. שיטות ספקטרומטר מסה מנצלות את היתרון של אימות המוני של הגליקנים שנותחו, דבר שאינו אפשרי בשיטות מבוססות LC באמצעות פלט של זיהוי פלורסנט או מיקרו-מערכים של לקטין. שיטה זו משתמשת ב-LC ובזיהוי הקרינה הפלואורסצנטית כדי להקצות באמצעות זמן שמירה על השוואה לסולם דקטרן. ניטור פלואורסצנטית מאפשר רגישות מוגברת וכימות בשל הקלות של הגילוי שלה, שבו MS לבד אולי לא יוכלו לכמת מינים שפע נמוך בשל יעילות יינון העניים של oligosaccharides. המידע ההמוני מ-MS משמש כדי לאשר את הזהויות של גליקן, אך תוכנת העיבוד אינה משתמשת במידע המוני כקריטריון ההקצאה העיקרי. מכאן, ללא כרומטוגרפיה הניתנת לפתירה ובקלות הפסגות, שיטה זו יכולה לסבול לגבי משימות גלינו. למרבה המזל, המידע ההמוני יכול לעזור עם הקצאות גליל גם במצבים שבהם הכרומטוגרפיה מהווה משנה, כגון משמרות בזמן שמירה המזרות הקצאות גלירות. אם נעשה שימוש בשיטה זו ללא MS, הכרומטוגרפיה חייבת להיות ברמה הגבוהה ביותר, מכיוון שאין אפשרות להשתמש במידע המוני כדי לתקן את הזמן המתאים למגורים.
השיטה לניתוח חומצת אמינו שתוארה כאן משתמשת ב-LC-MS לצורך כימות מהירות של חומצות אמינו בלתי מחמיחות במדיה של התרבות התא הגולמי. השיטות החלופיות לניתוח חומצת אמינו דורשות לאפשר זיהוי אולטרא-סגול באמצעות חומצות אמינו. שיטת LC-MS מציעה יתרונות חשובים על-ידי שיטת LC-UV: הוא מאפשר זיהוי מבוסס על הזמן שמירה הן מסה יון לעומת LC-UV שיטה, אשר מוגבל על ידי חוסר אפיון המוני. יתר על כן, שיטת LC-MS מציע זמן והיתרונות הנוזדוטיים, כמו שיטת LC-UV דורש תגובה ללעג זמן רב, אשר עשוי להקנות השתנות לדוגמה27. עם זאת, הזרקה של מדיה של תרבות התא הגולמי בשיטה LC-MS יכול לגרום להשפעות מזיקות על אות MS בשל יון מגקפה מפויית. סולם כיול מוזרק לעתים קרובות כבדיקת התאמה למערכת, וסדר המדגם אקראי כדי למנוע הטיה בנתונים.
תהליך תרבות התא עבור ייצור נוגדנים באמצעות microbioreactors חקנים מתואר בעבר9. במחקר זה, פרוטוקולים מפורטים לאפיון נוגדנים חד שבטיים שיטות למקסם את הנתונים שנרכשו מתוך כרכים מדגם מוגבל מוגדרים היטב. כמויות מוגבלות של נוזלי תרבות התאים שנקטפו יכול לעיתים להגביל את מידע המוצר שנרכש והבחירה של ההליכים האנליטיים הנכונים כדי להשיג נתונים באיכות המוצר הוא חיוני. הניתוח חשוב לקשר בין פרמטרי תהליך המעלה לבין השינויים באיכות המוצר. כאן, מנחה מסופק עבור משתמשים לאפיין mAbs כאשר עובדים עם microbioreactors חקנים.
Disclosures
פרסום זה משקף את התצוגות של המחבר ואין לפרש אותו כך שייצג את התצוגות או המדיניות של ה-FDA.
Acknowledgements
המחברים מודים לסקוט לאוטה על התמיכה האנליטית שסיפקה. מימון פנימי חלקי ותמיכה בעבודה זו מסופק על-ידי תוכנית הנתיב הקריטי של CDER (CA1-13). פרויקט זה נתמך בחלקו על ידי פעילות לתוכנית התמחות/השתתפות במחקר במשרד למוצרי ביוטכנולוגיה, מינהל המזון והתרופות בארה ב, המנוהל על ידי המכון למדע ולחינוך ע י מכון אוק רידג ' באמצעות בין משרד האנרגיה וה-FDA של ארה ב.
Materials
| Name | Company | Catalog Number | Comments |
| CHO DG44 Cell Line | Invitrogen | A1100001 | |
| Akta Avant 25 | General Electric Life Sciences | 28930842 | |
| Pro Sep vA Ultra Chromatography Resin | Millipore Sigma | 115115830 | Purification Stationary Phase |
| Omnifit 10cm Column | Diba Fluid Intelligence | 006EZ-06-10-AA | Housing for Stationary Phase |
| Tris Base | Fisher Scientific | BP154-1 | |
| Superloop 10 mL | GE Healthcare | 18-1113-81 | |
| µDawn Multi Angle Light Scattering Detector | Wyatt | WUDAWN-01 | |
| 0.22 µm Millex GV Filter Unit PVDF Membrane | Merck Millipore | SLGV033RB | |
| 10X Phosphate Buffered Saline | Corning | 46-013-CM | |
| 12 mL Syringe | Covidien | 8881512878 | |
| 1290 Infinity Binary Pump | Agilent Technologies | G4220A | |
| 1290 Infinity DAD | Agilent Technologies | G4212A | |
| 1290 Infinity Sampler | Agilent Technologies | G4226A | |
| 1290 Infinity Thermostat | Agilent Technologies | G1330B | |
| 1290 Infinity Thermostatted Column Compartment | Agilent Technologies | G1316C | |
| 15 mL Falcon tube | Corning Inc. | 352097 | |
| 150 uL Glass Inserts with Polymer Feet | Agilent Technologies | 5183-2088 | |
| 50 mL Falcon tube | Corning Inc. | 352070 | |
| 96-Well Plate | Bio-Rad | 127737 | |
| Acetic Acid | Sigma-Aldrich | 695072 | |
| Acetonitrile | Fisher Chemical | BPA996-4 | |
| ACQUITY I-Class UPLC BSM | Waters Corporation | 18601504612 | |
| ACQUITY I-Class UPLC Sample Manager | Waters Corporation | 186015000 | |
| ACQUITY UPLC FLR Detector | Waters Corporation | 176015029 | |
| Amicon Ultra-4 100 kDa centrifugal filters | Merck Millipore | UFC810096 | |
| Amino Acid Standard, 1 nmol/µL | Agilent Technologies | 5061-3330 | |
| Amino Acid Supplement | Agilent Technologies | 5062-2478 | |
| Ammonium Formate Solution - Glycan Analysis | Waters Corporation | 186007081 | |
| Blue Screw Caps with Septa | Agilent Technologies | 5182-0717 | |
| CD OptiCHO AGT Medium | Thermo Fisher Scientific | A1122205 | |
| Centrifuge Tubes | Eppendorf | 22363352 | |
| Charge Variant Chip | Perkin Elmer | 760435 | |
| Charge Variant Reagent Kit | Perkin Elmer | CLS760670 | |
| Chromatography Water (MS Grade) | Fisher Chemical | W6-4 | |
| Dimethylformamide | Thermo Scientific | 20673 | |
| Extraction Plate Manifold for Oasis 96-Well Plates | Waters Corporation | 186001831 | |
| Formic Acid | Fisher Chemical | A117-50 | |
| GlycoWorks RapiFlour-MS N-Glycan Starter Kit - 24 Sample | Waters Corporation | 176003712 | |
| GXII Buffer Tubes | E&K Scientific | 697075- NC | |
| GXII Detection Window Cleaning Cloth | VWR | 21912-046 | |
| GXII HT Touch | Perkin Elmer | CLS138160 | |
| GXII Ladder Tubes | Genemate | C-3258-1 | |
| GXII Lint-Free Swab | ITW Texwipe | TX758B | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Intact mAb Mass Check Standard | Waters Corporation | 186006552 | |
| Intrada Amino Acid Column 150 x 2 mm | Imtakt | WAA25 | |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 840274100 | |
| Optilab UT-rEX Differential Refractive Index Detector | Wyatt | WTREX-11 | |
| Perchloric acid | Aldrich Chemistry | 311421 | |
| Pipet Tips with Microcapillary for Loading Gels | Labcon | 1034-960-008 | |
| Polypropylene 96-Well Microplate, F-bottom, Chimney-style, Black | Greiner Bio-One | 655209 | |
| RapiFlour-MS Dextran Calibration Ladder | Waters Corporation | 186007982 | |
| Screw Top Clear Vial 2mL | Agilent Technologies | 5182-0715 | |
| Sodium Chloride | Fisher Scientific | S271-1 | |
| Sodium Iodide | Sigma Aldrich | 383112 | |
| TSKgel UP-SW3000 4.6mm ID x 30 cm L | Tosoh Biosciences | 003449 | |
| UNIFI Scientific Information System | Waters Corporation | 667005138 | |
| Vacuum Manifold Shims | Waters Corporation | 186007986 | |
| Vacuum Pump | Waters Corporation | 725000604 | |
| Xevo G2 Q-ToF | Waters Corporation | 186005597 | |
| Zeba Spin Desalting Column, 0.5 mL | Thermo Scientific | 89883 |
References
- . . Pharmaceutical cGMPs for the 21st Century: A Risk-Based Approach. , (2004).
- New Molecular Entity (NME) Drug and New Biologic Approvals. FDA Available from: https://www.dfa.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicAprrovalReports/NDAandBLAApprovalReports/ucm373420.htm (2015)
- Foltz, I. N., Karow, M., Wasserman, S. M. Evolution and Emergence of Therapeutic Monoclonal Antibodies. Circulation. 127, 2222-2230 (2013).
- Kondragunta, B., Drew, J. L., Brorson, K. A., Moreira, A. R., Rao, G. Advances in clone selection using high-throughput bioreactors. Biotechnology Progress. 26 (4), 1095-1103 (2010).
- Hmiel, L., Brorson, K., Boyne, M. Post-translational structural modifications of immunoglobulin G and their effect on biological activity. Analytical & Bioanalytical Chemistry. 407 (1), 79-94 (2015).
- Rathore, A. S. Roadmap for implementation of quality by design (QbD) for biotechnology products. Trends in Biotechnology. 27 (9), 546-553 (2009).
- . International Council for Harminisation of Techinical Requirements for Pharmaceuticals for Human Use. ICH. , (1999).
- Berkowitz, S. A., Engen, J. R., Mazzeo, J. R., Jones, G. B. Analytical tools for characterizing biopharmaceuticals and the implications for biosimilars. Nature Reviews Drug Discovery. 11 (7), 527-540 (2012).
- Velugula-Yellela, S. R., et al. Use of high-throughput automated microbioreactor system for production of model IgG1 in CHO cells. Journal of Visualized Experiments. , (2018).
- Largy, E., Cantais, F., Van Vyncht, G., Beck, A., Delobel, A. Orthogonal liquid chromatography-mass spectrometry methods for the comprehensive characterization of therapeutic glycoproteins, from released glycans to intact protein level. Journal of Chromatography A. 1498, 128-146 (2017).
- Yang, J. -. M., et al. Investigation of the correlation between charge and glycosylation of IgG1 variants by liquid chromatography-mass spectrometry. Analytical Biochemistry. 448, 82-91 (2014).
- Agarabi, C. D., et al. Bioreactor Process Parameter Screening Utilizing a Plackett-Burman Design for a Model Monoclonal Antibody. Journal of Pharmaceutical Sciences. 104 (6), 1919-1928 (2015).
- Wen, J., Arakawa, T., Philo, J. S. Size-Exclusion Chromatography with On-Line Light-Scattering, Absorbance, and Refractive Index Detectors for Studying Proteins and Their Interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Veurink, M., Stella, C., Tabatabay, C., Pournaras, C. J., Gurny, R. Association of ranibizumab (Lucentis) or bevacizumab (Avastin) with dexamethasone and triamcinolone acetonide: An in vitro stability assessment. European Journal of Pharmaceutics and Biopharmaceutics. 78 (2), 271-277 (2011).
- Li, Y., Weiss, W. F., Roberts, C. J. Characterization of high-molecular-weight nonnative aggregates and aggregation kinetics by size exclusion chromatography with inline multi-angle laser light scattering. Journal of Pharmaceutical Sciences. 98 (11), 3997-4016 (2009).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Han, H., Livingston, E., Chen, X. High throughput profiling of charge heterogeneity in antibodies by microchip electrophoresis. Analytical Chemistry. 83 (21), 8184-8191 (2011).
- Wheeler, T. D., et al. Microchip zone electrophoresis for high-throughput analysis of monoclonal antibody charge variants. Analytical Chemistry. 86 (11), 5416-5424 (2014).
- Carrillo-Cocom, L., et al. Amino acid consumption in naive and recombinant CHO cell cultures: producers of a monoclonal antibody. Cytotechnology. 67 (5), 809-820 (2015).
- Chen, P., Harcum, S. W. Effects of amino acid additions on ammonium stressed CHO cells. Journal of Biotechnology. 117 (3), 277-286 (2005).
- Xing, Z., et al. Optimizing amino acid composition of CHO cell culture media for a fusion protein production. Process Biochemistry. 46 (7), 1423-1429 (2011).
- Fan, Y., et al. Amino acid and glucose metabolism in fed-batch CHO cell culture affects antibody production and glycosylation. Biotechnology and Bioengineering. 112 (3), 521-535 (2015).
- Read, E. K., et al. Fermentanomics informed amino acid supplementation of an antibody producing mammalian cell culture. Biotechnology Progress. 29 (3), 745-753 (2013).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography. A. 1415, 83-90 (2015).
- Zhang, L., Luo, S., Zhang, B. Glycan analysis of therapeutic glycoproteins. MAbs. 8 (2), 205-215 (2016).
- Wahl, O., Holzgrabe, U. Amino acid analysis for pharmacopoeial purposes. Talanta. 154, 150-163 (2016).
- Le, A., Ng, A., Kwan, T., Cusmano-Ozog, K., Cowan, T. M. A rapid, sensitive method for quantitative analysis of underivatized amino acids by liquid chromatography-tandem mass spectrometry (LC-MS/MS). Journal of Chromatography B. 944, 166-174 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved