Method Article
Purificação e análise de um anticorpo monoclonal de células de ovário de hamster chinês usando um sistema de Microbioreator automatizado
Neste Artigo
Resumo
Um protocolo detalhado para a purificação e a análise subseqüente de um anticorpo monoclonal do líquido de cultura de pilha colhido (HCCF) de microbioreactors automatizados foi descrito. O uso de análises para determinar os atributos críticos de qualidade (CQAs) e maximizar o volume de amostra limitado para extrair informações vitais também é apresentado.
Resumo
Os anticorpos monoclonais (mAbs) são um dos produtos biológicos mais populares e bem caracterizados fabricados hoje. Mais comumente produzidos usando células de ovário de hamster chinês (CHO), cultura e condições de processo devem ser otimizados para maximizar os títulos de anticorpos e alcançar perfis de qualidade alvo. Normalmente, essa otimização usa biorreatores de microescala automatizados (15 mL) para a tela de várias condições de processo em paralelo. Os critérios de otimização incluem o desempenho da cultura e os atributos críticos de qualidade (CQAs) do produto anticorpo monoclonal (mAb), que pode impactar sua eficácia e segurança. As métricas de desempenho da cultura incluem crescimento celular e consumo de nutrientes, enquanto as CQAs incluem os perfis de N-glicosilação e agregação do mAb, variantes de carga e peso molecular. Este protocolo detalhado descreve como purificar e analisar subseqüentemente amostras de HCCF produzidas por um sistema automatizado do microbioreactor para ganhar métricas e saídas valiosas do desempenho. Primeiramente, uma proteína automatizada um método rápido da cromatografia líquida da proteína (FPLC) é usada para purificar o MAB das amostras colhidas da cultura de pilha. Uma vez concentrados, os perfis glicados são analisados por espectrometria de massas utilizando uma plataforma específica (consulte a tabela de materiais). Os pesos moleculares do anticorpo e os perfis da agregação são determinados usando a cromatografia da exclusão do tamanho-espalhamento claro do ângulo múltiplo (SEC-MALS), quando as variações da carga forem analisadas usando a electroforese da zona capilar do microchip (mCZE). Além das métricas de desempenho da cultura capturadas durante o processo de biorreator (ou seja, viabilidade da cultura, contagens de células e metabólitos comuns, incluindo glutamina, glicose, lactato e amônia), a mídia gasta é analisada para identificar os nutrientes limitantes para melhorar as estratégias de alimentação e o design geral do processo. Portanto, um protocolo detalhado para a quantificação absoluta de aminoácidos por cromatografia líquida-espectrometria de massas (LC-MS) de meios gastos também é descrito. Os métodos usados neste protocolo aproveitam as plataformas de alta taxa de transferência que são compatíveis para um grande número de amostras de pequeno volume.
Introdução
A terapêutica proteica está sendo usada para tratar uma variedade crescente de condições médicas, incluindo complicações de transplante tecidual, distúrbios auto-imunes e cânceres1. Desde 2004, a administração de alimentos e drogas dos Estados Unidos (USFDA) documentou uma proporção crescente de aplicações de licença biológica (BLAs) de todas as aprovações reguladas pelo centro de avaliação e pesquisa de drogas (CDER), com BLAs representando mais de 25% em 2014 e 20152.
Considerando este mercado em expansão, os fabricantes biofarmacêuticos são desafiados com rapidamente entregando mais produto com qualidade consistente. Os esforços para aumentar o rendimento do produto concentraram-se na engenharia de células CHO e na triagem da linha de produção, embora as melhorias mais significativas sejam devidas aos avanços na otimização da estratégia de mídia/feed e controles ambientais da cultura celular1, 3. º , 4. º , 5 durante o processo de fabricação.
Desde que os mAbs são produzidos em um sistema biológico, pode haver uma variabilidade inerente da proteína. A composição do anticorpo pode ser alterada pós-translacionalmente, como a glicosilação ou impactada pela degradação ou reações enzimáticas. Estas variações estruturais podem provocar reações imunes perigosas ou alterar a ligação do anticorpo, que por sua vez pode reduzir ou eliminar a função terapêutica pretendida5. Assim, os atributos críticos da qualidade (CQAs) de anticorpos monoclonais-perfil de N-glycan, distribuição da variação da carga, e a porcentagem do anticorpo na forma monomérica-são monitorados e controlados regularmente como parte de uma aproximação da qualidade pelo projeto (QbD) durante processosdefabricação1,6. Em um ambiente de produção regulamentado, as proteínas terapêuticas devem atender aos critérios de aceitação a serem licenciados como um produto comercial aprovado de drogas7. Os métodos aqui apresentados seriam tipicamente parte do processo de caracterização da qualidade de um anticorpo7,8, e qualquer cientista protéico estará familiarizado com o seu uso.
No trabalho prévio9, a aplicação e a operação dos microbioreactors para a seleção elevada da produção de condições da cultura de pilha no Bioprocessamento ascendente foram descritas. O produto purificado obtido a partir das diferentes condições de mídia é submetido à análise de N-glycan usando LC-MS. os padrões de glicosilação de proteínas terapêuticas podem ser detectados e caracterizados usando técnicas de LC-MS10,11, e o a presença de várias espécies de glicanos tem sido associada a parâmetros Bioprocessos como estratégia alimentar, pH e temperatura12. O efeito das diferentes condições de mídia sobre a qualidade do produto, indicado pela porcentagem da IgG resultante na forma monomérica, também é avaliado com cromatografia de exclusão de tamanho-espalhamento de luz multiangulares (SEC-mals)13,14 , o perfil Variant da carga 15. The representa um número de modificações16 que poderiam impactar a função de um produto. A electroforese da zona microcapilar (mcze) é uma técnica que ofereça um tempo consideravelmente mais rápido da análise comparada à cromatografia tradicional da troca catiónica (CEx) e aos métodos de focalização isoelétrico capilares (CIEF) usados para a análise variante da carga17 ,18. A mídia de biorreator gasto foi analisada para rastrear o consumo de aminoácidos durante a produção protéica, pois relaciona-se com alterações nos atributos de identificação do anticorpo19,20,21,22 , a 23.
A análise protéica nos permite identificar os parâmetros críticos do processo (CPPs) com base nas relações entre as entradas do processo e as mudanças nas CQAs. Durante o desenvolvimento de Bioprocessos, identificar e medir CPPs demonstra fundamentalmente o controle do processo e assegura que o produto não tenha mudado, o que é essencial em ambientes de manufatura altamente regulamentados. Neste trabalho são apresentadas técnicas analíticas para mensurar algumas das características bioquímicas da proteína mais pertinente ao produto CQAs (perfil N-glycan, variantes de carga e homogeneidade de tamanho).
Protocolo
1. purificação do anticorpo
Nota: o tampão de equilíbrio para o anticorpo em casa é 25 mM Tris, 100 mM NaCl, pH 7,5. O tampão de eluição utilizado é de 0,1 M de ácido acético. Os tampões e a resina (proteína A) são dependentes do anticorpo específico purified. O volume da coluna é equivalente à altura da cama da resina. A quantidade de fase móvel usada é determinada em termos de volume de coluna.
- Inicializando o sistema de purificação
- Abra o software anexado ao sistema de purificação. Utilizando instruções manuais, equilibrar a coluna com o tampão de equilíbrio a uma vazão de 2 mL/min para 40 min. pare o funcionamento manual após a equilibração.
- No coletor de fração, coloque 15 mL de tubos cônicos para coletar o eluato de anticorpos purificados e 50 mL de tubos cônicos para coletar fluxo durante a alta lavagem de sal. Certifique-se de que o coletor de fração seja redefinido para a posição inicial abrindo e fechando o coletor de fração antes do início da execução. O coletor de fração é mantido a 7 ° c.
Observação: o coletor de fração pode ser redefinido manualmente na guia coletor de fração em configurações, para tubos de 15 ml e 50 ml.
- Injeção da amostra
Nota: o fluido de cultura de células colhidas utilizado nos seguintes procedimentos foi obtido a partir de células de ovário de hamster chinês cultivadas em microbiorreatores automatizados9.- Adicione o fluido de cultura de células de colheita filtrada a 0,22 μm a uma seringa vazia de 12 mL cuja extremidade do bocal esteja tampada.
- Segurando a seringa com o bocal virado para baixo, insira o êmbolo da seringa até que uma pequena porção do êmbolo esteja. Certificando-se de que o fluido não está vazando, gire a seringa com o bocal voltado para cima e retire a tampa.
- Ainda segurando a seringa com o bico virado para cima, empurre o cilindro para dissipar qualquer ar até que o fluido de cultura celular esteja na ponta do bico. Insira o bocal da seringa na porta de injecção manual do sistema de purificação e gire para apertar.
- Empurre para baixo no êmbolo até que toda a amostra seja injetada e seja visível no loop de amostra de 10 mL em anexo de grande volume.
- Abra o arquivo de método salvo. Salve o arquivo de resultado no local necessário e especifique o nome do arquivo quando solicitado. Hit executar depois que o exemplo foi injetado no loop de amostra de grande volume.
- Executando o método de purificação
- Selecione o método salvo e clique em executar quando solicitado pelo software do instrumento (etapa 1.2.5).
Nota: o sistema está configurado para executar os seguintes passos. O usuário não precisa fazer nada enquanto o instrumento está em execução. - Equilibrar a coluna com três volumes de coluna (CVs) de tampão de equilibração a uma vazão de 2 mL/min. Uma vez que a coluna é equilibrada, o sistema, usando o loop de amostra de grande volume, injetará a amostra na coluna a uma taxa de fluxo de 1 mL/min.
- Uma gota no sinal UV em 280 nanômetro indica que a amostra está carregando terminado. Lave a coluna com tampão de equilíbrio a uma vazão de 2 mL/min até que o sinal UV caia abaixo de 25 mAU.
- Use quatro CVs de 25 milímetros Tris com 1 M NaCl em pH 7,5 para executar uma lavagem de sal elevada secundária em uma taxa de fluxo de 2 mL/min. O coletor de fração do sistema coletará qualquer proteína/DNA que sai da coluna durante a lavagem de sal em tubos de 50 mL.
- Aplique cinco CVS do tampão da eluição em uma taxa de fluxo de 1 ml/min para Eluir o anticorpo fora da coluna. Recolha o eluato em tubos de 15 mL com base no sinal UV; Quando o sinal UV 280 está acima de 35 mAU, a coleção começa; a coleção termina quando o sinal cai abaixo de 50 mAU; Isso é chamado de corte de pico.
Nota: o corte de pico assegura a normalização dos perfis de eluição e evita o pico de eluição que pode conter agregados proteicos24. - Lave a coluna utilizando três CVs de tampão de equilibração. A corrida termina após a etapa de lavagem.
- Após a eluição, neutralizar imediatamente a proteína purificada utilizando a base Tris de 1 M para um pH de ~ 5,5. Meça a concentração da proteína usando um espectrofotômetro UV-Vis do microespectrômetro em 280 nanômetro e em 260 nanômetro e armazene em 4 ° c.
- Concentre o anticorpo purificado utilizando unidades centrífugas (passo 2). Em seguida, sujeitar o anticorpo purificado à análise de glicanos utilizando LC-MS e analisar o perfil de agregação usando SEC-MALS (etapas 3 & 4).
Nota: o anticorpo purificado não deve ser congelado sem mais trocas de tampão, uma vezes que os ciclos de congelamento-degelo frequentes podem causar agregação e precipitação.
- Selecione o método salvo e clique em executar quando solicitado pelo software do instrumento (etapa 1.2.5).
2. concentração de anticorpos purificados
Nota: o tampão Tris-Acetato é de 0,1 M de ácido acético neutralizado com 1 M Tris base a um pH de ~ 5,5.
- Insira 100 filtros kDa em tubos de centrifugação.
- Lave os filtros com 500 μL de água destilada dupla. Centrifugador por 10 min a 14.000 x g à temperatura ambiente (RT). Repita este passo duas vezes. Descarte o filtrado.
- Transfira os filtros enxaguados para tubos de centrifugação frescos e adicione 500 μL de amostra a cada filtro. Centrifugador por 10 min a 14.000 x g.
- Inverta o filtro em um tubo de giro fresco. Centrifugue por 2 min a 1.000 x g para recolher a amostra concentrada.
- Determine as concentrações da amostra usando um espectrofotômetro UV-VIS. Em branco o espectrofotômetro usando uma solução de tampão do Tris-Acetato. Use um coeficiente de extinção de proteínas de 1,37 mL • (mg • cm)-1 a 280 nm para uma solução de IgG de 1% (% m/v).
- Use a amostra concentrada para preparar 12,5 μL de solução de trabalho de 2 mg/mL para análise de glicanos e 30 μL de 3,5 mg/mL de solução de trabalho para SEC-MALS.
Observação: o protocolo pode ser pausado aqui. As amostras devem ser refrigeradas a 4 ° c. Na concentração de 2 mg/mL, estas amostras devem ser estáveis durante pelo menos três meses a 4 ° c, enquanto as concentrações mais elevadas podem precipar-se.
3. análise de N-glycans utilizando espectroscopia de massa
- Rotulagem e isolamento de N-glycan
- Comece com concentrações de anticorpos de 2 mg/mL num tampão adequado, como fosfato de sódio neutro, citrato ou tampão HEPES. Prepare um padrão de mAb intacto (como o NIST mAb) em 2 mg/mL para processar ao lado das amostras experimentais para servir como um controle positivo.
Nota: os anticorpos devem estar em um tampão final contendo não SDS e menos de 0,1 mM nucleófilos (como Tris, DTT, glicina ou histidina). SDS no buffer de exemplo deve ser removido. Se os nucleófilos estão no buffer, em seguida, dilui-los ou executar uma troca de buffer, uma vez que irá interferir com o kit. O protocolo geral é fornecido com o kit glicana. - Diluir 7,5 μL dos anticorpos com 15,3 μL de água LC-MS-grade em tubos de 1 mL fornecidos com o kit e, em seguida, desnaturar utilizando 6 μL de solução a 5% de um surfactante amigável à enzima e MS-friendly a 90 ° c durante 3 min.
- Arrefecer as amostras durante 3 minutos até à temperatura ambiente (RT). Em seguida, adicione 1,2 μL de PNGase F e incubar por 5 min a 50 ° c.
- Após refrigerar 3 min a RT, Rotule os n-glycans clivados adicionando 12 μl do reagente de marcação fluorescente dissolvido em dimetilformamida anidro (Dmf) e aguarde 5 min. diluir a mistura de n-glycan rotulada com 358 μL de acetonitrila (ACN).
- Coloque uma placa de cromatografia de interação hidrofílica (HILIC) em um colector de vácuo com calços e bandeja de resíduos. Use uma pipeta multicanal para um grande número de amostras.
- Condicionar os poços com 200 μL de água, onde o vácuo é ajustado de modo que o líquido tomará 15-30 s para passar através da resina HILIC. Equilibrar com 200 μL de 85% da ACN antes de carregar a mistura de glicana rotulada pela ACN (400 μL), aplicando o aspirador após cada novo líquido ser adicionado aos poços. Lave a resina com 600 μL de 1% de ácido fórmico (FA)/90% de ACN duas vezes.
- Substitua a bandeja de resíduos por tubos de coleta de 600 μL. Elute o N-glycans etiquetado com tampão da eluição do SPE (3 elutions de 30 μL cada) nos tubos da coleção. Diluir as eluções agrupadas com 310 μL de diluente da amostra DMF/ACN. Pipeta as amostras em frascos de amostrador automático para estar pronto para análise de fluorescência (FLR)-MS.
Nota: estas amostras são estáveis quando armazenadas a-80 ° c durante pelo menos 1 mês. Guarde a placa HILIC na sua embalagem original, gravada fechada e dentro de um dessecador para uso futuro.
- Comece com concentrações de anticorpos de 2 mg/mL num tampão adequado, como fosfato de sódio neutro, citrato ou tampão HEPES. Prepare um padrão de mAb intacto (como o NIST mAb) em 2 mg/mL para processar ao lado das amostras experimentais para servir como um controle positivo.
- Análise LC-MS de N-glycans rotulados
- Analise as amostras de eluição de N-glycan rotuladas em um sistema de cromatografia líquida de ultra desempenho (UPLC) acoplado a um espectrómetro de massa de tempo de voo (Q-ToF) de detector de fluorescência e quadrupolo. Use uma coluna aprovada para a separação cromatográfica dos glicanos etiquetados e aqueça-o ao ° c 60 durante separações.
Nota: a coluna deve ser lavada com 60% de acetonitrila e 40% H2o antes de usar: 50 CVS antes do primeiro uso ou 20 CVS se a coluna tiver sido usada antes.- Use 50 mM de amônio (AmF) (feito com concentrado de fase móvel) e 100% LC-MS-grade ACN para as fases móveis. O AmF é sensível às mudanças do pH e é utilizável por 1 mês após a mistura. Ajuste a taxa de fluxo inicial a 0,4 mL/min, com o inclinação do LC que fornece o AmF crescente durante a fase da eluição.
- Defina o detector FLR para medir no EX 265/EM 425 nm com uma taxa de amostragem de 2 Hz. defina o Q-ToF para o modo de sensibilidade de íon positivo MS1, com uma faixa de massa de 100-2000 Daltons (da), um tempo de digitalização de 0,25 segundos e aquisição de dados contínuos. Use a encefalina de leucina (2 ng/μl em 50% ACN/0.1% FA) para a referência de massa interna, no modo "não aplicar correção".
Observação: a correção de referência de massa interna será aplicada posteriormente durante o processamento de dados. - Re-suspender a escada de dextrano sequencialmente em 22,5 μL de H2O, 25 ΜL de DMF e 52,5 ΜL de ACN. Prepare alíquotas de 10 μL para armazenamento a-80 ° c, pois a escada não é estável por mais de 24 h a temperaturas mais elevadas (temperatura ambiente, 4 ° c). A escada de dextrano degrada-se após mais de um ciclo do congelar-thaw.
- Coloque as amostras no amostrador automático definido para 10 ° c. Carregue um frasco da escada do dextrano junto com amostras, porque a informação do tempo de retenção da escada será usada para atribuições quando a informação maciça usada para validar identificações. Use injeções de 10 μL para as amostras e injeções de 7,5 μL para a escada. Injectar amostras em triplicado. Execute o método carregado.
- Analise as amostras de eluição de N-glycan rotuladas em um sistema de cromatografia líquida de ultra desempenho (UPLC) acoplado a um espectrómetro de massa de tempo de voo (Q-ToF) de detector de fluorescência e quadrupolo. Use uma coluna aprovada para a separação cromatográfica dos glicanos etiquetados e aqueça-o ao ° c 60 durante separações.
- Identificação de N-glycan para dados LC-MS
- Realizar o processamento de dados com um programa otimizado para cromatografia de interação hidrofílica espectrometria de massas de fluorescência (HILIC-FLR-MS).
- Aplique correções de referência de massa interna dentro do programa. Designe as injeções da escada do dextrano como o "padrão" na informação da amostra. No método de análise, defina os tempos de retenção do composto de separação para os compostos de escada que foram detectados durante a execução.
- Para garantir que a área% será devolvida para os glicanos identificados, modifique o método de análise: na guia processamento , clique em configurações de quantitation -calibrar e definir "tipo de ajuste da curva de calibração" para "resposta relativa (%)".
4. análise da agregação de anticorpos utilizando SEC-MALS
- Preparação da amostra
- Transfira a proteína diluída 3,5 mg/mL (passo 2) para um frasco para injetáveis com uma pastilha de vidro de 150 μL. Use uma ponta do carregamento do gel ao Pipet no sino inferior da inserção para evitar a introdução de bolhas.
- Tampe o frasco com uma tampa de septos e analise imediatamente. Armazene a 4 ° c se analisar mais tarde.
- Configuração e equilibração SEC-MALS
Nota: analise a agregação em SEC-MALS configurada com uma cromatografia líquida ultra de alta pressão (UHPLC) com um detetor de MALS e um detector de índice refractive controlados pelo software de MALS.- Configurar um arquivo do método no software de UHPLC para o controle do sistema de UHPLC, ajustando a taxa de fluxo a 0,4 mL/min com uma fase móvel de 1x fosfato tamponado Saline (PBS) (diluído de 10x), o volume da injeção a 5 μL, a temperatura da coluna a 25 ° c e o detector de matriz de diodos (DAD) para monitorizar 280 nm. Definir o tempo de execução para 20 min. equilibrar o sistema por pelo menos 4 h antes de qualquer análise da amostra.
- A interface entre os detectores UHPLC e Multi Angle Light Scattering-refractive index (MALS-RI) requer o uso da saída analógica no DAD. Defina a atenuação DAD para 1.000 mAU no arquivo de método DAD e AU/UV configuração para 1 (UV instrumento ≫ Channels ≫ Channel 1).
- Ligue a lâmpada DAD 30 min antes da análise inicial e defina o comprimento de onda para 280 nm. Ao mesmo tempo, limpe a célula de referência do índice de refração (RI) por 15 min ou até que a linha de base seja estável e feche a célula de referência.
- Configure a sequência de software SEC-MALS, definindo o tempo de coleta para 12 min, o volume de injeção para 5 μL, o DN/DC para 0,185 mL/g, coeficiente de extinção A280 se previamente determinado experimentalmente ou para 1,37 mL * (mg * cm)-1, e a concentração do Amostra. Clique em executar e aguarde até que a caixa de diálogo "aguardando para injetar" apareça na tela.
Nota: o coeficiente de extinção A280 é específico para a proteína de interesse e deve ser determinado experimentalmente. - Configure uma lista de exemplo no software UHPLC na mesma ordem que no software MALS-RI e envie.
Nota: é importante executar uma verificação de adequação do sistema antes e depois de uma execução. A albumina sérica bovina normalmente é usada para verificar a ampliação do pico, um sinal de que a coluna da SEC pode precisar de limpeza ou substituição. A mesma injeção padrão de BSA pode ser usada para especificar o alinhamento do sinal, o pico de ampliação e a normalização do detector.
-
Análise agregada com software MALS
- Clique no separador procedimentosmarcados. Especifique o nível mínimo de desprezo exigido; nenhum é geralmente suficiente.
- Verifique se as linhas de base foram desenhadas corretamente e ajuste se necessário, para canais LS1, LS2, LS3, RI e UV. Defina a área de pico de interesse.
- Revise a distribuição de massa molecular para confirmar que os picos chamados contêm partículas de tamanho semelhante.
5. análise de variantes de carga
- Preparação e rotulagem da amostra
- Comece com 80 μL de uma solução de anticorpo 3,5 mg/mL. Desalt a amostra usando uma coluna de Dessalinagem de 0,5 mL (7K MWCO). Prepare a coluna primeiro tirando a tampa inferior, em seguida, afrouxando a rolha superior, e colocando-o em um tubo de micro-centrífuga 1,7 mL. Centrifugue a coluna de dessalinagem durante 1 min a 1.500 x g.
Observação: marque o exterior da coluna com um ponto para que ele possa ser colocado na orientação original para as próximas etapas. - Transfira a coluna para um novo tubo de microcentrífuga. Adicione o 80 μL de proteína diluída na parte superior da coluna. Alinhe a coluna à orientação original. Centrifugador por 2 min a 1.500 x g. Retire a amostra da centrífuga, descarte a coluna de dessalinagem e misture bem a amostra.
Nota: a Dessalinagem só é necessária se a matriz da amostra contiver aminas primárias, excipientes que perturbarão a electroforese da amostra ou outras substâncias incompatíveis. - Diluir a amostra para uma concentração final de 2 mg/mL num volume de 25 μL e adicionar 5 μL do tampão de rotulagem (ver tabela de materiais: kit de reagentes de variante de carga) na placa de 96 poços. Prepare o reagente de rotulagem diluindo a quantidade necessária de reagente de rotulagem (ver tabela de materiais: kit de reagente variante de carga) 1:30 em dimetilformamida. Incubar a amostra por 10 min à temperatura ambiente longe da luz.
Nota: é importante descongelar e, em seguida, utilizar imediatamente este reagente e utilizá-lo dentro de 10 min de mistura com DMF. - Após a incubação, adicione 60 μL de água de grau de reagente e misture bem com pipetagem. Cubra a placa com um selo da placa e centrifugue a placa em 1.000 x g por 1 minuto.
- Comece com 80 μL de uma solução de anticorpo 3,5 mg/mL. Desalt a amostra usando uma coluna de Dessalinagem de 0,5 mL (7K MWCO). Prepare a coluna primeiro tirando a tampa inferior, em seguida, afrouxando a rolha superior, e colocando-o em um tubo de micro-centrífuga 1,7 mL. Centrifugue a coluna de dessalinagem durante 1 min a 1.500 x g.
- Preparando o chip variante de carga
- Prepare o chip Variant Charge removendo a solução de armazenamento e lavando os poços 1, 3, 4, 7, 8 e 10 com água. Em seguida, substitua a água por pH 7,2 em execução (ver tabela de materiais: kit de reagentes de variante de carga).
- Adicione 750 μL de pH 7,2 que executam o tampão ao tubo do amortecedor e coloc o tubo do amortecedor no ponto indicado no canto esquerdo superior da bandeja da amostra. Agora remova o selo da placa da placa 96-well, pressione a placa do descarregamento na interface de usuário do instrumento, e introduza a placa na bandeja da amostra de gxii.
Nota: foram utilizados buffers de pH 7,2 para esta análise. os tampões do pH 5.6-7.2 podem ser usados dependendo da proteína pI. Ao usar buffers de pH inferiores, tempos de execução de amostra mais longos podem ser necessários. - Pressione o botão descarregar chip na interface do usuário. Assegure-se de que os eléctrodos estão livres de quaisquer partículas e, se não, limpe com um cotonete sem fiapos. Ao inserir a microplaqueta certifique-se de que a janela no centro da microplaqueta está livre das partículas ou dos borrões. Se necessário, limpe com um pano macio sem fiapos.
Nota: ao trabalhar com chips de eletroforese capilar, remova o tampão por aspiração a vácuo, seguido pela adição imediata da próxima solução para evitar que os poços SECem. Para minimizar a introdução de bolhas, pratique a técnica de pipetagem reversa. Ao manusear o chip, esteja atento ao capilar frágil que se estende da parte inferior do chip, certificando-se de que ele não seque e não quebre a manipulação áspera. - Feche a tampa da câmara de chip e selecione o ensaio de variante de carga de proteína HT . Clique no botão executar . Siga as instruções para selecionar os poços de amostra, o tipo de placa, o tempo de ensaio (68, 90 ou 100 s) e o nome do arquivo. Clique em Iniciar no final dos prompts.
- A limpeza de cavacos requer a lavagem de cada poço 2x com água, seguida da adição de buffer de armazenamento (vide tabela de materiais: kit de reagentes de variante de carga). Uma vez no buffer de armazenamento, substitua o chip no instrumento e, quando solicitado, selecione o ensaio de carga de proteína HT. Na tela principal, selecione Wash na interface do usuário. Uma vez terminado, retire o chip, limpe os eléctrodos com água e um cotonete sem fiapos e guarde o chip a 4 ° c.
- Análise de variantes de carga
- Abra o software de análise de instrumentos. Importe a execução indo para arquivo ≫ Importar arquivo de dados... e clicando no arquivo *. gxd desejado. Somente o nome será transportado para o software, então renomear os poços é vantajoso (ferramentas ≫ editor de nome de exemplo). Selecione os arquivos a serem exportados mantendo pressionada a tecla Shift enquanto seleciona os arquivos. Clique em arquivo ≫ exportar... e selecione a caixa de dados RAW e, em seguida, a caixa de formato AIA .
- Abra a guia procurar projetos dentro do software de análise. Clique em banco de dados ≫ importar dados... e selecione o exportado *. Arquivos CDF.
- Uma vez importado, navegue até a guia injeções , selecione os arquivos a serem analisados, clique com o botão direito e vá para o processo... Na janela que aparece, marque a caixa de seleção ao lado de processar e selecione a caixa de rádio "usar método de processamento especificado" e o método de processamento desejado na caixa suspensa. Na caixa suspensa imediatamente abaixo rotulada "como:" Selecione calibrar e Quantitate. Uma vez processado, navegue até a guia resultados e verifique a integração dos cromatogramas.
Observação: o método de processamento precisa ser verificado para cada método. Como ponto de partida, os parâmetros usados para o método de processamento atual são incluídos no arquivo suplementar.
Nota: a exportação dos dados pode ser feita a forma de um relatório ou somente a quantificação máxima pode ser exportada. Eles podem ser feitos ao mesmo tempo que o processamento ou a partir da janela de resultados.
6. análise do aminoácido
- Configurando a curva padrão para a quantificação absoluta do aminoácido por LC-MS
- Prepare a mistura de aminoácido estendido (EAA) dissolvendo 59,45 mg de ASN, 59, 0 mg de Hyp, 65,77 mg de GLN e 91,95 mg de TRP em 25 mL de 0,1 N HCl. A concentração final de cada aminoácido na mistura de EAA é de 18 nmol/μL.
- Prepare a solução de estoque padrão interno (ISTD) dissolvendo 58,58 mg de NVA e 44,54 mg de SAR em 50 mL de HCl.
- Prepare os padrões de aminoácidos completos combinando a solução de aminoácidos contendo ala, ASP, arg, Cys, glu, Gly, his, Ile, leu, Met, Phe, pro, ser, thr, TRP, Tyr, Val em 1 nmol/μL cada uma com a mistura de EAA para concentrações de aminoácidos finais de 900 , 225, 90, 22,5 e 9 pmol/μL. Adicione o estoque de ISTD preparado às normas de aminoácidos para uma concentração final de 90 pmol/μL ou 900 pmol/μL para criar padrões internos "Baixos" e "altos" para usar como controles positivos para o método.
- Coloque as concentrações de aminoácidos em frascos de amostra no amostrador automático do UPLC. Gere uma curva de calibração (9 a 900 pmol/μL) no software do instrumento com base nas concentrações padrão de aminoácidos utilizando as seguintes instruções.
- Use o Q-ToF no modo de sensibilidade positiva de ionização por electrospray (ESI) acoplado a um UPLC para análise de aminoácidos intactos. Para a separação cromatográfica, use uma coluna normal da fase feita para separações do ácido aminado. Prepare os seguintes buffers com reagentes de classe de espectrometria de massa: A = acetonitrila + 0,1% de ácido fórmico e B = 100 mM de amônio formate. Defina a vazão LC para 0,6 mL/min e a temperatura da coluna para 40 ° c.
- Use as seguintes condições de gradiente de 15 minutos para separações de aminoácidos: 14% B (0-3 min), 14-100% B (3-10 min), 100% B (10-13 min), 100-8% B (13-14 min), 8% B (14-15 min).
- Use as listagens de coluna "tipo de amostra" e "conc A" no programa de aquisição MS para criar uma curva de calibração para análise futura de mídia de biorreator bruto no programa de quantificação. Para fazer essas colunas aparecerem no programa de aquisição, use o comando Personalizar exibição... quando clicar com o botão direito do mouse na barra de menu superior.
- O tipo de amostra para os padrões de aminoácidos será "padrão", enquanto as amostras de mídia será "analyte". Preencha a coluna "conc A" com as concentrações numéricas das normas nas unidades requeridas (ex: pmol/μL).
- Execute as concentrações padrão de aminoácidos preparados pelo menos duas vezes. Valide que o instrumento de UPLC e o espectrómetro maciço estão trabalhando corretamente verific os picos de ISTD.
- Use a opção "Editar método" no aplicativo de quantificação para criar o método de quantificação (arquivo *. mdb). Defina todos os aminoácidos de interesse na aplicação de quantificação, como o nome composto, o valor de m/z e o tempo de retenção esperado. Altere os parâmetros de integração para o método aqui.
- Use o método de aminoácido criado nas amostras padrão para criar a curva de calibração. Essa curva pode ser exportada para um arquivo *. CDB para uso com as amostras de mídia usando o comando Export ≫ Calibration... .
- No aplicativo de quantificação, salve o layout desejado em um arquivo *. QLT para aplicar a conjuntos de dados futuros usando "salvar layout como...". Nome (nome da injeção), área e conc são as colunas de saída mais importantes.
- Análise de aminoácidos de meios de biorreator brutos por LC-MS
- Centrifugue a mídia bruta de biorreator em 1.962 x g por 5 minutos e passe por um filtro de 0,22 μm.
- Acompanhamento com uma limpeza de ácido perclórico para remover proteínas e partículas: misture os meios de biorreator filtrados com 0,4 N HClO4 a uma proporção de 1:1 e centrifugador a 14.700 x g por 5 min em RT. colete os meios esclarecidos em frascos para injetáveis do amostrador automático.
Nota: ajuste o volume de injeção conforme necessário para que as concentrações de aminoácidos caiam dentro da faixa de calibração. Dependendo do instrumento, o volume de injeção pode ser ajustado entre 0,1 μL e 10 μL. - Executar amostras de mídia em triplicado por LC-MS. Use "amostras de processo" no programa de quantificação junto com o método (*. mdb) e o arquivo de calibração (*. CDB). O método e a curva de calibração serão aplicados automaticamente às amostras de mídia bruta pelo aplicativo de quantificação depois que todas as injeções forem concluídas.
- Para exportar dados para análise em outro programa (como uma planilha), use o comando "Print" e crie um arquivo *. XPS ou *. pdf.
Resultados
O fluido de cultura de células colhidas do biorreator automatizado de microescala é purificado usando cromatografia líquida de proteína rápida (FPLC), como observado na Figura 1 e os atributos críticos de qualidade de proteínas purificadas (CQAs) foram caracterizados por vários métodos analíticos a jusante. Este é um benefício chave do sistema automatizado do microbioreactor; as diferenças nas CQAs podem ser rapidamente avaliadas através de uma vasta gama de condições. Dados de N-glycan de mAbs produzidos por CHO que são processados por espectrometria de massas devem aparecer como os cromatogramas mostrados na Figura 2. A figura retrata uma comparação entre dois cromatogramas mostrando que o pico de manose 5 (M5) de uma amostra é consideravelmente menor. Se apenas uma linha de base barulhenta for observada em vez de picos, isso pode significar que a configuração da cromatografia está defeituosa ou que o procedimento não é bem-sucedido. Usando controles, a solução de problemas pode ser simplificada. Primeiramente, avalie os picos de FLR da escada do dextrano; Estes picos indicam que o sistema cromatográfico está a funcionar correctamente. Em seguida, compare os picos obtidos experimentalmente com aqueles obtidos de um padrão de mAb intacto processado. Se os picos da norma estiverem visíveis, mas não forem identificados picos de amostra, as amostras de mAb não foram processadas corretamente. Isto pode ser devido ao SDS ou à presença nucleófilo no amortecedor que interfere com a rotulagem e a purificação do N-glycan.
SEC-MALS pode ser usado para avaliar mais duas CQAs: o perfil de agregação e o peso molecular do anticorpo. Um cromatograma representativo da SEC-MALS é comparável ao mostrado na Figura 3. A distribuição de massa molecular e o peso molecular absoluto foram determinados utilizando-se o software requerido com um coeficiente de extinção de 1,37 mL * (mg * cm)-1 e um DN/dc de 0,185 ml/g. Como a chamada de pico e definindo a linha de base no software é realizada manualmente, os resultados podem variar ligeiramente de usuário para usuário. O peso molecular absoluto do monomérico IgG1 da Figura 3 é 1,504 x 105 da ± 0,38% (azul) e o complexo de ordem superior é de 7,799 x 105 da ± 3,0% (vermelho). A polidispersão dos agregados é muito maior do que a do monómero, como indicado pela distribuição de massa molar vermelha do pico 1 (Figura 3). A pequena quantidade de amostra e a importância da agregação como CQA fazem desta técnica uma ferramenta analítica complementar altamente valiosa para o sistema automatizado de microbioreatores.
O resultado de mCZE é um electropherogram, tal como na Figura 4, que mostra o perfil da variação da carga para um anticorpo monoclonal. O perfil é uma assinatura única para a proteína que está sendo investigada e é altamente sensível ao pH de operação. Também visível é um pico de corante livre à esquerda do perfil variante de carga. Ao estabelecer um pH de funcionamento, há alguma discrição ao operador para equilibrar a resolução e o sinal; Além disso, o operador deve garantir uma boa separação do pico de corante livre que migra em ~ 30 s. A amostra pode ser dessalinada após a rotulagem para remover este pico, embora isso leva a uma perda significativa no sinal. Uma vez que um pH de funcionamento é estabelecido, os perfis da amostra podem ser comparados. Embora geralmente consistentes, mudanças na eficiência de rotulagem ou diferenças em excipientes podem levar a pequenas diferenças na migração de uma amostra e o perfil de variante de carga fazendo eletroferogramas difícil de comparar diretamente. Em vez disso, o método de comparação é geralmente baseado nas porcentagens de espécies básicas, principais e ácidas. Neste caso, as diferenças relativas tão pequenas quanto 1-2% podem ser identificadas usando mCZE.
O consumo de aminoácidos pode ser monitorado para determinar se a depleção está causando alterações nas CQAs. Os leituras do cromatograma do espectrómetro maciço podem ser usados para avaliar a criação bem sucedida de uma curva da calibração para a quantificação absoluta dos ácidos aminados em amostras cruas dos meios do biorreator. A Figura 5 retrata dois cromatogramas de íons totais (TIC) e um cromatograma íon extraído (xic) como resultados representativos durante este processo. Na Figura 5a, o TIC mostrado retrata o sinal de fundo do sistema de buffer como apenas um espaço em branco de água foi injetado. Figura 5 B RETRATA um TIC representativo do padrão de aminoácidos onde, quando comparado com a água em branco, pequenos picos que correspondem às espécies de aminoácidos individuais podem ser observados (como a lisina em 7,96 minutos). Para integrar o pico e facilitar a quantificação da área de pico (e, portanto, a concentração), o XIC é usado onde apenas o sinal de uma "janela de massa cromatograma" definida é exibida. Dependendo da sensibilidade do instrumento e da qualidade da separação cromatográfica, a janela de massa ideal terá que ser determinada pelo usuário. Neste exemplo (Figura 5C), o Xic de lisina (m/z = 147,1144) com uma janela de massa de 10 ppm é mostrado onde lisina no padrão de aminoácidos elutos fora da coluna em 8, 3 minutos.
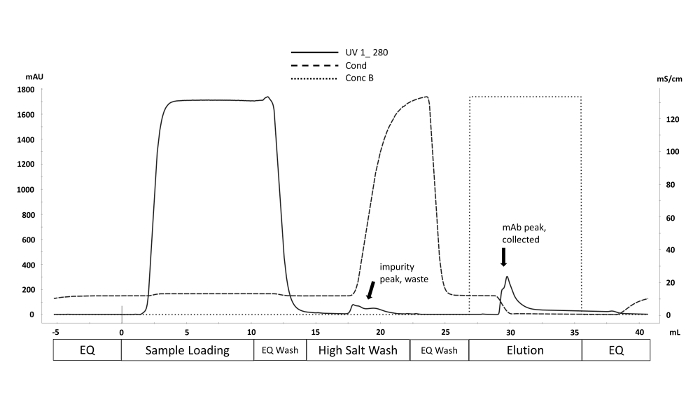
Figura 1 . Cromatograma representativo do esquema de purificação utilizando a técnica de cromatografia líquida de proteína rápida (FPLC). As fases do método de purificação correspondentes ao volume (mL) são rotuladas ao longo do eixo x. A absorvância UV a 280 nm (mAU eixo y, linha sólida) é monitorada durante todo o ciclo de purificação. As impurezas não especificamente ligadas são deslocadas pelo aumento da condutividade (mS/cm y-Axis, linha tracejada) durante a lavagem de sal alto. o anticorpo é eluído da coluna da proteína A com a introdução do amortecedor da eluição (conc B, linha pontilhada) quando o pH diminui a 4 (não mostrado). Por favor clique aqui para ver uma versão maior desta figura.
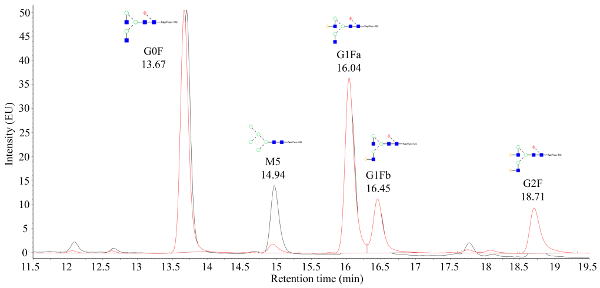
Figura 2. Um cromatograma de fluorescência representativo obtido a partir de glicanos marcados que são verificados em massa. O eixo x é o tempo de retenção (minutos) enquanto o eixo y é a intensidade do sinal. O pico em 14,94 min representa a glicina mannose 5 (M5), onde uma grande diferença entre a força do sinal M5 pode ser observada entre as duas amostras que são sobrepostas. Por favor clique aqui para ver uma versão maior desta figura.
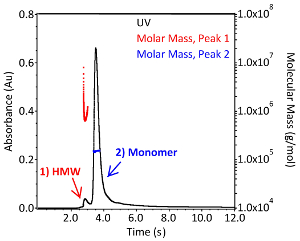
Figura 3. Distribuição de peso molecular do anticorpo monoclonal IgG1. Cromatograma de um anticorpo monoclonal IgG1 intacto separado por cromatografia de exclusão de tamanho em 1X PBS (pH 7,4). A absorvência é monitorada em 280 nm (preto; eixo esquerdo) e os detectores de espalhamento de luz e de índice de refração foram utilizados para calcular o peso molecular absoluto de cada pico (vermelho e azul; eixo direito). As espécies de alto peso molecular são indicadas com o pico rotulado como "HMW". Por favor clique aqui para ver uma versão maior desta figura.

Figura 4 . Perfil variante de carga de um anticorpo monoclonal IgG1. Este electroferograma é gerado em uma plataforma de mcze. Um pico de corante livre migra em ~ 30 s e está bem separado do IgG1. Para a quantificação, os picos foram divididos em espécies básicas, principais e ácidas, utilizando software de análise de dados de instrumentos. A linha vermelha descreve as áreas de pico integradas. Por favor clique aqui para ver uma versão maior desta figura.
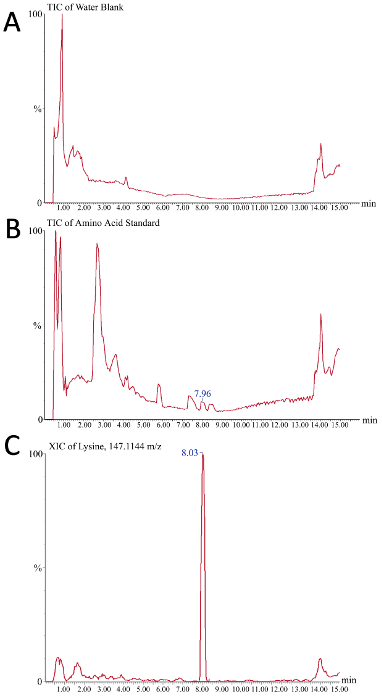
Figura 5. Resultados representativos dos cromatogramas de íon para a análise de aminoácidos de massa baseada em espectrometria de meios de biorreator brutos. O eixo x é o tempo (minutos), enquanto o eixo y é a intensidade do sinal (a) uma água em branco serve como o controle negativo e revela o sinal de fundo observado ao longo do gradiente de cromatografia líquida (B) o 225 pmol/μl aminoácido o padrão é usado aqui como um controle positivo, porque os picos individuais observados neste cromatograma do íon total representam os ácidos aminados diferentes da mistura padrão que está sendo resolvida cromatograficamente (C) um cromatograma extraído representativo do íon para m /z 147,1144, que é lisina. O pico de 7,96 min em B corresponde ao pico de 8, 3 em C de lisina. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
HCCF contem os restos e as grandes partículas que podem obstruir e destruir a instrumentação cara, assim o esclarecimento da cultura é necessário antes do processamento mais adicional do downstream. A centrifugação é geralmente a primeira aproximação às pilhas separadas e às outras partículas insolúveis das proteínas seguidas pela filtração. Este HCCF filtrado é submetido então à cromatografia líquida da proteína rápida (FPLC) para a purificação. A purificação de HCCF de microbioreatores automatizados para obter o produto é um passo importante no processamento a jusante. Aqui, um sistema FPLC de bancada com uma coluna de proteína a é usado para obter anticorpos monoclonais do HCCF. O Analytics para processos upstream pode fornecer insights úteis sobre o comportamento da célula e orientar o design de Bioprocessos, ajudando a obter um produto de qualidade consistente e confiável. O Analytics também nos permite vincular os atributos de qualidade crítica (CQAs) aos processos upstream e downstream. São apresentados aqui quatro ensaios que são comumente usados na caracterização de anticorpos monoclonais. Essas técnicas são robustas, confiáveis e prontamente destacáveis para análise de processos e produtos a partir de uma variedade de fontes upstream que são apenas parcialmente purificadas e ainda podem conter níveis residuais de DNA e HCP.
Ao limpar amostras para análise, um importante equilíbrio deve ser atingido entre a criação de uma amostra que está suficientemente limpa para análise, preservando a variabilidade presente no biorreator. Os dois contaminantes mais comuns que afetam o produto são o DNA e o HCP, que podem ser verificados medindo-se a absorbância da razão em 260/280 nm e através de SDS-PAGE ou μCE-SDS. Os ensaios aqui apresentados não são sensíveis a níveis baixos de conteúdo de DNA. A pureza do produto é > 95% puro, como determinado pelo μCE-SDS.
A análise de variante de carga com um sistema de eletroforese microcapilar fornece um método de alta taxa de transferência para identificar variantes de carga, com chips e reagentes que são relativamente fáceis de implementar. A natureza da técnica e a química do reagente de rotulagem são sensíveis a excipientes e outras aminas primárias, exigindo assim uma etapa de dessalinagem para a maioria das matrizes de amostras. Da experiência, os baixos níveis de DNA comigram com o livre-corante da reação de rotulagem e não impactam a qualidade dos resultados. Embora a variabilidade da quantificação de pico básico, principal e ácido seja tipicamente < 1%, níveis mais elevados de DNA e outros contaminantes podem aumentar a variabilidade do ensaio. É extremamente importante ser consistente com a rotulagem da proteína e assegurar o uso alerta do DMF após a remoção da garrafa e de ser misturado com o corante. Os padrões de lisina e/ou histidina são recomendados como controles de rotulagem. Ao longo do tempo e dependendo da qualidade da amostra, os cavacos podem perder o revestimento nos canais de microfluílicos, levando a um maior ruído, a presença de picos fantasmas e maior variação amostral-amostra. Para identificar esta ocorrência, os espaços em branco e um padrão da adequação do sistema (isto é NISTmAb) foram analisados simultaneamente com as amostras em intervalos regulares. Quando surgem problemas de chip, os chips podem ser lavados com a solução de armazenamento ou substituídos.
Os métodos utilizados para a análise glicônica de glicoproteínas terapêuticas envolvem principalmente cromatografia líquida (LC) e/ou espectrometria de massas (MS), com análise de Microarray de lectina ganhando popularidade como terceira opção25. O método descrito neste artigo usa LC e MS, que tem benefícios e desvantagens. Os métodos espectrométricos de massa têm a vantagem da verificação em massa dos glicanos analisados, o que não é possível com métodos baseados em LC usando uma saída de detecção fluorescente ou Microarrays de lectina. Este método usa a deteção do LC e da fluorescência para atribuir identidades do glicana usando a comparação do tempo de retenção a um padrão da escada do dextrano. A monitoração da fluorescência permite o aumento da sensibilidade e da quantificação devido à facilidade de sua deteção, onde o MS sozinho não pôde poder quantificar a baixa espécie da abundância devido à eficiência pobre da ionização dos oligosaccharides. As informações de massa do MS são usadas para confirmar as identidades do glicana, mas o software de processamento não usa informações de massa como os critérios de atribuição primária. Assim, sem cromatografia reprodutível e picos facilmente resolvíveis, este método pode sofrer em relação a atribuições de glicéis. Felizmente, as informações de massa podem ajudar com as atribuições de glicina mesmo em situações em que a cromatografia é subpar, como turnos no tempo de retenção que dificultam as atribuições de glicina reprodutíveis. Se este método é usado sem MS, a cromatografia deve estar ao mais alto nível desde que a informação de massa não pode ser usada para corrigir para a deriva do tempo de residência.
O método de análise de aminoácidos descrito aqui utiliza LC-MS para quantificação rápida de aminoácidos underivatized em meios de cultura de células brutas. Métodos alternativos de análise de aminoácidos requerem agentes de derivação de aminoácidos para permitir a detecção de UV26. O método LC-MS oferece vantagens importantes sobre o método LC-UV: permite a identificação com base no tempo de retenção e na massa de íons em oposição ao método LC-UV, que é limitado pela falta de caracterização em massa. Além disso, o método LC-MS oferece vantagens de tempo e reprodutibilidade, pois o método LC-UV requer uma reação de derivação demorada, o que pode transmitir a variabilidade da amostra27. No entanto, a injeção de meios de cultura de células brutas no método LC-MS pode causar efeitos prejudiciais no sinal de SM devido à incrustagem de escumadeira de íons. Uma escada de calibração é injetada freqüentemente como uma verificação de adequação do sistema, e a ordem da amostra é randomizada para evitar viés nos dados.
O processo de cultura celular para produção de anticorpos utilizando microbioreatores é descrito anteriormente9. Neste estudo, protocolos detalhados para métodos de caracterização de anticorpos monoclonais que maximizam os dados adquiridos de volumes de amostra limitados são bem definidos. Quantidades limitadas de fluido de cultura de células colhidas podem às vezes restringir as informações do produto adquiridas e a seleção dos procedimentos analíticos certos para obter dados de qualidade do produto é essencial. As análises são importantes para vincular os parâmetros de processo upstream às alterações na qualidade do produto. Aqui, um Guideline é fornecido para que os usuários caracterizem mAbs ao trabalhar com microbioreactors.
Divulgações
Esta publicação reflete os pontos de vista do autor e não deve ser interpretado para representar as visões ou políticas da FDA.
Agradecimentos
Os autores gostariam de agradecer a Scott lute pelo apoio analítico que ele forneceu. O financiamento interno parcial e o suporte para este trabalho são fornecidos pelo programa de caminho crítico CDER (CA #1-13). Este projeto é apoiado em parte por uma nomeação para o estágio/programa de participação de pesquisa no escritório de produtos de biotecnologia, E.U. alimentos e administração de drogas, administrado pelo Oak Ridge Institute for Science and Education através de um acordo interinstitucional entre o departamento de energia dos EUA e a FDA.
Materiais
| Name | Company | Catalog Number | Comments |
| CHO DG44 Cell Line | Invitrogen | A1100001 | |
| Akta Avant 25 | General Electric Life Sciences | 28930842 | |
| Pro Sep vA Ultra Chromatography Resin | Millipore Sigma | 115115830 | Purification Stationary Phase |
| Omnifit 10cm Column | Diba Fluid Intelligence | 006EZ-06-10-AA | Housing for Stationary Phase |
| Tris Base | Fisher Scientific | BP154-1 | |
| Superloop 10 mL | GE Healthcare | 18-1113-81 | |
| µDawn Multi Angle Light Scattering Detector | Wyatt | WUDAWN-01 | |
| 0.22 µm Millex GV Filter Unit PVDF Membrane | Merck Millipore | SLGV033RB | |
| 10X Phosphate Buffered Saline | Corning | 46-013-CM | |
| 12 mL Syringe | Covidien | 8881512878 | |
| 1290 Infinity Binary Pump | Agilent Technologies | G4220A | |
| 1290 Infinity DAD | Agilent Technologies | G4212A | |
| 1290 Infinity Sampler | Agilent Technologies | G4226A | |
| 1290 Infinity Thermostat | Agilent Technologies | G1330B | |
| 1290 Infinity Thermostatted Column Compartment | Agilent Technologies | G1316C | |
| 15 mL Falcon tube | Corning Inc. | 352097 | |
| 150 uL Glass Inserts with Polymer Feet | Agilent Technologies | 5183-2088 | |
| 50 mL Falcon tube | Corning Inc. | 352070 | |
| 96-Well Plate | Bio-Rad | 127737 | |
| Acetic Acid | Sigma-Aldrich | 695072 | |
| Acetonitrile | Fisher Chemical | BPA996-4 | |
| ACQUITY I-Class UPLC BSM | Waters Corporation | 18601504612 | |
| ACQUITY I-Class UPLC Sample Manager | Waters Corporation | 186015000 | |
| ACQUITY UPLC FLR Detector | Waters Corporation | 176015029 | |
| Amicon Ultra-4 100 kDa centrifugal filters | Merck Millipore | UFC810096 | |
| Amino Acid Standard, 1 nmol/µL | Agilent Technologies | 5061-3330 | |
| Amino Acid Supplement | Agilent Technologies | 5062-2478 | |
| Ammonium Formate Solution - Glycan Analysis | Waters Corporation | 186007081 | |
| Blue Screw Caps with Septa | Agilent Technologies | 5182-0717 | |
| CD OptiCHO AGT Medium | Thermo Fisher Scientific | A1122205 | |
| Centrifuge Tubes | Eppendorf | 22363352 | |
| Charge Variant Chip | Perkin Elmer | 760435 | |
| Charge Variant Reagent Kit | Perkin Elmer | CLS760670 | |
| Chromatography Water (MS Grade) | Fisher Chemical | W6-4 | |
| Dimethylformamide | Thermo Scientific | 20673 | |
| Extraction Plate Manifold for Oasis 96-Well Plates | Waters Corporation | 186001831 | |
| Formic Acid | Fisher Chemical | A117-50 | |
| GlycoWorks RapiFlour-MS N-Glycan Starter Kit - 24 Sample | Waters Corporation | 176003712 | |
| GXII Buffer Tubes | E&K Scientific | 697075- NC | |
| GXII Detection Window Cleaning Cloth | VWR | 21912-046 | |
| GXII HT Touch | Perkin Elmer | CLS138160 | |
| GXII Ladder Tubes | Genemate | C-3258-1 | |
| GXII Lint-Free Swab | ITW Texwipe | TX758B | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Intact mAb Mass Check Standard | Waters Corporation | 186006552 | |
| Intrada Amino Acid Column 150 x 2 mm | Imtakt | WAA25 | |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 840274100 | |
| Optilab UT-rEX Differential Refractive Index Detector | Wyatt | WTREX-11 | |
| Perchloric acid | Aldrich Chemistry | 311421 | |
| Pipet Tips with Microcapillary for Loading Gels | Labcon | 1034-960-008 | |
| Polypropylene 96-Well Microplate, F-bottom, Chimney-style, Black | Greiner Bio-One | 655209 | |
| RapiFlour-MS Dextran Calibration Ladder | Waters Corporation | 186007982 | |
| Screw Top Clear Vial 2mL | Agilent Technologies | 5182-0715 | |
| Sodium Chloride | Fisher Scientific | S271-1 | |
| Sodium Iodide | Sigma Aldrich | 383112 | |
| TSKgel UP-SW3000 4.6mm ID x 30 cm L | Tosoh Biosciences | 003449 | |
| UNIFI Scientific Information System | Waters Corporation | 667005138 | |
| Vacuum Manifold Shims | Waters Corporation | 186007986 | |
| Vacuum Pump | Waters Corporation | 725000604 | |
| Xevo G2 Q-ToF | Waters Corporation | 186005597 | |
| Zeba Spin Desalting Column, 0.5 mL | Thermo Scientific | 89883 |
Referências
- . . Pharmaceutical cGMPs for the 21st Century: A Risk-Based Approach. , (2004).
- New Molecular Entity (NME) Drug and New Biologic Approvals. FDA Available from: https://www.dfa.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicAprrovalReports/NDAandBLAApprovalReports/ucm373420.htm (2015)
- Foltz, I. N., Karow, M., Wasserman, S. M. Evolution and Emergence of Therapeutic Monoclonal Antibodies. Circulation. 127, 2222-2230 (2013).
- Kondragunta, B., Drew, J. L., Brorson, K. A., Moreira, A. R., Rao, G. Advances in clone selection using high-throughput bioreactors. Biotechnology Progress. 26 (4), 1095-1103 (2010).
- Hmiel, L., Brorson, K., Boyne, M. Post-translational structural modifications of immunoglobulin G and their effect on biological activity. Analytical & Bioanalytical Chemistry. 407 (1), 79-94 (2015).
- Rathore, A. S. Roadmap for implementation of quality by design (QbD) for biotechnology products. Trends in Biotechnology. 27 (9), 546-553 (2009).
- . International Council for Harminisation of Techinical Requirements for Pharmaceuticals for Human Use. ICH. , (1999).
- Berkowitz, S. A., Engen, J. R., Mazzeo, J. R., Jones, G. B. Analytical tools for characterizing biopharmaceuticals and the implications for biosimilars. Nature Reviews Drug Discovery. 11 (7), 527-540 (2012).
- Velugula-Yellela, S. R., et al. Use of high-throughput automated microbioreactor system for production of model IgG1 in CHO cells. Journal of Visualized Experiments. , (2018).
- Largy, E., Cantais, F., Van Vyncht, G., Beck, A., Delobel, A. Orthogonal liquid chromatography-mass spectrometry methods for the comprehensive characterization of therapeutic glycoproteins, from released glycans to intact protein level. Journal of Chromatography A. 1498, 128-146 (2017).
- Yang, J. -. M., et al. Investigation of the correlation between charge and glycosylation of IgG1 variants by liquid chromatography-mass spectrometry. Analytical Biochemistry. 448, 82-91 (2014).
- Agarabi, C. D., et al. Bioreactor Process Parameter Screening Utilizing a Plackett-Burman Design for a Model Monoclonal Antibody. Journal of Pharmaceutical Sciences. 104 (6), 1919-1928 (2015).
- Wen, J., Arakawa, T., Philo, J. S. Size-Exclusion Chromatography with On-Line Light-Scattering, Absorbance, and Refractive Index Detectors for Studying Proteins and Their Interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Veurink, M., Stella, C., Tabatabay, C., Pournaras, C. J., Gurny, R. Association of ranibizumab (Lucentis) or bevacizumab (Avastin) with dexamethasone and triamcinolone acetonide: An in vitro stability assessment. European Journal of Pharmaceutics and Biopharmaceutics. 78 (2), 271-277 (2011).
- Li, Y., Weiss, W. F., Roberts, C. J. Characterization of high-molecular-weight nonnative aggregates and aggregation kinetics by size exclusion chromatography with inline multi-angle laser light scattering. Journal of Pharmaceutical Sciences. 98 (11), 3997-4016 (2009).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Han, H., Livingston, E., Chen, X. High throughput profiling of charge heterogeneity in antibodies by microchip electrophoresis. Analytical Chemistry. 83 (21), 8184-8191 (2011).
- Wheeler, T. D., et al. Microchip zone electrophoresis for high-throughput analysis of monoclonal antibody charge variants. Analytical Chemistry. 86 (11), 5416-5424 (2014).
- Carrillo-Cocom, L., et al. Amino acid consumption in naive and recombinant CHO cell cultures: producers of a monoclonal antibody. Cytotechnology. 67 (5), 809-820 (2015).
- Chen, P., Harcum, S. W. Effects of amino acid additions on ammonium stressed CHO cells. Journal of Biotechnology. 117 (3), 277-286 (2005).
- Xing, Z., et al. Optimizing amino acid composition of CHO cell culture media for a fusion protein production. Process Biochemistry. 46 (7), 1423-1429 (2011).
- Fan, Y., et al. Amino acid and glucose metabolism in fed-batch CHO cell culture affects antibody production and glycosylation. Biotechnology and Bioengineering. 112 (3), 521-535 (2015).
- Read, E. K., et al. Fermentanomics informed amino acid supplementation of an antibody producing mammalian cell culture. Biotechnology Progress. 29 (3), 745-753 (2013).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography. A. 1415, 83-90 (2015).
- Zhang, L., Luo, S., Zhang, B. Glycan analysis of therapeutic glycoproteins. MAbs. 8 (2), 205-215 (2016).
- Wahl, O., Holzgrabe, U. Amino acid analysis for pharmacopoeial purposes. Talanta. 154, 150-163 (2016).
- Le, A., Ng, A., Kwan, T., Cusmano-Ozog, K., Cowan, T. M. A rapid, sensitive method for quantitative analysis of underivatized amino acids by liquid chromatography-tandem mass spectrometry (LC-MS/MS). Journal of Chromatography B. 944, 166-174 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados