Method Article
自動化された微生物叢システムを用いた中国ハムスター卵巣細胞からのモノクローナル抗体の精製と分析
要約
自動微生物反応器の収穫された細胞培養液(HCCF)からのモノクローナル抗体の精製およびその後の分析のための詳細なプロトコルが記載されている。分析を使用して重要な品質属性(CQA)を決定し、限られたサンプル量を最大化して重要な情報を抽出することも紹介します。
要約
モノクローナル抗体(mAbs)は、今日製造された最も人気があり、よく特徴付けられた生物学的製品の一つです。最も一般的に中国ハムスター卵巣(CHO)細胞を使用して製造され、培養およびプロセス条件は、抗体力中を最大化し、標的品質プロファイルを達成するために最適化されなければならない。通常、この最適化では、自動化されたマイクロスケールバイオリアクター(15 mL)を使用して、複数のプロセス条件を並列にスクリーニングします。最適化基準には、培養性能とモノクローナル抗体(mAb)製品の重要な品質属性(CQA)が含まれており、その有効性と安全性に影響を与える可能性があります。培養性能指標には細胞増殖と栄養消費量が含まれ、CQAにはmAbのN-グリコシル化および凝集プロファイル、電荷変異体、および分子量が含まれます。この詳細なプロトコルでは、自動化されたマイクロバイオリアクターシステムによって生成されたHCCFサンプルを精製し、その後分析し、貴重なパフォーマンスメトリックと出力を得る方法について説明します。まず、自動タンパク質高速タンパク質液体クロマトグラフィー(FPLC)法を用いて、採取した細胞培養サンプルからmAbを精製する。濃縮されると、グリカンプロファイルは、特定のプラットフォームを使用して質量分析によって分析されます(材料の表を参照)。抗体分子量および凝集プロファイルは、サイズ排除クロマトグラフィー-複数角度光散乱(SEC-MALS)を使用して決定され、電荷変異体はマイクロチップキャピラリーゾーン電気泳動(mCZE)を用いて分析される。バイオリアクタープロセス中に捕捉された培養性能メトリック(すなわち、培養生存率、細胞数、グルタミン、グルウズ糖、乳酸塩、アンモニアを含む一般的な代謝産物)に加えて、使用済み培養物は、以下の栄養素を特定するために分析される。供給戦略と全体的なプロセス設計を改善します。そこで、使用済み媒体の液体クロマトグラフィー質量分析(LC-MS)によるアミノ酸の絶対定量のための詳細なプロトコルも記載されている。このプロトコルで使用される方法は、多数の小容量サンプルに対応するハイスループット プラットフォームを利用します。
概要
タンパク質治療薬は、組織移植合併症、自己免疫疾患、および癌1を含む様々な病状の増大を治療するために使用されている。2004年以来、米国食品医薬品局(USFDA)は、薬物評価研究センター(CDER)によって規制されているすべての承認の生物学的ライセンス申請(BLA)の増加率を文書化し、BLAは25%以上を占めています。2014年と2015年2.
この拡大する市場を考えると、バイオ医薬品メーカーは、一貫した品質でより多くの製品を迅速に提供することに挑戦しています。製品の収量を増やす取り組みは、CHO細胞工学と生産ラインスクリーニングに焦点を当てていますが、最も重要な改善は、メディア/フィード戦略の最適化と細胞培養環境制御1の進歩によるものです。3,4,製造プロセス中に5。
mAbsは生物学的システムで産生されるので、タンパク質の変動が生じやすい。抗体組成物は、グリコシル化などの翻訳後に変更したり、分解または酵素反応によって影響を受けたりすることができます。これらの構造的変化は、危険な免疫反応を引き起こすか、抗体結合を変化させる可能性があり、これは意図された治療機能5を減少または排除することができる。したがって、モノクローナル抗体の臨界品質属性(CQA)-N-グリカンプロファイル、電荷変異分布、および単量体形態の抗体の割合は、品質設計(QbD)アプローチの一部として定期的に監視および制御されます。製造プロセス1,6.規制された生産環境では、治療タンパク質は承認された市販薬として認可される受け入れ基準を満たす必要があります7.本明細書に提示される方法は、典型的には抗体7、8の品質特性特性処理の一部であり、任意のタンパク質科学者はその使用法に精通しているであろう。
先行研究9では、上流バイオプロセッシングにおける細胞培養条件の高スループットスクリーニングのための微生物反応器の適用および操作が記載されている。からからからからからからからこのからからからからそのからからからからからからそのからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからからから様々なグリカン種の存在は、飼料戦略、pH、および温度12などのバイオプロセスパラメータにリンクされている。製品品質に対する様々なメディア条件の影響は、単量体形態で得られたIgGのパーセンテージによって示され、サイズ排除クロマトグラフィー-多角光散乱(SEC-MALS)13,14でも評価される。,15.請求バリアントプロファイルは、製品の機能に影響を与える可能性のある多数の変更16を表します。微小キャピラリーゾーン電気泳動(mCZE)は、電荷変異分析に用いられる従来のカチオン交換(CEX)クロマトグラフィーおよびキャピラリーアイソ電集光(cIEF)法に比べてかなり速い分析時間を提供する技術です17 、18.使用済みバイオリアクター培地は、抗体の同定属性19、20、21、22の変化に関連するタンパク質産生中のアミノ酸消費量を追跡するために分析された。,23.
タンパク質分析により、プロセス入力とCQの変化の関係に基づいて重要なプロセスパラメータ(CPP)を特定できます。バイオプロセス開発では、CPPの特定と測定は、プロセス制御を基本的に実証し、高度に規制された製造環境で不可欠な製品が変更されていないことを保証します。本論文では,製品CQAに最も関連するタンパク質の生化学的特性の一部を測定する分析技術(N-グリカンプロファイル、電荷変異体、およびサイズ均質性)を提示する.
プロトコル
1. 抗体の精製
注:社内抗体の平衡バッファーは、25 mMトリス、100 mM NaCl、pH 7.5です。使用する溶出バッファーは0.1M酢酸である。緩衝液および樹脂(タンパク質A)は、精製された特異的抗体に依存する。カラム容積は樹脂のベッド高さと同等です。使用されるモバイルフェーズの量は、列のボリュームで決定されます。
- 精製システムの初期化
- 精製システムに接続されているソフトウェアを開きます。手動指示を使用して、2 mL/minの流量で平衡バッファでカラムを平衡化し、40分間、平衡化後の手動実行を停止します。
- 画分コレクターでは、精製された抗体溶出物と50mLの円錐管を収集するために15 mL円錐管を配置し、高塩洗浄時にフロースルーを収集します。実行を開始する前に分数コレクタを開閉して、分数コレクタが開始位置にリセットされていることを確認します。分数のコレクターは7 °Cで維持される。
注:分数コレクタは、15 mLチューブと50 mLチューブの両方について、設定の「分数コレクタ」タブの下で手動でリセットできます。
- サンプル注入
注:以下の手順で使用される収穫された細胞培養液は、自動化されたマイクロバイオリアクター9で培養された中国ハムスター卵巣細胞から得られた。- 0.22 μm 濾過された収穫細胞培養液を、ノズル端がキャップされた空の12 mLシリンジに追加します。
- ノズルを下に向けたシリンジを持ち、プランジャーの小さな部分が入るまで注射器プランジャーを挿入します。流体が漏れていないことを確認し、ノズルを上にしてシリンジを回し、キャップを取り外します。
- ノズルを上向きにしてシリンジを保持し、細胞培養液がノズルの先端になるまで、シリンダーを押して空気を排出します。シリンジノズルを精製システムの手動射出口に挿入し、引き締めるためにねじれます。
- すべてのサンプルが注入され、付属の10 mL大容量サンプルループに見えるまでプランジャーを押し下げます。
- 保存したメソッド ファイルを開きます。結果ファイルを必要な場所に保存し、プロンプトが表示されたときにファイル名を指定します。サンプルが大容量サンプルループに注入された後に実行されます。
- 精製方法の実行
- 保存した方法を選択し、計測器ソフトウェアのプロンプトが表示されたときに[実行]をクリックします(ステップ1.2.5)。
注: システムは、次の手順を実行するように設定されています。ユーザーは、計測器の実行中に何もする必要はありません。 - 2 mL/min の流量で平衡バッファーの 3 列ボリューム (CV) でカラムを平衡化します。カラムが平衡化されると、システムは、大容量サンプルループを使用して、1 mL/minの流量でカラムにサンプルを注入します。
- 280 nm の UV 信号の低下は、サンプルの読み込みが終了したことを示します。紫外線信号が25 mAUを下回るまで、2 mL/minの流量で平衡バッファーでカラムを洗います。
- pH 7.5で1M NaClを持つ25 mMトリスの4つのCVを使用して、流量2mL/minの二次高塩洗浄を行います。システム分画コレクターは50 mL管の塩洗浄の間にコラムから外れる蛋白質/DNAを集める。
- 溶出バッファーの5つのCVを1mL/minの流量で適用し、抗体をカラムから溶出させる。UV信号に基づいて15 mLチューブで溶出物を収集します。UV 280 信号が 35 mAU を超えると、コレクションが開始されます。信号が50 mAUを下回るとコレクションが終了します。これをピークカットと呼び、これをピークカットと呼び、これを使用します。
注:ピーク切断は、溶出プロファイルの正規化を保証し、タンパク質凝集体24を含む可能性のある溶出ピークテーリングを回避します。 - 平衡バッファーの 3 つの CV を使用してカラムを洗浄します。洗浄ステップの後に実行が終了します。
- 溶出後、1Mトリス塩基を用いて精製タンパク質をpH〜5.5に直ちに中和する。280nmおよび260 nmのマイクロボリュームUV-Vis分光光度計を用いてタンパク質濃度を測定し、4°Cで保存します。
- 遠心単位を用いて精製抗体を濃縮する(ステップ2)。次いで、精製抗体をLC-MSを用いてグリカン分析に行い、凝集プロファイル後はSEC-MALSを用いて分析する(ステップ3&4)。
注:精製された抗体は、頻繁な凍結融解サイクルが凝集および沈殿を引き起こす可能性があるため、さらなる緩衝交換なしに凍結してはならない。
- 保存した方法を選択し、計測器ソフトウェアのプロンプトが表示されたときに[実行]をクリックします(ステップ1.2.5)。
2. 精製抗体の濃度
注:トリス酢酸バッファーは、1Mトリスベースで中和された0.1M酢酸を約5.5のpHにします。
- 遠心管に100 kDaフィルターを挿入します。
- フィルターを 500 μL の二重蒸留水で洗います。室温(RT)で14,000 x gで10分間遠心分離機。この手順を 2 回繰り返します。ろ過を破棄します。
- すすり付きフィルターを新鮮な遠心チューブに移し、各フィルターに500μLのサンプルを追加します。14,000 x gで10分間遠心分離機。
- フィルターを新鮮なスピンチューブに反転させます。濃縮されたサンプルを収集するために1,000 x gで2分間遠心分離機。
- UV-Vis 分光光度計を使用してサンプル濃度を決定します。トリスアセテートバッファーの溶液を使用して分光光度計を空白にします。1% (% m/v) IgG 溶液には、タンパク質消滅係数 1.37 mL•(mg•cm)-1を 280 nm で使用します。
- 濃縮サンプルを使用して、グリカン分析用の2mg/mL作動溶液の12.5 μLと、SEC-MALS用の3.5mg/mL作動溶液の30 μLを調製します。
注: プロトコルはここで一時停止できます。サンプルは4°Cで冷蔵する必要があります。2mg/mL濃度では、これらのサンプルは4°Cで少なくとも3ヶ月間安定し、より高い濃度が沈殿する可能性があります。
3. 質量分析法を用いてN-グリカンの分析
- N-グリカン標識と分離
- 中性リン酸ナトリウム、ク硝酸ナトリウムまたはHEPESバッファーなどの適切なバッファーで2mg/mLの抗体濃度から始めます。2mg/mLで無傷のmAb規格(NIST mAbなど)を準備し、実験サンプルと一緒に処理し、陽性対照として機能します。
注:抗体は、SDSを含まない最終バッファー内にあり、0.1mM未満の核不球(トリス、DTT、グリシンまたはヒスチジンなど)にする必要があります。サンプル バッファ内の SDS を削除する必要があります。ヌクレオフィラがバッファー内にある場合は、キットに干渉するため、それらを希釈するか、バッファー交換を実行します。一般的なプロトコルは、グリカンキットで提供される。 - キットに付属の1mLチューブに15.3μLのLC-MSグレードの水を含む抗体の7.5 μLを希釈し、酵素に優しいMSフレンドリーな界面活性剤の6μLを3分間90°Cで5%溶液で変性させます。
- サンプルを室温(RT)まで3分間冷却します。次いで、PNGase Fの1.2 μLを加え、50°Cで5分間インキュベートする。
- RTに3分冷却した後、無水ジメチルホルミド(DMF)に溶解した蛍光タグ試薬の12μLを加えて、アセトニトリル(ACN)の358μLで標識されたNグリカン混合物を5分間希釈して、cleavedNグリカンに標識します。
- シムと廃棄物トレイを使用した真空マニホールドに親水性相互作用クロマトグラフィー(HILIC)プレートを配置します。多数のサンプルにはマルチチャンネルピペットを使用します。
- 液体がHILIC樹脂を通過するのに15〜30 sかかるように真空が調整される水の200 μLで井戸を調整します。ACN希釈標識グリカン混合物(400μL)をロードする前に、85%ACNの200 μLで平衡化し、新しい液体をウェルに加えた後に真空を適用します。樹脂を1%ギ酸(FA)/90%ACNの600μLで2回洗浄します。
- 廃棄物トレイを600μLの回収管に交換してください。SPE溶出バッファー(各30μLの3つの溶出)を持つ標識されたNグリカンを回収管に溶出します。DMF/ACNサンプル希釈剤の310 μLでプールされた溶出物を希釈します。サンプルを自動サンプラーバイアルにピペットし、蛍光(FLR)-MS分析の準備が整います。
注:これらのサンプルは、少なくとも1ヶ月間-80°Cで保存すると安定しています。HILICプレートは、元のパッケージに保存し、テープでシャットし、将来の使用のためにデシケータの中に保管してください。
- 中性リン酸ナトリウム、ク硝酸ナトリウムまたはHEPESバッファーなどの適切なバッファーで2mg/mLの抗体濃度から始めます。2mg/mLで無傷のmAb規格(NIST mAbなど)を準備し、実験サンプルと一緒に処理し、陽性対照として機能します。
- 標識NグリカンのLC-MS分析
- 蛍光検出器と四重極飛行時間(Q-ToF)質量分析計に結合された超高性能液体クロマトグラフィー(UPLC)システム上の標識されたNグリカン溶出サンプルを分析します。標識されたグリカンのクロマトグラフィー分離に承認されたカラムを使用し、分離中に60°Cに熱します。
注: カラムを使用する前に 60% アセトニトリルと 40% H2O でフラッシュする必要があります: 最初の使用前に 50 CV または 20 CV (カラムが以前に使用された場合)。- モバイルフェーズには50mMアンモニウムフォアメイト(AmF)(モバイル相濃縮物で作られた)と100%LC-MSグレードのACNを使用します。AmFはpHの変化に敏感であり、混合した後1ヶ月間使用可能である。初期流量を0.4 mL/minに設定し、LC勾配により溶出フェーズ中にAmFを増加させています。
- サンプリングレートが2HzのEX 265/EM 425 nmで測定するFLR検出器を設定し、Q-ToFをMS1正イオン感度モードに設定し、質量範囲を100~2,000ダルトン(Da)、スキャン時間0.25秒、連続データ取得に設定します。内部質量基準には、ルーシンエンケファリン(50%ACN/0.1%FAで2ng/μL)を使用し、「補正を適用しない」モードで使用します。
注: 内部質量参照補正は、データ処理中に後で適用されます。 - H2O の 22.5 μL、DMF の 25 μL、および ACN の 52.5 μL でデキストラン ラダーを順次再中断します。ラダーは高温(室温、4°C)で24時間以上安定していないため、-80°Cで保存するために10 μLのアリコートを準備します。デキストランはしごは、複数の凍結融解サイクルの後に劣化します。
- サンプルを自動サンプラーにセットして10°Cにします。ラダーの保持時間情報は割り当てに使用され、識別の検証に使用される質量情報が割り当てに使用されるため、サンプルと共にデエクストラン ラダーのバイアルを読み込みます。サンプルには10 μLの注入を使用し、はしごには7.5 μLの注入を使用します。三つ三つサンプルを注入する。読み込まれたメソッドを実行します。
- 蛍光検出器と四重極飛行時間(Q-ToF)質量分析計に結合された超高性能液体クロマトグラフィー(UPLC)システム上の標識されたNグリカン溶出サンプルを分析します。標識されたグリカンのクロマトグラフィー分離に承認されたカラムを使用し、分離中に60°Cに熱します。
- LC-MSデータのNグリカン同定
- 親水性相互作用クロマトグラフィー蛍光質量分析(HILIC-FLR-MS)データに最適化されたプログラムでデータ処理を実行します。
- プログラム内で内部質量参照修正を適用します。サンプル情報でデエクストランラダー注射を「標準」として指定します。解析方法では、分離化合物の保持時間を、実行中に検出されたラダー化合物の保持時間に設定します。
- 特定されたグリカンに対してエリア%が返されるようにするには、[解析方法: [処理]タブで [定量設定- キャリブレーション] をクリックし、「キャリブレーションカーブ適合タイプ」を「相対応答(%)」に設定します。
4. SEC-MALSを用いた抗体凝集の解析
- サンプル調製
- 3.5 mg/mL(ステップ2)希釈タンパク質を150μLガラスインサートでバイアルに移します。気泡の導入を避けるために、インサートの下のベルにピペットにゲルローディングチップを使用してください。
- バイアルをセプタキャップでキャップし、すぐに分析します。後で分析する場合は4°Cで保存してください。
- SEC-MALSの構成と平衡化
注:MALSソフトウェアによって制御されるMALS検出器と屈折指数検出器を用いて超高圧液体クロマトグラフィー(UHPLC)で構成されたSEC-MALSの凝集を分析します。- UHPLCシステムを制御するためのUHPLCソフトウェアの方法ファイルを構成し、流量を1xリン酸緩衝生理食(PBS)の移動相で0.4 mL/minに設定し(10xから希釈)、射出量を5μLに、カラム温度を25°Cに設定します。280 nmを監視するダイオードアレイディテクタ(DAD)。サンプル分析の前に、実行時間を 20 分に設定します。
- UHPLCとマルチアングルライト散乱 - 屈折率(MALS-RI)検出器間のインターフェイスは、DAD上のアナログ出力を使用する必要があります。DAD メソッド ファイルの DAD 減衰を 1,000 mAU に設定し、AU/UV 設定を 1 (UVインストゥルメント>チャンネル>チャネル1) に設定します。
- 解析開始の30分前にDADランプをオンにし、波長を280nmに設定します。同時に、屈折率(RI)参照セルを15分間パージするか、ベースラインが安定するまで参照セルを閉じます。
- SEC-MALSソフトウェアシーケンスを設定し、収集時間を12分に設定し、注入量を5μLに、dn/dcを0.185 mL/gに、A280消滅係数を以前に実験的に決定した場合、または1.37 mL*(mg*cm)-1、および濃度サンプル。[実行]をクリックし、[挿入待ち] ダイアログボックスが画面に表示されるまで待ちます。
注:A280消滅係数は目的のタンパク質に特異的であり、実験的に決定されるべきである。 - UHPLC ソフトウェアのサンプル リストを MALS-RI ソフトウェアと同じ順序で設定し、送信します。
注: 実行の前後にシステム適合性チェックを実行することが重要です。ウシ血清アルブミンは、典型的には、ピークの広がりをチェックするために使用され、SECカラムは、洗浄または交換を必要とする可能性があることを示す。同じBSA標準注入を使用して、信号位置合わせ、ピーク拡散、検出器の正規化を指定できます。
-
MALSソフトウェアを使用した集計分析
- [手順] のマークが付いているタブをクリックします。必要な呼吸の最小レベルを指定します。通常はどれも十分です。
- ベースラインが正しく描画されていることを確認し、必要に応じて LS1、LS2、LS3、RI、および UV チャネルを調整します。対象のピーク領域を設定します。
- 分子質量分布を確認して、呼び出されたピークに同じサイズの粒子が含まれていることを確認します。
5. 請求バリアント分析
- サンプルの調製とラベリング
- 3.5 mg/mL抗体溶液の80 μLから始めます。0.5 mL脱塩カラム(7k MWCO)を使用してサンプルを脱塩します。最初に底部ストッパーをスナップしてから、上部ストッパーを緩め、1.7 mLのマイクロ遠心分離管に入れてカラムを準備します。1,500 x gで 1 分間脱塩列を遠心分離します。
注: 列の外側にドットをマークして、次のステップの元の方向に配置できるようにします。 - カラムを新しいマイクロ遠心分離管に移します。希釈タンパク質の80 μLをカラムの上部に追加します。列を元の方向に揃えます。1,500 x gで2分間遠心分離機。遠心分離機からサンプルを取り出し、脱塩列を捨て、サンプルをよく混ぜます。
注:脱塩は、サンプルマトリックスに一次アミン、サンプル電気泳動を乱す賦形剤、またはその他の互換性のない物質が含まれている場合にのみ必要です。 - 25 μLの体積で2mg/mLの最終濃度にサンプルを希釈し、96ウェルプレートにラベリングバッファーの5 μLを追加します(材料表:チャージバリアント試薬キットを参照)。必要量のラベリング試薬を希釈してラベリング試薬を調剤(ジメチルホルミドで1:30)。。サンプルを光から離れた室温で10分間インキュベートします。
注:解凍し、すぐにこの試薬を使用し、DMFと混合の10分以内にそれを使用することが重要です。 - インキュベート後、試薬グレードの水を60μL加え、ピペッティングでよく混ぜます。プレートシールでプレートを覆い、1,000 x gで1分間遠心分離します。
- 3.5 mg/mL抗体溶液の80 μLから始めます。0.5 mL脱塩カラム(7k MWCO)を使用してサンプルを脱塩します。最初に底部ストッパーをスナップしてから、上部ストッパーを緩め、1.7 mLのマイクロ遠心分離管に入れてカラムを準備します。1,500 x gで 1 分間脱塩列を遠心分離します。
- 充電バリアントチップの準備
- 貯蔵液を取り除き、井戸1、3、4、7、8、10を水で取り除き、充電バリアントチップを準備します。次に、水を pH 7.2 の実行バッファーに置き換えます(「材料の表: 電荷バリアント試薬キット」を参照)。
- pH 7.2 ランニングバッファの750 μLをバッファチューブに追加し、サンプルトレイの左上隅にある示されたスポットにバッファチューブを配置します。次に、96ウェルプレートからプレートシールを取り外し、計測器ユーザーインターフェイスのアンロードプレートを押し、プレートをGXIIサンプルトレイに挿入します。
注: pH 7.2 バッファは、この分析に使用されました。pH 5.6-7.2バッファーは、タンパク質pIに応じて使用されてもよい。より低いpHバッファを使用する場合、より長いサンプル実行時間が必要になる場合があります。 - ユーザー インターフェイスの[チップのアンロード]ボタンを押します。電極に粒子が含まれていないことを確認し、そうでない場合は糸くずの自由な綿棒できれいにしてください。チップを挿入する際は、チップの中央の窓にパーティクルや汚れがないことを確認します。必要に応じて、糸くずのない柔らかい布で清掃してください。
注:毛細血管電気泳動チップを使用する場合は、真空吸引によってバッファを除去し、次の溶液を即座に添加して井戸が乾燥するのを防ぎます。気泡の導入を最小限に抑えるために、リバースピペッティング技術を練習してください。チップを取り扱う場合は、チップの底部から伸びる壊れやすい毛細血管に注意し、乾燥せず、大まかな取り扱いを破らないようにしてください。 - 蓋をチップチャンバに閉じ、HTタンパク質チャージバリアントアッセイを選択します。[実行]ボタンをクリックします。プロンプトに従って、サンプルウェル、プレートタイプ、アッセイ時間(68、90、または100s)、およびファイル名を選択します。プロンプトの最後にある [開始] をクリックします。
- チップのクリーンアップには、各ウェルを水で2x洗浄し、その後にストレージバッファを追加する必要があります(「材料の表:チャージバリアント試薬キット」を参照)。ストレージバッファに入ったら、機器のチップを交換し、プロンプトが表示されたら、HTタンパク質チャージアッセイを選択します。メイン画面で[ユーザーインターフェイスでウォッシュ]を選択します。完成したら、チップを取り出し、水と糸くずのない綿棒で電極を拭き取り、チップを4°Cに保管します。
- 請求バリアント分析
- 計測器解析ソフトウェアを開きます。[ファイル>データ ファイルのインポート] に進むことで実行をインポートします。希望する *.gxd ファイルをクリックします。名前だけがソフトウェアに引き継がれるので、ウェルの名前を変更すると有利です (ツール > サンプルネームエディタ)。ファイルを選択しながらシフトを押したままエクスポートするファイルを選択します。[ファイル>エクスポート] をクリックします。を選択し、[生データ]ボックスを選択し、[AIA書式]ボックスを選択します。
- 解析ソフトウェア内の [プロジェクトの参照] タブを開きます。データベース>データのインポートをクリックし、エクスポートされた *を選択します。CDF ファイル。
- インポートしたら、[注射]タブに移動し、分析するファイルを選択し、右クリックして[プロセス]に移動します。ポップアップウィンドウで、[プロセス]の横にあるチェックボックスを選択し、ドロップダウンボックスから「指定した処理方法を使用」ラジオボックスと目的の処理方法を選択します。「方法:」というラベルの下にあるドロップダウン ボックスで、[キャリブレーションと定量化] を選択します。処理が完了したら、[結果] タブに移動し、クロマトグラムの統合を確認します。
注: 処理方法は、メソッドごとに検証する必要があります。開始点として、現在の処理方法に使用されるパラメーターが補足ファイルに含まれます。
注: データのエクスポートは、レポートの形式で行うか、ピーク定量のみがエクスポートされる場合があります。これらは、処理と同時に、または結果ウィンドウから実行できます。
6. アミノ酸分析
- LC-MSによる絶対アミノ酸定量の標準曲線の設定
- アスンの59.45mg、59.00mgのヒップ、65.77mgのGln、および0.1 N HClの25 mLでTrpの91.95mgを溶解することにより、拡張アミノ酸(EAA)混合物を調出す。EAA混合物中の各アミノ酸の最終濃度は18nmol/μLである。
- HClの50 mLでNvaの58.58 mgおよび44.54 mgのSarを溶解することにより、内部標準(ISTD)ストック溶液を準備します。
- Ala、Asp、Arg、Cys、Glu、Gly、His、Ile、Leu、Met、Phe、Pro、Ser、Thr、Trp、Tyr、Valをそれぞれ1nmol/μLの最終アミノ酸濃度のEAA混合物で組み合わせることで、完全なアミノ酸基準を調融、225、90、22.5、および9 pmol/μL. 90 pmol/μLまたは900 pmol/μLのいずれかの最終濃度のアミノ酸基準に調製されたISTDストックを追加し、この方法の正のコントロールとして使用する「低」および「高」の内部基準を作成します。
- アミノ酸濃度をサンプルバイアルに入れ、UPLCのオートサンプラーに入れる。次の指示に従って、アミノ酸標準濃度に基づいて計測器ソフトウェアでキャリブレーション曲線(9~900 pmol/μL)を生成します。
- 無傷のアミノ酸分析のためのUPLCに結合される電気噴霧イオン化(ESI)正の感受性モードのQ-ToFを使用する。クロマトグラフィー分離には、アミノ酸分離用に作られた通常の位相カラムを使用します。質量分析グレード試薬で以下のバッファーを調味する:A=アセトニトリル+0.1%ギ酸およびB=100 mMアンモニウムフォアメイト。LC流量を0.6mL/minに設定し、カラム温度を40°Cに設定します。
- アミノ酸分離には、次の15分間の勾配条件を使用します:14%B(0-3分)、14-100%B(3-10分)、100%B(10-13分)、100-8%B(13-14分)、8%B(14-15分)。
- MS取得プログラムの「サンプルタイプ」および「Conc A」列リストを使用して、定量プログラムにおける原油バイオリアクター媒体の将来の分析のためのキャリブレーション曲線を作成します。これらの列を取得プログラムに表示するには、[表示のカスタマイズ]コマンドを使用して、上部のメニュー バーを右クリックします。
- アミノ酸規格のサンプルタイプは「標準」、メディアサンプルは「分析」となります。必要な単位(pmol/μLなど)の規格の数値濃度で「Conc A」列に記入してください。
- 調製したアミノ酸標準濃度を少なくとも2回実行します。ISTDのピークをチェックして、UPLC計測器と質量分析計が正しく動作していることを確認します。
- 定量アプリケーションの 「編集方法」オプションを使用して、定量メソッド (*.mdb ファイル) を作成します。化合物名、m/z 値、予想保持時間など、定量アプリケーションで関心のあるすべてのアミノ酸を定義します。ここでメソッドの統合パラメータを変更します。
- 標準サンプルで作成されたアミノ酸法を使用して、キャリブレーション曲線を作成します。このカーブは、エクスポート>キャリブレーションコマンドを使用してメディア サンプルで使用するために *.cdb ファイルにエクスポートできます。
- 定量アプリケーションで、目的のレイアウトを *.qlt ファイルに保存して、"レイアウトを次のように保存"を使用して将来のデータセットに適用します。名前 (インジェクション名)、エリア、および Conc は最も重要な出力列です。
- LC-MSによる粗バイオリアクター培地のアミノ酸分析
- 遠心分離機粗バイオリアクター媒体を1,962 x gで5分間使用し、0.22 μmフィルターを通過します。
- タンパク質と粒子状物質を除去するための過塩素酸クリーンアップをフォローアップ:0.4 N HClO 4で0.4 N HClO4を1:1比で混合し、RTで5分間14,700 x gで遠心分離機を混合します。
注:必要に応じて射出量を調整して、アミノ酸濃度をキャリブレーション範囲内に収めます。器械によって、注入容積は0.1 μLと10 μLの間で調節することができる。 - LC-MS. 定量プログラムの下で、メソッド (*.mdb) およびキャリブレーション ファイル (*.cdb) と共に「プロセス サンプル」を使用して、メディア サンプルを三つ編みで実行します。メソッドとキャリブレーション曲線は、すべての注入が完了すると、定量アプリケーションによって原油メディアサンプルに自動的に適用されます。
- 別のプログラム (スプレッドシートなど) で分析用のデータをエクスポートするには、"印刷" コマンドを使用して 、*.xps または *.pdf ファイルを作成します。
結果
自動マイクロスケールバイオリアクターから採取された細胞培養液は、高速タンパク質液体クロマトグラフィー(FPLC)を用いて精製され、図1に見られるように精製されたタンパク質の臨界品質属性(CQA)は、様々な特徴を持つ。下流の分析方法。これは、自動化されたマイクロバイオリアクターシステムの主な利点です。CQAの違いは、幅広い条件で迅速に評価することができます。質量分析によって処理されるCHO産生mAbsからのNグリカンデータは、図2に示すクロマトグラムのように見えるはずです。この図は、1つのサンプルからのマンノース5ピーク(M5)がかなり低いことを示す2つのクロマトグラム間の比較を示しています。ピークの代わりにノイズの多いベースラインのみが観察される場合は、クロマトグラフィーの設定に障害があるか、手順が正常に行きませんか。コントロールを使用すると、トラブルシューティングを簡略化できます。まず、デキストランラダーからFLRピークを評価します。これらのピークは、クロマトグラフィーシステムが正しく動作していることを示しています。次に、実験的に得られたピークと、処理された無傷のmAb規格から得られたピークを比較する。標準からのピークが表示され、サンプルピークが特定されていない場合、mAbサンプルは正しく処理されませんでした。これは、N-グリカン標識および精製を妨害するバッファー内のSDSまたはヌクレオフィルの存在に起因する可能性がある。
SEC-MALSは、さらに2つのCQA(凝集プロファイルおよび抗体の分子量)を評価するために使用することができる。代表的なSEC-MALSクロマトグラムは、図3に示されているものに匹敵します。分子質量分布と絶対分子量は、消滅係数が1.37mL*(mg*cm)-1、dn/dcが0.185 mL/gの必要なソフトウェアを用いて決定した。ソフトウェアのベースラインのピーク呼び出しと設定は手動で実行されますが、結果はユーザーによって若干異なる場合があります。図3のモノマーIgG1の絶対分子量は1.504 x 105 Da ±0.38%(青)、高次複合体は7.799 x 105 Da±3.0%(赤)です。集体の多分散性は、ピーク1の赤いモル質量分布によって示されるモノマーのそれよりもはるかに大きい(図3)。CQAとしてのサンプルの少量と集約の重要性は、この技術を自動化されたマイクロバイオリアクターシステムに対する非常に貴重な補完分析ツールにします。
mCZEの結果は、モノクローナル抗体の電荷変異プロファイルを示す図4のようなエレクトロフェログラムである。プロフィールは調査される蛋白質のための独特な署名であり、作動pHに非常に敏感である。また、電荷バリアントプロファイルの左側にフリー染料ピークが表示されます。動作pHを確立する場合、オペレータは解像度と信号のバランスをとるいくつかの裁量があります。さらに、オペレータは~30sで移行するフリー染料ピークからの良好な分離を確保する必要があります。サンプルは、このピークを除去するためにラベル付け後に脱塩することができますが、これは信号の大幅な損失につながります。作動pHが確立されると、サンプルプロフィールを比較することができる。一般的に一貫していますが、標識効率の変化や賦形剤の違いは、サンプルの移行と電荷バリアントプロファイルのわずかな違いが生じ、エレクトロフェログラムを直接比較するのが難しくなりかいます。代わりに、比較方法は、通常、基本、主、および酸性種のパーセンテージに基づいています。この場合、mCZEを用いて1〜2%と小さい相対差を同定することができる。
アミノ酸の消費量を監視して、枯渇が CQA の変化を引き起こしているかどうかを判断できます。質量分析計からのクロマトグラム読み出しは、粗バイオリアクター培地サンプル中のアミノ酸の絶対定量のための較正曲線の正常な作成を評価するために使用することができる。図5は、このプロセス中の代表的な結果として、2つの合計イオンクロマトグラム(TIC)と1つの抽出されたイオンクロマトグラム(XIC)を示す。図5Aでは、図5のTICは、水ブランクのみが注入されたとして、バッファシステムからのバックグラウンド信号を示す。図 5Bは、水ブランクと比較すると、個々のアミノ酸種に対応する小さなピーク(7.96分のリジンなど)が観察できるアミノ酸標準の代表的なTICを示す。ピークを統合し、ピーク面積(したがって濃度)の定量を容易にするために、XICは定義された「クロマトグラム質量ウィンドウ」からの信号のみが表示される場所で使用される。器械の感受性およびクロマトグラフィーの分離の質によって、最適な質量窓はユーザーによって決定されなければならない。この例(図5C)では、10ppmの質量ウィンドウを持つリジンのXIC(m/z = 147.1144)が示され、アミノ酸標準のリジンが8.03分でカラムから溶出します。
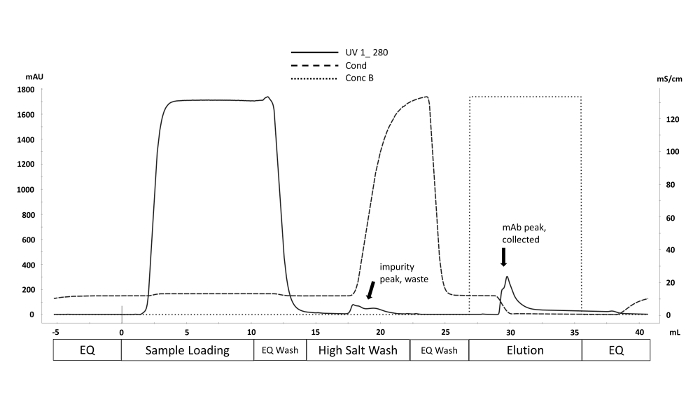
図 1.高速タンパク質液体クロマトグラフィー(FPLC)技術を用いた精製スキームの代表的なクロマトグラム。体積(mL)に対応する精製方法相は、X軸に沿って標識される。280nm(mAU y軸、実線)での紫外線吸光度は、精製サイクル全体を通して監視される。非特異的結合不純物は、高塩洗浄中に導電性(mS/cm Y軸、破線)を増加させることにより変位する。が表示されます)。この図のより大きなバージョンを表示するには、ここをクリックしてください。
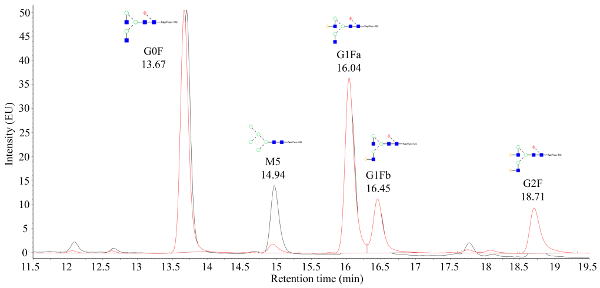
図 2.質量検証されたタグ付きグリカンから得られる代表的な蛍光クロマトグラム。X 軸は保持時間 (分) で、Y 軸は信号強度です。14.94分のピークはマンノース5(M5)グリカンを表し、M5信号強度の間に大きな差がオーバーレイされる2つのサンプル間で観察することができる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
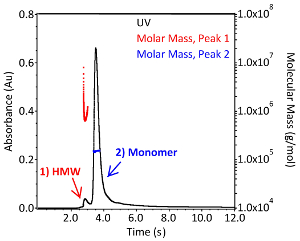
図 3.IgG1モノクローナル抗体の分子量分布1x PBS(pH7.4)におけるサイズ排除クロマトグラフィーにより分離された無傷のIgG1モノクローナル抗体のクロマトグラム。吸光度は280nm(黒、左軸)で監視され、光散乱および屈折指数検出器は、各ピーク(赤と青、右軸)の絶対分子量を計算するために使用されました。高分子量種は「HMW」と標識されたピークで示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4.IgG1モノクローナル抗体の電荷変異プロファイル。この電気フェログラムはmCZEプラットフォーム上で生成される。フリー染料ピークは~30sで移行し、IgG1から十分に分離されています。定量化のために、ピークは計測器データ解析ソフトウェアを使用して、基本、主、酸性種に分割されました。赤い線は、統合されたピーク領域の概要を説明します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
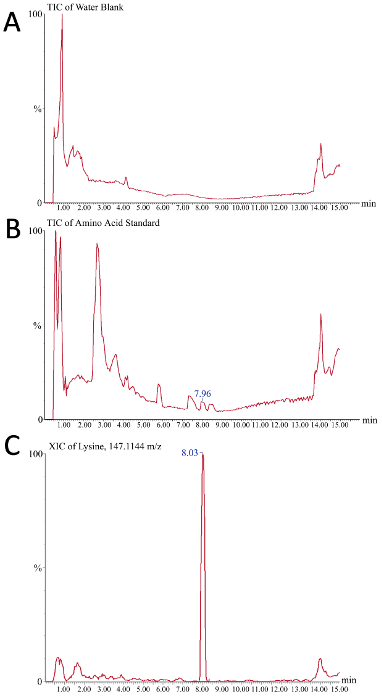
図 5.粗バイオリアクター培地の質量分析ベースのアミノ酸分析のためのイオンクロマトグラムの代表的な結果。X軸は時間(分)、Y軸は信号強度(A)水ブランクは負のコントロールとして機能し、液体クロマトグラフィー勾配(B)225pmol/μLアミノ酸の過程で観察される背景信号を明らかにするこの全イオンクロマトグラムで観察される個々のピークは、クロマトグラフィー的に解決される標準ミックスの異なるアミノ酸を表す(C)mの代表的な抽出されたイオンクロマトグラムを表す、正の対照としてここで使用される。/z 147.1144、リジンです。Bの7.96分のピークは、リジンのCの8.03ピークに相当する。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
HCCFには、高価な計装を詰まらせ、破壊できる破片や大きな粒子が含まれているため、さらに下流処理を行う前に培養を明確化する必要があります。遠心分離は、一般に、細胞および他の不溶性粒子をタンパク質から分離し、その後ろろ過を行う最初のアプローチである。この濾過されたHCCFは、次に精製のために高速タンパク質液体クロマトグラフィー(FPLC)を施す。製品を得るために自動化された微生物反応器からのHCCFの精製は、下流処理における重要なステップです。ここで、タンパク質Aカラムを用いたベンチトップFPLCシステムを用いて、HCCFからモノクローナル抗体を得る。上流プロセスの分析は、細胞の挙動に関する有用な洞察を提供し、バイオプロセス設計を導き、一貫性のある信頼性の高い品質の製品を得るのに役立ちます。アナリティクスでは、重要品質属性 (CQA) をアップストリームおよびダウンストリームプロセスにリンクすることもできます。モノクローナル抗体の特性化に一般的に使用される4つのアッセイを紹介します。これらの技術は、堅牢で信頼性が高く、部分的に精製されたさまざまな上流のソースからのプロセスおよび製品分析に容易に展開でき、DNA と HCP の残留レベルが依然として含まれている可能性があります。
分析用のサンプルをクリーンアップする場合、バイオリアクターに存在する変動性を維持しながら、分析に十分にクリーンなサンプルを作成する間に重要なバランスを取る必要があります。製品に影響を与える2つの最も一般的な汚染物質はDNAとHCPで、260/280 nmで比吸光度を測定し、SDS-PAGEまたはμCE-SDSを介して確認することができます。ここで提示されるアッセイは、DNA含有量の低レベルに敏感ではありません。製品の純度は、μCE-SDSによって決定される>95%の純度です。
マイクロキャピラリー電気泳動システムによる電荷バリアント解析は、比較的実装が容易なチップおよび試薬で、電荷バリアントを識別するためのハイスループット方式を提供します。標識試薬の技術の性質と化学は、賦形剤および他の一次アミンに対して敏感であるため、ほとんどのサンプルマトリックスに対して脱塩工程を必要とする。経験から、低レベルのDNAは標識反応からフリー染料と共に移動し、結果の質に影響を与えない。塩基性、主期、および酸性ピーク定量の変動性は一般的に<1%であるが、DNAおよび他の汚染物質のレベルが高いほど、アッセイの変動性が増加する可能性がある。タンパク質標識と一致し、ボトルから取り出し、色素と混合した後のDMFの迅速な使用を確保することが非常に重要です。リジンおよび/またはヒスチジンの標準は、ラベリングコントロールとして推奨されます。時間が経つにつれて、サンプルの品質に応じて、チップはマイクロ流体チャネル上のコーティングを汚れたり失ったりし、より大きなノイズ、ゴーストピークの存在、およびサンプル間のバリエーションの大きな変化につながります。この発生を識別するために、ブランクとシステム適合性基準(すなわちNISTmAb)を定期的にサンプルと同時に分析した。チップの問題が発生した場合は、チップをストレージソリューションで洗浄するか、交換することができます。
治療用糖タンパク質のグリカン分析に用いられる方法は、主に液体クロマトグラフィー(LC)および/または質量分析(MS)を含み、第3の選択肢としてレクチンマイクロアレイ分析が第3の選択肢として人気を集めている。このホワイト ペーパーで説明する方法では、LC と MS の両方を使用しますが、これは利点と欠点があります。質量分析法は、蛍光検出出力またはレクチンマイクロアレイを用いたLCベースの方法では不可能である分析されたグリカンの質量検証の利点を有する。この方法は、LCおよび蛍光検出を使用して、保持時間比較を使用してグリカンIDをデキストランラダー標準に割り当てます。蛍光モニタリングは、オリゴ糖のイオン化効率が悪いため、MSだけでは低い豊富な種を定量することができない場合があり、その検出の容易さのために、感度と定量を増加させることができます。MS からの大量情報はグリカン ID の確認に使用されますが、処理ソフトウェアは一次割り当て基準として大量情報を使用しません。したがって、再現性のクロマトグラフィーおよび容易に解決可能なピークがなければ、この方法はグリカンの割り当てに関して苦しむことができる。幸いなことに、質量情報は、再現可能なグリカンの割り当てを妨げる保持時間のシフトなど、クロマトグラフィーがサブパーである状況でもグリカンの割り当てを助けることができます。この方法を MS なしで使用する場合、質量情報を使用して滞留時間のドリフトを修正できないため、クロマトグラフィーは最高レベルである必要があります。
ここで説明するアミノ酸分析方法は、粗細胞培養培地における未活性化アミノ酸の迅速な定量にLC-MSを利用する。代替アミノ酸分析方法は、UV検出26を可能にするためにアミノ酸誘導化剤を必要とする。LC-MS法は、LC-UV法に対して重要な利点を提供します:それは質量特性の欠如によって制限されるLC-UV法とは対照的に、保持時間とイオン質量の両方に基づいて識別することができます。さらに、LC-MS法は、LC-UV法が時間のかかる誘導性反応を必要とし、サンプル変動27を付与する可能性があるため、時間および再現性の利点を提供する。しかし、LC-MS法における粗細胞培養培地の注入は、イオンスキマーファウリングによるMS信号に有害な影響を及ぼす可能性があります。キャリブレーションラダーは、システム適合性チェックとして頻繁に注入され、サンプル順序はデータの偏りを防ぐためにランダム化されます。
微生物ビオリアクターを用いた抗体産生のための細胞培養プロセスについては、前述9.本研究では、限られたサンプル量から得られたデータを最大化するモノクローナル抗体特性特性法の詳細なプロトコルが明確に定義されている。収穫された細胞培養液の限られた量は、取得した製品情報を制限することができ、製品品質データを得るために適切な分析手順の選択が不可欠である。分析は、上流のプロセス パラメータを製品品質の変化にリンクすることが重要です。ここでは、マイクロバイオリアクターを使用する際にmAbsを特徴付けるガイドラインが提供されています。
開示事項
この出版物は著者の見解を反映しており、FDAの見解や方針を表すものとして解釈されるべきではありません。
謝辞
著者たちは、スコット・ルーテが提供した分析的支援に感謝したいと思います。この作業に対する部分的な内部資金とサポートは、CDER クリティカル パス プログラム (CA #1-13) によって提供されます。このプロジェクトは、オークリッジ科学教育研究所が運営する米国食品医薬品局(米国食品医薬品局)のインターンシップ/研究参加プログラムへの任命により、一部を支援しています。米国エネルギー省とFDAとの間の機関間協定。
資料
| Name | Company | Catalog Number | Comments |
| CHO DG44 Cell Line | Invitrogen | A1100001 | |
| Akta Avant 25 | General Electric Life Sciences | 28930842 | |
| Pro Sep vA Ultra Chromatography Resin | Millipore Sigma | 115115830 | Purification Stationary Phase |
| Omnifit 10cm Column | Diba Fluid Intelligence | 006EZ-06-10-AA | Housing for Stationary Phase |
| Tris Base | Fisher Scientific | BP154-1 | |
| Superloop 10 mL | GE Healthcare | 18-1113-81 | |
| µDawn Multi Angle Light Scattering Detector | Wyatt | WUDAWN-01 | |
| 0.22 µm Millex GV Filter Unit PVDF Membrane | Merck Millipore | SLGV033RB | |
| 10X Phosphate Buffered Saline | Corning | 46-013-CM | |
| 12 mL Syringe | Covidien | 8881512878 | |
| 1290 Infinity Binary Pump | Agilent Technologies | G4220A | |
| 1290 Infinity DAD | Agilent Technologies | G4212A | |
| 1290 Infinity Sampler | Agilent Technologies | G4226A | |
| 1290 Infinity Thermostat | Agilent Technologies | G1330B | |
| 1290 Infinity Thermostatted Column Compartment | Agilent Technologies | G1316C | |
| 15 mL Falcon tube | Corning Inc. | 352097 | |
| 150 uL Glass Inserts with Polymer Feet | Agilent Technologies | 5183-2088 | |
| 50 mL Falcon tube | Corning Inc. | 352070 | |
| 96-Well Plate | Bio-Rad | 127737 | |
| Acetic Acid | Sigma-Aldrich | 695072 | |
| Acetonitrile | Fisher Chemical | BPA996-4 | |
| ACQUITY I-Class UPLC BSM | Waters Corporation | 18601504612 | |
| ACQUITY I-Class UPLC Sample Manager | Waters Corporation | 186015000 | |
| ACQUITY UPLC FLR Detector | Waters Corporation | 176015029 | |
| Amicon Ultra-4 100 kDa centrifugal filters | Merck Millipore | UFC810096 | |
| Amino Acid Standard, 1 nmol/µL | Agilent Technologies | 5061-3330 | |
| Amino Acid Supplement | Agilent Technologies | 5062-2478 | |
| Ammonium Formate Solution - Glycan Analysis | Waters Corporation | 186007081 | |
| Blue Screw Caps with Septa | Agilent Technologies | 5182-0717 | |
| CD OptiCHO AGT Medium | Thermo Fisher Scientific | A1122205 | |
| Centrifuge Tubes | Eppendorf | 22363352 | |
| Charge Variant Chip | Perkin Elmer | 760435 | |
| Charge Variant Reagent Kit | Perkin Elmer | CLS760670 | |
| Chromatography Water (MS Grade) | Fisher Chemical | W6-4 | |
| Dimethylformamide | Thermo Scientific | 20673 | |
| Extraction Plate Manifold for Oasis 96-Well Plates | Waters Corporation | 186001831 | |
| Formic Acid | Fisher Chemical | A117-50 | |
| GlycoWorks RapiFlour-MS N-Glycan Starter Kit - 24 Sample | Waters Corporation | 176003712 | |
| GXII Buffer Tubes | E&K Scientific | 697075- NC | |
| GXII Detection Window Cleaning Cloth | VWR | 21912-046 | |
| GXII HT Touch | Perkin Elmer | CLS138160 | |
| GXII Ladder Tubes | Genemate | C-3258-1 | |
| GXII Lint-Free Swab | ITW Texwipe | TX758B | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Intact mAb Mass Check Standard | Waters Corporation | 186006552 | |
| Intrada Amino Acid Column 150 x 2 mm | Imtakt | WAA25 | |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 840274100 | |
| Optilab UT-rEX Differential Refractive Index Detector | Wyatt | WTREX-11 | |
| Perchloric acid | Aldrich Chemistry | 311421 | |
| Pipet Tips with Microcapillary for Loading Gels | Labcon | 1034-960-008 | |
| Polypropylene 96-Well Microplate, F-bottom, Chimney-style, Black | Greiner Bio-One | 655209 | |
| RapiFlour-MS Dextran Calibration Ladder | Waters Corporation | 186007982 | |
| Screw Top Clear Vial 2mL | Agilent Technologies | 5182-0715 | |
| Sodium Chloride | Fisher Scientific | S271-1 | |
| Sodium Iodide | Sigma Aldrich | 383112 | |
| TSKgel UP-SW3000 4.6mm ID x 30 cm L | Tosoh Biosciences | 003449 | |
| UNIFI Scientific Information System | Waters Corporation | 667005138 | |
| Vacuum Manifold Shims | Waters Corporation | 186007986 | |
| Vacuum Pump | Waters Corporation | 725000604 | |
| Xevo G2 Q-ToF | Waters Corporation | 186005597 | |
| Zeba Spin Desalting Column, 0.5 mL | Thermo Scientific | 89883 |
参考文献
- . . Pharmaceutical cGMPs for the 21st Century: A Risk-Based Approach. , (2004).
- New Molecular Entity (NME) Drug and New Biologic Approvals. FDA Available from: https://www.dfa.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicAprrovalReports/NDAandBLAApprovalReports/ucm373420.htm (2015)
- Foltz, I. N., Karow, M., Wasserman, S. M. Evolution and Emergence of Therapeutic Monoclonal Antibodies. Circulation. 127, 2222-2230 (2013).
- Kondragunta, B., Drew, J. L., Brorson, K. A., Moreira, A. R., Rao, G. Advances in clone selection using high-throughput bioreactors. Biotechnology Progress. 26 (4), 1095-1103 (2010).
- Hmiel, L., Brorson, K., Boyne, M. Post-translational structural modifications of immunoglobulin G and their effect on biological activity. Analytical & Bioanalytical Chemistry. 407 (1), 79-94 (2015).
- Rathore, A. S. Roadmap for implementation of quality by design (QbD) for biotechnology products. Trends in Biotechnology. 27 (9), 546-553 (2009).
- . International Council for Harminisation of Techinical Requirements for Pharmaceuticals for Human Use. ICH. , (1999).
- Berkowitz, S. A., Engen, J. R., Mazzeo, J. R., Jones, G. B. Analytical tools for characterizing biopharmaceuticals and the implications for biosimilars. Nature Reviews Drug Discovery. 11 (7), 527-540 (2012).
- Velugula-Yellela, S. R., et al. Use of high-throughput automated microbioreactor system for production of model IgG1 in CHO cells. Journal of Visualized Experiments. , (2018).
- Largy, E., Cantais, F., Van Vyncht, G., Beck, A., Delobel, A. Orthogonal liquid chromatography-mass spectrometry methods for the comprehensive characterization of therapeutic glycoproteins, from released glycans to intact protein level. Journal of Chromatography A. 1498, 128-146 (2017).
- Yang, J. -. M., et al. Investigation of the correlation between charge and glycosylation of IgG1 variants by liquid chromatography-mass spectrometry. Analytical Biochemistry. 448, 82-91 (2014).
- Agarabi, C. D., et al. Bioreactor Process Parameter Screening Utilizing a Plackett-Burman Design for a Model Monoclonal Antibody. Journal of Pharmaceutical Sciences. 104 (6), 1919-1928 (2015).
- Wen, J., Arakawa, T., Philo, J. S. Size-Exclusion Chromatography with On-Line Light-Scattering, Absorbance, and Refractive Index Detectors for Studying Proteins and Their Interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Veurink, M., Stella, C., Tabatabay, C., Pournaras, C. J., Gurny, R. Association of ranibizumab (Lucentis) or bevacizumab (Avastin) with dexamethasone and triamcinolone acetonide: An in vitro stability assessment. European Journal of Pharmaceutics and Biopharmaceutics. 78 (2), 271-277 (2011).
- Li, Y., Weiss, W. F., Roberts, C. J. Characterization of high-molecular-weight nonnative aggregates and aggregation kinetics by size exclusion chromatography with inline multi-angle laser light scattering. Journal of Pharmaceutical Sciences. 98 (11), 3997-4016 (2009).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Han, H., Livingston, E., Chen, X. High throughput profiling of charge heterogeneity in antibodies by microchip electrophoresis. Analytical Chemistry. 83 (21), 8184-8191 (2011).
- Wheeler, T. D., et al. Microchip zone electrophoresis for high-throughput analysis of monoclonal antibody charge variants. Analytical Chemistry. 86 (11), 5416-5424 (2014).
- Carrillo-Cocom, L., et al. Amino acid consumption in naive and recombinant CHO cell cultures: producers of a monoclonal antibody. Cytotechnology. 67 (5), 809-820 (2015).
- Chen, P., Harcum, S. W. Effects of amino acid additions on ammonium stressed CHO cells. Journal of Biotechnology. 117 (3), 277-286 (2005).
- Xing, Z., et al. Optimizing amino acid composition of CHO cell culture media for a fusion protein production. Process Biochemistry. 46 (7), 1423-1429 (2011).
- Fan, Y., et al. Amino acid and glucose metabolism in fed-batch CHO cell culture affects antibody production and glycosylation. Biotechnology and Bioengineering. 112 (3), 521-535 (2015).
- Read, E. K., et al. Fermentanomics informed amino acid supplementation of an antibody producing mammalian cell culture. Biotechnology Progress. 29 (3), 745-753 (2013).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography. A. 1415, 83-90 (2015).
- Zhang, L., Luo, S., Zhang, B. Glycan analysis of therapeutic glycoproteins. MAbs. 8 (2), 205-215 (2016).
- Wahl, O., Holzgrabe, U. Amino acid analysis for pharmacopoeial purposes. Talanta. 154, 150-163 (2016).
- Le, A., Ng, A., Kwan, T., Cusmano-Ozog, K., Cowan, T. M. A rapid, sensitive method for quantitative analysis of underivatized amino acids by liquid chromatography-tandem mass spectrometry (LC-MS/MS). Journal of Chromatography B. 944, 166-174 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved