Method Article
자동화된 미생물체 시스템을 사용하여 중국 햄스터 난소 세포의 단일 클론 항체의 정화 및 분석
요약
자동화된 미생물반응기의 수확된 세포 배양 유체(HCCF)로부터의 단일클론 항체의 정제 및 후속 분석을 위한 상세한 프로토콜이 기술되었다. 분석을 사용하여 중요한 품질 특성(CQA)을 결정하고 제한된 샘플 볼륨을 최대화하여 중요한 정보를 추출하는 것도 제공됩니다.
초록
단일 클론 항체 (mAbs)는 오늘날 제조 된 가장 인기 있고 잘 특성이있는 생물학적 제품 중 하나입니다. 가장 일반적으로 중국 햄스터 난소 (CHO) 세포를 사용하여 생산, 배양 및 공정 조건은 항체 적기를 최대화하고 목표 품질 프로파일을 달성하기 위해 최적화되어야한다. 일반적으로 이러한 최적화는 자동화된 마이크로스케일 바이오리액터(15mL)를 사용하여 여러 공정 조건을 병렬로 스크리핑합니다. 최적화 기준에는 배양 성능과 단일클론 항체(mAb) 제품의 중요한 품질 특성(CQA)이 포함되며, 이는 그 효능 및 안전성과 에 영향을 미칠 수 있습니다. 배양 성능 메트릭은 세포 성장 및 영양소 소비를 포함하며, CQA에는 mAb의 N-글리코실화 및 응집 프로파일, 전하 변이체 및 분자량이 포함됩니다. 이 상세한 프로토콜은 자동화된 미생물 기체 시스템에서 생성된 HCCF 샘플을 정화하고 분석하여 귀중한 성능 메트릭 및 출력을 얻는 방법을 설명합니다. 첫째, 자동화된 단백질 A 고속 단백질 액상 크로마토그래피(FPLC) 방법은 수확된 세포 배양 샘플로부터 mAb를 정화하는 데 사용된다. 일단 집중되면, 글리칸 프로파일은 특정 플랫폼을 사용하여 질량 분석법에 의해 분석됩니다 (재료 표참조). 항체 분자량 및 응집 프로파일은 크기 배제 크로마토그래피-다중 각도 광 산란(SEC-MALS)을 사용하여 결정되며, 전하 변이체는 마이크로칩 모세관 영역 전기 영동(mCZE)을 사용하여 분석됩니다. 생물반응기 과정 동안 포착된 배양 성능 메트릭(즉, 배양 생존가능성, 세포 수 및 글루타민, 포도당, 락테이트 및 암모니아를 포함한 일반적인 대사산물) 이외에, 소비된 배지는 제한적인 영양소를 식별하기 위해 분석된다. 공급 전략 및 전반적인 공정 설계를 개선할 수 있습니다. 따라서, 소비된 매체의 액체 크로마토그래피 질량 분광법(LC-MS)에 의한 아미노산의 절대 정량화를 위한 상세한 프로토콜도 설명된다. 이 프로토콜에 사용되는 방법은 많은 수의 소량 샘플에 호환되는 높은 처리량 플랫폼을 활용합니다.
서문
단백질 치료제는 조직 이식 합병증, 자가면역 질환 및 암 1을 포함하는증가하는 다양한 의료 조건을 치료하는 데 사용되고 있다. 2004년부터 미국 식품의약국(USFDA)은 약물 평가 및 연구 센터(CDER)가 규제하는 모든 승인의 생물학적 라이선스 신청(BLA)의 비율이 증가하고 있으며, BLA가 25% 이상을 차지하고 있습니다. 2014 년과 2015 년2.
이러한 시장 확대를 고려할 때, 바이오 제약 제조업체는 일관된 품질로 더 많은 제품을 신속하게 제공하는 데 어려움을 겪고 있습니다. 제품 수율을 높이기 위한 노력은 CHO 세포 공학 및 생산 라인 스크리닝에 초점을 맞추고 있지만, 가장 중요한 개선사항은 미디어/사료 전략 최적화 및 세포 배양 환경 제어의 발전에 기인합니다1. 3개 , 4개 , 5 제조 공정 중.
mAb는 생물학적 시스템에서 생산되기 때문에 고유의 단백질 가변성이 있을 수 있습니다. 항체 조성물은 글리코실화와 같은 번역 후 변경되거나 분해 또는 효소 반응에 의해 영향을 받을 수 있다. 이러한 구조적 변이는 위험한 면역 반응을 유발하거나 항체 결합을 변화시킬 수 있으며, 이는 차례로 의도된 치료 기능5를감소 또는 제거할 수 있다. 따라서, 단일 클론 항체의 중요한 품질 특성 (CQA) - N-글리칸 프로파일, 전하 변이체 분포 및 단일체 형태의 항체의 백분율 - 동안 품질 별 설계 (QbD) 접근법의 일부로 정기적으로 모니터링되고 제어됩니다. 제조공정 1,6. 규제 된 생산 환경에서 치료 단백질은 승인 된 상용 의약품7로허가되기 위해 수용 기준을 충족해야합니다. 본 명세서에 제시된 방법은 전형적으로 항체7,8에대한 품질 특성화 과정의 일부가 될 것이며, 임의의 단백질 과학자는 그들의 사용에 익숙할 것이다.
이전 작업9에서, 업스트림 바이오프로세싱에서 세포 배양 조건의 높은 처리량 스크리닝을 위한 미생물 반응기의 적용 및 작동이 설명되었다. 다양한 매체 조건에서 얻은 정제생성물은 LC-MS 를 이용한 N-글리칸 분석을 행하고 치료단백질의 글리코실화 패턴을 검출하고 LC-MS 기술10,11,및 다양한 글리칸 종의 존재는 사료 전략, pH 및 온도12와같은 생물 공정 매개 변수와 연결되었습니다. 결과 IgG의 백분율로 단조로운 형태로 표시된 제품 품질에 대한 다양한 미디어 조건의 영향은 또한 크기 배제 크로마토그래피- 다각형 광 산란(SEC-MALS)13,14로 평가됩니다. , 15. 충전 변형 프로파일은 제품의 기능에 영향을 줄 수있는 여러 가지 수정 사항16을 나타냅니다. 미세 모세관 영역 전기 영동 (mCZE)은 전하 변이체 분석 (17)에 사용되는 기존의 양이온 교환 (CEX) 크로마토그래피 및 모세관 등전 초점 (cIEF) 방법에 비해 상당히 빠른 분석 시간을 제공하는 기술입니다. ,18. 항체의 식별 속성19,20,21,22의 변화와 관련하여 단백질 생산 중 아미노산 소비를 추적하기 위해 생체 반응기 매체를 분석했습니다. , 23.
단백질 분석을 통해 공정 입력과 CQA의 변경 간의 관계를 기반으로 중요한 공정 파라미터(CCP)를 식별할 수 있습니다. 생물 공정 개발 중에 CPP를 식별하고 측정하는 것은 공정 제어를 근본적으로 입증하고 제품이 변경되지 않았는지 확인하며, 이는 규제가 엄격한 제조 환경에서 필수적입니다. 이 백서에서는 제품 CQA(N-글리칸 프로파일, 전하 변이체 및 크기 균질성)와 가장 관련이 있는 단백질의 생화학적 특성 중 일부를 측정하는 분석 기술이 제시된다.
프로토콜
1. 항체의 정화
참고: 사내 항체에 대한 평형 완충제는 25 mM Tris, 100 mM NaCl, pH 7.5이다. 사용된 용출 완충제는 0.1 M 아세트산이다. 완충제 및 수지(Protein A)는 정제된 특이적 항체에 의존한다. 기둥 부피는 수지의 침대 높이와 동일합니다. 사용되는 모바일 단계의 양은 열 볼륨 측면에서 결정됩니다.
- 정화 시스템 초기화
- 정제 시스템에 부착된 소프트웨어를 엽니다. 수동 지침을 사용하여 40분 동안 2mL/min의 유량으로 평형 버퍼와 열을 평형 화합니다.
- 분획 수집기에서, 15 mL 원추형 튜브를 배치하여 고염 세척 시 유동을 수집하는 정제된 항체 용루액 및 50 mL 원추형 튜브를 수집한다. 분수 수집기는 실행을 시작하기 전에 분수 수집기를 열고 닫아 시작 위치로 재설정되었는지 확인합니다. 분획 수집기는 7°C에서 유지된다.
참고: 분수 수집기는 15mL 및 50mL 튜브 모두에 대해 설정의 분수 수집기 탭에서 수동으로 재설정할 수 있습니다.
- 시료 주입
참고: 다음 절차에 사용된 수확된 세포 배양 액은 자동화된 마이크로 바이오리액터9에서배양된 중국 햄스터 난소 세포로부터 수득되었다.- 0.22 μm의 여과된 수확 세포 배양 액을 노즐 끝이 막힌 빈 12 mL 주사기에 추가합니다.
- 노즐이 아래로 향하여 주사기를 잡고 플런저의 작은 부분이 들어갈 때까지 주사기 플런저를 삽입합니다. 액체가 새지 않는지 확인한 다음 노즐이 위로 향하여 주사기를 돌리고 캡을 제거합니다.
- 노즐이 위를 향하도록 주사기를 계속 잡고, 실린더를 밀어 세포 배양 액이 노즐의 끝에 다다붙을 때까지 공기를 불식시합니다. 주사기 노즐을 정화 시스템의 수동 분사 포트에 삽입하고 비틀어 조입니다.
- 모든 샘플이 주입되고 부착된 10mL 대용량 샘플 루프에서 볼 수 될 때까지 플런저를 누설합니다.
- 저장된 메서드 파일을 엽니다. 결과 파일을 필요한 위치에 저장하고 메시지가 표시되면 파일 이름을 지정합니다. 샘플이 대용량 샘플 루프에 주입된 후 히트 실행.
- 정제 방법 실행
- 저장된 방법을 선택하고 계측기 소프트웨어(1.2.5단계)가 메시지가 표시되면 실행을 클릭합니다.
참고: 시스템은 다음 단계를 실행하도록 설정되어 있습니다. 계측기를 실행하는 동안 사용자는 아무 것도 할 필요가 없습니다. - 2mL/min의 유량으로 평형 버퍼의 세 개의 열 볼륨(CV)으로 컬럼을 평형화합니다. 컬럼이 평형화되면 대용량 샘플 루프를 사용하는 시스템이 1mL/min의 유량으로 샘플을 컬럼에 주입합니다.
- 280 nm에서 UV 신호가 떨어지면 샘플로딩이 완료된 것을 나타냅니다. UV 신호가 25 mAU 이하로 떨어질 때까지 2 mL / min의 유량으로 평형 버퍼로 컬럼을 씻으하십시오.
- pH 7.5에서 1 M NaCl과 25mM Tris의 4개의 CV를 사용하여 2mL/min의 유량으로 이차 높은 염분 세척을 수행합니다. 시스템 분획 수집기는 50 mL 튜브에서 염세척 중에 컬럼에서 나오는 모든 단백질/DNA를 수집합니다.
- 1 mL/min의 유량으로 용출 버퍼 의 5 개의 CV를 적용하여 기둥에서 항체를 용출하십시오. UV 신호에 기초하여 15 mL 튜브에서 용루를 수집; UV 280 신호가 35 mAU 이상이면 수집이 시작됩니다. 신호가 50 mAU 이하로 떨어지면 수집이 종료됩니다. 이를 피크 커팅이라고 합니다.
참고 : 피크 절단은 용출 프로파일의 정상화를 보장하고 단백질 응집체24를포함 할 수있는 용출 피크 테일링을 방지합니다. - 평형 버퍼의 세 개의 CV를 사용하여 열을 세척합니다. 세척 단계 후에 실행이 종료됩니다.
- 용출 후 1 M 트리스 염기를 사용하여 정제된 단백질을 즉시 중화하여 ~5.5의 pH로 하였다. 280 nm 및 260 nm에서 마이크로 볼륨 UV-Vis 분광광도계를 사용하여 단백질 농도를 측정하고 4 °C에서 저장합니다.
- 원심 단위를 사용하여 정제 된 항체를 농축하십시오 (단계 2). 이어서 정제된 항체를 LC-MS를 이용한 글리칸 분석에 적용하고, 응집 프로파일 후 SEC-MALS를 이용하여 분석하였다(단계 3 & 4).
참고: 정제된 항체는 빈번한 동결 해동 주기가 응집 및 침전을 일으킬 수 있으므로 추가 버퍼 교환 없이 동결되어서는 안 됩니다.
- 저장된 방법을 선택하고 계측기 소프트웨어(1.2.5단계)가 메시지가 표시되면 실행을 클릭합니다.
2. 정제 된 항체의 농도
참고: 트리스-아세테이트 완충제는 0.1 M 아세트산으로 1 M 트리스 염기를 중화하여 ~5.5의 pH로 한다.
- 원심분리기 튜브에 100kDa 필터를 삽입합니다.
- 이중 증류수 500 μL로 필터를 세척하십시오. 실온 (RT)에서 14,000 x g에서 10 분 동안 원심 분리기. 이 단계를 두 번 반복합니다. 여과액을 버리십시오.
- 헹구는 필터를 신선한 원심분리기 튜브로 옮기고 각 필터에 500 μL의 샘플을 추가합니다. 14,000 x g에서 10 분 동안 원심 분리기 .
- 필터를 신선한 스핀 튜브로 반전시면 됩니다. 농축 된 샘플을 수집하기 위해 1,000 x g에서 2 분 동안 원심 분리기.
- UV-Vis 분광광도계를 사용하여 시료 농도를 결정합니다. Tris-acetate 버퍼 용액을 사용하여 분광광도계를 비워 둡니까? 1%(%m/v) IgG 용액에 대해 280 nm에서 1.37 mL•(mg•cm)-1의 단백질 소멸 계수를 사용하십시오.
- 농축 된 샘플을 사용하여 글리칸 분석을위한 2 mg / mL 작업 용액 12.5 μL및 SEC-MALS용 3.5 mg / mL 작업 솔루션 30 μL을 준비하십시오.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 시료는 4°C에서 냉장 보관해야 합니다. 에서 2 mg/mL 농도, 이러한 샘플은 적어도 3 개월 동안 안정 해야 4 °C 높은 농도 침전 수 있습니다 하는 동안.
3. 질량 분광법을 이용한 N-글리칸 분석
- N-글리칸 라벨링 및 절연
- 중성 인산나트륨, 구연산염 또는 HEPES 완충제와 같은 적절한 완충액에서 2 mg/mL의 항체 농도로 시작합니다. 실험 샘플과 함께 처리하기 위해 2 mg/mL에서 손상되지 않은 mAb 표준(예: NIST mAb)을 준비하여 양성 대조군역할을 합니다.
참고: 항체는 SDS가 없고 0.1 mM 미만의 핵소자(트리스, DTT, 글리신 또는 히스티딘)를 포함하는 최종 완충액에 있어야 한다. 샘플 버퍼의 SDS를 제거해야 합니다. 핵보유가 완충액에 있는 경우, 그(것)들을 희석하거나 키트를 방해할 것이기 때문에 버퍼 교환을 능력을 발휘합니다. 일반 프로토콜은 글리칸 키트와 함께 제공된다. - 키트와 함께 제공된 1 mL 튜브에 LC-MS 등급의 물 15.3 μL로 항체의 7.5 μL을 희석한 다음 90°C에서 효소 친화적이고 MS 친화적인 계면활성제의 6 μL을 사용하여 변성합니다.
- 샘플을 실온(RT)까지 3분간 식힙니다. 이어서, PNGase F의 1.2 μL을 넣고 50°C에서 5분 동안 배양한다.
- RT로 3분 간 냉각한 후, 무수 디메틸포르마미드(DMF)에 용해된 형광 태깅 시약 12 μL을 첨가하여 갈라진 N-글리칸에 라벨을 붙이고 5분 동안 기다립니다.
- 심과 폐기물 트레이진공 매니폴드에 친수성 상호 작용 크로마토그래피 (HILIC) 플레이트를 놓습니다. 다중 수의 샘플에 다중 채널 파이펫을 사용합니다.
- 200 μL의 물로 우물을 조절하여 진공이 조정되어 액체가 HILIC 수지를 통과하는 데 15-30 초가 걸릴 수 있습니다. ACN 희석 된 글리칸 혼합물 (400 μL)을 적재하기 전에 200 μL의 85 % ACN과 평형화하고, 각각의 새로운 액체가 웰에 첨가 된 후 진공을 적용합니다. 600 μL의 1% 포르믹산(FA)/90% ACN으로 수지세척하십시오.
- 폐기물 트레이를 600 μL 수거 튜브로 교체하십시오. SPE 용출 완충제 (각각 30 μL의 3 개의 용루)로 표지 된 N-글리칸을 수집 튜브에 용출합니다. 310 μL의 DMF/ACN 시료 희석액으로 풀린 용출을 희석합니다. 형광(FLR)-MS 분석을 위해 샘플을 자동 샘플러 바이알에 파이펫합니다.
참고: 이 샘플은 -80°C에서 적어도 1개월 동안 보관할 때 안정적입니다. HILIC 플레이트를 원래 포장에 보관하고, 테이프로 닫은 후 건조기 내부에 보관하십시오.
- 중성 인산나트륨, 구연산염 또는 HEPES 완충제와 같은 적절한 완충액에서 2 mg/mL의 항체 농도로 시작합니다. 실험 샘플과 함께 처리하기 위해 2 mg/mL에서 손상되지 않은 mAb 표준(예: NIST mAb)을 준비하여 양성 대조군역할을 합니다.
- 라벨이 부착된 N-글리칸의 LC-MS 분석
- 형광 검출기 및 사중극자 비행 시간(Q-ToF) 질량 분석기에 결합된 초고성능 액체 크로마토그래피(UPLC) 시스템에서 라벨이 부착된 N-글리칸 용출 샘플을 분석합니다. 표지된 글리칸의 크로마토그래피 분리를 위해 승인된 컬럼을 사용하고 분리 시 60°C까지 가열한다.
참고: 열은 사용하기 전에 60% 아세토니트릴 및 40% H2O로 플러시되어야 합니다: 처음 사용하기 전에 50 CV 또는 이전에 열을 사용한 경우 20CV.- 50 mM 암모늄 포메이트 (AmF) (이월 상 농축물로 만든) 및 100 % LC-MS 등급 ACN을 사용하여 이동 상을 하십시오. AmF는 pH 변화에 민감하며 혼합 후 1개월 동안 사용할 수 있습니다. LC 그라데이션을 사용하여 초기 유량을 0.4mL/min으로 설정하고 용출 단계에서 AmF를 증가시도록 합니다.
- 2Hz의 샘플링 속도로 EX 265/EM 425 nm에서 측정할 FLR 검출기를 설정합니다. Q-ToF를 MS1 포지티브 이온 감도 모드로 설정하고 질량 범위가 100-2,000 달톤(Da), 스캔 시간 0.25초 및 연속체 데이터 수집으로 설정합니다. "보정 을 적용하지 마십시오" 모드에서 내부 질량 참조에 류신 엔케팔린(50% ACN/0.1% FA에서 2 ng/μL)을 사용하십시오.
참고: 내부 질량 참조 보정은 나중에 데이터 처리 중에 적용됩니다. - DMF의 22.5 μL, DMF의25 μL 및 ACN의 52.5 μL에서 덱스턴 사다리를 순차적으로 다시 중단한다. 사다리가 더 높은 온도 (실온, 4 °C)에서 24 시간 이상 동안 안정되지 않기 때문에 - 80 °C에서 보관하기 위해 10 μL aliquots를 준비하십시오. 덱스트렌 사다리는 두 개 이상의 동결 해동 주기 후에 성능이 저하됩니다.
- 샘플을 10°C로 설정된 자동 샘플러에 놓습니다. 사다리의 고정 시간 정보가 할당에 사용되는 반면 질량 정보는 식별을 검증하는 데 사용되기 때문에 샘플과 함께 덱스렌 사다리 의 바이알을 로드합니다. 샘플에는 10 μL 주사를 사용하고 사다리에는 7.5 μL 주사를 사용합니다. 샘플을 삼중으로 주입합니다. 로드된 메서드를 실행합니다.
- 형광 검출기 및 사중극자 비행 시간(Q-ToF) 질량 분석기에 결합된 초고성능 액체 크로마토그래피(UPLC) 시스템에서 라벨이 부착된 N-글리칸 용출 샘플을 분석합니다. 표지된 글리칸의 크로마토그래피 분리를 위해 승인된 컬럼을 사용하고 분리 시 60°C까지 가열한다.
- LC-MS 데이터를 위한 N-글리칸 식별
- 친수성 상호작용 크로마토그래피 형광 질량 분석법(HILIC-FLR-MS) 데이터에 최적화된 프로그램으로 데이터 처리를 수행합니다.
- 프로그램 내에서 내부 질량 참조 보정을 적용합니다. 샘플정보에서 덱스터 주사를 "표준"으로 지정합니다. 해석 방법에서분리 화합물 보존 시간을 실행 중에 감지된 사다리 화합물의 고정 시간으로 설정합니다.
- 식별된 글리칸에 대해 영역 %가 반환되도록 하려면 해석 방법을 수정합니다: 처리 탭에서 정량 설정 - 보정 및 "보정 곡선 맞춤 유형"을 "상대 응답(%)"로 설정합니다.
4. SEC-MALS를 이용한 항체 응집 분석
- 샘플 준비
- 희석된 단백질3.5 mg/mL(2단계)을 150 μL 유리 인서트를 사용하여 바이알로 옮김. 젤 로딩 팁을 사용하여 기포가 유입되는 것을 방지하려면 인서트의 아래쪽 종에 파이펫을 넣습니다.
- 세프타 캡으로 바이알을 캡하고 즉시 분석하십시오. 나중에 분석하면 4°C에서 보관하십시오.
- SEC-MALS 구성 및 평형
참고: MALS 검출기 및 MALS 소프트웨어에 의해 제어되는 굴절률 검출기로 초고압 액체 크로마토그래피(UHPLC)로 구성된 SEC-MALS의 집계를 분석합니다.- UHPLC 시스템의 제어를 위한 UHPLC 소프트웨어에서 방법 파일을 구성하고, 1x 인산완 버퍼링 식염수(PBS)의 이동상(PBS)의 이면상으로 유량을 0.4 mL/min으로 설정하고(10x에서 희석), 사출 부피를 5 μL로, 컬럼 온도를 25°C로 설정합니다. 및 다이오드 어레이 검출기(DAD)를 280 nm를 모니터링한다. 시료 분석 전에 실행 시간을 20분으로 설정합니다.
- UHPLC와 다중 각도 광 산란 - 굴절률(MALS-RI) 검출기 간의 인터페이스는 DAD에서 아날로그 출력을 사용해야 합니다. DAD 방법 파일에서 DAD 감쇠를 1,000mAU로 설정하고 AU/UV 설정을 1로 설정합니다(UV계측기>채널>채널1).
- 분석을 시작하기 30분 전에 DAD 램프를 켜고 파장을 280nm로 설정합니다. 동시에 굴절률(RI) 기준 셀을 15분 동안 또는 기준선이 안정될 때까지 제거한 다음 기준 셀을 닫습니다.
- SEC-MALS 소프트웨어 시퀀스를 구성하고, 수집 시간을 12분으로 설정하고, 주입 량을 5 μL로, dn/dc를 0.185 mL/g로, A280 소멸 계수(이전에 실험적으로 결정된 경우) 또는 1.37 mL*(mg*cm)-1로, 및 농도를 샘플. 실행을 클릭하고 "삽입 대기 중" 대화 상자가 화면에 나타날 때까지 기다립니다.
참고: A280 소멸 계수는 관심 있는 단백질에 따라 다르며 실험적으로 결정해야 합니다. - MALS-RI 소프트웨어와 동일한 순서로 UHPLC 소프트웨어의 샘플 목록을 구성하고 제출합니다.
참고: 실행 전후에 시스템 적합성 검사를 실행하는 것이 중요합니다. 소 혈청 알부민은 일반적으로 피크 확대를 확인하는 데 사용됩니다, SEC 열청소 또는 교체가 필요할 수 있다는 신호. 동일한 BSA 표준 주입을 사용하여 신호 정렬, 피크 확대 및 검출기 정규화를 지정할 수 있습니다.
-
MALS 소프트웨어로 집계 분석
- 절차로 표시된 탭을클릭합니다. 필요한 경멸의 최소 수준을 지정합니다. 없음은 일반적으로 충분하지 않습니다.
- LS1, LS2, LS3, RI 및 UV 채널에 대해 기준선이 올바르게 그려졌는지 확인하고 필요한 경우 조정합니다. 관심 있는 피크 영역을 설정합니다.
- 분자 질량 분포를 검토하여 호출된 피크에 비슷한 크기의 입자가 포함되어 있는지 확인합니다.
5. 전하 변형 분석
- 시료 준비 및 라벨링
- 3.5 mg/mL 항체 용액의 80 μL로 시작합니다. 0.5 mL 탈염 컬럼(7k MWCO)을 사용하여 샘플을 탈염합니다. 먼저 바닥 스토퍼를 스냅한 다음 상단 스토퍼를 느슨하게 하고 1.7 mL 마이크로 원심분리튜브에 넣어 컬럼을 준비합니다. 1,500 x g에서 1 분 동안 탈염 열을 원심 분리기.
주: 다음 단계의 원래 방향으로 배치할 수 있도록 열의 외부를 점으로 표시합니다. - 컬럼을 새로운 마이크로 원심분리기 튜브로 옮김. 희석된 단백질 80 μL을 컬럼 의 상단에 추가합니다. 열을 원래 방향에 맞춥습니다. 1,500 x g에서 2 분 동안 원심 분리기 . 원심분리기에서 샘플을 제거하고 탈염 컬럼을 버리고 샘플을 잘 섞습니다.
참고: 데솔팅은 샘플 매트릭스에 1차 아민, 시료 전기 동극 또는 기타 호환되지 않는 물질을 교란시키는 부형제가 포함되어 있는 경우에만 필요합니다. - 샘플을 25 μL의 부피에서 2 mg/mL의 최종 농도로 희석하고 라벨링 버퍼의 5 μL을 추가합니다(재료 표: 전하 변형 시약 키트참조)를 96웰 플레이트에 넣습니다. 디메틸포름아미드에서 필요한 양의 라벨링 시약(재료 표: 전하 변형 시약 키트참조)을 희석하여 라벨 시약을 준비합니다. 빛에서 떨어진 실온에서 10 분 동안 샘플을 배양하십시오.
참고: 해동한 다음 즉시 이 시약을 사용하고 DMF와 혼합한 후 10분 이내에 사용하는 것이 중요합니다. - 배양 후, 시약 등급의 물 60 μL을 추가하고 파이펫팅으로 잘 섞습니다. 접시 를 밀봉하고 1 분 동안 1,000 x g의 플레이트를 원심 분리합니다.
- 3.5 mg/mL 항체 용액의 80 μL로 시작합니다. 0.5 mL 탈염 컬럼(7k MWCO)을 사용하여 샘플을 탈염합니다. 먼저 바닥 스토퍼를 스냅한 다음 상단 스토퍼를 느슨하게 하고 1.7 mL 마이크로 원심분리튜브에 넣어 컬럼을 준비합니다. 1,500 x g에서 1 분 동안 탈염 열을 원심 분리기.
- 전하 변형 칩 준비
- 보관 용액을 제거하고 물로 웰 1, 3, 4, 7, 8 및 10을 세척하여 Charge Variant 칩을 준비합니다. 그런 다음 물을 pH 7.2 실행 버퍼로 교체하십시오(재료 표: 전하 변형 시약 키트참조).
- 완충튜브에 750 μL의 pH 7.2 러닝 버퍼를 추가하고 샘플 트레이의 왼쪽 상단 모서리에 있는 표시된 지점에 버퍼 튜브를 놓습니다. 이제 96웰 플레이트에서 플레이트 씰을 제거하고 계측기 사용자 인터페이스에서 언로드 플레이트를 누르고 플레이트를 GXII 샘플 트레이에 삽입합니다.
참고: pH 7.2 버퍼는 이 분석에 사용되었다. pH 5.6-7.2 완충제는 단백질 pI에 따라 사용될 수 있다. 낮은 pH 버퍼를 사용하는 경우 샘플 실행 시간이 더 길어질 수 있습니다. - 사용자 인터페이스에서 칩 언로드 버튼을 누릅니다. 전극에 입자가 없는지, 그렇지 않은 경우 보풀이 없는 면봉으로 청소하십시오. 칩을 삽입 할 때 칩의 중앙에있는 창이 입자 또는 얼룩이없는 지 확인하십시오. 필요한 경우 보풀이 없는 부드러운 천으로 닦으세요.
참고: 모세관 전기 동동 칩으로 작업할 때 진공 흡인에 의한 버퍼를 제거한 다음 다음 다음 용액을 즉시 추가하여 우물이 건조되는 것을 방지합니다. 거품의 도입을 최소화하기 위해 역파이팅 기술을 연습하십시오. 칩을 취급할 때, 칩 바닥에서 연장되는 깨지기 쉬운 모세관을 염두에 두고 건조하지 않고 거친 핸들링을 뚫지 않도록 하십시오. - 칩 챔버에 뚜껑을 닫고 HT 단백질 전하 변이체 분석기를 선택합니다. 실행 버튼을 클릭합니다. 프롬프트에 따라 샘플 웰, 플레이트 유형, 분석 시간(68, 90 또는 100s) 및 파일 이름을 선택합니다. 프롬프트 끝에서 시작을 클릭합니다.
- 칩 정리는 각 우물을 물로 2x 세척한 다음 저장 버퍼를 추가해야 합니다(재료 표: 전하 변형 시약 키트참조). 저장 버퍼에 들어가면 기기의 칩을 교체하고 메시지가 표시되면 HT 단백질 충전 분석기를 선택합니다. 메인 화면에서 사용자 인터페이스에서 세척을 선택합니다. 완료되면 칩을 제거하고 물과 보풀이없는 면봉으로 전극을 닦고 칩을 4 °C에 보관하십시오.
- 전하 변형 분석
- 계측기 분석 소프트웨어를 엽니다. File>데이터 파일가져오기로 이동하여 실행을 가져옵니다... 원하는 *.gxd 파일을 클릭합니다. 이름만 소프트웨어로 이월되므로 웰의 이름을 바꾸는 것이 유리합니다(도구> 샘플 이름편집기). 파일을 선택하는 동안 시프트를 누르고 내보낼 파일을 선택합니다. 파일>내보내기를 클릭합니다... Raw 데이터 상자를 선택한 다음 AIA 형식 상자를 선택합니다.
- 분석 소프트웨어 내에서 프로젝트 찾아보기 탭을 엽니다. 데이터베이스>가져오기 데이터를 클릭하고 내보낸 *를 선택합니다. CDF 파일.
- 일단 가져, 주사 탭으로 이동, 분석 할 파일을 선택, 마우스 오른쪽 버튼으로 클릭하고 프로세스로 이동 ... 팝업 창에서 프로세스 옆의 확인란을 선택하고 드롭다운 상자에서 "지정된 처리 방법 사용" 라디오 상자와 원하는 처리 방법을 선택합니다. "How:"라고 표시된 바로 아래드롭다운 박스에서 캘리브레이트와 수량을 선택합니다. 처리가 완료되면 결과 탭으로 이동하여 크로마토그램의 통합을 확인합니다.
참고: 각 메서드에 대해 처리 방법을 확인해야 합니다. 시작점으로 현재 처리 방법에 사용되는 매개 변수가 보충 파일에 포함됩니다.
참고: 데이터 내보내기는 보고서 형태로 수행하거나 최대 정량화만 내보낼 수 있습니다. 이러한 작업은 처리 또는 결과 창과 동시에 수행할 수 있습니다.
6. 아미노산 분석
- LC-MS에 의한 절대 아미노산 정량화를 위한 표준 곡선 설정
- 확장 된 아미노산을 준비 (EAA) 아센의 59.45 mg을 용해 하여 혼합물, 59.00 Hyp의 mg, 65.77 Gln의 mg, 및 91.95 Trp의 mg 25 mL의 0.1 N HCl. EAA 혼합물의 각 아미노산의 최종 농도는 18 nmol/μL입니다.
- 내부 표준(ISTD) 스톡 솔루션을 HCl 50 mL에서 58.58 mg의 Nva 및 44.54 mg의 Sar를 용해시킴으로써 준비합니다.
- Ala, Asp, Arg, Cys, Glu, Gly, His, Ile, Leu, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val at 1 nmol/μL을 함유한 아미노산 스톡 용액을 결합하여 최종 아미노산 농도 900의 최종 아미노산 농도를 위해 EAA 혼합물을 각각 조합하여 완전한 아미노산 표준을 준비하십시오. , 225, 90, 22.5 및 9 pmol/μL. 준비된 ISTD 스톡을 아미노산 표준에 추가하여 90 pmol/μL 또는 900 pmol/μL의 최종 농도를 추가하여 "낮음" 및 "높은" 내부 표준을 만들어 이 방법에 대한 포지티브 컨트롤로 사용합니다.
- 샘플 바이알에 아미노산 농도를 UPLC의 자동 샘플러에 넣습니다. 다음 지침을 사용하여 아미노산 표준 농도에 따라 기기 소프트웨어에서 교정 곡선(9 ~900pmol/μL)을 생성합니다.
- 그대로 아미노산 분석을 위해 UPLC에 결합된 전기 분무 이온화(ESI) 양성 감도 모드에서 Q-ToF를 사용하십시오. 크로마토그래피 분리를 위해 아미노산 분리를 위해 만들어진 정상 상 컬럼을 사용하십시오. 질량 분석 등급 시약으로 다음 완충제를 준비하십시오: A = 아세토니트릴 + 0.1% 포름산 및 B = 100 mM 암모늄 포메이트. LC 유량을 0.6 mL/min으로 설정하고 컬럼 온도를 40°C로 설정합니다.
- 아미노산 분리를 위해 다음 15 분 그라데이션 조건을 사용하십시오 : 14 % B (0-3 분), 14-100 % B (3-10 분), 100 % B (10-13 분), 100-8 % B (13-14 분), 8 % B (14-15 분).
- MS 수집 프로그램의 "샘플 유형" 및 "Conc A" 열 목록을 사용하여 정량 프로그램에서 원유 생물반응기 매체의 향후 분석을 위한 교정 곡선을 만듭니다. 이러한 열을 수집 프로그램에 표시하려면 상단 메뉴 모음을 마우스 오른쪽 단추로 클릭할 때 표시 사용자 지정 명령을 사용합니다.
- 아미노산 표준에 대한 샘플 유형은 "표준"이되고 미디어 샘플은 "Analyte"가 됩니다. "Conc A" 열을 필요한 단위의 표준 수치 농도로 채웁니다(예: pmol/μL).
- 준비된 아미노산 표준 농도를 적어도 두 번 실행합니다. ISTD 피크를 확인하여 UPLC 계측기 및 질량 분석기에서 제대로 작동하는지 확인합니다.
- 정량 응용 프로그램에서 "방법 편집" 옵션을 사용하여 정량 메서드(*.mdb 파일)를 만듭니다. 정량 적용에서 관심 있는 모든 아미노산(예: 화합물 이름, m/z 값 및 예상 보존 시간)을 정의합니다. 여기에서 메서드의 통합 매개 변수를 변경합니다.
- 표준 샘플에 생성된 아미노산 방법을 사용하여 교정 곡선을 만듭니다. 이 곡선은 Export>교정... 명령을 사용하여 미디어 샘플과 함께 사용할 수 있도록 *.cdb 파일로 내보낼 수 있습니다.
- 정량 응용 프로그램에서 원하는 레이아웃을 *.qlt 파일에 저장하여 "레이아웃 저장..."을 사용하여 향후 데이터 집합에 적용합니다. 이름(사출 이름), 영역 및 Conc는 가장 중요한 출력 열입니다.
- LC-MS에 의한 조생물반응기 매체의 아미노산 분석
- 원심분리기 원유 생물반응기 매체를 1,962 x g에서 5분간 통과시키고 0.22 μm 필터를 통과한다.
- 단백질과 미립자 물질을 제거하기 위해 과염소산 정화를 수행하십시오: 여과된 바이오리액터 매체를 1:1 비율로 0.4 N HClO 4와 혼합하고 RT에서 5분 동안 14,700 x g의 원심분리기를 RT에서 5분 동안 혼합합니다.
참고: 아미노산 농도가 교정 범위 내에 있도록 필요에 따라 주입 량을 조정합니다. 계측기에 따라 사출 량은 0.1 μL에서 10 μL 사이로 조정할 수 있습니다. - LC-MS. 정량 프로그램 하에서 "공정 샘플"을 방법(*.mdb) 및 교정 파일(*.cdb)과 함께 사용하여 삼중 으로 미디어 샘플을 실행합니다. 모든 주사가 완료되면 정량 응용 프로그램에 의해 조미디어 샘플에 메서드 및 교정 곡선이 자동으로 적용됩니다.
- 다른 프로그램(예: 스프레드시트)에서 분석을 위해 데이터를내보내려면 "인쇄" 명령을 사용하고 *.xps 또는 *.pdf 파일을 만듭니다.
결과
자동화된 마이크로스케일 바이오리액터로부터 수확된 세포 배양액은 도 1과 같이 빠른 단백질 액상 크로마그래피(FPLC)를 사용하여 정제되고, 정제된 단백질의 중요한 품질 특성(CQA)은 다양한 특징을 특징으로 하였다. 다운스트림 분석 방법. 이것은 자동화 된 미생물 시스템의 주요 이점입니다. 다양한 조건에서 빠르게 평가할 수 있습니다. 질량 분석법에 의해 처리되는 CHO 생산 mAbs의 N-글리칸 데이터는 도2에 나타난 크로마토그램과 같아야 한다. 이 그림은 한 샘플에서 만노스 5 피크(M5)가 상당히 낮다는 것을 보여주는 두 크로마토그램 간의 비교를 나타낸다. 피크 대신 시끄러운 기준선만 관찰되는 경우 크로마토그래피 설정에 결함이 있거나 프로시저가 성공하지 못한다는 의미일 수 있습니다. 컨트롤을 사용하면 문제 해결을 간소화할 수 있습니다. 첫째, 덱스렌 사다리에서 FLR 피크를 평가; 이러한 피크는 크로마토그래피 시스템이 올바르게 작동하고 있음을 나타냅니다. 다음으로, 실험적으로 수득된 피크를 처리된 그대로 mAb 표준으로부터 얻은 피크와 비교한다. 표준의 피크가 표시되지만 샘플 피크가 식별되지 않으면 mAb 샘플이 올바르게 처리되지 않았습니다. 이는 N-글리칸 라벨링 및 정제를 방해하는 완충제 내의 SDS 또는 뉴클레오필 존재 때문일 수 있다.
SEC-MALS는 항체의 응집 프로파일 및 분자량이라는 두 가지 더 많은 CQA를 평가하는 데 사용될 수 있다. 대표적인 SEC-MALS 크로마토그램은 그림3에 나타낸 것과 비슷합니다. 분자 질량 분포 및 절대 분자량은 소멸 계수가 1.37 mL*(mg*cm)-1및 dn/dc0.185 mL/g의 필요한 소프트웨어를 사용하여 결정하였다. 소프트웨어의 최고 통화 및 기준 설정이 수동으로 수행되므로 결과는 사용자마다 약간 다를 수 있습니다. 도 3에서 단모성 IgG1의 절대 분자량은 1.504 x 105 Da±0.38%(청색)이고 고차 복합체는 7.799 x 105 Da±3.0%(적색)이다. 응집체의 다분산은 피크 1의 적색 어금니 질량 분포에 의해 지시된 바와 같이단량체의 다분산도보다 훨씬 크다(그림 3). 소량의 시료와 CQA로서의 응집의 중요성은 이 기술을 자동화된 미생물 반응기 시스템에 매우 가치 있는 보완 분석 도구로 만듭니다.
mCZE의 결과는 단일 클론 항체에 대한 전하 변이체 프로파일을 보여주는 도4와 같은 전기 전형체입니다. 프로파일은 조사중인 단백질에 대한 독특한 서명이며 작동 pH에 매우 민감합니다. 또한 전하 변형 프로파일의 왼쪽에 있는 자유 염료 피크가 보입니다. 작동 pH를 설정할 때 작업자가 해상도와 신호의 균형을 맞추기 위해 재량에 따라 조정됩니다. 또한, 작업자는 ~30s에서 이동하는 자유 염료 피크에서 좋은 분리를 보장해야합니다. 이 피크를 제거하기 위해 라벨링 후 샘플을 탈염시킬 수 있지만 신호가 현저하게 손실됩니다. 작동 pH가 설정되면 샘플 프로파일을 비교할 수 있습니다. 일반적으로 일관된 반면, 라벨링 효율의 변화 또는 부형제의 차이는 샘플 의 이동과 전하 변형 프로파일의 변화에 약간의 차이가 발생할 수 있으므로 전기 전형은 직접 비교하기 가 어렵습니다. 대신, 비교 방법은 일반적으로 기본, 주요 및 산성 종의 백분율을 기반으로합니다. 이 경우 mCZE를 사용하여 1-2%만큼 작은 상대적 차이를 식별할 수 있습니다.
아미노산 소비고갈고갈이 CQA의 변화를 일으키는지 여부를 확인하기 위해 모니터링할 수 있습니다. 질량 분석기의 크로마토그램 판독값은 조생물 반응기 미디어 샘플에서 아미노산의 절대 정량화를 위한 교정 곡선의 성공적인 생성을 평가하는 데 사용할 수 있습니다. 도 5는 이 과정에서 2개의 총 이온 크로마토그램(TIC)과 추출된 이온 크로마토그램(XIC)을 대표적인 결과로 나타낸다. 도 5A에서, 도시된 TIC는 물 블랭크만 주입된 바와 같이 버퍼 시스템의 배경 신호를 도시한다. 그림 5 B는 아미노산 표준의 대표적인 TIC를 나타내며, 물 빈 것과 비교했을 때, 개별 아미노산 종에 대응하는 작은 피크가 관찰될 수 있다(예: 7.96분의 리신). 피크를 통합하고 피크 영역(및 따라서 농도)의 정량화를 용이하게 하기 위해 XIC는 정의된 "크로마토그램 질량 창"의 신호만 표시되는 곳에서 사용됩니다. 계측기의 감도와 크로마토그래피 분리의 품질에 따라 최적의 질량 창은 사용자가 결정해야 합니다. 이 예에서(도5C) 10 ppm의 질량 윈도우를 가진 리신의 XIC(m/z=147.1144)는 아미노산 표준에서 리신이 8.03분에서 컬럼떨어져 용해되는 곳을 도시한다.
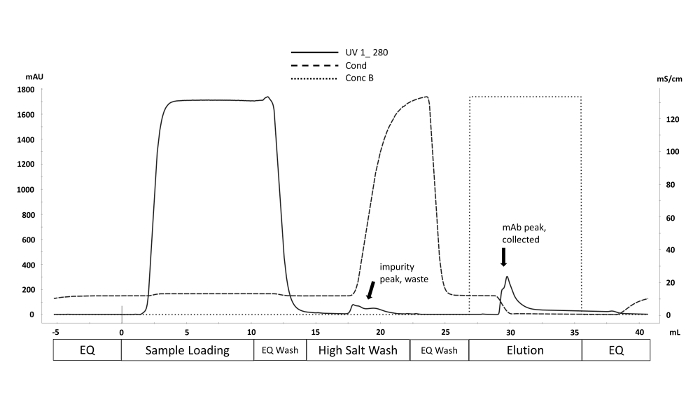
그림 1 . 빠른 단백질 액상 크로마토그래피(FPLC) 기술을 이용한 정제 방식의 대표적인 크로마토그램. 체적(mL)에 해당하는 정제 방법 상은 x축을 따라 표지된다. 280 nm (mAU y 축, 실선)에서의 UV 흡광도는 정제 주기 전반에 걸쳐 모니터링됩니다. 비특이적 결합 불순물은 높은 염분 세척 동안 전도도(mS/cm y축, 파선)를 증가시킴으로써 변위됩니다. 를 표시합니다). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
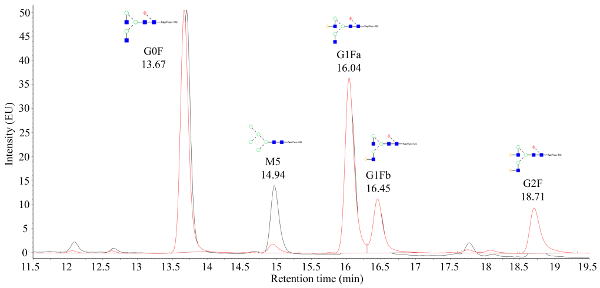
그림 2. 질량 이 확인된 태그글리칸으로부터 얻은 대표적인 형광 크로마토그램. x축은 유지 시간(분)이며 y축은 신호 강도입니다. 14.94분의 피크는 만노스 5(M5) 글리칸을 나타내며, 여기서 M5 신호 강도 사이의 큰 차이는 중첩된 두 샘플 간에 관찰될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
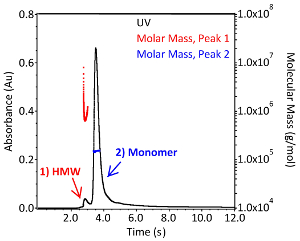
그림 3. IgG1 단일 클론 항체의 분자량 분포. 1x PBS(pH7.4)에서 크기 배제 크로마토그래피에 의해 분리된 손상되지 않은 IgG1 단일클론 항체의 크로마토그램. 흡광도는 280 nm(검정; 좌측 축)에서 모니터링되고 광 산란 및 굴절률 검출기는 각 피크(적색 및 청색; 오른쪽 축)의 절대 분자량을 계산하는 데 사용되었다. 높은 분자량 종은 "HMW"라고 표시된 피크로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 . IgG1 단일클론 항체의 전하 변이체 프로파일. 이 전기 전형체는 mCZE 플랫폼에서 생성됩니다. 자유 염료 피크는 ~ 30s에서 마이그레이션되며 IgG1과 잘 분리됩니다. 정량화를 위해 피크는 계측기 데이터 분석 소프트웨어를 사용하여 기본, 주 및 산성 종으로 분할되었습니다. 빨간색 선은 통합된 피크 영역을 간략하게 설명합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
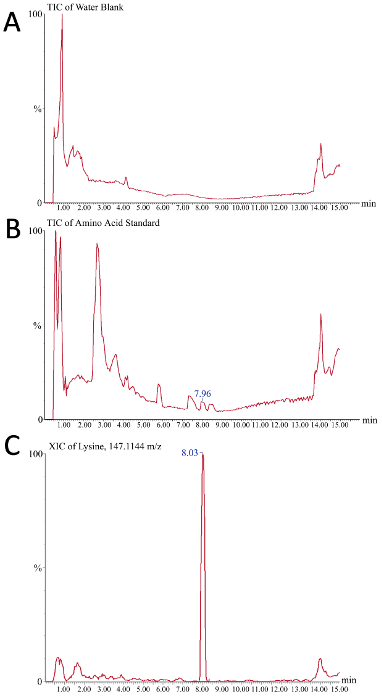
그림 5. 조생물반응기 매체의 질량 분광계 계 아미노산 분석을 위한 이온 크로마토그램의 대표적인 결과. x축은 시간(분)이 면서 y축은 신호강도(A) 물 블랭크가 음의 제어 역할을 하며 액체 크로마토그래피 그라데이션(B) 225 pmol/μL 아미노산의 과정에서 관찰된 배경 신호를 나타낸다. 표준은 이 총 이온 크로마토그램에서 관찰된 개별 피크가 크로마토그래피로 해결되는 표준 혼합물의 상이한아미노산을 나타내기 때문에 양성 대조군으로 여기에서 사용된다 (C) m에 대한 대표적인 추출된 이온 크로마토그램 /z 147.1144, 이는 리신이다. B의 7.96 분 피크는 리신의 C에서 8.03 피크에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
HCCF에는 비용이 많이 드는 계측을 막고 파괴할 수 있는 이물질과 큰 입자가 포함되어 있으므로 추가 다운스트림 처리 전에 배양 설명이 필요합니다. 원심분리는 일반적으로 여과 에 이어 단백질에서 세포 및 기타 불용성 입자를 분리하는 첫 번째 접근법입니다. 이러한 여과된 HCCF는 정제를 위해 빠른 단백질 액상 크로마토그래피(FPLC)를 실시합니다. 제품을 얻기 위해 자동화 된 미생물 반응기에서 HCCF의 정제는 다운 스트림 처리에 중요한 단계입니다. 여기서, 단백질 A 컬럼을 가진 벤치탑 FPLC 시스템은 HCCF로부터 단일클론 항체를 얻기 위해 사용된다. 업스트림 프로세스에 대한 분석은 세포 거동에 대한 유용한 통찰력을 제공하고 생물 공정 설계를 안내하여 일관되고 신뢰할 수 있는 품질의 제품을 얻을 수 있도록 도와줍니다. 또한 분석을 통해 중요한 품질 특성(CQA)을 업스트림 및 다운스트림 프로세스에 연결할 수 있습니다. 여기에서 제시된 단클론 항체의 특성화에서 일반적으로 이용되는 4개의 비약은. 이러한 기술은 부분적으로만 정제되고 DNA 및 HCP의 잔류 수준을 포함할 수 있는 다양한 업스트림 소스의 공정 및 제품 분석을 위해 강력하고 신뢰할 수 있으며 쉽게 배포할 수 있습니다.
분석을 위해 샘플을 청소할 때 는 생물 반응기의 가변성을 유지하면서 분석을 위해 충분히 깨끗한 샘플을 만드는 것 사이에 중요한 균형을 맞추어야 합니다. 제품에 영향을 미치는 두 가지 가장 일반적인 오염 물질은 DNA와 HCP이며, 260/280 nm에서 비흡도를 측정하고 SDS-PAGE 또는 μCE-SDS를 통해 확인할 수 있습니다. 여기에서 제시된 검사는 DNA 내용의 낮은 수준에 과민하지 않습니다. 제품의 순도는 μCE-SDS에 의해 결정된 바와 같이 >95% 순수합니다.
미세 모세관 전기 영동 시스템을 이용한 전하 변이체 분석은 상대적으로 구현하기 쉬운 칩과 시약으로 전하 변종을 식별하는 높은 처리량 방법을 제공합니다. 기술의 본질과 라벨시약의 화학은 부형제 및 기타 1차 아민에 민감하므로 대부분의 시료 매트릭스에 대해 탈염 단계가 필요합니다. 경험에서, DNA의 낮은 수준은 라벨 링 반응에서 자유 염료와 함께 마이그레이션하고 결과의 품질에 영향을 미치지 않습니다. 기본, 주 및 산성 피크 정량화의 가변성은 전형적으로 <1%, DNA 및 기타 오염 물질의 상부는 분석의 가변성을 증가시킬 수 있습니다. 단백질 라벨링과 일치하고 병에서 제거하고 염료와 혼합 한 후 DMF를 신속하게 사용하는 것이 매우 중요합니다. Lysine 및/또는 히스티딘 표준 라벨링 컨트롤로 권장 됩니다. 시간이 지남에 따라 샘플 품질에 따라 칩은 미세 유체 채널에서 코팅을 파울하거나 잃어 더 큰 소음, 고스트 피크의 존재 및 샘플 간 변형을 더 많이 발생시킬 수 있습니다. 이러한 발생을 식별하기 위해 블랭크 및 시스템 적합성 표준(즉, NISTmAb)을 정기적으로 샘플과 동시에 분석했습니다. 칩 문제가 발생하면 칩을 저장 솔루션으로 세척하거나 교체할 수 있습니다.
치료용 당단백질의 글리칸 분석에 사용되는 방법은 주로 액체 크로마토그래피(LC) 및/또는 질량 분석법(MS)을 포함하며, 렉틴마이크로어레이 분석은 제3의 옵션25로 인기를 얻고 있습니다. 이 문서에서 설명하는 방법은 장점과 단점이 있는 LC와 MS를 모두 사용합니다. 질량 분광 방법은 형광 검출 출력 또는 렉틴 마이크로어레이를 사용하는 LC 기반 방법으로는 불가능한 분석된 글리칸의 질량 검증의 장점이 있다. 이 방법은 LC 및 형광 검출을 사용하여 dextran 사다리 표준에 대한 보존 시간 비교를 사용하여 글리칸 ID를 할당합니다. 형광 모니터링은 MS만으로는 올리고당의 이온화 효율이 좋지 않아 낮은 풍부도종을 정량화하지 못할 수 있는 검출의 용이성으로 인해 감도 및 정량화를 증가시킴을 허용합니다. MS의 대량 정보는 글리칸 ID를 확인하는 데 사용되지만 처리 소프트웨어는 대용량 정보를 기본 할당 기준으로 사용하지 않습니다. 따라서 재현 가능한 크로마토그래피와 쉽게 해결할 수 있는 피크가 없으면 이 방법은 글리칸 할당과 관련하여 어려움을 겪을 수 있습니다. 다행히도 질량 정보는 크로마토그래피가 하위인 상황에서도 재현 가능한 글리칸 할당을 방해하는 보존 시간의 변화와 같은 상황에서도 글리칸 할당에 도움이 될 수 있습니다. 이 방법을 MS 없이 사용하는 경우, 질량 정보를 사용하여 체류 시간 드리프트를 수정할 수 없기 때문에 크로마토그래피는 가장 높은 수준에 있어야 합니다.
여기서 설명된 아미노산 분석 방법은 조세포 배양 배지에서 과소화된 아미노산의 신속한 정량화를 위해 LC-MS를 활용한다. 대체 아미노산 분석 방법은 UV 검출26을가능하게 하는 아미노산 유도제를 필요로 한다. LC-MS 방법은 LC-UV 방법에 비해 중요한 이점을 제공합니다: 질량 특성화의 부족에 의해 제한되는 LC-UV 방법과 는 반대로 체류 시간 및 이온 질량을 모두 기반으로 식별할 수 있습니다. 더욱이, LC-MS 방법은 시간 및 재현성 이점을 제공하며, LC-UV 방법은 시료 가변성(27)을 부여할 수 있는 시간 소모적 유도반응을 필요로 한다. 그러나, LC-MS 방법에서 조세포 배양 배지의 주입은 이온 스키머 파울링으로 인한 MS 신호에 해로운 영향을 미칠 수 있다. 교정 사다리는 시스템 적합성 검사로 자주 주입되며, 데이터의 편향을 방지하기 위해 샘플 순서가 무작위화됩니다.
미생물을 이용한 항체 생산을 위한 세포 배양공정은 앞서 9. 이 연구에서는 제한된 샘플 볼륨에서 수집된 데이터를 최대화하는 단일 클론 항체 특성 화 방법에 대한 상세한 프로토콜이 잘 정의되어 있습니다. 수확된 세포 배양 액의 양이 제한되어 때때로 획득된 제품 정보를 제한할 수 있으며 제품 품질 데이터를 얻기 위한 올바른 분석 절차의 선택이 필수적입니다. 분석은 업스트림 프로세스 매개변수를 제품 품질의 변화에 연결하는 데 중요합니다. 여기서, 사용자가 미생물 반응기로 작업 할 때 mAbs를 특성화할 수있는 지침이 제공됩니다.
공개
이 출판물은 저자의 견해를 반영하며 FDA의 견해 또는 정책을 나타내는 것으로 해석되어서는 안됩니다.
감사의 말
저자는 그가 제공 한 분석 지원에 대한 스콧 루테에게 감사드립니다. 이 작업에 대한 부분적인 내부 자금 지원 및 지원은 CDER 중요 경로 프로그램(CA #1-13)에 의해 제공됩니다. 이 프로젝트는 오크 리지 과학 교육 연구소가 관리하는 미국 식품 의약국(FDA)의 생명 공학 제품 사무소에서 인턴십/연구 참여 프로그램을 통해 부분적으로 지원됩니다. 미국 에너지부와 FDA 간의 기관 간 계약을 체결할 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| CHO DG44 Cell Line | Invitrogen | A1100001 | |
| Akta Avant 25 | General Electric Life Sciences | 28930842 | |
| Pro Sep vA Ultra Chromatography Resin | Millipore Sigma | 115115830 | Purification Stationary Phase |
| Omnifit 10cm Column | Diba Fluid Intelligence | 006EZ-06-10-AA | Housing for Stationary Phase |
| Tris Base | Fisher Scientific | BP154-1 | |
| Superloop 10 mL | GE Healthcare | 18-1113-81 | |
| µDawn Multi Angle Light Scattering Detector | Wyatt | WUDAWN-01 | |
| 0.22 µm Millex GV Filter Unit PVDF Membrane | Merck Millipore | SLGV033RB | |
| 10X Phosphate Buffered Saline | Corning | 46-013-CM | |
| 12 mL Syringe | Covidien | 8881512878 | |
| 1290 Infinity Binary Pump | Agilent Technologies | G4220A | |
| 1290 Infinity DAD | Agilent Technologies | G4212A | |
| 1290 Infinity Sampler | Agilent Technologies | G4226A | |
| 1290 Infinity Thermostat | Agilent Technologies | G1330B | |
| 1290 Infinity Thermostatted Column Compartment | Agilent Technologies | G1316C | |
| 15 mL Falcon tube | Corning Inc. | 352097 | |
| 150 uL Glass Inserts with Polymer Feet | Agilent Technologies | 5183-2088 | |
| 50 mL Falcon tube | Corning Inc. | 352070 | |
| 96-Well Plate | Bio-Rad | 127737 | |
| Acetic Acid | Sigma-Aldrich | 695072 | |
| Acetonitrile | Fisher Chemical | BPA996-4 | |
| ACQUITY I-Class UPLC BSM | Waters Corporation | 18601504612 | |
| ACQUITY I-Class UPLC Sample Manager | Waters Corporation | 186015000 | |
| ACQUITY UPLC FLR Detector | Waters Corporation | 176015029 | |
| Amicon Ultra-4 100 kDa centrifugal filters | Merck Millipore | UFC810096 | |
| Amino Acid Standard, 1 nmol/µL | Agilent Technologies | 5061-3330 | |
| Amino Acid Supplement | Agilent Technologies | 5062-2478 | |
| Ammonium Formate Solution - Glycan Analysis | Waters Corporation | 186007081 | |
| Blue Screw Caps with Septa | Agilent Technologies | 5182-0717 | |
| CD OptiCHO AGT Medium | Thermo Fisher Scientific | A1122205 | |
| Centrifuge Tubes | Eppendorf | 22363352 | |
| Charge Variant Chip | Perkin Elmer | 760435 | |
| Charge Variant Reagent Kit | Perkin Elmer | CLS760670 | |
| Chromatography Water (MS Grade) | Fisher Chemical | W6-4 | |
| Dimethylformamide | Thermo Scientific | 20673 | |
| Extraction Plate Manifold for Oasis 96-Well Plates | Waters Corporation | 186001831 | |
| Formic Acid | Fisher Chemical | A117-50 | |
| GlycoWorks RapiFlour-MS N-Glycan Starter Kit - 24 Sample | Waters Corporation | 176003712 | |
| GXII Buffer Tubes | E&K Scientific | 697075- NC | |
| GXII Detection Window Cleaning Cloth | VWR | 21912-046 | |
| GXII HT Touch | Perkin Elmer | CLS138160 | |
| GXII Ladder Tubes | Genemate | C-3258-1 | |
| GXII Lint-Free Swab | ITW Texwipe | TX758B | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Intact mAb Mass Check Standard | Waters Corporation | 186006552 | |
| Intrada Amino Acid Column 150 x 2 mm | Imtakt | WAA25 | |
| NanoDrop One Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | 840274100 | |
| Optilab UT-rEX Differential Refractive Index Detector | Wyatt | WTREX-11 | |
| Perchloric acid | Aldrich Chemistry | 311421 | |
| Pipet Tips with Microcapillary for Loading Gels | Labcon | 1034-960-008 | |
| Polypropylene 96-Well Microplate, F-bottom, Chimney-style, Black | Greiner Bio-One | 655209 | |
| RapiFlour-MS Dextran Calibration Ladder | Waters Corporation | 186007982 | |
| Screw Top Clear Vial 2mL | Agilent Technologies | 5182-0715 | |
| Sodium Chloride | Fisher Scientific | S271-1 | |
| Sodium Iodide | Sigma Aldrich | 383112 | |
| TSKgel UP-SW3000 4.6mm ID x 30 cm L | Tosoh Biosciences | 003449 | |
| UNIFI Scientific Information System | Waters Corporation | 667005138 | |
| Vacuum Manifold Shims | Waters Corporation | 186007986 | |
| Vacuum Pump | Waters Corporation | 725000604 | |
| Xevo G2 Q-ToF | Waters Corporation | 186005597 | |
| Zeba Spin Desalting Column, 0.5 mL | Thermo Scientific | 89883 |
참고문헌
- . . Pharmaceutical cGMPs for the 21st Century: A Risk-Based Approach. , (2004).
- New Molecular Entity (NME) Drug and New Biologic Approvals. FDA Available from: https://www.dfa.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/DrugandBiologicAprrovalReports/NDAandBLAApprovalReports/ucm373420.htm (2015)
- Foltz, I. N., Karow, M., Wasserman, S. M. Evolution and Emergence of Therapeutic Monoclonal Antibodies. Circulation. 127, 2222-2230 (2013).
- Kondragunta, B., Drew, J. L., Brorson, K. A., Moreira, A. R., Rao, G. Advances in clone selection using high-throughput bioreactors. Biotechnology Progress. 26 (4), 1095-1103 (2010).
- Hmiel, L., Brorson, K., Boyne, M. Post-translational structural modifications of immunoglobulin G and their effect on biological activity. Analytical & Bioanalytical Chemistry. 407 (1), 79-94 (2015).
- Rathore, A. S. Roadmap for implementation of quality by design (QbD) for biotechnology products. Trends in Biotechnology. 27 (9), 546-553 (2009).
- . International Council for Harminisation of Techinical Requirements for Pharmaceuticals for Human Use. ICH. , (1999).
- Berkowitz, S. A., Engen, J. R., Mazzeo, J. R., Jones, G. B. Analytical tools for characterizing biopharmaceuticals and the implications for biosimilars. Nature Reviews Drug Discovery. 11 (7), 527-540 (2012).
- Velugula-Yellela, S. R., et al. Use of high-throughput automated microbioreactor system for production of model IgG1 in CHO cells. Journal of Visualized Experiments. , (2018).
- Largy, E., Cantais, F., Van Vyncht, G., Beck, A., Delobel, A. Orthogonal liquid chromatography-mass spectrometry methods for the comprehensive characterization of therapeutic glycoproteins, from released glycans to intact protein level. Journal of Chromatography A. 1498, 128-146 (2017).
- Yang, J. -. M., et al. Investigation of the correlation between charge and glycosylation of IgG1 variants by liquid chromatography-mass spectrometry. Analytical Biochemistry. 448, 82-91 (2014).
- Agarabi, C. D., et al. Bioreactor Process Parameter Screening Utilizing a Plackett-Burman Design for a Model Monoclonal Antibody. Journal of Pharmaceutical Sciences. 104 (6), 1919-1928 (2015).
- Wen, J., Arakawa, T., Philo, J. S. Size-Exclusion Chromatography with On-Line Light-Scattering, Absorbance, and Refractive Index Detectors for Studying Proteins and Their Interactions. Analytical Biochemistry. 240 (2), 155-166 (1996).
- Veurink, M., Stella, C., Tabatabay, C., Pournaras, C. J., Gurny, R. Association of ranibizumab (Lucentis) or bevacizumab (Avastin) with dexamethasone and triamcinolone acetonide: An in vitro stability assessment. European Journal of Pharmaceutics and Biopharmaceutics. 78 (2), 271-277 (2011).
- Li, Y., Weiss, W. F., Roberts, C. J. Characterization of high-molecular-weight nonnative aggregates and aggregation kinetics by size exclusion chromatography with inline multi-angle laser light scattering. Journal of Pharmaceutical Sciences. 98 (11), 3997-4016 (2009).
- Espinosa-de la Garza, C. E., et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis. 34 (8), 1133-1140 (2013).
- Han, H., Livingston, E., Chen, X. High throughput profiling of charge heterogeneity in antibodies by microchip electrophoresis. Analytical Chemistry. 83 (21), 8184-8191 (2011).
- Wheeler, T. D., et al. Microchip zone electrophoresis for high-throughput analysis of monoclonal antibody charge variants. Analytical Chemistry. 86 (11), 5416-5424 (2014).
- Carrillo-Cocom, L., et al. Amino acid consumption in naive and recombinant CHO cell cultures: producers of a monoclonal antibody. Cytotechnology. 67 (5), 809-820 (2015).
- Chen, P., Harcum, S. W. Effects of amino acid additions on ammonium stressed CHO cells. Journal of Biotechnology. 117 (3), 277-286 (2005).
- Xing, Z., et al. Optimizing amino acid composition of CHO cell culture media for a fusion protein production. Process Biochemistry. 46 (7), 1423-1429 (2011).
- Fan, Y., et al. Amino acid and glucose metabolism in fed-batch CHO cell culture affects antibody production and glycosylation. Biotechnology and Bioengineering. 112 (3), 521-535 (2015).
- Read, E. K., et al. Fermentanomics informed amino acid supplementation of an antibody producing mammalian cell culture. Biotechnology Progress. 29 (3), 745-753 (2013).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography. A. 1415, 83-90 (2015).
- Zhang, L., Luo, S., Zhang, B. Glycan analysis of therapeutic glycoproteins. MAbs. 8 (2), 205-215 (2016).
- Wahl, O., Holzgrabe, U. Amino acid analysis for pharmacopoeial purposes. Talanta. 154, 150-163 (2016).
- Le, A., Ng, A., Kwan, T., Cusmano-Ozog, K., Cowan, T. M. A rapid, sensitive method for quantitative analysis of underivatized amino acids by liquid chromatography-tandem mass spectrometry (LC-MS/MS). Journal of Chromatography B. 944, 166-174 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유