A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מתרגם הריבוכמה אהדה לטיהור (מלכודת) כדי לחקור את התפתחות השורש של הספר הבסיסי בקנה מידה ספציפי לסוג תא
In This Article
Summary
מתרגם הריבוכמה אהדה (מלכודת) מציעה את האפשרות לנתח תוכניות התפתחותיות עם עיבוד מינימלי של איברים ורקמות. הפרוטוקול מניב RNA באיכות גבוהה מתאים המיועדים עם חלבון פלורסנט ירוק (GFP)-יחידת משנה ריבוזומבית. כלים לניתוח במורד הזרם, כגון רביעיית-PCR או RNA-seq, חושפים פרופילי ביטויים ספציפיים לסוג תאים.
Abstract
במאמר זה, אנו מעניקים הוראות הידיים על מנת להשיג נתונים טרנסלסיים מסוגים שונים של השורש החדש של שורש השיטה באמצעות הריבותרגום האהדה (השמנה) שיטה ומיטוב רצופות הכנה לספרייה נמוכה.
כחומר מתחיל, אנו מעסיקים קווי צמחים לבטא GFP-tagged חלבון RPL18 באופן ספציפי סוג תא על ידי שימוש ביזמים נאותים. לפני החילוץ והפקת ה-RNA, הרקמה מוקפאת, השומרת על שלמות הרקמה ובמקביל מאפשרת ביצוע מחקרי סדרת זמן ברזולוציה גבוהה. בעיקר, מבנים קיר התא נשארים ללא פגע, אשר הוא חיסרון משמעותי בהליכים חלופיים כגון מיון המופעל על-ידי תאים בעלי קרינה פלואורסצנטית מבוסס הגישה הנשענת על רקמות לבודד אוכלוסיות תאים נפרדות. בנוסף, אין קיבעון רקמות הכרחי כמו לכידת לייזר מבוססי מיקרוניתוח טכניקות, אשר מאפשר RNA באיכות גבוהה לקבל.
עם זאת, דגימה מאוכלוסיות משנה של תאים ורק בידוד polysome הקשורים RNA מגביל באופן חמור תשואות RNA. לכן, יש צורך להחיל שיטות רגישות מספיק לספרייה לרכישת נתונים מוצלחת על-ידי RNA-seq.
השמנה מציעה כלי אידיאלי עבור מחקר הצמח כמו תהליכים התפתחותיים רבים כרוך תאים הקשורים לקיר ומכני איתות. השימוש ביזמים למקד אוכלוסיות תאים ספציפיות הוא גישור הפער בין איבר ורמת תא בודד, כי בתורו סובלים מרזולוציה קטנה או עלויות גבוהות מאוד. כאן, אנו להחיל את המלכודת ללמוד תקשורת תא התא במערך השורש הצדדי.
Introduction
מונע על ידי יישום הגוברת של טכניקות רצף הדור הבא, רזולוציה מרחבית בביולוגיה התפתחותית יכול להיות מוגבר. מחקרים עכשוויים מכוונים לניתוח רקמות למטה לסוגי תאים מיוחדים, אם לא ברמה אחת של תא1,2,3,4. למטרה זו, שפע של שיטות שונות המציאו במשך 50 השנים האחרונות (ראה איור 1a)5,6,7,8,9,10,11,12,13,14,15.
כלים רבים במדעי הצמח הינם עיבודים של טכניקות שהיו חלוץ במחקר בעלי חיים. זה לא המקרה לשיטה שאנו מציגים בפרוטרוט כאן. ב 2005, מצויד ברקע חזק בתרגום חלבון, מעבדה ביילי Serres להנדס ריבוזומלי חלבונים עבור האהדה הבאה טיהור16. לפיכך, הם יכולים להימנע מיצירת פרופיל רב פעמי ומעמיק לעבודה, אשר מבוסס על מעבר באמצעות שיפוע של סוכות ושימש להערכת תרגום הריבוזומים מאזשנות ה-60,18. השיטה מאז המכונה ריבולtional טיהור אהדה (מלכודת)16. לאחר לימודי העברה מוצלחים בצמחים, מלכודת היימן ואח ' לבעלי חיים19 ואחרים הרחיבו את היישום שלה ל-20שמרים, דרוסופילה21, קסנפוס22 ו-דג זברה23,24.
למרות השינוי הגנטי של מערכת המודל הוא תנאי מוקדם עבור השמנה, אשר מגביל את היישום שלה מינים הניתנים לטרנספורמציה גנטית, ניתן בו לרתום התנגדות זו כדי למקד את קבוצות המשנה של תאים, כי הם בעלי עניין מיוחד, ובכל זאת קשה מאוד לבודד מן הרקמה בשלמותה/איבר25 (למשל בצמחים, כל התאים מוחזקים במקומם דרך קירות התא היוצרים את הבסיס של שלד הידרוסטטי26. כדי לשחרר תא צמח ממטריקס זה, מדענים יש גם לחתוך פיזית את התא מתוך הרקמה המקיפה שלה דרך לכידת לייזר מיקרוניתוח (LCM)27 או ביצע העיכול אנזימטי של קירות התא28. בין התאים האחרונים, מה שנקרא פרוטואופרציה, האוכלוסייה של העניין היא בעלת תווית בדרך כלל וניתן להפריד באמצעות מיון תא המופעל על ידי קרינה פלואורסצנטית (FACS)7. LCM בדרך כלל דורש מדגם להיות קבוע מוטבע שעווה, אשר בסופו של דבר מתדרדר את האיכות של ה-RNA שלה29. FACS מבוססי שיטות להניב RNA באיכות גבוהה, אבל התהליך של protoplasting עצמו מציג הבדלים ביטוי גנים30 ורקמות עם קירות תא משני שונה ועבה הם לשמצה קשה לטפל. כמו-כן, מניחים על תהליכים התפתחותיים רבים בצמחים להסתמך על אותות מכנית ולכן השלמות של קיר התא היא בעלת חשיבות עליונה31. שתי שיטות, אשר להשתמש בקיצור דרך לעקוף בידוד התא על ידי הפעלה ברמה של נוקלאושני, הם מיון גרעיני המופעל באמצעות קרינה פלואורסצנטית (מאווררים) ובידוד של גרעינים מתויג סוגי תאים ספציפיים (שלמות). כמו במלכודת, הם משתמשים ביזמים ספציפיים לסוג תא כדי לסמן גרעינים, שלאחר מכן לקבל מועשר באמצעות מיון או למשוך למטה, בהתאמה8,15. האתגר העיקרי עבור כל הגישות הללו היא לקבל די חומר RNA מקבוצות המשנה של תאים ברקמה. כמו המלכודת לוכדת רק חלק של RNAs הסלולר, אוסף לדוגמה הוא צוואר בקבוק משמעותי. לפיכך, דרושות במיוחד פרוטוקולי הכנה לספריה הרגישים כדי להפיק נתונים באיכות גבוהה מכמויות קלט נמוכות.
מאז הקמתה, המלכודת כבר נעשה שימוש בשילוב עם מיקרו מערכים DNA או, כמו עלויות רצף ירד באופן משמעותי בשנים האחרונות, RNA-seq10,32,33. הרבה שאלות מחקר כבר הובהר כפי שנסקרו בסאבלוק ואח '.34. אנחנו משוכנעים כי דוחות יותר יעברו בשנים הקרובים כמו הטכניקה היא מאוד תכליתי בעת שילוב יזמים שונים כדי למקד סוגי תאים ספציפיים. בסופו של דבר, זה ייעשה גם בדרך inducible, והוא עשוי להיות משולב עם בדיקת תגובת הצמח לגורמי סטרס ביוטיים ובין רבים. בנוסף, כאשר קווים הטרנסגניים יציבה אינם זמינים, מערכות שעירות ביטוי השורש יש גם בהצלחה לבצע מלכודת עגבניות ותרופות35,36.
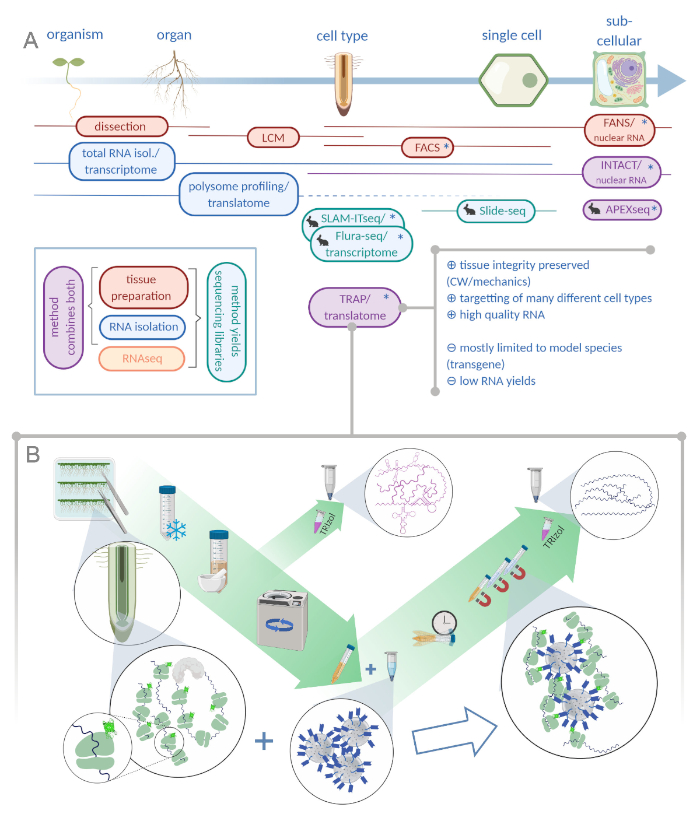
איור 1: מתרגם הריבוכמה אהדה (השמנה) משלים את תיק הניתוח "omics". A. הגדלת רמות של דיוק אנליטי, עד תא יחיד או אפילו ברזולוציה subcellular יכול להיות מושגת על ידי שפע של שיטות או שילובים מהם. התוכנית מעניקה סקירה של הכלים הזמינים כעת בתחום הצמח ובעלי החיים. אוסף רקמות ברזולוציה התאית יכול להיות מושגת על ידי פרוטוקולים כמו LCM או FACS, אשר מצמידים לאחר מכן להמרה סטנדרטי או polysome בדיקת פרופיל/translatome. מלכודת ושלמות לשלב לכידת רקמות בידוד RNA כפי שהם מבוססים על התיוג האפיפי. עם זאת, דגימות שלמות רק גרעיני התא ומהווה, לכן, מקרה מיוחד של ניתוח ההמרה. סמל ארנב קטן מסמן שיטות שפותחו לאחרונה בשדה בעלי חיים: בעוד סלאם-itseq ו flura-seq להסתמך על יקוד מטבולית של rnas מחדש עם שינוי אורציל בתאים ביטוי האנזים מאשרני, שקופית-seq עושה שימוש בשקופית זכוכית מצופה עם ברקודים DNA המספקים מידע מיקומני ב הגישה תיוג הקרבה מלווה איפקס-seq כדי לדגום RNAs בתאי subcellular ספציפיים. בעיקר, רזולוציה מוגברת לעתים קרובות דורש את הדור של החומר הטרנסגניים (כוכביות) ושיטות אלה משמשות בעיקר עבור מינים מודל. המלכודת מתאימה במיוחד עבור מדעי הצמח לימודי מעורבים קיר תא (CW) או איתות מכונאי, כמו גם מינים תאים שקשה לשחרר מתוך מטריצה CW שלהם. ב. מפורט שלבי המעבדה הרטובה של הליך המלכודת: השתילים מבטאים חלבון מתויג מסוג gfp בסוגים שונים של תאים (כגון אנדודרסיס שורש) גדלים על מנות פטרי במשך שבעה ימים וחומר שורש שנקטפו על ידי הקפאת ההקפאה. מדגם סה כ בקרת RNA נאסף מתוך תמצית גולמי הומוגניים לפני הפלטינג פסולת באמצעות צנטריפוגה. חרוזים אנטי-GFP מגנטיים נוספים לתמצית נקי לבצע immunoprecipitation. לאחר הדגירה ושלושה צעדים לשטוף, ה-RNA polysome הקשורים (מלכודת/polysome RNA) הוא קיבל ישירות באמצעות כלורופורם פנול-הכלורופורם. LCM: לכידת לייזר מיקרודיסקציה, FACS/אוהדים: תא מופעל על-ידי קרינה פלואורסצנטית/מיון גרעיני, איפקס-seq: שיטה המבוססת על הנדסה ascorbate peroxidase, שלמות: בידוד של גרעינים מתויג סוגי תאים ספציפיים, סלאם-ITseq: thiol (SH)-האלקילציה מקושרת עבור רצף חילוף החומרים של RNA ברקמות, Flura-seq: fluorouracil-התווית ברצף RNA (נוצר עם Biorender.com) אנא לחץ כאן כדי להציג
המטרה של מאמר זה היא לספק תיאור מפורט של שיטת TRAP, כדי להדגיש שלבים קריטיים ולספק הדרכה לשיטת הכנה לספריה אפשרית.
ניסוי המלכודת הגנרית יהיה למעשה מורכב השלבים הבאים (ראה גם איור 1B): (1) הכנת חומר הצמח כולל שיבוט של ריבוכמה תיוג בניית, הייצור קו טרנסגניים ובחירה, גדל ו bulking של זרעים, עיקור וציפוי, ומתח יישום/טיפול (אופציונלי) ו לקצור רקמות; (2) אימונופיקציה, כולל המגון רקמות וניקוי של תמצית גסה, שטיפת חרוזים ואימונופיקציה, ולשטוף את הצעדים; (3) הערכת הוצאת רנ א ואיכות; ו (4) הכנה לספרייה.
שורש arabidopsis כבר מערכת מודל ללמוד פיתוח הצמח מאז המבוא שלה כמפעל דגם37,38. כאן, היישום של המלכודת הוא לראווה בהקשר של פיתוח השורש הצמח לרוחב. בצמחים, הצטברות של מערכת השורש כולה מסתמך על ביצוע של תוכנית זו ולכן חשוב מאוד להישרדותו של האורגניזם39. באראידאופזיס, שורשי הצדדיים מקורם ברקמת כלקרום העור השוכנת ליד כלי הדם ולכן הוא כינה את המוט הקרום (xpp; ראה איור 2 ג)40. כמה תאים XPP, אשר נמצאים עמוק בתוך השורש, לרכוש זהות תא מייסד, על גורם הורמונלי מקומי, להתחיל להתרבות על ידי נפיחות וחילוק אנטיליבאלי41. עם זאת, בשל נוכחותם של מטריצת קיר נוקשה התא, תהליך זה מפעילה לחץ מכני על הרקמות הסובבות. בפרט, אנדודראמיס הנמצא במעלה מושפע, כפי שהוא בדרך של ציר צמיחה שורש לרוחב42,43,44. אכן, החדש הקמתה החדשה יהיה צריך לצמוח דרך התאים האנדודרסטיות האלה (איור 2c2) בעוד תאי הקליפה והאפידרמיס הם רק דחפו הצידה הפריבדיום לבסוף לצאת45,46. העבודה האחרונה במעבדה שלנו הראתה כי האנדודרסטיות תורמת באופן פעיל כדי להכיל את השגשוג בקרום הלב. חסימה ממוקדת של איתות הורמונלי אנדועורי מספיק כדי לעכב גם את החלוקה הראשונה מאוד בתאים XPP47. לפיכך, התקשורת האנדוציציסטית מהווה מחסום מוקדם מאוד לפיתוח השורש הרוחבי בערידרופזיס. עם זאת, לא ידוע כיצד מבוצע הוצלב הזה. כדי לפתור את התעלומה הזאת, אנחנו בחרנו את הגישה השמנה-seq כדי למקד את התאים XPP וכלי העורי. כדי להעשיר את התאים בתוכנית השורש לרוחב, אנו לחקה את הגורם ההורמונלי על ידי החלת באופן שונה היישום מערכת הקלה אנלוגי (1-נפלוג חומצה אצטית, NAA)48, אשר באותו זמן מותר לפתור באופן זמני את השלב הראשוני של היווצרות השורש הצדדי.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. שיבוט של טרנסגנים, ייצור ובחירה של קו טרנסגניים
- שיבוט המקדם של בחירה בווקטור הערך המתאים. השתמש בשיטת שיבוט מבוססת שילוב מחדש (טבלת חומרים) ושילוב מחדש של היזמים ב-PDONRP4-P1r. שיבוט RPL18 (עם תג האהדה או חלבון פלורסנט של בחירה) באמצעות שכפול מבוסס-מחדש בשילוב ב PDONRP1-P249.
- לשלב את וקטור ההזנה המכילה RPL18 עם וקטור הערך המכיל את היזם בשני הקטעים מחדש התגובה לתוך וקטור היעד המתאים עם מהיר-אדום בחירה הקלטת50 כדי להקל על מבחר ישיר של הזרעים טרנסגניים.
- לאמת את הווקטור המשולב מחדש ברצף ולהפוך אותו לאגרובריה מתאימה ומוכשרת. הפרח מטבל הפרחים מטבילה ואחרי 3-4 שבועות קציר ובחר הזרעים T151.
- השתמש במיקרוסקופיה כדי לזהות קווים מביעים היטב ולאמת תבניות ביטוי בהתאם לפעילות המקדם המדווחת בקווים עצמאיים מרובים. בחירת קווים המציגים תבנית של ביטוי מייצג עם הכנסת T-DNA יחידה. זה עשוי לעזור למזער את ההשתקה ויהיה יתרון עבור צלבים גנטיים.
- בחר צאצא T3 הhomozygous עבור הגן סמן.
2. התפשטות ועיקור
- השמנה ספציפית לסוג תא מבודדת RNA ממספר מצומצם של תאי יעד לכל שורש. כדי להפיק את חומר ההתחלה הדרוש, הפץ את homozygous קווים. לשם כך, השתמש בתנאי גדילה סטנדרטיים עם דגש מיוחד על בקרת גדילה פטרייתי.
הערה: אם לא ניתן להשיג קווי הכנסה בודדים, יש לגדל אצוות באוכלוסיות גדולות במשך מספר דורות כדי למנוע השתקה של הדוריות ה-DNA. - לחטא כמויות גדולות של זרעי Arabidopsis עם סיבוב אחד של גז כלור וסיבוב אחד של 70% אטוח.
- הפיצו זרעים באופן שווה על 12 ס"מ x 12 ס מ מנות פטרי מרובעים (פחות מ 0.3 מ"ל זרעים/צלחת) ומערימה אותם לתוך desiccator או מיכל מתאים אחר. הימנע היווצרות מקבץ או ערימה כמו הזרעים צריך להיות נגיש לגז. ביצוע גז עיקור לילה עם מלבין ואמצעי אחסון של HCl כפי שדווח52: 100 mL של אקונומיקה (13%) עם 6 מ ל של conc. HCl ב 60 L desiccator. לפחות 1 לפני איסוף הזרעים במיכל סטרילי.
התראה: 37% HCl הוא מאוד מאכל ודורש טיפול זהיר. , גז כלור רעיל. תשתמש במכסה המנוע - קח 0.1 mL של יבש, גז מעוקר זרעים לצלחת ולערבב אותם עם הפתרון עיקור (70% אטוח, 0, 01% הרצף) בטמפרטורת החדר. דגירה של 20 דקות, decant אטוח ולשטוף את הזרעים 3-4 פעמים עם ה-H סטרילי2O.
- העבר את הזרעים ספוגים לצינורות 50 mL ולדלל עם סטרילי 0.1% אגר כדי לקבל 1 מ ל של לספוג את זרעי שתיית לוחית (0.1 mL seed/1 mL לשהול).
הערה: בשל אירועי אינטגרציה טרנסגנטית, קווי הצמח עלולים להיות רגישים לטכניקות עיקור שונות; במיוחד זמן הדגירה של אטוח נמצא במצב קריטי. בידינו, שלבי העיקור הכפולים היו נחוצים כדי להימנע מזיהום פטרייתי במהלך הניסויים. זה חשוב במיוחד בעת ביצוע סדרת זמן כזיהום של נקודת זמן אחת הסלים את הניסוי כולו. ייתכן שאין צורך בעיקור כפול, בהתאם לתנאים הגדלים המקומיים.
- הפיצו זרעים באופן שווה על 12 ס"מ x 12 ס מ מנות פטרי מרובעים (פחות מ 0.3 מ"ל זרעים/צלחת) ומערימה אותם לתוך desiccator או מיכל מתאים אחר. הימנע היווצרות מקבץ או ערימה כמו הזרעים צריך להיות נגיש לגז. ביצוע גז עיקור לילה עם מלבין ואמצעי אחסון של HCl כפי שדווח52: 100 mL של אקונומיקה (13%) עם 6 מ ל של conc. HCl ב 60 L desiccator. לפחות 1 לפני איסוף הזרעים במיכל סטרילי.
3. ציפוי
- הכינו את הצעדים הבאים מראש. יוצקים 1/2 MS לוחות (pH 5.8) עם 1% אגר בכמויות הדרושות לניסוי (20-30 לכל מדגם/נקודת זמן). גזור 1 מ ל פיפטה טיפים כדי להגדיל את קוטר הטיפ כדי ca. 3-4 mm עם להב תער. . לעשות באוטוקלב את הטיפים צור מחזיק תבנית לציפוי שלוש שורות של זרעים לצלחת עם מכסים מרובעים של צלחת פטרי. הכן מכסה זרימה למינארי כדי לספק סביבת עבודה סטרילית ותייג את הלוחות שיעובדו.
הערה: אם הצלחות רבות מעובדות באותו זמן, תוויות צבעוניות יכול להאיץ את התיוג. - מניחים לוחיות ריק אגר לתוך מחזיק התבנית ולהפיץ 1 מ ל של לספוג זרעי באופן שווה על שלוש שורות. הניחו את הלוחות המעובדים בערימות לתוך הזרימה הבינכבתית עד שהזרעים יבשים (כלומר, היצמד למשטח אגר). אין להשאיר את הצלחות יותר כמו אגר יהיה להתייבש גם.
- לאחר הזרעים הם יבשים מספיק, לסגור את העפעפיים ולאטום כל צלחת עם קלטת מיקרופור. שפכו את הזרעים ליומיים ב -4 ° c בחשכה ואחר כך מניחים אותם לתוך חדר גידול.
4. טיפול ברקמה (אופציה)
הערה: בפרוטוקול זה, אנו מתווה את הטיפול האקסוגני של שורשי האראדזיס עם האוקמין הסינתטי והמשתנה naa. בהתאם לשאלה הניסיונית בהישג יד, חלק זה צריך להיות מותאם או יכול להיות מושמט לחלוטין.
- להכין רצועות של נייר טישו של 1.5-2 ס"מ גובה ו 10 ס מ אורך. זמני הדגירה המורחבת דורשים את הרקמה להיות אוטוקלבד לפני השימוש.
- להסיר את הקלטת מיקרונקבובית מכל הצלחות כי יש לעבור את הטיפול הורמונלי. לדלל 1 מ ל של 10 מ"מ naa (מומס dmso) ב 1 L של נוזל, בלוק 1/2 MS פתרון (pH 5.8) ולהשרות את הנייר טישו בפתרון (10 μm naa).
- השתמשו בפינצטה להחלת רצועת נייר טישו על כל שורה של שורשים. בעדינות להשתמש באצבעות כדי להסיר בועות אוויר. רוקן את הנוזל העודף מהצלחת, לסגור את המכסה ולתייג את הצלחת עם הזמן. לזמן דגירה המורחבת, למקם את הצלחות בחזרה אל חדר הגידול.
5. קציר
- אחזר צלחות עבור כל שכפול/נקודת זמן ביולוגית/טיפול. לאסוף חנקן נוזלי בכלי הקיבול נקי Dewar ומתייג צינורות (15 או 50 mL) עבור דגימות רקמות שונות. הכן מחזיק קלקר.
התראה: להכיר את ההליכים חנקן נוזלי טיפול (aeration, frostbites, שעלולים להתפוצץ צינורות). - פתח את הצלחת ולהסיר את הנייר טישו עם מלקחיים, להיות זהירים לא לנתק את השורשים מפני השטח אגר. עם להב כירורגי, גזור פעם אחת בכל שורה לאורך הצומת לירות-שורש בשבץ יחיד, נחוש. לנקות את הלהבים בין דגימות להחליף לעתים קרובות כדי להבטיח חדות.
- עם מלקחיים, לסחוב לאורך שורשי כל שורה כדי לאסוף אותם בשלוש חבילות. תפוס את השורשים ולרוקן אותם לתוך צינור 50 mL מלא חנקן נוזלי כדי לשבור את ההקפאה.
הערה: אל תנסו להרכיב שורשים לתוך מבנים צפופים (כמו כדורים) כפי שהם קשה לטחון בשלב הבא. - המשך עם כל הלוחות המהווים מדגם אחד (לפי סדר זמני הדגירה) ויוצקים חנקן נוזלי עודף. השתמשו במכסה הצינורית כדי למנוע מהשורשים להישפך. ואז לסגור את המכסה ולאסוף את כל הצינורות בכלי Dewar. אחסן את רקמת השורש ב--80 ° c.
6. אימונואופוריפיקציה
הערה: שלב זה נועד להשיג באיכות גבוהה השמנה/polysome RNA. לכן, בקפדנות לבצע ייעוץ טוב לטיפול RNA. בצע את כל השלבים בסעיף זה בספסל סטרילי ונקה את כל הציוד ו-עבדה אספקה עם פתרון rnase-הסרת (טבלת חומרים). ללבוש כפפות ולשנות אותם מיד כאשר מזוהמים עם מדגם, קרח, או מקורות אחרים שלא נוקו. מאז זהו היבט מכריע מאוד, מקטע על השימוש בציוד שימוש חוזר יחד עם הייעוץ לסילוק אשפה כלולה.
- הכנת מאגר
- הכינו פתרונות מלאי בהתאם לטבלה 1 ולחיטוי (A) או לסינון מסנן (₳). אלא אם צוין אחרת, הממס הוא RNase-מים ללא תשלום.
- התמוססות והממיסים (DTT), פנילמתיל פלוקסיל, ו-כלורמפאנקול (CAM), בממסים המתאימים להם כפי שמצוין בטבלה 1 ואחסנו אותם ב-20 ° c. כל המניות האחרות. יכולות להישאר בטמפרטורת החדר
- טרום לערבב את המניות-עם מרכיבים 1-4 עבור לשטוף מאגר (WB) ו 1-6 עבור polysome מאגר החילוץ (PEB)-כדי למנוע ערבוב זמן מאגר לפני כל החילוץ. לכן, רק להוסיף מים ומרכיבים קפואים (7-10) ביום של החילוץ. שמרו על מניות טרום מעורבות ו-RNase-מים ללא תשלום ב -4 ° c.
הערה: ריכוז DTT הוא 1/5 של הריכוז המדווח של Zanetti ואח ' 2005, כמו האינטראקציה ננוbody עם GFP הוא רגיש לריכוזי DTT גבוה.
| רכיבים | ריכוז מניות | הוסף נפח ב-mL עבור 50 mL של WB * | הוסף נפח ב-mL עבור 50 mL של PEB * | ||
| 1 | טריס, pH 9 | קצת | 2 מטרים בלבד | מיכל 5 | מיכל 5 |
| 2 | אשלגן כלורי | קצת | 2 מטרים בלבד | מיכל 5 | מיכל 5 |
| 3 | מיכל בגין | קצת | 0.5 מ ' | 2.5 | 2.5 |
| 4 | מיכלהשני | קצת | 1 מדיום | 1.75 | 1.75 |
| מיכל 5 | PTE | קצת | 20% (v/v) | 0 | 2.5 |
| 6 | תערובת חומרי ניקוי | קצת | 0 | 2.5 | |
| היחידה 20 | 20% (v/v) | ||||
| טריטון-X 100 | 20% (v/v) | ||||
| בריל-35 | 20% (w/v) | ||||
| איגפל | 20% (v/v) | ||||
| 7 | DTT | ₳ | 0.5 מ ' | 0.1 | 0.1 |
| 8 | PMSF | ₳ | 0.1 M (אלכוהול איזופרופיל) | 0.5 | 0.5 |
| 9 | ציקלוהexiמיד | ₳ | 25 מ"ג/mL (אטוח) | 0.1 | 0.1 |
| 10 | כלורמפניקול | ₳ | 50 מ ג/mL (אטוח) | 0.05 | 0.05 |
טבלה 1: הרכב מאגר ועצות ערבוב. החומרים עם ריכוזי מניות נתון מעורב בכמויות נתון תשואה 50 mL של WB או PEB. טריס: טריס-(הידרוקסימתיל)-אמימתאן, EGTA: אתילן גליקול-bis (β-עמינח האתר)-N, n, N '-טטרה-חומצה אצטית, PTE: Polyoxyethylene-(10)-tridecyl אתר, א: אוטוקלב, ₳: מסנן לחטא; * מילוי עד 50 mL עם מים חינם RNase.
- רקמת הומוגון/שיוף
- קריר צנטריפוגה למטה ומניחים הומוזים וצינורות צנטריפוגה על הקרח. הפשרה של DTT, PMSF, CHX ו-CAM. מערבבים PEB ו WB מתוך פתרונות המניה בצינורות 50 mL לפי דרישות היום (של דגימות) וקריר על הקרח.
הערה: הוסף PMSF רק זמן קצר לפני השימוש, כמו מחצית החיים של PMSF במים הוא רק 30 דקות. - הכינו הרבה חנקן נוזלי בכלי מלחמה ואחזר דגימות רקמה מ-80 ° c. לחבוש כפפות כותנה מתחת לכפפות מעבדה רגילה כדי למנוע כוויות מפגזים קר. יוצקים חנקן נוזלי למרגמות וקוצים עד שהם קרים מספיק כדי לאפשר שחיקה. מומלץ לתכנן מערכת כדי להבחין בין מרגמות (תווית או לשמור בסדר מסוים).
- דגימת רקמה ריקה לחומר מליטה וטוחנים בזהירות עד שכל החומר הוא אבקה לבנה. במידת הצורך, להוסיף חנקן נוזלי כדי לשמור על הרקמה קפוא או כדי להקל על שחיקה טובה יותר.
- הוסף 5 מ ל של PEB למדגם במהירות לערבב עם האבקה לפני המאגר קופא. בעוד לדוגמה זו הטיה (לערבב מדי פעם) תהליך דגימה נוספת.
- ברגע שניתן להעביר את התערובת, לרוקן את הניעור לתוך זכוכית הומוגניזה ולשמור על קרח. עם תוספת של 2 מ ל של PEB, שטוף את החומר המליטה והזיפים והוסיפו אותו למדגם בתוך ההומוגניזה.
הערה: הימנע ממדגם נוזלי לחלוטין שכן זה מאפשר השפלה RNA. - לטחון את המלא באופן ידני עד התמצית היא הומוגנית. אנו ממליצים על מינימום של 4 כדי 5 צולל.
הערה: ייתכן שיידרש זמן המתנה נוסף כדי לאפשר לשאיפה להפשיר עוד יותר. הטיפול של המסטרים מחייב התמדה. אל תחיל בכוח הזרוע והיזהר מכוחות היניקה. אם לא נלקח בחשבון, זה יוביל לניקוז, זיהום או הרס של ההומוגניצר. - יוצקים את תמצית השורש הגולמי לתוך צינורית צנטריפוגה 50 mL (לשמור על קרח).
הערה: בדרך כלל ניתן לקרקע מספר דגימות לפני ההעברה. נדרש טיפול מקבילי בטחינת, העברה והומוגניזציה. נסה לעבוד מהר אבל לא למהר; . הישארי רגועה תמיד שומרים דגימות. מומוגניים על הקרח
- קריר צנטריפוגה למטה ומניחים הומוזים וצינורות צנטריפוגה על הקרח. הפשרה של DTT, PMSF, CHX ו-CAM. מערבבים PEB ו WB מתוך פתרונות המניה בצינורות 50 mL לפי דרישות היום (של דגימות) וקריר על הקרח.
- סה כ אוסף לדוגמה RNA
- העברת 200 μL של כל דוגמית גסה לצינור מיקרוצנטריפוגה נקי (המסומן והתקרר על הקרח מראש).
- להמשיך עם החילוץ RNA כמפורט עבור דגימות השמנה בנקודות 7.1 ו 7.2. בצע את השלבים הבאים תוך כדי ניקוי של דגימות בצנטריפוגה.
- בצע טיפול DNase עם רנ א הכולל מחדש כדי לחסל את הזיהום DNA ולנקות את התגובה באמצעות ערכה מסחרית (טבלת חומרים).
הערה: הכולל של RNA שעקירות בדרך כלל תשואה ריכוזים גבוהים ודגימות צריך להיות מדולל באופן משמעותי. אנו ממליצים למדוד את הריכוז לאחר דילול על ידי פרוטוקול Qubit רגיש.
- ניקוי התמצית הגולמי
- קח את דלי הקרח עם דגימות מ 6.2.7 ו צנטריפוגה אותם עבור 15 דקות ב 16,000 x g ו 4 ° c.
הערה: כדי לאזן את הצנטריפוגה, הצמד דגימות בהתאם. במידה והדבר אינו אפשרי לחלוטין, התאם דוגמה אחת על-ידי הוספת PEB. - יוצקים את הסופרנטאנט לצינור צנטריפוגה טרי (מקורר על הקרח מראש) וחזור על צנטריפוגה (15 דקות ב-16,000 x g ו-4 ° c). ניתן לבצע העברה זו במהירות ליד הצנטריפוגה.
- בעוד התמצית גולמי הוא ניקוי, ליזום כביסה של GFP חרוזים עבור שלב 6.6.
הערה: לשמור על זה דלי קרח על נדנדה על שייקר, אבל לא למקם חזרה לתוך הספסל סטרילי כפי שהוא עלול להיות מזוהם.
- קח את דלי הקרח עם דגימות מ 6.2.7 ו צנטריפוגה אותם עבור 15 דקות ב 16,000 x g ו 4 ° c.
- שטיפת חרוזים
- מגנטים מגנטיים GFP-חרוזים (#samples x 60 μL, לוח חומרים) לתוך שפופרת 1.5 mL. . מניחים על העמדה המגנטית , לאחר שהחרוזים נאספו. הסר את הסופרנטאנט
- להוסיף 1 מ ל של WB קר, להשהות מחדש את החרוזים ולאסוף אותם שוב. מחק את מאגר הכביסה וחזור שוב עם 1 מ ל של WB.
- בסופו של דבר, השהה מחדש את החרוזים ב-WB לאמצעי האחסון הראשוני המשמש בשלב 6.5.1.
- אימונואופוריפיקציה (IP)
- מיד לאחר צנטריפוגה, שופכים את supernatant מנוקה לתוך תווית 15 מ ל צינורות ולהוסיף 60 μL של חרוזים שנשטפו לכל מדגם.
- מניחים את כל הדגימות אופקית לתוך דלי הקרח ולשים אותו על שייקר. תן את התערובת דגירה עבור 2 h כדי לאגד את הפוליזומים מתויג GFP לחרוזים.
- לאסוף את החרוזים על המעמד המגנטי עבור 15 צינורות mL (על הקרח) ולהוסיף PMSF כדי PEB הנותרים. . מחק את הסופרנטאנט יוצקים כ 5 מ ל של PEB לחרוזים להשעות אותם מחדש על ידי הטיה. טלטל את הדגימות עבור 15 דקות באותה הגדרה כמו בסעיף 6.6.2.
- חזור על שוטף עם WB ל סך של 3 שוטף (1 x PEB, 2 x WB). לפני כל החלפת מאגר, הוסף PMSF.
- לאסוף את החרוזים ב 1 מ ל WB ו להעביר אותם לצינור 1.5 mL. לבסוף, לאסוף את החרוזים פעם נוספת על המעמד המגנטי ולהסיר את כל נוזלי. סגור את השפופרת ושמור על הקרח עד שכל הדגימות יעובדו.
- מובילים את הדגימות למנוע. הוצאת רנ א
- סילוק פסולת. והתניה מחדש של ציוד מעבדה
- אם התבצע על פי מעבדת מעבדה טובה (ראה סעיף 2.2.1), תהליך העיקור מניב פתרון מימית. השאירו את הגז כלור, כמו גם השאריות של HCl ומלבין, כדי לתדלק את המנוע.
- לסילוק PEB ו-WB: כמו CHX מפרקת ב-pH גבוה, לאסוף את כל הנוזלים ולהביא pH > 9. היפטרו מפסולת הנוזל. בפסולת הכימית של הלוגגנציה כל מוצקים (רקמות, פיפטות סרולוגית, כפפות, וכו ') צריך להיות מסולק כמו פסולת כימית.
- איסוף נוזלים המכילים פנול בנפרד, כמו גם החומר מזוהם-פנול (טיפים, צינורות וכפפות).
- שטיפת ידיים מרגמות, קוצים והומוגון (ספוגים ומברשת) עם סבון ולשטוף היטב. לאחר מכן אופים את החומר ב-> 220 ° c בלילה. או לעטוף בנייר כסף לפני הטיפול או המקום לתוך מכולה חסינת חום, מכוסה.
- מברשת צינורות צנטריפוגה נקי עם חומרי ניקוי ולאחר מכן diethylפחמתי (DEPC)-לטפל במנוע. לשם כך, להוסיף הנוזל DEPC נוזלי למים מיונלים (1 מ ל של DEPC ל 1 L של H2O) ומערבבים דרך טלטול. מניחים את צינורות הצנטריפוגה על מגש אוטוקללתי הפוך כי תופס שנשפך המים DEPC. יוצקים את ההשעיה לתוך הצינורות וללכת 3 שעות או לילה. DEPC מפרקת בתהליך האוטוקלינג הבאים.
התראה: DEPC הוא רעיל מאוד.
7. הוצאת רנ א ומקוו
- הוצאת רנ א
- מצננים את הצנטריפוגה לשולחן עד 4 ° c.
- להוסיף 1 מ ל חומצה-guanidinium-פנול מבוססי מגיב (טבלה של חומרים) לכל מדגם, להפוך כדי להשעות את החרוזים או מוחלטת RNA ללגום ו-דגירה עבור 5 דקות על הקרח. ! אל תעשה מערבולת
- הוסף 200 μL של כלורופורם ו-דגירה עבור 3 דקות על הקרח. ואז ביסודיות מערבולת את הדגימות.
- , כדי לסייע להפרדת הפאזה. צנטריפוגה במקסימום מהירות עבור 10-15 דקות, 4 ° c.
- תווית 1.5 mL נמוך החזקת צינורות (טבלת חומרים) ו סדרת מחלקים 650 μl של איזופנול לתוך כל.
- בזהירות לקחת את השלב העליון מימית (ca. 650 μL) ולהעביר את הצינורות המוכנים עם איזופנול. הימנע לגעת בשלב אורגני ורוד.
- מזרז RNA לילה ב-20 ° c.
הערה: מומלץ לאחסן את הדגימות באיזופנול ב-20 ° c או-80 ° c ומסיסות רק במים בעת הצורך. המים ממים ממים גם ב-80 ° c כאשר מאוחסן במשך שבועות/חודשים.
- משקעים ברנ א
- מצננים את הצנטריפוגה לשולחן עד 4 ° c.
- הכינו טרי 80% אטוח עם מים ללא RNase והקרירים ב-20 ° צ' (5 דקות ב-80 ° c לזרז את התהליך).
- צנטריפוגה את הדגימות במהירות מקסימלית (ca. 13,000 x g) עבור 30 דקות ולהיפטר supernatant. הגלולה לא תהיה גלויה, כך פיפטה בזהירות כאילו היה שם. להוסיף 1 מ ל של קר 80% אטוח ולהפוך את השפופרת 1 או 2 פעמיים.
- צנטריפוגה שוב עבור 30 דקות במהירות מקסימלית ולחזור על לשטוף סכום כולל של שני שטיפת.
- ספין למטה עבור 2 דקות ולהסיר את כל שרידי אטוח עם 10 μL טיפ. השאר את הגלולה יבש עבור 3-5 דקות (לא יותר) בטמפרטורת החדר ולהשעות מחדש ב 20 μL RNase-מים בחינם.
- שמור את הדגימות על קרח ולבצע בקרת איכות בהקדם האפשרי. המשך לאחסן את הדגימות ב-80 ° c. הימנע מחזורי הפשרת הקפאה.
- בקרת איכות באמצעות ציוד ייעודי (טבלת חומרים) לפי המלצות היצרן.
8. הכנת הספרייה
- cDNA סינתזה והגברה עם v4 חכם במיוחד כניסה נמוכה RNA Kit
- לחשב את הדילול של כל מדגם כדי להיות 1.5 ng של מלכודת-RNA או כולל RNA בנפח של 4.75 μL. לבצע את כל התגובות ב-PCR-צינוריות ולדלל דגימות עם ali, טריים של מים חינם RNase.
- בצע את כל השלבים בהתאם להמלצות של היצרן עם 1/2 את אמצעי התגובה. ההגביר את מעגלי הדנ. עם 12-13 מחזורי ה-PCR
- נקה את ה-PCR על ידי הוספת 0.5 μL של מאגר הליזה 10x ו -25 μL של חרוזי SPRI (טבלת חומרים). אם דגימות רבות מאגר הליזה מעובד וחרוזים יכול להיות מעורב מראש. ודא כי החרוזים הם התפזרו באופן שווה לפני ליטוף.
- המשך עם הפרוטוקול באמצעי התגובה המלאה (17 μL של מאגר הימנעות). אל תתנו לחרוזים להתייבש למשך יותר מ 3 דקות. דגימות מיובשות יתר יכול להיות שחולצו על ידי פעמים דגירה ממושכת.
- למדוד את ריכוזי המדגם עם ערכת ה-DNA Qubit HS.
הערה: ערכת ה-v4 החכמה יותר יכולה לסבול את הקלט 200 pg. הצלחנו להשיג ספריות במקרים בהם לא היתה אפשרות לקבוע ערכי Qubit (מתחת 250 pg, מגבלת זיהוי) עם ה-PCR מחזור 16. עם זאת, חומר הקלט המוגבל עשוי גם להניב פחות ספריות מורכבות.
- מערכת פיצול והקשר מתאם PCR עם הכנת הספריה של ה-DNA של Nextera
- לדלל את cDNA עם RNase-מים ללא תשלום כדי לקבל ריכוז של 200 pg/μl ו פיפטה 1.25 μL ב-PCR-tube.
- בצע את כל השלבים על פי היצרן עם 1/4 את אמצעי התגובה. ההגביר את ה-Dna עם 12 מחזורי PCR ומתאמים תואמים לדגימות השייכות למאגר אחד ברצף. עם המדד של המאייר ערכות A ו-D עד 384 דגימות יכול להיות מרובב.
- עבור ה-PCR לנקות להוסיף 12.5 μL של מאגר resuspension ו 22.5 μL של חרוזי SPRI (0.9 x יחס). המדגם עם 22 μL של מאגר הימנעות.
הערה: ה-QC והאיגוד בוצעו על ידי החברה ברצף (טבלת חומרים) ולכן לא היה צורך בנורמליזציה מבוססת חרוז. תגובת הפיצול האנזימטית רגישה מאוד לקלט חומרי, כמו כל אנזים שחותך רק פעם אחת. לכן, לא יעלה על המלצת הריכוז.
Access restricted. Please log in or start a trial to view this content.
תוצאות
להערכת איכות, ההליך הנ ל צריך להיות נחקר בשלבים ביניים מספר: אימות תבנית ביטוי בplanta, בקרת איכות של RNA polyזומבית מבודדים כמו גם של ספריות הסופי. רביעיית ה-PCR משתמש בגנים הידועים של סמן יכול, בנוסף, להתבצע כדי לאשר את התגובה למצב הטיפול או כדי לכוונן את התנאים הניסיוניים.
Access restricted. Please log in or start a trial to view this content.
Discussion
אימות תבנית הלוקליזציה של RPL18
חיוני כדי למנוע פרשנות של נתונים מכל ניסוי השמנה היא תבנית הביטוי הנכון של יחידת המשנה הריבוזומתית המתויג. לכן, שילוב של GFP כמו תג אפירופה ל RPL18 מאוד באלגנטיות מאפשר אימות של דפוס הביטוי הרצוי ברציפות, מתחת השבר polysome מן הרקמה אותה. גישות פולשנית יותר ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
היינו רוצים להודות ז ' אן קלוד וואלזר של המרכז גיוון גנטי ציריך עבור ייעוץ מומחה מכריע בשלב מוקדם של פרויקט זה. העבודה במעבדה ורמר נתמך על ידי מענק מפרופסור SNF (PP00P3_157524) ו R' צייד ציוד מענק (316030_164086) מן הקרן הלאומית המדע השוויצרי (SNF) הוענק JEMV.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Sterilization | |||
| bleach, 13% | Sigma | 71696 | |
| beaker | VWR | 214-1172/74/75 | |
| desiccator with porcelaine plate (DURAN) | Sigma/Merck | Z317454-1EA/Z317594-1EA | |
| EtOH, p.a. | Honeywell | 02860-1L | |
| HCl, 37% | Roth | 4625.1 | |
| Tween 20 | Sigma | P9416 | |
| Plate growth + harvesting | |||
| MS salts, basal salt mixture, incl. MES buffer | Duchefa | M0254 | |
| agar plant for cell culture | Applichem/Panreac | A2111.1000 | |
| DMSO | Sigma | D4540 | |
| forcepts | Rubis Switzerland | 5-SA model | |
| KOH | Fluka | 60370 | |
| micropore/surgical tape | 3M | 1530-0 | |
| NAA | Duchefa | N0903 | |
| petri dishes 120x120 mm | Greiner bio-one | 688102 | |
| scalpel | VWR/Swann-Morton | 233-5454 | |
| tissues, neutral, two-layered | any supplier of your choice | ||
| Immunoprecipitation | |||
| GFP-beads: gtma-100 GFP-Trap_MA | Chromotek | e.g. gtma-100 | |
| Brij-35 | Sigma | P1254-500G | |
| centrifuge tubes (in accordance with centrifuge) | Beckman Coulter | 357001 | |
| Chloramphenicol | Applichem | C0378-25G | |
| cotton gloves | VWR | 113-7355 | |
| Cycloheximide, HPLC grade | Sigma | 01810-1G | |
| DEPC | VWR | E174 | might have long delivery times |
| DTT | Fluka | 43815 | |
| EGTA | Sigma | 3054.3 | |
| homogenizers DUALL 23 | KONTES GLASS CO (via VWR) | SCERSP885450-0023 (set) | SCERSP885451-0023 pestle only - SCERSP885452-0023 cylinder only; long delivery times |
| Igepal CA-360 | Sigma | I3021-100ml | |
| KCl | Sigma | 60130 | |
| MgCl2 hexahydrat | Roth | 2189.2 | |
| mortar and pestle | VWR | 470148-960 & 470019-978 | |
| PMSF | Roche | 10 837 091 001 | |
| Polyoxyethylene-(10)-tridecylether/PTE | Sigma | P2393-500G | |
| RNase-free water | Roth | T143.3 | |
| RNAZap | Thermo Fisher | AM9780/AM9782 | for cleaning surfaces |
| Tris, >99.3% | Roth | AE15.3 | |
| Triton X-100 | Fluka | T8787-250ml | |
| Tween 20 | Sigma | P9416-100ml | |
| RNA extraction | |||
| 2-Propanol, p.a. | Sigma | 33539-1L-GL-R | |
| Chloroform, HPLC grade | Scharlau | CL02181000 | |
| EtOH, p.a. | Honeywell | 02860-1L | |
| low-retention microcentrifuge tubes, 1.5 ml | Eppendorf/Sigma | Z666548-250EA | LoBind |
| RNase-free DNase set | Qiagen | 79254 | |
| RNeasy MiniElute Cleanup Kit | Qiagen | 74204 | |
| TRIzol reagent | ThermoFisher/Ambion | 15596018 | |
| Library preparation | |||
| 15/50 mL Tube Magnetic Separator | Abraxis | PN 472250 | |
| AMPure beads | Beckman Coulter | A63881 | |
| Index Kit A | Illumina | FC-131-2001 | |
| Index Kit D | Illumina | FC-131-2004 | |
| neodymium magnets | Amazon/other | 6 x 1.5 mm range: N42 (NdFeB) | |
| Nextera XT kit | Illumina | FC-131-1024/1096 | https://emea.support.illumina.com/ |
| PCR strips | ThermoScientific | AB-0266 | |
| SMARTer v4 kit | Takara Bioscience | 634892 | https://www.takarabio.com/ |
| Bioanalyzer | Agilent | 2100 Bioanalyzer Instrument | specialized equipment for RNA/DNA quality control |
| Tapestation | Agilent | 4200 Tapestation Instrument | specialized equipment for RNA/DNA quality control |
| Fragment Analyzer | Agilent | 5400 Fragment Analyzer System | specialized equipment for RNA/DNA quality control (high throughput) |
| LabChip | PerkinElmer | LabChip GX Touch Nucleic Acid Analyzer | specialized equipment for RNA/DNA quality control (high throughput) |
| Qubit 4 Fluorometer | ThermoFisher | Q33239 | specialized equipment for RNA/DNA concentration determination |
| qRT-PCR | |||
| GATA23 | Microsynth | fwd: AGTGAGAATGAA AGAAGAGAAGGG; rev: GTGGCTGCGAAT AATATGAATACC | |
| GH3.3 | Microsynth | fwd: CAAACCAATCCT CCAAATGAC; rev: ACTTATCCGCAA CCCGACT | |
| LBD29 | Microsynth | fwd: TCTCCAACAACA GGTTGTGAAT; rev: AAGGAGCCTTAG TAGTGTCTCCA | |
| UBC21 | Microsynth | fwd: TGCGACTCAGGG AATCTTCT; rev: TCATCCTTTCTT AGGCATAGCG | |
| SsoAdvanced Universal SYBR Green | Bio-Rad | #172-5270 | |
| iScript Adv cDNA Kit | Bio-Rad | #172-5038 | |
| miscellaneous | |||
| Falcon tubes 15 ml, Cellstar | Greiner bio-one | 188261 | |
| Falcon tubes 50 ml, Cellstar | Greiner bio-one | 210261 | |
| filter tips 1 ml | Axygen | TF-1000-R-S | |
| filter tips 10 µl | Axygen | TF-10-R-S | |
| filter tips 100 µl | Axygen | TF-100-R-S | |
| filter tips 20 µl | Axygen | TF-20-R-S | |
| filter tips 200 µl | Axygen | TF-200-R-S | |
| microcentrifuge tubes 1.5 ml | SARSTEDT | 72.690.001 | |
| Propidium iodide | Sigma | P4170-100MG | |
| sequencing company | Novogene | en.novogene.com |
References
- Van Verk, M. C., Hickman, R., Corné, M. J., Pieterse, M., Van Wees, S. C. RNA-Seq: Revelation Of The Messengers. Trends In Plant Science. 18 (4), 175-179 (2013).
- Libault, M., Pingault, L., Zogli, P., Schiefelbein, J. Plant Systems Biology At The Single-Cell Level. Trends In Plant Science. 22 (11), 949-960 (2017).
- Mustroph, A., et al. Profiling Translatomes Of Discrete Cell Populations Resolves Altered Cellular Priorities During Hypoxia In Arabidopsis. Proceedings Of The National Academy Of Sciences Of The United States Of America. 106 (44), 18843-18848 (2009).
- Karve, R., Iyer-Pascuzzi, A. S. Digging Deeper: High-Resolution Genome-Scale Data Yields New Insights Into Root Biology. Current Opinion In Plant Biology. 24, 24-30 (2015).
- Warner, J. R., Knopf, P. M., Rich, A. A Multiple Ribosomal Structure In Protein Synthesis. Proceedings of The National Academy of Sciences of The United States of America. 49 (1), 122-129 (1963).
- Gautam, V., Sarkar, A. K. Laser Assisted Microdissection, An Efficient Technique To Understand Tissue Specific Gene Expression Patterns And Functional Genomics In Plants. Molecular Biotechnology. 57 (4), 299-308 (2015).
- Bargmann, B. O. R., Birnbaum, K. D. Fluorescence Activated Cell Sorting Of Plant Protoplasts. Journal of Visualized Experiments. (36), e1673(2010).
- Deal, R. B., Henikoff, S. The Intact Method For Cell Type-Specific Gene Expression And Chromatin Profiling In Arabidopsis Thaliana. Nature Protocols. 6 (1), 56-68 (2011).
- Dougherty, J. D. The Expanding Toolkit Of Translating Ribosome Affinity Purification. The Journal of Neuroscience: The Official Journal Of The Society For Neuroscience. 37 (50), 12079-12087 (2017).
- Mustroph, A., Juntawong, P., Bailey-Serres, J. Isolation Of Plant Polysomal mRNA By Differential Centrifugation And Ribosome Immunopurification Methods. Methods in Molecular Biology. 553, 109-126 (2009).
- Matsushima, W., et al. SLAM-ITseq: Sequencing Cell Type-Specific Transcriptomes Without Cell Sorting. Development. 145 (13), (2018).
- Basnet, H., et al. Flura-Seq Identifies Organ-Specific Metabolic Adaptations During Early Metastatic Colonization. Elife. 8, (2019).
- Rodriques, S. G., et al. Slide-Seq: A Scalable Technology For Measuring Genome-Wide Expression At High Spatial Resolution. Science. 363 (6434), 1463-1467 (2019).
- Fazal, F. M., et al. Atlas Of Subcellular RNA Localization Revealed By Apex-Seq. Cell. 178 (2), 473-490 (2019).
- Slane, D., Bayer, M. Cell Type-Specific Gene Expression Profiling Using Fluorescence-Activated Nuclear Sorting. Plant Gene Regulatory Networks: Methods And Protocols. Kaufmann, K., Mueller-Roeber, B. , Springer. New York, NY. 27-35 (2017).
- Zanetti, M. E., Chang, I. F., Gong, F., Galbraith, D. W., Bailey-Serres, J. Immunopurification Of Polyribosomal Complexes Of Arabidopsis For Global Analysis Of Gene Expression. Plant Physiology. 138 (2), 624-635 (2005).
- King, H. A., Gerber, A. P. Translatome Profiling: Methods For Genome-Scale Analysis Of mRNA Translation. Briefings In Functional Genomics. 15 (1), 22-31 (2016).
- Mašek, T., Valášek, L., Pospíšek, M. Polysome Analysis And RNA Purification From Sucrose Gradients. RNA: Methods And Protocols. Nielsen, H. , Humana Press. Totowa, NJ. 293-309 (2011).
- Heiman, M., et al. A Translational Profiling Approach For The Molecular Characterization Of Cns Cell Types. Cell. 135 (4), 738-748 (2008).
- Halbeisen, R. E., Scherrer, T., Gerber, A. P. Affinity Purification Of Ribosomes To Access The Translatome. Methods. 48 (3), 306-310 (2009).
- Thomas, A., et al. A Versatile Method For Cell-Specific Profiling Of Translated mRNAs In Drosophila. Plos One. 7 (7), e40276(2012).
- Watson, F. L., et al. Cell Type-Specific Translational Profiling In The Xenopus Laevis Retina. Developmental Dynamics. 241 (12), 1960-1972 (2012).
- Lam, P. Y., Harvie, E. A., Huttenlocher, A. Heat Shock Modulates Neutrophil Motility In Zebrafish. Plos One. 8 (12), e84436(2013).
- Fang, Y., et al. Translational Profiling Of Cardiomyocytes Identifies An Early Jak1/Stat3 Injury Response Required For Zebrafish Heart Regeneration. Proceedings Of The National Academy Of Sciences Of The United States Of America. 110 (33), 13416-13421 (2013).
- Mustroph, A., Zanetti, M. E., Girke, T., Bailey-Serres, J. Isolation And Analysis Of mRNAs From Specific Cell Types Of Plants By Ribosome Immunopurification. Methods In Molecular Biology. 959, 277-302 (2013).
- Monshausen, G. B., Gilroy, S. Feeling Green: Mechanosensing In Plants. Trends In Cell Biology. 19 (5), 228-235 (2009).
- Day, R. C., Grossniklaus, U., Macknight, R. C. Be More Specific! Laser-Assisted Microdissection Of Plant Cells. Trends In Plant Science. 10 (8), 397-406 (2005).
- Sheen, J. Signal Transduction In Maize And Arabidopsis Mesophyll Protoplasts. Plant Physiology. 127 (4), 1466-1475 (2001).
- Datta, S., et al. Laser Capture Microdissection: Big Data From Small Samples. Histology And Histopathology. 30 (11), 1255-1269 (2015).
- Birnbaum, K., et al. A Gene Expression Map Of The Arabidopsis Root. Science. 302 (5652), 1956(2003).
- Hamant, O., Haswell, E. S. Life Behind The Wall: Sensing Mechanical Cues In Plants. BMC Biology. 15 (1), 1354(2017).
- Vragović, K., et al. Translatome Analyses Capture Of Opposing Tissue-Specific Brassinosteroid Signals Orchestrating Root Meristem Differentiation. Proceedings of The National Academy of Sciences of the United States of America. 112 (3), 923-928 (2015).
- Wang, Y., Jiao, Y. Translating Ribosome Affinity Purification (Trap) For Cell-Specific Translation Profiling In Developing Flowers. Methods In Molecular Biology. 1110, 323-328 (2014).
- Sablok, G., Powell, J. J., Kazan, K. Emerging Roles And Landscape Of Translating mRNAs In Plants. Frontiers in Plant Science. 8, 1443(2017).
- Ron, M., et al. Hairy Root Transformation Using Agrobacterium Rhizogenes As A Tool For Exploring Cell Type-Specific Gene Expression And Function Using Tomato As A Model. Plant Physiology. 166 (2), 455-469 (2014).
- Reynoso, M. A., et al. Evolutionary Flexibility In Flooding Response Circuitry In Angiosperms. Science. 365 (6459), 1291-1295 (2019).
- Dolan, L., et al. Cellular Organisation Of The Arabidopsis Thaliana Root. Development. 119 (1), 71(1993).
- Ristova, D., Barbez, E. Root Development. , Springer. New York, NY. (2018).
- Shekhar, V., Stӧckle, D., Thellmann, M., Vermeer, J. E. M. The Role Of Plant Root Systems In Evolutionary Adaptation. Current Topics in Developmental Biology. 131, 55-80 (2019).
- Malamy, J. E., Benfey, P. N. Down And Out In Arabidopsis: The Formation Of Lateral Roots. Trends in Plant Science. 2 (10), 390-396 (1997).
- de Smet, I., et al. Bimodular Auxin Response Controls Organogenesis In Arabidopsis. Proceedings of the National Academy of Sciences of The United States of America. 107 (6), 2705-2710 (2010).
- Péret, B., et al. Arabidopsis Lateral Root Development: An Emerging Story. Trends In Plant Science. 14 (7), 399-408 (2009).
- Vilches-Barro, A., Maizel, A. Talking Through Walls: Mechanisms Of Lateral Root Emergence In Arabidopsis Thaliana. Current Opinion in Plant Biology. 23, 31-38 (2015).
- Porco, S., et al. Lateral Root Emergence In Arabidopsis Is Dependent On Transcription Factor Lbd29 Regulation Of Auxin Influx Carrier Lax3. Development. 143 (18), 3340-3349 (2016).
- Stoeckle, D., Thellmann, M., Vermeer, J. E. Breakout-Lateral Root Emergence In Arabidopsis Thaliana. Current Opinion in Plant Biology. 41, 67-72 (2018).
- Banda, J., et al. Lateral Root Formation In Arabidopsis: A Well-Ordered Lrexit. Trends in Plant Science. 24 (9), 826-839 (2019).
- Vermeer, J. E. M., et al. A Spatial Accommodation By Neighboring Cells Is Required For Organ Initiation In Arabidopsis. Science. 343 (6167), 178-183 (2014).
- Vanneste, S., et al. Cell Cycle Progression In The Pericycle Is Not Sufficient For Solitary Root/Iaa14-Mediated Lateral Root Initiation In Arabidopsis Thaliana. The Plant Cell. 17 (11), 3035-3050 (2005).
- Marques-Bueno, M. M., et al. A Versatile Multisite Gateway-Compatible Promoter And Transgenic Line Collection For Cell Type-Specific Functional Genomics In Arabidopsis. The Plant Journal : For Cell and Molecular Biology. 85 (2), 320-333 (2016).
- Shimada, T. L., Shimada, T., Hara-Nishimura, I. A Rapid And Non-Destructive Screenable Marker, Fast, For Identifying Transformed Seeds Of Arabidopsis Thaliana. The Plant Journal : For Cell and Molecular Biology. 61 (3), 519-528 (2010).
- Clough, S. J., Bent, A. F. Floral Dip: A Simplified Method For Agrobacterium Mediated Transformation Of Arabidopsis Thaliana. The Plant Journal. 16 (6), 735-743 (1998).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized Method For High-Throughput Sterilization Of Arabidopsis Seeds. Journal Of Visualized Experiments. (128), e56587(2017).
- Andersen, T. G., et al. Diffusible Repression Of Cytokinin Signalling Produces Endodermal Symmetry And Passage Cells. Nature. 555, 529-533 (2018).
- Schroeder, A., et al. The Rin: An Rna Integrity Number For Assigning Integrity Values To Rna Measurements. BMC Molecular Biology. 7, 3(2006).
- Vragović, K., Bartom, E., Savaldi-Goldstein, S. Quantitation Of Cell Type-Specific Responses To Brassinosteroid By Deep Sequencing Of Polysome-Associated Polyadenylated RNA. Methods in Molecular Biology. 1564, 81-102 (2017).
- Bertin, B., Renaud, Y., Aradhya, R., Jagla, K., Junion, G. Trap-Rc, Translating Ribosome Affinity Purification From Rare Cell Populations Of Drosophila Embryos. Journal Of Visualized Experiments. (103), e52985(2015).
- Livak, K. J., Schmittgen, T. D. Analysis Of Relative Gene Expression Data Using Real-Time Quantitative PCR And The 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Jiao, Y., Meyerowitz, E. M. Cell-Type Specific Analysis Of Translating Rnas In Developing Flowers Reveals New Levels Of Control. Molecular Systems Biology. 6, 419(2010).
- Tian, C., et al. A Gene Expression Map Of Shoot Domains Reveals Regulatory Mechanisms. Nature Communications. 10 (1), 141(2019).
- Townsley, B. T., Covington, M. F., Ichihashi, Y., Zumstein, K., Sinha, N. R. Brad-Seq: Breath Adapter Directional Sequencing: A Streamlined, Ultra-Simple And Fast Library Preparation Protocol For Strand Specific mRNA Library Construction. Frontiers in Plant Science. 6, 366(2015).
- Song, Y., et al. A Comparative Analysis Of Library Prep Approaches For Sequencing Low Input Translatome Samples. BMC Genomics. 19 (1), 696(2018).
- Basu, D., Haswell, E. S. Plant Mechanosensitive Ion Channels: An Ocean Of Possibilities. Current Opinion in Plant Biology. 40, 43-48 (2017).
- Brady, S. M., et al. A High-Resolution Root Spatiotemporal Map Reveals Dominant Expression Patterns. Science. 318 (5851), 801(2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved