JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
세포 유형 별 척도에서 애기장대 뿌리 개발을 조사하기 위해 리보솜 친화성 정제 (TRAP) 번역
요약
리보솜 친화도 정제(TRAP)를 번역하면 장기와 조직의 최소한의 처리로 개발 프로그램을 해부할 수 있습니다. 이 프로토콜은 녹색 형광 단백질(GFP)으로 표적화된 세포로부터 고품질의 RNA를 산출합니다. qRT-PCR 또는 RNA-seq와 같은 다운스트림 분석 도구는 조직 및 세포 유형별 발현 프로파일을 밝힙습니다.
초록
이 기사에서는 번역 리보솜 친화도 정제 (TRAP) 방법 및 연속최적화 된 낮은 입력 라이브러리 준비를 통해 상이한 애기장대 탈리아나 루트 세포 유형에서 translatome 데이터를 얻기 위한 실습 지침을 제공합니다.
시작 재료로서, 우리는 적절한 프로모터를 사용하여 세포 유형별 방식으로 GFP 태그리보소말 단백질 RPL18을 발현하는 식물 라인을 사용합니다. 면역 정화 및 RNA 추출 전에 조직은 고정되어 조직 무결성을 보존하고 동시에 높은 시간적 해상도로 타임 시리즈 연구를 실행할 수 있습니다. 특히, 세포벽 구조는 손상되지 않은 상태로 남아 있으며, 이는 뚜렷한 세포 집단을 분리하기 위해 조직 에 의존하는 형광 활성화 세포 선별 기반 접근법과 같은 대체 절차의 주요 단점입니다. 또한 고품질 RNA를 얻을 수 있는 레이저 포획 미세 해부 기반 기술에서와 같이 조직 고정이 필요하지 않습니다.
그러나, 세포의 하위 집단에서 샘플링만 폴리섬 관련 RNA를 격리하는 것은 RNA 수율을 심각하게 제한합니다. 따라서 RNA-seq에 의한 성공적인 데이터 수집을 위해 충분히 민감한 라이브러리 준비 방법을 적용해야 합니다.
TRAP은 세포벽 관련 및 기계적 신호 경로와 관련된 많은 개발 공정으로 플랜트 연구에 이상적인 도구를 제공합니다. 특정 세포 집단을 표적으로 하는 프로모터의 사용은 차례차례로 작은 해결책 또는 아주 높은 비용 때문에 손해를 입는 기관과 단세포 수준 사이 격차를 다리로 입니다. 여기에서, 우리는 측방 루트 형성에 있는 세포 세포 통신을 공부하기 위하여 TRAP를 적용합니다.
서문
차세대 염기서열 분석 기술의 응용이 증가함에 따라 개발 생물학의 공간 해상도가 증대될 수 있습니다. 현대 연구는 단세포 수준1,2,2,3,,4가아니라면, 전문화한 세포 모형에 조직을 해부하는 것을 목표로 합니다. 이를 위해, 지난 50년 동안 다양한 방법이 고안되었다(도 1A참조)5,6,6,77,8,,9,,10,,11,12,,13,,14,,15.,
식물 과학의 많은 도구는 동물 연구에서 개척 된 기술의 적응되었습니다. 여기에서 자세히 소개하는 방법은 그렇지 않습니다. 2005년, 단백질 번역에 대한 탄탄한 배경을 갖춘 베일리-세레스 연구소는 후속 친화도 정제16을위해 리보소말 단백질을 설계하기 시작했습니다. 따라서, 그들은 수크로오스 그라데이션을 가진 초원심분리에 기초하고 1960년대,17,18년이후 리보솜 을 번역하는 데 사용된 시간 소모적이고 노동 집약적인 폴리솜 프로파일링을 피할 수 있었다. 상기 방법은 이후 번역리보솜 친화도 정제(TRAP)16으로지칭되었다. 식물에서 성공적인 트랜스플라토메 연구 후, Heiman 등은 동물19에 대한 TRAP을 적용했으며 다른 동물은 효모20, 초파리21, 제노푸스22 및 제브라피시23,,24로적용을 확대했다.
모델 시스템의 유전자 변형은 TRAP의 전제 조건이지만, 이는 유전자 변형에 대한 적용을 제한하는 종에 대한 적용을 제한하지만, 하나는 동시에 특별한 관심과 그렇지 않으면 손상되지 않은 조직 / 기관(예를 들어, 감염된 식물 에서 마우스 뇌 또는 곰팡이 hyphae에서 고도로 분지 수지상 세포)에서 분리하기 매우 어려운 세포의 하위 세트를 대상으로이 반대를 활용할 수 있습니다. 식물에서, 모든 세포는 정수체골격(26)의기초를 형성하는 세포벽을 통해 제자리에 유지된다. 이 매트릭스에서 식물 세포를 해방하기 위하여는, 과학자는 레이저 포획 미세 분부 (LCM)27를 통해 그 주변 조직에서 세포를 물리적으로 잘라내거나 세포벽28의효소 소화를 수행했습니다. 후자의 세포 들 중, 소위 프로토 플라스타체, 관심있는 집단은 형광 표지되고 형광 활성화 세포 선별(FACS)7을통해 분리될 수 있다. LCM은 일반적으로 그것의 RNA29의질을 궁극적으로 악화시키는 왁스에서 고정되고 매립되는 견본을 요구합니다. FACS 기반 방법은 고품질 RNA를 산출하지만, 프로토라스팅 자체의 과정은 유전자 발현30의 차이를 도입하고 변형되고 두꺼운 이차 세포벽을 가진 조직은 치료하기가 악명 이어 있다. 더욱이, 식물의 많은 발달 공정은 기계적으로 전송된 신호에 의존하는 것으로 가정되므로 세포벽의 무결성이 가장 중요하다31. 핵의 수준에서 작동하여 세포 격리를 우회하기 위해 바로 가기를 사용하는 두 가지 방법은 형광 활성화 핵 선별 (FANS) 및 특정 세포 유형 (INTACT)에 태그 된 핵의 분리입니다. TRAP에서와 같이, 그(것)들은 핵을 표시하기 위하여 세포 유형 특정 프로모터를 이용하고, 그 후에 분류를 통해 농축되거나, 각각8,,15. 이 모든 접근을 위한 중요한 도전은 조직에 있는 세포의 부분 집합에서 충분한 RNA 물자를 얻는 것입니다. TRAP이 셀룰러 RNA의 일부만 캡처하므로 샘플 수집은 상당한 병목 현상입니다. 따라서 낮은 입력 량에서 고품질 데이터를 생성하려면 특히 중요한 라이브러리 준비 프로토콜이 필요합니다.
설립 이래, TRAP은 DNA 마이크로어레이와 병용되어 사용되거나, 시퀀싱 비용이 최근 몇 년 동안 현저히 감소함에 따라, RNA-seq10,,32,,33. 연구 질문의 무리는 이미 사블락 등에서 검토로 해명되었습니다34. 우리는 기술이 특정 세포 모형을 표적으로 하기 위하여 다른 프로모터를 결합할 때 아주 다재다능하기 때문에 앞으로 더 많은 보고가 따를 것이라는 점을 확신합니다. 결국, 이것은 유도 할 수있는 방법으로도 수행 될 것이며, 많은 생물학적 및 비생물적 스트레스 요인에 대한 식물의 반응을 조사하는 것으로 결합 될 수 있습니다. 또한, 안정적인 형질전환라인을 사용할 수 없는 곳에서는, 털이 많은 뿌리 발현 시스템도 토마토와메디아고(35,,36)에서TRAP을 수행하는 데 성공적으로 사용되었다.
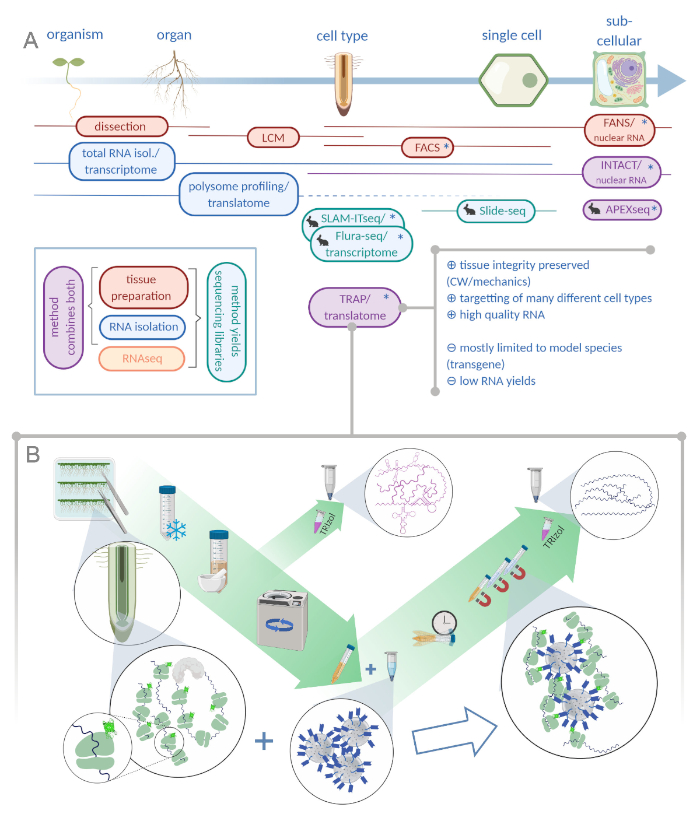
그림 1: 리보솜 친화성 정제(TRAP)를 번역하는 것은 "오믹스" 분석 포트폴리오를 보완합니다. A. 분석 정밀도의 증가 수준, 단일 세포 또는 심지어 세포 이하 의 해상도는 이들의 방법 또는 조합의 과다에 의해 달성 될 수있다. 이 계획은 식물과 동물 분야에서 현재 사용 가능한 도구의 개요를 제공합니다. 세포 결정에서 조직 수집은 LCM 또는 FACS와 같은 프로토콜에 의해 달성 될 수 있으며, 표준 전사체 또는 폴리섬 프로파일링 / 트랜스 라토메 분석과 결합됩니다. TRAP 과 INTACT는 에피토프 태깅을 기반으로 조직 캡처 및 RNA 격리를 모두 통합합니다. 그러나, INTACT 는 세포 핵만을 샘플링하고, 따라서, 전사체 분석의 특별한 경우를 구성한다. 작은 토끼 아이콘은 동물 분야에서 새로 개발 된 방법을 표시 : SLAM-ITseq 및 Flura-seq는 허용 효소를 발현하는 세포에서 수정 된 우라실 염기를 가진 초기 RNAs의 대사 지색에 의존하는 반면, Slide-seq는 세포 범위에서 위치 정보를 제공하는 DNA 바코드가있는 코팅 된 유리 슬라이드를 사용합니다. 근접 라벨링 접근법은 APEX-seq에서 특정 세포 외 구획에서 RNA를 샘플링하는 방법을 따릅니다. 특히, 증가 된 해상도는 종종 형질전환 물질 (별표)의 생성을 필요로하고 이러한 방법은 따라서 주로 모델 종에 사용된다. TRAP은 특히 CW 매트릭스에서 방출하기 어려운 세포종뿐만 아니라 세포벽(CW) 또는 역학 신호와 관련된 식물 과학 연구에 적합합니다. B. TRAP 절차의 상세한 습식 실험실 단계: GFP 태그가 달린 리보좀 단백질을 구별된 세포 유형(예: 뿌리 내피)에서 발현하는 모종은 7일 동안 페트리 접시에서 재배되고 스냅 동결에 의해 수확된 뿌리 재료입니다. 총 RNA 제어 샘플은 원심 분리를 통해 파편을 펠릿하기 전에 균질화된 원유 추출물로부터 수집됩니다. 자기 항-GFP 비드는 면역 침전을 수행하기 위해 클리어된 추출물에 첨가된다. 배양 및 3개의 세척 단계 후, 폴리솜 관련 RNA(TRAP/폴리솜 RNA)는 페놀-클로로포름 추출을 통해 직접 수득된다. LCM : 레이저 캡처 미세 해부, FACS / 팬 : 형광 활성화 세포 / 핵 선별, APEX-seq: 엔지니어링 된 아스코르브 인 과산화제에 기초한 방법, INTACT: 특정 세포 유형에 태그 된 핵의 격리, SLAM-ITseq: THIOL(SH)-조직내 RNA의 대사 시퀀싱에 대한 연결 알킬레이션, 플루라-세크: 플루라-세크: 플루라-세크: 플루오라실 라벨RNA 시퀀싱(Biorender.com 이쪽을 클릭하십시오.
이 문서의 목표는 TRAP 메서드에 대한 자세한 설명을 제공하고 중요한 단계를 강조 표시하고 가능한 라이브러리 준비 방법에 대한 지침을 제공하는 것입니다.
일반 TRAP 실험은 본질적으로 다음 단계로 구성됩니다 (도 1B참조) ( (1) 리보솜 태깅 구조의 복제, 형질 전환 라인 생산 및 선택, 씨앗의 성장 및 벌킹, 살균 및 도금, 스트레스 적용 / 치료 (선택 사항) 및 조직 수확을 포함한 식물 재료의 준비; (2) 조 추출물의 조직 균질화 및 개간, 비드 세척 및 면역정화, 및 세척 단계를 포함하는 면역화; (3) RNA 추출 및 품질 평가; (4) 도서관 준비.
애기장대 뿌리는 모델 플랜트37,,38으로도입된 이래 식물 개발을 연구하는 모델 시스템이다. 여기서 TRAP의 적용은 식물 측면 루트 개발의 맥락에서 전시된다. 식물에서 전체 루트 시스템의 축적은이 프로그램의 실행에 의존하므로 유기체(39)의생존에 매우 중요합니다. 애기장대에서,측면 뿌리는 자일렘 혈관 옆에 상주하는 pericycle 조직에서 유래하고 따라서 자일렘 극 페리사이클이라고합니다 (XPP; 그림 2C참조)40. 뿌리 안쪽 깊숙이 위치한 일부 XPP 세포는 설립자 세포 정체성을 얻고 국소 호르몬 트리거에 따라 팽창과 반대로41을나누어 증식하기 시작합니다. 그러나 단단한 세포벽 매트릭스가 존재하기 때문에이 과정은 주변 조직에 기계적 응력을 가합니다. 특히, 횡근근성장축(42,,43,,4244)의방식이기 때문에, 과도내피증이 영향을 받는다. 실제로, 새로 형성된 프리모르듐은 지나치게 내피세포(도2C2)를통해 성장해야 하는 반면 피질과 표피 세포는 프리모르듐이 마침내45,,46으로나타난다. 우리의 실험실에 있는 최근 일은 내분비가 pericycle에 있는 확산을 수용하기 위하여 적극적으로 기여하고 있다는 것을 보여주었습니다. 내피 호르몬 신호의 표적 차단은 XPP세포(47)에서의제1 분열조차도 억제하기에 충분하다. 따라서, pericycle-endodermis 통신은 애기장대에서측근 발달을 위한 아주 초기 체크포인트를 구성합니다. 그러나 이 크로스토크가 어떻게 수행되는지는 알 수 없습니다. 이 수수께끼를 풀기 위해 XPP 및 내피 세포를 대상으로 하는 TRAP-seq 접근법을 선택했습니다. 측면 루트 프로그램에서 세포를 풍부하게하기 위해, 우리는 외인성으로 auxin 아날로그를 적용하여 호르몬 트리거를 모방 (1-naphthaleneacetic 산, NAA)48,이는 동시에 일시적으로 측면 루트 형성의 초기 단계를 해결 허용.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 이식 유전자의 복제, 형질전환 라인 생산 및 선택
- 적절한 엔트리 벡터에서 선택된 프로모터를 복제한다. 재조합 계 클론방법(표 오브 머티리얼)을사용하고 pDONRP1-P249에서재조합 기반 복제를 사용하여 pDONRP4-P1r. 클론 RPL18(선호도 태그 또는 선택의 형광 단백질 포함)에서 프로모터를 재결합한다.
- RPL18을 함유하는 엔트리 벡터를 프로모터-함유 진입 벡터와 결합하여 적절한 대상 벡터로 재조합하여 FAST-red 선택카세트(50)를 적절히 결합하여 형질전환 종자의 직접 선택을 용이하게 한다.
- 시퀀싱을 통해 재결합 된 벡터를 확인하고 적합하고 유능한 농균으로 변환하십시오. 꽃딥 애기장대 식물과 3-4주 후 수확하고 T1종자(51)를선택한다.
- 현미경 검사를 사용하여 잘 표현되는 라인을 식별하고 여러 개의 독립적인 라인에서 보고된 프로모터 활동에 따라 발현 패턴을 확인합니다. 단일 T-DNA 삽입으로 대표적인 발현 패턴을 나타내는 선을 선택합니다. 이것은 침묵을 최소화하는 것을 도울 수 있고 유전 십자가를 위해 유리할 것입니다.
- 마커 유전자에 대한 동형접합인 T3 자손을 선택합니다.
2. 전파 및 살균
- 세포 유형별 TRAP은 루트당 제한된 수의 표적 세포로부터 RNA를 분리한다. 필요한 시작 재료를 생성하려면 동형 접합 선을 전파합니다. 이를 위해 곰팡이 성장 제어에 특별한 초점을 맞춘 표준 성장 조건을 사용하십시오.
참고: 단일 삽입 라인을 얻을 수 없는 경우, T-DNA 유도 된 세대 간 침묵을 피하기 위해 몇 세대에 걸쳐 큰 인구에서 배치를 성장. - 염소 가스 한 라운드와 70 % EtOH의 한 라운드로 애기장대 씨앗을 대량으로 살균하십시오.
- 12cm x 12cm 스퀘어 페트리 접시(0.3 mL 미만의 씨앗/접시)에 씨앗을 고르게 펴서 건조기 또는 기타 적합한 용기에 쌓습니다. 씨앗이 가스에 접근 할 필요가 있기 때문에 덩어리 또는 힙 형성을 피하십시오. 보고된 표백제 및 HCl 부량으로 밤새 가스 살균 수행52: 표백제 100 mL (13%) 60 L 데시케이드에 6 mL의 Cc. HCl. 멸균 용기에 씨앗을 수집하기 전에 적어도 1 시간 동안 방어하십시오.
주의: 37% HCl은 부식성이 매우 높으며 세심한 취급이 필요합니다. 염소 가스는 독성, 연기 후드를 사용합니다. - 접시당 0.1 mL의 건조한 가스 멸균 씨앗을 취하고 실온에서 멸균 용액 (70 % EtOH, 0,01 % 트위넨)과 혼합하십시오. 20 분 동안 배양하고, Decant EtOH를 멸균H2O로 3-4 회 씻어 낸다.
- 불린 씨앗을 50 mL 튜브로 옮기고 멸균 0.1 % 한천으로 희석하여 플레이트 당 1 mL의 임비브 씨앗 슬러리 (0.1 mL 종자 / 1 mL 슬러리)를 얻습니다.
참고: 이식 유전자 통합 이벤트로 인해 플랜트 라인은 다양한 멸균 기술에 취약할 수 있습니다. 특히 EtOH 인큐베이션 시간이 중요한 것으로 나타났다. 우리의 손에, 이중 살균 단계는 실험 도중 곰팡이 오염을 피하기 위하여 필요했습니다. 이는 단일 타임 포인트의 오염으로 타임시리즈를 수행할 때 전체 실험을 방해하는 경우에 특히 중요합니다. 국소 성장 조건에 따라 이중 살균이 항상 필요한 것은 아닙니다.
- 12cm x 12cm 스퀘어 페트리 접시(0.3 mL 미만의 씨앗/접시)에 씨앗을 고르게 펴서 건조기 또는 기타 적합한 용기에 쌓습니다. 씨앗이 가스에 접근 할 필요가 있기 때문에 덩어리 또는 힙 형성을 피하십시오. 보고된 표백제 및 HCl 부량으로 밤새 가스 살균 수행52: 표백제 100 mL (13%) 60 L 데시케이드에 6 mL의 Cc. HCl. 멸균 용기에 씨앗을 수집하기 전에 적어도 1 시간 동안 방어하십시오.
3. 도금
- 이러한 단계를 미리 준비하십시오. 실험에 필요한 수량에 1%의 한천으로 1/2 MS 플레이트(pH 5.8)를 붓습니다(샘플/시간 점당 20-30). 1 mL 파이펫 팁을 잘라 팁 직경을 ca. 3-4mm로 확대면도날로 합니다. 팁을 오토클레이브합니다. 사각형 페트리 접시 뚜껑 접시 당 씨앗의 세 행을 도금하기위한 템플릿 홀더를 만듭니다. 멸균 작업 환경을 제공하고 처리할 플레이트에 라벨을 붙이기 위해 층류 후드를 준비합니다.
참고: 많은 플레이트가 동시에 처리되는 경우 컬러 라벨은 라벨 의 속도를 높일 수 있습니다. - 빈 한천 접시를 템플릿 홀더에 넣고 3개의 행에 1mL의 임브 시드를 고르게 분배합니다. 씨앗이 건조 될 때까지 (즉, 한천 표면에 충실) 층류 흐름에 스택에 처리 된 플레이트를 놓습니다. 한천이 마르기 때문에 접시를 더 이상 두지 마십시오.
- 씨앗이 충분히 건조되면 뚜껑을 닫고 각 접시를 마이크로 기공 테이프로 밀봉하십시오. 4 °C에서 이틀 동안 씨앗을 층화하고 그 후 성장 챔버에 배치합니다.
4. 조직 치료 (선택 사항)
참고: 이 프로토콜에서는 합성 보조 체변 NAA를 가진 애기장대 뿌리의 외인성 치료를 간략하게 설명합니다. 현재 의실험적인 질문에 따라 이 부분을 조정하거나 완전히 생략할 수 있습니다.
- 높이 2cm, 길이 10cm의 티슈 페이퍼 스트립을 준비하십시오. 연장된 배양 시간은 사용하기 전에 조직을 오토클레이브해야 합니다.
- 호르몬 치료를 받아야하는 모든 플레이트에서 마이크로 포어 테이프를 제거하십시오. 10 mM NaA (DMSO에 용해)의 1 mL을 액체 1 L에 희석하고, 오토 클레이브 1/2 MS 용액 (pH 5.8)을 희석하고 용액 (10 μM NAA)에 티슈 페이퍼를 담급니다.
- 핀셋을 사용하여 각 뿌리 줄에 티슈 페이퍼 스트립을 적용합니다. 손가락을 부드럽게 사용하여 기포를 제거합니다. 접시에서 여분의 액체를 비우고 뚜껑을 닫고 시간에 따라 접시에 레이블을 지정하십시오. 연장된 배양 시간을 위해 플레이트를 다시 성장 챔버에 넣습니다.
5. 수확
- 각 생물학적 복제/시간 지점/치료에 대한 플레이트를 검색합니다. 깨끗한 Dewar 용기에 액체 질소를 수집하고 다른 조직 샘플에 대한 라벨 튜브 (15 또는 50 mL). 스티로폼 홀더를 준비합니다.
주의: 액체 질소 처리 절차(폭기, 동상, 폭발 가능성이 있는 튜브)에 익숙해지십시오. - 접시를 열고 포지프로 티슈 페이퍼를 제거하여 한천 표면에서 뿌리를 분리하지 않도록주의하십시오. 수술 블레이드를 사용하면 단 한 번의 결정 스트로크로 촬영 루트 접합을 따라 행당 한 번 잘라냅니다. 시료 사이에 블레이드를 청소하고 선명도를 보장하기 위해 자주 교환하십시오.
- 핀셋을 사용하여 각 행의 루트를 따라 스 와이프하여 세 번들로 수집합니다. 뿌리를 잡고 액체 질소로 채워진 50 mL 튜브에 비우면 얼어 붙습니다.
참고: 다음 단계에서 분쇄하기 어렵기 때문에 뿌리가 조밀한 구조(예: 공)로 조립하지 마십시오. - 하나의 샘플을 구성하는 모든 플레이트 (인큐베이션 시간 순서)를 진행하고 여분의 액체 질소를 부어. 튜브 뚜껑을 사용하여 뿌리가 흘리지 않도록 하십시오. 그런 다음 뚜껑을 닫고 Dewar 용기의 모든 튜브를 수집합니다. 뿌리 조직을 -80 °C에 저장합니다.
6. 면역 정화
참고 : 이 단계는 고품질 TRAP / 폴리 섬 RNA를 얻는 것을 목표로합니다. 따라서 RNA 처리를 위한 모범 사례 조언을 엄격히 따르십시오. 이 섹션의 모든 단계를 멸균 벤치에서 수행하고 RNase 제거 용액(재료표)으로모든 장비와 실험실용품을 청소합니다. 장갑을 착용하고 시료, 얼음 또는 청소되지 않은 다른 소스로 오염되었을 때 즉시 교체하십시오. 이것은 매우 중요한 측면이기 때문에 폐기물 처리 조언과 함께 장비 재사용에 대한 섹션이 포함되어 있습니다.
- 버퍼 준비
- 표 1 및 오토클레이브(A) 또는 필터 멸균(△)에 따른 재고 솔루션을 준비합니다. 달리 명시되지 않는 한, 용매는 RNase-free 물입니다.
- 용해 및 알리쿠트 디티오트레이톨(DTT), 페닐메틸설포닐 불소(PMSF), 사이클로헥시미드(CHX) 및 클로람페니콜(CAM)을 각각의 용매에 용매에 용해시키고 이를 -20°C에서 저장한다. 다른 모든 주식은 실온에서 유지 될 수 있습니다.
- 세척 버퍼(WB)의 경우 1-4, 폴리섬 추출 버퍼(PEB)의 경우 1-6성분으로 주식을 미리 혼합하여 모든 추출 전에 시간 소모적인 버퍼 혼합을 방지합니다. 따라서 추출 당일에 물과 냉동 성분 (7-10)만 첨가하십시오. 미리 혼합된 스톡과 RNase가 없는 물을 4°C에서 유지합니다.
참고: DTT 농도는 GFP와의 nanobody 상호 작용이 높은 DTT 농도에 민감하기 때문에 2005년 자네티 등으로부터 보고된 농도의 1/5이다.
| 재료 | 재고 농도 | 50 mL의 WB* mL에 볼륨 추가 | PEB 50 mL에 대한 mL볼륨 추가* | ||
| 1 | 트리스, pH 9 | A. | 2 M | 5 | 5 |
| 2 | KCl | A. | 2 M | 5 | 5 |
| 3 | EGTA | A. | 0.5 M | 2.5 | 2.5 |
| 4 | MgCl2 | A. | 1 M | 1.75 | 1.75 |
| 5 | Pte | A. | 20% (v/v) | 0 | 2.5 |
| 6 | 세제 믹스 | A. | 0 | 2.5 | |
| 트웬 20 | 20% (v/v) | ||||
| 트리톤-X 100 | 20% (v/v) | ||||
| 브리즈-35 | 20% (v) | ||||
| 이게팔 (것)이게팔 (것 | 20% (v/v) | ||||
| 7 | Dtt | ₳ | 0.5 M | 0.1 | 0.1 |
| 8 | PMSF | ₳ | 0.1 M (이소프로판올) | 0.5 | 0.5 |
| 9 | 사이클로색시미드 | ₳ | 25 mg/mL (EtOH) | 0.1 | 0.1 |
| 10 | 클로람페니콜 | ₳ | 50 mg/mL (EtOH) | 0.05 | 0.05 |
표 1: 버퍼 조성 및 혼합 조언. 주어진 양의 혼합 된 재고 농도와 성분은 WB 또는 PEB의 50 mL을 산출한다. 트리스-(하이드록시메틸)-아미노메탄, EGTA: 에틸렌 글리콜 비스(β-아미노에테르)-N,N', N'-테트라 아세트산, PTE: 폴리옥시에틸렌-(10)-트리데실 에테르, A: 오토클레이브, 아미노메탄; *RNase가 없는 물로 최대 50mL를 채우실 수 있습니다.
- 조직 균질화/분쇄
- 원심분리기를 식히고 균질화와 원심분리기를 얼음 위에 놓습니다. DTT, PMSF, CHX 및 CAM의 aliquots를 해동합니다. PEB와 WB를 스톡 솔루션에서 50 mL 튜브에 섞어 하루의 요구 사항(샘플의 #)에 따라 얼음으로 식힙니다.
참고: PMSF의 반감기는 30분밖에 되지 않아 사용 직전에 PMSF를 추가하십시오. - Dewar 용기에 액체 질소를 충분히 준비하고 -80 °C 저장에서 조직 샘플을 회수하십시오. 차가운 박격포로 인한 화상을 방지하기 위해 표준 실험실 장갑 아래에 면 장갑을 착용하십시오. 액체 질소를 박격포에 붓고 연삭을 허용할 정도로 차가워질 때까지 유봉에 붓습니다. 박격포를 구별하는 시스템을 고안하는 것이 좋습니다 (라벨 또는 특정 순서로 유지).
- 모든 재료가 흰색 분말이 될 때까지 빈 조직 샘플을 박격포로 넣고 조심스럽게 갈아냅니다. 필요한 경우 액체 질소를 추가하여 조직을 동결 상태로 유지하거나 더 나은 분쇄를 촉진하십시오.
- PEB 5 mL을 시료에 넣고 버퍼가 멈추기 전에 분말과 빠르게 섞습니다. 이 샘플 해동 (수시로 혼합) 다른 샘플을 처리하는 동안.
- 혼합물을 옮길 수 있는 즉시 슬러리를 유리 균질화로 비우고 얼음을 유지합니다. 추가로 2 mL의 PEB로 모르타르와 유봉을 헹구고 균질화의 샘플에 추가하십시오.
참고: RNA 분해를 허용하므로 완전히 액체 샘플을 피하십시오. - 추출물이 균일 할 때까지 슬러리를 수동으로 갈아. 최소 4~5회 플런지 하는 것이 좋습니다.
참고: 슬러리가 더 해동될 수 있도록 약간의 추가 대기 시간이 필요할 수 있습니다. 균질화의 처리는 약간의 근면이 필요합니다. 무차별 대힘을 가하고 흡입력을 조심하십시오. 고려하지 않으면 균질화의 유출, 오염 또는 파괴로 이어질 수 있습니다. - 50 mL 원심 분리튜브에 조뿌리 추출물을 붓습니다 (얼음에 보관).
참고 : 일반적으로 여러 샘플은 전송하기 전에 접지 할 수 있습니다. 연삭, 이송 및 균질화의 병렬 처리가 필요합니다. 빨리 작동하려고하지만 서두르지 않는다; 침착하십시오. 항상 얼음에 균질화된 샘플을 보관하십시오.
- 원심분리기를 식히고 균질화와 원심분리기를 얼음 위에 놓습니다. DTT, PMSF, CHX 및 CAM의 aliquots를 해동합니다. PEB와 WB를 스톡 솔루션에서 50 mL 튜브에 섞어 하루의 요구 사항(샘플의 #)에 따라 얼음으로 식힙니다.
- 총 RNA 샘플 수집
- 각 원유 샘플의 200 μL aliquots를 깨끗한 미세 원심 분리튜브로 옮김(미리 얼음에 라벨을 부착하고 냉각)합니다.
- 7.1 및 7.2 지점에서 TRAP 샘플에 대해 상세히 설명된 대로 RNA 추출을 진행합니다. 샘플이 원심분리기에서 지우는 동안 이 단계를 수행합니다.
- DNA 오염을 제거하고 상용키트(표 의 재료)를사용하여 반응을 정화하기 위해 재중단된 총 RNA로 DNase 치료를 수행한다.
참고: 총 RNA 추출은 일반적으로 고농도를 산출하며 샘플을 상당히 희석해야 합니다. 민감한 Qubit 프로토콜에 의한 희석 후 농도를 측정하는 것이 좋습니다.
- 원유 추출물 제거
- 6.2.7의 샘플로 얼음 양동이를 가져 와서 16,000 x g 및 4 °C에서 15 분 동안 원심 분리합니다.
참고: 원심분리기의 균형을 맞추려면 그에 따라 샘플을 페어링합니다. 이것이 완전히 불가능한 경우 PEB를 추가하여 하나의 샘플을 조정합니다. - 상급체를 신선한 원심분리기 튜브(미리 얼음에 식혀)에 붓고 원심분리를 반복합니다(16,000 x g 및 4°C에서 15분). 이 전송은 원심 분리기 옆에 신속하게 수행 될 수있다.
- 원유 추출물이 청산되는 동안, 6.6단계에 대한 GFP 비드세척을 시작한다.
참고: 이 얼음 양동이는 셰이커에 흔들리기 위해 보관하지만 오염될 수 있으므로 멸균 벤치에 다시 놓지 마십시오.
- 6.2.7의 샘플로 얼음 양동이를 가져 와서 16,000 x g 및 4 °C에서 15 분 동안 원심 분리합니다.
- 비드 워시
- Aliquot 자기 GFP 비드 (#samples x 60 μL, 재료 표)1.5 mL 튜브에. 마그네틱 스탠드에 놓습니다. 구슬이 수집되면, 상급을 제거합니다.
- 차가운 WB 의 1 mL을 추가하고 구슬을 다시 일시 중단하고 다시 수집하십시오. 세척 버퍼를 버리고 WB 1 mL로 다시 한 번 반복하십시오.
- 궁극적으로, 6.5.1 단계에서 사용되는 초기 볼륨으로 WB의 구슬을 다시 일시 중단합니다.
- 면역 정화 (IP)
- 원심 분리 직후, 표지된 15 mL 튜브에 제거된 상급물을 붓고 시료당 60 μL의 세척된 구슬을 추가합니다.
- 모든 샘플을 얼음 양동이에 수평으로 놓고 셰이커에 놓습니다. 혼합물을 GFP 표지 폴리좀을 구슬에 결합시키기 위해 2시간 동안 배양하게 한다.
- 15 mL 튜브 (얼음)에 대한 자기 스탠드에 구슬을 수집하고 나머지 PEB에 PMSF를 추가합니다. 상급제는 버리십시오. 약 5 mL의 PEB를 구슬에 붓고 기울여 다시 일시 중단하십시오. 섹션 6.6.2와 동일한 설정에서 15 분 동안 샘플을 흔들어.
- WB로 세안한 횟수를 총 3회(1 x PEB, 2 x WB)로 반복합니다. 각 버퍼 교환 전에 PMSF를 추가합니다.
- WB의 1 mL에서 구슬을 수집하고 1.5 mL 튜브로 전송합니다. 마지막으로, 마그네틱 스탠드에서 구슬을 한 번 더 수집하고 모든 액체를 제거합니다. 튜브를 닫고 모든 샘플이 처리될 때까지 얼음을 유지합니다.
- RNA 추출을 위해 샘플을 연기 후드로 운반합니다.
- 실험실 용품의 폐기물 처리 및 재조정.
- 좋은 실험실 연습에 따라 수행하는 경우 (섹션 2.2.1 참조), 살균 절차는 수성 NaCl 용액을 산출한다. 염소 가스뿐만 아니라 잔류 HCl 및 표백제를 두고 연기 후드에 수축하십시오.
- PEB 및 WB 폐기: CHX가 높은 pH로 분해됨에 따라 모든 액체를 수집하고 pH>9로 가져옵니다. 할로겐화 된 화학 폐기물에 액체 폐기물을 처리합니다. 모든 고형물 (조직, 혈청 화피, 장갑 등)은 화학 폐기물로 폐기해야합니다.
- 페놀 함유 액체뿐만 아니라 페놀 오염 물질 (팁, 튜브 및 장갑)을 별도로 수집합니다.
- 박격포, 유봉, 균질화제(스폰지와 브러쉬)를 비누로 손으로 씻고 철저히 헹구세요. 이어서, 재료를 >220°C에서 밤새 굽는다. 처리 전에 주석 호일에 싸서 내열, 덮인 용기에 넣습니다.
- 세제로 깨끗한 원심분리튜브를 브러쉬한 다음, 디에틸피로카보네이트(DEPC)를 연기 후드에 대접하십시오. 이를 위해 액체 DEPC를 탈이온수(DEPC 1mL ~H2O 1L)에 넣고 흔들어서 섞습니다. 원심분리기 튜브를 유출된 DEPC 물을 잡는 오토클레이브 식 트레이에 놓습니다. 튜브에 현탁액을 붓고 3 시간 또는 하룻밤 동안 둡니다. DEPC는 후속 오토클레이브 프로세스에서 분해됩니다.
주의: DEPC는 매우 독성이 있습니다.
7. RNA 추출 및 QC
- RNA 추출
- 탁상 원심분리기를 4°C로 식힙니다.
- 각 샘플에 산 구니디늄-페놀 계 시약(재료표)의1 mL을 추가하고, 비드 또는 총 RNA 슬러리를 다시 중단하고 얼음위에 5분 동안 배양한다. 소용돌이하지 마십시오!
- 200 μL의 클로로포름을 넣고 얼음에 3분 동안 배양합니다. 그런 다음 샘플을 철저히 소용돌이.
- 위상 분리를 돕기 위해 최대원심분리. 10-15 분, 4 °C의 속도.
- 라벨 1.5 mL 저유지관(재료 표)및 aliquot 650 μL의 이소프로판올을 각각 에 넣습니다.
- 조심스럽게 상부 수성 상 (ca. 650 μL)을 취하고 이소 프로판올으로 준비된 튜브로 옮니다. 분홍색 유기 상을 만지지 마십시오.
- -20°C에서 하룻밤 동안 RNA를 침전시한다.
참고: 샘플을 -20°C 또는 -80°C에서 이소프로판올에 보관하고 필요할 때만 물에 용해시키는 것이 좋습니다. 수성 RNA는 수주/개월 동안 보관할 때 -80°C에서도 저하됩니다.
- RNA 강수량
- 탁상 원심분리기를 4°C로 식힙니다.
- RNase가 없는 물로 신선한 80% EtOH를 준비하고 -20°C에서 식히고 (-80°C에서 5분 간 공정 속도를 높이는 데 도움이 됩니다).
- 샘플을 최대 속도(약 13,000 x g)로30분 동안 원심분리하고 상한액을 폐기합니다. 펠릿은 보이지 않으므로 마치 그곳에 있는 것처럼 조심스럽게 피펫을 피펫으로 표시합니다. 차가운 80% EtOH 의 1 mL을 추가하고 튜브를 1~2회 반전시다.
- 최대 속도로 30 분 동안 다시 원심 분리기를 하고 총 2 번의 세척으로 세척을 반복하십시오.
- 2분 동안 스핀다운하고 10 μL 팁으로 잔류 EtOH를 모두 제거합니다. 펠릿을 실온에서 3-5분 간 건조시키고 20 μL RNase 가 없는 물에 다시 그대로 두십시오.
- 샘플을 얼음 위에 보관하고 가능한 한 빨리 품질 관리를 수행하십시오. 샘플을 -80°C에서 보관합니다. 동결 해동 주기를 피하십시오.
- 제조업체의 권장 사항에 따라 전용 장비(재료 표)를사용한 품질 관리.
8. 도서관 준비
- SMARTer v4 초저입력 RNA 키트로 cDNA 합성 및 증폭
- 4.75 μL의 부피에서 TRAP-RNA 또는 총 RNA의 1.5 ng를 가지고 각 샘플의 희석을 계산합니다.
- 반응 량의 1/2로 제조업체의 권장 사항에 따라 모든 단계를 수행합니다. 12-13 PCR 주기로 cDNA를 증폭합니다.
- 0.5 μL의 10x 용해 버퍼와 25 μL의 SPRI 비드(재료 표)를추가하여 PCR을 정리합니다. 많은 샘플이 용해 버퍼를 처리하고 비드가 미리 혼합될 수 있는 경우. 비드가 파이펫팅 전에 고르게 분산되어 있는지 확인하십시오.
- 프로토콜을 전체 반응 량(용출 완충액 17 μL)으로 진행합니다. 구슬을 3 분 이상 건조시키지 마십시오. 과건조된 시료는 장기간 배양 시간에 의해 잠재적으로 구출될 수 있습니다.
- Qubit HS DNA 키트로 샘플 농도를 측정합니다.
참고 : SMARTer v4 키트는 200 pg 입력까지 견딜 수 있습니다. 우리는 Qubit 값이 16 주기 PCR로 (250 pg, 탐지 제한 미만)을 결정할 수없는 경우 라이브러리를 얻었습니다. 그러나 제한된 입력 재질로 덜 복잡한 라이브러리를 생성할 수도 있습니다.
- Nextera XT DNA 라이브러리 준비 키트를 갖춘 단편화 및 어댑터 결찰 PCR
- CDNA를 RNase 가없는 물로 희석하여 PCR 튜브에서 200 pg /μl 및 파이펫 1.25 μL의 농도를 얻습니다.
- 반응 량의 1/4로 제조업체에 따라 모든 단계를 수행합니다. 하나의 시퀀싱 풀에 속하는 샘플에 대해 12개의 PCR 사이클과 호환 어댑터로 cDNA를 증폭합니다. Illumina의 인덱스 키트 A 및 D를 사용하면 최대 384개의 샘플을 멀티플렉싱할 수 있습니다.
- PCR 클린업을 위해 12.5 μL의 재서스펜션 버퍼와 22.5 μL의 SPRI 비드(0.9배 비)를 추가합니다. 용출 완충제 22 μL로 샘플을 용출합니다.
참고: QC 및 풀링은 시퀀싱회사(재료 표)에의해 수행되었기 때문에 비드 기반 정규화가 필요하지 않았습니다. 효소 단편화 반응 (tagmentation)은 모든 효소가 한 번만 자르기 때문에 물질 입력에 매우 민감합니다. 따라서 농도 권장 사항을 초과하지 마십시오.
Access restricted. Please log in or start a trial to view this content.
결과
품질 평가를 위해, 전술한 절차는 몇 가지 중간 단계에서 조사되어야 한다: 질라에서의 발현 패턴 검증, 단리된 다각형 RNA의 품질 관리뿐만 아니라 최종 라이브러리. 공지된 마커 유전자를 이용한 qRT-PCR은, 또한, 치료 조건에 대한 반응을 확인하거나 실험 조건을 미세 조정하기 위해 수행될 수 있다.
GFP 신호 분포의 공초?...
Access restricted. Please log in or start a trial to view this content.
토론
RPL18 현지화 패턴 검증
TRAP 실험에서 데이터의 잘못된 해석을 방지하는 데 중요한 것은 태그가 지정된 리보소말 소단위의 적절한 발현 패턴입니다. 따라서, RPL18에 에피토프 태그로서 GFP의 혼입은 매우 우아하게 동일한 조직에서 다각성 분획의 원하는 발현 패턴 및 연속적으로, 풀다운의 검증을 가능하게 한다. 적절한 프로모터 패턴을 보장하기 위한 보다 침습적인 접근법은 Jiao 및 M...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는이 프로젝트의 초기 단계에서 중요한 전문가 조언을 취리히 유전 다양성 센터의 장 클로드 Walser에 감사드립니다. Vermeer 연구소의 작업은 SNF 교수 직교 보조금(PP00P3_157524)과 JEMV에 수여된 스위스 국립 과학 재단(SNSF)의 R'EQUIP 장비 보조금(316030_164086)에 의해 지원되었습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Sterilization | |||
| bleach, 13% | Sigma | 71696 | |
| beaker | VWR | 214-1172/74/75 | |
| desiccator with porcelaine plate (DURAN) | Sigma/Merck | Z317454-1EA/Z317594-1EA | |
| EtOH, p.a. | Honeywell | 02860-1L | |
| HCl, 37% | Roth | 4625.1 | |
| Tween 20 | Sigma | P9416 | |
| Plate growth + harvesting | |||
| MS salts, basal salt mixture, incl. MES buffer | Duchefa | M0254 | |
| agar plant for cell culture | Applichem/Panreac | A2111.1000 | |
| DMSO | Sigma | D4540 | |
| forcepts | Rubis Switzerland | 5-SA model | |
| KOH | Fluka | 60370 | |
| micropore/surgical tape | 3M | 1530-0 | |
| NAA | Duchefa | N0903 | |
| petri dishes 120x120 mm | Greiner bio-one | 688102 | |
| scalpel | VWR/Swann-Morton | 233-5454 | |
| tissues, neutral, two-layered | any supplier of your choice | ||
| Immunoprecipitation | |||
| GFP-beads: gtma-100 GFP-Trap_MA | Chromotek | e.g. gtma-100 | |
| Brij-35 | Sigma | P1254-500G | |
| centrifuge tubes (in accordance with centrifuge) | Beckman Coulter | 357001 | |
| Chloramphenicol | Applichem | C0378-25G | |
| cotton gloves | VWR | 113-7355 | |
| Cycloheximide, HPLC grade | Sigma | 01810-1G | |
| DEPC | VWR | E174 | might have long delivery times |
| DTT | Fluka | 43815 | |
| EGTA | Sigma | 3054.3 | |
| homogenizers DUALL 23 | KONTES GLASS CO (via VWR) | SCERSP885450-0023 (set) | SCERSP885451-0023 pestle only - SCERSP885452-0023 cylinder only; long delivery times |
| Igepal CA-360 | Sigma | I3021-100ml | |
| KCl | Sigma | 60130 | |
| MgCl2 hexahydrat | Roth | 2189.2 | |
| mortar and pestle | VWR | 470148-960 & 470019-978 | |
| PMSF | Roche | 10 837 091 001 | |
| Polyoxyethylene-(10)-tridecylether/PTE | Sigma | P2393-500G | |
| RNase-free water | Roth | T143.3 | |
| RNAZap | Thermo Fisher | AM9780/AM9782 | for cleaning surfaces |
| Tris, >99.3% | Roth | AE15.3 | |
| Triton X-100 | Fluka | T8787-250ml | |
| Tween 20 | Sigma | P9416-100ml | |
| RNA extraction | |||
| 2-Propanol, p.a. | Sigma | 33539-1L-GL-R | |
| Chloroform, HPLC grade | Scharlau | CL02181000 | |
| EtOH, p.a. | Honeywell | 02860-1L | |
| low-retention microcentrifuge tubes, 1.5 ml | Eppendorf/Sigma | Z666548-250EA | LoBind |
| RNase-free DNase set | Qiagen | 79254 | |
| RNeasy MiniElute Cleanup Kit | Qiagen | 74204 | |
| TRIzol reagent | ThermoFisher/Ambion | 15596018 | |
| Library preparation | |||
| 15/50 mL Tube Magnetic Separator | Abraxis | PN 472250 | |
| AMPure beads | Beckman Coulter | A63881 | |
| Index Kit A | Illumina | FC-131-2001 | |
| Index Kit D | Illumina | FC-131-2004 | |
| neodymium magnets | Amazon/other | 6 x 1.5 mm range: N42 (NdFeB) | |
| Nextera XT kit | Illumina | FC-131-1024/1096 | https://emea.support.illumina.com/ |
| PCR strips | ThermoScientific | AB-0266 | |
| SMARTer v4 kit | Takara Bioscience | 634892 | https://www.takarabio.com/ |
| Bioanalyzer | Agilent | 2100 Bioanalyzer Instrument | specialized equipment for RNA/DNA quality control |
| Tapestation | Agilent | 4200 Tapestation Instrument | specialized equipment for RNA/DNA quality control |
| Fragment Analyzer | Agilent | 5400 Fragment Analyzer System | specialized equipment for RNA/DNA quality control (high throughput) |
| LabChip | PerkinElmer | LabChip GX Touch Nucleic Acid Analyzer | specialized equipment for RNA/DNA quality control (high throughput) |
| Qubit 4 Fluorometer | ThermoFisher | Q33239 | specialized equipment for RNA/DNA concentration determination |
| qRT-PCR | |||
| GATA23 | Microsynth | fwd: AGTGAGAATGAA AGAAGAGAAGGG; rev: GTGGCTGCGAAT AATATGAATACC | |
| GH3.3 | Microsynth | fwd: CAAACCAATCCT CCAAATGAC; rev: ACTTATCCGCAA CCCGACT | |
| LBD29 | Microsynth | fwd: TCTCCAACAACA GGTTGTGAAT; rev: AAGGAGCCTTAG TAGTGTCTCCA | |
| UBC21 | Microsynth | fwd: TGCGACTCAGGG AATCTTCT; rev: TCATCCTTTCTT AGGCATAGCG | |
| SsoAdvanced Universal SYBR Green | Bio-Rad | #172-5270 | |
| iScript Adv cDNA Kit | Bio-Rad | #172-5038 | |
| miscellaneous | |||
| Falcon tubes 15 ml, Cellstar | Greiner bio-one | 188261 | |
| Falcon tubes 50 ml, Cellstar | Greiner bio-one | 210261 | |
| filter tips 1 ml | Axygen | TF-1000-R-S | |
| filter tips 10 µl | Axygen | TF-10-R-S | |
| filter tips 100 µl | Axygen | TF-100-R-S | |
| filter tips 20 µl | Axygen | TF-20-R-S | |
| filter tips 200 µl | Axygen | TF-200-R-S | |
| microcentrifuge tubes 1.5 ml | SARSTEDT | 72.690.001 | |
| Propidium iodide | Sigma | P4170-100MG | |
| sequencing company | Novogene | en.novogene.com |
참고문헌
- Van Verk, M. C., Hickman, R., Corné, M. J., Pieterse, M., Van Wees, S. C. RNA-Seq: Revelation Of The Messengers. Trends In Plant Science. 18 (4), 175-179 (2013).
- Libault, M., Pingault, L., Zogli, P., Schiefelbein, J. Plant Systems Biology At The Single-Cell Level. Trends In Plant Science. 22 (11), 949-960 (2017).
- Mustroph, A., et al. Profiling Translatomes Of Discrete Cell Populations Resolves Altered Cellular Priorities During Hypoxia In Arabidopsis. Proceedings Of The National Academy Of Sciences Of The United States Of America. 106 (44), 18843-18848 (2009).
- Karve, R., Iyer-Pascuzzi, A. S. Digging Deeper: High-Resolution Genome-Scale Data Yields New Insights Into Root Biology. Current Opinion In Plant Biology. 24, 24-30 (2015).
- Warner, J. R., Knopf, P. M., Rich, A. A Multiple Ribosomal Structure In Protein Synthesis. Proceedings of The National Academy of Sciences of The United States of America. 49 (1), 122-129 (1963).
- Gautam, V., Sarkar, A. K. Laser Assisted Microdissection, An Efficient Technique To Understand Tissue Specific Gene Expression Patterns And Functional Genomics In Plants. Molecular Biotechnology. 57 (4), 299-308 (2015).
- Bargmann, B. O. R., Birnbaum, K. D. Fluorescence Activated Cell Sorting Of Plant Protoplasts. Journal of Visualized Experiments. (36), e1673(2010).
- Deal, R. B., Henikoff, S. The Intact Method For Cell Type-Specific Gene Expression And Chromatin Profiling In Arabidopsis Thaliana. Nature Protocols. 6 (1), 56-68 (2011).
- Dougherty, J. D. The Expanding Toolkit Of Translating Ribosome Affinity Purification. The Journal of Neuroscience: The Official Journal Of The Society For Neuroscience. 37 (50), 12079-12087 (2017).
- Mustroph, A., Juntawong, P., Bailey-Serres, J. Isolation Of Plant Polysomal mRNA By Differential Centrifugation And Ribosome Immunopurification Methods. Methods in Molecular Biology. 553, 109-126 (2009).
- Matsushima, W., et al. SLAM-ITseq: Sequencing Cell Type-Specific Transcriptomes Without Cell Sorting. Development. 145 (13), (2018).
- Basnet, H., et al. Flura-Seq Identifies Organ-Specific Metabolic Adaptations During Early Metastatic Colonization. Elife. 8, (2019).
- Rodriques, S. G., et al. Slide-Seq: A Scalable Technology For Measuring Genome-Wide Expression At High Spatial Resolution. Science. 363 (6434), 1463-1467 (2019).
- Fazal, F. M., et al. Atlas Of Subcellular RNA Localization Revealed By Apex-Seq. Cell. 178 (2), 473-490 (2019).
- Slane, D., Bayer, M. Cell Type-Specific Gene Expression Profiling Using Fluorescence-Activated Nuclear Sorting. Plant Gene Regulatory Networks: Methods And Protocols. Kaufmann, K., Mueller-Roeber, B. , Springer. New York, NY. 27-35 (2017).
- Zanetti, M. E., Chang, I. F., Gong, F., Galbraith, D. W., Bailey-Serres, J. Immunopurification Of Polyribosomal Complexes Of Arabidopsis For Global Analysis Of Gene Expression. Plant Physiology. 138 (2), 624-635 (2005).
- King, H. A., Gerber, A. P. Translatome Profiling: Methods For Genome-Scale Analysis Of mRNA Translation. Briefings In Functional Genomics. 15 (1), 22-31 (2016).
- Mašek, T., Valášek, L., Pospíšek, M. Polysome Analysis And RNA Purification From Sucrose Gradients. RNA: Methods And Protocols. Nielsen, H. , Humana Press. Totowa, NJ. 293-309 (2011).
- Heiman, M., et al. A Translational Profiling Approach For The Molecular Characterization Of Cns Cell Types. Cell. 135 (4), 738-748 (2008).
- Halbeisen, R. E., Scherrer, T., Gerber, A. P. Affinity Purification Of Ribosomes To Access The Translatome. Methods. 48 (3), 306-310 (2009).
- Thomas, A., et al. A Versatile Method For Cell-Specific Profiling Of Translated mRNAs In Drosophila. Plos One. 7 (7), e40276(2012).
- Watson, F. L., et al. Cell Type-Specific Translational Profiling In The Xenopus Laevis Retina. Developmental Dynamics. 241 (12), 1960-1972 (2012).
- Lam, P. Y., Harvie, E. A., Huttenlocher, A. Heat Shock Modulates Neutrophil Motility In Zebrafish. Plos One. 8 (12), e84436(2013).
- Fang, Y., et al. Translational Profiling Of Cardiomyocytes Identifies An Early Jak1/Stat3 Injury Response Required For Zebrafish Heart Regeneration. Proceedings Of The National Academy Of Sciences Of The United States Of America. 110 (33), 13416-13421 (2013).
- Mustroph, A., Zanetti, M. E., Girke, T., Bailey-Serres, J. Isolation And Analysis Of mRNAs From Specific Cell Types Of Plants By Ribosome Immunopurification. Methods In Molecular Biology. 959, 277-302 (2013).
- Monshausen, G. B., Gilroy, S. Feeling Green: Mechanosensing In Plants. Trends In Cell Biology. 19 (5), 228-235 (2009).
- Day, R. C., Grossniklaus, U., Macknight, R. C. Be More Specific! Laser-Assisted Microdissection Of Plant Cells. Trends In Plant Science. 10 (8), 397-406 (2005).
- Sheen, J. Signal Transduction In Maize And Arabidopsis Mesophyll Protoplasts. Plant Physiology. 127 (4), 1466-1475 (2001).
- Datta, S., et al. Laser Capture Microdissection: Big Data From Small Samples. Histology And Histopathology. 30 (11), 1255-1269 (2015).
- Birnbaum, K., et al. A Gene Expression Map Of The Arabidopsis Root. Science. 302 (5652), 1956(2003).
- Hamant, O., Haswell, E. S. Life Behind The Wall: Sensing Mechanical Cues In Plants. BMC Biology. 15 (1), 1354(2017).
- Vragović, K., et al. Translatome Analyses Capture Of Opposing Tissue-Specific Brassinosteroid Signals Orchestrating Root Meristem Differentiation. Proceedings of The National Academy of Sciences of the United States of America. 112 (3), 923-928 (2015).
- Wang, Y., Jiao, Y. Translating Ribosome Affinity Purification (Trap) For Cell-Specific Translation Profiling In Developing Flowers. Methods In Molecular Biology. 1110, 323-328 (2014).
- Sablok, G., Powell, J. J., Kazan, K. Emerging Roles And Landscape Of Translating mRNAs In Plants. Frontiers in Plant Science. 8, 1443(2017).
- Ron, M., et al. Hairy Root Transformation Using Agrobacterium Rhizogenes As A Tool For Exploring Cell Type-Specific Gene Expression And Function Using Tomato As A Model. Plant Physiology. 166 (2), 455-469 (2014).
- Reynoso, M. A., et al. Evolutionary Flexibility In Flooding Response Circuitry In Angiosperms. Science. 365 (6459), 1291-1295 (2019).
- Dolan, L., et al. Cellular Organisation Of The Arabidopsis Thaliana Root. Development. 119 (1), 71(1993).
- Ristova, D., Barbez, E. Root Development. , Springer. New York, NY. (2018).
- Shekhar, V., Stӧckle, D., Thellmann, M., Vermeer, J. E. M. The Role Of Plant Root Systems In Evolutionary Adaptation. Current Topics in Developmental Biology. 131, 55-80 (2019).
- Malamy, J. E., Benfey, P. N. Down And Out In Arabidopsis: The Formation Of Lateral Roots. Trends in Plant Science. 2 (10), 390-396 (1997).
- de Smet, I., et al. Bimodular Auxin Response Controls Organogenesis In Arabidopsis. Proceedings of the National Academy of Sciences of The United States of America. 107 (6), 2705-2710 (2010).
- Péret, B., et al. Arabidopsis Lateral Root Development: An Emerging Story. Trends In Plant Science. 14 (7), 399-408 (2009).
- Vilches-Barro, A., Maizel, A. Talking Through Walls: Mechanisms Of Lateral Root Emergence In Arabidopsis Thaliana. Current Opinion in Plant Biology. 23, 31-38 (2015).
- Porco, S., et al. Lateral Root Emergence In Arabidopsis Is Dependent On Transcription Factor Lbd29 Regulation Of Auxin Influx Carrier Lax3. Development. 143 (18), 3340-3349 (2016).
- Stoeckle, D., Thellmann, M., Vermeer, J. E. Breakout-Lateral Root Emergence In Arabidopsis Thaliana. Current Opinion in Plant Biology. 41, 67-72 (2018).
- Banda, J., et al. Lateral Root Formation In Arabidopsis: A Well-Ordered Lrexit. Trends in Plant Science. 24 (9), 826-839 (2019).
- Vermeer, J. E. M., et al. A Spatial Accommodation By Neighboring Cells Is Required For Organ Initiation In Arabidopsis. Science. 343 (6167), 178-183 (2014).
- Vanneste, S., et al. Cell Cycle Progression In The Pericycle Is Not Sufficient For Solitary Root/Iaa14-Mediated Lateral Root Initiation In Arabidopsis Thaliana. The Plant Cell. 17 (11), 3035-3050 (2005).
- Marques-Bueno, M. M., et al. A Versatile Multisite Gateway-Compatible Promoter And Transgenic Line Collection For Cell Type-Specific Functional Genomics In Arabidopsis. The Plant Journal : For Cell and Molecular Biology. 85 (2), 320-333 (2016).
- Shimada, T. L., Shimada, T., Hara-Nishimura, I. A Rapid And Non-Destructive Screenable Marker, Fast, For Identifying Transformed Seeds Of Arabidopsis Thaliana. The Plant Journal : For Cell and Molecular Biology. 61 (3), 519-528 (2010).
- Clough, S. J., Bent, A. F. Floral Dip: A Simplified Method For Agrobacterium Mediated Transformation Of Arabidopsis Thaliana. The Plant Journal. 16 (6), 735-743 (1998).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized Method For High-Throughput Sterilization Of Arabidopsis Seeds. Journal Of Visualized Experiments. (128), e56587(2017).
- Andersen, T. G., et al. Diffusible Repression Of Cytokinin Signalling Produces Endodermal Symmetry And Passage Cells. Nature. 555, 529-533 (2018).
- Schroeder, A., et al. The Rin: An Rna Integrity Number For Assigning Integrity Values To Rna Measurements. BMC Molecular Biology. 7, 3(2006).
- Vragović, K., Bartom, E., Savaldi-Goldstein, S. Quantitation Of Cell Type-Specific Responses To Brassinosteroid By Deep Sequencing Of Polysome-Associated Polyadenylated RNA. Methods in Molecular Biology. 1564, 81-102 (2017).
- Bertin, B., Renaud, Y., Aradhya, R., Jagla, K., Junion, G. Trap-Rc, Translating Ribosome Affinity Purification From Rare Cell Populations Of Drosophila Embryos. Journal Of Visualized Experiments. (103), e52985(2015).
- Livak, K. J., Schmittgen, T. D. Analysis Of Relative Gene Expression Data Using Real-Time Quantitative PCR And The 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Jiao, Y., Meyerowitz, E. M. Cell-Type Specific Analysis Of Translating Rnas In Developing Flowers Reveals New Levels Of Control. Molecular Systems Biology. 6, 419(2010).
- Tian, C., et al. A Gene Expression Map Of Shoot Domains Reveals Regulatory Mechanisms. Nature Communications. 10 (1), 141(2019).
- Townsley, B. T., Covington, M. F., Ichihashi, Y., Zumstein, K., Sinha, N. R. Brad-Seq: Breath Adapter Directional Sequencing: A Streamlined, Ultra-Simple And Fast Library Preparation Protocol For Strand Specific mRNA Library Construction. Frontiers in Plant Science. 6, 366(2015).
- Song, Y., et al. A Comparative Analysis Of Library Prep Approaches For Sequencing Low Input Translatome Samples. BMC Genomics. 19 (1), 696(2018).
- Basu, D., Haswell, E. S. Plant Mechanosensitive Ion Channels: An Ocean Of Possibilities. Current Opinion in Plant Biology. 40, 43-48 (2017).
- Brady, S. M., et al. A High-Resolution Root Spatiotemporal Map Reveals Dominant Expression Patterns. Science. 318 (5851), 801(2007).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유