Method Article
יישום הפרעות CRISPR (CRISPRi) להשתקת גנים במינים פתוגניים של לפטוספירה
In This Article
Summary
כאן, היישום של הפרעות CRISPR (CRISPRi) עבור השתקת גנים ספציפיים במין לפטוספירה מתואר. תאי לפטוספירה משתנים על ידי הטיות עם פלסמידים המבטאים dCas9 (Cas9 "מת" קטליטי) ו- RNA בעל מדריך יחיד (sgRNA), האחראי על זיווג הבסיס למטרה הגנומית הרצויה. מוצגות שיטות לאימות השתקת גנים.
Abstract
לפטוספירוזיס הוא זונוזה מוזנחת גלובלית, האחראית לפחות למיליון מקרים בשנה וכמעט 60 אלף מקרי מוות. המחלה נגרמת על ידי חיידקים פתוגניים ואלימים של הסוג לפטוספירה, או על ידי מגע ישיר עם החיידקים או בעקיפין על ידי חשיפה למים מזוהמים או אדמה. חיות בית וחיות בר פועלות כמאגר של זיהום, ומשילות לפטוספירים מצינורות כליות קולוניאליים של הכליה, באמצעות שתן, לסביבה. הדור של זנים מוטנטיים של לפטוספירה הוא קריטי כדי להעריך ולהבין מנגנונים פתוגניים של זיהום. הפרעות CRISPR (CRISPRi) הוכיחו את עצמם ככלי פשוט, זול וספציפי להשתקת גנים בלפטוספירהפתוגנית . לכן, הפרטים המתודולוגיים של קבלת המבנים plasmid המכילים הן dCas9 והן RNA מדריך, משלוח של plasmids ל לפטוספירה על ידי הטיות עם זן E. coli β2163, והתאוששות והערכה transconjugant, יתואר. בנוסף, התקשורת שתוארה לאחרונה הורנסבי-אלט-נאלי (HAN) מאפשרת בידוד מהיר יחסית ובחירה של מושבות מוטציות על לוחות אגר.
Introduction
לפטוספירוזיס הוא זונוזה עולמית מוזנחת הנגרמת על ידי מינים פתוגניים ואלימים של הסוג לפטוספירה. אצל בני אדם, המחלה אחראית ליותר ממיליון מקרים ו -60,000 מקרי מוות בשנה ברחבי העולם1,2. עד כה, אין חיסון ארוך טווח ויעיל למחלה. זיהוי גורמי ארס ומנגנונים פתוגניים הוא חיוני להתפתחות של אסטרטגיות טיפוליות ומונעות טובות יותר. לכן, היכולת ליצור מוטציות גנטיות ולהעריך את הפנוטיפ המתקבל היא קריטית לניתוח גנומי פונקציונלי3.
בניית מוטנטים בלפטוספירה פתוגנית נחשבה, עד כה, לא יעילה מטבעה, מייגעת, יקרה וקשה ליישום. תרחיש זה השתנה באופן דרסטי עם היישום של הפרעות CRISPR האחרונות (CRISPRi) כדי saprophytic4 ופתוגניים 5 לפטוספירים.
השתקת גנים מושגת על ידי ביטוי של שני מרכיבים: גרסה של CRISPR / Cas (cמבריק regularly interspaced short palindromic repeat /CRISPR כמוsociated) אנזים Cas9 מ סטרפטוקוקוס pyogenes, הנקרא Cas9 מת קטליטית (dCas9) ו RNA מדריך יחיד (sgRNA), שניתן לערוך על פי היעד הרצוי6,7,8. חלבון dCas9, כאשר הוא קשור ל- sgRNA, מופנה למטרות DNA ספציפיות על ידי זיווג בסיס ווטסון ו- Crick, מה שגורם לחסימה סטרית להתארכות פולימראז RNA, וכתוצאה מכך השתקת גנים עקב שעתוק הגן החסום7 (איור 1).
כתב יד זה נועד לתאר את בניית הפלסמיד להבעת dCas9 ו- sgRNA, הטיות בין התורם E. coli β 2163 לבין תאי לפטוסירה הנמענים, התאוששות בין-יבשתית, ולבסוף, אימות מושבות מוטציות נבחרות.
Protocol
1. הגדרת פרוטוספייסר ובניית פלסמיד
הערה: בסעיף זה, השלב הראשון של בחירת protospacers מתאימים לבניית sgRNA וקשר נוסף לתוך pMaOri.dCas9, מתואר (איור 1). רצף פרוטו-ספיסר זה מורכב מרצף של 20 נוקלאוטידים כנגד המטרה הרצויה.
- להשיג את רצף הנוקלאוטידים של גן העניין להשתקה ב- GenBank (https://www.ncbi.nlm.nih.gov/genbank). שלח אותו לשרת האינטרנט CHOPCHOP (http://chopchop.cbu.uib.no/), עם פרמטרים שהוגדרו עבור סטרפטוקוקוס פיוגנס Cas9 ומוטיב NGG הסמוך protospacer לאחר בחירת "יעד Fasta". הגדר את הפרמטרים ל- NGG "CRISPR/Cas9" ו- PAM (מוטיב סמוך של protospacer).
- בהתבסס על התוצאות שהושגו, בחר protospacers עם הציון הטוב ביותר האפשרי (חץ ירוק), הממוקמים קרוב ככל האפשר 5'end של אזור הקידוד, והכי חשוב, כלולים גדיל תבנית (מינוס) מאז sgRNA חייב להתאים את גדיל הקידוד של הגן עבור השתקת גנים מלאה.
הערה: מוטיב NGG אינו כלול ברצף sgRNA הסופי. - השתמש במקדם lipL32 כדי לבטא את ה- RNA המדריך היחיד המכיל רצף נוקלאוטידים משתנה של 20 בקצה 5 ' ורצף פיגומים dCas9 שמור. מזגו את רצף 20 nt, המכונה protospacer, למקדם lipL32 (בקצה 5') ופיגומי sgRNA (3'end) (איור 1B).
הערה: עבור מקדם lipL32 מוגדר היטב, השתמש באזור האמרגן הכולל -334 ל- TSS (אתר התחלת תמלול, המבוסס על Zhukova ואח'9). בדוק את הקובץ המשלים לקבלת קלטת sgRNA הסופית. - צור את קלטת sgRNA על-ידי PCR5 רציף או שסינתז אותה על-ידי ספק מסחרי.
- לאחר קבלת הקלטת, ליתז אותו pMaOri.dCas9 plasmid באתר ההגבלה של חג המולדהראשון בשני קצות (cccggg)4.
- לעכל הן את קלטת sgRNA והן pMaOri.dCas9 plasmid עם אנזים הגבלת חג המולדI ולהמשיך קשירה (איור 1B).
- בצע את שלבי השיבוט בזן E. coli e. coli e. auxotrophic dT π110, בשל pMaOri11 (ובהרחבה, pMaOri.dCas9) מקור השכפול, R6K-גמא.
הערה: לקבלת פרוטוקול מפורט עבור קשירה ובחירת שיבוט, עיין בפרסומים קודמים של פרננדס ונסימנטו12. dCas9 מונחה sgRNA ייקשר לגדיל הקידוד של הגן הנבחר של עניין, ולכן, יחסום התארכות פולימראז RNA (איור 1C), וכתוצאה מכך השתקת גנים.
2. טרנספורמציה לפטוספירה על ידי הטיות
הערה: ערכה גרפית של שלב זה מוצגת באיור 2. כדי להפוך את HAN מדיה וצלחות HAN, עיין הורנסבי ואח'13 ו פרננדס ואח'5.
- לגדל תאי לפטוספירה פתוגניים ב 29 או 37 °C (50 °F) ב HAN מדיה13 תחת תסיסה על ידי דילול תרבות רוויה HAN טרי בשעה 1:100; בדרך כלל, L. interrogans serovar קופנהגני זן Fiocruz L1-130 לוקח 4-6 ימים כדי להגיע לצפיפות התא המתאים.
- ודא שתרביות מגיעות לתקליטת מנת יתר של 0.2-0.4 ב- 420 ננומטר (2 עד 5 x 108 תאים/מ"ל) לפני השימוש בהטיות.
הערה: מאז HAN מדיה משנה צבע כמו צפיפות התא להגדיל (בשל פנול אדום הכלול במדיה DMEM), צנטריפוגה (4,000 x גרם,15 דקות, טמפרטורת החדר) 1 מ"ל של מדיה התרבות כדי להסיר לפטוספירים ולהחיל supernatant כמו ריק למדידת O.D.
- ודא שתרביות מגיעות לתקליטת מנת יתר של 0.2-0.4 ב- 420 ננומטר (2 עד 5 x 108 תאים/מ"ל) לפני השימוש בהטיות.
- הפוך את זן E. coli ההזוי β2163, אוקסוטרופי לחומצה דיאמינופימלית (DAP), עם pMaOri.dCas9 המכיל את קלטת sgRNA. עבור E. שינוי קולי, השתמש בפרוטוקולי הלם חום או אלקטרופורציה. כלול טרנספורמציה עם pMaOri.dCas9 plasmid ללא קלטת sgRNA כפקד.
- לשינוי הלם חום, מערבבים את ה- DNA הפלסמי (100 ננוגרם) עם תאי E. coli בעלי יכולת כימית ודגרה על קרח למשך 30 דקות. בצע הלם חום ב 42 °C (90 s) ומניחים אותו שוב על קרח במשך 5 דקות. לשחזר את התאים על ידי הוספת 1 מ"ל של מדיה LB, דגירה ב 37 °C (50 °F) במשך 1 שעות ולהמשיך ציפוי.
- עבור אלקטרופורציה, השתמש בתאים אלקטרו-קומפטנטיים מעורבבים עם 100 ננוגרם של DNA plasmid. השתמש בפרמטרים הבאים עבור דופק: 1.8 kV, 100 Ω ו 25 μF. לשחזר את התאים כפי שהוסבר לעיל.
- צלחת התאים E. coli התורם המרה במדיום אגר LB בתוספת חומצה Diaminopimelic (DAP) (0.3 mM) ו spectinomycin (40 מיקרוגר /mL) כדי לבחור עבור plasmids.
- להטיה, בחר מושבה אחת מכל צלחת יום אחד לפני יום ההטיה (אשר נקבע על ידי ניטור O.D. של תרבויות לפטוסספירים).
- בחר מושבה אחת של E. coli β2163 מתוך pMaOri.dCas9 הריק, ואחד מלוחות pMaOri.dCas9sgRNA. אפשר להם לגדול לילה ב 10 מ"ל של LB בתוספת DAP ו spectinomycin ב 37 °C (50 °F).
- למחרת, לדלל את התרבויות הרוויות 1:100 ב 10 מ"ל של LB טרי בתוספת DAP (לא כוללים את האנטיביוטיקה כאן) עד OD420nm של 0.2-0.4. בדרך כלל, זה לוקח 2-3 שעות עבור E. coli להגיע לצפיפות זו.
- בתוך מכסה המנוע BSL2 biosafety, להרכיב מנגנון סינון על ידי הצבת קוטר 25 מ"מ, גודל נקבובית 0.1 מיקרומטר, מסנן ממברנה אסטרים תאית מעורב בחלק העליון של בסיס הזכוכית. מניחים משפך זכוכית 15 מ"ל למעלה ומחזיקים את שני החלקים עם מלחציים באביב. חברו את הזכוכית למשאבת ואקום והוסיפו את התרבויות למשפך לסינון.
- הוסף 5 מ"ל של תרבות לפטוספירה למשפך. הוסף נפח של E. coli כדי להוות את הפרופורציה 1:1 בהתבסס על ערכי OD420nm של שתי התרבויות. הפעל את משאבת הוואקום ותרכז תאים על ידי סינון. לאחר ריכוז התא במסנן הממברנה, יש לאחזר אותו בזהירות. ודא בינוני מסונן דרך הממברנה.
הערה: סינון לוקח 5 עד 10 דקות. - מקם את המסנן על צלחת EMJH זמינה מסחרית (ראה טבלת חומרים) בתוספת DAP (0.3 mM). ודא שצד החיידקים למעלה. לדגור על הצלחות ב 29 °C (50 °F) במשך 24 שעות.
הערה: אם HAN או צלחות EMJH14 משלימות משמשים, E. coli יכול להתרבות ולהתגבר על הפרופורציה המיועדת 1:1, אשר בתורו יכול להפחית את יעילות ההטיה5. - לאחר 24 שעות, לשחזר את המסננים מן הצלחות ומניחים כל מסנן בודד בצינור חרוט 50 מ"ל.
- השתמש 1 מ"ל של מדיום HAN נוזלי כדי לשחרר את התאים מפני השטח מסנן על ידי pipetting נרחב מערבולת.
- דמיינו את פתרונות החיידקים המעורבים שנמצאו על ידי מיקרוסקופיית שדה כהה כדי לבדוק אם יש כדאיות ותנועתיות של תאים, ואת הפרופורציות של לפטוספירה:E. coli.
הערה: בשלב זה, ניתן לראות מספרים שווים של E. coli ו לפטוספירה. - יש למרוח 100-200 מיקרו-אל של תרבות זו על לוחות HAN המכילים סרום ארנבת מומת של 0.4% וספקטינומיצין של 40 מיקרוגרם/מ"ל. לוחות דגירה ב 37 °C (5 °F) באטמוספרה 3% CO2.
הערה: בדרך כלל, L. interrogans serovar קופנהגני זן Fiocruz L1-130 תאים יוצרים מושבות ב 5-7 ימים על לוחות בקרה וב 8-10 ימים על לוחות spectinomycin. בשלב זה, E. coli לא יגדל מאז הם auxotrophic עבור DAP. - כשליטה, לדלל תרביות ב 104 לפטוספירים / מ"ל ולהוסיף 100 μL על לוחות ללא אנטיביוטיקה, לניטור צמיחה לפטוספירלית.
3. בחירת מושבה וצמיחה ואימות בין יבשתיים
הערה: מושבות צריכות להיות גלויות עד היום 10. עם זאת, הם לא קל מדי לדמיין. בדרך כלל בנקודת זמן זו, לוחות HAN הם קצת אטומים בגלל התאים היבשים שהופצו ומושבות לפטוספירה יכולות להופיע כהילה שקופה על רקע הלבן. מומלץ לראות את הלוחות בזוויות שונות כדי להשיג שכיחות אור שונה, ולכן, מה שהופך את המושבות גלויות יותר. בזמני דגירה ארוכים יותר, מושבות יכולות לרכוש מראה צפוף יותר, ובמקרה זה, הן מציגות כהילה חלבית על רקע כהה.
- הוסף 100 μL של מדיה HAN נוזלית לכל 1.5 מ"ל microTube כדי לשחזר מוטציות. קח לפחות 3 מושבות מכל צלחת.
- בעזרת קצה מיקרופיפט, "לחפור" את אגר כדי לאחזר את המושבות מן הצלחות מאז מושבות לפטוסירליות יכול להיות תת קרקעי.
הערה: אגר צפוי להילקח בשלב זה. מושבות יש לקחת מלוחות בקרה המכילים pMaOri.dCas9 plasmid ריק, וצלחות עם לפטוספירים המכילים plasmids מבטאים הן dCas9 ו RNA מדריך יחיד, המיועד לגן היעד. - לחלק את המושבה שנאספה ב 100 μL של מדיה HAN ב microtube 1.5 מ"ל הומוגני במרץ. בשלב זה, להבטיח הפסקה מקסימלית של שלמות אגר כדי לשחרר תאים. מערבולת ההשעיה ל-10.
- בעזרת קצה מיקרופיפט, "לחפור" את אגר כדי לאחזר את המושבות מן הצלחות מאז מושבות לפטוסירליות יכול להיות תת קרקעי.
- דמיין את התאים המשוחזרים על ידי מיקרוסקופיית שדה כהה בהגדלה של פי 200-400 על ידי הוספת טיפה של 5 μL על שקופית זכוכית וכסה את הדגימות מיד עם כיסוי.
- אשר את נוכחותם של לפטוספירים חיים ובת קיימא התאושש מהמושבות.
- לאחר הדמיה ואישור של לפטוספירים קיימא, להעביר 100 μL של תאים למדיה HAN נוזלי המכיל 40 מיקרוגרם / mL spectinomyצין.
- לאחר צמיחה במדיה HAN נוזלי, להעריך את התרבויות לנוכחות של plasmid עם pMaOri2 F פריימר (ACGCAATATTCGATACCGAC) ו R (ATAGGTGAAGTAGGCCCACCC), אשר מזהים את האזור כי אגף את קלטת sgRNA.
- לאסוף 200 μL של תרבות, צנטריפוגה (4,000 x גרם,15 דקות), להשליך את supernatant, ו respend הכדור המתקבל ב 20 μL של מים.
- השתמש בהשעיה זו כתבנית עבור PCR נוסף, ללא צורך בחילוץ DNA12.
הערה: תאים עם pMaOri.dCas9 יעבדו אמפליסון של 281 bp, לעומת אלה המכילים את plasmids עם קלטת sgRNA אשר יעבד אמפליסון של 723 bp.
- לאישור השתקת גנים, בצע אימונובלוט המשתמש בתמציות תאים מ transconjugants המכיל רק pMaOri.dCas9 (שליטה שלילית) ו pMaOri.dCas9sgRNA.
- החל את המקבילה של 5 x 107 תאים לכל נתיב של נתרן דודסיל סולפט (SDS) ג'ל פוליאקרילמיד.
- חלבוני אלקטרו-תזרים לממברנה לדגירה עם נוגדנים מתאימים. מלבד הנוגדן נגד גן היעד להשתקה, השתמש עוד אחד לבקרת טעינה.
- שמור את תרביות המוטציות בתקשורת HAN בתוספת ספקטינומיצין לשמירה על הפלסמיד. אם אין אנטיביוטיקה מוחלת על התקשורת, השתקת גנים מלאה ניתן לראות לפחות שלושה מעברים5.
תוצאות
למרות התוכן CG בגנומים לפטוספירה spp. הוא בדרך כלל סביב 35%; כמעט כל גן צפוי להכיל את PAM 5'NGG 3'; יש לקחת בחשבון מוטיב זה בגדיל התבנית. לאחר הזנת רצף הקידוד של גן (מההתחלה ועד הפסקת קודונים), בהתבסס על תוצאות CHOPCHOP, יש לבחור פרוטו-ספייסרים בגדיל המינוס (-, התבנית). חשוב לא לכלול את מוטיב NGG בפרוטו-ספייסר sgRNA של 20 nt.
אם ההטיה מתבצעת עם 1:1 תורם: שיעור תא הנמען, עבור 24 שעות על פני השטח של לוחות אגר EMJH בתוספת DAP, ו 200 μL של השעיית חיידקים התאושש מופצים על HAN בתוספת לוחות אגר ספקטינומיצין, מושבות transconjugants צריך להיות גלוי בערך 8-10 ימים. התפשטות של נפח זה בדרך כלל גורמת ל-20-40 מושבות לצלחת(איור 3A). על מנת לבדוק את הכדאיות התא לאחר ההטיות, תאים ניתן להפיץ על לוחות HAN ללא בחירה אנטיביוטית. במקרה זה, מושבות ניתן לראות ברגע 7 ימים. לוחות HAN הופכים צהוב חיוור באטמוספירה של 3% CO2.
לאחר קטיף המושבה וצמיחה במדיה נוזלית בתוספת ספקטינומיצין, PCR באמצעות תאים שלמים פריימרים pMaOri2 יכול לשמש לבדיקת איכות ראשונית של transconjugants (איור 3B). תאים לפטוספירליים המכילים את pMaOri.dCas9 plasmid הבקרה אמורים לגרום לאמפליקון של 281 bp, בעוד תאים אלה המכילים את plasmid להשתקה, כלומר, המכיל הן dCas9 ו sgRNA, צריך לגרום אמפליסון 723 bp. pMaOri2 F ו- R פריימרים תוכננו לאגף את אתר ההגבלה של חג המולדI, שהוא האתר המשמש במהלך קשירת קלטות sgRNA.
עם אישור של נוכחות plasmid, תאים ניתן לקצור מהתקשורת, שטף פעמיים עם PBS, ולאחר מכן משמש להכנת תמצית תא שלם עבור חיסונים. אם ההשתקה התרחשה, חלבוני היעד, במקרה זה, גם LipL32 או גם LigA ו- LigB, יש לראות רק בתאי סוג הבר ובאלה המכילים pMaOri.dCas9; אפילו בזמני חשיפה גבוהים יותר, אין לראות חלבונים מתאימים בתאים המכילים pMaOri.dCas9sgRNA (איור 3C).
אם מתוכננים ניסויים להערכת עוצמה לפטוספירלית לאחר השתקת גנים, תרבויות המשמשות להטיה צריכות להיות נמוכות במעבר ארסי לפטוספירה. לאחר השתקת גנים מאושר, כמה aliquots ניתן להקפיא כגיבוי. אם הגן המושתק יש פנוטיפ מדיד, למשל, בהתבסס על עבודה קודמת עם חלבונים רקומביננטיים, תרבויות יכולות לשמש לאימות, ובמקרה זה, תאים המכילים pMaOri.dCas9 בלבד, ניתן לכלול כשליטה שלילית.
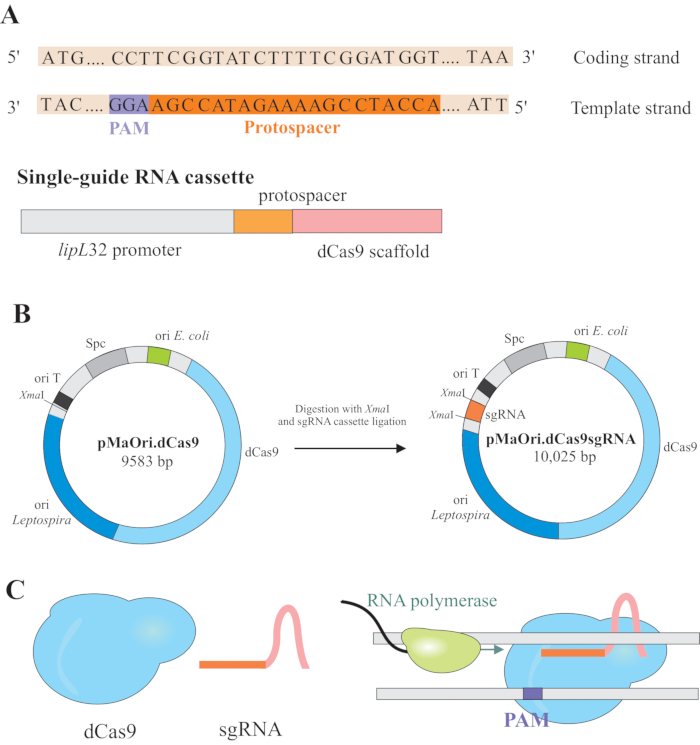
איור 1: פיתוח של dCas9 ו sgRNA המבטא פלסמיד. (A)פרוטו-ספייסזר באורך 20 nt, ואחריו S. pyogenes dCas9 PAM 5'-NGG-3', נבחר בתוך גדיל התבנית של גן היעד כך שה- sgRNA הבא יכול לבצע שיוך בסיס ווטסון ו- Crick לגדיל הקידוד המתאים, וכתוצאה מכך השתקת גנים מלאה. (B)קלטת sgRNA מורכבת ממקדם lipL32, פרוטו-ספייסר 20 nt ופיגומי dCas9. pMaOri.dCas9 plasmid משמש עמוד שדרה עבור קשירת קלטת sgRNA באתר ההגבלה של חג המולדI. הפלסמיד המתקבל, המכונה pMaOri.dCas9sgRNA מועבר לפטוספירים, והביטוי של dCas9 ו- sgRNA אחראי על השתקת הגן. (C)dCas9 בהכוונת sgRNA משמש כמחסום פיזי להארכת פולימראז RNA, ולכן, מעכב את שעתוק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
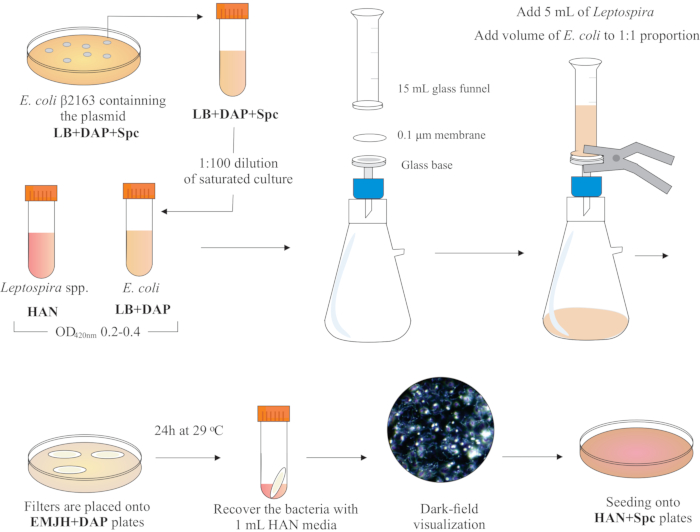
איור 2: ייצוג סכמטי של פרוטוקול ההטיה. המין הרצוי לפטוספירה גדל בתקשורת HAN, תחת עצבנות, עד ניתוח O.D. של 0.2-0.4 (שלב אמצע היומן) ב 420 ננומטר. יום אחד לפני ההטיה, מושבה של תורם רקומביננטי E. coli β2163 המכיל את plasmid של עניין הוא הרים מן LB + DAP + Spc אגר לוחות, כמו תאים גדלים לילה LB נוזלי עם אותו תוספי. למחרת, Eרווי. תרבויות קולי מדוללות ב- LB פלוס DAP וגדלות עד לתן O.D. של 0.2-0.4 ב- 420 ננומטר. הן התורם E. coli והן הנמען לפטוספירה מעורבבים ביחס תא 1:1 על פני השטח של מסנן 0.1 מיקרומטר על ידי מנגנון סינון תחת לחץ שלילי. לאחר מכן, מסננים ממוקמים על גבי לוחות אגר EMJH בתוספת DAP, והכנסות דגירה עבור 24 שעות ב 29 °C (70 °F). השימוש ב- EMJH מגביל את התפשטות ה- E. coli, ושיעור 1:1 המיועד נשמר. חיידקים נמצאים במסננים על ידי צנרת עם מדיה HAN 1 מ"ל, והשעיות דמיינו תחת מיקרוסקופיה Darkfield. לבסוף, 100-200 μL של כל מתלה הם זרעו על לוחות אגר HAN המכילים 0.4% סרום ארנב ודגורה ב 37 °C (3% CO2). בשלב זה, DAP מושמט, וכתוצאה מכך, E. coli auxotrophic לא יגדל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
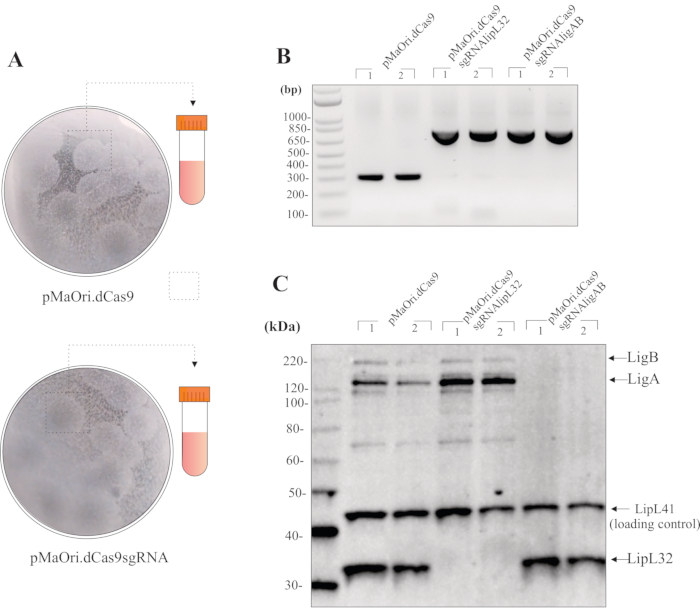
איור 3: תוצאות מייצגות להערכת מוטנטים. (א)מושבות מלוחות המכילות לפטוספירה שעברו טרנספורה עם pMaOri.dCas9 ריק (שליטה שלילית לניסויים נוספים) ו- plasmids pMaOri.dCas9sgRNA (עם גנים ממוקדים מושתקים) נקטפים, הומוגניים במרץ ב- HAN נוזלי וגדלים ב- HAN נוזלי המכיל ספקטינומיצין. תאים רקומביננטיים יכולים להיות מאומתים על ידי PCR עם פריימרים מאגפים את אתר חג המולדI בתוך pMaOri.dCas9. (B)במקרה זה, תאים המכילים pMaOri.dCas9 רק הביא אמפליסון של 281 bp, בעוד תאים אלה המכילים plasmid להשתקה, המכילים הן dCas9 ו sgRNA, הראו אמפליסון 723 bp. לאחר אישור של נוכחות של plasmids, השתקת גנים אומתה על ידי ניתוח אימונובלוט. (C)מומלץ הדגירה עם נוגדנים הן לחלבון היעד והן לחלבון בקרת טעינה; בחיסון הייצוגי, תמציות תאים שלמים מ transconjugants המכיל pMaOri.dCas9 לבד או עם קלטות sgRNA מיקוד lipL32 (pMaOri.dCas9sgRNAlipL32) ו גנים LigA ו LigB (pMaOri.dCas9sgRNAligAB) גנים מוצגים. דגירה משותפת עם אנטי-LipL32, אנטי-LigAB ו- Anti-LipL41 (בקרת טעינה לא ממוקדת) מאשרת כי הביטוי של חלבון LipL32 מבוטל בתאים המכילים pMaOri.dCas9sgRNAlipL32 וגם LigA ו- LigB בתאים המכילים pMaOri.dCas9sgRNAligAB. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
קובץ משלים: רצף קלטות RNA (sgRNA) מדריך יחיד. תמלול sgRNA מכוון על ידי מקדם lipL32 המכונן (נוקלאוטידים נועזים). sgRNA מורכב מ-20 נוקלאוטידים המתייחסים לפרוטו-ספייס, האחראי על שיוך הבסיס לגדיל הקידוד של גן המטרה, ורצף פיגומים dCas9 (נוקלאוטידים בקו תחתון). חג המולד אני מגביל אתרים (cccggg) כלולים בשני קצות לצורך קשירה ב pMaOri.dCas9 plasmid. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
לאחר הרצף המוקדם שלפתוגניים 15,16,17,18 ו19מינילפטוספירה, כריית נתונים של הגנום לשפוך אור על כמה היבטים של לפטוספירלי פתוגנזה. ברוב המקרים, תפקוד החלבון נחקר על ידי שימוש המקביל רקומביננטי של חלבונים חשופים משטח putative לפטוספירלי ספקולציות הבאות של פונקציית החלבוןהמקומית 20,21,22,23,24,25,26.
דור המוטנטים, והערכת הפנוטיפ שלהם, הם מרכיבים מרכזיים בניתוח גנומי תפקודי. ניסיונות ראשוניים ליצור מוטציות בפטוספירה spp. הושגו על ידי מוטגנסיס טרנספוסון אקראי27,28,29,30; עם זאת, לאחר ניתוח מקיף ומייגע להסקת זהותם של גנים משובשים, צוין כי רק 15% מכלל הגנים ב- L. interrogans serovar Manilae שובשו27. נוקאאוט גנים ממוקד הושג עוד יותר על ידי רקומבינציה הומולוגית תוך שימוש בפלסטידים מתאבדים כדי לספק קלטת עמידות לאנטיביוטיקה המוקפת בזרועות הומולוגיות בתוך המטרה הרצויה31,32.
על ידי יישום טכנולוגיות אלה, כמה היבטים של ביולוגיה בסיסית leptospiral וvirulence נחקרו31,33,34,35,36,37. הפיתוח של E. coli-לפטוספירה וקטור הסעות הטעיה, pMaOri 11, אפשר משלוח של רכיבים עבור השתקת גנים אפיזומליים.
הוכח בעבר כי השבר הכפול שנגרם על ידי Cas9 הוא קטלני לפטוספירה spp. וכאלטרנטיבה, הגרסה הלא פעילה קטליטית של האנזים, dCas9, יכולה לשמש להשגת השתקת גנים הן במינים ספורופיטיים והן במינים פתוגניים4,5. על ידי שימוש pMaOri.dCas9 plasmid כעמוד שדרה עבור קשירת קלטת sgRNA, השתקה גנטית ספציפית ויציבה ניתן להשיג בשל הביטוי של dCas9 ו sgRNA; sgRNA הקשור ל- dCas9 יוביל את החלבון למטרה הרצויה על ידי זיווג בסיס ווטסון-קריק.
עבור השתקת גנים מלאה, יש לעצב את הפרוטו-ספייסר בהתבסס על גדיל התבנית של הגן הרצוי, כך שצמד הבסיס של ה- sgRNA יתרחש עם גדיל הקידוד. בהתבסס על תוכן ממוצע של C+G של 35% ב-Leptospira spp., PAM 5'-NGG-3' יתרחש לפחות פי 3 כל 100 bp. לכן, כמעט כל גן בתוך הגנום של לפטוספירה יכיל לפחות PAM אחד. עם זאת, אם המוטיב NGG לא נמצא, ניתן להעריך את מוטיב NAG החלופי.
טכניקות קודמות של השתקת גנים, כגון אצבעות אבץ ו- TALE (מפעילי שעתוק דמויי מפעיל), הסתמכו על בניית חלבון אחד שונה לכל יעד, מה שהופך טכניקות אלה מייגעות ויקרות38. במקרה של CRISPRi, הרכיב המשתנה הוא sgRNA, מה שהופך את זה הכרחי רק לשנות את 20 bp בסוף 5 '. השתקתגניםמלאה, יציבה וממוקדה נצפתה לא רק בפטוספירה spp. 4,5, אלא גם בחיידקים אחרים8,39,40,41.
הפיתוח של HAN מדיה13 העדיף את ההתאוששות של מוטציות על ידי צמצום דרסטי של זמן הדגירה להיווצרות המושבה ומאפשר לפטוספירה לגדול ב 37 oC. עם זאת, במהלך שלב ההטיות, השימוש בו אינו מומלץ שכן E. coli יכול להתרבות במרץ בתקשורת זו ולהתגבר על היחס המיועד 1:1 בין תאי התורם והנמען. בשלב זה, EMJH פלוס DAP היא הבחירה הטובה יותר, שכן E. coli לשכפל גרוע במדיה זו. ראוי להזכיר כי מעבדות מסוימות לעשות בתוך הבית תוספת EMJH, אשר יכול להכיל רכיבים נוספים שעשויים גם לתמוך בצמיחה של תאי E. coli.
פרוטוקול ההטיה שהוצג כאן היה מותאם עבור L. interrogans serovar קופנהגני זן Fiocruz L1-130, וזה הוכח גם להיות יעיל בהפיכת זן פתוגניים מבודד לאחרונה מדגימות קרקע5. ניסיונות ראשוניים עם סרוברים שונים של מינים ל. בורגפטרסניי מצביעים על יעילות הטיות נמוכה יותר עם הפרוטוקול המתואר. לכן, כאשר עובדים עם מינים שונים / serovars של לפטוספירה, תנאים אופטימליים עבור הטיות צריך להיקבע אמפירית, בהתחשב התורם: פרופורציות תא הנמען, צפיפות תאים ראשונית, מדיה הטיות וזמן (24 ו 48 שעות). סביר להניח כי מינים שונים של לפטוספירה ו serovars יתנהגו אחרת עם פרוטוקולי הטיות שונים.
למרות מושבות לפטוספירה ספרופיטיות קל יחסית לדמיין על לוחות, מושבות פתוגניות יכול להיות קשה יותר להתבונן. בדרך כלל, באמצעות מדיה HAN בתוספת 0.4% סרום ארנב ו spectinomycin, מושבות transconjugant ניתן לראות ביום 10. מניסיוננו, המושבות מציגות בתחילה כהילה שקופה על פני השטח התקשורתיים. בפרוטוקול הווידאו, מושבות צפופות יותר, לאחר 14 ימים של צמיחה, מוצגות מכיוון שקשה היה לצלם את המושבות השקופות. בשלב זה, סיבוב הלוח כדי להשיג שכיחות אור שונה ומעבר בין רקעים לבנים וכהים יכול לעזור לזהות מושבות.
עבור אימות מוטציות, אימונובלוטינג מציע גישה פשוטה; עם זאת, מאחר שנוגדנים לא תמיד זמינים נגד חלבוני היעד, ניתן לנקוט באסטרטגיות חלופיות לאימות השתקת גנים. כמותית לאחור-תמלול PCR (qRT-PCR) באמצעות פריימרים עבור גן היעד ובקרה מכוננת יעילה כדי לאמת השתקת גנים מאז sgRNA מונחה dCas9 אחראי לחסימת תמלול גנים. אם גן היעד מקודד רצועת חלבון מוגדרת בבירור בג'ל חלבון, SDS-PAGE יכול להפגין השתקה, ולפי lipL32 השתקתגנים 5. אם גנים ביוסינתזה LPS מושתקים, כתמי LPS ניתן להשתמש; במקרה של השתקת גנים קידוד עבור אנזימים עם מצעים מוגדרים היטב, התקפות קינטיות עם מצעים כרומוגניים הם אסטרטגיות תקפות; השתקת β-גלקטוזידאז ב- L. biflexa אומתה על ידי שימוש ב- X-gal ו- ONPG (אורתו-ניטרופיניל-β-גלקטוסיד)מצעים 4.
לאחר אישור של השתקת גנים, ניסויים יכולים להיות מתוכננים כדי להעריך פנוטיפ נוסף. בדיקות כריכה יכולות להתבצע במקרה של השתקת דבקים חיידקיים; בדיקת סרום-אתגר אישרה את התפקיד של LigA ו LigB בהישרדות בסרום המוצג על ידי לפטוספירהפתוגנית5. מוטציות יכולות לשמש גם לחסן בעלי חיים כדי להעריך את ההנחיה של virulence; במקרה זה, יש להשוות בעלי חיים מחוסנים עם המוטציה לאלה נגועים בתאים המכילים pMaOri.dCas9 בלבד.
לסיכום, הפרוטוקול הנוכחי מתאר את היישום של CRISPRi להשתקת גנים במיני לפטוספירה פתוגניים באמצעות מדיה HAN כדי להקל על התאוששות מוטציה בתוך 10 ימים. השתקת גנים בשילוב עם ניתוח גנומי פונקציונלי ישפרו את הבנתנו של מנגנונים פתוגניים של לפטוספירה, ובסופו של דבר יוביל לפיתוח אסטרטגיות מניעתיות טובות יותר לבקרת מחלות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
משרד החקלאות האמריקאי הוא ספק ומעסיק שוויון הזדמנויות. אזכור שמות מסחריים או מוצרים מסחריים בפרסום זה נועד אך ורק לצורך מסירת מידע ספציפי, ואינו מרמז על המלצה או תמיכה של משרד החקלאות האמריקאי. הסוכנות הברזילאית FAPESP (מענק 2014/50981-0) תמכה כלכלית בעבודה זו; LGVF ממומן באמצעות מלגה מ- FAPESP (2017/06731-8 ו-2019/20302-8). למממנים לא היה כל תפקיד בעיצוב מחקר, איסוף וניתוח נתונים, החלטה לפרסם או הכנת כתבי יד. המחברים מודים גם להאנה היל ואלכסנדר גריימס משירותי הראייה של משרד החקלאות האמריקאי על הצילומים והעריכה של פרוטוקול הווידאו.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1 µm pore size mixed cellulose esters membrane | Millipore | VCWP02500 | Filtration for bacterial conjugation |
| 2,6-Diaminopimelic acid (DAP) | Sigma | D1377 | Growth of auxotrophic E. coli β2163 |
| Agar Noble | BD & Company | 214230 | Used for preparation of solid EMJH and HAN plates |
| Bacto Agar | BD & Company | 214010 | Used for preparation of solid LB plates |
| Clarity Western ECL substrate | Biorad | 170-5060 | Chemiluminescent substrate |
| dNTP set | Thermo Fisher | 10297-018 | dNTPs for PCR reaction |
| Glass Microanalysis Filter Holder | Millipore | XX1012530 | Filtration for bacterial conjugation |
| Imaging System | Biorad | ChemiDoc MP | Chemiluminescence detection |
| LB broth, Miller | BD & Company | 244620 | Lysogenic liquid medium for E. coli culturing |
| Leptospira Enrichment EMJH | BD & Company | 279510 | Supplementation of EMJH media |
| Leptospira Medium Base EMJH | BD & Company | 279410 | EMJH medium for Leptospira |
| Mini-PROTEAN TGX Gels 12% | Biorad | 4568043 | Used for polyacrylamide gel eletrophoresis |
| Optical density reader | Molecular Devices | SpectraMax M2 | For optical density measurements of bacterial cultures |
| Phosphate Buffered Saline 7.4 | Sigma | 806552 | Saline solution for washing bacterial pellets |
| Spectinomycin | Sigma | S0692 | Selection of pMaOri backbone plasmids |
| Taq DNA Polymerase | Thermo Fisher | EP0402 | Enyme, buffer and MgCl2 for PCR reaction |
| Thermocycler | Applied Biosystem | GeneAmp PCR System 9700 | Used for PCR reaction cycling |
| Thymidine (dT) | Sigma | T9250 | Growth of auxotrophic E. coli π1 |
| XmaI restriction enzyme | New Englan BioLabs | R0180L | Digestion of plasmids and inserts |
References
- Bharti, A. R., et al. Leptospirosis: A zoonotic disease of global importance. Lancet Infectious Disease. 3 (12), 757-771 (2003).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLoS Neglected Tropical Disease. 9 (9), 0003898(2015).
- Shapiro, R. S., et al. A CRISPR-Cas9-based gene drive platform for genetic interaction analysis in Candida albicans. Nature Microbiology. 3 (1), 73-82 (2018).
- Fernandes, L. G. V., et al. Gene silencing based on RNA-guided catalytically inactive Cas9 (dCas9): a new tool for genetic engineering in Leptospira. Science Reports. 9 (1), 1839(2019).
- Fernandes, L. G. V., Hornsby, R. L., Nascimento, A. L. T. O., Nally, J. E. Genetic manipulation of pathogenic Leptospira: CRISPR interference (CRISPRi)-mediated gene silencing and rapid mutant recovery at 37 C. Science Reports. 11 (1), 1768(2021).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Choudhary, E., Thakur, P., Pareek, M., Agarwal, N. Gene silencing by CRISPR interference in mycobacteria. Nature Communication. 6, 6267(2015).
- Zhukova, A., et al. Genome-wide transcriptional start site mapping and sRNA identification in the pathogen. Frontiers in Cell and Infectious Microbiology. 7, 10(2017).
- Demarre, G., et al. A new family of mobilizable suicide plasmids based on broad host range R388 plasmid (IncW) and RP4 plasmid (IncPalpha) conjugative machineries, and their cognate Escherichia coli host strains. Research in Microbiology. 156 (2), 245-255 (2005).
- Pappas, C. J., Benaroudj, N., Picardeau, M. A replicative plasmid vector allows efficient complementation of pathogenic Leptospira strains. Applied Environmental Microbiology. 81 (9), 3176-3181 (2015).
- Fernandes, L. G. V., Nascimento, A. L. T. O. Specific gene silencing in Leptospira biflexa by RNA-guided catalytically inactive Cas9 (dCas9). Methods in Molecular Biology. 2134, 109-122 (2020).
- Hornsby, R. L., Alt, D. P., Nally, J. E. Isolation and propagation of leptospires at 37 °C directly from the mammalian host. Science Reports. 10 (1), 9620(2020).
- Haake, D. A. Hamster model of leptospirosis. Current Protocols in Microbiology. , Chapter 12, Unit 12E.12 (2006).
- Nascimento, A. L., et al. Comparative genomics of two Leptospira interrogans serovars reveals novel insights into physiology and pathogenesis. Journal of Bacteriology. 186 (7), 2164-2172 (2004).
- Nascimento, A. L., et al. Genome features of Leptospira interrogans serovar Copenhageni. Brazillian Journal of Medical Biology Research. 37 (4), 459-477 (2004).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Bulach, D. M., et al. Genome reduction in Leptospira borgpetersenii reflects limited transmission potential. Proceedings of the National Academy of Science U. S. A. 103 (39), 14560-14565 (2006).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLoS One. 3 (2), 1607(2008).
- Fernandes, L. G., et al. OmpL1 is an extracellular matrix- and plasminogen-interacting protein of Leptospira spp. Infections and Immunity. 80 (10), 3679-3692 (2012).
- Fernandes, L. G., et al. Leptospira spp.: Novel insights into host-pathogen interactions. Veterinary Immunology and Immunopathology. 176, 50-57 (2016).
- Castiblanco-Valencia, M. M., et al. Leptospiral immunoglobulin-like proteins interact with human complement regulators factor H, FHL-1, FHR-1, and C4BP. Journal of Infectious Diseases. 205 (6), 995-1004 (2012).
- Choy, H. A., et al. The multifunctional LigB adhesin binds homeostatic proteins with potential roles in cutaneous infection by pathogenic Leptospira interrogans. PLoS One. 6 (2), 16879(2011).
- Siqueira, G. H., et al. The recombinant LIC10508 is a plasma fibronectin, plasminogen, fibrinogen and C4BP-binding protein of Leptospira interrogans. Pathogen and Diseases. 74 (2), (2016).
- Teixeira, A. F., et al. Features of two new proteins with OmpA-like domains identified in the genome sequences of Leptospira interrogans. PLoS One. 10 (4), 0122762(2015).
- Kochi, L. T., et al. The interaction of two novel putative proteins of Leptospira interrogans with E-cadherin, plasminogen and complement components with potential role in bacterial infection. Virulence. 10 (1), 734-753 (2019).
- Murray, G. L., et al. Genome-wide transposon mutagenesis in pathogenic Leptospira species. Infections and Immunity. 77 (2), 810-816 (2009).
- Bourhy, P., Louvel, H., Saint Girons, I., Picardeau, M. Random insertional mutagenesis of Leptospira interrogans, the agent of leptospirosis, using a mariner transposon. Journal of Bacteriology. 187 (9), 3255-3258 (2005).
- Pětrošová, H., Picardeau, M. Screening of a Leptospira biflexa mutant library to identify genes involved in ethidium bromide tolerance. Applied Environmental Microbiology. 80 (19), 6091-6103 (2014).
- Slamti, L., Picardeau, M. Construction of a library of random mutants in the spirochete Leptospira biflexa using a mariner transposon. Methods in Molecular Biology. 859, 169-176 (2012).
- Croda, J., et al. Targeted mutagenesis in pathogenic Leptospira species: Disruption of the LigB gene does not affect virulence in animal models of leptospirosis. Infections and Immunity. 76 (12), 5826-5833 (2008).
- Picardeau, M., Brenot, A., Saint Girons, I. First evidence for gene replacement in Leptospira spp. Inactivation of L. biflexa flaB results in non-motile mutants deficient in endoflagella. Molecular Microbiology. 40 (1), 189-199 (2001).
- King, A. M., et al. High-temperature protein G is an essential virulence factor of Leptospira interrogans. Infections and Immunity. 82 (3), 1123-1131 (2014).
- Lambert, A., et al. FlaA proteins in Leptospira interrogans are essential for motility and virulence but are not required for formation of the flagellum sheath. Infections and Immunity. 80 (6), 2019-2025 (2012).
- Murray, G. L., et al. Leptospira interrogans requires heme oxygenase for disease pathogenesis. Microbes and Infections. 11 (2), 311-314 (2009).
- Ristow, P., et al. The OmpA-like protein Loa22 is essential for leptospiral virulence. PLoS Pathogens. 3 (7), 97(2007).
- Sasaki, Y., et al. Leptospiral flagellar sheath protein FcpA interacts with FlaA2 and FlaB1 in Leptospira biflexa. PLoS One. 13 (4), 0194923(2018).
- Gaj, T., Gersbach, C. A., Barbas, C. F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology. 31 (7), 397-405 (2013).
- Cress, B. F., et al. Rapid generation of CRISPR/dCas9-regulated, orthogonally repressible hybrid T7-lac promoters for modular, tuneable control of metabolic pathway fluxes in Escherichia coli. Nucleic Acids Research. 44 (9), 4472-4485 (2016).
- Zhao, C., Shu, X., Sun, B. Construction of a gene knockdown system based on catalytically inactive ("dead") Cas9 (dCas9) in Staphylococcus aureus. Applied Environmental Microbiology. 83 (12), (2017).
- Zhao, Y., et al. CRISPR/dCas9-mediated multiplex gene repression in Streptomyces. Biotechnology Journal. , 1800121(2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved