Method Article
Leptospira'nın Patojenik Türlerinde Gen Susturma için CRISPR Parazitinin (CRISPRi) Uygulanması
Bu Makalede
Özet
Burada, Leptospira türlerinde spesifik gen susturma için CRISPR parazitinin (CRISPRi) uygulanması açıklanmıştır. Leptospira hücreleri, dCas9 'u (katalitik olarak "ölü" Cas9) ifade eden plazmidler ve istenen genomik hedefe taban eşleştirmeden sorumlu tek kılavuzlu bir RNA (sgRNA) ile konjugasyon ile dönüştürülür. Gen susturma doğrulamak için yöntemler sunulmaktadır.
Özet
Leptospirosis, yılda en az 1 milyon vakadan ve neredeyse 60 bin ölümden sorumlu olan küresel ihmal edilmiş bir zoonozdur. Hastalık, Leptospiracinsinin patojenik ve virülan bakterilerinden kaynaklanır Bakteri ile doğrudan temas yoluyla veya dolaylı olarak kontamine suya veya toprağa maruz kalarak. Evcil ve vahşi hayvanlar, idrar yoluyla böbreğin kolonize böbrek tübüllerinden çevreye leptospires dökerek enfeksiyonun rezervuar konakları olarak hareket eder. Leptospira'nın mutant suşlarının üretimi, enfeksiyonun patojenik mekanizmalarını değerlendirmek ve anlamak için kritik öneme sahiptir. CRISPR paraziti (CRISPRi), patojenik Leptospira'dagen susturma için basit, uygun fiyatlı ve spesifik bir araç olduğunu kanıtlamıştır. Bu nedenle, hem dCas9 hem de kılavuz RNA içeren plazmid yapılarının elde edilmesi, plazmidlerin E. coli suşu β2163 ile konjugasyon yapılarak Leptospira'ya teslim edilmesi ve transkonjugant geri kazanım ve değerlendirmenin metodolojik ayrıntıları açıklanacaktır. Ek olarak, yakın zamanda tanımlanan Hornsby-Alt-Nally (HAN) medyası, agar plakalarında mutant kolonilerinin nispeten hızlı izolasyonu ve seçilmesine izin verir.
Giriş
Leptospirosis, Leptospiracinsinin patojenik ve virülan türlerinin neden olduğu ihmal edilmiş bir dünya zoonozdur. İnsanlarda, hastalık dünya çapında yılda bir milyondan fazla vaka ve 60.000 ölüme neden olur1,2. Şimdiye kadar, hastalık için uzun vadeli ve etkili bir aşı yoktur. Virülans faktörlerinin ve patojenik mekanizmaların tanımlanması, daha iyi terapötik ve profilaktik stratejilerin geliştirilmesi için çok önemlidir. Bu nedenle, genetik mutasyonlar üretme ve ortaya çıkan fenotipi değerlendirme yeteneği fonksiyonel genomik analiz için kritik önemesahiptir 3.
Patojenik Leptospira'da mutantların inşası, şimdiye kadar doğası gereği verimsiz, zahmetli, maliyetli ve uygulanması zor olarak kabul edildi. Bu senaryo, son CRISPR parazitinin (CRISPRi) saprofitik4 ve patojenik5 leptospire uygulanmasıyla büyük ölçüde değişti.
Gen susturma iki bileşenin ekspresyonu ile elde edilir: CRISPR / Cas'ınbir varyantı (clustered regularly interspaced s hort palindromic repeat /CRISPR sociated olarak)enzim Cas9 Streptococcus pyogenes, katalitik olarak ölü Cas9 (dCas9) ve tek kılavuzlu RNA (sgRNA) olarak adlandırılır, istenen hedefe göre düzenlenebilir6,7,8. dCas9 proteini, sgRNA'ya bağlandığında, Watson ve Crick baz eşleştirmesi tarafından belirli DNA hedeflerine yönlendirilir ve RNA polimeraz uzamasına sterik bir tıkanmaya neden olur ve tıkanmış gen transkripsiyonu nedeniyle gen susturma ile sonuçlanır7 (Şekil 1).
Bu makale, hem dCas9 hem de sgRNA'yı ifade etmek için plazmidin yapımını, donör E. coli β2163 ile alıcı Leptospira hücreleri arasındaki konjugasyonu, transkonjugant iyileşmeyi ve son olarak seçilen mutant kolonilerinin doğrulanmasını tanımlamayı amaçlamaktadır.
Protokol
1. Protospacer tanımı ve plazmid yapısı
NOT: Bu bölümde, sgRNA'yı ve daha fazla ligasyonu pMaOri.dCas9'a oluşturmak için uygun protospacer'ları seçmenin ilk adımı açıklanmıştır (Şekil 1). Bu protospacer dizisi, istenen hedefe karşı 20 nükleotid dizisinden oluşur.
- GenBank'ta (https://www.ncbi.nlm.nih.gov/genbank) susturma için ilgi geninin nükleotid dizisini elde edin. "Fasta Target"ı seçtikten sonra Streptococcus pyogenes Cas9 ve protospacer bitişik motif NGG için tanımlanan parametrelerle CHOPCHOP web sunucusuna (http://chopchop.cbu.uib.no/) gönderin. Parametreleri "CRISPR/Cas9" ve PAM (protospacer bitişik motif) NGG olarak tanımlayın.
- Elde edilen sonuçlara dayanarak, kodlama bölgesinin 5'ine mümkün olduğunca yakın bulunan ve en önemlisi, sgRNA'nın tam gen susturma için genin kodlama zinciriyle eşleşmesi gerektiğinden, şablon (eksi) telinde bulunan mümkün olan en iyi puana (yeşil ok) sahip protospacer'ları seçin.
NOT: NGG motifi son sgRNA dizisine dahil değildir. - 5' ucunda değişken 20 nükleotid dizisi ve korunmuş bir dCas9 iskele dizisi içeren tek kılavuz RNA'yı ifade etmek için lipL32 promotörunu kullanın. Protospacer olarak adlandırılan 20 nt dizisini lipL32 promotörü (5' ucunda) ve sgRNA iskelesi (3'end) (Şekil 1B)ile birleştirin.
NOT: İyi tanımlanmış bir lipL32 organizatörü için, TSS'ye -334'den oluşan organizatör bölgesini (Zhukova ve ark.9'adayalı Transkripsiyon Başlangıç Sitesi) kullan. Son sgRNA kaseti için Ek Dosya'yı kontrol edin. - SgRNA kasetini sıralı PCR5 ile oluşturun veya ticari bir sağlayıcı tarafından sentezlendirin.
- Kaseti elde ettikten sonra, her iki ucundaki XmaI kısıtlama sitesinde pMaOri.dCas9 plazmid (cccggg)4'e ayarlayın.
- Hem sgRNA kasetini hem de pMaOri.dCas9 plazmidini XmaI kısıtlama enzimi ile sindirin ve ligasyona geçin (Şekil 1B).
- Klonlama adımlarını dT auxotrophic E. coli strain π110, pMaOri11 (ve uzantı olarak pMaOri.dCas9) çoğaltmanın kaynağı olan R6K-gama nedeniyle gerçekleştirin.
NOT: Ligasyon ve klon seçimi için ayrıntılı bir protokol için Fernandes ve Nascimento12'ninönceki yayınlarına bakın. sgRNA güdümlü dCas9, seçilen ilgi geninin kodlama zincirine bağlanacak ve bu nedenle RNA polimeraz uzamasını (Şekil 1C) engelleyecek ve gen susturma ile sonuçlanacaktır.
2. Konjugasyon ile Leptospira dönüşümü
NOT: Şekil 2'de bu adımın grafik şeması sunulmuştur. HAN medya ve HAN plakaları yapmak için Hornsby ve ark.13 ve Fernandes ve ark.5'e bakın.
- Taze HAN'da 1:100'de doymuş bir kültürü seyrelterek ajitasyon altında HAN media13'te 29 veya 37 °C'de patojenik Leptospira hücreleri yetiştirin; tipik olarak, L. sorgulayıcılar serovar Kopenhagi suşu Fiocruz L1-130'un uygun hücre yoğunluğuna ulaşması 4-6 gün sürer.
- Konjugasyon için kullanmadan önce kültürlerin 420 nm'de (2 ila 5 x 10 8 hücre/mL)0,2-0,4 O.D.'ye ulaştığından emin olun.
NOT: Hücre yoğunlukları arttıkça HAN ortamı renk değiştirdiğinden (DMEM ortamlarında bulunan fenol kırmızısı nedeniyle), santrifüj (4.000 x g, 15 dk, oda sıcaklığı) 1 mL kültür medyasının leptospires kaldırmak ve O.D.'yi ölçmek için boş olarak supernatant uygulamak.
- Konjugasyon için kullanmadan önce kültürlerin 420 nm'de (2 ila 5 x 10 8 hücre/mL)0,2-0,4 O.D.'ye ulaştığından emin olun.
- Konjugatif E. coli suşu β2163, Diaminopimelic asit (DAP) için auxotrophic, sgRNA kaseti içeren plazmid pMaOri.dCas9 ile dönüştürün. Eiçin. coli dönüşümü, ısı şoku protokolleri veya elektroporasyon kullanın. Kontrol olarak sgRNA kaseti olmayan plazmid pMaOri.dCas9 ile dönüşümü dahil edin.
- Isı şoku dönüşümü için plazmid DNA'yı (100 ng) kimyasal olarak yetkin E. coli hücreleriyle karıştırın ve 30 dakika boyunca buz üzerinde kuluçkaya yatın. 90 s için 42 °C'de ısı şoku gerçekleştirin ve 5 dakika boyunca tekrar buza yerleştirin. 1 mL LB ortam ekleyerek hücreleri kurtarın, 1 saat boyunca 37 °C'de kuluçkaya yaslanın ve kaplamaya geçin.
- Elektroporasyon için, 100 ng plazmid DNA ile karıştırılmış elektro-rekabet hücreleri kullanın. Nabız için aşağıdaki parametreleri kullanın: 1,8 kV, 100 Ω ve 25 μF. Hücreleri yukarıda açıklandığı gibi kurtarın.
- Plazmidler için seçmek üzere Diaminopimelic asit (DAP) (0,3 mM) ve spektinomisinin (40 μg/mL) desteklenmiş LB agar ortamında dönüştürülmüş donör E. coli hücrelerini plakala.
- Konjugasyon için, konjugasyon gününden bir gün önce her plakadan bir koloni seçin (leptospires kültürlerinin O.D.'si izlenerek belirlenir).
- Boş pMaOri.dCas9'dan bir E. coli β β2163 kolonisi ve pMaOri.dCas9sgRNA plakalarından bir koloni seçin. 10 mL LB artı DAP ve spektinomisinin 37 °C'de bir gecede büyümesine izin verin.
- Ertesi gün, doymuş kültürleri 10 mL taze LB artı DAP'ta 1:100 seyreltin (antibiyotiği buraya dahiletmeyin) 0.2-0.4'ün 420nm'sinde OD'ye kadar. Normalde E. coli'nin bu yoğunluklara ulaşması 2-3 saat sürer.
- Bir BSL2 biyogüvenlik davlumbazının içine, cam tabanın üstüne 25 mm çapında, 0,1 μm gözenek boyutunda, karışık selüloz esterleri membran filtresi yerleştirerek bir filtreleme aparatı monte edin. Üzerine 15 mL cam huni yerleştirin ve her iki parçayı da yaylı kelepçelerle tutun. Camı bir vakum pompasına bağlayın ve filtrasyon için kültürleri hunilere ekleyin.
- Hunine 5 mL Leptospira kültürü ekleyin. Her iki kültürün OD420nm değerlerine göre 1:1 oranını oluşturmak için bir E. coli hacmi ekleyin. Vakum pompasını açın ve hücreleri filtrasyonla konsantre edin. Membran filtresindeki hücre konsantrasyonundan sonra dikkatlice alın. Ortamın membrandan filtrelendiğini sağlayın.
NOT: Filtrasyon 5 ila 10 dakika sürer. - Filtreyi DAP (0,3 mM) ile desteklenmiş ticari olarak kullanılabilen bir EMJH plakasına (bkz. Malzeme Tablosu)yerleştirin. Bakteri tarafının yukarıda olduğundan emin olun. Plakaları 29 °C'de 24 saat kuluçkaya yatırın.
NOT: HAN veya şirket içi EMJH14 plakaları kullanılırsa, E. coli çoğalabilir ve hedeflenen 1:1 oranının üstesinden gelebilir, bu da konjugasyon verimliliğini azaltabilir5. - 24 saat sonra, filtreleri plakalardan kurtarın ve her bir filtreyi 50 mL konik bir tüpe yerleştirin.
- Geniş pipetleme ve girdaplama ile hücreleri filtre yüzeyinden serbest bırakmak için 1 mL sıvı HAN ortamı kullanın.
- Hücre canlılığını ve hareketliliğini ve Leptospira:E. coli oranlarını kontrol etmek için geri kazanılan karışık bakteriyel çözeltileri karanlık alan mikroskopisi ile görselleştirin.
NOT: Bu aşamada eşdeğer E. coli ve Leptospira sayıları görülebilir. - Bu kültürün 100-200 μL'sini% 0.4 inaktive tavşan serumu ve 40 μg / mL spektinomisin içeren HAN plakalarına yayın. %3 CO2 atmosferde 37 °C'de plakaları kuluçkaya yatır.
NOT: Normalde, L. sorgulayıcılar serovar Kopenhagi suşu Fiocruz L1-130 hücreleri kontrol plakalarında 5-7 günde ve spektinomisin plakalarında 8-10 günde koloniler oluşturur. Bu aşamada, E. coli DAP için auxotrophic oldukları için büyümeyecektir. - Kontrol olarak, kültürleri 104 leptospires/ mL'de seyreltin ve leptospiral büyümeyi izlemek için antibiyotiksiz plakalara 100 μL ekleyin.
3. Koloni seçimi ve transkonjugant büyüme ve doğrulama
NOT: Koloniler 10. Ancak, görselleştirmek çok kolay değildir. Normalde bu zaman noktasında, HAN plakaları yayılmış kurutulmuş hücreler nedeniyle biraz donuk ve Leptospira kolonileri beyazımsı arka plana karşı şeffaf bir hale olarak görünebilir. Farklı ışık insidansı elde etmek için plakaların farklı açılarda görüntülenmesi önerilir, bu nedenle kolonileri daha belirgin hale getirir. Daha uzun kuluçka sürelerinde, koloniler daha yoğun bir görünüm elde edebilir ve bu durumda karanlık bir arka plana karşı sütlü haleler olarak ortaya çıkabilirler.
- Mutantları kurtarmak için her 1,5 mL mikrotüpe 100 μL sıvı HAN ortamı ekleyin. Her plakadan en az 3 koloni alın.
- Bir mikropipette ucu yardımıyla, leptospiral koloniler yeraltı olabileceği için kolonileri plakalardan almak için agar'ı "kazın".
NOT: Ağar'ın da bu aşamada alınması bekleniyor. Koloniler boş pMaOri.dCas9 plazmid içeren kontrol plakalarından ve hedef gen için tasarlanmış hem dCas9 hem de tek kılavuz RNA'yı ifade eden plazmidler içeren leptospires plakalardan alınmalıdır. - Toplanan koloniyi 100 μL HAN ortamlarında 1,5 mL mikrotüpte dağıtın ve kuvvetlice homojenize edin. Bu aşamada, hücreleri serbest bırakmak için agar bütünlüğünün maksimum kırılmasını sağlayın. Vortex süspansiyonu 10 sn.
- Bir mikropipette ucu yardımıyla, leptospiral koloniler yeraltı olabileceği için kolonileri plakalardan almak için agar'ı "kazın".
- Kurtarılan hücreleri 200-400x büyütmede karanlık alan mikroskopisi ile cam bir kaydırağa 5 μL'lik bir damla ekleyerek görselleştirin ve numuneleri hemen bir kapakla örtün.
- Kolonilerden kurtarılan canlı ve uygulanabilir leptospirlerin varlığını onaylayın.
- Uygulanabilir leptospirlerin görselleştirilmesi ve onaylanmasından sonra, 100 μL hücreyi 40 μg/ mL spektinomisinin içeren sıvı HAN ortamına aktarın.
- Sıvı HAN ortamlarında büyümeden sonra, sgRNA kasetini saran bölgeyi tanıyan primer pMaOri2 F (ACGCAATGTATCGATACCGAC) ve R (ATAGGTGAAGTAGGCCCACCC) ile plazmid varlığı için kültürleri değerlendirin.
- 200 μL kültür, santrifüj (4.000 x g, 15 dk) toplayın, süpernatantı atın ve elde edilen peletin 20 μL suya yeniden harcan.
- Dna ekstraksiyonu12'yegerek kalmadan, bu süspansiyonu ek PCR için bir şablon olarak kullanın.
NOT: pMaOri.dCas9'a sahip hücreler, 723 bp'lik bir amplicon oluşturacak sgRNA kaseti ile plazmidleri içerenlere kıyasla 281 bp'lik bir amplicon oluşturacaktır.
- Gen susturma onayı için, sadece pMaOri.dCas9 (negatif kontrol) ve pMaOri.dCas9sgRNA içeren transkonjugantlardan hücre özlerini kullanan bir immünoblot gerçekleştirin.
- Sodyum dodecyl sülfat (SDS) poliakrilamid jelin şeridi başına 5 x10 7 hücre eşdeğerini uygulayın.
- Uygun antikorlarla inkübasyon için bir zara elektrotransfer proteinleri. Susturma için hedef gen karşı antikor yanı sıra, yükleme kontrolü için başka bir tane kullanın.
- Mutant kültürlerini HAN medyasında ve plazmidi korumak için spetinomicin'de tutun. Ortama antibiyotik uygulanmazsa, en az üç pasaj için tam gen susturma gözlenebilir5.
Sonuçlar
Leptospira spp. genomlarındaki CG içeriği tipik olarak% 35 civarında olsa da; hemen hemen her genin PAM 5'NGG 3' içermesi muhtemeldir; bu motifin şablon telinde dikkate alınması gerekir. Chopchop sonuçlarına göre bir genin kodlama sırasını girdikten sonra (baştan sona kodonlar), protospacer'lar eksi (-, şablon) iplikçikte seçilmelidir. NGG motifinin 20 nt sgRNA protospacer'a dahil olmaması önemlidir.
Konjugasyon 1:1 donör:alıcı hücre oranı ile yapılırsa, EMJH agar plakalarının yüzeyinde 24 saat artı DAP için ve kurtarılan bakteri süspansiyonunun 200 μL'si HAN artı spectinomycin agar plakalarına yayılırsa, transkonjugant kolonileri yaklaşık 8-10 gün içinde görülebilir olmalıdır. Bu hacmin yayılması normalde plaka başına 20-40 koloni ile sonuçlanır (Şekil 3A). Konjugasyon sonrası hücre canlılığını kontrol etmek için, hücreler antibiyotik seçimi olmadan HAN plakalarına yayılabilir. Bu durumda, koloniler 7 gün gibi kısa bir sürede gözlemlenebilir. HAN plakaları % 3 CO2 atmosferinde soluk sarıya döner.
Sıvı ortamda koloni toplama ve büyüme artı spektinomisinin büyümesinden sonra, transkonjugantların ilk kalite kontrolü için tüm hücreleri ve pMaOri2 astarlarını kullanan PCR kullanılabilir (Şekil 3B). Kontrol pMaOri.dCas9 plazmid içeren leptospiral hücreler 281 bp amplicon ile sonuçlanmalı, susturma için plazmid içeren hücreler, yani hem dCas9 hem de sgRNA içeren hücreler 723 bp amplicon ile sonuçlanmalıdır. pMaOri2 F ve R primer'lar, sgRNA kaset ligasyonu sırasında kullanılan site olan XmaI kısıtlama bölgesini kuşatmak için tasarlanmıştır.
Plazmid varlığının onaylanmasıyla, hücreler medyadan toplanabilir, PBS ile iki kez yıkanabilir ve daha sonra immünblotting için tam hücreli bir ekstrakt hazırlamak için kullanılabilir. Susturma meydana geldiyse, bu durumda, LipL32 veya hem LigA hem de LigB olan hedef proteinler, yalnızca vahşi tip hücrelerde ve pMaOri.dCas9 içerenlerde gözlenmelidir; daha yüksek maruz kalma sürelerinde bile, pMaOri.dCas9sgRNA ( Şekil3C)içeren hücrelerde karşılık gelen proteinler görünmemelidir.
Gen susturma sonrası leptospiral virülansı değerlendirmek için deneyler planlanıyorsa, konjugasyon için kullanılan kültürler düşük geçişli virülan Leptospiraolmalıdır. Gen susturma onaylandıktan sonra, birkaç aliquot yedek olarak dondurulabilir. Susturulan gen ölçülebilir bir fenotipe sahipse, örneğin, rekombinant proteinlerle yapılan önceki çalışmalara dayanarak, kültürler doğrulama için kullanılabilir ve bu durumda, yalnızca pMaOri.dCas9 içeren hücreler negatif kontrol olarak dahil edilebilir.
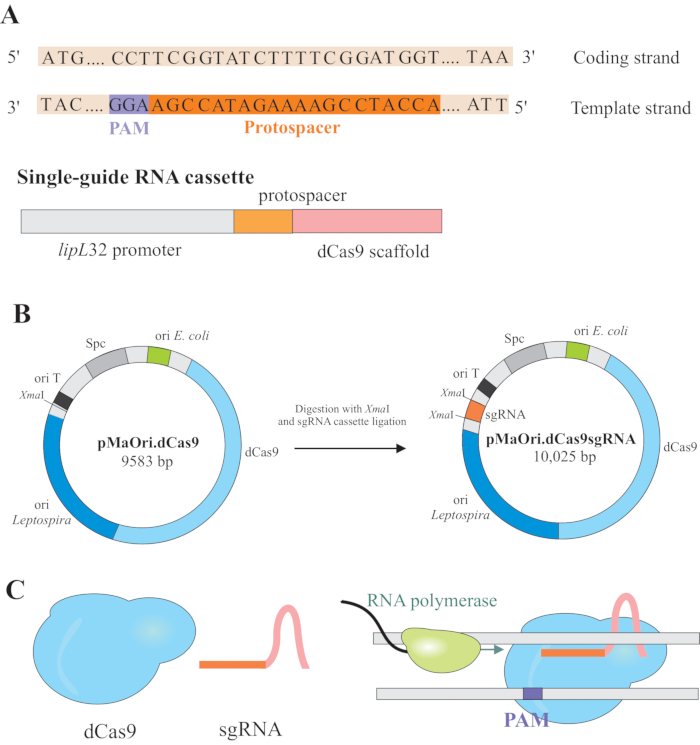
Şekil 1: Plazmid ifade eden dCas9 ve sgRNA gelişimi. (A) S. pyogenes dCas9 PAM 5'-NGG-3' tarafından takip edilen 20 nt uzunluğunda bir protospacer, hedef genin şablon zinciri içinde seçilir, böylece sonraki sgRNA, Watson ve Crick taban eşleştirmesini ilgili kodlama zinciriyle gerçekleştirebilir ve bu da tam gen susturma ile sonuçlanır. (B) SgRNA kaseti lipL32 promotör, 20 nt protospacer ve dCas9 iskeleden oluşur. pMaOri.dCas9 plazmid, XmaI kısıtlama sitesinde sgRNA kaset ligasyonu için bir omurga olarak kullanılır. Elde edilen plazmid, pMaOri.dCas9sgRNA olarak tabir edilen leptospires teslim edilir ve gen susturma hem dCas9 hem de sgRNA ifadesi sorumludur. (C) sgRNA tarafından yönlendirilen dCas9, RNA polimeraz uzaması için fiziksel bir bariyer görevi görür, bu nedenle transkripsiyonu engeller. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
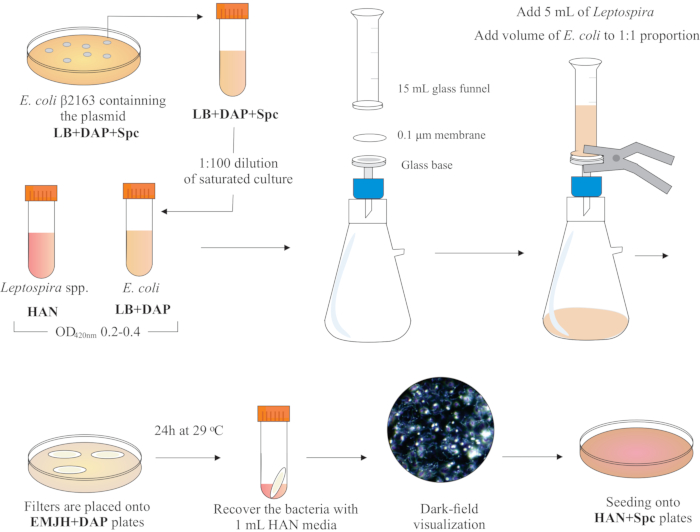
Şekil 2: Konjugasyon protokolünün şematik gösterimi. İstenen Leptospira türleri HAN medyasında, ajitasyon altında, 420 nm'de 0.2-0.4 (orta kütük fazı) O.D.'ye kadar yetiştirilir. Konjugasyondan bir gün önce, ilgi plazmidini içeren bir rekombinant donör E. coli β2163 kolonisi LB + DAP + Spc agar plakalarından seçilir, çünkü hücreler aynı takviye ile sıvı LB'de bir gecede yetiştirilir. Ertesi gün, doymuş E. coli kültürleri LB artı DAP'ta seyreltilir ve 420 nm'de 0.2-0.4 O.D.'ye kadar yetiştirilir. Hem donör E. coli hem de alıcı Leptospira, negatif basınç altında bir filtrasyon aparatı tarafından 0,1 μm filtrenin yüzeyine 1:1 hücre oranında karıştırılır. Daha sonra, FILTRELER DAP ile desteklenmiş EMJH agar plakalarının üzerine yerleştirilir ve kuluçka 29 ° C'de 24 saat boyunca devam eder. EMJH kullanımı E. coli çoğalmasını sınırlar ve hedeflenen 1:1 oranı korunur. Bakteriler 1 mL HAN ortam ile pipetleme ile filtrelerden geri kazanılır ve süspansiyonlar darkfield mikroskopisi altında görselleştirilir. Son olarak, her süspansiyonun 100-200 μL'si% 0.4 tavşan serumu içeren HAN agar plakalarına tohumlanır ve% 3 CO2'de37 ° C'de inkübe edilir. Bu aşamada, DAP atlanır ve sonuç olarak, auxotrophic E. coli büyümez. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
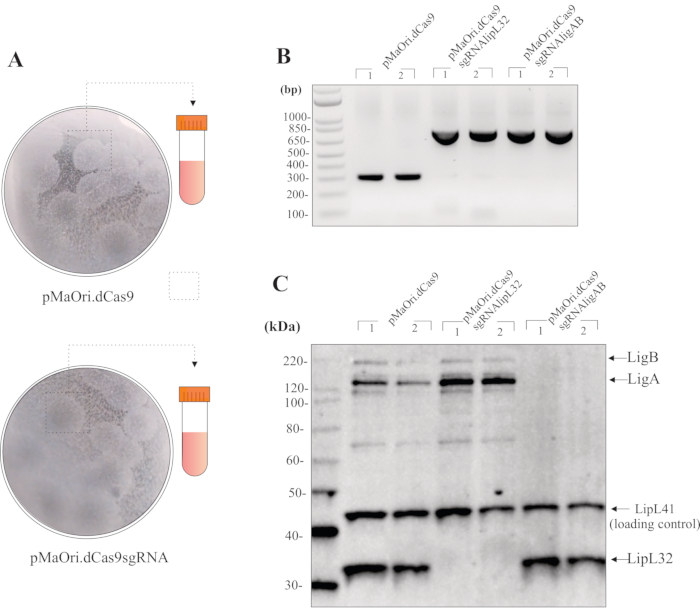
Şekil 3: Mutantların değerlendirilmesi için temsili sonuçlar. (A) Boş pMaOri.dCas9 (daha fazla deney için negatif kontrol) ve plazmidler pMaOri.dCas9sgRNA (hedeflenen gen susturulmuş) ile dönüştürülen Leptospira içeren plakalardan koloniler toplanır, sıvı HAN'da kuvvetli bir şekilde homojenize edilir ve spektinomisin içeren sıvı HAN'da yetiştirilir. Rekombinant hücreler PCR tarafından pMaOri.dCas9 içindeki XmaI sitesini kuşatıran astarlarla doğrulanabilir. (B) Bu durumda, pMaOri.dCas9 içeren hücreler sadece 281 bp amplicon ile sonuçlanırken, susturma plazmidini içeren, hem dCas9 hem de sgRNA içeren hücreler 723 bp amplicon gösterdi. Plazmidlerin varlığının doğrulanması üzerine, gen susturma immünoblot analizi ile doğrulandı. (C) Hem hedef proteine hem de yükleme kontrol proteinine karşı antikorlarla inkübasyon önerilir; temsili immünoblotta, tek başına pMaOri.dCas9 içeren transkonjugantlardan veya lipL32 'yi (pMaOri.dCas9sgRNAlipL32) ve hem LigA hem de LigB (pMaOri.dCas9sgRNAligAB) genlerini hedefleyen sgRNA kasetlerinden tam hücreli ekstraktlar görüntülenir. Anti-LipL32, anti-LigAB ve anti-LipL41 (hedefsiz, yükleme kontrolü) ile birlikte inkübasyon, lipL32 proteininin ifadesinin pMaOri.dCas9sgRNAlipL32 ve hem LigA hem de LigB içeren hücrelerde pMaOri.dCas9sgRNAligAB içeren hücrelerde kaldırıldığını doğrular. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tamamlayıcı Dosya: Tek kılavuz RNA (sgRNA) kaset sırası. SgRNA transkripsiyon, konsültatör lipL32 promotörü (kalın nükleotitler) tarafından yönetilir. sgRNA, protospacer'a atıfta bulunan, hedef genin kodlama zincirine baz eşleştirmeden sorumlu 20 nükleotitten ve dCas9 iskele dizisinden (altı çizili nükleotidler) oluşur. Xma Ben kısıtlama siteleri (cccggg) pMaOri.dCas9 plazmid ligasyon için her iki ucunda dahildir. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Patojenik15 , 16,17,18ve saprofitik19 Leptospira türlerinin erken dizilimlerinden sonra, genomun veri madenciliği leptospiral patogenezin çeşitli yönlerine ışık tutar. Çoğu durumda, protein fonksiyonu putatif leptospiral yüzeye maruz proteinlerin rekombinant muadili kullanılarak ve daha sonra yerli protein fonksiyonu20 , 21,22,23,24,25,26spekülasyonu kullanılarak araştırılmıştır.
Mutantların üretimi ve ilgili fenotiplerinin değerlendirilmesi, fonksiyonel genomik analizin temel bileşenleridir. Leptospira spp.'de mutant üretme girişimleri rastgele transposon mutajensis27 , 28,29,30; bununla birlikte, bozulan genlerin kimliğini çıkarıcı kapsamlı ve zahmetli analizlerden sonra, L. sorgulayıcıları serovar Manilae'deki tüm genlerin sadece% 15'inin bozulduğu belirtildi27. Hedeflenen gen nakavtı, istenen hedef31,32içinde homolog kollar tarafından kuşatılmış bir antibiyotik direnç kaseti sunmak için intihar plazmidleri kullanılarak homolog rekombinasyon ile daha da elde edildi.
Bu teknolojiler uygulanarak, leptospiral temel biyoloji ve virülansın çeşitli yönleri araştırıldı31,33,34,35,36,37. E. coli-Leptospira konjugatif mekik vektörü, pMaOri 11'in gelişimi, epizomal gen susturma bileşenlerinin teslimine izin verildi.
Daha önce Cas9 kaynaklı çift iplikçik kırılmasının Leptospira spp. için ölümcül olduğu gösterilmiştir ve alternatif olarak, enzimin katalitik olarak inaktif varyantı olan dCas9, hem saprofitik hem de patojenik türlerde gen susturma elde etmek için kullanılabilir4,5. Plazmid pMaOri.dCas9'u sgRNA kaset ligasyonu için bir omurga olarak kullanarak, hem dCas9 hem de sgRNA ekspresyumu nedeniyle spesifik ve kararlı gen susturma elde edilebilir; dCas9'a bağlı sgRNA, Watson-Crick baz eşleştirmesi ile proteini istenen hedefe götürecektir.
Tam gen susturma için protospacer, istenen genin şablon zincirine göre tasarlanmalıdır, böylece sgRNA'nın taban eşleşmesi kodlama teli ile gerçekleşir. Leptospira spp.'deki ortalama %35'lik C+G içeriğine dayanarak PAM 5'-NGG-3' her 100 bp'de en az 3 kez gerçekleşecektir. Bu nedenle, Leptospira genomunda hemen hemen her gen en az bir PAM içerecektir. Ancak NGG motifi bulunamazsa alternatif NAG motifi değerlendirilebilir.
Çinko parmaklar ve TALE (transkripsiyon aktivatör benzeri efektörler) gibi önceki gen susturma teknikleri, her hedefe bir farklı protein yapımına dayanıyordu ve bu teknikleri zahmetli ve maliyetli hale getirdi38. CRISPRi durumunda, değişken bileşen sgRNA'dır, bu da yalnızca 5' uçtaki 20 bp'yi değiştirmeyi gerekli hale getirir. Tam, kararlı ve hedefli gen susturma sadece Leptospira spp.4,5, aynı zamanda diğer bakterilerde de gözlenmiştir 8,39,40,41.
HAN media13'ün gelişimi, koloni oluşumu için kuluçka süresini büyük ölçüde azaltarak ve Leptospira'nın C 37'de büyümesine izin vererek mutantların geri kazanılmasını tercih etti. Bununla birlikte, konjugasyon adımı sırasında, E. coli bu ortamda güçlü bir şekilde çoğalabileceğinden ve donör ve alıcı hücreler arasındaki hedeflenen 1:1 oranının üstesinden gelebileceğinden kullanılması önerilmez. Bu aşamada, EMJH artı DAP daha iyi bir seçimdir, çünkü E. coli bu medyada kötü bir şekilde çoğalr. Bazı laboratuvarların, E. coli hücrelerinin büyümesini de destekleyebilecek ek bileşenler içerebilen şirket içi takviyeli EMJH yaptığını belirtmek gerekir.
Burada sunulan konjugasyon protokolü L. sorgulayıcılar serovar Copenhageni suşu Fiocruz L1-130 için optimize edildi ve ayrıca yakın zamanda izole edilmiş patojenik bir suşun toprak örneklerinden dönüşümünde etkili olduğu kanıtlanmıştır5. L. borgpetersenii türlerinin farklı serovarları ile yapılan ilk girişimler, açıklanan protokolle daha düşük konjugasyon verimliliğine işaret eder. Bu nedenle, Leptospira'nınfarklı türleri / serovarları ile çalışırken, donör:alıcı hücre oranları, ilk hücre yoğunlukları, konjugasyon ortamı ve süresi (24 ve 48 saat) göz önünde bulundurularak, konjugasyon için en uygun koşullar ampirik olarak belirlenmelidir. Farklı Leptospira türlerinin ve serovarlarının farklı konjugasyon protokolleri ile farklı davranacağını varsaymak mantıklıdır.
Saprofitik Leptospira kolonilerinin plakalarda görselleştirilmesi nispeten kolay olsa da, patojenik kolonileri gözlemlemek daha zor olabilir. Normalde% 0.4 tavşan serumu ve spektinomisin ile desteklenmiş HAN medyası kullanılarak, transkonjugan koloniler 10. Deneyimlerimize göre, koloniler başlangıçta medya yüzeyinde şeffaf bir hale olarak bulunurlar. Video protokolünde, şeffaf olanların çekilmesi zor olduğu için 14 günlük büyümeden sonra daha yoğun koloniler gösterilmiştir. Bu aşamada, farklı ışık insidansı elde etmek için plakayı döndürmek ve beyaz ve koyu arka planlar arasında geçiş yapmak kolonileri tanımlamaya yardımcı olabilir.
Mutant doğrulaması için, immünobotting basit bir yaklaşım sunar; bununla birlikte, antikorlar hedef proteinlere karşı her zaman mevcut olmadığından, gen susturmasını doğrulamak için alternatif stratejiler izlenebilir. Hedef gen için astarlar kullanan nicel ters transkriptaz PCR (qRT-PCR) ve sgRNA güdümlü dCas9 gen transkripsiyonunun tıkanmasının sorumlusu olduğundan, konsitülatif kontrol gen susturma doğrulamak için etkilidir. Hedef gen protein jellerinde açıkça tanımlanmış bir protein bandını kodlarsa, SDS-PAGE susturma gösterebilir ve lipL32 gen susturma5. LPS biyosentez genleri susturulursa, LPS boyama kullanılabilir; iyi tanımlanmış substratlara sahip enzimler için kodlanan genlerin susturması durumunda, kromojenik substratlara sahip kinetik tahliller geçerli stratejilerdir; L. biflexa'da β-galaktozdaz susturma X-gal ve ONPG (orto-Nitrophenyl-β-galaktoside) substratları4kullanılarak doğrulandı.
Gen susturma teyid edildikten sonra, fenotipi daha fazla değerlendirmek için deneyler tasarlanabilir. Bakteriyel adezlerin susturması durumunda bağlayıcı tahliller yapılabilir; serum-challenge tahlilleri, Patojenik Leptospira5tarafından görüntülenen serum sağkalımında LigA ve LigB'nin rolünü doğruladı. Mutantlar, virülansın zayıflamasını değerlendirmek için hayvanları aşılamak için de kullanılabilir; Bu durumda, mutant ile aşılanan hayvanlar sadece pMaOri.dCas9 içeren hücrelerle enfekte olanlarla karşılaştırılmalıdır.
Sonuç olarak, mevcut protokol, 10 gün içinde mutant iyileşmesini kolaylaştırmak için HAN medyasını kullanan patojenik Leptospira türlerinde gen susturma için CRISPRi uygulamasını açıklar. Gen susturma fonksiyonel genomik analiz ile birlikte Leptospirapatojenik mekanizmaları anlamamızı geliştirecek ve sonuçta hastalık kontrolü için daha iyi profilaktik stratejilerin geliştirilmesine yol açacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
USDA fırsat eşitliği sağlayıcısı ve işverenidir. Bu yayında ticari adlardan veya ticari ürünlerden bahsedilmesi yalnızca belirli bilgileri sağlamak içindir ve ABD Tarım Bakanlığı'nın tavsiyesi veya onayı anlamına gelmez. Brezilya ajansı FAPESP (grant 2014/50981-0) bu çalışmayı finansal olarak destekledi; LGVF, FAPESP'ten (2017/06731-8 ve 2019/20302-8) burs ile finanse edilir. Fon sağlayıcılar çalışma tasarımı, veri toplama ve analiz, yayınlama kararı veya makale hazırlamada hiçbir rol oynamamışlardır. Yazarlar ayrıca USDA Görsel Hizmetler'den Hannah Hill ve Alexander Grimes'a video protokolünü çektirip düzenlediklerinden dolayı teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.1 µm pore size mixed cellulose esters membrane | Millipore | VCWP02500 | Filtration for bacterial conjugation |
| 2,6-Diaminopimelic acid (DAP) | Sigma | D1377 | Growth of auxotrophic E. coli β2163 |
| Agar Noble | BD & Company | 214230 | Used for preparation of solid EMJH and HAN plates |
| Bacto Agar | BD & Company | 214010 | Used for preparation of solid LB plates |
| Clarity Western ECL substrate | Biorad | 170-5060 | Chemiluminescent substrate |
| dNTP set | Thermo Fisher | 10297-018 | dNTPs for PCR reaction |
| Glass Microanalysis Filter Holder | Millipore | XX1012530 | Filtration for bacterial conjugation |
| Imaging System | Biorad | ChemiDoc MP | Chemiluminescence detection |
| LB broth, Miller | BD & Company | 244620 | Lysogenic liquid medium for E. coli culturing |
| Leptospira Enrichment EMJH | BD & Company | 279510 | Supplementation of EMJH media |
| Leptospira Medium Base EMJH | BD & Company | 279410 | EMJH medium for Leptospira |
| Mini-PROTEAN TGX Gels 12% | Biorad | 4568043 | Used for polyacrylamide gel eletrophoresis |
| Optical density reader | Molecular Devices | SpectraMax M2 | For optical density measurements of bacterial cultures |
| Phosphate Buffered Saline 7.4 | Sigma | 806552 | Saline solution for washing bacterial pellets |
| Spectinomycin | Sigma | S0692 | Selection of pMaOri backbone plasmids |
| Taq DNA Polymerase | Thermo Fisher | EP0402 | Enyme, buffer and MgCl2 for PCR reaction |
| Thermocycler | Applied Biosystem | GeneAmp PCR System 9700 | Used for PCR reaction cycling |
| Thymidine (dT) | Sigma | T9250 | Growth of auxotrophic E. coli π1 |
| XmaI restriction enzyme | New Englan BioLabs | R0180L | Digestion of plasmids and inserts |
Referanslar
- Bharti, A. R., et al. Leptospirosis: A zoonotic disease of global importance. Lancet Infectious Disease. 3 (12), 757-771 (2003).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLoS Neglected Tropical Disease. 9 (9), 0003898(2015).
- Shapiro, R. S., et al. A CRISPR-Cas9-based gene drive platform for genetic interaction analysis in Candida albicans. Nature Microbiology. 3 (1), 73-82 (2018).
- Fernandes, L. G. V., et al. Gene silencing based on RNA-guided catalytically inactive Cas9 (dCas9): a new tool for genetic engineering in Leptospira. Science Reports. 9 (1), 1839(2019).
- Fernandes, L. G. V., Hornsby, R. L., Nascimento, A. L. T. O., Nally, J. E. Genetic manipulation of pathogenic Leptospira: CRISPR interference (CRISPRi)-mediated gene silencing and rapid mutant recovery at 37 C. Science Reports. 11 (1), 1768(2021).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Choudhary, E., Thakur, P., Pareek, M., Agarwal, N. Gene silencing by CRISPR interference in mycobacteria. Nature Communication. 6, 6267(2015).
- Zhukova, A., et al. Genome-wide transcriptional start site mapping and sRNA identification in the pathogen. Frontiers in Cell and Infectious Microbiology. 7, 10(2017).
- Demarre, G., et al. A new family of mobilizable suicide plasmids based on broad host range R388 plasmid (IncW) and RP4 plasmid (IncPalpha) conjugative machineries, and their cognate Escherichia coli host strains. Research in Microbiology. 156 (2), 245-255 (2005).
- Pappas, C. J., Benaroudj, N., Picardeau, M. A replicative plasmid vector allows efficient complementation of pathogenic Leptospira strains. Applied Environmental Microbiology. 81 (9), 3176-3181 (2015).
- Fernandes, L. G. V., Nascimento, A. L. T. O. Specific gene silencing in Leptospira biflexa by RNA-guided catalytically inactive Cas9 (dCas9). Methods in Molecular Biology. 2134, 109-122 (2020).
- Hornsby, R. L., Alt, D. P., Nally, J. E. Isolation and propagation of leptospires at 37 °C directly from the mammalian host. Science Reports. 10 (1), 9620(2020).
- Haake, D. A. Hamster model of leptospirosis. Current Protocols in Microbiology. , Chapter 12, Unit 12E.12 (2006).
- Nascimento, A. L., et al. Comparative genomics of two Leptospira interrogans serovars reveals novel insights into physiology and pathogenesis. Journal of Bacteriology. 186 (7), 2164-2172 (2004).
- Nascimento, A. L., et al. Genome features of Leptospira interrogans serovar Copenhageni. Brazillian Journal of Medical Biology Research. 37 (4), 459-477 (2004).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Bulach, D. M., et al. Genome reduction in Leptospira borgpetersenii reflects limited transmission potential. Proceedings of the National Academy of Science U. S. A. 103 (39), 14560-14565 (2006).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLoS One. 3 (2), 1607(2008).
- Fernandes, L. G., et al. OmpL1 is an extracellular matrix- and plasminogen-interacting protein of Leptospira spp. Infections and Immunity. 80 (10), 3679-3692 (2012).
- Fernandes, L. G., et al. Leptospira spp.: Novel insights into host-pathogen interactions. Veterinary Immunology and Immunopathology. 176, 50-57 (2016).
- Castiblanco-Valencia, M. M., et al. Leptospiral immunoglobulin-like proteins interact with human complement regulators factor H, FHL-1, FHR-1, and C4BP. Journal of Infectious Diseases. 205 (6), 995-1004 (2012).
- Choy, H. A., et al. The multifunctional LigB adhesin binds homeostatic proteins with potential roles in cutaneous infection by pathogenic Leptospira interrogans. PLoS One. 6 (2), 16879(2011).
- Siqueira, G. H., et al. The recombinant LIC10508 is a plasma fibronectin, plasminogen, fibrinogen and C4BP-binding protein of Leptospira interrogans. Pathogen and Diseases. 74 (2), (2016).
- Teixeira, A. F., et al. Features of two new proteins with OmpA-like domains identified in the genome sequences of Leptospira interrogans. PLoS One. 10 (4), 0122762(2015).
- Kochi, L. T., et al. The interaction of two novel putative proteins of Leptospira interrogans with E-cadherin, plasminogen and complement components with potential role in bacterial infection. Virulence. 10 (1), 734-753 (2019).
- Murray, G. L., et al. Genome-wide transposon mutagenesis in pathogenic Leptospira species. Infections and Immunity. 77 (2), 810-816 (2009).
- Bourhy, P., Louvel, H., Saint Girons, I., Picardeau, M. Random insertional mutagenesis of Leptospira interrogans, the agent of leptospirosis, using a mariner transposon. Journal of Bacteriology. 187 (9), 3255-3258 (2005).
- Pětrošová, H., Picardeau, M. Screening of a Leptospira biflexa mutant library to identify genes involved in ethidium bromide tolerance. Applied Environmental Microbiology. 80 (19), 6091-6103 (2014).
- Slamti, L., Picardeau, M. Construction of a library of random mutants in the spirochete Leptospira biflexa using a mariner transposon. Methods in Molecular Biology. 859, 169-176 (2012).
- Croda, J., et al. Targeted mutagenesis in pathogenic Leptospira species: Disruption of the LigB gene does not affect virulence in animal models of leptospirosis. Infections and Immunity. 76 (12), 5826-5833 (2008).
- Picardeau, M., Brenot, A., Saint Girons, I. First evidence for gene replacement in Leptospira spp. Inactivation of L. biflexa flaB results in non-motile mutants deficient in endoflagella. Molecular Microbiology. 40 (1), 189-199 (2001).
- King, A. M., et al. High-temperature protein G is an essential virulence factor of Leptospira interrogans. Infections and Immunity. 82 (3), 1123-1131 (2014).
- Lambert, A., et al. FlaA proteins in Leptospira interrogans are essential for motility and virulence but are not required for formation of the flagellum sheath. Infections and Immunity. 80 (6), 2019-2025 (2012).
- Murray, G. L., et al. Leptospira interrogans requires heme oxygenase for disease pathogenesis. Microbes and Infections. 11 (2), 311-314 (2009).
- Ristow, P., et al. The OmpA-like protein Loa22 is essential for leptospiral virulence. PLoS Pathogens. 3 (7), 97(2007).
- Sasaki, Y., et al. Leptospiral flagellar sheath protein FcpA interacts with FlaA2 and FlaB1 in Leptospira biflexa. PLoS One. 13 (4), 0194923(2018).
- Gaj, T., Gersbach, C. A., Barbas, C. F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology. 31 (7), 397-405 (2013).
- Cress, B. F., et al. Rapid generation of CRISPR/dCas9-regulated, orthogonally repressible hybrid T7-lac promoters for modular, tuneable control of metabolic pathway fluxes in Escherichia coli. Nucleic Acids Research. 44 (9), 4472-4485 (2016).
- Zhao, C., Shu, X., Sun, B. Construction of a gene knockdown system based on catalytically inactive ("dead") Cas9 (dCas9) in Staphylococcus aureus. Applied Environmental Microbiology. 83 (12), (2017).
- Zhao, Y., et al. CRISPR/dCas9-mediated multiplex gene repression in Streptomyces. Biotechnology Journal. , 1800121(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır