Method Article
Application de l’interférence CRISPR (CRISPRi) pour le silençage génique chez les espèces pathogènes de Leptospira
Dans cet article
Résumé
Ici, l’application de l’interférence CRISPR (CRISPRi) pour le silençage génétique spécifique chez les espèces de Leptospira est décrite. Les cellules de Leptospira sont transformées par conjugaison avec des plasmides exprimant dCas9 (Catalytiquement « mort » Cas9) et un ARN monoguide (SGRNA), responsable de l’appariement de base à la cible génomique souhaitée. Des méthodes pour valider le silençage génique sont présentées.
Résumé
La leptospirose est une zoonose mondiale négligée, responsable d’au moins 1 million de cas par an et de près de 60 mille décès. La maladie est causée par des bactéries pathogènes et virulentes du genre Leptospira, soit par contact direct avec les bactéries, soit indirectement par exposition à de l’eau ou du sol contaminés. Les animaux domestiques et sauvages agissent comme des hôtes réservoirs de l’infection, excrant des leptospires des tubules rénaux colonisés du rein, par l’intermédiaire de l’urine, dans l’environnement. La génération de souches mutantes de Leptospira est essentielle pour évaluer et comprendre les mécanismes pathogènes de l’infection. L’interférence CRISPR (CRISPRi) s’est avérée être un outil simple, abordable et spécifique pour le silençage génique dans le Leptospirapathogène. Par conséquent, les détails méthodologiques de l’obtention des constructions plasmidiques contenant à la fois de l’ARN dCas9 et de l’ARN guide, de l’administration de plasmides à Leptospira par conjugaison avec la souche β2163 de E. coli, et de la récupération et de l’évaluation des transconjugants, seront décrits. De plus, le milieu Hornsby-Alt-Nally (HAN) récemment décrit permet l’isolement et la sélection relativement rapides des colonies mutantes sur les plaques de gélose.
Introduction
La leptospirose est une zoonose mondiale négligée causée par des espèces pathogènes et virulentes du genre Leptospira. Chez l’homme, la maladie représente plus d’un million de cas et 60 000 décès par an dans le monde1,2. Jusqu’à présent, il n’existe pas de vaccin efficace et à long terme contre la maladie. L’identification des facteurs de virulence et des mécanismes pathogènes est essentielle au développement de meilleures stratégies thérapeutiques et prophylactiques. Par conséquent, la capacité de générer des mutations génétiques et d’évaluer le phénotype résultant est essentielle à l’analyse génomique fonctionnelle3.
La construction des mutants dans le Leptospira pathogène a été considérée, jusqu’à présent, intrinsèquement inefficace, laborieuse, coûteuse, et difficile à mettre en œuvre. Ce scénario a radicalement changé avec l’application de la récente interférence CRISPR (CRISPRi) aux leptospires saprophytes4 et pathogènes5.
Le silençage génique est obtenu par l’expression de deux composants : une variante du CRISPR/Cas(clustré regularly interspaced short palindromic repeat/C RISPR associated) enzyme Cas9 de Streptococcus pyogenes,appelé catalytiquement mort Cas9 (dCas9) et un ARN monoguide (sgRNA), qui peut être édité selon la cibledésirée 6,7,8. La protéine dCas9, lorsqu’elle est liée à l’ARNsm, est dirigée vers des cibles d’ADN spécifiques par l’appariement de bases de Watson et de Crick, provoquant un blocage stérique de l’allongement de l’ARN polymérase, entraînant un silençage du gène dû à la transcription obstruée du gène7 (Figure 1).
Ce manuscrit vise à décrire la construction du plasmide pour exprimer à la fois le dCas9 et l’ARNm, la conjugaison entre le donneur E. coli β2163 et les cellules de Leptospira réceptrices, la récupération transconjugante, et enfin, la validation de colonies mutantes sélectionnées.
Protocole
1. Définition du proto-espaceur et construction du plasmide
REMARQUE: Dans cette section, la première étape de la sélection des protospacers appropriés pour la construction de l’ARNdb et la ligature ultérieure dans pMaOri.dCas9, est décrite (Figure 1). Cette séquence protospacer comprend une séquence de 20 nucléotides contre la cible souhaitée.
- Obtenir la séquence nucléotidique du gène d’intérêt pour le silence chez GenBank (https://www.ncbi.nlm.nih.gov/genbank). Soumettez-le au serveur web CHOPCHOP (http://chopchop.cbu.uib.no/), avec des paramètres définis pour Streptococcus pyogenes Cas9 et protospacer motif adjacent NGG après avoir sélectionné la "Cible Fasta« . Définissez les paramètres de « CRISPR/Cas9 » et PAM (protospacer adjacent motif) NGG.
- Sur la base des résultats obtenus, sélectionnez des protospacers avec le meilleur score possible (flèche verte), qui sont situés le plus près possible de l’extrémité 5' de la région codante et, surtout, sont contenus dans le brin modèle (moins) puisque le sgRNA doit s’apparier au brin codant du gène pour un silençage complet du gène.
REMARQUE : Le motif NGG n’est pas inclus dans la séquence sgRNA finale. - Utilisez le promoteur lipL32 pour exprimer l’ARN guide unique qui contient une séquence nucléotidique variable 20 à l’extrémité 5' et une séquence d’échafaudage dCas9 conservée. Fusionner la séquence 20-nt, appelée protospacer, au promoteur lipL32 (à son extrémité 5') et à l’échafaudage sgRNA (extrémité 3')(Figure 1B).
REMARQUE: Pour un promoteur lipL32 bien défini, utilisez la région promotrice comprenant -334 au TSS (Transcription Start Site, basé sur Zhukova et al.9). Vérifiez le fichier supplémentaire pour la cassette sgRNA finale. - Générez la cassette sgRNA par PCRséquentielle 5 ou faites-la synthétiser par un fournisseur commercial.
- Après avoir obtenu la cassette, ligatez-la en plasmide pMaOri.dCas9 sur le site de restriction de NoëlI aux deux extrémités (cccggg)4.
- Digérer à la fois la cassette sgRNA et le plasmide pMaOri.dCas9 avec l’enzyme derestriction Xma I et procéder à la ligature(Figure 1B).
- Effectuer les étapes de clonage dans la souche dT auxotrophe e. coli π110, en raison de l’origine pMaOri11 (et par extension, pMaOri.dCas9) de réplication, R6K-gamma.
REMARQUE: Pour un protocole détaillé pour la ligature et la sélection des clones, reportez-vous aux publications précédentes de Fernandes et Nascimento12. dCas9 guidé par sgRNA se liera au brin codant du gène d’intérêt sélectionné et, par conséquent, obstruera l’allongement de l’ARN polymérase(figure 1C),ce qui entraînera un silence du gène.
2. Transformation de Leptospira par conjugaison
Remarque : un schéma graphique de cette étape est présenté dans Figure 2. Pour créer des supports HAN et des plaques HAN, reportez-vous à Hornsby et al.13 et Fernandes et al.5.
- Cultiver des cellules de Leptospira pathogènes à 29 ou 37 °C dans les milieux HAN13 sous agitation en diluant une culture saturée dans des HAN frais à 1:100; typiquement, L. interrogans sérovar Copenhageni souche Fiocruz L1-130 prend 4-6 jours pour atteindre la densité cellulaire appropriée.
- S’assurer que les cultures atteignent un D.O. de 0,2-0,4 à 420 nm (2 à 5 x10 8 cellules/mL) avant d’utiliser pour la conjugaison.
REMARQUE: Étant donné que le milieu HAN change de couleur à mesure que les densités cellulaires augmentent (en raison du rouge de phénol contenu dans le milieu DMEM), centrifuger (4 000 x g,15 min, température ambiante) 1 mL du milieu de culture pour éliminer les leptospires et appliquer le surnageant comme blanc pour mesurer l’O.D.
- S’assurer que les cultures atteignent un D.O. de 0,2-0,4 à 420 nm (2 à 5 x10 8 cellules/mL) avant d’utiliser pour la conjugaison.
- Transformer la souche conjuguée E. coli β2163, auxotrophe pour l’acide diaminopimélique (DAP), avec le plasmide pMaOri.dCas9 contenant la cassette sgRNA. Pour E. transformation coli, utiliser soit des protocoles de choc thermique, soit l’électroporation. Inclure la transformation avec le plasmide pMaOri.dCas9 sans cassette sgRNA comme contrôle.
- Pour la transformation par thermochoc, mélanger l’ADN plasmidique (100 ng) avec des cellules de E. coli chimiquement compétentes et incuber sur de la glace pendant 30 min. Effectuer un choc thermique à 42 °C pendant 90 s et le replacer sur la glace pendant 5 min. Récupérez les cellules en ajoutant 1 mL de milieux LB, incuber à 37 °C pendant 1 h et procéder au placage.
- Pour l’électroporation, utilisez des cellules électrocompétentes mélangées à 100 ng d’ADN plasmidique. Utilisez les paramètres suivants pour l’impulsion : 1,8 kV, 100 Ω et 25 μF. Récupérez les cellules comme expliqué ci-dessus.
- Plaquer les cellules D. coli donneuses transformées dans un milieu de gélose LB complété par de l’acide diaminopimélique (DAP) (0,3 mM) et de la spectinomycine (40 μg/mL) pour sélectionner les plasmides.
- Pour la conjugaison, sélectionnez une colonie dans chaque plaque un jour avant le jour de la conjugaison (qui est déterminée en surveillant le D.O. des cultures de leptospires).
- Sélectionnez une colonie de E. coli β2163 dans le pMaOri.dCas9 vide et une autre parmi les plaques pMaOri.dCas9sgRNA. Laissez-les cultiver pendant la nuit dans 10 mL de LB plus DAP et de spectinomycine à 37 °C.
- Le lendemain, diluer les cultures saturées 1:100 dans 10 mL de LB frais plus DAP (n’incluez pas l’antibiotique ici) jusqu’àOD 420nm de 0.2-0.4. Normalement, il faut 2-3 h pour que E. coli atteigne ces densités.
- À l’intérieur d’une hotte de biosécurité BSL2, assemblez un appareil de filtration en plaçant un filtre à membrane d’esters de cellulose mélangés de 25 mm de diamètre et de 0,1 μm sur le dessus de la base en verre. Placez un entonnoir en verre de 15 mL sur le dessus et maintenez les deux pièces avec des pinces à ressort. Connectez le verre à une pompe à vide et ajoutez les cultures à l’entonnoir pour la filtration.
- Ajouter 5 mL de culture de Leptospira à l’entonnoir. Ajouter un volume de E. coli pour constituer la proportion de 1:1 basée sur les valeurs deDO 420nm des deux cultures. Allumez la pompe à vide et concentrez les cellules par filtration. Après la concentration cellulaire dans le filtre à membrane, récupérez-le soigneusement. Assurez-vous que le milieu est filtré à travers la membrane.
REMARQUE: La filtration prend 5 à 10 min. - Placez le filtre sur une plaque EMJH disponible dans le commerce (voir table des matériaux)complétée par du DAP (0,3 mM). Assurez-vous que le côté bactéries est en place. Incuber les plaques à 29 °C pendant 24 h.
REMARQUE: Si des plaques HAN ou EMJH14 complétées en interne sont utilisées, E. coli peut proliférer et surmonter la proportion prévue de 1:1, ce qui peut à son tour diminuer l’efficacité de la conjugaison5. - Après 24 h, récupérez les filtres des plaques et placez chaque filtre individuel dans un tube conique de 50 mL.
- Utilisez 1 mL de milieu HAN liquide pour libérer les cellules de la surface du filtre par pipetage et vortexage étendus.
- Visualisez les solutions bactériennes mixtes récupérées par microscopie à champ noir pour vérifier la viabilité et la motilité des cellules, et les proportions de Leptospira: E. coli.
REMARQUE : À ce stade, on peut voir des nombres équivalents de E. coli et de Leptospira. - Étaler 100 à 200 μL de cette culture sur des plaques DEN contenant 0,4 % de sérum de lapin inactivé et 40 μg/mL de spectinomycine. Incuber des plaques à 37 °C dans une atmosphère à 3 % de CO2.
REMARQUE: Normalement, L. interrogans sérovar Copenhageni souche Fiocruz L1-130 cellules forment des colonies en 5-7 jours sur les plaques de contrôle et en 8-10 jours sur les plaques de spectinomycine. À ce stade, E. coli ne se développera pas puisqu’il est auxotrophe pour le DAP. - Pour lutter contre les cultures, diluer les cultures à 104 leptospires/mL et ajouter 100 μL sur les plaques sans antibiotique, pour surveiller la croissance leptospirale.
3. Sélection des colonies et croissance et validation des transconjugants
REMARQUE: Les colonies devraient être apparentes au jour 10. Cependant, ils ne sont pas trop faciles à visualiser. Normalement, à ce stade, les plaques HAN sont un peu opaques en raison des cellules séchées qui se sont répandues et les colonies de Leptospira peuvent apparaître comme un halo transparent sur le fond blanchâtre. Il est recommandé de visualiser les plaques à différents angles pour obtenir une incidence lumineuse différente, ce qui rend les colonies plus apparentes. À des périodes d’incubation plus longues, les colonies peuvent acquérir un aspect plus dense et, dans ce cas, elles se présentent sous forme de halos laiteux sur un fond sombre.
- Ajouter 100 μL de milieux HAN liquides à chaque microtube de 1,5 mL pour récupérer les mutants. Prenez au moins 3 colonies de chaque plaque.
- À l’aide d’une pointe de micropipette, « creusez » la gélose pour récupérer les colonies des plaques, car les colonies leptospirales peuvent être souterraines.
NOTA : On s’attend à ce que la gélose soit emportée à ce stade. Les colonies doivent être prélevées sur des plaques témoins contenant du plasmide pMaOri.dCas9 vide et sur des plaques contenant des leptospires contenant des plasmides exprimant à la fois l’ARN dCas9 et l’ARN guide unique, conçues pour le gène cible. - Distribuer la colonie recueillie dans 100 μL de milieux HAN dans un microtube de 1,5 mL et homogénéiser vigoureusement. À ce stade, assurez une rupture maximale de l’intégrité de la gélose pour libérer les cellules. Vortex la suspension pendant 10 s.
- À l’aide d’une pointe de micropipette, « creusez » la gélose pour récupérer les colonies des plaques, car les colonies leptospirales peuvent être souterraines.
- Visualisez les cellules récupérées par microscopie en champ sombre à un grossissement de 200 à 400x en ajoutant une goutte de 5 μL sur une lame de verre et couvrez immédiatement les échantillons avec une lame de couverture.
- Confirmer la présence de leptospires vivantes et viables récupérées dans les colonies.
- Après la visualisation et la confirmation de leptospires viables, transférer 100 μL de cellules dans des milieux HAN liquides contenant 40 μg/mL de spectinomycine.
- Après la croissance dans les milieux HAN liquides, évaluer les cultures pour la présence du plasmide avec l’amorce pMaOri2 F (ACGCAATGTATCGATACCGAC) et R (ATAGGTGAAGTAGGCCCACCC), qui reconnaissent la région qui flanque la cassette sgRNA.
- Prélever 200 μL de culture, centrifuger (4 000 x g,15 min), jeter le surnageant et ressusciter la pastille résultante dans 20 μL d’eau.
- Utilisez cette suspension comme modèle pour une PCR supplémentaire, sans avoir besoin d’extraction d’ADN12.
REMARQUE: Les cellules avec pMaOri.dCas9 rendront un amplicon de 281 bp, par rapport à celles contenant les plasmides avec la cassette sgRNA qui rendra un amplicon de 723 bp.
- Pour la confirmation du silençage génique, effectuer un immunoblot en utilisant des extraits cellulaires de transconjugants contenant uniquement pMaOri.dCas9 (contrôle négatif) et pMaOri.dCas9sgRNA.
- Appliquer l’équivalent de 5 x 107 cellules par voie du gel de polyacrylamide de dodécyl sulfate de sodium (SDS).
- Electrotransfert les protéines à la membrane pour l’incubation avec les anticorps appropriés. Outre l’anticorps contre le gène cible pour faire taire, utilisez-en un autre pour le contrôle de la charge.
- Conservez les cultures mutantes dans les milieux HAN plus la spectinomycine pour maintenir le plasmide. Si aucun antibiotique n’est appliqué sur le milieu, un silençage complet des gènes peut être observé pendant au moins trois passages5.
Résultats
Même si la teneur en CG dans les génomes de Leptospira spp. est généralement d’environ 35%; pratiquement tous les gènes sont susceptibles de contenir le PAM 5'NGG 3'; ce motif doit être pris en compte dans le brin de modèle. Après avoir entré la séquence codante d’un gène (du début à l’arrêt des codons), en fonction des résultats CHOPCHOP, les protospacers doivent être sélectionnés au brin moins (-, modèle). Il est important de ne pas inclure le motif NGG dans le protospacer 20-nt sgRNA.
Si la conjugaison est effectuée avec une proportion donneur/cellule réceptif de 1:1, pendant 24 h à la surface des plaques de gélose EMJH plus DAP, et que 200 μL de la suspension bactérienne récupérée sont répartis sur les plaques de gélose HAN plus spectinomycine, les colonies de transconjugants devraient être visibles à environ 8-10 jours. L’étalement de ce volume se traduit normalement par 20 à 40 colonies par plaque(figure 3A). Afin de vérifier la viabilité cellulaire après la conjugaison, les cellules peuvent être réparties sur des plaques HAN sans sélection antibiotique. Dans ce cas, les colonies peuvent être observées dès 7 jours. Les plaques HAN deviennent jaune pâle dans une atmosphère à 3 % de CO2.
Après la cueillette des colonies et la croissance dans les milieux liquides plus la spectinomycine, la PCR utilisant des cellules entières et des amorces pMaOri2 peut être utilisée pour un contrôle de qualité initial des transconjugants(Figure 3B). Les cellules leptospirales contenant le plasmide témoin pMaOri.dCas9 devraient donner un amplicon de 281 pb, tandis que les cellules contenant le plasmide pour faire taire, c’est-à-dire contenant à la fois dCas9 et sgRNA, devraient avoir comme conséquence un amplicon de 723 pb. Les amorces pMaOri2 F et R ont été conçues pour flanquer le site de restriction de NoëlI, qui est le site utilisé pendant la ligature de cassette sgRNA.
Avec la confirmation de la présence de plasmides, les cellules peuvent être récoltées dans les milieux, lavées deux fois avec du PBS, puis utilisées pour préparer un extrait de cellules entières pour l’immunoblotting. Si le silence s’est produit, les protéines cibles, dans ce cas, LipL32 ou LigA et LigB, doivent être observées uniquement dans les cellules de type sauvage et dans celles contenant pMaOri.dCas9; même avec des temps d’exposition plus élevés, aucune protéine correspondante ne devrait être visible dans les cellules contenant pMaOri.dCas9sgRNA (Figure 3C).
Si des expériences pour évaluer la virulence leptospirale après le silence des gènes sont prévues, les cultures utilisées pour la conjugaison devraient être leptospiravirulent à faible passage. Une fois le silence des gènes confirmé, plusieurs aliquotes peuvent être congelées en tant que sauvegarde. Si le gène réduit au silence a un phénotype mesurable, par exemple, basé sur des travaux antérieurs avec des protéines recombinantes, les cultures peuvent être utilisées pour la validation et, dans ce cas, les cellules contenant pMaOri.dCas9 seulement, peuvent être incluses comme contrôle négatif.
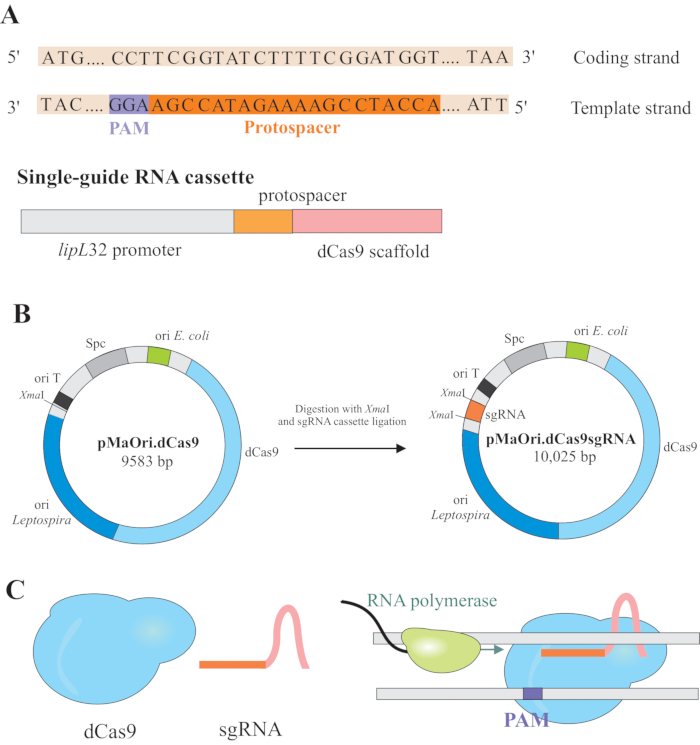
Figure 1: Développement du dCas9 et du plasmide exprimant l’ARNm. (A) Un protospacer long de 20 nt, suivi du S. pyogenes dCas9 PAM 5'-NGG-3', est sélectionné dans le brin modèle du gène cible afin que l’ARNm ultérieur puisse effectuer l’appariement de base de Watson et de Crick au brin codant correspondant, ce qui entraîne un silençage complet du gène. (B) La cassette sgRNA est composée du promoteur lipL32, du protospacer 20-nt et de l’échafaudage dCas9. Le plasmide pMaOri.dCas9 est utilisé comme colonne vertébrale pour la ligature de cassettes sgRNA sur le site de restriction de NoëlI. Le plasmide résultant, appelé pMaOri.dCas9sgRNA est livré aux leptospires, et l’expression de dCas9 et sgRNA est responsable du silençage du gène. (C) sgRNA-dirigé dCas9 agit comme une barrière physique à l’élongation de l’ARN polymérase, donc, entravant la transcription. Veuillez cliquer ici pour voir une version plus grande de cette figure.
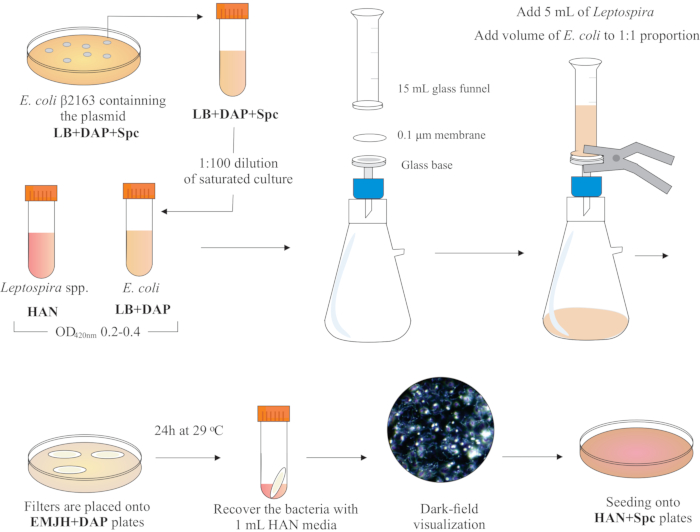
Figure 2: Représentation schématique du protocole de conjugaison. L’espèce désirée de Leptospira est cultivée dans les milieux HAN, sous agitation, jusqu’à ce que O.D. de 0,2-0,4 (phase du milieu du log) à 420 nm. Un jour avant la conjugaison, une colonie de donneur recombinant E. coli β2163 contenant le plasmide d’intérêt est prélevée parmi les plaques de gélose LB+DAP+Spc, car les cellules sont cultivées pendant la nuit dans du liquide LB avec la même supplémentation. Le lendemain, saturé E. Les cultures de coli sont diluées dans du LB plus du DAP et cultivées jusqu’à ce que le D.O. soit de 0,2 à 0,4 à 420 nm. Le donneur E. coli et le receveur Leptospira sont mélangés à une proportion cellulaire de 1:1 sur la surface d’un filtre de 0,1 μm par un appareil de filtration sous pression négative. Ensuite, des filtres sont placés sur les plaques de gélose EMJH complétées par du DAP, et l’incubation se poursuit pendant 24 h à 29 °C. L’utilisation de l’EMJH limite la prolifération de E. coli, et la proportion prévue de 1:1 est maintenue. Les bactéries sont récupérées des filtres par pipetage avec des milieux HAN de 1 mL, et les suspensions sont visualisées sous microscopie darkfield. Enfin, 100 à 200 μL de chaque suspension sont ensemencés sur des plaques de gélose HAN contenant 0,4 % de sérum de lapin et incubés à 37 °C dans 3 % deCO2. À ce stade, le DAP est omis et, par conséquent, E. coli auxotrophe ne se développera pas. Veuillez cliquer ici pour voir une version plus grande de cette figure.
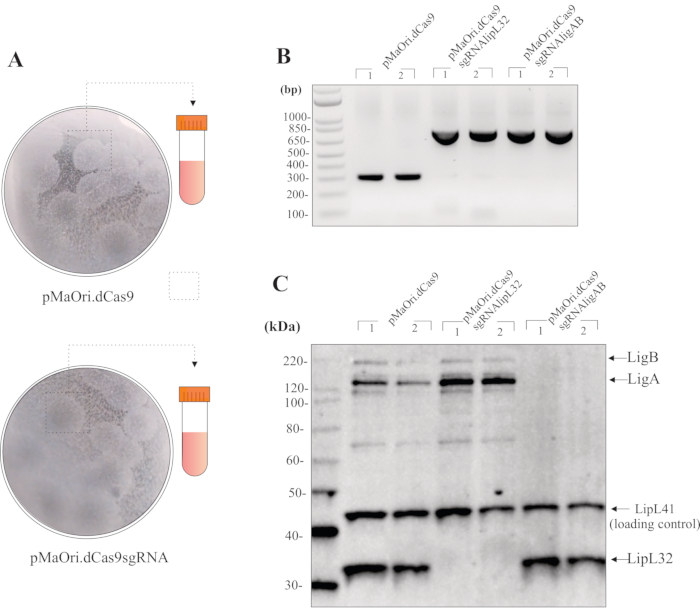
Figure 3: Résultats représentatifs pour l’évaluation des mutants. (A) Des colonies de plaques contenant du Leptospira transformées avec du pMaOri.dCas9 vide (témoin négatif pour d’autres expériences) et des plasmides pMaOri.dCas9sgRNA (avec un gène ciblé réduit au silence) sont cueillies, vigoureusement homogénéisées dans des HAN liquides et cultivées dans des HAN liquides contenant de la spectinomycine. Les cellules recombinantes peuvent être validées par PCR avec des amorces flanquant le site de NoëlI dans pMaOri.dCas9. (B) Dans ce cas, les cellules contenant pMaOri.dCas9 n’ont abouti qu’à un amplicon de 281 pb, tandis que les cellules contenant le plasmide pour faire taire, contenant à la fois dCas9 et sgRNA, ont montré un amplicon de 723 pb. Après confirmation de la présence des plasmides, le silençage du gène a été validé par analyse d’immunoblot. (C) L’incubation avec des anticorps dirigés à la fois contre la protéine cible et une protéine de contrôle de la charge est recommandée; dans l’immunoblot représentatif, des extraits de cellules entières de transconjugants contenant pMaOri.dCas9 seul ou avec des cassettes sgRNA ciblant lipL32 (pMaOri.dCas9sgRNAlipL32) et les gènes LigA et LigB (pMaOri.dCas9sgRNAligAB) sont affichés. La co-incubation avec anti-LipL32, anti-LigAB et anti-LipL41 (non-cible, contrôle de charge) confirme que l’expression de la protéine LipL32 est abolie dans les cellules contenant pMaOri.dCas9sgRNAlipL32 et LigA et LigB dans les cellules contenant pMaOri.dCas9sgRNAligAB. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Dossier supplémentaire : Séquence de cassettes d’ARN à guide unique (SGRNA). La transcription sgRNA est dirigée par le promoteur lipL32 constitutif (nucléotides gras). sgRNA est composé de 20 nucléotides se référant au protospacer, responsable de l’appariement de base au brin codant du gène cible, et de la séquence d’échafaudage dCas9 (nucléotides soulignés). Noël Les sites de restriction I (cccggg) sont inclus aux deux extrémités pour la ligature au plasmide pMaOri.dCas9. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Après le séquençage précoce des espèces pathogènes15,16,17,18 et saprophytes19Leptospira, l’exploration de données du génome a mis en lumière plusieurs aspects de la pathogenèse leptospirale. Dans la plupart des cas, la fonction protéique a été explorée en utilisant la contrepartie recombinante de protéines leptospirales leptospirales exposées à la surface et la spéculation ultérieure sur la fonction protéique native20,21,22, 23,24,25,26.
La génération de mutants, et l’évaluation de leur phénotype respectif, sont des composants clés de l’analyse génomique fonctionnelle. Les premières tentatives de génération de mutants dans les spp. de Leptospira ont été réalisées par mutagenèse aléatoire de transposon27,28,29,30; cependant, après une analyse approfondie et laborieuse pour déduire l’identité des gènes perturbés, il a été noté que seulement 15% de tous les gènes de L. interrogans sérovar Manillee ont été perturbés27. L’élimination ciblée des gènes a en outre été obtenue par recombinaison homologue utilisant des plasmides suicidaires pour délivrer une cassette de résistance aux antibiotiques flanquée de bras homologues dans la cible souhaitée31,32.
En appliquant ces technologies, plusieurs aspects de la biologie de base leptospirale et de la virulence ont été explorés31,33,34,35,36,37. Le développement du vecteur navette conjugaison E. coli-Leptospira, pMaOri 11, a permis l’administration de composants pour le silençage des gènes épisomales.
Il a été précédemment démontré que la cas9-induite double brin rupture est mortelle pour Leptospira spp. et, comme alternative, la variante catalytiquement inactive de l’enzyme, dCas9, peut être utilisée pour obtenir le silençage génique chez les espèces saprophytes et pathogènes4,5. En utilisant le plasmide pMaOri.dCas9 comme épine dorsale pour la ligature de la cassette sgRNA, un silençage génétique spécifique et stable peut être obtenu en raison de l’expression de dCas9 et de sgRNA; L’ARNm lié à dCas9 conduira la protéine à la cible souhaitée par appariement de base Watson-Crick.
Pour un silençage complet du gène, le protospacer doit être conçu en fonction du brin modèle du gène souhaité afin que l’appariement de base de l’ARNsm se produise avec le brin codant. Sur la base d’une teneur moyenne en C+G de 35% dans Leptospira spp., le PAM 5'-NGG-3' se produira au moins 3 fois tous les 100 pb. Par conséquent, pratiquement n’importe quel gène dans le génome de Leptospira contiendra au moins un PAM. Toutefois, si le motif NGG n’est pas trouvé, le motif NAG alternatif peut être évalué.
Les techniques antérieures de silençage génique, telles que les doigts de zinc et les effecteurs TALE (transcript activator-like effectors), reposaient sur la construction d’une protéine différente pour chaque cible, rendant ces techniques laborieuses et coûteuses38. Dans le cas de CRISPRi, la composante variable est le sgRNA, ce qui rend nécessaire de ne changer que les 20 pb à l’extrémité 5'. Un silençage génique complet, stable et ciblé a été observé non seulement chez Leptospira spp.4,5,mais aussi chez d’autres bactéries8,39,40,41.
Le développement du média HAN13 a favorisé la récupération des mutants en réduisant considérablement le temps d’incubation pour la formation des colonies et en permettant à Leptospira de croître à 37 °C. Cependant, au cours de l’étape de conjugaison, son utilisation n’est pas recommandée puisque E. coli peut proliférer vigoureusement dans ce milieux et surmonter la proportion prévue de 1:1 entre les cellules donneuses et les cellules réceptrices. À ce stade, EMJH plus DAP est le meilleur choix, car E. coli se réplique mal dans ce média. Il convient de mentionner que certains laboratoires fabriquent à l’interne des EMJH complétés, qui peuvent contenir des composants supplémentaires qui pourraient également soutenir la croissance des cellules E. coli.
Le protocole de conjugaison présenté ici a été optimisé pour L. interrogans sérovar Copenhageni souche Fiocruz L1-130, et il s’est également avéré efficace dans la transformation d’une souche pathogène récemment isolée à partir d’échantillons de sol5. Les tentatives initiales avec différents sérovars des espèces de L. borgpetersenii indiquent des efficacités de conjugaison inférieures avec le protocole décrit. Ainsi, lorsque vous travaillez avec différentes espèces / sérovars de Leptospira,les conditions optimales de conjugaison doivent être déterminées empiriquement, en tenant compte des proportions de cellules donneuses: réceptrices, des densités cellulaires initiales, des milieux de conjugaison et du temps (24 et 48 h). Il est raisonnable de supposer que différentes espèces de Leptospira et sérovars se comporteront différemment avec différents protocoles de conjugaison.
Même si les colonies saprophytes de Leptospira sont relativement faciles à visualiser sur les plaques, les colonies pathogènes peuvent être plus difficiles à observer. Normalement, en utilisant des milieux HAN complétés par du sérum de lapin à 0,4% et de la spectinomycine, des colonies transconjugantes peuvent être observées au jour 10. D’après notre expérience, les colonies se présentent initialement sous la forme d’un halo transparent à la surface du média. Dans le protocole vidéo, des colonies plus denses, après 14 jours de croissance, sont montrées car les colonies transparentes étaient difficiles à filmer. À ce stade, la rotation de la plaque pour obtenir une incidence lumineuse différente et le déplacement entre les arrière-plans blancs et sombres peuvent aider à identifier les colonies.
Pour la validation des mutants, l’immunoblotting offre une approche simple; cependant, comme les anticorps ne sont pas toujours disponibles contre les protéines cibles, d’autres stratégies pour valider le silençage des gènes peuvent être poursuivies. La PCR quantitative par transcriptase inverse (qRT-PCR) utilisant des amorces pour le gène cible et un contrôle constitutif est efficace pour valider le silence du gène puisque le dCas9 guidé par sgRNA est responsable du blocage de la transcription du gène. Si le gène cible code pour une bande protéique clairement définie dans des gels protéiques, SDS-PAGE peut démontrer un silence, et selon le gène lipL32 faisant taire5. Si les gènes de biosynthèse de LPS sont réduits au silence, la souillure de LPS peut être employée ; dans le cas de gènes silencieux codant pour des enzymes avec des substrats bien définis, les essais cinétiques avec des substrats chromogènes sont des stratégies valides; β-galactosidase faisant taire L. biflexa a été validée par l’utilisation de substrats X-gal et ONPG (ortho-Nitrophényl-β-galactoside)4.
Après confirmation du silençage génique, les expériences peuvent être conçues pour évaluer davantage le phénotype. Des essais de liaison peuvent être effectués dans le cas de l’adhesines bactériennes faisant taire; les analyses de sérum-défi ont confirmé le rôle de LigA et de LigB dans la survie de sérum montrée par Leptospirapathogène 5. Les mutants peuvent également être utilisés pour inoculer les animaux afin d’évaluer l’atténuation de la virulence; dans ce cas, les animaux inoculés avec le mutant doivent être comparés à ceux infectés par des cellules contenant pMaOri.dCas9 uniquement.
En conclusion, le protocole actuel décrit l’application de CRISPRi pour le silençage génique chez les espèces pathogènes de Leptospira utilisant des milieux han pour faciliter le rétablissement de mutant dans les 10 jours. Le silence des gènes combiné à l’analyse génomique fonctionnelle améliorera notre compréhension des mécanismes pathogènes de Leptospiraet conduira finalement au développement de meilleures stratégies prophylactiques pour le contrôle des maladies.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’USDA est un fournisseur et un employeur offrant l’égalité des chances. La mention de noms commerciaux ou de produits commerciaux dans cette publication a uniquement pour but de fournir des informations spécifiques et n’implique pas une recommandation ou une approbation par le département de l’Agriculture des États-Unis. L’agence brésilienne FAPESP (subvention 2014/50981-0) a soutenu financièrement ce travail; Lgvf est financé par une bourse de la FAPESP (2017/06731-8 et 2019/20302-8). Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publier ou la préparation des manuscrits. Les auteurs remercient également Hannah Hill et Alexander Grimes des services visuels de l’USDA pour le tournage et le montage du protocole vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| 0.1 µm pore size mixed cellulose esters membrane | Millipore | VCWP02500 | Filtration for bacterial conjugation |
| 2,6-Diaminopimelic acid (DAP) | Sigma | D1377 | Growth of auxotrophic E. coli β2163 |
| Agar Noble | BD & Company | 214230 | Used for preparation of solid EMJH and HAN plates |
| Bacto Agar | BD & Company | 214010 | Used for preparation of solid LB plates |
| Clarity Western ECL substrate | Biorad | 170-5060 | Chemiluminescent substrate |
| dNTP set | Thermo Fisher | 10297-018 | dNTPs for PCR reaction |
| Glass Microanalysis Filter Holder | Millipore | XX1012530 | Filtration for bacterial conjugation |
| Imaging System | Biorad | ChemiDoc MP | Chemiluminescence detection |
| LB broth, Miller | BD & Company | 244620 | Lysogenic liquid medium for E. coli culturing |
| Leptospira Enrichment EMJH | BD & Company | 279510 | Supplementation of EMJH media |
| Leptospira Medium Base EMJH | BD & Company | 279410 | EMJH medium for Leptospira |
| Mini-PROTEAN TGX Gels 12% | Biorad | 4568043 | Used for polyacrylamide gel eletrophoresis |
| Optical density reader | Molecular Devices | SpectraMax M2 | For optical density measurements of bacterial cultures |
| Phosphate Buffered Saline 7.4 | Sigma | 806552 | Saline solution for washing bacterial pellets |
| Spectinomycin | Sigma | S0692 | Selection of pMaOri backbone plasmids |
| Taq DNA Polymerase | Thermo Fisher | EP0402 | Enyme, buffer and MgCl2 for PCR reaction |
| Thermocycler | Applied Biosystem | GeneAmp PCR System 9700 | Used for PCR reaction cycling |
| Thymidine (dT) | Sigma | T9250 | Growth of auxotrophic E. coli π1 |
| XmaI restriction enzyme | New Englan BioLabs | R0180L | Digestion of plasmids and inserts |
Références
- Bharti, A. R., et al. Leptospirosis: A zoonotic disease of global importance. Lancet Infectious Disease. 3 (12), 757-771 (2003).
- Costa, F., et al. Global morbidity and mortality of Leptospirosis: A systematic review. PLoS Neglected Tropical Disease. 9 (9), 0003898(2015).
- Shapiro, R. S., et al. A CRISPR-Cas9-based gene drive platform for genetic interaction analysis in Candida albicans. Nature Microbiology. 3 (1), 73-82 (2018).
- Fernandes, L. G. V., et al. Gene silencing based on RNA-guided catalytically inactive Cas9 (dCas9): a new tool for genetic engineering in Leptospira. Science Reports. 9 (1), 1839(2019).
- Fernandes, L. G. V., Hornsby, R. L., Nascimento, A. L. T. O., Nally, J. E. Genetic manipulation of pathogenic Leptospira: CRISPR interference (CRISPRi)-mediated gene silencing and rapid mutant recovery at 37 C. Science Reports. 11 (1), 1768(2021).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Qi, L. S., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Choudhary, E., Thakur, P., Pareek, M., Agarwal, N. Gene silencing by CRISPR interference in mycobacteria. Nature Communication. 6, 6267(2015).
- Zhukova, A., et al. Genome-wide transcriptional start site mapping and sRNA identification in the pathogen. Frontiers in Cell and Infectious Microbiology. 7, 10(2017).
- Demarre, G., et al. A new family of mobilizable suicide plasmids based on broad host range R388 plasmid (IncW) and RP4 plasmid (IncPalpha) conjugative machineries, and their cognate Escherichia coli host strains. Research in Microbiology. 156 (2), 245-255 (2005).
- Pappas, C. J., Benaroudj, N., Picardeau, M. A replicative plasmid vector allows efficient complementation of pathogenic Leptospira strains. Applied Environmental Microbiology. 81 (9), 3176-3181 (2015).
- Fernandes, L. G. V., Nascimento, A. L. T. O. Specific gene silencing in Leptospira biflexa by RNA-guided catalytically inactive Cas9 (dCas9). Methods in Molecular Biology. 2134, 109-122 (2020).
- Hornsby, R. L., Alt, D. P., Nally, J. E. Isolation and propagation of leptospires at 37 °C directly from the mammalian host. Science Reports. 10 (1), 9620(2020).
- Haake, D. A. Hamster model of leptospirosis. Current Protocols in Microbiology. , Chapter 12, Unit 12E.12 (2006).
- Nascimento, A. L., et al. Comparative genomics of two Leptospira interrogans serovars reveals novel insights into physiology and pathogenesis. Journal of Bacteriology. 186 (7), 2164-2172 (2004).
- Nascimento, A. L., et al. Genome features of Leptospira interrogans serovar Copenhageni. Brazillian Journal of Medical Biology Research. 37 (4), 459-477 (2004).
- Ren, S. X., et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing. Nature. 422 (6934), 888-893 (2003).
- Bulach, D. M., et al. Genome reduction in Leptospira borgpetersenii reflects limited transmission potential. Proceedings of the National Academy of Science U. S. A. 103 (39), 14560-14565 (2006).
- Picardeau, M., et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLoS One. 3 (2), 1607(2008).
- Fernandes, L. G., et al. OmpL1 is an extracellular matrix- and plasminogen-interacting protein of Leptospira spp. Infections and Immunity. 80 (10), 3679-3692 (2012).
- Fernandes, L. G., et al. Leptospira spp.: Novel insights into host-pathogen interactions. Veterinary Immunology and Immunopathology. 176, 50-57 (2016).
- Castiblanco-Valencia, M. M., et al. Leptospiral immunoglobulin-like proteins interact with human complement regulators factor H, FHL-1, FHR-1, and C4BP. Journal of Infectious Diseases. 205 (6), 995-1004 (2012).
- Choy, H. A., et al. The multifunctional LigB adhesin binds homeostatic proteins with potential roles in cutaneous infection by pathogenic Leptospira interrogans. PLoS One. 6 (2), 16879(2011).
- Siqueira, G. H., et al. The recombinant LIC10508 is a plasma fibronectin, plasminogen, fibrinogen and C4BP-binding protein of Leptospira interrogans. Pathogen and Diseases. 74 (2), (2016).
- Teixeira, A. F., et al. Features of two new proteins with OmpA-like domains identified in the genome sequences of Leptospira interrogans. PLoS One. 10 (4), 0122762(2015).
- Kochi, L. T., et al. The interaction of two novel putative proteins of Leptospira interrogans with E-cadherin, plasminogen and complement components with potential role in bacterial infection. Virulence. 10 (1), 734-753 (2019).
- Murray, G. L., et al. Genome-wide transposon mutagenesis in pathogenic Leptospira species. Infections and Immunity. 77 (2), 810-816 (2009).
- Bourhy, P., Louvel, H., Saint Girons, I., Picardeau, M. Random insertional mutagenesis of Leptospira interrogans, the agent of leptospirosis, using a mariner transposon. Journal of Bacteriology. 187 (9), 3255-3258 (2005).
- Pětrošová, H., Picardeau, M. Screening of a Leptospira biflexa mutant library to identify genes involved in ethidium bromide tolerance. Applied Environmental Microbiology. 80 (19), 6091-6103 (2014).
- Slamti, L., Picardeau, M. Construction of a library of random mutants in the spirochete Leptospira biflexa using a mariner transposon. Methods in Molecular Biology. 859, 169-176 (2012).
- Croda, J., et al. Targeted mutagenesis in pathogenic Leptospira species: Disruption of the LigB gene does not affect virulence in animal models of leptospirosis. Infections and Immunity. 76 (12), 5826-5833 (2008).
- Picardeau, M., Brenot, A., Saint Girons, I. First evidence for gene replacement in Leptospira spp. Inactivation of L. biflexa flaB results in non-motile mutants deficient in endoflagella. Molecular Microbiology. 40 (1), 189-199 (2001).
- King, A. M., et al. High-temperature protein G is an essential virulence factor of Leptospira interrogans. Infections and Immunity. 82 (3), 1123-1131 (2014).
- Lambert, A., et al. FlaA proteins in Leptospira interrogans are essential for motility and virulence but are not required for formation of the flagellum sheath. Infections and Immunity. 80 (6), 2019-2025 (2012).
- Murray, G. L., et al. Leptospira interrogans requires heme oxygenase for disease pathogenesis. Microbes and Infections. 11 (2), 311-314 (2009).
- Ristow, P., et al. The OmpA-like protein Loa22 is essential for leptospiral virulence. PLoS Pathogens. 3 (7), 97(2007).
- Sasaki, Y., et al. Leptospiral flagellar sheath protein FcpA interacts with FlaA2 and FlaB1 in Leptospira biflexa. PLoS One. 13 (4), 0194923(2018).
- Gaj, T., Gersbach, C. A., Barbas, C. F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology. 31 (7), 397-405 (2013).
- Cress, B. F., et al. Rapid generation of CRISPR/dCas9-regulated, orthogonally repressible hybrid T7-lac promoters for modular, tuneable control of metabolic pathway fluxes in Escherichia coli. Nucleic Acids Research. 44 (9), 4472-4485 (2016).
- Zhao, C., Shu, X., Sun, B. Construction of a gene knockdown system based on catalytically inactive ("dead") Cas9 (dCas9) in Staphylococcus aureus. Applied Environmental Microbiology. 83 (12), (2017).
- Zhao, Y., et al. CRISPR/dCas9-mediated multiplex gene repression in Streptomyces. Biotechnology Journal. , 1800121(2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon