Method Article
דימות פריסייט במוח והדמיה המודינמית בעכברים מהונדסים ב- Vivo
In This Article
Summary
פרוטוקול זה מציג צעדים לרכישה וניתוח של תמונות סידן פלואורסצנטיות מפריקיטים משחישת מוח ונתוני זרימת דם מכלי דם סמוכים בעכברים מרדים. טכניקות אלה שימושיות למחקרים של פיזיולוגיה של תאי קיר וניתן להתאים אותן לחקור סידן ארעי בכל סוג תא.
Abstract
ההתקדמות האחרונה בביולוגיה של חלבונים וגנטיקה של עכברים אפשרה למדוד תנודות סידן תאיות של תאי מוח ב-vivo ותיאם זאת עם המודינמיקה המקומית. פרוטוקול זה משתמש בעכברים מהונדסים שהוכנו עם חלון גולגולת כרוני ומבטאים את מחוון הסידן המקודד גנטית, RCaMP1.07, תחת מקדם אקטין שריר חלק α כדי לסמן במיוחד תאי ציור קיר, כגון תאי שריר חלקים וסקולרית ו pericytes ensheathing. השלבים מפורטים על איך להכין צנתר וריד זנב להזרקה תוך ורידי של צבעים פלואורסצנטיים כדי לעקוב אחר זרימת הדם, כמו גם כיצד למדוד סידן ריסייט במוח ואת המודינמיקה כלי הדם המקומי (קוטר, מהירות תאי דם אדומים, וכו ') על ידי שני מיקרוסקופיה פוטון ב vivo דרך החלון הגולגולתי בעכברים מרדימים קטמין / קסילאסין. לבסוף, פרטים מסופקים לניתוח של תנודות סידן וסרטי זרימת דם באמצעות אלגוריתמי עיבוד תמונה שפותחו על ידי בארט ואח '2018, בדגש על האופן שבו תהליכים אלה יכולים להיות מותאמים לנתוני הדמיה תאית אחרים.
Introduction
כלי ההשמה של מערכת העצבים המרכזית מורכב מחדירה לעורקים, נימים וצמחייה עולה. בתוך רשת זו, תאי קיר כגון תאי שריר חלקים וסקולריים עטוף arterioles ו pericytes להרחיב תהליכים תאיים לאורך ענפי arteriole הראשון נימים1. Pericytes נראה שיש כמה תפקידים בתוך המוח כולל תחזוקה של מחסום הדם - מוח1,2, הגירה תנועתיות3, תכונות תאי גזע פוטנציאליים, ואת הרגולציה של זרימת הדם במוח4,5,6. רבים מהתפקידים התפקודיים של פריציטים נקשרו לתנודות בסידן תאי שעשויות לווסת את ההתכלחות או ההתכווצות של תאים אלה4,5,6.
מספר מחקרים אחרונים קבעו קריטריונים לזיהוי סוגים שונים של פריציטים במוח7,8. תאי קיר בתוך 4 הענפים הראשונים של עורקים חודרים הם ensheathing pericytes בהתבסס על הביטוי שלהם של חלבון התכווצות α שריר חלק אקטין (αSMA) שלהם בולט, סומטה בוצית עם תהליכים העוטפים את כלי הדם7,8,9. כדי לדמיין תנודות סידן pericytes ensheathing, פרוטוקול זה משתמש קו עכבר מהונדס רומן, Acta2-RCaMP1.07, הידוע גם בשם Tg (RP23-370F21-RCaMP1.07)B3-3Mik / J10. עכברים אלה מבטאים את מחוון הסידן האדום המקודד גנטית, RCaMP1.07, בתאי αSMA המבטאים (תאי שריר חלקים וסקולריים ופריציטים). מושבות הרבייה נשמרות על ידי חציית בעלי חיים שאינם מקריים עם hemizygotes. RCaMP1.07 הוא חלבון פלואורסצנטי אדום עם תחום מחייב calmodulin, אשר מגביר פלואורסצנטיות בעת קשירה סידן תאי10,11. פרוטוקול זה מתאר את השלבים להדמיית סידן משולבת של פריציטים וזרימת דם על ידי שתי מיקרוסקופיות פוטון כולל הליכים להזרקת וריד זנב של צבעים פלואורסצנטיים, רכישת תמונת מיקרוסקופ בעכברים מרדים וניתוח נתונים עם פלטפורמות תכנות (איור 1). טכניקות אלה שימושיות לטיפול בשאלות על פיזיולוגיה של תאי קיר, אך ניתן להתאים אותן לחקר סידן ארעי בכל סוג תא במוח או במערכת איברים אחרת.
עכבר Acta2-RCaMP1.07 בן 10 חודשים שימש לניסוי שהוצג במאמר זה. העכבר עבר ניתוח לחלון גולגולתי כרוני ולהשתלת ראש חודשיים לפני כן. פרטים על הפרוטוקול הכירורגי נדונים במחקרים קודמים12,13 והליכים דומים בוצעו בפרוטוקולים אחרים שפורסמו בעבר14,15. כלי ההדבקה מסומן עם פלואורסצאין-דקסטרן ירוק (70,000 מגוואט, פתרון אניוני, 2.5% w/v) מוזרק תוך ורידי. צבע זה חסכוני וזמין ממקורות מסחריים, אך יש לו ספקטרום פליטה רחב יותר שעשוי לחפוף עם פליטת RCaMP ולדמם דרך במהלך רכישת תמונת מיקרוסקופ. צעדים לבחינת אי-קמיקס ספקטרלי מפורטים בסעיף 4 להלן כדי לעקוף זאת, אך ניתן להשתמש גם בצבעים ירוקים אחרים עם ספקטרום פליטה צר יותר, כגון אלה המבוססים על EGFP.
Protocol
כל ההליכים הכוללים בעלי חיים ניסיוניים המתוארים להלן אושרו על ידי הוועדה לטיפול בבעלי חיים של אוניברסיטת מניטובה, הנשלטת על ידי המועצה הקנדית לטיפול בבעלי חיים.
1. הגדרת הליך והכנה
הערה: הפריטים הבאים נדרשים להזרקת קטטר וריד זנב: מזרקי אינסולין, חתיכה 15 ס"מ של צינורות PE10, 30 G מחטים, גזה, מלוחים, מלקחיים, צבע דקסטרן פלואורסין ירוק, צבת ומספריים. כמו כן, יש מחט מוכנה עם הרדמה קטמין / קסילסין שיוזרק לפני מפגש ההדמיה.
קריטי: כל החומרים והציוד בשלבים 1 ו -2 חייבים להיות מעוקרים לפני השימוש על ידי autoclaving או שטיפה עם 70% אתנול. אם לא ניתן לעקר את הצבת כראוי, מומלץ להשתמש בזוג מחזיקי מחטים גדולים. הרכבה קטטר חייב להיעשות עם צבת ומלקחיים כדי למנוע דקירות מחט מקרית.
- לחתוך כ 15-20 ס"מ של צינורות פוליאתילן, PE10 (I.D. 28 מ"מ; O.D. 61 מ"מ).
- מלא מזרק אינסולין 27 גרם עם 0.9% מלוחים ותחרה מחט המזרק לתוך הקצה של צינור פוליאתילן. לדחוף תמיסת מלח דרך הצינור, לוודא שאין דליפות.
- באמצעות צבת, לכופף מחט 30 G (0.3 מ"מ x 25 מ"מ) הלוך ושוב עד שהוא נשבר מהרכזת. המחט חייבת להיות נקייה ללא כיפופים.
- מחזיק את המחט עם מלקחיים, בזהירות להכניס את המחט לתוך סוף צינורות PE10 המחובר למזרק מלא מלוחים ולהסיר בועות אוויר. זה הצנתר להזרקה.
- מסנן 30 μL של 2.5% (w/v) פלואורסצאין דקסטרן באמצעות מסנן 13-25 מיקרומטר לפני ההזרקה.
- מלא מזרק אינסולין אחר עם 30 μL aliquot של dextran ולוודא כי אין בועות במזרק מלא.
2. הזרקת וריד זנב
- מרדים את העכבר עם איזופלוראן (4% אינדוקציה, 1.5% תחזוקה) או קטמין/קסילאסין (60 מ"ג/ק"ג; 10 מ"ג/ק"ג; i.p.) ולהחיל ג'ל חומר סיכה לעיניים. קטמין/קסילאסין מומלץ למדידות זרימת דם יציבות יותר במהלך ההדמיה ואת המינון ניתן להגדיל ל 90 מ"ג/ק"ג; 10 מ"ג/ק"ג קטמין/קסילאסין לפגישות הדמיה ארוכות יותר.
- כאשר העכבר נמצא במישור הניתוחי של ההרדמה, הנח כפפה מלאה במים חמים על הזנב כדי להרחיב את הווריד לרוחב.
- הסר את הכפפה לאחר 30s ולנקות את הזנב עם אתנול.
- מניחים את הזנב בין האגודל לאצבע האמצעית. ספק לחץ עם האצבע המורה על הזנב כדי להרחיב את הווריד. עם היד השנייה, להרים את המחט של הקטטר עם מלקחיים המכוונים את המסגרת כלפי מעלה לכיוון התקרה.
- לאחר ניקוי הזנב עם 70% אתנול, בצורה חלקה, הכנס את המחט לווריד בזווית של 0 מעלות והזריק בעדינות תמיסת מלח דרך הצנתר כדי להבטיח שהמחט ממוקמת כראוי.
הערה: אם אין התנגדות על הבוכנה ואין נפיחות של הזנב, אז המחט היא בווריד. אם יש התנגדות משמעותית או נפיחות, יש להסיר את המחט. שלבים 2.2-2.5 ניתן לחזור על עצמם עד 3 פעמים בכל צד של הזנב, החלפת מחט 30G בסוף הקטטר כל ניסוי שני עד המיקום נכון. - ברגע המחט הוא בווריד, להחליף את מזרק מלוחים בסוף הקטטר עם המזרק המכיל דקסטרן פלואורסצ'ין (שלב 1.6). לאט לאט להזריק את dextran לתוך צינורות קטטר, להבטיח לא בועות להיכנס לצינור. אם בועת אוויר נראית לעין, לחתוך את הצינורות המכילים את הבועה כדי להסיר אותו ולאחד מחדש את המזרק.
- כאשר כל dextran (30 μL aliquot) כבר מוזרק, להסיר את המזרק, ולהחליף אותו עם מזרק מלוחים. הזריקו את ה- dextran הנותר מהצינורות לעכבר עד שלא נשאר צבע בצינור.
- הסר את המחט מהזנב ולספק לחץ עם גזה במשך 10-30 s עד הדימום מפסיק.
קריטי: אם לאחר 6 ניסיונות הזרקת וריד הזנב אינה מוצלחת, החיה צריכה להיות בתמונה בפגישה אחרת. כמו כן, הנפח הכולל (מלוחים ו dextran) מוזרק לתוך העכבר לא יעלה על 100 μL.
3. שתי מיקרוסקופיה פוטונית
- התמקדות בחלון הגולגולת
הערה: השתמש הרדמה קטמין/ xylazine במהלך רכישת נתונים כי יש לו פחות השפעות כלי דם (vasodilation) מאשר איזופלוראן. אם משתמשים באיזופלוראן בשלבים לעיל, הזריקו לעכבר קטמין/קסילעין i.p. (המינון המומלץ המתואר לעיל) לפני ההדמיה.- תקן את העכבר עם בורג דרך עמוד הראש שלו לפלטפורמה עם כרית חימום מתחת למיקרוסקופ.
- החל חומר סיכה לעיניים של העכבר.
- נקו את חלון הגולגולת עם אפליקטורים דנטליים לחים. ודא שלא נותרו חלקיקים שעלולים להפריע לתהליך ההדמיה.
- החל ג'ל אולטרסאונד על החלון.
- התמקדו במטרה של שני פוטוסקופים עד שניתן יהיה לראות את כלי הדם מתחת לחלון.
- בדוק את הנשימה של העכבר וודא כי כרית החימום מספקת תמיכה בטמפרטורה.
- רכישת תמונה
הערה: למיקרוסקופ הדו-פוטון המשמש בניסוי זה יש לייזר טי-ספיר טונה לערעור פלואורסצנטי עם תא פוקל השולט בכמות הלייזר שמגיעה לדגימה. אור הנפלט מחולק על ידי dichroic מעבר ארוך 565 לשני צינורות photomultiplier GaAsP (PMTs) עם מסנן מעבר פס 595/50 (אדום) ומסנן מעבר פס 525/70 (ירוק) לזיהוי.
ההליכים המתוארים בשלבים 3.2 עד 3.4 מבוצעים באמצעות תוכנה ספציפית של מיקרוסקופ שני פוטון מפרוטוקול זה (ראה טבלת חומרים). ניתן להתאים שלבים אלה לתוכנות וציוד מיקרוסקופ אחרים.- עם אורות החדר כבוי, להגדיר את אורך הגל הרצוי בתוכנת מיקרוסקופ ל 990 ננומטר כדי לרגש הן RCaMP ו פלואורסצין-דקסטרן על ידי לחיצה על תיבת לייזר 2-P.
- הגדר את כוח הלייזר על ידי לחיצה על סעיף תיבת כוח / רווח /לייזרים והתאמת מתח התא Pockels 1 ב 30% או ערך של 300 בסולם של 1000. כוח הלייזר שמגיע לדגימה בהגדרה זו נקבע בעבר להיות ~ 30 mW.
- הגדר את הרגישות של גלאי PMT על-ידי לחיצה על המקטע תיבת צריכת חשמל/ PMTs והתאמת הערך ל- 700-800.
הערה: ניתן להתאים ערכים אלה ביחס לעוצמת הדגימה הפלואורסצנטית ויש להגדיר אותם לאפס לפני הדלקת האורות בחדר. - עבור אל המקטע רזולוציית תמונה ולחץ על הרזולוציה 512 x 512 עבור גודל תמונה גדול יותר.
- לחץ על לייזר 2-P/פתח כדי לפתוח את תריס לייזר 2-P.
- עבור אל מקטע הסריקה ולחץ על לחצן סריקה חיה.
הערה: סריקה חיה עם פרמטרים אלה ורזולוציה גבוהה יותר, ניתן לראות תאי ציור קיר חיוביים RCaMP ופלזמת דם מתויגת פלואורסצנטית. אם האות חלש, ניתן להגדיל את ערך הפוקאל עד שהתמונה תהיה ברורה.
קריטי: בשכבות הרקמה שטחית, כוח הלייזר לא יעלה על 50 mW, שהוא כ 600 בהגדרות תאים Pockels בדוגמה זו.
- רכישת ערימת עומק של תאי ציור הקיר ורשת כלי הדם
הערה: רכישת מחסנית עומק מומלץ לאתר כראוי pericytes ברשת כלי הדם. pericytes ensheathing ממוקמים על הענף הראשון עד הרביעי מן arteriole חודר7,8,9. תוכנת המיקרוסקופ המשמשת בפרוטוקול זה מתייחסת לערימות עומק כ-"Z-series".- הזזת מטרת המיקרוסקופ במישור X, Y ו- Z, לוקליזציה של עורק גדול על פני השטח של המוח בהתבסס על תיוג תאי השריר החלק של RCaMP.
- לחץ על התיבה Z-Series.
- התמקד בחלק העליון של הרקמה ליד כלי pial, להגדיר את זה כנקודת האפס ואת החלק העליון של מחסנית סדרת Z על ידי לחיצה על הנוכחי Z-סדרה / מיקום התחלה [μm] סעיף. לחץ על התיבה עם ארבעה פסים שחורים ופס אדום אחד בחלק העליון.
- התמקדו ברקמה לעומק הרצוי והגדירו זאת כתחתית הערימה על-ידי לחיצה על המקטע הנוכחי מסדרת Z/Stop [μm]. לחץ על התיבה עם ארבעה פסים שחורים ופס אדום אחד בתחתית.
- הגדר את העובי של כל מישור תמונה (גודל צעד) ל- 1-2 מיקרומטר על-ידי הקלדת הערך הרצוי בתיבה שמתחת ללחצן "גודל צעד" ( לחצןגודל צעד הוא מקומי במקטע סדרת Z/סדרת Z נוכחית). פעולה זו תגדיר את מספר התמונות שנרכשו במחסנית.
- הגדר את כוח הלייזר כדי להגדיל באופן אקספוננציאלי כמו המיקרוסקופ נע עמוק יותר דרך הערימה על ידי לחיצה על התיבה פיצוי לייזר / PMT ובחירה יחסית (מעבר צבע מעריכי).
- תן שם לקובץ, בחר תיקיה לשמירתו ולחץ על התחל Z-סידרה.
- לאחר הרכישה, פתח את סדרת Z בתוכנת עיבוד ההדמיה.
- למזג את שני הערוצים כתמונות צבעוניות ולסרוק דרך הערימה מחפש pericytes וכלי דם של עניין על ידי לחיצה בתיבה תמונה | | צבע ערוצים מפוצלים; | תמונה | צבע מזג ערוצים.
- בחר אזורי עניין (ROIs) המכילים פריציטים ושומרים את המיצ'ים כדי לסייע באיתור נקודות אלה שוב בהפעלות הדמיה עתידיות.
- סדרת T-סדרת סידן הדמיה סרט רכישה (זמן)
- באמצעות מחסנית העומק וההעלות על ההבשלה מלמעלה כהפניה, הזז את מטרת המיקרוסקופ בציר X, Y ו- Z במהלך מצב סריקה חיה עד שיימצא ליצייט של עניין.
- כדי לאסוף סרט של אירועי סידן pericyte, להגדיל את קצב פריימים הרכישה (>10 פריימים לשנייה) על ידי מעבר למקטע רזולוציית תמונה, ולחיצה על התיבה 128x128.
- הגדר את משך ההדמיה ל- 60 שניות על-ידי לחיצה על התיבה T-series והזנת השעה בתיבה משך זמן.
- לצד התיבה שמור נתיב, לחץ על הלחצן עם שלוש נקודות כדי לעדכן את נתיב השמירה בשם קובץ ייחודי.
- שנה את גודל התצוגה האופטית של כלי השיט כדי להסביר את הרזולוציה הנמוכה יותר ולקבל תצוגה קרובה יותר של ה- pericyte על-ידי התאמת הערך במקטע זום אופטי [mag].
- השג את סדרת T על-ידי לחיצה על התחל סדרת T.
- מדידות המודינמיקה עם קימאוגרפיות (סריקות קו)
- התמקד בכלי העניין ברזולוציה של 512 x 512פיקסלים במצב סריקה חיה.
- כדי למדוד את קוטר כלי הדם ואת מהירות תאי הדם האדומים, לחץ על סריקת הקו כדי להתחיל סריקה חד ממדית עם המיקרוסקופ.
- הגדר את משך הסריקה (30-60 שניות) באלפיות שניה.
- צייר קו שחוצה את כלי העניין וזז במקביל לאורך כלי השיט. זה ייצור קימוגרף של קוטר הכלי בצד שמאל ופסים של תאי הדם האדומים הנעים דרך כלי הדם מימין.
הערה: ניתן למדוד כלי דם מרובים באותו קו כל עוד הם באותו מישור הדמיה. - תן שם לקובץ ולחץ על סריקות התחלה כדי להשיג את הנתונים.
4. ניתוח תמונה
- ניתוח סרט סידן.
הערה: פרוטוקול זה מתאר את השלבים לבאי-התיוו הסתעפות ספקטרלית (איור 2) ושתי שיטות שונות לניתוח אירועי סידן ריסייט ensheathing באמצעות ידני, ביד שנבחרו על ביצוע חיים (איור 3) ובחירה אוטומטית המבוססת על בדיקות הרה"ג (ROI) ומבוססת פעילות (איור 4)16,17. על מנת לזהות ולסווג את פסגות האות עם עקבות הסידן המנורמלים מכל החזר על ROI, הנתונים הם ארוכי טווח ומסוננים על ידי פסים המסייעים להחליק את הנתונים להערכות משרעת ורוחב וגם לזהות פסגות של צורות שונות: פסגות בודדות, רב פסגות ומישורים (איור 3B). ניתן למטב את הפרמטרים לניתוח זה כדי לזהות סוגים שונים של אותות סלולריים דינמיים. השלבים הבאים ידרשו שימוש בתוכנת עיבוד תמונה ותוכנת תכנות עם חבילות עיבוד תמונה המכילות קודים שונים לניתוח סרטי סידן כאמור. נא עיין בטבלת החומרים לקבלת רשימה מלאה של תוכניות וחבילות המשמשות בפרוטוקול זה. ניתן לייבא נתוני הדמיה מסוגים שונים של מיקרוסקופים כאשר חבילות אלה שומרות על המטה-נתונים מהתמונות.
הערה: שלבים 4.1.1-4.1.7 מתארים כיצד לבחור ROIs ביד בתוכנת עיבוד תמונה לשימוש הבא בשיטת ניתוח הסידן הידנית (שלב 4.1.16)- טען את סדרת T הדמיית סידן בתוכנת עיבוד התמונה, על-ידי גרירת הקובץ .xml אל סרגל כלי התוכנה. לחץ על התיבה אישור.
- קח את הממוצע של הערימה (הממוצע של הערימה מסומן כ "הקרנת Z" על ידי תוכנת עיבוד התמונה). ניתן לעשות זאת על ידי לחיצה על תמונה | ערימות | הקרנת Z בסרגל הכלים.
- הפוך תמונה צבעונית משני הערוצים כמו בשלב 3.3.9.
- פתח את חלון מנהל ההפרשה על-ידי לחיצה בתיבה נתח | כלים | מנהל ההבצה, או פשוט לחיצה על האות "T" במקלדת.
- בחר את הכלי מצולע על ידי לחיצה על צורת המצולע בסרגל התוכנה לעיבוד תמונה וחלוקה לרמות של מבני pericyte ensheathing גלויים, כגון סומה ותהליכים.
- לחץ על לחצן הוסף הממוקם בחלון מנהל ROI כדי להוסיף ROIs נבחרים במנהל ההון עלה על ההון.
- תן לכל אזור עניין שם ייחודי על-ידי לחיצה על לחצן שנה שם ושמור אותם כתיקיית zip שניתן לטעון מאוחר יותר בתוכנת התכנות על-ידי לחיצה על עוד>> | שמור.
הערה: שלבים 4.1.8-4.1.14 מתארים כיצד לייבא את סדרת הסידן T לפלטפורמת התכנות וכיצד לבטל את הפלואורופורים השונים שזוהו על ידי המיקרוסקופ PMTs לערוצים שונים(איור 2). - פתח את תוכנת התכנות וודא שהתיקיות עבור חבילות עיבוד התמונה נמצאות בנתיב (ראה טבלת חומרים).
- יבא את סדרת הסידן T לתוך תוכנת התכנות על-ידי קריאה לפונקציה BioFormats בחלון הפקודה של פלטפורמת התכנות, אשר פותח באופן אוטומטי את חלון בחירת הקבצים.
- הגדר את מה שנמצא בכל ערוץ על-ידי הזנת המספר הרצוי. בדוגמה זו, ערוץ 1 עונה=6 (cellular_signal), ערוץ 2 עונה=1 (blood_plasma).
- התווה את הנתונים כסרט בתוך תוכנת התכנות כדי להקל על תצוגה חזותית על-ידי קריאה לפונקציה של העלילה.
- להסרת פלואורסצנטיות ירוקה מפלואורסצין-דקסטרן שמדמם דרך לתוך ערוץ RCaMP האדום, בטל את הערוצים בחבילת עיבוד התמונה על ידי קריאה לפונקציה unmix_chs בחלון הפקודה של פלטפורמת התכנות.
- בחר אזור המכיל פלואורסצנטיות רק מפלואורופור זה בערוץ 1, כגון RCaMP במקרה זה.
- בחר אזור המכיל רק פלואורסצנטיות מפלואורופור 2, כגון פלואורסצ'ין בפלסמת הדם בדוגמה זו.
- בחר אזור רקע שאין בו פלואורסצנטיות מאף אחד מהפלואורופור. פעולה זו יוצרת מטריצת תרומה ספקטרלית המוחלת על כל פיקסל בכל ערוץ. זה משפר באופן משמעותי את לוקליזציה של אות RCaMP אשר ישפר את הזיהוי של אירועי סידן במבנים אלה.
הערה: כפי שהוזכר לעיל, ישנן דרכים מרובות שבהן ניתן לנתח את נתוני הדמיית הסידן בתוך חבילות עיבוד התמונה. שלבים 4.1.16-4.1.23 מתארים את השיטה לניתוח אירועי סידן ריסייט ensheathing באמצעות ROIs ידני שנבחר ביד. - הפעל את ניתוח האיתות התאי על סרט הסידן הלא מעורב על-ידי קריאה לפונקציה CellScan בחלון הפקודה של פלטפורמת התכנות.
- הקוד ישאל "באיזה שיטת זיהוי ROI ברצונך להשתמש?". הקלד את המספר 2 כדי לטעון את ה- ROIs שנבחרו בעבודת יד לפלטפורמת התכנות.
- טען את אזורי העניין מתיקיית ה- zip שנבחרו מתוך הפריטיטים ביד קודם לכן (שלב 4.1.6).
- הקוד ישאל "מהו גורם קנה המידה?". קבע את גורם קנה המידה עבור ה- ROIs שנבחרו ידנית ביחס לסדרת התמונות המנותחת והקלד את מספר קנה המידה. בדוגמה זו, גורם קנה המידה הוא 1 מכיוון שאין צורך לשנות את גודל ה- ROIs מכיוון שהם נבחרו בתמונות עם 128x128 פיקסלים, רזולוציה זהה לזו של סרט הסידן המקורי.
- צור התוויות של כל ROI ושל עקבות הסידן המנורמלות בצבעים שונים (איור 3A) על-ידי קריאה לפונקציות התהליך והתוויה בחלון הפקודה.
- אם הקוד אינו מזהה את רוב אירועי הסידן במעקבים הבודדים, שנה את הפרמטרים המובנים בתוך תיבת מיטוב התצורה על-ידי קריאה לפונקציה opt_config והתאמת הערכים, כגון הקטנת הסף לנתונים המסוננים שעברו לטווח קצר לפי שלושה מסטיית התקן של התקופה הבסיסית, שהיא 30 המסגרות הראשונות של סדרת T.
- בחר בלחצן תהליך בתיבה מיטוב כדי להחיל את הפרמטרים החדשים.
הערה: כדי לזהות ולסווג את האותות, עקבות הסידן המנורמלים עוברים מזמן ועוברים פסים מסוננים, מה שעוזר להחליק את הנתונים להערכות משרעת ורוחב, אך גם כדי לקבוע אם אותות הם פסגות בודדות, רב פסגות או מישורים (איור 3B). - פלט הנתונים כקובץ .csv המכיל מידע מרחבי אודות אזורי העניין והפסגות שזוהו על-ידי קריאה לפונקציה output_data בחלון הפקודה. תן לקובץ שם ייחודי לניתוח נוסף בתוכנית סטטיסטיקה.
הערה: שלבים 4.1.24-4.1.31 מתארים את השיטה לניתוח אירועי סידן ריסייט ensheathing באמצעות ניתוח של ROIs מבוססי פעילות. - חזור על שלבים 4.1.8.8.4.1.16 כדי לייבא את סרט הסידן, לבטל את ערוצים ולקרוא לפונקציה CellScan בפלטפורמת התכנות.
- הקוד ישאל "באיזה שיטת זיהוי ROI ברצונך להשתמש?". הקלד את המספר 6 כדי לבחור את האזור האוטומטי של זיהוי עניין בהתבסס על הפעילות והשינוי בפלואורסצנטיות ב- 3 ממדים (x, y וזמן; "אלגוריתם FLIKA 3D").
- התווה את התוצאות המעובדות כדי להציג את אזורי העניין המזוהים כצבעים שונים על-ידי קריאה לפונקציות התהליך וההתוויה בחלון הפקודה. כל עלות על-חלל נבדלת בזמן ובמרחב ומיוצגת כמסכה מכוסה-על(איור 4).
- אם האלגוריתם אינו מזהה ROIs הנראים בבירור בעין, שנה את הפרמטרים המובנים בתוך תיבת המיטוב על-ידי קריאה לפונקציה opt_config והתאמת הערכים, כגון הגדלת המסנן הגאוסאי המחליק את הנתונים בזמן (ב- 2 s) והקטנת הסף למציאת ROIs לפי 3 מסטיית התקן של הבסיס.
- בחר בלחצן התהליך בתיבת המיטוב כדי להחיל את הפרמטרים החדשים. עם תהליך האופטימיזציה יש לזהות יותר ROIs (איור 4B).
- התווה את ההמחשה כסרט כדי לזהות בבירור את אזורי הפעילות (המתוארים בצבעי הקשת) על-ידי שינוי מצב תיבת ברירת המחדל לסרט בתוך חלון המיטוב לפריטים חזותיים נוספים.
- פלט הנתונים כקובץ csv על-ידי קריאה לפונקציה output_data בחלון הפקודה. ניתן לנתח קובץ זה עוד יותר בתוכנית סטטיסטיקה.
הערה: ניתן להתאים את פרמטרי הניתוח כך שיתאימו לכל סוג של אות תאי דינמי (סידן, יחסי FRET וכו '). כל השלבים לעיל יכולים להיות אוטומטיים עם קוד תכנות פשוט על מנת לאצ'רב לעבד סרטי סידן רבים עם אותן הגדרות.
- ניתוח זרימת הדם של סריקת קו.
- יבא את קובץ הנתונים של סריקת הקו kymograph שנרכש בסעיף 3.5 לתוכנת התכנות.
- הקוד ישאל "מה מוצג בערוץ 1 ו-2?". הגדר את מה שיש בכל ערוץ כאשר תתבקש. בדוגמה זו, ערוץ 1 ריק (סוג 0) ו- ערוץ 2 blood_plasma (סוג 1).
- הפעל את פונקציית ניתוח הקוטר בסריקת הקו על-ידי קריאה לפונקציה LineScanDiam, הפותחת תיבה לבחירת האזור המתאים לקוטר בקימוגרף (איור 5B, משמאל).
- צייר קופסה מחוץ לגבולות הפלואורסצנטיות של הקימולוגרפיה המתאימה לקוטר כלי השיט.
- עבד מחלקת נתונים זו על-ידי קריאה לפונקציה של התהליך כדי למדוד את הרוחב המלא בחצי מקסימה עבור קוטר כלי השיט וליצור חלקה (איור 5C) עם פונקציית התוויית התוויה.
- פלט הנתונים כקובץ csv על-ידי קריאה לפונקציה output_data בחלון הפקודה. ניתן לנתח קובץ זה עוד יותר בתוכנית סטטיסטיקה.
- הפעל את ניתוח המרת הראדון המהיר על-ידי קריאה לפונקציה LineScanVel, הפותחת תיבה לבחירת האזור המתאים למהירות RBC בקימוגרף (איור 5B, מימין).
- צייר קופסה בתוך הגבול של פלואורסצנטיות קימאוגרפית המתאימה למהירות כלי השיט.
- עבד מחלקת נתונים זו על-ידי קריאה לתפקוד התהליך על מנת לחשב את המהירות, השטף והצפיפות הליניארית של תאי דם אדומים מזווית הפסים בפלואורסצנטיות. צור עלילה (איור 5D) עם פונקציית העלילה.
- פלט הנתונים כקובץ csv על-ידי קריאה לפונקציה output_data בחלון הפקודה. ניתן לנתח קובץ זה עוד יותר בתוכנית סטטיסטיקה.
הערה: לקימאוגרפים חייבת להיות פלואורסצנטיות ברורה עם קצוות מוגדרים היטב בין החללים השחורים כדי שניתוח הקוטר והמהירות יהיה מדויק(איור 5A, B). חשוב מאוד לצייר את הקווים האורתוגונליים והמקבילים בצורה מדויקת, אחרת ניתוח אמין של הקימאוגרפים לא יתאפשר. בדומה לניתוח סידן עם אלגוריתמי עיבוד התמונה, ניתן אופטימיזציה של הפרמטרים לחישובי קוטר ומהירות.
תוצאות
לפלואורסצין-דקסטרן יש ספקטרום פליטה רחב שיכול לדמם דרך הערוץ האדום, מה שמשפיע על זיהוי RCaMP בפריקיטים מתנפחים(איור 2A). ביטול ספקטרלי לאחר רכישת נתונים בתוכנה מפחית את הדימום פלואורסצ'ין דרך (איור 2B, נמוך יותר), שיפור זיהוי אותות סידן בשלבי ניתוח הבאים.
ניתוח סידן עם אלגוריתמי עיבוד התמונה המשמשים בפרוטוקול זה מאפשר מספר גישות שונות לזיהוי ROIs ותנודות סידן תאיות (כלומר, אותות סידן). בחירת מבנים תאיים ביד מאפשרת זיהוי של תנודות סידן באזורים אלה (איור 3A), כולל סוגים שונים של פסגות אותות, כגון פסגות בודדות ורב-פסגות, לאחר שעקבות הסידן המנורמלות הן בעלות מעבר נמוך ומסונן על פסים (איור 3B). בנוסף, ROIs מזוהים על ידי קיבוץ פיקסלים פעילים יחד שבו עוצמת הפלואורסצנטיות משתנה עם הזמן באמצעות אלגוריתמים לעיבוד תמונה שפותחו על ידי Ellefsen et al. 201416 ו Barrett et al. 201817 (איור 4). ניתן להחיל זאת על כל אות סלולרי דינמי על-ידי התאמת הזמן, הסף והפרמטרים המרחביים כך שיקיף את הגודל והצורה הצפויים של האות. הפחתת הסף לזיהוי אותות מוצאת אזורים מעניינים יותר (איור 4B).
ניתן לנתח קימאוגרפיות המודינמיות בהירות וברורות כדי למדוד קוטר ומהירות RBC בכלי הדם ליד פריציטים מתנפלים(איור 5A,B). הקוטר מחושב מהרוחב המלא בחצי מהערך המרבי של הפלואורסצנטיות(איור 5C). מהירות RBC משוערת מהפסים העשויים מ- RBCs ללא תווית, כאשר הזווית היא קלט לתוך טרנספורמציה Radon כדי לחשב את המהירות, השטף (תאים / s) וצפיפות ליניארית (תאים / מ"מ; איור 5D). קימאוגרפים באיכות ירודה שבהם יש רוויית פלואורסצנטיות, יחס אות לרעש גרוע או תנועה של שדה ההדמיה(איור 6A)יוצרים חלקות לא אמינות עם נקודות שגיאה (צלבים אדומים) שבהם לא ניתן לקבוע נתונים (איור 6B, C). איכות הנתונים שנרכשו היא קריטית לתוצאה טובה ועקבות השלבים המתוארים בפרוטוקול זה מבטיחות תוצאות טובות.
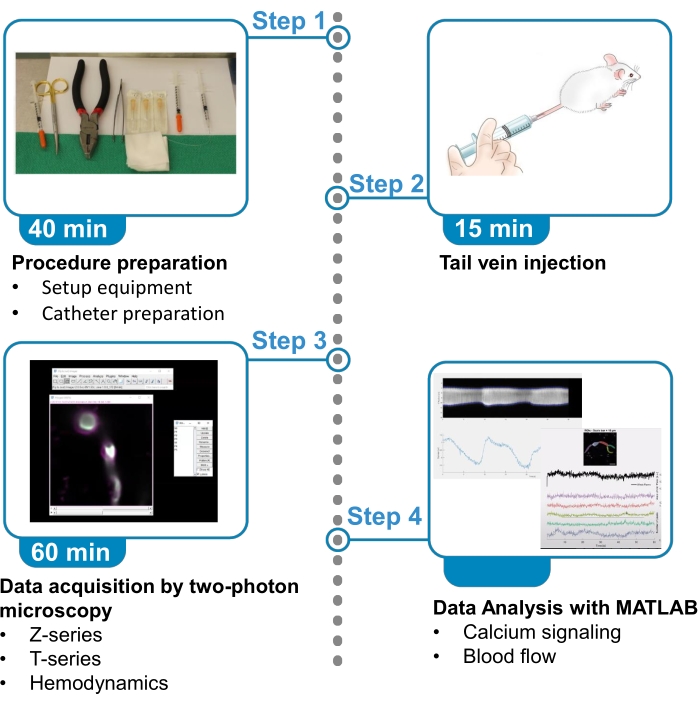
איור 1. סיכום הפרוטוקול. הפרוטוקול מציג את השלבים לרכישה וניתוח של תמונות סידן פלואורסצנטיות מפריקיטים של גישוש מוח וזרימת דם מכלי דם סמוכים בעכברים מרדים. הפרוטוקול מחולק ל-4 שלבים. 1) הכנת נוהל: הגדרת ציוד והכנת צנתר; 2) הזרקת וריד זנב; 3) רכישת נתונים על ידי מיקרוסקופיה דו פוטונית; 4) ניתוח נתונים עם אלגוריתמים לעיבוד תמונה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
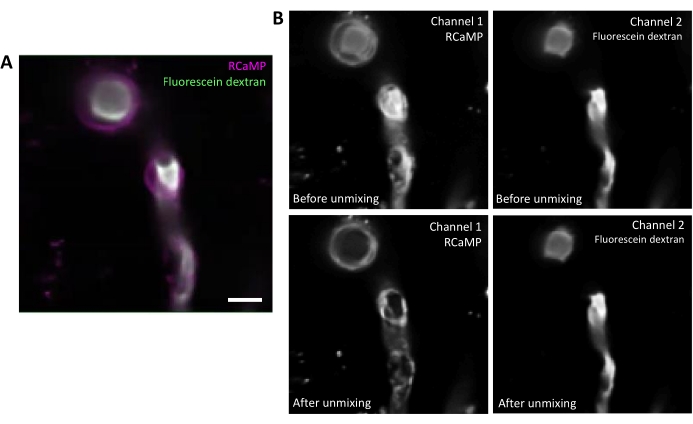
איור 2. התיר ספקטרלי של פלואורופורים. A) תמונה ממוצעת מייצגת של RCaMP ensheathing pericyte ופלואורסצין-דקסטרן שכותרתו כלי דם מרכישה מסדרת T. סרגל קנה מידה= 10 מיקרומטר.B) עליון: כאשר בוחנים ערוצים בודדים, לדמם דרך מערוץ 2 ניכר בערוץ 1 (משמאל). נמוך יותר: לאחר ביטול ספקטרלי, הדימום מצטמצם והאות מ- RCaMP בולט יותר במבנה ההפריסיט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
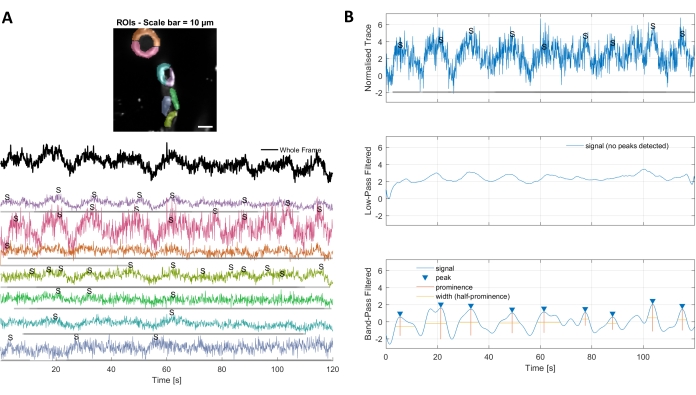
איור 3. ROIs שנבחר ביד ועקבות סידן ממוטבות. A) ניתן להשתמש באזורים בעלי עניין שנבחרו בתוכנת עיבוד התמונה המשמשת (צורות קשת בענן) כדי לזהות עקבות אותות סידן. ב) פסגות אותות מעקבים מנורמלים מזוהות על-ידי מעבר נמוך ועובר פס המסנן את הנתונים. הגדרנו את סף האות כפי 3 פעמים את סטיית התקן של התקופה הבסיסית (30 המסגרות הראשונות) וכל פסגות מעל סף זה נחשבו לאות (מעקב נמוך יותר). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
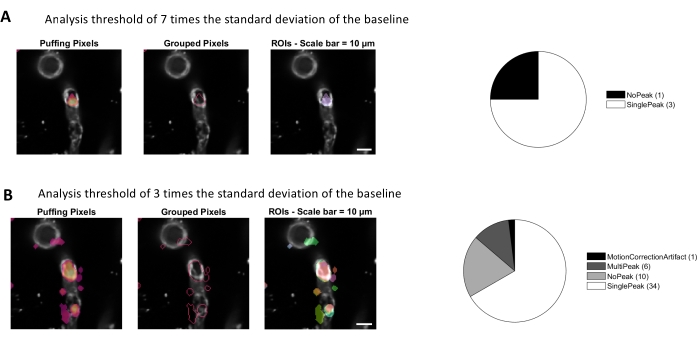
איור 4. בדיקות ROIs אוטומטיות מבוססות פעילות לניתוח סידן. אותם נתונים נותחו עם סף של פי 7 מסטיית התקן של קו הבסיס (A) ופי 3 מסטיית התקן של הבסיס (B). הקטנת הסף לזיהוי פיקסלים פעילים מוצאת שיאי ROIs (B) ואותות נוספים (תרשים עוגה) בתוך הפריטים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
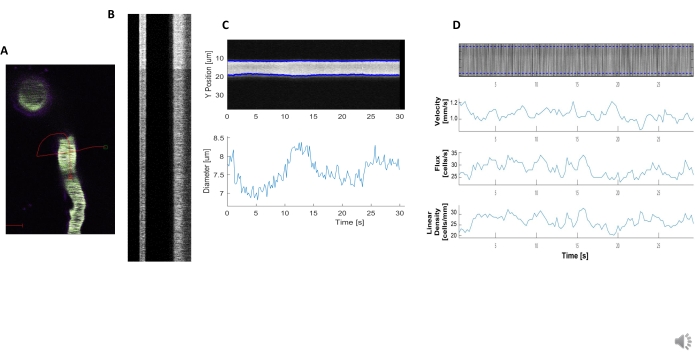
איור 5. מדידות המודינמיות של קימאוגרפיה. A) סריקת קו לדוגמה דרך כלי השיט. B) דוגמה לקימאוגרפיות מוגדרות היטב לקוטר (משמאל) ומהירות (מימין). הפסים השחורים בתוך הרצועה הימנית של פלואורסצנטיות תואמים RBCs.C) ניתוח קוטר עם תנודות vasomotion ברור. D) ניתוח מהירות עם התוויות עבור ציר Y = שטף RBC (תאים/s), צפיפות קו (תאים/מ"מ), מהירות (mm/s) וזווית פסים (מעלה), יחס אות לרעש (יחידות שרירותיות, a.u.), ציר X = זמן (שניות). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
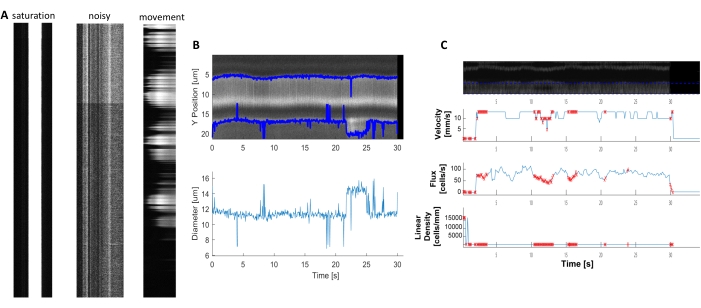
איור 6. ייצוג של מדידות המונמיות באיכות ירודה. A) דוגמאות לקימאוגרפיות באיכות ירודה עם רוויית פלואורסצנטיות, יחס אות לרעש גרוע או תנועה של שדה ההדמיה במהלך הרכישה. B ו- C) התוויות דומות לאיור 7 של נתוני קוטר ומהירות בעלי נקודות שגיאה (נקודות אדומות) בגלל האיכות הירודה של הקימאוגרפיות. (תמונה E, ציר Y= קוטר (מיקרומטר), ציר X =זמן (שני); תמונה F, ציר Y = שטף RBC (תאים/s), צפיפות קו (תאים/מ"מ), מהירות (mm/s) וזווית פסים (מעלות), יחס אות לרעש (a.u.), ציר X = זמן (שני). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
השיטה הנוכחית מספקת פרטים על הזרקת וריד זנב העכבר עם קטטר, רכישת תמונה מיקרוסקופ שני פוטון עבור ערימות עומק, סרטי איתות סידן תאים, יצירת קימאוגרפים המודינמיים, וניתוח סידן והמודינמי עם אלגוריתמי עיבוד התמונה שלנו17 (איור 1). ישנם מספר יתרונות לטכניקות אלה המשפרים את תוצאת ההדמיה in vivo ומפחיתים זמן, משאבים ומתח מן החי במהלך הפגישה. ראשית, השימוש של קטטר עבור הזרקת וריד הזנב מספק שליטה רבה יותר על המחט, המזרק ואת כמות החומר מוזרק לתוך זרימת של העכבר. בנוסף, זה מונע הזרקת צבע לתוך רקמת הזנב, חיסכון ריאגנטים יקרים. שנית, אנו משתמשים בעכברים מהונדסים המבטאים חיישני סידן מקודדים גנטית ב- pericytes ensheathing ומדגימים כיצד להתאים אותם לרשת כלי הדם במוח עם ערימת z עומק, המאפשרת זיהוי תאים והעתקה בפגישות הדמיה עוקבות לטווח ארוך. זהו גורם חשוב במחקרי פירוק ומבטיח סיווג תאים תקין6,7. שלישית, אנו מספקים את הפרמטרים שלנו לאיסוף סרטי סידן ותוני סריקת קו המודינמי שהם נקודת התחלה טובה למדידת אותות סלולריים דינמיים. לבסוף, אנו מציגים את אלגוריתמי עיבוד התמונה שלנו17, ארגז כלים מקיף לעיבוד תמונה המכיל גישות מרובות לעיבוד קדם תמונה (כגון ביטול ספקטרלי), ניתוח תמונת סידן וניתוח המודינמי (קוטר, מהירות וכו '). אלגוריתמים אלה יכולים ליצור התוויות להדמיה מהירה וקלה של הנתונים, תוך מזעור רמת המומחיות הנדרשת לניתוח תוצאות. יתר על כן, זה יכול להיות אוטומטי עם כמה שורות של קוד כדי לאצווה במהירות לעבד ערכות נתונים מרובות עם אותם פרמטרים. זה יכול לשפר את הדמיית הנתונים ואת ההשקעה בזמן של החוקר.
המפתח לאיסוף נתוני הדמיית סידן טובים הוא להתאים את עוצמת הלייזר ואת הגדרות PMT לרכישת אותות פלואורסצנטיות ברורה, אך גם לאסוף נתונים בקצב פריימים מספיק כדי ללכוד את כל אירוע הסידן. הנתונים בפרוטוקול זה נרכשו במהירות של 10-11 פריימים לשנייה, הלוכדת את תנודות הסידן האיטיות יותר בפריקיטים. ישנם גם מספר שלבים במהלך הניתוח שיכולים לשפר את תוצאת הניתוח. ראשית, ביטול ספקטרלי מועיל אם יש חפיפה משמעותית בין ספקטרום הפליטה של פלואורופורים(איור 2). פלואורסצ'ין-דקסטרן שימש בפרוטוקול זה מכיוון שהוא מצומד דקסטרן חסכוני וזמין מסחרית המשמש בדרך כלל למדידות המודינמיות5. ביטול ספקטרלי עוזר לנקות את הנתונים לגילוי משופר של אותות סידן, אך ניתן להשתמש גם בפלואורופורים חלופיים עם ספקטרום פליטה צר יותר. שנית, בחירת יד של מבנים תאיים כ- ROIs (איור 3) שימושית לסיווג אירועי סידן באזורים תת-תאיים שונים כגון ענפי סומה או תהליך. בחירת ROI מבוססת פעילות (איור 4)16 מספקת מידע מרחבי וטמפורלי יותר על אירועי סידן בודדים. זה יכול להיות מועיל בעת קביעת התדירות של אירועי סידן באזור נתון או הפצת אירועים לאזורים תאיים אחרים. השימוש בתוכנת תכנות לניתוח נתוני הדמיה יכול לחסוך לחוקרים שעות של זמן כאשר הנתונים מעובדים באצווה, אך נדרש השקעה ראשונית בזמן כדי להתאים את הפרמטרים לתוצאות אופטימליות. הגורמים החשובים ביותר הם הגודל הצפוי (ב- μm 2 ) של האזור הפעיל, כמו גם משך האות (יש להגדיר זמן אות מינימליוזמןאות מרבי). החוקרים חייבים לבחון תחילה כמה סרטי T-series לדוגמה כדי לקבוע בצורה הטובה ביותר אילו פרמטרים מתאימים לנתונים שלהם. לבסוף, נתונים באיכות ירודה שנרכשו במיקרוסקופ עלולים לעכב מאוד את ניתוח הסידן והמודינמיקה(איור 6). לכן, יש להקפיד כדי לייעל את הגדרות רכישת המיקרוסקופ בהתחלה. עם גורמים אלה בראש, פרוטוקול זה שניתן להתאים להדמיית סידן או ניתוח של אותות תאיים דינמיים אחרים (למשל, נתרן פלואורסצנטי, אשלגן, מטבוליט, או תנודות מתח) ברקמות או בסוגי תאים אחרים.
קיימות מספר מגבלות לפרוטוקול זה. ראשית, הנתונים נאספים תחת הרדמה, אשר משפיע על פעילות המוח ועלול להשפיע על זרימת הדם. הדמיה דומה יכולה להיעשות בעכברים ערים שאומנו לקבל קיבוע ראש לתוצאות פיזיולוגיות יותר. בנוסף, חשוב לזכור כי אנו אוספים תמונות דו ממדיות של תא תלת מימדי וכלי דם ב vivo. לכן, אנחנו יכולים ללכוד רק סיעה של אירועי הסידן בתוך תאים אלה או זרימת הדם בחלק אחד של כלי הדם בכל פעם.
מגבלה נוספת שיש לציין היא כי הדמיית סידן שני פוטון רגישה לממצאי תנועה, שבהם התנועה פנימה והחוצה של מישור המוקד יכולה לטעות בתנודות סידן. פרוטוקול זה בוצע תחת הרדמה, אשר מגביל את התנועה של החיה; עם זאת, ממצאי תנועה יכולים להיות הציגו על ידי קצב הנשימה של העכבר, קצב הלב, נפיחות רקמות אפשרית, ובמקרה של pericytes ensheathing, התכווצות כלי דם או vasomotion 4,6,18,19. חפצי תנועה יכולים להיות מקלים על ידי מספר אסטרטגיות. חבילות עיבוד התמונה המשמשות בפרוטוקול זה כוללות שלב אופציונלי לתיקון תנועה, המשתמש במנוע פיתול דו-ממדי כדי ליישר את התמונות בתוך סדרת T בהתבסס על כלי ההשנה הנראה לעין13,17. מסגרות עם שינויים משמעותיים במישור המוקד מזוהות על ידי אלגוריתם זה וניתן לא לכלול אותם בניתוח. בנוסף, ניתן להשתמש באסטרטגיות סטטיסטיות בתוך חבילות עיבוד ההדמיה, כגון ציון Z בעת יצירת עקבות פלואורסצנטיות כדי לנרמל את התנועה המושרה תנודות סידן20. הגישה החזקה ביותר להסביר ממצאי תנועה בהדמיה של שני פוטונים היא לשלב ביטוי של שני אינדיקטורים פלואורסצנטיים באותו תא, כגון מחוון סידן (למשל, GCaMP) וכתב פלואורסצנטי (למשל, mCherry) שאינו תלוי בסידן. לאחר מכן ניתן לייחס תנודות בכתב הפלואורסצנטי לתנועה והם מופחתים מאות מחוון הסידן כדי לנרמל חפצי תנועה.
מטרת פרוטוקול זה היא לספק הבנה ברורה כיצד לאסוף נתוני הדמיית סידן וזרימת דם אופטימליים ב- vivo ולהציג שיטות וכלי ניתוח חדשים שהחוקרים יכולים ליישם על מנת לשפר את תוצאותיהם. טכניקות אלה ניתן ליישם כדי לחקור את התפקיד של אוכלוסיות pericytes שונים בשליטה על זרימת הדם או במצבי מחלות מוח שונים. פרמטרי הדמיה אלה יכולים לשמש גם לחקר סידן וזרימת דם בסוגי תאים אחרים ובמערכות איברים ועקרונות דומים חלים על טכניקות הדמיה דינמיות אחרות המאפשרות חיישנים אחרים המקודדים גנטית, מעבר לסידן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ג'יי מזא נתמך על ידי מלגות מ-Mitacs ומחקר מניטובה. מימון עבודה זו ניתן על ידי המכונים הקנדיים לחקר הבריאות, מחקר מניטובה, קרן השירות הרפואי מניטובה, מימון סטארט-אפים מאוניברסיטת מניטובה ומוח קנדה באמצעות הקרן לחקר המוח בקנדה, בתמיכתם הכספית של Health Canada וקרן עזריאלי. הדעות המובעות כאן אינן מייצגות בהכרח את עמדותיהם של שר הבריאות או ממשלת קנדה.
Materials
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
References
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -. A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -. F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a., et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402 (2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory Available from: https://www.jax.org/strain/028345 (2021)
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680 (2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297 (2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved