Method Article
Imagem pericínica cerebral de cálcio e hemodinâmica em camundongos transgênicos em Vivo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo apresenta etapas para adquirir e analisar imagens fluorescentes de cálcio de pericytes e dados de fluxo sanguíneo de vasos sanguíneos próximos em camundongos anestesiados. Essas técnicas são úteis para estudos de fisiologia celular mural e podem ser adaptadas para investigar transitórios de cálcio em qualquer tipo de célula.
Resumo
Os recentes avanços na biologia proteica e na genética dos camundongos tornaram possível medir flutuações intracelulares de cálcio das células cerebrais in vivo e correlacionar isso com a hemodinâmica local. Este protocolo utiliza camundongos transgênicos que foram preparados com uma janela craniana crônica e expressam o indicador de cálcio geneticamente codificado, RCaMP1.07, sob o promotor de actina muscular α-suave para rotular especificamente células mural, como células musculares lisas vasculares e pericítos ensheathing. São delineadas etapas sobre como preparar um cateter de veia da cauda para injeção intravenosa de corantes fluorescentes para rastrear o fluxo sanguíneo, bem como como medir o cálcio pericítil cerebral e hemodinâmica do vaso sanguíneo local (diâmetro, velocidade de glóbulos vermelhos, etc.) por duas microscopia de fótons in vivo através da janela craniana em camundongos anesthetizados cetamina/xilazina. Finalmente, são fornecidos detalhes para a análise de flutuações de cálcio e filmes de fluxo sanguíneo através dos algoritmos de processamento de imagem desenvolvidos por Barrett et al. 2018, com ênfase em como esses processos podem ser adaptados a outros dados de imagem celular.
Introdução
A vasculatura do sistema nervoso central consiste em arterioles penetrantes, capilares e venules ascendentes. Dentro dessa rede, células mural como células musculares lisas vasculares encase arterioles e pericítos estendem processos celulares ao longo dos primeiros ramos arteriolos e capilares1. Os pericítos parecem ter vários papéis dentro do cérebro, incluindo a manutenção da barreira hemencefálica1,2, migração e motilidade3, propriedades potenciais de células-tronco, e a regulação do fluxo sanguíneo cerebral4,5,6. Muitos dos papéis funcionais dos pericítos têm sido ligados a flutuações no cálcio intracelular que podem regular a dilatação ou contração dessas células4,5,6.
Vários estudos recentes estabeleceram critérios para identificar diferentes tipos de pericítos cerebrais7,8. As células mural dentro dos primeiros 4 ramos de arterioles penetrantes são pericílitos envolventes com base em sua expressão da proteína contratil α-suave actina muscular (αSMA) e sua somata saliente e ovoid com processos que envolvem vasos7,8,9. Para visualizar flutuações de cálcio em pericytes ensheathing, este protocolo utiliza uma nova linha de mouse transgênico, Acta2-RCaMP1.07, também conhecida como Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J10. Estes camundongos expressam o indicador de cálcio geneticamente codificado vermelho, RCaMP1.07, em células expressas αSMA (células musculares lisas vasculares e pericítos ensheathing). Colônias de reprodução são mantidas cruzando animais não-carga com hemizygotes. RCaMP1.07 é uma proteína fluorescente vermelha com domínio de ligação de calmodulina, que aumenta a fluorescência ao se ligar ao cálcio intracelular10,11. Este protocolo descreve os passos para a imagem combinada de cálcio de pericítes e medidas de fluxo sanguíneo por duas microscopia de fótons, incluindo procedimentos para injeção de veias traseiras de corantes fluorescentes, aquisição de imagens de microscópio em camundongos anestesiados e análise de dados com plataformas de programação(Figura 1). Essas técnicas são úteis para abordar questões sobre fisiologia celular mural, mas podem ser adaptadas para estudar transitórios de cálcio em qualquer tipo de célula no cérebro ou em outro sistema de órgãos.
Uma fêmea de 10 meses de idade Acta2-RCaMP1.07 foi usada para o experimento apresentado neste artigo. O camundongo foi submetido a cirurgia para janela craniana crônica e pós-implantação da cabeça dois meses antes. Os detalhes do protocolo cirúrgico são discutidos em estudos anteriores12,13 e procedimentos semelhantes foram realizados em outros protocolos publicados anteriormente14,15. A vasculatura é rotulada com fluoresceína-Dextran verde (70.000 MW, solução aniônica, 2,5% w/v) injetada por via intravenosa. Este corante é econômico e prontamente disponível a partir de fontes comerciais, mas tem um espectro de emissões mais amplo que pode se sobrepor à emissão de RCaMP e sangrar durante a aquisição de imagens de microscópio. As etapas para a desmragem espectral estão descritas na Seção 4 abaixo para contornar isso, mas outros corantes verdes com espectros de emissão mais estreitos, como os baseados no EGFP, também podem ser usados.
Protocolo
Todos os procedimentos envolvendo animais experimentais descritos abaixo foram aprovados pelo Comitê de Cuidados com Animais da Universidade de Manitoba, que é regido pelo Conselho Canadense de Cuidados com Animais.
1. Configuração e preparação do procedimento
NOTA: Os seguintes itens são necessários para uma injeção de cateter de veias da cauda: seringas de insulina, um pedaço de tubos PE10 de 15 cm, agulhas de 30 G, gaze, soro fisiológico, fórceps, corante de fluoresceína verde, alicate e tesoura. Além disso, tenha uma agulha pronta com anestesia de cetamina/xilazina que será injetada antes da sessão de imagem.
CRÍTICA: Todos os materiais e equipamentos das etapas 1 e 2 devem ser esterilizados antes do uso por autoclaving ou lavagem com 70% de etanol. Se o alicate não puder ser esterilizado adequadamente, recomenda-se o uso de um par de grandes porta-agulhas. O conjunto do cateter deve ser feito com alicate e fórceps para evitar perfurações acidentais de agulhas.
- Corte aproximadamente 15-20 cm de tubos de polietileno, PE10 (I.D. 28 mm; O.D. 61 mm).
- Encha uma seringa de insulina de 27 G com salina de 0,9% e amarre a agulha da seringa na ponta do tubo de polietileno. Empurre soro fisiológico através do tubo, certificando-se de que não há vazamentos.
- Usando alicates, dobre uma agulha de 30 G (0,3 mm x 25 mm) para frente e para trás até que se rompa do cubo. A agulha deve estar limpa sem curvas.
- Segurando a agulha com fórceps, insira cuidadosamente a agulha na extremidade da tubulação PE10 que está presa à seringa salina cheia e remova bolhas de ar. Este é o cateter para injeção.
- Filtrar 30 μL de 2,5% (w/v) fluoresceína dextran através de um filtro de 13-25 μm antes da injeção.
- Encha outra seringa de insulina com a alíquota de 30 μL de dextran e certifique-se de que não há bolhas na seringa cheia.
2. Injeção de veia de cauda
- Anestesiar o camundongo com isoflurane (4% de indução, 1,5% de manutenção) ou cetamina/xilazina (60 mg/kg; 10 mg/kg; i.p.) e aplicar gel lubrificante ocular. A cetamina/xilazina é recomendada para medidas mais estáveis de fluxo sanguíneo durante a imagem e a dose pode ser aumentada para 90 mg/kg; 10 mg/kg de cetamina/xilazina para sessões de imagem mais longas.
- Quando o rato estiver no plano cirúrgico da anestesia, coloque uma luva cheia de água morna na cauda para dilatar a veia lateral.
- Retire a luva depois dos 30 e limpe a cauda com etanol.
- Coloque a cauda entre o polegar e o dedo médio. Forneça pressão com o dedo indicador na cauda para dilatar a veia. Com a outra mão, pegue a agulha do cateter com fórceps orientando a moldura para cima em direção ao teto.
- Depois de limpar a cauda com 70% de etanol, insira a agulha na veia em um ângulo de 0° e injete suavemente soro fisiológico através do cateter para garantir que a agulha seja colocada corretamente.
NOTA: Se não houver resistência no êmbolo e nenhum inchaço da cauda, então a agulha está na veia. Se houver resistência ou inchaço significativos, a agulha deve ser removida. As etapas 2.2-2.5 podem ser repetidas até 3 vezes em cada lado da cauda, substituindo a agulha 30G no final do cateter a cada segundo ensaio até que a colocação esteja correta. - Uma vez que a agulha esteja na veia, troque a seringa salina no final do cateter com a seringa contendo fluoresceína dextran (Passo 1.6). Injete lentamente o dextran na tubulação do cateter, garantindo que não entrem bolhas no tubo. Se uma bolha de ar for aparente, corte a tubulação contendo a bolha para removê-la e recoloque a seringa.
- Quando todo o dextran (30 μL aliquot) tiver sido injetado, remova a seringa e substitua-a pela seringa salina. Injete o dextran restante da tubulação no mouse até que nenhum corante seja deixado no tubo.
- Retire a agulha da cauda e forneça pressão com gaze por 10-30 s até que o sangramento pare.
CRÍTICA: Se após 6 tentativas a injeção da veia da cauda não for bem sucedida, o animal deve ser imageado em outra sessão. Além disso, o volume total (soro fisiológico e dextran) injetado no mouse não deve exceder 100 μL.
3. Microscopia de dois fótons
- Focando na janela craniana
NOTA: Use a anestesia cetamina/xilazina durante a aquisição de dados porque tem menos efeitos vasculares (vasodilatação) do que a isoflurane. Se usar isoflurane nas etapas acima, injete o mouse com cetamina/xilazina i.p. (dose recomendada descrita acima) antes da imagem.- Fixar o mouse com um parafuso através de seu poste de cabeça para uma plataforma com uma almofada de aquecimento sob o microscópio.
- Aplique lubrificante ocular nos olhos do mouse.
- Limpe a janela craniana com aplicadores dentários úmidos. Certifique-se de que não há partículas que possam interferir no processo de imagem.
- Aplique gel de ultrassom na janela.
- Concentre-se através do objetivo do microscópio de dois fótons até que os vasos sanguíneos pial possam ser vistos sob a janela.
- Verifique a respiração do mouse e certifique-se de que a almofada de aquecimento está fornecendo suporte de temperatura suficiente.
- Aquisição de imagens
NOTA: O microscópio de dois fótons usado neste experimento tem um laser ti-safira tunable para excitação de fluorescência com uma célula Pockel que controla a quantidade de laser que atinge a amostra. A luz emitida é dividida por um dicrómico de passagem longa de 565 para dois tubos fotomultiplier GaAsP (PMTs) com filtro de passagem de banda 595/50 (vermelho) e filtro de passagem de banda 525/70 (verde) para detecção.
Os procedimentos descritos nas Etapas 3.2 a 3.4 são realizados utilizando-se software específico do microscópio de dois fótons deste protocolo (ver Tabela de Materiais). Essas etapas podem ser adaptadas para outros softwares e equipamentos de microscópio.- Com as luzes da sala apagadas, defina o comprimento de onda desejado no software de microscópio para 990 nm para excitar tanto rcamp quanto fluorescein-dextran clicando na caixa laser 2-P.
- Defina a potência do laser clicando na seção Caixa de Energia/Ganho /Lasers e ajustando a tensão celular Pockels 1 a 30% ou um valor de 300 em uma escala de 1000. A potência laser que atinge a amostra nesta configuração foi previamente determinada como sendo ~30 mW.
- Defina a sensibilidade do detector PMT clicando na seção Caixa de Energia/Ganho/ PMTs e ajustando o valor para 700-800.
NOTA: Esses valores podem ser ajustados em relação à intensidade da amostra fluorescente e devem ser ajustados a zero antes de acender as luzes da sala. - Vá para a seção Resolução de Imagens e clique na resolução 512 x 512 para um tamanho de imagem maior.
- Clique em Laser 2-P/Abra para abrir o obturador laser 2 P.
- Vá para a Seção de Digitalização e clique no botão Digitalizar ao vivo.
NOTA: Pode-se ver a varredura ao vivo com esses parâmetros e maior resolução, células mural positivas RCaMP e o plasma de sangue fluorescentemente rotulado. Se o sinal estiver fraco, o valor do pockel pode ser aumentado até que a imagem esteja clara.
CRÍTICA: Nas camadas superficiais do tecido, a potência do laser não deve exceder 50 mW, o que equivale a cerca de 600 nas configurações das células Pockels neste exemplo.
- Adquirindo uma pilha de profundidade das células mural e da rede vascular
NOTA: Recomenda-se a aquisição de uma pilha de profundidade para localizar adequadamente os pericítos na rede vascular. Pericytes ensheathing estão localizados no primeiro ao quarto ramos da arteriola penetrante7,8,9. O software de microscópio utilizado neste protocolo refere-se a pilhas de profundidade como "série Z".- Movendo o objetivo do microscópio no plano X, Y e Z, localize uma grande artéria na superfície do cérebro com base na rotulagem de célula muscular lisa de RCaMP.
- Clique na caixa série Z.
- Concentre-se na parte superior do tecido perto dos vasos de pial, defina isso como o ponto zero e o topo da pilha da série Z clicando na seção atual da série Z/ Posição inicial [μm]. Clique na caixa com quatro listras pretas e uma listra vermelha na parte superior.
- Concentre-se no tecido até a profundidade desejada e ajuste-o como a parte inferior da pilha clicando na seção atual da série Z/Stop [μm]. Clique na caixa com quatro listras pretas e uma listra vermelha na parte inferior.
- Defina a espessura de cada plano de imagem (tamanho da etapa) para 1-2 μm digitando o valor desejado na caixa abaixo do botão "Step Size" (o botãoStep Size é localizado na seção série Z/Série Z atual). Isso definirá o número de imagens que são adquiridas na pilha.
- Defina a potência do laser para aumentar exponencialmente à medida que o microscópio se move mais fundo através da pilha clicando na caixa de compensação laser/PMT e selecionando Relativo (Gradiente Exponencial).
- Nomeie o arquivo, escolha uma pasta para salvá-loe clique em Iniciar série Z .
- Após a aquisição, abra a série Z no software de processamento de imagens.
- Mescle os dois canais como imagens coloridas e escaneie através da pilha procurando pericítes e vasos sanguíneos de interesse clicando na caixa Imagem | | de cor Canais Divididos; | de imagem | de cor Canais de mesclagem.
- Selecione Regiões de interesse (ROIs) que contenham pericítos e salve as posições para ajudar a localizar essas manchas novamente em sessões futuras de imagem.
- Aquisição de filme de imagem de cálcio da série T (tempo)
- Usando a pilha de profundidade e ROIs de cima como referência, mova o objetivo do microscópio no eixo X, Y e Z durante o modo de varredura ao vivo até que um pericyte de interesse seja encontrado.
- Para coletar um filme de eventos de cálcio pericíte, aumente a taxa de quadros de aquisição (>10 quadros por segundo) indo para a seção de Resolução de Imagem e clicando na caixa 128x128.
- Defina a duração da imagem para 60 s clicando na caixa série T e digitando o tempo na caixa de duração.
- Ao lado da caixa Salvar caminho, clique no botão com três pontos para atualizar o caminho de salvar com um nome de arquivo exclusivo.
- Zoom opticamente no vaso para dar conta da resolução mais baixa e para obter uma visão mais próxima do pericyte, ajustando o valor na seção Zoom Óptico [mag].
- Adquira a série T clicando na série Start T.
- Medições de hemodinâmica com kymógrafos (varreduras de linha)
- Concentre-se na embarcação de interesse em resolução de 512 x 512pixels no modo Live Scan.
- Para medir o diâmetro do vaso sanguíneo e a velocidade dos glóbulos vermelhos, clique na Varredura de Linha para iniciar uma varredura unidimensional com o microscópio.
- Defina a duração da varredura (30-60 s) em milissegundos.
- Desenhe uma linha que bissecte o navio de interesse e se move paralelamente ao longo da nave. Isso vai gerar um kymograph do diâmetro do vaso à esquerda e listras dos glóbulos vermelhos movendo-se através do vaso à direita.
NOTA: Vários vasos sanguíneos podem ser medidos com a mesma linha, desde que estejam no mesmo plano de imagem. - Nomeie o arquivo e clique no Start Linescan(s) para adquirir os dados.
4. Análise de imagem
- Análise de filme de cálcio.
NOTA: Este protocolo descreve os passos para a desmrtura espectral (Figura 2) e dois métodos diferentes para analisar eventos de cálcio pericíte pericíte ensheathing utilizando ROIs manuais e selecionados à mão (Figura 3) e seleção automatizada e baseada em ROTE (Figura 4)16,17. A fim de detectar e classificar os picos de sinal com o traço de cálcio normalizado de cada ROI, os dados são filtrados de passe longo e passe de banda, o que ajuda a suavizar os dados para estimativas de amplitude e largura e também para identificar picos de diferentes formas: picos únicos, vários picos e platôs (Figura 3B). Os parâmetros para esta análise podem ser otimizados para detectar diferentes tipos de sinais celulares dinâmicos. As etapas abaixo exigirão o uso de software de processamento de imagens e software de programação com pacotes de processamento de imagens que contêm diferentes códigos para analisar filmes de cálcio como mencionado acima. Consulte a tabela de materiais para obter uma lista completa de programas e pacotes usados neste protocolo. Dados de imagem de diferentes tipos de microscópios podem ser importados com essas embalagens mantendo os metadados das imagens.
NOTA: As etapas 4.1.1-4.1.7 descrevem como selecionar ROIs manualmente no software de processamento de imagens para uso subsequente no método manual de análise de cálcio (Passo 4.1.16)- Carregue a série T de imagem de cálcio no software de processamento de imagens, arrastando o arquivo .xml para a barra de ferramentas de software. Clique na caixa OK.
- Pegue a média da pilha (a média da pilha é rotulada como "projeção Z" pelo software de processamento de imagem). Isso pode ser feito clicando em Imagem | Pilhas | Projeção Z na barra de ferramentas.
- Faça uma imagem colorida de ambos os canais como na etapa 3.3.9.
- Abra a janela do gerenciador de ROI clicando na caixa Analise | Ferramentas | Roi Manager, ou simplesmente pressionando a letra "T" no teclado.
- Selecione a ferramenta polígono clicando na forma do polígono na barra de ferramentas de software de processamento de imagem e delineie as estruturas de pericyte de ensheathing visível, como soma e processos.
- Clique no botão Adicionar localizado na janela gerenciador de ROI para adicionar ROIs selecionados no gerenciador de ROI.
- Dê a cada região de interesse um nome único clicando no botão Rename e salve-os como uma pasta zip que pode ser carregada mais tarde no software de programação clicando em Mais>> | Salve.
NOTA: As etapas 4.1.8-4.1.14 descrevem como importar a série T de cálcio para a plataforma de programação e como desmixar os diferentes fluoroforos detectados pelos PMTs do microscópio em diferentes canais(Figura 2). - Abra o software de programação e certifique-se de que as pastas dos pacotes de processamento de imagens estejam no caminho (ver Tabela de Materiais).
- Importe a série T de cálcio para o software de programação chamando a função BioFormats na janela de comando da plataforma de programação, que abre automaticamente a janela de seleção de arquivos.
- Defina o que está em cada canal digitando o número desejado. Neste exemplo, resposta do Canal 1=6 (cellular_signal), resposta do Canal 2=1 (blood_plasma).
- Plote os dados como um filme dentro do software de programação para facilitar a visualização chamando a função de plot.
- Para remover fluorescência verde do fluoresceíno-dextran que sangra até o canal RCaMP vermelho, desmixe os canais no pacote de processamento de imagens chamando a função unmix_chs na janela de comando da plataforma de programação.
- Selecione uma região que só contenha fluorescência deste fluoróforo no Canal 1, como o RCaMP neste caso.
- Selecione uma região que contenha apenas fluorescência do fluorohore 2, como fluoresceína no plasma de sangue neste exemplo.
- Selecione uma área de fundo que não tenha fluorescência de nenhum fluoróforo. Isso gera uma matriz de contribuição espectral que é aplicada a cada pixel em cada canal. Melhora significativamente a localização do sinal RCaMP que aumentará a detecção de eventos de cálcio nessas estruturas.
NOTA: Como mencionado acima, existem várias maneiras de que os dados de imagem de cálcio possam ser analisados dentro dos pacotes de processamento de imagem. As etapas 4.1.16-4.1.23 descrevem o método para analisar eventos de cálcio pericíte pericítes usados em ROIs manuais e selecionados à mão. - Execute a análise de sinalização celular no filme de cálcio não misturado, chamando a função CellScan na janela de comando da plataforma de programação.
- O código perguntará "Qual método de detecção de ROI você gostaria de usar?". Digite o número 2 para carregar os ROIs selecionados a dedo para a plataforma de programação.
- Carregue as regiões de interesse da pasta zip que foram selecionadas dos pericítes manualmente (Passo 4.1.6).
- O código perguntará "Qual é o fator escala?". Determine o fator de escala para os ROIs selecionados a dedo em relação à série de imagens que está sendo analisada e digite o número da escala. Neste exemplo, o fator de escala é 1 porque os ROIs não precisam ser redimensionados, pois foram selecionados em imagens com 128x128 pixels, a mesma resolução do filme original de cálcio.
- Gerar parcelas de cada ROI e traços de cálcio normalizados em cores diferentes (Figura 3A) chamando o processo e as funções do gráfico na janela de comando.
- Se o código não detectar a maioria dos eventos de cálcio nos traços individuais, modifique os parâmetros incorporados dentro da caixa de otimização de configuração chamando a função opt_config e ajustando os valores, como diminuir o limiar para os dados filtrados de passe curto para três vezes o desvio padrão do período de linha de base, que são os primeiros 30 quadros da série T.
- Selecione o botão Processar na caixa de otimização para aplicar os novos parâmetros.
NOTA: Para detectar e classificar os sinais, o traço de cálcio normalizado é filtrado por passagem longa e passagem de banda, o que ajuda a suavizar os dados para estimativas de amplitude e largura, mas também para determinar se os sinais são picos únicos, vários picos ou platôs(Figura 3B). - Produza os dados como um arquivo .csv que contém informações espaciais sobre as regiões de interesse e os picos que foram identificados chamando a função output_data na janela de comando. Dê ao arquivo um nome único para análise posterior em um programa de estatísticas.
NOTA: As etapas 4.1.24-4.1.31 descrevem o método para analisar eventos de cálcio pericíte ensheathing utilizando a análise de ROIs baseadas em atividade. - Repita os passos 4.1.8.-4.1.16 para importar o filme de cálcio, desmixar os canais e chamar a função CellScan na plataforma de programação.
- O código perguntará "Qual método de detecção de ROI você gostaria de usar?". Digite o número 6 para selecionar a região automatizada de identificação de juros com base na atividade e alteração da fluorescência em 3 dimensões (x, y e tempo; "Algoritmo 3D FLIKA").
- Plote os resultados processados para visualizar as regiões de interesse identificadas como cores diferentes, chamando o processo e as funções do plot na janela de comando. Cada ROI é distinguido no tempo e no espaço e representado como uma máscara sobreposta(Figura 4).
- Se o algoritmo não detectar ROIs claramente visíveis pelo olho, modifique os parâmetros incorporados dentro da caixa de otimização chamando a função opt_config e ajustando os valores, como aumentar o filtro gaussiano que suaviza os dados a tempo (por 2 s) e diminuir o limiar para encontrar ROIs para 3 vezes o desvio padrão da linha de base.
- Selecione o botão de processo na caixa de otimização para aplicar os novos parâmetros. Com o processo de otimização mais ROIs devem ser identificados(Figura 4B).
- Plote os ROIs como um filme para identificar claramente as áreas de atividade (delineadas nas cores do arco-íris) alterando o modo da caixa padrão para filme dentro da janela de otimização para visualização posterior.
- Exaú-los como um arquivo csv chamando a função output_data na janela de comando. Este arquivo pode ser analisado mais adiante em um programa de estatísticas.
NOTA: Os parâmetros de análise podem ser ajustados para se encaixar em qualquer tipo de sinal celular dinâmico (cálcio, razões DE TRAS, etc.). Todas as etapas acima podem ser automatizadas com código de programação simples, a fim de processar em lote muitos filmes de cálcio com as mesmas configurações.
- Análise de fluxo sanguíneo de varredura de linha.
- Importe o arquivo de dados de análise de linha adquirido na seção 3.5 para o software de programação.
- O código perguntará "O que é mostrado nos canais 1 e 2?". Defina o que está em cada canal quando solicitado. Neste exemplo, o Canal 1 é em branco (tipo 0) e o Canal 2 é blood_plasma (tipo 1).
- Execute a função de análise de diâmetro na varredura de linha chamando a função LineScanDiam, que abre uma caixa para selecionar a área que corresponde ao diâmetro no kymograph(Figura 5B, à esquerda).
- Desenhe uma caixa fora dos limites de fluorescência kymógrafo que corresponde ao diâmetro do vaso.
- Processe essa classe de dados chamando a função do processo para medir a largura total em meia máxima para o diâmetro do vaso e gerar um plot (Figura 5C) com a função de parcela.
- Exaú-los como um arquivo csv chamando a função output_data na janela de comando. Este arquivo pode ser analisado mais adiante em um programa de estatísticas.
- Execute a análise de transformação de radon de velocidade chamando a função LineScanVel, que abre uma caixa para selecionar a área que corresponde à velocidade RBC no kymograph(Figura 5B, à direita).
- Desenhe uma caixa dentro da borda da fluorescência kymograph que corresponde à velocidade do vaso.
- Processe essa classe de dados chamando a função do processo para calcular a velocidade, o fluxo e a densidade linear dos glóbulos vermelhos a partir do ângulo das raias na fluorescência. Gere um plot(Figura 5D) com a função de enredo.
- Exaú-los como um arquivo csv chamando a função output_data na janela de comando. Este arquivo pode ser analisado mais adiante em um programa de estatísticas.
NOTA: Os kymogramas devem ter fluorescência clara com bordas bem definidas entre os espaços pretos para que o diâmetro e a análise de velocidade sejam precisos(Figura 5A,B). É muito importante desenhar as linhas ortogonais e paralelas de forma precisa, caso contrário, uma análise confiável dos kymógrafos não será possível. Semelhante à análise de cálcio com os algoritmos de processamento de imagem, os parâmetros para cálculos de diâmetro e velocidade podem ser otimizados.
Resultados
Fluoresceíno-dextran possui um amplo espectro de emissões que pode sangrar até o canal vermelho, impactando a detecção de RCaMP em pericytes ensheathing(Figura 2A). A desmontagem espectral após a aquisição de dados no programa de software reduz o sangramento de fluoresceína através(Figura 2B, menor), aumentando a detecção de sinal de cálcio em etapas subsequentes de análise.
A análise de cálcio com os algoritmos de processamento de imagem utilizados neste protocolo permite várias abordagens diferentes para identificar ROIs e flutuações intracelulares de cálcio (ou seja, sinais de cálcio). A seleção de estruturas celulares manualmente permite a detecção de flutuações de cálcio dentro dessas regiões (Figura 3A), incluindo diferentes tipos de picos de sinal, como picos únicos e vários picos, após os traços de cálcio normalizados serem filtrados por baixo passe e passe de banda(Figura 3B). Além disso, os ROIs são identificados por agrupar pixels ativos onde a intensidade da fluorescência muda ao longo do tempo usando algoritmos de processamento de imagem desenvolvidos por Ellefsen et al. 201416 e Barrett et al. 201817 (Figura 4). Isso pode ser aplicado a qualquer sinal celular dinâmico ajustando o tempo, limiar e parâmetros espaciais para abranger o tamanho e a forma esperados do sinal. A diminuição do limiar de identificação de sinal encontra mais regiões de interesse(Figura 4B).
Kymogramas hemodinâmicos brilhantes e claros podem ser analisados para medir o diâmetro e a velocidade de RBC em vasos sanguíneos próximos a pericítos ensheathing(Figura 5A,B). O diâmetro é calculado a partir da largura total a metade do máximo da fluorescência (Figura 5C). A velocidade RBC é aproximada das listras feitas de RBCs não rotuladas, onde o ângulo é entrada em uma transformação radon para calcular a velocidade, fluxo (células/s) e densidade linear (células/mm; Figura 5D). Kymographs de má qualidade onde há saturação de fluorescência, má relação sinal para ruído ou movimento do campo de imagem(Figura 6A) cria parcelas não confiáveis com pontos de erro (cruzes vermelhas) onde os dados não podem ser determinados(Figura 6B, C). A qualidade dos dados adquiridos é fundamental para um bom resultado e seguir as etapas descritas neste protocolo garante bons resultados.
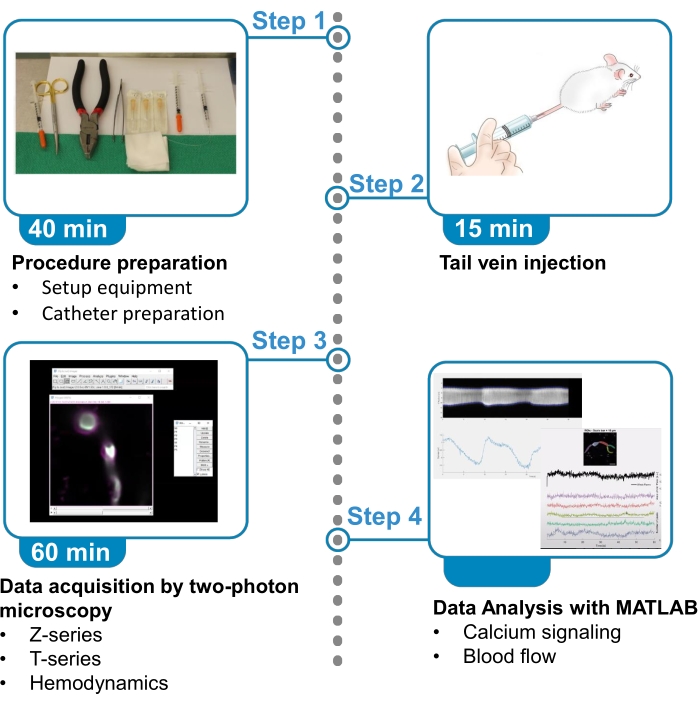
Figura 1. Resumo do protocolo. O protocolo apresenta os passos para adquirir e analisar imagens fluorescentes de cálcio de pericytes e dados de fluxo sanguíneo de vasos sanguíneos próximos em camundongos anestesiados. O protocolo é dividido em 4 etapas. 1) Preparação do procedimento: configuração de equipamentos e preparação de cateter; 2) Injeção da veia da cauda; 3) Aquisição de dados por microscopia de dois fótons; 4) Análise de dados com algoritmos de processamento de imagens. Clique aqui para ver uma versão maior desta figura.
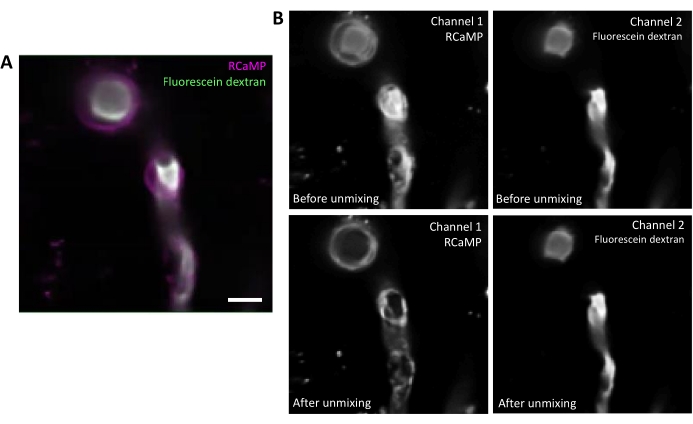
Figura 2. Descompra de fluoroforos espectrais. A) Imagem média representativa da pericyte ensheathing RCaMP e fluoresceína-dextran rotulada vaso sanguíneo a partir de uma aquisição da série T. Barra de escala= 10 μm.B) Superior: Ao considerar canais individuais, o sangramento do Canal 2 é aparente no Canal 1 (à esquerda). Mais baixo: Após a desmlicagem espectral, o sangramento é reduzido e o sinal de RCaMP é mais proeminente na estrutura pericyte. Clique aqui para ver uma versão maior desta figura.
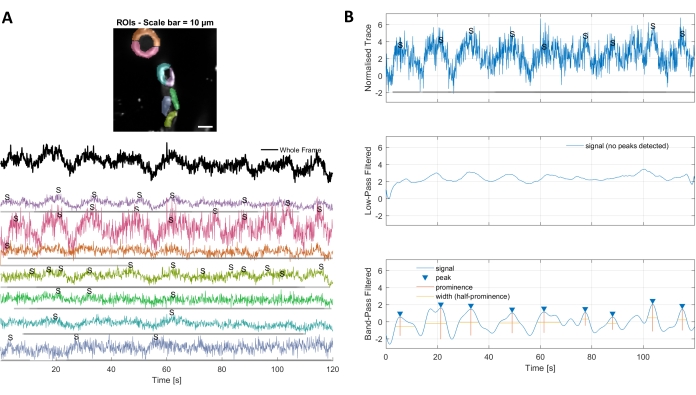
Figura 3. ROIs selecionados à mão e traços otimizados de cálcio. A) Regiões de interesse selecionadas no software de processamento de imagens usadas (formas arco-íris) podem ser usadas para identificar traços de sinal de cálcio. B) Os picos de sinal a partir de traços normalizados são identificados por passe baixo e passe de banda filtrando os dados. Definimos o limiar de sinal como 3 vezes o desvio padrão do período de linha de base (primeiros 30 quadros) e quaisquer picos acima desse limiar foram considerados um sinal (traço inferior). Clique aqui para ver uma versão maior desta figura.
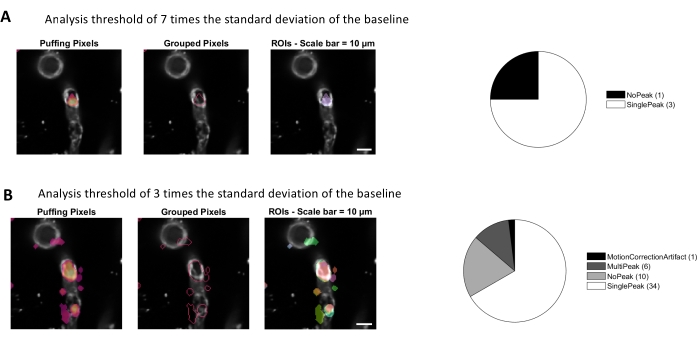
Figura 4. ROIs automatizados e baseados em atividade para análise de cálcio. Os mesmos dados foram analisados com um limiar de 7 vezes o desvio padrão da linha de base (A) e 3 vezes o desvio padrão da linha de base (B). A diminuição do limiar para identificação de pixels ativos encontra mais ROIs (B) e picos de sinal (gráfico de tortas) dentro dos pericílitos. Clique aqui para ver uma versão maior desta figura.
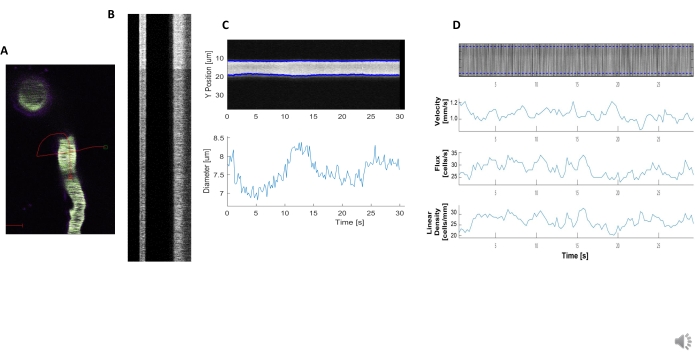
Figura 5. Medições hemodinâmicas de kymógrafo. A) Exemplo de varredura de linha através da nave. B) Exemplo de kymógrafos bem definidos para diâmetro (esquerda) e velocidade (direita). As listras negras dentro da faixa direita de fluorescência correspondem a RBCs.C) Análise de diâmetro com flutuações claras de vasomotion. D) Análise de velocidade com gráficos para eixo Y= fluxo RBC (células/s), densidade de linha (células/mm), velocidade (mm/s) e ângulo de raia (grau), relação sinal/ruído (unidades arbitrárias, a.u.), eixo X=tempo (seg). Clique aqui para ver uma versão maior desta figura.
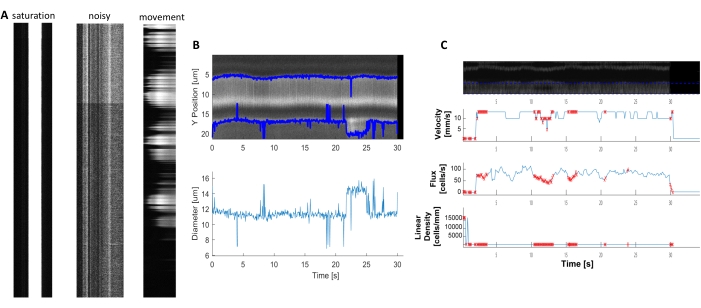
Figura 6. Representação de medidas hemodinâmicas de má qualidade. A) Exemplos de kymogramas de má qualidade com saturação de fluorescência, má relação sinal/ruído ou movimento do campo de imagem durante a aquisição. B e C) Parcelas semelhantes à Figura 7 de dados de diâmetro e velocidade que possuem pontos de erro (pontos vermelhos) devido à má qualidade dos kymógrafos. (imagem E, eixo Y=Diâmetro (μm), eixo X=tempo (seg); imagem F, eixo Y= fluxo RBC (células/s), densidade de linha (células/mm), velocidade (mm/s) e ângulo de raia (grau), relação sinal/ruído (a.u.), eixo X=tempo (seg). Clique aqui para ver uma versão maior desta figura.
Discussão
O presente método fornece detalhes sobre a injeção da veia da cauda do rato com um cateter, aquisição de imagens de microscópio de dois fótons para pilhas de profundidade, filmes de sinalização de cálcio celular, criação de kymografos hemodinâmicos e análise de cálcio e hemodinâmica com nossos algoritmos de processamento de imagem17 (Figura 1). Existem várias vantagens para essas técnicas que melhoram o resultado da imagem in vivo e reduzem o tempo, os recursos e o estresse animal durante a sessão. Primeiro, o uso de um cateter para injeção de veias traseiras fornece mais controle sobre a agulha, a seringa e a quantidade de substância injetada na circulação do camundongo. Além disso, evita a injeção de corante no tecido da cauda, economizando reagentes caros. Em segundo lugar, usamos camundongos transgênicos que expressam sensores de cálcio geneticamente codificados em pericítes ensheathing e demonstram como localizá-los dentro da rede vascular cerebral com uma pilha z de profundidade, o que facilita a identificação e realocação de células em sessões de imagem subsequentes a longo prazo. Este é um fator importante nos estudos pericíte e garante classificação celular adequada6,7. Em terceiro lugar, fornecemos nossos parâmetros para a coleta de filmes de cálcio e dados de varredura de linha hemodinâmica que são um bom ponto de partida para medir sinais celulares dinâmicos. Finalmente, apresentamos nossos algoritmos de processamento de imagem17, uma caixa de ferramentas abrangente de processamento de imagem que contém múltiplas abordagens para pré-processamento de imagem (como descompramento espectral), análise de imagem de cálcio e análise hemodinâmica (diâmetro, velocidade, etc.). Esses algoritmos podem gerar parcelas para uma visualização rápida e fácil dos dados, minimizando o nível de experiência do usuário necessário para analisar resultados. Além disso, ele pode ser automatizado com algumas linhas de código para processar rapidamente vários conjuntos de dados com os mesmos parâmetros. Isso pode potencialmente melhorar a visualização de dados e o investimento temporal do pesquisador.
A chave para coletar bons dados de imagem de cálcio é ajustar a potência do laser e as configurações de PMT para aquisição clara de sinal de fluorescência, mas também coletar dados a uma taxa de quadros suficiente para capturar todo o evento de cálcio. Os dados deste protocolo foram adquiridos a 10-11 quadros por segundo, o que captura as oscilações mais lentas de cálcio em pericytes ensheathing. Há também várias etapas durante a análise que podem melhorar o resultado da análise. Em primeiro lugar, o descompreamento espectral é benéfico se houver sobreposição significativa entre os espectros de emissões de fluoroforos(Figura 2). Fluoresceíno-dextran foi utilizado neste protocolo por ser um conjugado dextran econômico e comercialmente disponível que é comumente usado para medições hemodinâmicas5. A desmixagem espectral ajuda a limpar os dados para maior detecção de sinais de cálcio, mas fluoroforos alternativos com espectros de emissões mais estreitos também poderiam ser usados. Em segundo lugar, selecionar manualmente estruturas celulares como ROIs (Figura 3) é útil para classificar eventos de cálcio em diferentes regiões subcelulares, como os ramos soma ou processo. A seleção de ROI baseada em atividade (Figura 4)16 fornece mais informações espaciais e temporais sobre eventos individuais de cálcio. Isso pode ser útil ao determinar a frequência de eventos de cálcio em uma determinada área ou a propagação de eventos para outras áreas celulares. O uso de software de programação para analisar dados de imagem pode economizar horas de tempo aos pesquisadores quando os dados são processados em lote, mas requer algum investimento inicial para ajustar os parâmetros para resultados ideais. Os fatores mais importantes são o tamanho esperado (em μm2) da região ativa, bem como a duração do sinal (tempo mínimo de sinal e tempo máximo de sinal devem ser definidos). Os pesquisadores devem examinar alguns exemplos de filmes da série T primeiro para determinar melhor quais parâmetros se encaixam em seus dados. Finalmente, dados de baixa qualidade adquiridos no microscópio podem dificultar muito a análise de cálcio e hemodinâmica(Figura 6). Portanto, deve-se tomar cuidado para otimizar as configurações de aquisição de microscópio no início. Com esses fatores em mente, este protocolo que pode ser adaptado para se adequar à imagem de cálcio ou análise de outros sinais celulares dinâmicos (por exemplo, sódio fluorescente, potássio, metabólito ou flutuações de tensão) em outros tecidos ou tipos de células.
Há várias limitações para este protocolo. Primeiro, os dados são coletados sob anestesia, que afeta a atividade cerebral e pode afetar o fluxo sanguíneo. Imagens semelhantes podem ser feitas em camundongos acordados que são treinados para aceitar a fixação da cabeça para resultados mais fisiológicos. Além disso, é importante lembrar que coletamos imagens bidimensionais de uma célula tridimensional e vaso sanguíneo in vivo. Portanto, só podemos capturar uma facção dos eventos de cálcio dentro dessas células ou o fluxo sanguíneo em uma única seção do vaso sanguíneo de cada vez.
Outra limitação a notar é que a imagem de cálcio de dois fótons é sensível aos artefatos de movimento, onde o movimento dentro e fora do plano focal pode ser confundido com flutuações de cálcio. Este protocolo foi realizado sob anestesia, que limita a circulação do animal; no entanto, os artefatos de movimento podem ser introduzidos pela frequência respiratória do camundongo, frequência cardíaca, possível inchaço tecidual, e no caso de pericytes ensheathing, contração do vaso ou vasomotion 4,6,18,19. Artefatos de movimento podem ser mitigados por várias estratégias. Os pacotes de processamento de imagem usados neste protocolo incluem uma etapa opcional de correção de movimento, que utiliza um mecanismo de convolução 2D para alinhar as imagens dentro da série T com base na vasculatura visível13,17. Quadros com alterações significativas no plano focal são identificados por este algoritmo e podem ser excluídos da análise. Além disso, é possível utilizar estratégias estatísticas dentro dos pacotes de processamento de imagens, como um escore Z ao gerar os traços de fluorescência para normalizar as flutuações de cálcio induzidas pelo movimento20. A abordagem mais robusta para explicar artefatos de movimento em imagens de dois fótons é combinar a expressão de dois indicadores fluorescentes dentro da mesma célula, como um indicador de cálcio (por exemplo, GCaMP) e um repórter fluorescente (por exemplo, mCherry) que é independente do cálcio. As flutuações no repórter fluorescente podem então ser atribuídas ao movimento e são subtraídas do sinal indicador de cálcio para normalizar artefatos de movimento.
O objetivo deste protocolo é fornecer uma compreensão clara de como coletar dados ideais de imagem de cálcio e fluxo sanguíneo in vivo e apresentar novos métodos e ferramentas de análise que os pesquisadores possam implementar para melhorar seus resultados. Essas técnicas podem ser aplicadas para estudar o papel de diferentes populações de pericítes no controle do fluxo sanguíneo ou em diferentes estados de doenças cerebrais. Esses parâmetros de imagem também podem ser usados para estudar o cálcio e o fluxo sanguíneo em outros tipos de células e sistemas de órgãos e princípios semelhantes se aplicam a outras técnicas dinâmicas de imagem que são possíveis por outros sensores geneticamente codificados, além do cálcio.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
J. Meza é apoiado por bolsas da Mitacs e Research Manitoba. O financiamento para este trabalho foi fornecido pelos Institutos Canadenses de Pesquisa em Saúde, Pesquisa manitoba, Manitoba Medical Service Foundation, financiamento inicial da Universidade de Manitoba e Brain Canada através do Canada Brain Research Fund, com o apoio financeiro da Health Canada e da Azrieli Foundation. As opiniões aqui expressas não representam necessariamente as opiniões do Ministro da Saúde ou do Governo do Canadá.
Materiais
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
Referências
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -. A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -. F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a., et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402 (2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory Available from: https://www.jax.org/strain/028345 (2021)
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680 (2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297 (2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados