Method Article
Calcium péricyte cérébral et imagerie hémodynamique chez des souris transgéniques in vivo
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole présente des étapes pour acquérir et analyser des images fluorescentes de calcium à partir de péricytes ensanglant le cerveau et des données de flux sanguin provenant de vaisseaux sanguins voisins chez des souris anesthésiées. Ces techniques sont utiles pour l’étude de la physiologie cellulaire murale et peuvent être adaptées pour étudier les transitoires de calcium dans n’importe quel type de cellule.
Résumé
Les progrès récents de la biologie des protéines et de la génétique de la souris ont permis de mesurer in vivo les fluctuations intracellulaires du calcium des cellules cérébrales et de les corréler avec l’hémodynamique locale. Ce protocole utilise des souris transgéniques qui ont été préparées avec une fenêtre crânienne chronique et expriment l’indicateur de calcium génétiquement codé, RCaMP1.07, sous le promoteur de l’actine musculaire α lisse pour étiqueter spécifiquement les cellules murales, telles que les cellules musculaires lisses vasculaires et les péricytes gainants. Les étapes sont décrites sur la façon de préparer un cathéter veineux de la queue pour l’injection intraveineuse de colorants fluorescents pour tracer le flux sanguin, ainsi que sur la façon de mesurer le calcium péricyte cérébral et l’hémodynamique locale des vaisseaux sanguins (diamètre, vitesse des globules rouges, etc.) par microscopie à deux photons in vivo à travers la fenêtre crânienne chez des souris anesthésiées à la kétamine / xylazine. Enfin, des détails sont fournis pour l’analyse des fluctuations du calcium et des films de flux sanguin via les algorithmes de traitement d’image développés par Barrett et al. 2018, en mettant l’accent sur la façon dont ces processus peuvent être adaptés à d’autres données d’imagerie cellulaire.
Introduction
Le système nerveux central se compose d’artérioles pénétrantes, de capillaires et de veinules ascendantes. Au sein de ce réseau, les cellules murales telles que les cellules musculaires lisses vasculaires enveloppent les artérioles et les péricytes étendent les processus cellulaires le long des premières branches artérioles et capillaires1. Les péricytes semblent avoir plusieurs rôles dans le cerveau, y compris le maintien de la barrière hémato-encéphalique1,2, la migration et la motilité3, les propriétés potentielles des cellules souches et la régulation du flux sanguin cérébral4,5,6. De nombreux rôles fonctionnels des péricytes ont été liés à des fluctuations du calcium intracellulaire qui peuvent réguler la dilatation ou la contraction de ces cellules4,5,6.
Plusieurs études récentes ont établi des critères pour identifier différents types de péricytescérébraux 7,8. Les cellules murales dans les 4 premières branches des artérioles pénétrantes sont des péricytes gainants en fonction de leur expression de la protéine contractile α-lisse actine musculaire (αSMA) et de leur somata ovoïde saillant avec des processus qui enveloppentautour desvaisseaux 7,8,9. Pour visualiser les fluctuations calciques dans les péricytes ensaissés, ce protocole utilise une nouvelle lignée de souris transgénique, Acta2-RCaMP1.07, également connue sous le nom de Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J10. Ces souris expriment l’indicateur de calcium génétiquement codé en rouge, RCaMP1.07, dans les cellules exprimant l’αSMA (cellules musculaires lisses vasculaires et péricytes gainants). Les colonies de reproduction sont maintenues en croisant des animaux non transporteurs avec des hémizygotes. RCaMP1.07 est une protéine fluorescente rouge avec un domaine de liaison à la calmoduline, qui augmente la fluorescence lors de la liaison au calcium intracellulaire10,11. Ce protocole décrit les étapes de l’imagerie calcique combinée des péricytes en gainant et des mesures du débit sanguin par microscopie à deux photons, y compris les procédures d’injection de colorants fluorescents dans la veine de la queue, l’acquisition d’images au microscope chez des souris anesthésiées et l’analyse de données avec des plates-formes de programmation (Figure 1). Ces techniques sont utiles pour répondre aux questions sur la physiologie cellulaire murale, mais peuvent être adaptées pour étudier les transitoires de calcium dans n’importe quel type de cellule du cerveau ou d’un autre système organique.
Une souris Acta2-RCaMP1.07 femelle de 10 mois a été utilisée pour l’expérience présentée dans cet article. La souris a subi une intervention chirurgicale pour une fenêtre crânienne chronique et une tête après l’implantation deux mois auparavant. Les détails du protocole chirurgical sont discutés dans les études précédentes12,13 et des procédures similaires ont été effectuées dans d’autres protocoles précédemment publiés14,15. Le système vasculaire est marqué avec de la fluorescéine-dextran verte (70 000 MW, solution anionique, 2,5 % p/v) injectée par voie intraveineuse. Ce colorant est rentable et facilement disponible auprès de sources commerciales, mais il a un spectre d’émission plus large qui peut chevaucher l’émission RCaMP et saigner lors de l’acquisition d’images au microscope. Les étapes du démélange spectral sont décrites à la section 4 ci-dessous pour contourner ce problème, mais d’autres colorants verts avec des spectres d’émission plus étroits, tels que ceux basés sur l’EGFP, peuvent également être utilisés.
Protocole
Toutes les procédures impliquant des animaux de laboratoire décrites ci-dessous ont été approuvées par le Comité des soins aux animaux de l’Université du Manitoba, qui est régi par le Conseil canadien des soins aux animaux.
1. Configuration et préparation de la procédure
REMARQUE: Les articles suivants sont requis pour une injection de cathéter veineux caudale: seringues à insuline, un morceau de tube PE10 de 15 cm, aiguilles de 30 G, gaze, solution saline, pinces, colorant dextran à la fluorescéine verte, pince et ciseaux. De plus, préparez une aiguille avec une anesthésie à la kétamine / xylazine qui sera injectée avant la séance d’imagerie.
CRITIQUE : Tous les matériaux et équipements des étapes 1 et 2 doivent être stérilisés avant l’utilisation par autoclavage ou rinçage à l’éthanol à 70 %. Si la pince ne peut pas être correctement stérilisée, l’utilisation d’une paire de grands porte-aiguilles est recommandée. L’assemblage du cathéter doit être effectué avec une pince et une pince pour éviter les perforations accidentelles de l’aiguille.
- Couper environ 15-20 cm de tube en polyéthylène, PE10 (I.D. 28 mm; O.D. 61 mm).
- Remplissez une seringue à insuline de 27 G avec une solution saline à 0,9 % et encercez l’aiguille de la seringue dans l’extrémité du tube en polyéthylène. Poussez la solution saline à travers le tube, en vous assurant qu’il n’y a pas de fuites.
- À l’aide d’une pince, pliez une aiguille de 30 G (0,3 mm x 25 mm) d’avant en arrière jusqu’à ce qu’elle se détache du moyeu. L’aiguille doit être propre et sans courbure.
- En tenant l’aiguille avec une pince, insérez soigneusement l’aiguille dans l’extrémité du tube PE10 qui est attaché à la seringue remplie de solution saline et retirez les bulles d’air. Il s’agit du cathéter pour injection.
- Filtrer 30 μL de 2,5 % (p/v) de fluorescéine dextran à travers un filtre de 13 à 25 μm avant l’injection.
- Remplissez une autre seringue à insuline avec l’aliquote de 30 μL de dextran et assurez-vous qu’il n’y a pas de bulles dans la seringue remplie.
2. Injection de veine caudale
- Anesthésier la souris avec de l’isoflurane (4 % d’induction, 1,5 % d’entretien) ou de la kétamine/xylazine (60 mg/kg ; 10 mg/kg ; i.p.) et appliquer un gel lubrifiant pour les yeux. La kétamine/xylazine est recommandée pour des mesures de débit sanguin plus stables pendant l’imagerie et la dose peut être augmentée à 90 mg/kg; 10 mg/kg de kétamine/xylazine pour des séances d’imagerie plus longues.
- Lorsque la souris est au plan chirurgical de l’anesthésie, placez un gant rempli d’eau tiède sur la queue pour dilater la veine latérale.
- Retirez le gant après 30 s et nettoyez la queue avec de l’éthanol.
- Placez la queue entre le pouce et le majeur. Fournir une pression avec l’index sur la queue pour dilater la veine. Avec l’autre main, ramassez l’aiguille du cathéter avec des pinces orientant la lunette vers le haut vers le plafond.
- Après avoir nettoyé la queue avec de l’éthanol à 70%, insérez doucement l’aiguille dans la veine à un angle de 0 ° et injectez doucement une solution saline à travers le cathéter pour vous assurer que l’aiguille est placée correctement.
REMARQUE: S’il n’y a pas de résistance sur le piston et pas de gonflement de la queue, l’aiguille est dans la veine. S’il y a une résistance ou un gonflement important, l’aiguille doit être retirée. Les étapes 2.2 à 2.5 peuvent être répétées jusqu’à 3 fois de chaque côté de la queue, en remplaçant l’aiguille 30G à la fin du cathéter tous les deux essais jusqu’à ce que le placement soit correct. - Une fois l’aiguille dans la veine, remplacer la seringue saline à l’extrémité du cathéter par la seringue contenant de la fluorescéine dextran (étape 1.6). Injectez lentement le dextran dans le tube du cathéter, en veillant à ce qu’aucune bulle ne pénètre dans le tube. Si une bulle d’air est apparente, coupez le tube contenant la bulle pour l’enlever et rattez la seringue.
- Lorsque tout le dextran (aliquote de 30 μL) a été injecté, retirez la seringue et remplacez-la par la seringue saline. Injectez le dextran restant du tube dans la souris jusqu’à ce qu’il ne reste plus de colorant dans le tube.
- Retirez l’aiguille de la queue et pressez avec de la gaze pendant 10 à 30 s jusqu’à ce que le saignement cesse.
CRITIQUE: Si, après 6 tentatives, l’injection de la veine caudale échoue, l’animal doit être imagé lors d’une autre séance. De plus, le volume total (solution saline et dextran) injecté dans la souris ne doit pas dépasser 100 μL.
3. Microscopie à deux photons
- Se concentrer sur la fenêtre crânienne
REMARQUE: Utilisez une anesthésie à la kétamine / xylazine lors de l’acquisition des données, car elle a moins d’effets vasculaires (vasodilatation) que l’isoflurane. Si vous utilisez de l’isoflurane dans les étapes ci-dessus, injecter à la souris de la kétamine/xylazine i.p. (dose recommandée décrite ci-dessus) avant l’imagerie.- Fixez la souris avec une vis à travers son poteau de tête à une plate-forme avec un coussin chauffant sous le microscope.
- Appliquez du lubrifiant pour les yeux sur les yeux de la souris.
- Nettoyez la fenêtre crânienne avec des applicateurs dentaires humides. Assurez-vous qu’il n’y a plus de particules qui pourraient interférer avec le processus d’imagerie.
- Appliquez un gel à ultrasons sur la fenêtre.
- Concentrez-vous à travers l’objectif du microscope à deux photons jusqu’à ce que les vaisseaux sanguins piaux puissent être vus sous la fenêtre.
- Vérifiez la respiration de la souris et assurez-vous que le coussin chauffant fournit un support de température suffisant.
- Acquisition d’images
REMARQUE: Le microscope à deux photons utilisé dans cette expérience a un laser Ti-Sapphire accordable pour l’excitation de fluorescence avec une cellule de Pockel qui contrôle la quantité de laser qui atteint l’échantillon. La lumière émise est divisée par un dichroïque à long passage de 565 en deux tubes photomultiplicateurs GaAsP (PMT) avec filtre passe-bande 595/50 (rouge) et filtre passe-bande 525/70 (vert) pour la détection.
Les procédures décrites aux étapes 3.2 à 3.4 sont effectuées à l’aide d’un logiciel spécifique du microscope à deux photons de ce protocole (voir Table des matériaux). Ces étapes peuvent être adaptées à d’autres logiciels et équipements de microscope.- Lorsque les lumières de la pièce sont éteintes, réglez la longueur d’onde souhaitée dans le logiciel du microscope sur 990 nm pour exciter à la fois le RCaMP et la fluorescéine-dextran en cliquant sur la boîte laser 2-P.
- Réglez la puissance du laser en cliquant sur la section Puissance / Gain /Lasers et en ajustant la tension de la cellule Pockels 1 à 30% ou une valeur de 300 sur une échelle de 1000. La puissance laser qui atteint l’échantillon à ce réglage a été préalablement déterminée à environ 30 mW.
- Réglez la sensibilité du détecteur PMT en cliquant sur la section Puissance / Gain /PMT et en ajustant la valeur à 700-800.
REMARQUE: Ces valeurs peuvent être ajustées par rapport à l’intensité de l’échantillon fluorescent et doivent être réglées à zéro avant d’allumer les lumières dans la pièce. - Allez dans la section Résolution d’image et cliquez sur la résolution 512 x 512 pour une taille d’image plus grande.
- Cliquez sur Laser 2-P/Ouvrir pour ouvrir l’obturateur Laser 2-P.
- Allez dans la section Numérisation et cliquez sur le bouton Analyse en direct.
REMARQUE: Le balayage en direct avec ces paramètres et une résolution plus élevée, les cellules murales RCaMP positives et le plasma sanguin marqué par fluorescence peuvent être vus. Si le signal est faible, la valeur de pockel peut être augmentée jusqu’à ce que l’image soit claire.
CRITIQUE: Dans les couches tissulaires superficielles, la puissance du laser ne doit pas dépasser 50 mW, soit environ 600 dans les paramètres des cellules de Pockels dans cet exemple.
- Acquisition d’une pile de profondeur des cellules murales et du réseau vasculaire
REMARQUE: L’acquisition d’une pile de profondeur est recommandée pour localiser correctement les péricytes dans le réseau vasculaire. Les péricytes gainants sont situés sur les première à quatrième branches de l’artériole pénétrante7,8,9. Le logiciel de microscope utilisé dans ce protocole fait référence aux piles de profondeur sous le nom de « série Z ».- En déplaçant l’objectif du microscope dans les plans X, Y et Z, localisez une grande artère à la surface du cerveau en fonction du marquage des cellules musculaires lisses du RCaMP.
- Cliquez sur la case Série Z.
- Concentrez-vous en haut du tissu près des vaisseaux piaux, définissez-le comme point zéro et haut de la pile de la série Z en cliquant sur la section Current Z-series/ Start position [μm]. Cliquez sur la boîte avec quatre bandes noires et une bande rouge sur le dessus.
- Concentrez-vous vers le bas dans le tissu à la profondeur souhaitée et définissez-la comme le bas de la pile en cliquant sur la section Current Z-series/Stop position [μm]. Cliquez sur la boîte avec quatre bandes noires et une bande rouge en bas.
- Réglez l’épaisseur de chaque plan d’image (taille de pas) sur 1-2 μm en tapant la valeur souhaitée dans la case sous le bouton "Taille de pas" (le bouton Taille depas est localisé dans la section Série Z / Série Z actuelle). Cela définira le nombre d’images acquises dans la pile.
- Réglez la puissance du laser pour qu’elle augmente de manière exponentielle à mesure que le microscope se déplace plus profondément dans la pile en cliquant sur la case Compensation laser/PMT et en sélectionnant Relatif (gradient exponentiel).
- Nommez le fichier, choisissez un dossier pour l’enregistrer et cliquez sur Démarrer la série Z.
- Après l’acquisition, ouvrez la série Z dans le logiciel de traitement d’imagerie.
- Fusionnez les deux canaux sous forme d’images colorées et parcourez la pile à la recherche de péricytes et de vaisseaux sanguins d’intérêt en cliquant dans la case Image | | de couleur Canaux divisés; | de l’image | de couleur Fusionner les canaux.
- Sélectionnez les régions d’intérêt (ROI) qui contiennent des péricytes et enregistrez les positions pour aider à localiser à nouveau ces points lors de futures sessions d’imagerie.
- Acquisition de films d’imagerie calcique de la série T (temps)
- En utilisant la pile de profondeur et les rois d’en haut comme référence, déplacez l’objectif du microscope dans les axes X, Y et Z en mode de balayage en direct jusqu’à ce qu’un péricyte d’intérêt soit trouvé.
- Pour collecter un film d’événements de calcium péricyte, augmentez la fréquence d’images d’acquisition (>10 images par seconde) en allant dans la section Résolution d’image et en cliquant sur la case 128x128.
- Réglez la durée de l’imagerie sur 60 s en cliquant sur la case série T et en entrant l’heure dans la zone durée.
- À côté de la zone Enregistrer le chemin, cliquez sur le bouton avec trois points pour mettre à jour le chemin d’enregistrement avec un nom de fichier unique.
- Zoom optique sur le récipient pour tenir compte de la résolution inférieure et pour obtenir une vue plus rapprochée du péricyte en ajustant la valeur dans la section Zoom optique [mag].
- Acquérez la série T en cliquant sur Démarrer la série T.
- Mesures hémodynamiques avec kymographes (balayages linéaires)
- Concentrez-vous sur le navire d’intérêt à une résolution de 512 x 512pixels en mode Live Scan.
- Pour mesurer le diamètre des vaisseaux sanguins et la vitesse des globules rouges, cliquez sur le balayage linéaire pour lancer un balayage unidimensionnel au microscope.
- Définissez la durée de l’analyse (30-60 s) en millisecondes.
- Tracez une ligne qui coupe en deux le navire d’intérêt et se déplace parallèlement le long du navire. Cela générera un kymographe du diamètre du vaisseau à gauche et des stries des globules rouges se déplaçant à travers le vaisseau à droite.
REMARQUE: Plusieurs vaisseaux sanguins peuvent être mesurés avec la même ligne tant qu’ils sont dans le même plan d’imagerie. - Nommez le fichier et cliquez sur le(s) Start Linescan(s) pour acquérir les données.
4. Analyse d’images
- Analyse de film calcique.
REMARQUE : Ce protocole décrit les étapes du démélange spectral (Graphique 2) et deux méthodes différentes pour analyser les événements de calcium péricytaire d’ensaissage à l’aide de ROI manuels sélectionnés à la main (Graphique 3) et une sélection automatisée du retour sur investissement basée sur l’activité (Graphique 4)16,17. Afin de détecter et de classer les pics de signal avec la trace de calcium normalisée de chaque retour sur investissement, les données sont filtrées passe-long et passe-bande, ce qui permet de lisser les données pour les estimations d’amplitude et de largeur et également d’identifier les pics de différentes formes: pics simples, pics multiples et plateaux (Graphique 3B). Les paramètres de cette analyse peuvent être optimisés pour détecter différents types de signaux cellulaires dynamiques. Les étapes ci-dessous nécessiteront l’utilisation d’un logiciel de traitement d’image et d’un logiciel de programmation avec des packages de traitement d’image contenant différents codes pour analyser les films de calcium comme mentionné ci-dessus. Veuillez consulter le tableau des matériaux pour obtenir la liste complète des programmes et des packages utilisés dans ce protocole. Les données d’imagerie de différents types de microscopes peuvent être importées avec ces packages conservant les métadonnées des images.
REMARQUE : Les étapes 4.1.1 à 4.1.7 décrivent comment sélectionner manuellement les retours sur investissement dans un logiciel de traitement d’images en fonction d’une utilisation ultérieure dans la méthode d’analyse manuelle du calcium (étape 4.1.16)- Chargez la série T d’imagerie calcique dans le logiciel de traitement d’image en faisant glisser le fichier .xml vers la barre d’outils du logiciel. Cliquez sur la case OK.
- Prenez la moyenne de la pile (la moyenne de la pile est étiquetée comme «projection Z» par le logiciel de traitement d’image). Cela peut être fait en cliquant sur Image | Piles | Projection Z dans la barre d’outils.
- Créez une image colorée à partir des deux canaux comme à l’étape 3.3.9.
- Ouvrez la fenêtre gestionnaire de retour sur investissement en cliquant dans la case Analyser | Outils | ROI Manager,ou simplement en appuyant sur la lettre «T» dans le clavier.
- Sélectionnez l’outil polygone en cliquant sur la forme du polygone dans la barre d’outils du logiciel de traitement d’image et tracez les structures péricytaires en gainage visibles, telles que le soma et les processus.
- Cliquez sur le bouton Ajouter situé dans la fenêtre du gestionnaire de retour sur investissement pour ajouter les retours sur investissement sélectionnés dans le gestionnaire de retour sur investissement.
- Donnez à chaque région d’intérêt un nom unique en cliquant sur le bouton Renommer et enregistrez-les en tant que dossier zip qui peut être chargé ultérieurement dans le logiciel de programmation en cliquant sur Plus>> | Enregistrer.
REMARQUE: Les étapes 4.1.8 à 4.1.14 décrivent comment importer la série T de calcium dans la plate-forme de programmation et comment mélanger les différents fluorophores détectés par les PMT du microscope dans différents canaux(Figure 2). - Ouvrez le logiciel de programmation et assurez-vous que les dossiers des packages de traitement d’image sont sur le chemin (voir Tableau des matériaux).
- Importez la série T de calcium dans le logiciel de programmation en appelant la fonction BioFormats dans la fenêtre de commande de la plate-forme de programmation, qui ouvre automatiquement la fenêtre de sélection de fichier.
- Définissez ce qui se trouve sur chaque canal en entrant le numéro souhaité. Dans cet exemple de données, Channel 1 answer=6 (cellular_signal), Channel 2 answer=1 (blood_plasma).
- Tracez les données sous forme de film dans le logiciel de programmation pour faciliter la visualisation en appelant la fonction de tracé.
- Pour éliminer la fluorescence verte de la fluorescéine-dextran qui saigne dans le canal RCaMP rouge, démixez les canaux du package de traitement d’image en appelant la fonction unmix_chs dans la fenêtre de commande de la plate-forme de programmation.
- Sélectionnez une région qui ne contient que la fluorescence de ce fluorophore dans le canal 1, comme RCaMP dans ce cas.
- Sélectionnez une région qui ne contient que la fluorescence du fluorophore 2, telle que la fluorescéine dans le plasma sanguin dans cet exemple.
- Sélectionnez une zone d’arrière-plan qui n’a pas de fluorescence de l’un ou l’autre fluorophore. Cela génère une matrice de contribution spectrale qui est appliquée à chaque pixel de chaque canal. Il améliore considérablement la localisation du signal RCaMP, ce qui améliorera la détection des événements calciques dans ces structures.
REMARQUE: Comme mentionné ci-dessus, il existe plusieurs façons d’analyser les données d’imagerie calcique dans les packages de traitement d’image. Les étapes 4.1.16 à 4.1.23 décrivent la méthode d’analyse des événements de calcium péricytaire en enseumant à l’aide d’un ROI manuel sélectionné à la main. - Exécutez l’analyse de signalisation cellulaire sur le film de calcium non mélangé en appelant la fonction CellScan dans la fenêtre de commande de la plate-forme de programmation.
- Le code demandera « Quelle méthode de détection du retour sur investissement souhaitez-vous utiliser? ». Tapez le chiffre 2 pour charger les rois sélectionnés à la main sur la plate-forme de programmation.
- Chargez les régions d’intérêt à partir du dossier zip qui ont été sélectionnées à la main dans les péricytes précédemment (étape 4.1.6).
- Le code demandera « Quel est le facteur d’échelle? ». Déterminez le facteur d’échelle pour les rois sélectionnés à la main par rapport à la série d’images analysée et tapez le numéro de l’échelle. Dans cet exemple, le facteur d’échelle est de 1 car les rois n’ont pas besoin d’être redimensionnés puisqu’ils ont été sélectionnés sur des images de 128x128 pixels, la même résolution que le film de calcium d’origine.
- Générez des graphiques de chaque roi et des traces de calcium normalisées de différentes couleurs(Figure 3A)en appelant les fonctions de processus et de tracé dans la fenêtre de commande.
- Si le code ne détecte pas la majorité des événements calciques dans les traces individuelles, modifiez les paramètres intégrés dans la zone d’optimisation de la configuration en appelant la fonction opt_config et en ajustant les valeurs, par exemple en diminuant le seuil pour les données filtrées passe-court à trois fois l’écart-type de la période de référence, qui correspond aux 30 premières images de la série T.
- Sélectionnez le bouton Processus dans la zone d’optimisation pour appliquer les nouveaux paramètres.
REMARQUE: Afin de détecter et de classer les signaux, la trace de calcium normalisée est filtrée en passe longue et passe-bande, ce qui permet de lisser les données pour les estimations d’amplitude et de largeur, mais aussi de déterminer si les signaux sont des pics simples, des pics multiples ou des plateaux(Figure 3B). - Sortez les données sous la forme d’un fichier .csv contenant des informations spatiales sur les régions d’intérêt et les pics identifiés en appelant la fonction output_data dans la fenêtre de commande. Donnez au fichier un nom unique pour une analyse plus approfondie dans un programme de statistiques.
REMARQUE : Les étapes 4.1.24 à 4.1.31 décrivent la méthode d’analyse des événements de calcium péricytaire en enseumant à l’aide de l’analyse des ROI basés sur l’activité. - Répétez les étapes 4.1.8.-4.1.16 pour importer le film de calcium, démixer les canaux et appeler la fonction CellScan dans la plate-forme de programmation.
- Le code demandera « Quelle méthode de détection du retour sur investissement souhaitez-vous utiliser? ». Tapez le chiffre 6 pour sélectionner l’identification automatisée de la région d’intérêt en fonction de l’activité et du changement de fluorescence en 3 dimensions (x, y et temps; « Algorithme FLIKA 3D »).
- Tracez les résultats traités pour afficher les régions d’intérêt identifiées sous forme de couleurs différentes en appelant les fonctions de processus et de tracé dans la fenêtre de commande. Chaque ROI se distingue dans le temps et l’espace et représenté sous la forme d’un masque superposé(Figure 4).
- Si l’algorithme ne détecte pas les rois clairement visibles à l’œil, modifiez les paramètres intégrés dans la zone d’optimisation en appelant la fonction opt_config et en ajustant les valeurs, par exemple en augmentant le filtre gaussien qui lisse les données dans le temps (de 2 s) et en diminuant le seuil de recherche de retour sur investissement à 3 fois l’écart type de la ligne de base.
- Sélectionnez le bouton de processus dans la zone d’optimisation pour appliquer les nouveaux paramètres. Avec le processus d’optimisation, davantage de retours sur investissement doivent être identifiés (Figure 4B).
- Tracez les rois sous forme de film pour identifier clairement les zones d’activité (soulignées en couleurs arc-en-ciel) en changeant le mode de la boîte par défaut en film dans la fenêtre d’optimisation pour une visualisation plus poussée.
- Extrayez les données sous forme de fichier csv en appelant la fonction output_data dans la fenêtre de commande. Ce fichier peut être analysé plus en détail dans un programme de statistiques.
REMARQUE: Les paramètres d’analyse peuvent être ajustés pour s’adapter à tout type de signal cellulaire dynamique (calcium, rapports FRET, etc.). Toutes les étapes ci-dessus peuvent être automatisées avec un code de programmation simple afin de traiter par lots de nombreux films de calcium avec les mêmes paramètres.
- Analyse du flux sanguin par balayage linéaire.
- Importez le fichier de données kymographe à balayage linéaire acquis à la section 3.5 dans le logiciel de programmation.
- Le code demandera « Qu’est-ce qui est montré sur les canaux 1 et 2? ». Définissez ce qui se trouve sur chaque canal lorsque vous y êtes invité. Dans cet exemple, le canal 1 est vide (type 0) et le canal 2 est blood_plasma (type 1).
- Exécutez la fonction d’analyse de diamètre sur le balayage de ligne en appelant la fonction LineScanDiam, qui ouvre une boîte pour sélectionner la zone qui correspond au diamètre dans le kymographe (Figure 5B, à gauche).
- Dessinez une boîte à l’extérieur des limites de fluorescence du kymographe qui correspond au diamètre du vaisseau.
- Traitez cette classe de données en appelant la fonction de processus afin de mesurer la pleine largeur à un demi-maximum pour le diamètre du récipient et générez un tracé(Figure 5C)avec la fonction de tracé.
- Extrayez les données sous forme de fichier csv en appelant la fonction output_data dans la fenêtre de commande. Ce fichier peut être analysé plus en détail dans un programme de statistiques.
- Exécutez l’analyse de transformation de la vitesse du radon en appelant la fonction LineScanVel, qui ouvre une boîte pour sélectionner la zone qui correspond à la vitesse RBC dans le kymographe (Figure 5B, à droite).
- Dessinez une boîte à l’intérieur de la bordure de la fluorescence du kymographe qui correspond à la vitesse du vaisseau.
- Traitez cette classe de données en appelant la fonction de processus afin de calculer la vitesse, le flux et la densité linéaire des globules rouges à partir de l’angle des stries dans la fluorescence. Générez un tracé (Figure 5D) avec la fonction de tracé.
- Extrayez les données sous forme de fichier csv en appelant la fonction output_data dans la fenêtre de commande. Ce fichier peut être analysé plus en détail dans un programme de statistiques.
REMARQUE: Les kymographes doivent avoir une fluorescence claire avec des bords bien définis entre les espaces noirs pour que l’analyse du diamètre et de la vitesse soit précise (Figure 5A, B). Il est très important de dessiner les lignes orthogonales et parallèles de manière précise, sinon une analyse fiable des kymographes ne sera pas possible. Semblable à l’analyse du calcium avec les algorithmes de traitement d’image, les paramètres pour les calculs de diamètre et de vitesse peuvent être optimisés.
Résultats
La fluorescéine-dextran a un large spectre d’émission qui peut saigner dans le canal rouge, ce qui a un impact sur la détection du RCaMP dans les péricytes ensanglantés(Figure 2A). Le démélange spectral après l’acquisition des données dans le logiciel réduit le saignement de la fluorescéine à travers (Figure 2B, plus bas), améliorant la détection du signal calcique dans les étapes d’analyse ultérieures.
L’analyse du calcium avec les algorithmes de traitement d’image utilisés dans ce protocole permet plusieurs approches différentes pour identifier les ROI et les fluctuations du calcium intracellulaire (c.-à-d. les signaux de calcium). La sélection des structures cellulaires à la main permet de détecter les fluctuations calciques à l’intérieur de ces régions (Figure 3A), y compris différents types de pics de signal, tels que les pics simples et les pics multiples, après que les traces de calcium normalisées sont filtrées passe-bas et passe-bande (Figure 3B). De plus, les ROI sont identifiés en regroupant les pixels actifs où l’intensité de fluorescence change au fil du temps à l’aide d’algorithmes de traitement d’image développés par Ellefsen et al.2014 16 et Barrett et al. 201817 (Figure 4). Cela peut être appliqué à n’importe quel signal cellulaire dynamique en ajustant le temps, le seuil et les paramètres spatiaux pour englober la taille et la forme attendues du signal. La diminution du seuil d’identification du signal révèle plus de régions d’intérêt(Figure 4B).
Des kymographes hémodynamiques brillants et clairs peuvent être analysés pour mesurer le diamètre et la vitesse des globules rouges dans les vaisseaux sanguins à proximité des péricytes envelocés (Figure 5A, B). Le diamètre est calculé à partir de la pleine largeur à la moitié maximale de la fluorescence(Figure 5C). La vitesse rbC est approchée à partir des stries faites à partir de globules rouges non étiquetés, où l’angle est entré dans une transformation du radon pour calculer la vitesse, le flux (cellules/s) et la densité linéaire (cellules/mm; Figure 5D). Les kymographes de mauvaise qualité où il y a saturation en fluorescence, mauvais rapport signal/bruit ou mouvement du champ d’imagerie (Figure 6A) créent des tracés peu fiables avec des points d’erreur (croix rouges) où les données ne peuvent pas être déterminées (Figure 6B, C). La qualité des données acquises est essentielle pour un bon résultat et suivre les étapes décrites dans ce protocole garantit de bons résultats.
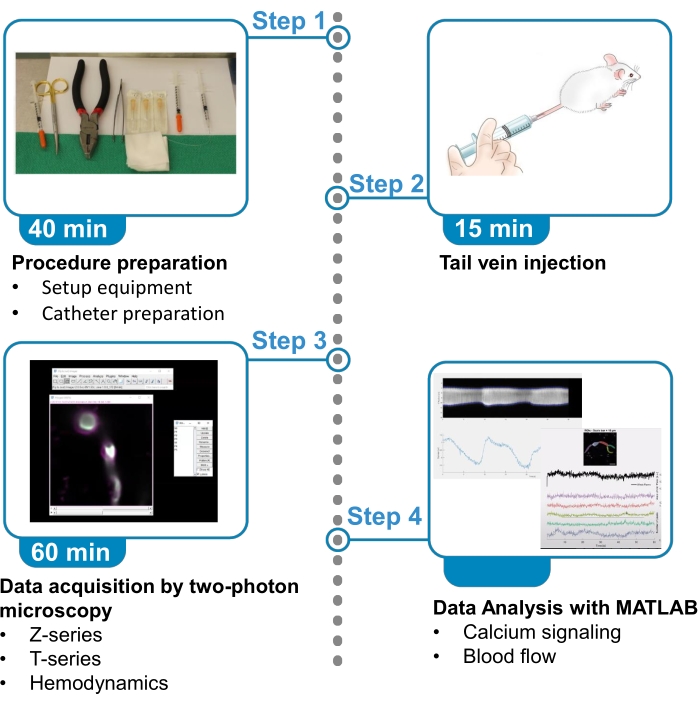
Graphique 1. Résumé du protocole. Le protocole présente les étapes à suivre pour acquérir et analyser des images fluorescentes de calcium à partir de péricytes gainant le cerveau et des données de flux sanguin provenant de vaisseaux sanguins voisins chez des souris anesthésiées. Le protocole est divisé en 4 étapes. 1) Préparation de la procédure: mise en place de l’équipement et préparation du cathéter; 2) Injection de veine caudale; 3) Acquisition de données par microscopie à deux photons; 4) Analyse de données avec des algorithmes de traitement d’images. Veuillez cliquer ici pour voir une version agrandie de cette figure.
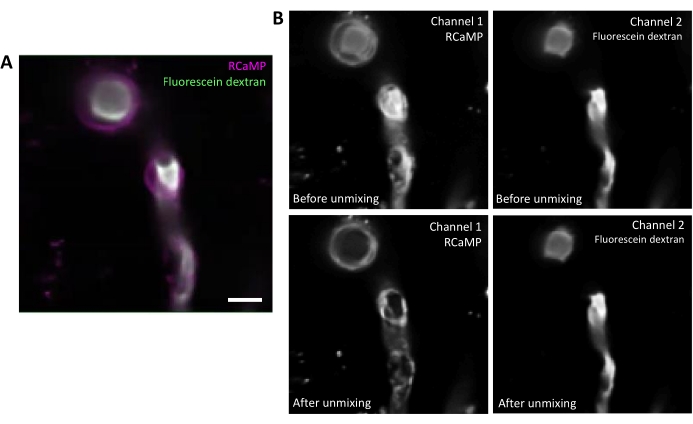
Graphique 2. Démélange spectral des fluorophores. A) Image moyenne représentative du vaisseau sanguin marqué péricyte et fluorescéine-dextran rCaMP provenant d’une acquisition de la série T. Barre d’échelle = 10 μm.B) Supérieure : Lorsque l’on considère les canaux individuels, le fond perdu du canal 2 est apparent dans le canal 1 (à gauche). Inférieur : Après le démélange spectral, le saignement est réduit et le signal du RCaMP est plus important dans la structure péricytaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
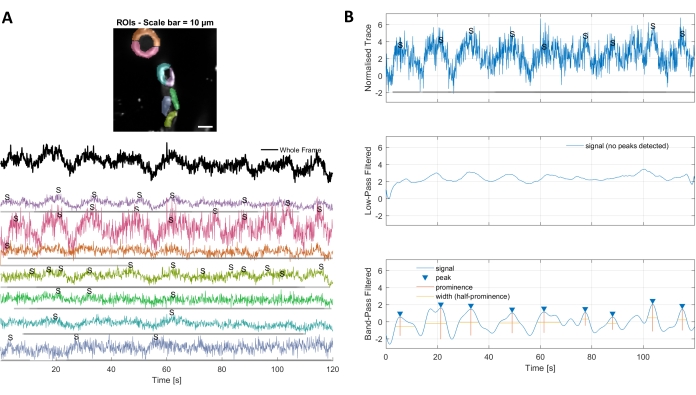
Graphique 3. Retours à la main sélectionnés et traces de calcium optimisées. A) Les régions d’intérêt sélectionnées dans le logiciel de traitement d’image utilisé (formes arc-en-ciel) peuvent être utilisées pour identifier les traces de signal de calcium. B) Les pics de signal à partir de traces normalisées sont identifiés par passage bas et passe-bande filtrant les données. Nous avons défini le seuil de signal comme 3 fois l’écart-type de la période de référence (30 premières images) et tout pic au-dessus de ce seuil a été considéré comme un signal (trace inférieure). Veuillez cliquer ici pour voir une version agrandie de cette figure.
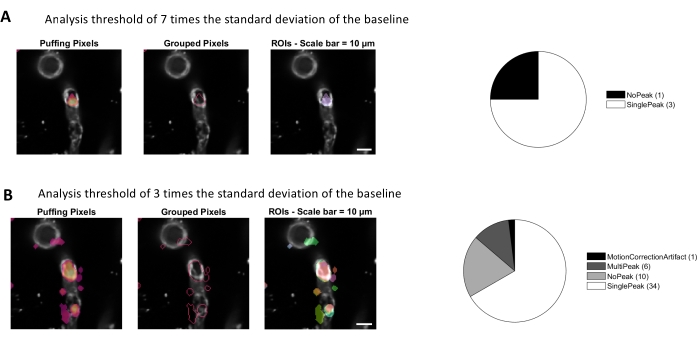
Graphique 4. Rois automatisés basés sur l’activité pour l’analyse du calcium. Les mêmes données ont été analysées avec un seuil de 7 fois l’écart-type de la ligne de base (A) et de 3 fois l’écart-type de la ligne de base (B). En diminuant le seuil d’identification des pixels actifs, on trouve plus de retour sur investissement (B) et de pics de signal (graphique à secteurs) dans les péricytes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
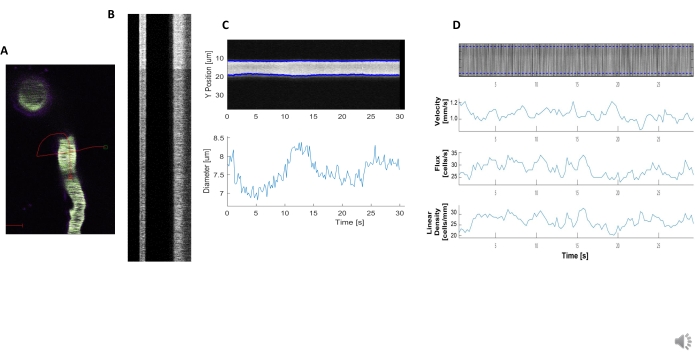
Graphique 5. Mesures hémodynamiques kymographiques. A) Exemple de balayage de ligne à travers le navire. B) Exemple de kymographes bien définis pour le diamètre (à gauche) et la vitesse (à droite). Les stries noires dans la bande de fluorescence droite correspondent à l’analyse du diamètre rbC.C) avec des fluctuations de vasomotion claires. D) Analyse de la vitesse avec des tracés pour l’axe Y = flux RBC (cellules / s), densité de ligne (cellules / mm), vitesse (mm / s) et angle de traînée (degré), rapport signal / bruit (unités arbitraires, a.u.), axe X = temps (sec). Veuillez cliquer ici pour voir une version agrandie de cette figure.
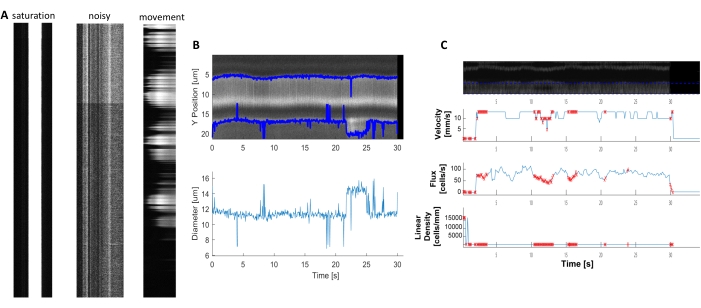
Graphique 6. Représentation de mesures hémodynamiques de mauvaise qualité. A) Exemples de kymographes de mauvaise qualité avec saturation en fluorescence, mauvais rapport signal/bruit ou mouvement du champ d’imagerie pendant l’acquisition. B et C) Graphiques similaires à la figure 7 des données de diamètre et de vitesse qui ont des points d’erreur (points rouges) en raison de la mauvaise qualité des kymographes. (image E, axe Y = diamètre (μm), axe X = temps (sec); image F, axe Y = flux RBC (cellules / s), densité de ligne (cellules / mm), vitesse (mm / s) et angle de traînée (degré), rapport signal / bruit (a.u.), axe X = temps (sec). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La présente méthode fournit des détails sur l’injection de veines de queue de souris avec un cathéter, l’acquisition d’images au microscope à deux photons pour les piles de profondeur, les films de signalisation du calcium cellulaire, la création de kymographes hémodynamiques et l’analyse du calcium et de l’hémodynamique avec nos algorithmes de traitement d’image17 (Figure 1). Ces techniques présentent plusieurs avantages qui améliorent les résultats de l’imagerie in vivo et réduisent le temps, les ressources et le stress animal pendant la séance. Tout d’abord, l’utilisation d’un cathéter pour l’injection de la veine caudale offre plus de contrôle sur l’aiguille, la seringue et la quantité de substance injectée dans la circulation de la souris. De plus, il empêche l’injection de colorant dans le tissu de la queue, ce qui permet d’économiser des réactifs coûteux. Deuxièmement, nous utilisons des souris transgéniques qui expriment des capteurs de calcium génétiquement codés dans les péricytes en enseumant et démontrent comment les localiser dans le réseau vasculaire cérébral avec une pile z de profondeur, ce qui facilite l’identification et la relocalisation des cellules lors de sessions d’imagerie ultérieures à long terme. C’est un facteur important dans les études péricytaires et assure une classification cellulaire correcte6,7. Troisièmement, nous fournissons nos paramètres pour la collecte de films de calcium et de données de balayage linéaire hémodynamique qui constituent un bon point de départ pour mesurer les signaux cellulaires dynamiques. Enfin, nous présentons nos algorithmes de traitement d’image17, une boîte à outils complète de traitement d’image qui contient plusieurs approches pour le prétraitement d’image (comme le démélange spectral), l’analyse d’image calcique et l’analyse hémodynamique (diamètre, vitesse, etc.). Ces algorithmes peuvent générer des tracés pour une visualisation rapide et facile des données, tout en minimisant le niveau d’expertise utilisateur requis pour analyser les résultats. De plus, il peut être automatisé avec quelques lignes de code pour traiter rapidement par lots plusieurs jeux de données avec les mêmes paramètres. Cela peut potentiellement améliorer la visualisation des données et l’investissement en temps du chercheur.
La clé pour collecter de bonnes données d’imagerie calcique est d’ajuster la puissance laser et les paramètres PMT pour une acquisition claire du signal de fluorescence, mais aussi de collecter des données à une fréquence d’images suffisante pour capturer l’ensemble de l’événement calcique. Les données de ce protocole ont été acquises à 10-11 images par seconde, ce qui capture les oscillations de calcium plus lentes dans les péricytes en gainant. Il existe également plusieurs étapes au cours de l’analyse qui peuvent améliorer les résultats de l’analyse. Premièrement, le démélange spectral est bénéfique s’il existe un chevauchement important entre les spectres d’émission des fluorophores(figure 2). La fluorescéine-dextran a été utilisée dans ce protocole parce qu’il s’agit d’un conjugué de dextran rentable et disponible dans le commerce qui est couramment utilisé pour les mesures hémodynamiques5. Le démélange spectral aide à nettoyer les données pour une meilleure détection des signaux calciques, mais d’autres fluorophores avec des spectres d’émission plus étroits pourraient également être utilisés. Deuxièmement, la sélection à la main des structures cellulaires en tant que ROI (Figure 3) est utile pour classer les événements calciques dans différentes régions sous-cellulaires telles que le soma ou les branches de processus. La sélection du retour sur investissement basée sur l’activité (Figure 4)16 fournit plus d’informations spatiales et temporelles sur les événements individuels du calcium. Cela peut être utile pour déterminer la fréquence des événements calciques dans une zone donnée ou la propagation des événements à d’autres zones cellulaires. L’utilisation d’un logiciel de programmation pour analyser les données d’imagerie peut faire gagner des heures aux chercheurs lorsque les données sont traitées par lots, mais cela nécessite un investissement initial en temps pour ajuster les paramètres afin d’obtenir des résultats optimaux. Les facteurs les plus importants sont la taille attendue (en μm2)de la région active ainsi que la durée du signal (le temps minimum du signal et le temps maximum du signal doivent être définis). Les chercheurs doivent d’abord examiner quelques exemples de films de la série T pour déterminer au mieux quels paramètres correspondent à leurs données. Enfin, des données de mauvaise qualité acquises au microscope peuvent grandement entraver l’analyse du calcium et de l’hémodynamique(Figure 6). Par conséquent, il faut prendre soin d’optimiser les paramètres d’acquisition du microscope au début. Avec ces facteurs à l’esprit, ce protocole peut être adapté pour s’adapter à l’imagerie calcique ou à l’analyse d’autres signaux cellulaires dynamiques (par exemple, sodium fluorescent, potassium, métabolite ou fluctuations de tension) dans d’autres tissus ou types de cellules.
Ce protocole présente plusieurs limitations. Tout d’abord, les données sont recueillies sous anesthésie, ce qui affecte l’activité cérébrale et pourrait avoir un impact sur le flux sanguin. Une imagerie similaire peut être effectuée chez des souris éveillées qui sont entraînées à accepter la fixation de la tête pour des résultats plus physiologiques. De plus, il est important de se rappeler que nous recueillons des images en 2 dimensions d’une cellule en 3 dimensions et d’un vaisseau sanguin in vivo. Par conséquent, nous ne pouvons capturer qu’une faction des événements calciques dans ces cellules ou le flux sanguin dans une seule section de vaisseau sanguin à la fois.
Une autre limite à noter est que l’imagerie calcique à deux photons est sensible aux artefacts de mouvement, où le mouvement à l’intérieur et à l’extérieur du plan focal peut être confondu avec les fluctuations du calcium. Ce protocole a été réalisé sous anesthésie, ce qui limite les mouvements de l’animal; cependant, les artefacts de mouvement peuvent être introduits par la fréquence respiratoire de la souris, la fréquence cardiaque, l’enflure possible des tissus et, dans le cas de l’enségainage des péricytes, la contraction des vaisseaux ou la vasomotion 4,6,18,19. Les artefacts de mouvement peuvent être atténués par plusieurs stratégies. Les packages de traitement d’image utilisés dans ce protocole incluent une étape de correction de mouvement en option, qui utilise un moteur de convolution 2D pour aligner les images au sein de la série T en fonction de la vascularisation visible13,17. Les images avec des changements significatifs dans le plan focal sont identifiées par cet algorithme et peuvent être exclues de l’analyse. De plus, il est possible d’utiliser des stratégies statistiques dans les packages de traitement d’imagerie, comme un Z-score lors de la génération des traces de fluorescence pour normaliser les fluctuations de calcium induites par le mouvement20. L’approche la plus robuste pour tenir compte des artefacts de mouvement dans l’imagerie à deux photons consiste à combiner l’expression de deux indicateurs fluorescents dans la même cellule, tels qu’un indicateur de calcium (par exemple, GCaMP) et un rapporteur fluorescent (par exemple, mCherry) indépendant du calcium. Les fluctuations du rapporteur fluorescent peuvent alors être attribuées au mouvement et sont soustraites du signal de l’indicateur de calcium pour normaliser les artefacts de mouvement.
Le but de ce protocole est de fournir une compréhension claire de la façon de recueillir des données optimales d’imagerie calcique et de flux sanguin in vivo et de présenter de nouvelles méthodes et de nouveaux outils d’analyse que les chercheurs peuvent mettre en œuvre afin d’améliorer leurs résultats. Ces techniques peuvent être appliquées pour étudier le rôle de différentes populations de péricytes dans le contrôle du flux sanguin ou dans différents états de maladie cérébrale. Ces paramètres d’imagerie peuvent également être utilisés pour étudier le calcium et le flux sanguin dans d’autres types de cellules et systèmes d’organes et des principes similaires s’appliquent à d’autres techniques d’imagerie dynamique rendues possibles par d’autres capteurs génétiquement codés, au-delà du calcium.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
J. Meza est soutenu par des bourses de Mitacs et de Research Manitoba. Le financement de ces travaux a été fourni par les Instituts de recherche en santé du Canada, Research Manitoba, la Manitoba Medical Service Foundation, le financement de démarrage de l’Université du Manitoba et Brain Canada par l’entremise du Fonds canadien de recherche sur le cerveau, avec le soutien financier de Santé Canada et de la Fondation Azrieli. Les opinions exprimées ici ne représentent pas nécessairement celles du ministre de la Santé ou du gouvernement du Canada.
matériels
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
Références
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -. A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -. F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a., et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402 (2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory Available from: https://www.jax.org/strain/028345 (2021)
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680 (2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297 (2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon