Method Article
생체 내 트랜스제닉 마우스의 뇌 성 구체 칼슘 및 혈역학 이미징
요약
이 프로토콜은 마취마우스에 있는 가까운 혈관에서 백혈구 및 혈류 데이터를 심신하는 두뇌에서 형광 칼슘 심상을 취득하고 분석하는 단계를 제시합니다. 이러한 기술은 벽화 세포 생리학의 연구에 유용하며 모든 세포 유형의 칼슘 과도를 조사하기 위해 적응 할 수 있습니다.
초록
단백질 생물학및 마우스 유전학에 있는 최근 어드밴스는 생체내 뇌 세포의 세포내 칼슘 변동을 측정하고 현지 혈역학과 상관관계를 가능하게 했습니다. 이 프로토콜은 만성 두개골 창으로 준비된 형질전환 마우스를 사용하고 유전적으로 인코딩된 칼슘 지표인 RCaMP1.07을 α 부드러운 근육 액틴 프로모터하에서 혈관 의 부드러운 근육 세포 및 천신 성 동맥과 같은 벽화 세포를 구체적으로 라벨링합니다. 단계는 혈액 흐름을 추적하기 위해 형광 염료의 정맥 주사를 위한 꼬리 정맥 카테터를 준비하는 방법뿐만 아니라 뇌 백혈구 칼슘 및 국부 혈관 혈역학 (직경, 적혈구 속도 등)을 측정하는 방법에 대해 설명되어 있습니다. 마지막으로, 2018년 Barrett 외에서 개발한 이미지 처리 알고리즘을 통해 칼슘 변동 및 혈류 영화의 분석을 위해 세부 사항이 제공되며, 이러한 프로세스가 다른 세포 이미징 데이터에 어떻게 적응할 수 있는지에 중점을 두고 있습니다.
서문
중추 신경계 혈관은 관통하는 동맥, 모세 혈관 및 오름차순 정맥으로 구성됩니다. 이 네트워크 내에서, 혈관 평활근 세포와 같은 벽화 세포는 제1 동맥 가지 및 모세 혈관1을따라 세포 과정을 확장한다. Pericytes는 혈액-뇌 장벽1,2,이동 및운동성3,잠재적 줄기 세포 특성 및 뇌 혈류량4,5,6의조절의 유지를 포함하여 뇌 내에서 여러 가지 역할을 갖는 것으로 보인다. pericytes의 기능적 역할의 대부분은 이들 세포의 팽창 또는 수축을 조절할 수 있는 세포내 칼슘의 변동에 연결되어4,5,6.
몇몇 최근 연구는 두뇌 pericytes7의다른 모형을 확인하기 위한 기준을설정했습니다 7,8. 관통하는 동맥의 처음 4개 가지 내의 벽화 세포는 수축 단백질 α-부드러운 근육 액틴(αSMA)과 혈관7,8,9를감싸는 공정을 통해 돌출, 오보이드 소마타의 발현에 기초하여 pericytes를 천신시키고 있다. 이 프로토콜은 천신 성 과구의 칼슘 변동을 시각화하기 위해 Tg (RP23-370F21-RCaMP1.07)B3-3Mik /J10으로알려진 새로운 형질형 마우스 라인 인 Acta2-RCaMP1.07을 사용합니다. 이 마우스는 적색 유전적으로 인코딩된 칼슘 표시기, RCaMP1.07을 αSMA 발현 세포(혈관 의 매끄러운 근육 세포 및 천신 성 동맥)에서 표현한다. 사육 식민지는 헤미지고테스와 비 캐리어 동물을 건너 유지됩니다. RCaMP1.07은 칼모둘린 결합 도메인을 가진 적색 형광 단백질로, 세포내칼슘(10)및11에결합할 때 형광을 증가시킨다. 이 프로토콜은 형광염료의 꼬리 정맥 주입, 마취 마우스의 현미경 이미지 수집, 프로그래밍 플랫폼을 사용하여 데이터 분석을 포함하여 2개의 광자 현미경 검사법에 의한 천식 성구 및 혈류 측정의 결합된 칼슘 이미징단계를 간략하게 설명합니다(그림1). 이러한 기술은 벽화 세포 생리학에 대 한 질문을 해결 하기 위해 유용 하지만 뇌 또는 다른 장기 시스템에 있는 모든 세포 모형에 칼슘 과도 를 공부 하도록 적응될 수 있다.
10개월 된 여성 Acta2-RCaMP1.07 마우스가 이 문서에서 제시된 실험에 사용되었습니다. 마우스는 만성 두개골 창 및 머리 포스트 이식 2 개월 전에 수술을 받았다. 수술 프로토콜에 대한 세부 사항은 이전 연구에서 논의된다12,13 유사한 절차는 이전에 출판 된 다른 프로토콜에서 수행되었다14,15. 혈관분기는 정맥 주사녹색 형광술-Dextran (70,000 MW, 애니온 용액, 2.5 % w /v)로 표시됩니다. 이 염료는 비용 효과적이고 상용 소스에서 쉽게 구할 수 있지만 RCaMP 방출과 겹치고 현미경 이미지 수집 중에 출혈 될 수있는 더 넓은 방출 스펙트럼을 가지고 있습니다. 스펙트럼 언믹싱을 위한 단계는 이를 우회하기 위해 아래 섹션 4에 설명되어 있지만 EGFP를 기반으로 하는 것과 같이 더 좁은 배출 스펙트럼을 가진 다른 녹색 염료도 사용될 수 있습니다.
프로토콜
아래에 설명된 실험적인 동물을 관련시키는 모든 절차는 매니토바 대학의 동물 관리 위원회에 의해 승인되었습니다, 이는 동물 관리에 캐나다 위원회에 의해 지배된다.
1. 절차 설정 및 준비
참고: 다음 항목은 꼬리 정맥 카테터 주입에 필요합니다 : 인슐린 주사기, PE10 튜브의 15cm 조각, 30 G 바늘, 거즈, 식염수, 집게, 녹색 형광염, 펜치 및 가위. 또한, 화상 진찰 세션 전에 주입될 케타민/자일라진 마취로 바늘을 준비하십시오.
중요: 1단계와 2단계의 모든 재료와 장비는 70%의 에탄올로 자동 절전 또는 헹구기 전에 소독되어야 합니다. 펜치를 제대로 살균할 수 없는 경우, 한 쌍의 큰 바늘 홀더를 사용하는 것이 좋습니다. 카테터 어셈블리는 우발적인 바늘 구멍을 피하기 위해 펜치와 집게로 수행해야합니다.
- 폴리에틸렌 튜빙, PE10 (I.D. 28mm) 약 15-20cm 를 자른다. O.D. 61 mm).
- 27 G 인슐린 주사기를 0.9% 식염수로 채우고 주사기의 바늘을 폴리에틸렌 튜브의 끝으로 레이스합니다. 튜브를 통해 식염수로 밀어 누출이 없는지 확인합니다.
- 펜치를 사용하여 허브에서 파손될 때까지 30G 바늘(0.3mm x 25mm)을 앞뒤로 구부립니다. 바늘은 굴곡없이 깨끗해야합니다.
- 바늘을 집게로 잡고, 식염수 채워진 주사기에 부착된 PE10 튜브의 끝에 바늘을 조심스럽게 삽입하고 기포를 제거합니다. 이것은 주입을위한 카테터입니다.
- 주입 전에 13-25 μm 필터를 통해 2.5 %(w /v) 형광 dextran의 30 μL을 필터링합니다.
- 또 다른 인슐린 주사기를 30 μL 알리쿼트로 채우고 채워진 주사기에 거품이 없는지 확인하십시오.
2. 꼬리 정맥 주입
- 이소플루란 (4% 유도, 1.5% 유지 보수) 또는 케타민/자일라진(60 mg/kg; 10 mg/kg; i.p.)으로 마우스를 마취시키고 눈 윤활유 젤을 바르십시오. 케타민/자일라진은 이미징 중 보다 안정적인 혈류 측정을 권장하며 용량은 90 mg/kg으로 증가할 수 있습니다. 10 mg/kg 케타민/자일라진더 긴 이미징 세션.
- 마우스가 마취의 수술 비행기에있을 때, 측면 정맥을 팽창시키기 위해 꼬리에 따뜻한 물로 가득 찬 장갑을 놓습니다.
- 30s 후에 장갑을 제거하고 에탄올로 꼬리를 청소합니다.
- 엄지손가락과 가운데 손가락 사이에 꼬리를 놓습니다. 정맥을 팽창시키기 위해 꼬리에 검지 손가락으로 압력을 제공합니다. 반면에, 천장쪽으로 베젤을 위쪽으로 방향을 향하도록 집게로 카테터의 바늘을 집어 들수 있습니다.
- 70% 에탄올로 꼬리를 청소한 후, 바늘을 0° 각도로 정맥에 넣고 카테터를 통해 식염수에 부드럽게 주입하여 바늘이 올바르게 배치되도록 합니다.
참고 : 플런저에 저항이 없고 꼬리의 붓기가없는 경우 바늘이 정맥에 있습니다. 상당한 저항 또는 붓기가있는 경우, 바늘을 제거해야합니다. 단계 2.2-2.5는 배치가 정확할 때까지 카테터의 끝에서 30G 바늘을 교체, 꼬리의 각 측면에 최대 3 회 반복 될 수있다. - 바늘이 정맥에 들어가면, 코테터 의 끝에 있는 식염수 주사기를 형광 제비(1.6단계)를 함유한 주사기로 전환한다. 천천히 카테터 튜브에 덱센을 주입하여 거품이 튜브에 들어가지 않도록 합니다. 기포가 명백한 경우 거품이 들어있는 튜브를 잘라 내어 제거하고 주사기를 다시 부착하십시오.
- 모든 dextran (30 μL 알리쿼트)를 주입하고 주사기를 제거하고 식염수 주사기로 교체하십시오. 튜브에서 남은 덱스네를 마우스에 주입하여 튜브에 염료가 남지 않도록 합니다.
- 꼬리에서 바늘을 제거하고 출혈이 멈출 때까지 10-30 s의 거즈로 압력을 제공합니다.
중요: 6번 시도 한 후 꼬리 정맥 주입이 성공하지 못하면 동물은 다른 세션에서 이미지화되어야합니다. 또한 마우스에 주입된 총 부피(식염수 및 덱센)는 100 μL을 초과해서는 안 됩니다.
3. 2 개의 광자 현미경 검사법
- 두개골 창에 집중
참고: 데이터 수집 중에 케타민/자일라진 마취를 사용하던 이유는 이소플루란보다 혈관 효과(혈관 확장)가 적기 때문입니다. 위의 단계에서 이소플루란을 사용하는 경우, 이미징 전에 케타민 /자일라진 i.p. (위에서 설명한 권장 용량)로 마우스를 주입하십시오.- 현미경 아래 가열 패드와 플랫폼에 머리 포스트를 통해 나사로 마우스를 고정합니다.
- 마우스의 눈에 눈 윤활제를 적용합니다.
- 축축한 치과 어플리케이터로 두개골 창을 청소하십시오. 이미징 프로세스를 방해할 수 있는 파티클이 남아 있지 않은지 확인합니다.
- 창에 초음파 젤을 바하십시오.
- 피알 혈관창 밑에서 볼 수 있을 때까지 2광자 현미경 목표를 통해 집중한다.
- 마우스의 호흡을 확인하고 가열 패드가 충분한 온도 지원을 제공하고 있는지 확인합니다.
- 이미지 수집
참고 : 이 실험에 사용되는 두 광자 현미경은 샘플에 도달하는 레이저의 양을 제어하는 Pockel 세포와 형광 흥분을위한 튜닝 Ti-사파이어 레이저가 있습니다. 방출된 빛은 595/50 대역 패스 필터(빨간색) 및 525/70 대역 패스 필터(green)가 있는 2개의 GaAsP 광증 튜브(PMT)로 565개의 긴 패스 이크로닉으로 분할됩니다.
3.2 ~ 3.4 단계에 설명된 절차는 이 프로토콜에서 2광자 현미경의 특정 소프트웨어를 사용하여 수행됩니다(재료표참조). 이러한 단계는 다른 현미경 소프트웨어 및 장비에 맞게 조정할 수 있습니다.- 방 조명이 꺼지면 현미경 소프트웨어의 원하는 파장을 990 nm로 설정하여 2-P 레이저 상자를 클릭하여 RCaMP와 형광술-엑스트라를 흥분시킵니다.
- 파워/게인 박스/레이저 섹션을 클릭하고 Pockels 1 셀 전압을 30% 또는 1000의 척도에서 300값으로 조정하여 레이저 전원을 설정합니다. 이 설정에서 샘플에 도달하는 레이저 전력은 이전에 ~30mW로 결정되었다.
- 전원/게인 박스/PMT 섹션을 클릭하고 값을 700-800으로 조정하여 PMT 검출기 감도를설정합니다.
참고: 이러한 값은 형광 시료의 강도에 따라 조정할 수 있으며 실내의 조명을 켜기 전에 0으로 설정해야 합니다. - 이미지 해상도 섹션으로 이동하여 512 x 512 해상도를 클릭하여 이미지 크기를 크게 조정합니다.
- 2-P 레이저를클릭 / 2-P 레이저 셔터를 엽니다.
- 스캐닝 섹션으로 이동하여 라이브 스캔 버튼을 클릭합니다.
참고: 이러한 매개 변수와 더 높은 해상도의 라이브 스캐닝, RCaMP 양성 벽화 세포 및 형광 표기 혈장등이 볼 수 있습니다. 신호가 약하면 그림이 명확해질 때까지 포크값값을 늘릴 수 있습니다.
중요: 피상적 조직 층에서 레이저 전력은 이 예에서 Pockels 세포 설정에서 약 600인 50mW를 초과해서는 안 됩니다.
- 벽화 셀 및 혈관 네트워크의 깊이 스택 획득
참고: 심도 스택을 획득하여 혈관 네트워크에서 pericytes를 올바르게 찾는 것이 좋습니다. 천시 퍼리사이클은 관통하는동맥7,8,9로부터1~4분기에 위치한다. 이 프로토콜에 사용되는 현미경 소프트웨어는 깊이 스택을 "Z 시리즈"로 지칭합니다.- X, Y 및 Z 평면에서 현미경 목표를 이동, RCaMP의 부드러운 근육 세포 라벨에 따라 뇌의 표면에 큰 동맥을 국소화.
- Z 시리즈 상자를 클릭합니다.
- 피알 혈관 근처의 조직의 상단에 초점을 맞추고, 현재 Z 계열/ 시작 위치 [μm] 섹션을 클릭하여 Z 시리즈 스택의 0점 및 상단으로 설정합니다. 상단에 네 개의 검은 줄무늬와 하나의 빨간색 줄무늬와 상자를 클릭합니다.
- 조직에서 원하는 깊이로 초점을 맞추고 현재 Z 계열/정지 위치 [μm] 섹션을 클릭하여 스택의 바닥으로 설정합니다. 네 개의 검은 줄무늬와 하단에 하나의 빨간색 줄무늬와 상자를 클릭합니다.
- "단계크기"버튼 아래 상자에 원하는 값을 입력하여 각 이미지 평면(스텝 사이즈)의 두께(스텝 사이즈)를 1-2 μm로 설정합니다(단계크기 버튼은 Z 시리즈/현재 Z 계열 섹션으로국한되어 있음). 이렇게 하면 스택에서 획득한 사진 수가 정의됩니다.
- 레이저/PMT 보정 상자를 클릭하고 상대(지수 그라데이션)를선택하여 현미경이 스택을 통해 더 깊어짐에 따라 레이저 전력을 기하급수적으로 증가시면 더욱 증가합니다.
- 파일 이름을 지정하고 저장하려면 폴더를 선택하고 Z 시리즈 시작을 클릭합니다.
- 인수 후 이미징 처리 소프트웨어에서 Z 시리즈를 엽니다.
- 두 채널을 컬러 이미지로 병합하고 상자 이미지를 클릭하여 관심있는 pericytes 및 혈관을 찾는 스택을 스캔합니다 | 색상 | 분할 채널; 이미지 | 색상 | 채널을 병합합니다.
- pericytes를 포함하는 관심 영역(ROI)을 선택하고 향후 이미징 세션에서 이러한 반점을 다시 찾는 데 도움이 되는 위치를 저장합니다.
- T 시리즈 칼슘 이미징 영화 습득 (시간)
- 위에서 온 깊이 스택 및 ROI를 참조로 사용하여, 관심의 pericyte가 발견 될 때까지 라이브 스캔 모드에서 X, Y 및 Z 축에서 현미경 목표를 이동합니다.
- 회낭 칼슘 이벤트의 동영상을 수집하려면 이미지 해상도 섹션으로 이동하여 128x128 상자를 클릭하여 획득 프레임 속도(초당 >10 프레임)를 늘립니다.
- T 시리즈 상자를 클릭하고 지속 시간 상자에 시간을 입력하여 이미징 기간을 60으로 설정합니다.
- 경로 저장 상자 옆에 는 세 개의 점으로 단추를 클릭하여 고유한 파일 이름으로 저장 경로를 업데이트합니다.
- 용기에 광학적으로 줌을 하여 낮은 해상도를 고려하고 광학 줌[mag] 섹션에서 값을 조정하여 pericyte를 더 자세히 볼 수 있습니다.
- 시작 T 시리즈를 클릭하여 T 시리즈를획득합니다.
- 키모그래프를 가진 혈역학 측정 (라인 스캔)
- 라이브 스캔 모드에서 512 x 512픽셀 해상도로 관심 있는 용기에 집중하십시오.
- 혈관 직경과 적혈구 속도를 측정하려면 라인 스캔을 클릭하여 현미경으로 1차원 검사를 시작합니다.
- 스캔 기간(30-60s)을 밀리초 단위로 설정합니다.
- 관심있는 선박을 양분하고 선박을 따라 평행하게 움직이는 선을 그립니다. 이것은 왼쪽에 혈관 직경의 kymograph를 생성하고 오른쪽에있는 혈관을 통해 이동하는 적혈구의 줄무늬.
참고: 여러 혈관은 동일한 이미징 평면에 있는 한 동일한 선으로 측정할 수 있습니다. - 파일이름을 지정하고 시작 Linescan(들)을 클릭하여 데이터를 수집합니다.
4. 이미지 분석
- 칼슘 영화 분석.
참고: 이 프로토콜은 스펙트럼 해제 단계를 간략하게 설명합니다.그림 2) 및 수동, 손으로 선택한 ROI를 사용하여 열성 회화물 칼슘 이벤트를 분석하는 두 가지 방법 (그림 3) 및 자동화된 활동 기반 ROI 선택 (그림 4)16,17. 각 ROI의 정규화된 칼슘 트레이스를 사용하여 신호 피크를 감지하고 분류하기 위해 데이터는 진폭 및 폭 추정에 대한 데이터를 원활하게 하고 또한 다른 모양의 피크를 식별하는 데 도움이 되는 긴 패스 및 대역 패스 필터링됩니다.그림 3B). 이 해석의 매개 변수는 다양한 유형의 동적 셀룰러 신호를 감지하도록 최적화할 수 있습니다. 아래 단계는 위에서 언급한 대로 칼슘 영화를 분석하기 위해 서로 다른 코드를 포함하는 이미지 처리 패키지가 있는 이미지 프로세싱 소프트웨어 및 프로그래밍 소프트웨어를 사용해야 합니다. 이 프로토콜에 사용되는 프로그램 및 패키지의 전체 목록은 재질 테이블을 참조하십시오. 다양한 유형의 현미경에서 이미징 데이터를 이미지에서 메타데이터를 유지 관리하는 이러한 패키지로 가져올 수 있습니다.
참고: 4.1.1-4.1.7 단계는 수동 칼슘 분석 방법(4.1.16 단계)에서 후속 사용을 위해 이미지 처리 소프트웨어에서 손으로 ROI를 선택하는 방법을 설명합니다.- .xml 파일을 소프트웨어 도구 모음으로 드래그하여 이미지 처리 소프트웨어에서 칼슘 이미징 T 계열을 로드합니다. 확인 상자를 클릭합니다.
- 스택의 평균을 가져 가라 (스택의 평균은 이미지 처리 소프트웨어에 의해"Z 프로젝션"으로표시됩니다). 이 작업은 이미지 | 클릭하여 수행할 수 있습니다. 스택 | 공구 막대의 Z 프로젝션.
- 단계 3.3.9와 같이 두 채널에서 컬러 이미지를 만듭니다.
- 상자 분석 | 클릭하여 ROI 관리자 창을 엽니다. 도구 | ROI 관리자,또는 단순히 키보드에 문자"T"를누르십시오.
- 이미지 처리 소프트웨어 도구 모음의 다각형 모양을 클릭하여 다각형 도구를 선택하고 소마 및 프로세스와 같은 눈에 보이는 천신 페리시테 구조를 간략하게 설명합니다.
- ROI 관리자 창에 있는 추가 버튼을 클릭하여 ROI 관리자에 선택한 ROI를 추가합니다.
- 각 관심 영역에 이름 바꾸기 단추를 클릭하여 고유한 이름을 지정하고 나중에 프로그래밍 소프트웨어에서 로드할 수 있는 zip 폴더로 저장합니다>> | 저장합니다.
참고: 단계 4.1.8-4.14 프로그래밍 플랫폼으로 칼슘 T 시리즈를 가져오는 방법과 현미경 PMT에 의해 검출된 다른 형광을 다른 채널로 혼합하는 방법을설명한다(그림 2). - 프로그래밍 소프트웨어를 열고 이미지 처리 패키지의 폴더가 경로에 있는지 확인합니다(재료 표참조).
- 자동으로 파일 선택 창을 여는 프로그래밍 플랫폼 명령 창에서 BioFormats 함수를 호출하여 칼슘 T 시리즈를 프로그래밍 소프트웨어로 가져옵니다.
- 원하는 숫자를 입력하여 각 채널의 내용을 정의합니다. 이 예제 데이터에서 채널 1 답변 =6 (cellular_signal), 채널 2 답변 =1 (blood_plasma).
- 플롯 함수를 호출하여 시각화를 용이하게 하기 위해 프로그래밍 소프트웨어 내에서 데이터를 동영상으로 플롯합니다.
- 빨간색 RCaMP 채널로 흘러 들어가는 형광-dextran에서 녹색 형광을 제거하기 위해 프로그래밍 플랫폼 명령 창에서 unmix_chs 함수를 호출하여 이미지 처리 패키지의 채널을 분리합니다.
- 이 경우 RCaMP와 같이 채널 1에서 이 형광에서만 형광이 포함된 영역을 선택합니다.
- 이 예에서 혈장 내형과 같은 형광 2로부터형광만 함유된 영역을 선택한다.
- 형광중 하나에서 형광이 없는 배경 영역을 선택합니다. 이렇게 하면 각 채널의 각 픽셀에 적용되는 스펙트럼 기여 매트릭스가 생성됩니다. 이러한 구조에서 칼슘 사건의 검출을 향상시키는 RCaMP 신호의 국소화를 크게 향상시킵니다.
참고: 위에서 언급했듯이, 화상 처리 패키지 내에서 칼슘 이미징 데이터를 분석할 수 있는 여러 가지 방법이 있습니다. 단계 4.16-4.1.23 수동, 손으로 선택한 ROI를 사용하여 ensheas pericyte 칼슘 이벤트를 분석하는 방법을 설명합니다. - 프로그래밍 플랫폼 명령 창에서 CellScan 기능을 호출하여 혼합되지 않은 칼슘 동영상에서 셀룰러 신호 분석을 실행합니다.
- 코드는 "어떤 ROI 감지 방법을 사용하시겠습니까?"라고 묻습니다. 숫자 2를 입력하여 손으로 선택한 ROI를 프로그래밍 플랫폼에 로드합니다.
- 이전(4.1.6 단계)을 손으로 대낭에서 선택한 지퍼 폴더에서 관심 영역을 로드합니다.
- 코드는 "배율 계수가 무엇입니까?"라고 묻습니다. 분석 중인 이미지 계열을 기준으로 손으로 선택한 ROI의 배율 계수를 결정하고 배율 수를 입력합니다. 이 예에서 스케일 계수는 원래 칼슘 영화와 동일한 해상도인 128x128 픽셀을 가진 이미지에서 ROI를 선택했기 때문에 크기를 조정할 필요가 없기 때문에 1입니다.
- 각 ROI및 정규화된 칼슘 흔적의 플롯을 다른색상(도 3A)으로생성하여 명령 창에서 공정 및 플롯 기능을 호출합니다.
- 코드가 개별 추적에서 칼슘 이벤트의 대부분을 감지하지 않는 경우, opt_config 함수를 호출하고 T 시리즈의 처음 30 프레임인 기준 기간의 표준 편차인 단축 패스 필터링 데이터에 대한 임계값을 3배로 줄이는 등의 값을 조정하여 구성 최적화 상자 내에서 기본 제공 매개변수를 수정합니다.
- 최적화 상자에서 프로세스 단추를 선택하여 새 매개 변수를 적용합니다.
참고: 신호를 감지하고 분류하기 위해 정규화된 칼슘 트레이스는 긴 패스와 대역 패스가 필터링되어 진폭 및 폭 추정에 대한 데이터를 원활하게 할 수 있지만 신호가 단일 피크인지, 다중 피크 또는 고원(그림3B)인지를 결정하는 데 도움이 됩니다. - 데이터를 관심 영역및 명령 창에서 output_data 함수를 호출하여 식별된 피크에 대한 공간 정보가 포함된 .csv 파일로 출력합니다. 통계 프로그램에서 추가 분석을 위해 파일에 고유한 이름을 지정합니다.
참고: 단계 4.1.24-4.1.31 활성 기반 ROI의 분석을 사용하여 열화 회혈 칼슘 이벤트를 분석하는 방법을 설명합니다. - 4.1.8.-4.16 단계를 반복하여 칼슘 영화를 가져오고 채널을 혼합해제하고 프로그래밍 플랫폼에서 CellScan 기능을 호출합니다.
- 코드는 "어떤 ROI 감지 방법을 사용하시겠습니까?"라고 묻습니다. 숫자 6을 입력하여 3차원(x, y, 및 시간)으로 형광의 활동 및 변화에 따라 자동 이자 식별 영역을 선택합니다. "3D FLIKA 알고리즘").
- 처리된 결과를 플롯하여 명령 창에서 프로세스 및 플롯 함수를 호출하여 식별된 관심 영역을 다른 색상으로 봅니다. 각 ROI는 시간과 공간에서 구별되며 오버레이마스크(그림 4)로표현됩니다.
- 알고리즘이 눈으로 명확하게 보이는 ROI를 감지하지 못하는 경우, opt_config 함수를 호출하고 데이터를 제시간에 부드럽게 하는 가제 필터를 증가시키고 기준선의 표준 편차의 3배로 ROI를 찾는 임계값을 줄이는 등의 값을 조정하여 최적화 상자 내에서 내장된 매개변수를 수정합니다.
- 최적화 상자에서 프로세스 버튼을 선택하여 새 매개 변수를 적용합니다. 최적화 프로세스를 사용하면 더 많은 ROI를 식별해야합니다(그림 4B).
- ROI를 동영상으로 플롯하여 기본 상자의 모드를 최적화 창 내에서 영화로 변경하여 활동 영역(무지개 색으로 설명)을 명확하게 식별하여 추가 시각화를 위해 합니다.
- 명령 창에서 output_data 함수를 호출하여 데이터를 csv 파일로 출력합니다. 이 파일은 통계 프로그램에서 더 분석할 수 있습니다.
참고: 분석 매개 변수는 모든 유형의 동적 세포 신호(칼슘, FRET 비율 등)에 맞게 조정할 수 있습니다. 위의 모든 단계는 동일한 설정으로 많은 칼슘 영화를 일괄 처리하기 위해 간단한 프로그래밍 코드로 자동화 할 수 있습니다.
- 라인 스캔 혈류 분석.
- 섹션 3.5에서 획득한 라인 스캔 kymograph 데이터 파일을 프로그래밍 소프트웨어로 가져옵니다.
- 코드는 "채널 1과 2에 표시되는 내용"을 묻습니다. 메시지가 표시될 때 각 채널의 내용을 정의합니다. 이 예제에서는 채널 1이 비어 있고(유형 0)채널 2는 blood_plasma(유형 1)입니다.
- 라인 스캔에서 직경 분석 기능을 실행하여 라인 스캔을 실행하여 상자를 열어 kymograph의 직경에 해당하는 영역을 선택합니다(그림5B,왼쪽).
- 혈관 직경에 해당하는 키모그래프 형광 경계 외부에 상자를 그립니다.
- 이 데이터 클래스는 혈관 직경의 절반 최대에서 전체 폭을 측정하고 플롯 함수를 사용하여 플롯(그림5C)을생성하기 위해 공정 함수를 호출하여 처리합니다.
- 명령 창에서 output_data 함수를 호출하여 데이터를 csv 파일로 출력합니다. 이 파일은 통계 프로그램에서 더 분석할 수 있습니다.
- [그림5B,오른쪽]에서RBC 속도에 해당하는 영역을 선택하는 상자를 여는 LineScanVel 함수를 호출하여 속도 라돈 변환 분석을 실행합니다.
- 혈관 속도에 해당하는 키모그래프 형광의 테두리 안쪽에 상자를 그립니다.
- 형광의 줄무늬 각도에서 적혈구의 속도, 플럭스 및 선형 밀도를 계산하기 위해 공정 함수를 호출하여 이 데이터 클래스를 처리합니다. 플롯 함수를 통해플롯(도 5D)을생성합니다.
- 명령 창에서 output_data 함수를 호출하여 데이터를 csv 파일로 출력합니다. 이 파일은 통계 프로그램에서 더 분석할 수 있습니다.
참고: 경질 및 속도 분석이 정확하기 위해서는 검은 색 공간 사이에 잘 정의된 가장자리가 있는 명확한 형광이 있어야합니다(그림 5A,B). 정확한 방식으로 직교 및 평행선을 그리는 것이 매우 중요하며, 그렇지 않으면 kymographs의 신뢰할 수있는 분석이 불가능합니다. 이미지 처리 알고리즘을 사용하여 칼슘 분석과 마찬가지로 직경 및 속도 계산을 위한 매개 변수를 최적화할 수 있습니다.
결과
플루오레세인-엑스트라른은 적색 채널로 출혈할 수 있는 광범위한 방출 스펙트럼을 가지며, 광신백세포(그림2A)에서RCaMP 검출에 영향을 미친다. 소프트웨어 프로그램에서 데이터 수집 후 스펙트럼 혼합해제(도 2B,하음)를 통해 형광출혈을 감소시키고, 후속 분석 단계에서 칼슘 신호 검출을 강화한다.
이 프로토콜에 사용되는 이미지 처리 알고리즘을 사용한 칼슘 분석은 ROI 및 세포내 칼슘 변동(즉, 칼슘 신호)을 식별하는 여러 가지 접근 방식을 허용합니다. 손으로 세포 구조를 선택하면 단일 피크 및 다중피크와 같은 다양한 유형의 신호 피크를 포함하여 이들 영역 내의 칼슘 변동을 검출할 수 있으며, 정규화된 칼슘 흔적이 낮은 패스 및 대역 통과 필터링(도3B)이허용된다. 또한, ROI는 Ellefsen 외. 201416 및 Barrett 외. 201817(그림 4)에의해 개발된 이미지 처리 알고리즘을 사용하여 시간이 지남에 따라 형광 강도가 변하는 활성 픽셀을 함께 그룹화하여 식별된다. 이는 신호의 예상 크기와 모양을 포괄하는 시간, 임계값 및 공간 파라미터를 조정하여 동적 셀룰러 신호에 적용될 수 있다. 신호 식별임계값을 낮추면 관심 영역이 더 많이 발견됩니다(그림4B).
밝고 명확한 혈역학 키모그래프는 심히 하는 백혈구 근처의 혈관에서 직경 및 RBC 속도를 측정하도록 분석할 수있다(도 5A,B). 직경은 전체 폭에서 형광(도5C)의절반 최대값으로 계산됩니다. RBC 속도는 라벨이 없는 RbC로 만들어진 줄무늬로부터 근사되며, 각도는 라돈 변환으로 입력되어 속도, 플럭스(cells/s) 및 선형 밀도(cells/mm; 그림 5D). 형광 포화도가 떨어지는 저품질 키모그래프, 이미징 필드의 노이즈 비 또는 이동에 대한 신호불량(도 6A)은데이터를 확인할 수 없는 오류 점(적십자)을 사용하여 신뢰할 수 없는 플롯을 생성한다(도6B,C). 획득된 데이터의 품질은 좋은 결과에 중요하며 이 프로토콜에 설명된 단계를 따라 하면 좋은 결과를 얻을 수 있습니다.
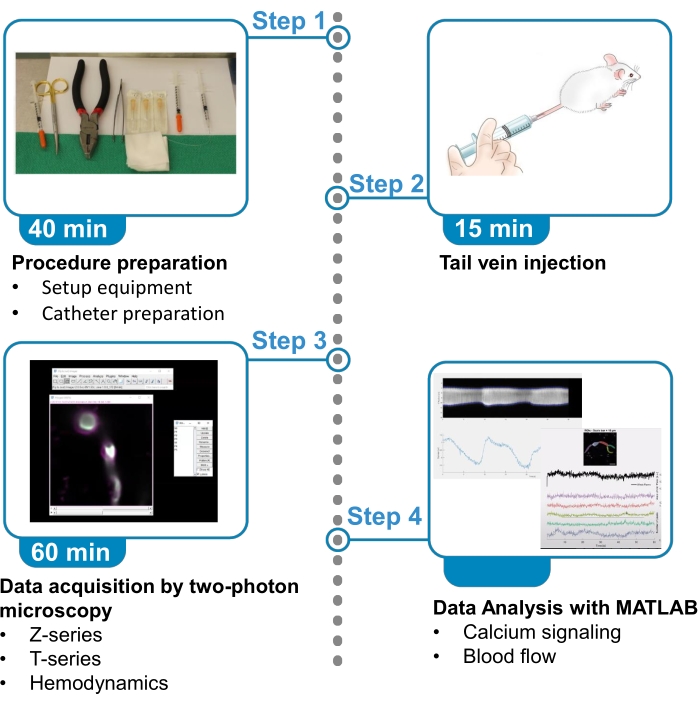
그림 1. 프로토콜 요약입니다. 이 프로토콜은 마취된 마우스에서 인근 혈관에서 뇌천면 과낭 및 혈류 데이터로부터 형광 칼슘 이미지를 획득하고 분석하는 단계를 제시합니다. 프로토콜은 4단계로 나뉩니다. 1) 절차 준비 : 장비 및 카테터 준비의 설정; 2) 꼬리 정맥 주입; 3) 2광자 현미경 검사법에 의한 데이터 수집; 4) 이미지 처리 알고리즘을 사용하여 데이터 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
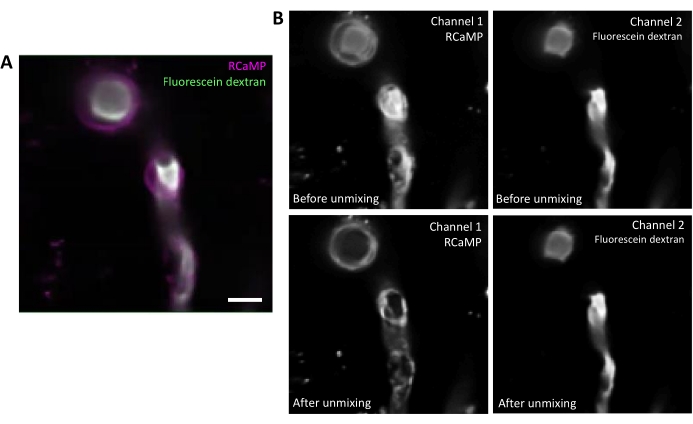
그림 2. 형광의 스펙트럼 혼합. A) T 시리즈 인수에서 RCaMP ensheathing pericyte 및 플루오레세인-dextran 라벨 혈관의 대표적인 평균 이미지. 배율 막대 = 10 μm.B) 어퍼: 개별 채널을 고려할 때 채널 2의 출혈이 채널 1(왼쪽)에서 명백합니다. 아래쪽: 스펙트럼 해제 후 출혈이 감소하고 RCaMP의 신호가 회낭 구조에서 더 두드러집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
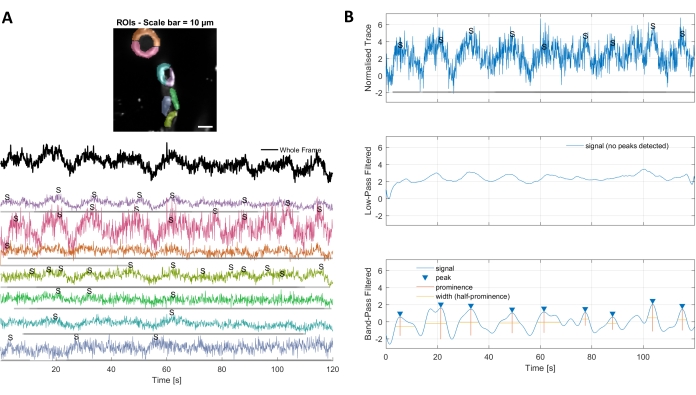
그림 3. 손으로 선택한 ROI와 최적화된 칼슘 흔적. A) 사용된 이미지 처리 소프트웨어(무지개 모양)에서 선택된 관심 영역을 사용하여 칼슘 신호 추적을 식별할 수 있다. B) 정규화된 추적의 신호 피크는 데이터를 필터링하는 로우 패스 및 대역 패스로 식별됩니다. 신호 임계값을 기준 기간(처음 30프레임)의 표준 편차의 3배로 정의했으며 이 임계값을 초과한 피크는 신호(낮은 추적)로 간주되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
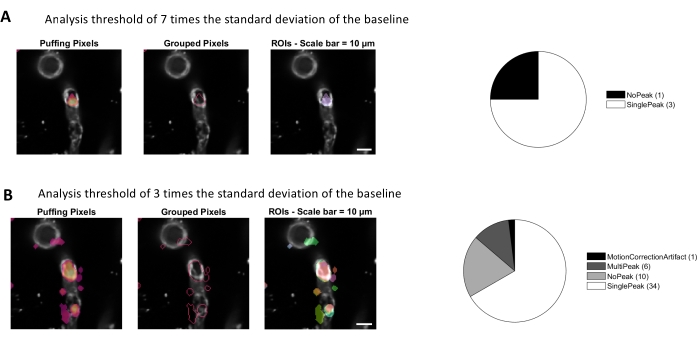
그림 4. 칼슘 분석을 위한 자동화된 활동 기반 ROI. 동일한 데이터는 기준선(A)의 표준 편차의 7배, 기준선(B)의 표준 편차의 3배에 달하는 임계값으로 분석하였다. 활성 픽셀을 식별하기 위한 임계값을 줄이면 pericytes 내에서 더 많은 ROI(B) 및 신호 피크(원형 차트)가 발견됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
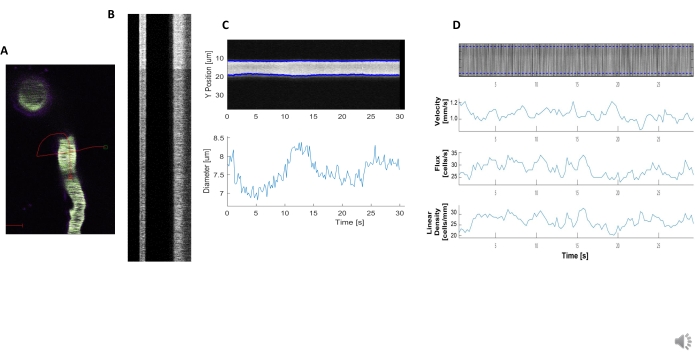
그림 5. 키모그래프 혈역학 측정. A) 예를 들어 선박을 통해 스캔합니다. B) 직경(왼쪽) 및 속도(오른쪽)에 대해 잘 정의된 키모그래프의 예입니다. 형광의 오른쪽 밴드 내의 검은 줄무늬는 명확한 혈관 운동 변동과 RbC.C) 직경 해석에 해당합니다. D) Y축= RBC 플럭스(셀/s), 라인 밀도(셀/mm), 속도(mm/s), 줄무늬 각도(도), 신호 대 잡음 비율(임의 단위, a.u.), X 축=시간(초)에 대한 플롯을 사용하여 속도 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
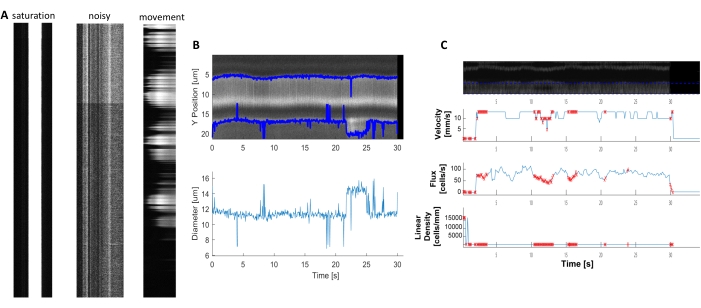
그림 6. 품질이 좋지 는 혈역학 측정을 표현합니다. A) 형광 포화, 낮은 신호 대 잡음 비 또는 습득 중 이미징 필드의 움직임을 가진 열악한 품질의 키모그래프의 예. B와 C) 키모그래프의 품질이 좋지 않아 오류점(적점)이 있는 직경 및 속도 데이터의 그림 7과 유사한 플롯을 그립니다. (이미지 E, Y 축=직경(μm), X 축=시간(초), 이미지 F, Y 축= RBC 플럭스(셀/s), 라인 밀도(셀/mm), 속도(mm/s), 그리고 줄무늬 각도(도), 신호 대 노이즈 비(a.u.), X 축=시간(초). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 방법은 깊이 스택을 위한 카테터, 2광자 현미경 이미지 수집, 세포 칼슘 신호 영상 생성, 혈역학 키모그래프 생성, 당사의 이미지 처리알고리즘(그림 1)을 이용한 칼슘 및 혈역학 분석을 통해 마우스 꼬리 정맥 주입에 대한 세부 정보를 제공한다(그림 1). 이러한 기술에는 생체 내 이미징 결과를 개선하고 세션 중에 시간, 자원 및 동물 스트레스를 줄이는 몇 가지 장점이 있습니다. 첫째, 꼬리 정맥 주입을 위한 카테터의 사용은 바늘, 주사기 및 마우스의 순환에 주입된 물질의 양을 더 많은 제어를 제공합니다. 또한, 그것은 꼬리 조직에 염료 주입을 방지, 비싼 시약을 절약. 둘째, 우리는 회신 백혈구에 유전으로 인코딩 된 칼슘 센서를 발현하는 트랜스 제닉 마우스를 사용하고 후속 이미징 세션에서 세포 식별 및 이전을 용이하게하는 깊이 z-스택으로 뇌 혈관 네트워크 내에서 국한하는 방법을 보여줍니다. 이것은 pericyte 연구 결과에 있는 중요한 요인이고 적당한 세포분류를6,7를보장합니다. 셋째, 당사는 동적 세포 신호를 측정하기 위한 좋은 출발점인 칼슘 영화와 혈역학 적 선 스캔 데이터를 수집하기 위한 매개 변수를 제공합니다. 마지막으로 이미지 사전 처리(스펙트럼 언믹싱), 칼슘 이미지 분석 및 혈역학 분석(직경, 속도 등)을 위한 여러 가지 접근 방식을 포함하는 포괄적인 이미지 처리 툴박스인 이미지 처리알고리즘(17)을소개합니다. 이러한 알고리즘은 데이터를 빠르고 쉽게 시각화할 수 있도록 플롯을 생성하는 동시에 결과를 분석하는 데 필요한 사용자 전문 지식 수준을 최소화할 수 있습니다. 또한 몇 줄의 코드로 자동화하여 동일한 매개 변수로 여러 데이터 집합을 신속하게 일괄 처리할 수 있습니다. 이를 통해 데이터 시각화와 연구원의 시간 투자를 잠재적으로 향상시킬 수 있습니다.
좋은 칼슘 이미징 데이터를 수집하는 열쇠는 명확한 형광 신호 수집을 위해 레이저 전력 및 PMT 설정을 조정하는 것이지만 전체 칼슘 이벤트를 캡처하기에 충분한 프레임 속도로 데이터를 수집하는 것입니다. 이 프로토콜의 데이터는 초당 10-11 프레임으로 획득되었으며, 이는 흡입 백혈구에서 느린 칼슘 진동을 포착합니다. 분석 중에 분석 결과를 개선할 수 있는 몇 가지 단계도 있습니다. 첫째, 스펙트럼 언믹싱은 형광의 방출 스펙트럼 사이에 상당한 중첩이 있는 경우 유익하다(도2). 플루오레세인-엑스트라넨은 혈역학측정에일반적으로 사용되는 비용 효율적이고 시판되는 dextran 컨쥬게이트이기 때문에 이 프로토콜에 사용되었다. 스펙트럼 언믹스는 칼슘 신호의 향상된 검출을 위한 데이터를 정리하는 것을 돕습니다, 그러나 더 좁은 방출 스펙트럼을 가진 대체 형광은 또한 사용될 수 있었습니다. 둘째, ROI(도3)로세포 구조를 직접 선택하는 것은 소마 또는 공정 분기와 같은 상이한 세포 영역에서 칼슘 이벤트를 분류하는 데 유용하다. 활동 기반 ROI 선택(그림 4)16개별 칼슘 이벤트에 대한 보다 많은 공간 및 측량 정보를 제공한다. 이것은 주어진 지역에 있는 칼슘 사건의 빈도 또는 그밖 세포 지역에 사건의 전파를 결정할 때 도움이 될 수 있습니다. 이미징 데이터를 분석하기 위해 프로그래밍 소프트웨어를 사용하면 데이터가 일괄 처리될 때 연구원의 시간을 절약할 수 있지만 최적의 결과를 위해 매개 변수를 조정하려면 초기 시간 투자가 필요합니다. 가장 중요한 요소는 활성 영역의 예상 크기(μm2)와신호의 지속 시간(최소 신호 시간 및 최대 신호 시간을 정의해야 합니다)입니다. 연구원은 데이터에 맞는 매개 변수를 가장 잘 결정하기 위해 먼저 몇 가지 예 T 시리즈 영화를 검사해야합니다. 마지막으로, 현미경에서 획득한 품질이 좋지 않는 데이터는 칼슘 및 혈역학의 분석을 크게 방해할 수있습니다(그림 6). 따라서, 초기에 현미경 획득 설정을 최적화하기 위해주의를 기울여야 한다. 이러한 요인을 염두에 두고, 다른 조직 또는 세포 유형에서 다른 동적 세포 신호(예: 형광나트륨, 칼륨, 대사 산물 또는 전압 변동)의 칼슘 이미징 또는 분석에 맞게 조정할 수 있는 이 프로토콜.
이 프로토콜에는 몇 가지 제한 사항이 있습니다. 첫째, 데이터는 뇌 활동에 영향을 미치고 혈류에 영향을 미칠 수있는 마취 하에 수집됩니다. 유사한 화상 진찰은 더 생리적인 결과를 위한 머리 고정을 받아들이기 위하여 훈련된 깨어 있는 마우스에서 행해질 수 있습니다. 또한 생체 내에서3차원 세포및 혈관의 2차원 이미지를 수집한다는 것을 기억하는 것이 중요합니다. 따라서, 우리는 한 번에 혈관의 단일 단면에 있는 이 세포 또는 혈류 내의 칼슘 사건의 파벌을 포착할 수 있습니다.
주목할 또 다른 제한사항은 2광자 칼슘 이미징이 초점 비행기 안팎의 움직임이 칼슘 변동으로 오인될 수 있는 모션 아티팩트에 민감하다는 것입니다. 이 프로토콜은 동물의 움직임을 제한하는 마취 하에 수행되었습니다. 그러나, 모션 아티팩트는 마우스의 호흡 속도, 심박수, 가능한 조직 부종, 및 복신의 경우, 혈관 수축 또는 혈관 수축 4,6,18,19에의해 도입될 수 있다. 모션 아티팩트는 여러 전략에 의해 완화될 수 있습니다. 이 프로토콜에 사용되는 이미지 프로세싱 패키지에는 2D 컨볼루션 엔진을 사용하여 보이는혈관(13,17)을기반으로 T 시리즈 내의 이미지를 정렬하는 선택적 모션 보정 단계가 포함됩니다. 초점 평면에 중요한 변화가 있는 프레임은 이 알고리즘에 의해 식별되며 분석에서 제외될 수 있습니다. 또한, 형광 흔적을 생성할 때 Z-점수와 같은 이미징 처리 패키지 내에서 통계적 전략을 사용하여 운동을 정상화할 수있다(20). 2광자 이미징에서 모션 아티팩트를 고려하는 가장 강력한 접근법은 칼슘 표시기(예를 들어, GCaMP)와 칼슘 독립적인 형광 기자(예를 들어, mCherry)와 같은 세포 내의 두 형광 지표의 발현을 결합하는 것입니다. 형광 기자의 변동은 운동에 기인할 수 있고 운동 아티팩트를 정상화하기 위하여 칼슘 표시기 신호에서 빼기 위하여.
이 프로토콜의 목적은 생체 내에서 최적의 칼슘 이미징 및 혈류 데이터를 수집하는 방법에 대한 명확한 이해를 제공하고 연구자가 결과를 개선하기 위해 구현할 수 있는 새로운 방법과 분석 도구를 제시하는 것입니다. 이 기술은 혈류 통제 또는 다른 두뇌 질병 상태에서 다른 pericytes 인구의 역할을 연구하기 위하여 적용될 수 있습니다. 이 화상 진찰 매개 변수는 또한 그밖 세포 모형 및 기관 시스템에서 칼슘 과 혈류를 연구하기 위하여 이용될 수 있고 유사한 원리는 칼슘을 넘어 그밖 유전으로 인코딩된 센서에 의해 가능하게 되는 그밖 동적 화상 진찰 기술에 적용됩니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
J. 메자는 미틱스와 연구 매니토바의 펠로우십에 의해 지원됩니다. 이 사업을 위한 기금은 건강 캐나다와 아즈릴리 재단의 재정 지원을 통해 매니토바와 뇌 캐나다 대학에서 시작 자금, 연구 매니토바, 매니토바 의료 서비스 재단, 신생 기금에 의해 제공되었다. 여기에 표현된 견해는 반드시 보건부 장관이나 캐나다 정부의 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
참고문헌
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -. A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -. F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a., et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402 (2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory Available from: https://www.jax.org/strain/028345 (2021)
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680 (2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297 (2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유