Method Article
Gehirn Perizyten-Kalzium und hämodynamische Bildgebung bei transgenen Mäusen in Vivo
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll enthält Schritte zur Erfassung und Analyse fluoreszierender Kalziumbilder von Gehirnummantelungsperizyten und Blutflussdaten aus nahe gelegenen Blutgefäßen bei anästhesierten Mäusen. Diese Techniken sind nützlich für Studien der Wandzellphysiologie und können angepasst werden, um Kalziumtransienten in jedem Zelltyp zu untersuchen.
Zusammenfassung
Jüngste Fortschritte in der Proteinbiologie und Mausgenetik haben es ermöglicht, intrazelluläre Kalziumfluktuationen von Gehirnzellen in vivo zu messen und mit der lokalen Hämodynamik zu korrelieren. Dieses Protokoll verwendet transgene Mäuse, die mit einem chronischen Schädelfenster präpariert wurden und den genetisch kodierten Kalziumindikator RCaMP1.07 unter dem α-glatten Muskel-Aktin-Promotor exprimieren, um Wandzellen wie vaskuläre glatte Muskelzellen und umhüllende Perizyten spezifisch zu kennzeichnen. Es werden Schritte beschrieben, wie ein Schwanzvenenkatheter für die intravenöse Injektion von fluoreszierenden Farbstoffen zur Verfolgung des Blutflusses vorbereitet wird und wie man das Perizytencalcium des Gehirns und die lokale Blutgefäßhämodynamik (Durchmesser, Geschwindigkeit der roten Blutkörperchen usw.) durch zwei Photonenmikroskopie in vivo durch das Schädelfenster bei Ketamin / Xylazin anästhesierten Mäusen misst. Schließlich werden Details für die Analyse von Kalziumschwankungen und Blutflussfilmen über die von Barrett et al. 2018 entwickelten Bildverarbeitungsalgorithmen bereitgestellt, wobei der Schwerpunkt darauf liegt, wie diese Prozesse an andere zelluläre Bildgebungsdaten angepasst werden können.
Einleitung
Die Vaskulatur des zentralen Nervensystems besteht aus durchdringenden Arteriolen, Kapillaren und aufsteigenden Venolen. Innerhalb dieses Netzwerks erweitern Wandzellen wie vaskuläre glatte Muskelzellen Arteriolen und Perizyten zelluläre Prozesse entlang der ersten Arteriolenäste und Kapillaren1. Perizyten scheinen mehrere Rollen im Gehirn zu haben, einschließlich der Aufrechterhaltung der Blut-Hirn-Schranke1,2, Migration und Motilität3, potenzielle Stammzelleigenschaften und die Regulierung des Gehirnblutflusses4,5,6. Viele der funktionellen Rollen von Perizyten wurden mit Schwankungen des intrazellulären Kalziums in Verbindung gebracht, die die Erweiterung oder Kontraktion dieser Zellen regulieren können4,5,6.
Mehrere neuere Studien haben Kriterien für die Identifizierung verschiedener Arten von Hirnperizytenfestgelegt 7,8. Wandzellen innerhalb der ersten 4 Zweige der eindringenden Arteriolen umhüllen Perizyten basierend auf ihrer Expression des kontraktilen Proteins α-glatten Muskelaktiin (αSMA) und ihrer hervorstehenden, eiförmigen Somata mit Prozessen, die sich umGefäße wickeln 7,8,9. Um Kalziumschwankungen in umhüllenden Perizyten zu visualisieren, verwendet dieses Protokoll eine neuartige transgene Mauslinie, Acta2-RCaMP1.07, auch bekannt als Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J10. Diese Mäuse exprimieren den roten genetisch kodierten Kalziumindikator RCaMP1.07 in αSMA-exprimierenden Zellen (vaskuläre glatte Muskelzellen und umhüllende Perizyten). Brutkolonien werden durch Kreuzung von Nichtträgertieren mit Hemizygoten erhalten. RCaMP1.07 ist ein rot fluoreszierendes Protein mit einer Calmodulin-Bindungsdomäne, die die Fluoreszenz erhöht, wenn es an das intrazelluläre Calcium10,11gebunden wird. Dieses Protokoll beschreibt die Schritte für die kombinierte Calcium-Bildgebung von umhüllenden Perizyten und Blutflussmessungen durch Zwei-Photonen-Mikroskopie, einschließlich Verfahren zur Injektion von Fluoreszenzfarbstoffen in die Schwanzvene, zur Mikroskopbilderfassung bei anästhesierten Mäusen und zur Datenanalyse mit Programmierplattformen (Abbildung 1). Diese Techniken sind nützlich, um Fragen zur Wandzellphysiologie zu beantworten, können aber angepasst werden, um Kalziumtransienten in jedem Zelltyp im Gehirn oder anderen Organsystem zu untersuchen.
Eine 10 Monate alte weibliche Acta2-RCaMP1.07-Maus wurde für das in diesem Artikel vorgestellte Experiment verwendet. Die Maus wurde zwei Monate zuvor wegen chronischer Schädelfenster- und Kopfimplantation operiert. Details für das operationsprotokoll werden in früheren Studien12,13 diskutiert und ähnliche Verfahren wurden in anderen zuvor veröffentlichten Protokollen14,15durchgeführt. Das Gefäß wird mit grünem Fluoreszein-Dextran (70.000 MW, anionische Lösung, 2,5% w/v) markiert, das intravenös injiziert wird. Dieser Farbstoff ist kostengünstig und leicht aus kommerziellen Quellen erhältlich, hat jedoch ein breiteres Emissionsspektrum, das sich mit der RCaMP-Emission überschneiden und während der Mikroskopbildaufnahme durchbluten kann. Schritte zur spektralen Entmischung sind in Abschnitt 4 unten beschrieben, um dies zu umgehen, aber es können auch andere grüne Farbstoffe mit engeren Emissionsspektren, wie sie auf EGFP basieren, verwendet werden.
Protokoll
Alle unten beschriebenen Verfahren mit Versuchstieren wurden vom Animal Care Committee der University of Manitoba genehmigt, das vom Canadian Council on Animal Care geregelt wird.
1. Aufbau und Vorbereitung des Verfahrens
HINWEIS: Für eine Schwanzvenenkatheterinjektion sind folgende Gegenstände erforderlich: Insulinspritzen, ein 15 cm Stück PE10-Schlauch, 30 G-Nadeln, Gaze, Kochsalzlösung, Zange, grünes Fluoreszein-Dextran-Farbstoff, Zange und Schere. Halten Sie auch eine Nadel mit Ketamin / Xylazin-Anästhesie bereit, die vor der Bildgebungssitzung injiziert wird.
KRITISCH: Alle Materialien und Geräte in den Schritten 1 und 2 müssen vor der Verwendung durch Autoklavieren oder Spülen mit 70% Ethanol sterilisiert werden. Wenn die Zange nicht richtig sterilisiert werden kann, wird die Verwendung eines Paares großer Nadelhalter empfohlen. Die Kathetermontage muss mit Zange und Zange erfolgen, um versehentliche Nadelstiche zu vermeiden.
- Schneiden Sie ca. 15-20 cm Polyethylenschlauch, PE10 (I.D. 28 mm; O.D. 61 mm).
- Füllen Sie eine 27 G Insulinspritze mit 0,9% Kochsalzlösung und schnüren Sie die Nadel der Spritze in die Spitze des Polyethylenröhrchens. Drücken Sie Kochsalzlösung durch das Rohr und stellen Sie sicher, dass keine Lecks vorhanden sind.
- Biegen Sie mit einer Zange eine 30 G-Nadel (0,3 mm x 25 mm) hin und her, bis sie von der Nabe bricht. Die Nadel muss sauber und ohne Biegungen sein.
- Halten Sie die Nadel mit einer Zette, führen Sie die Nadel vorsichtig in das Ende des PE10-Schlauchs ein, der an der mit Kochsalzlösung gefüllten Spritze befestigt ist, und entfernen Sie Luftblasen. Dies ist der Katheter für die Injektion.
- Filtern Sie 30 μL 2,5% (w/v) Fluorescein-Dextran vor der Injektion durch einen 13-25 μm Filter.
- Füllen Sie eine weitere Insulinspritze mit dem 30 μL Aliquot dextran und stellen Sie sicher, dass sich keine Blasen in der gefüllten Spritze befinden.
2. Injektion der Schwanzvene
- Betäuben Sie die Maus mit Isofluran (4% Induktion, 1,5% Erhaltung) oder Ketamin / Xylazin (60 mg / kg; 10 mg / kg; i.p.) und tragen Sie Augengleitgel auf. Ketamin / Xylazin wird für stabilere Blutflussmessungen während der Bildgebung empfohlen und die Dosis kann auf 90 mg / kg erhöht werden; 10 mg/kg Ketamin/Xylazin für längere Bildgebungssitzungen.
- Wenn sich die Maus auf der chirurgischen Ebene der Anästhesie befindet, legen Sie einen mit warmem Wasser gefüllten Handschuh auf den Schwanz, um die seitliche Vene zu erweitern.
- Entfernen Sie den Handschuh nach 30 s und reinigen Sie den Schwanz mit Ethanol.
- Legen Sie den Schwanz zwischen Daumen und Mittelfinger. Geben Sie Druck mit dem Zeigefinger auf den Schwanz, um die Vene zu erweitern. Nehmen Sie mit der anderen Hand die Nadel des Katheters mit einer Handzette auf, die die Lünette nach oben zur Decke ausrichtet.
- Nachdem Sie den Schwanz mit 70% Ethanol gereinigt haben, führen Sie die Nadel in einem Winkel von 0 ° sanft in die Vene ein und injizieren Sie vorsichtig Kochsalzlösung durch den Katheter, um sicherzustellen, dass die Nadel richtig platziert wird.
HINWEIS: Wenn es keinen Widerstand am Kolben und keine Schwellung des Schwanzes gibt, dann ist die Nadel in der Vene. Wenn ein signifikanter Widerstand oder eine Schwellung vorliegt, sollte die Nadel entfernt werden. Die Schritte 2.2-2.5 können bis zu 3 Mal auf jeder Seite des Schwanzes wiederholt werden, wobei die 30G-Nadel am Ende des Katheters jeden zweiten Versuch ersetzt wird, bis die Platzierung korrekt ist. - Sobald sich die Nadel in der Vene befindet, wechseln Sie die Kochsalzspritze am Ende des Katheters mit der Spritze, die Fluoresceindextran enthält (Schritt 1.6). Injizieren Sie das Dextran langsam in den Katheterschlauch, um sicherzustellen, dass keine Blasen in das Rohr gelangen. Wenn eine Luftblase sichtbar ist, schneiden Sie den Schlauch mit der Blase ab, um ihn zu entfernen und die Spritze wieder zusetzen.
- Wenn das gesamte Dextran (30 μL Aliquot) injiziert wurde, entfernen Sie die Spritze und ersetzen Sie sie durch die kochsalzhaltige Spritze. Injizieren Sie das verbleibende Dextran aus dem Schlauch in die Maus, bis kein Farbstoff mehr in der Tube vorhanden ist.
- Entfernen Sie die Nadel vom Schwanz und geben Sie Druck mit Gaze für 10-30 s, bis die Blutung aufhört.
KRITISCH: Wenn nach 6 Versuchen die Schwanzveneninjektion nicht erfolgreich ist, sollte das Tier in einer anderen Sitzung abgebildet werden. Auch das Gesamtvolumen (Kochsalzlösung und Dextran), das in die Maus injiziert wird, sollte 100 μL nicht überschreiten.
3. Zwei-Photonen-Mikroskopie
- Fokussierung auf das Schädelfenster
HINWEIS: Verwenden Sie Ketamin / Xylazin-Anästhesie während der Datenerfassung, da es weniger vaskuläre Wirkungen (Vasodilatation) als Isofluran hat. Wenn Sie Isofluran in den oben genannten Schritten verwenden, injizieren Sie der Maus vor der Bildgebung Ketamin / Xylazin i.p. (empfohlene Dosis, die oben beschrieben wird).- Befestigen Sie die Maus mit einer Schraube durch ihren Kopfpfosten an einer Plattform mit einem Heizkissen unter dem Mikroskop.
- Tragen Sie Augengleitmittel auf die Augen der Maus auf.
- Reinigen Sie das Schädelfenster mit feuchten Dentalapplikatoren. Stellen Sie sicher, dass keine Partikel übrig sind, die den Bildgebungsprozess stören könnten.
- Tragen Sie Ultraschallgel auf das Fenster auf.
- Fokussieren Sie durch das Zwei-Photonen-Mikroskopobjektiv, bis die Pial-Blutgefäße unter dem Fenster zu sehen sind.
- Überprüfen Sie die Atmung der Maus und stellen Sie sicher, dass das Heizkissen ausreichend Temperaturunterstützung bietet.
- Bilderfassung
HINWEIS: Das in diesem Experiment verwendete Zwei-Photonen-Mikroskop verfügt über einen abstimmbaren Ti-Saphir-Laser zur Fluoreszenzanregung mit einer Pockel-Zelle, der die Lasermenge steuert, die die Probe erreicht. Das emittierte Licht wird durch einen 565-Langpass-Dichroit auf zwei GaAsP-Photomultiplikatorröhren (PMTs) mit 595/50-Bandpassfilter (rot) und 525/70-Bandpassfilter (grün) zur Detektion aufgeteilt.
Die in den Schritten 3.2 bis 3.4 beschriebenen Verfahren werden mit einer spezifischen Software des Zwei-Photonen-Mikroskops aus diesem Protokoll durchgeführt (siehe Materialtabelle). Diese Schritte können an andere Mikroskopsoftware und -geräte angepasst werden.- Stellen Sie bei ausgeschalteter Raumbeleuchtung die gewünschte Wellenlänge in der Mikroskopsoftware auf 990 nm ein, um sowohl RCaMP als auch Fluorescein-Dextran anzuregen, indem Sie auf die 2-P-Laserbox klicken.
- Stellen Sie die Laserleistung ein, indem Sie auf den Abschnitt Power/Gain box/Lasers klicken und die Pockels 1-Zellenspannung auf 30% oder einen Wert von 300 auf einer Skala von 1000 einstellen. Die Laserleistung, die bei dieser Einstellung die Probe erreicht, wurde zuvor auf ~30 mW festgelegt.
- Stellen Sie die PMT-Detektorempfindlichkeit ein, indem Sie auf den Abschnitt Power/Gain box/PMTs klicken und den Wert auf 700-800 einstellen.
HINWEIS: Diese Werte können relativ zur Intensität der fluoreszierenden Probe angepasst werden und sollten vor dem Einschalten der Lichter im Raum auf Null eingestellt werden. - Gehen Sie zum Abschnitt Bildauflösung und klicken Sie auf die Auflösung von 512 x 512 für eine größere Bildgröße.
- Klicken Sie auf 2-P Laser/Öffnen, um den 2-P Laserverschluss zu öffnen.
- Gehen Sie zum Abschnitt Scannen und klicken Sie auf die Schaltfläche Live-Scan.
HINWEIS: Live-Scanning mit diesen Parametern und höherer Auflösung, RCaMP-positive Wandzellen und das fluoreszierend markierte Blutplasma sind zu sehen. Wenn das Signal schwach ist, kann der Pockel-Wert erhöht werden, bis das Bild klar ist.
KRITISCH: In den oberflächlichen Gewebeschichten sollte die Laserleistung 50 mW nicht überschreiten, was in den Pockels-Zelleinstellungen in diesem Beispiel etwa 600 beträgt.
- Erwerb eines Tiefenstapels der Wandzellen und des Gefäßnetzwerks
HINWEIS: Der Erwerb eines Tiefenstapels wird empfohlen, um Perizyten im Gefäßnetzwerk richtig zu lokalisieren. Umhüllende Perizyten befinden sich auf den ersten bis vierten Zweigen der eindringenden Arteriole7,8,9. Die in diesem Protokoll verwendete Mikroskopsoftware bezeichnet Tiefenstapel als "Z-Serie".- Bewegen Sie das Mikroskopobjektiv in die X-, Y- und Z-Ebene, lokalisieren Sie eine große Arterie auf der Oberfläche des Gehirns basierend auf der glatten Muskelzellmarkierung von RCaMP.
- Klicken Sie auf das Feld Z-Serie.
- Konzentrieren Sie sich auf die Oberseite des Gewebes in der Nähe der Pialgefäße, stellen Sie dies als Nullpunkt und oben auf dem Stapel der Z-Serie ein, indem Sie auf den Abschnitt Aktuelle Z-Serie / Startposition [μm] klicken. Klicken Sie auf das Kästchen mit vier schwarzen Streifen und einem roten Streifen auf der Oberseite.
- Konzentrieren Sie sich im Gewebe auf die gewünschte Tiefe und stellen Sie diese als Unterseite des Stapels ein, indem Sie auf den Abschnitt Aktuelle Z-Serie/Stoppposition [μm] klicken. Klicken Sie auf das Kästchen mit vier schwarzen Streifen und einem roten Streifen auf der Unterseite.
- Stellen Sie die Dicke jeder Bildebene (Schrittgröße) auf 1-2 μm ein, indem Sie den gewünschten Wert in das Feld unter der Schaltfläche "Schrittgröße" eingeben (die SchaltflächeSchrittgröße ist im Abschnitt Z-Serie / Aktuelle Z-Serielokalisiert ). Dadurch wird die Anzahl der Bilder definiert, die im Stapel erfasst werden.
- Stellen Sie die Laserleistung so ein, dass sie exponentiell ansteigen, wenn sich das Mikroskop tiefer durch den Stapel bewegt, indem Sie auf das Feld Laser-/PMT-Kompensation klicken und Relativ (exponentieller Gradient) auswählen.
- Benennen Sie die Datei, wählen Sie einen Ordner zum Speichern aus und klicken Sie auf Z-Serie starten.
- Öffnen Sie nach der Erfassung die Z-Serie in der Bildbearbeitungssoftware.
- Verschmelzen Sie die beiden Kanäle als farbige Bilder und scannen Sie den Stapel auf der Suche nach Perizyten und Blutgefäßen von Interesse, indem Sie in das Feld Bild | | Geteilte Kanäle; Bild | | Kanäle zusammenführen.
- Wählen Sie Regionen von Interesse (ROIs) aus, die Perizyten enthalten, und speichern Sie die Positionen, um diese Stellen in zukünftigen Bildgebungssitzungen wieder zu lokalisieren.
- Calcium-Imaging-Filmaufnahme der T-Serie (Zeit)
- Verwenden Sie den Tiefenstapel und die ROIs von oben als Referenz, bewegen Sie das Mikroskopobjektiv während des Live-Scan-Modus in der X-, Y- und Z-Achse, bis eine Perizyte von Interesse gefunden wird.
- Um einen Film mit Perizyt-Kalziumereignissen zu sammeln, erhöhen Sie die Aufnahmebildrate (>10 Bilder pro Sekunde), indem Sie zum Abschnitt Bildauflösung gehen und auf das Feld 128x128 klicken.
- Stellen Sie die Aufnahmedauer auf 60 s ein, indem Sie auf das Feld T-Serie klicken und die Zeit in das Dauerfeld eingeben.
- Klicken Sie neben dem Feld Pfad speichern auf die Schaltfläche mit drei Punkten, um den Speicherpfad mit einem eindeutigen Dateinamen zu aktualisieren.
- Zoomen Sie optisch auf das Gefäß, um die niedrigere Auflösung zu berücksichtigen und einen genaueren Blick auf den Perizyten zu erhalten, indem Sie den Wert im Abschnitt Optischer Zoom [mag] anpassen.
- Erwerben Sie die T-Serie, indem Sie auf T-Serie startenklicken.
- Hämodynamische Messungen mit Kymographen (Zeilenscans)
- Konzentrieren Sie sich im Live-Scan-Modus auf das interessierende Gefäß mit einer Auflösung von 512 x 512Pixeln.
- Um den Blutgefäßdurchmesser und die Geschwindigkeit der roten Blutkörperchen zu messen, klicken Sie auf den Zeilenscan, um einen eindimensionalen Scan mit dem Mikroskop zu starten.
- Legen Sie die Dauer des Scans (30-60 s) in Millisekunden fest.
- Zeichnen Sie eine Linie, die das interessierenden Gefäß teilt und sich parallel entlang des Gefäßes bewegt. Dies erzeugt einen Kymographen des Gefäßdurchmessers auf der linken Seite und Streifen der roten Blutkörperchen, die sich durch das Gefäß auf der rechten Seite bewegen.
HINWEIS: Mehrere Blutgefäße können mit derselben Linie gemessen werden, solange sie sich in derselben Bildgebungsebene befinden. - Benennen Sie die Datei und klicken Sie auf Linescan(s) starten, um die Daten zu erfassen.
4. Bildanalyse
- Calciumfilmanalyse.
HINWEIS: Dieses Protokoll beschreibt die Schritte zum spektralen Entmischen (Abbildung 2) und zwei verschiedene Methoden zur Analyse von Perizyt-Calcium-Ereignissen anhand manueller, handverlesener ROIs (Abbildung 3) und automatisierte, aktivitätsbasierte ROI-Auswahl (Abbildung 4)16,17. Um die Signalpeaks mit der normalisierten Calciumspur von jedem ROI zu erkennen und zu klassifizieren, werden die Daten long-pass- und bandpassgefiltert, was dazu beiträgt, die Daten für Amplituden- und Breitenschätzungen zu glätten und auch Peaks unterschiedlicher Form zu identifizieren: Einzelpeaks, Multipeaks und Plateaus (Abbildung 3B). Die Parameter für diese Analyse können optimiert werden, um verschiedene Arten von dynamischen Zellulären Signalen zu erkennen. Die folgenden Schritte erfordern die Verwendung von Bildverarbeitungssoftware und Programmiersoftware mit Bildverarbeitungspaketen, die verschiedene Codes zur Analyse von Kalziumfilmen enthalten, wie oben erwähnt. Eine vollständige Liste der in diesem Protokoll verwendeten Programme und Pakete finden Sie in der Materialtabelle. Bilddaten von verschiedenen Arten von Mikroskopen können mit diesen Paketen importiert werden, wobei die Metadaten aus den Bildern beibehalten werden.
HINWEIS: Die Schritte 4.1.1-4.1.7 beschreiben, wie SIE ROIs in einer Bildverarbeitungssoftware manuell auswählen, um sie anschließend in der manuellen Calciumanalysemethode zu verwenden (Schritt 4.1.16)- Laden Sie die Calcium Imaging T-Serie in die Bildverarbeitungssoftware, indem Sie die .xml Datei in die Software-Symbolleiste ziehen. Klicken Sie auf das Feld OK.
- Nehmen Sie den Durchschnitt des Stapels (der Durchschnitt des Stapels wird von der Bildverarbeitungssoftware als "Z-Projektion" bezeichnet). Dies kann durch Klicken auf Image | Stapel | Z-Projektion in der Symbolleiste.
- Erstellen Sie ein farbiges Bild aus beiden Kanälen wie in Schritt 3.3.9.
- Öffnen Sie das ROI-Manager-Fenster, indem Sie in das Feld Analyse | Werkzeuge | ROI Manager, oder drücken Sie einfach den Buchstaben "T" in der Tastatur.
- Wählen Sie das Polygonwerkzeug aus, indem Sie auf die Polygonform in der Symbolleiste der Bildverarbeitungssoftware klicken und die sichtbaren umhüllenden Perizytstrukturen wie Soma und Prozesse skizzieren.
- Klicken Sie auf die Schaltfläche Hinzufügen im ROI-Manager-Fenster, um ausgewählte ROIs im ROI-Manager hinzuzufügen.
- Geben Sie jeder Region von Interesse einen eindeutigen Namen, indem Sie auf die Schaltfläche Umbenennen klicken, und speichern Sie sie als Zip-Ordner, der später in der Programmiersoftware geladen werden kann, indem Sie auf Mehr klicken>> | Speichern.
HINWEIS: Die Schritte 4.1.8-4.1.14 beschreiben, wie die Calcium-T-Serie in die Programmierplattform importiert wird und wie die verschiedenen Fluorophore, die von den Mikroskop-PMTs detektiert werden, in verschiedene Kanäle entmischt werden (Abbildung 2). - Öffnen Sie die Programmiersoftware und stellen Sie sicher, dass sich die Ordner für die Bildverarbeitungspakete auf dem Pfad befinden (siehe Materialtabelle).
- Importieren Sie die calcium T-Serie in die Programmiersoftware, indem Sie die Funktion BioFormats im Befehlsfenster der Programmierplattform aufrufen, wodurch das Dateiauswahlfenster automatisch geöffnet wird.
- Definieren Sie, was sich auf jedem Kanal befindet, indem Sie die gewünschte Nummer eingeben. In diesen Beispieldaten antwort: Kanal 1 antwort=6 (cellular_signal), Kanal 2 antwort=1 (blood_plasma).
- Zeichnen Sie die Daten als Film in der Programmiersoftware, um die Visualisierung durch Aufrufen der Plotfunktion zu erleichtern.
- Um die grüne Fluoreszenz aus Fluorescein-Dextran zu entfernen, die in den roten RCaMP-Kanal durchblutet, entmischen Sie die Kanäle im Bildverarbeitungspaket, indem Sie die Funktion unmix_chs im Befehlsfenster der Programmierplattform aufrufen.
- Wählen Sie einen Bereich aus, der nur Fluoreszenz aus diesem Fluorophor in Kanal 1 enthält, z. B. in diesem Fall RCaMP.
- Wählen Sie einen Bereich aus, der nur Fluoreszenz aus Fluorophor 2 enthält, z. B. Fluoreszein im Blutplasma in diesem Beispiel.
- Wählen Sie einen Hintergrundbereich aus, der keine Fluoreszenz von beiden Fluorophoren aufenthält. Dadurch wird eine spektrale Beitragsmatrix erzeugt, die auf jedes Pixel in jedem Kanal angewendet wird. Es verbessert die Lokalisierung des RCaMP-Signals erheblich, was die Erkennung von Kalziumereignissen in diesen Strukturen verbessert.
HINWEIS: Wie oben erwähnt, gibt es mehrere Möglichkeiten, wie die Calcium-Bildgebungsdaten innerhalb der Bildverarbeitungspakete analysiert werden können. Die Schritte 4.1.16-4.1.23 beschreiben die Methode zur Analyse von Perizyt-Calcium-Ereignissen mit manuellen, handverlesenen ROIs. - Führen Sie die zelluläre Signalanalyse für den ungemischten Kalziumfilm aus, indem Sie die CellScan-Funktion im Befehlsfenster der Programmierplattform aufrufen.
- Der Code fragt "Welche ROI-Erkennungsmethode möchten Sie verwenden?". Geben Sie die Zahl 2 ein, um die handverlesenen ROIs auf die Programmierplattform zu laden.
- Laden Sie die interessierenden Bereiche aus dem Zip-Ordner, die zuvor von Hand aus den Perizyten ausgewählt wurden (Schritt 4.1.6).
- Der Code fragt "Was ist der Skalierungsfaktor?". Bestimmen Sie den Skalierungsfaktor für die handverlesenen ROIs relativ zur zu analysierenden Bildserie und geben Sie die Anzahl der Skala ein. In diesem Beispiel ist der Skalierungsfaktor 1, da die ROIs nicht in der Größe isiert werden müssen, da sie auf Bildern mit 128 x 128 Pixeln ausgewählt wurden, die gleiche Auflösung wie der ursprüngliche Calciumfilm.
- Generieren Sie Diagramme jedes ROI und der normalisierten Calciumspuren in verschiedenen Farben (Abbildung 3A), indem Sie die Prozess- und Plotfunktionen im Befehlsfenster aufrufen.
- Wenn der Code die Mehrheit der Calciumereignisse in den einzelnen Ablaufverfolgungen nicht erkennt, ändern Sie die integrierten Parameter innerhalb des Konfigurationsoptimierungsfelds, indem Sie die Funktion opt_config aufrufen und die Werte anpassen, z. B. den Schwellenwert für die gefilterten Kurzpassdaten auf das Dreifache der Standardabweichung des Basiszeitraums, d. h. die ersten 30 Frames der T-Serie, verringern.
- Klicken Sie im Optimierungsfeld auf die Schaltfläche Prozess, um die neuen Parameter anzuwenden.
HINWEIS: Um die Signale zu erkennen und zu klassifizieren, wird die normalisierte Calciumspur durch Langpass und Bandpass gefiltert, was hilft, die Daten für Amplituden- und Breitenschätzungen zu glätten, aber auch festzustellen, ob Signale einzelne Peaks, Multi-Peaks oder Plateaus sind (Abbildung 3B). - Geben Sie die Daten als .csv Datei aus, die räumliche Informationen über die interessierenden Regionen und die Spitzen enthält, die durch Aufrufen der Funktion output_data im Befehlsfenster identifiziert wurden. Geben Sie der Datei einen eindeutigen Namen für die weitere Analyse in einem Statistikprogramm.
HINWEIS: Die Schritte 4.1.24-4.1.31 beschreiben die Methode zur Analyse von perizyten Kalziumereignissen mithilfe der Analyse aktivitätsbasierter ROIs. - Wiederholen Sie die Schritte 4.1.8.-4.1.16, um den Calciumfilm zu importieren, die Kanäle zu entmischen und die CellScan-Funktion in der Programmierplattform aufzurufen.
- Der Code fragt "Welche ROI-Erkennungsmethode möchten Sie verwenden?". Geben Sie die Zahl 6 ein, um die automatisierte Identifizierung des Interessenbereichs basierend auf der Aktivität und Änderung der Fluoreszenz in 3 Dimensionen (x, y und Zeit; "3D FLIKA Algorithmus").
- Zeichnen Sie die verarbeiteten Ergebnisse, um die identifizierten Bereiche von Interesse als verschiedene Farben anzuzeigen, indem Sie die Prozess- und Plotfunktionen im Befehlsfenster aufrufen. Jeder ROI wird in Zeit und Raum unterschieden und als überlagerte Maske dargestellt (Abbildung 4).
- Wenn der Algorithmus KEINE ROIs erkennt, die mit dem Auge deutlich sichtbar sind, ändern Sie die integrierten Parameter in der Optimierungsbox, indem Sie die Funktion opt_config aufrufen und die Werte anpassen, z. B. den Gaußfilter erhöhen, der die Daten in der Zeit glättet (um 2 s) und den Schwellenwert für die Suche nach ROIs auf das 3-fache der Standardabweichung der Baseline verringern.
- Wählen Sie die Prozessschaltfläche im Optimierungsfeld aus, um die neuen Parameter anzuwenden. Mit dem Optimierungsprozess sollen mehr ROIs identifiziert werden (Abbildung 4B).
- Zeichnen Sie die ROIs als Film auf, um die Aktivitätsbereiche (in Regenbogenfarben umrissen) eindeutig zu identifizieren, indem Sie den Modus der Standardbox innerhalb des Optimierungsfensters zur weiteren Visualisierung in Film ändern.
- Geben Sie die Daten als CSV-Datei aus, indem Sie die Funktion output_data im Befehlsfenster aufrufen. Diese Datei kann in einem Statistikprogramm weiter analysiert werden.
HINWEIS: Die Analyseparameter können an jede Art von dynamischem Mobilfunksignal (Kalzium, FRET-Verhältnisse usw.) angepasst werden. Alle oben genannten Schritte können mit einfachem Programmiercode automatisiert werden, um viele Kalziumfilme mit den gleichen Einstellungen zu stapeln.
- Zeilenscan Blutflussanalyse.
- Importieren Sie die in Abschnitt 3.5 erfasste Zeilenscan-Kymograph-Datendatei in die Programmiersoftware.
- Der Code fragt "Was wird auf Kanal 1 und 2 gezeigt?". Definieren Sie, was sich auf jedem Kanal befindet, wenn Sie dazu aufgefordert werden. In diesem Beispiel ist Kanal 1 leer (Typ 0) und Kanal 2 ist blood_plasma (Typ 1).
- Führen Sie die Durchmesseranalysefunktion für den Zeilenscan aus, indem Sie die LineScanDiam-Funktion aufrufen, die ein Feld öffnet, um den Bereich auszuwählen, der dem Durchmesser im Kymographen entspricht (Abbildung 5B, links).
- Zeichnen Sie eine Box außerhalb der Kymograph-Fluoreszenzgrenzen, die dem Gefäßdurchmesser entspricht.
- Verarbeiten Sie diese Datenklasse, indem Sie die Prozessfunktion aufrufen, um die volle Breite bei halben Maxima für den Behälterdurchmesser zu messen und ein Diagramm (Abbildung 5C) mit der Plotfunktion zu generieren.
- Geben Sie die Daten als CSV-Datei aus, indem Sie die Funktion output_data im Befehlsfenster aufrufen. Diese Datei kann in einem Statistikprogramm weiter analysiert werden.
- Führen Sie die Geschwindigkeitsradontransformationsanalyse aus, indem Sie die LineScanVel-Funktion aufrufen, die ein Feld öffnet, um den Bereich auszuwählen, der der RBC-Geschwindigkeit im Kymographen entspricht (Abbildung 5B, rechts).
- Zeichnen Sie ein Feld innerhalb des Randes der Kymographenfluoreszenz, das der Gefäßgeschwindigkeit entspricht.
- Verarbeiten Sie diese Datenklasse, indem Sie die Prozessfunktion aufrufen, um die Geschwindigkeit, den Fluss und die lineare Dichte der roten Blutkörperchen aus dem Winkel der Streifen in der Fluoreszenz zu berechnen. Generieren Sie ein Diagramm (Abbildung 5D) mit der Plotfunktion.
- Geben Sie die Daten als CSV-Datei aus, indem Sie die Funktion output_data im Befehlsfenster aufrufen. Diese Datei kann in einem Statistikprogramm weiter analysiert werden.
HINWEIS: Die Kymographen müssen eine klare Fluoreszenz mit genau definierten Kanten zwischen den schwarzen Räumen aufweisen, damit die Durchmesser- und Geschwindigkeitsanalyse genau ist (Abbildung 5A, B). Es ist sehr wichtig, die orthogonalen und parallelen Linien präzise zu zeichnen, da sonst eine zuverlässige Analyse der Kymographen nicht möglich ist. Ähnlich wie bei der Calciumanalyse mit den Bildverarbeitungsalgorithmen können die Parameter für Durchmesser- und Geschwindigkeitsberechnungen optimiert werden.
Ergebnisse
Fluorescein-Dextran hat ein breites Emissionsspektrum, das in den roten Kanal durchbluten kann und den RCaMP-Nachweis in umhüllenden Perizyten beeinflusst (Abbildung 2A). Die spektrale Entmischung nach der Datenerfassung im Softwareprogramm reduziert die Fluoreszeinblutung durch (Abbildung 2B, niedriger) und verbessert die Kalziumsignalerkennung in nachfolgenden Analyseschritten.
Die Calciumanalyse mit den in diesem Protokoll verwendeten Bildverarbeitungsalgorithmen ermöglicht verschiedene Ansätze zur Identifizierung von ROIs und intrazellulären Calciumfluktuationen (d.h. Calciumsignalen). Die Auswahl zellulärer Strukturen per Hand ermöglicht die Detektion von Calciumfluktuationen innerhalb dieser Regionen (Abbildung 3A), einschließlich verschiedener Arten von Signalpeaks, wie Einzelpeaks und Multipeaks, nachdem die normalisierten Kalziumspuren Tiefpass und Bandpass gefiltert wurden (Abbildung 3B). Darüber hinaus werden ROIs identifiziert, indem aktive Pixel gruppiert werden, bei denen sich die Fluoreszenzintensität im Laufe der Zeit ändert, wobei Bildverarbeitungsalgorithmen verwendet werden, die von Ellefsen et al. 201416 und Barrett et al. 201817 entwickelt wurden (Abbildung 4). Dies kann auf jedes dynamische Mobilfunksignal angewendet werden, indem die Zeit-, Schwellenwert- und räumlichen Parameter so angepasst werden, dass sie die erwartete Größe und Form des Signals umfassen. Die Senkung des Schwellenwerts für die Signalidentifikation findet mehr Interessante Regionen (Abbildung 4B).
Helle und klare hämodynamische Kymographen können analysiert werden, um Durchmesser und RBC-Geschwindigkeit in Blutgefäßen in der Nähe von umhüllenden Perizyten zu messen (Abbildung 5A, B). Der Durchmesser wird aus der vollen Breite bei halbem Maximum der Fluoreszenz berechnet (Abbildung 5C). Die RBC-Geschwindigkeit wird aus den Streifen aus unbeschrifteten RBCs angenähert, wobei der Winkel in eine Radontransformation eingegeben wird, um die Geschwindigkeit, den Fluss (Zellen/s) und die lineare Dichte (Zellen/mm; Abbildung 5D). Kymographen von schlechter Qualität, bei denen eine Fluoreszenzsättigung, ein schlechtes Signal-Rausch-Verhältnis oder eine Bewegung des Abbildungsfeldes (Abbildung 6A) vorhanden ist, erzeugen unzuverlässige Diagramme mit Fehlerpunkten (rote Kreuze), an denen Daten nicht bestimmt werden können (Abbildung 6B, C). Die Qualität der erfassten Daten ist entscheidend für ein gutes Ergebnis und die Einhaltung der in diesem Protokoll beschriebenen Schritte gewährleistet gute Ergebnisse.
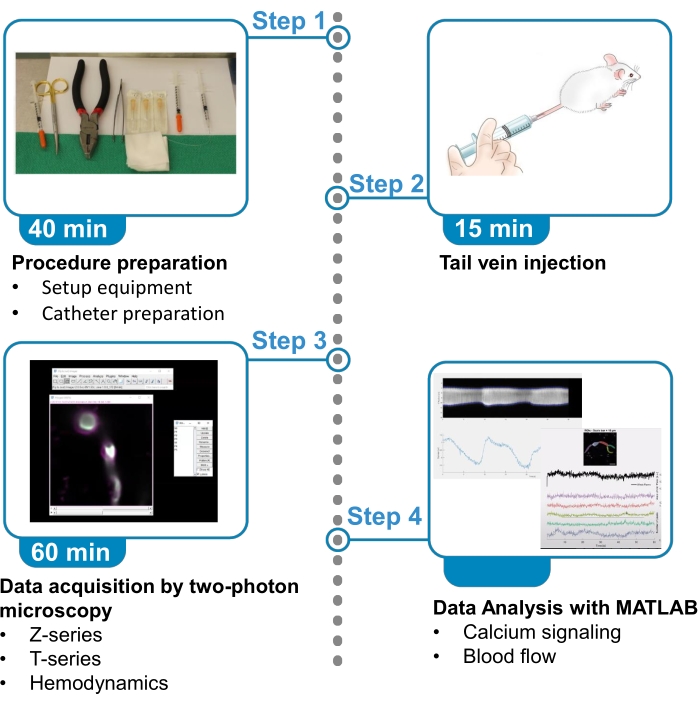
Abbildung 1. Zusammenfassung des Protokolls. Das Protokoll stellt die Schritte zur Erfassung und Analyse fluoreszierender Kalziumbilder von Gehirnen, die Perizyten umhüllen, und Blutflussdaten aus nahe gelegenen Blutgefäßen bei betäubten Mäusen vor. Das Protokoll ist in 4 Schritte unterteilt. 1) Verfahrensvorbereitung: Aufbau der Ausrüstung und Kathetervorbereitung; 2) Tail Vene Injektion; 3) Datenerfassung durch Zwei-Photonen-Mikroskopie; 4) Datenanalyse mit Bildverarbeitungsalgorithmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
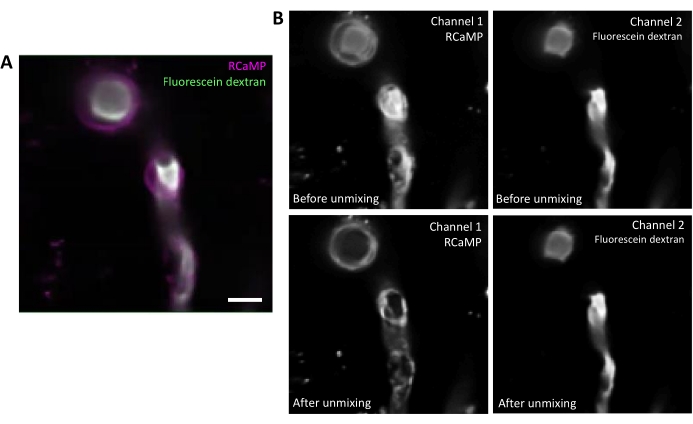
Abbildung 2. Spektrale Entmischung von Fluorophoren. A) Repräsentatives Durchschnittsbild des RCaMP-umhüllenden Perizyten- und Fluorescein-Dextran-markierten Blutgefäßes aus einer Erfassung der T-Serie. Skalenleiste= 10 μm.B) Oberer: Betrachtet man einzelne Kanäle, so ist in Kanal 1 (links) eine Durchblutung von Kanal 2 erkennbar. Niedriger: Nach der spektralen Entmischung wird die Durchblutung reduziert und das Signal von RCaMP ist in der Perizytenstruktur stärker ausgeprägt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
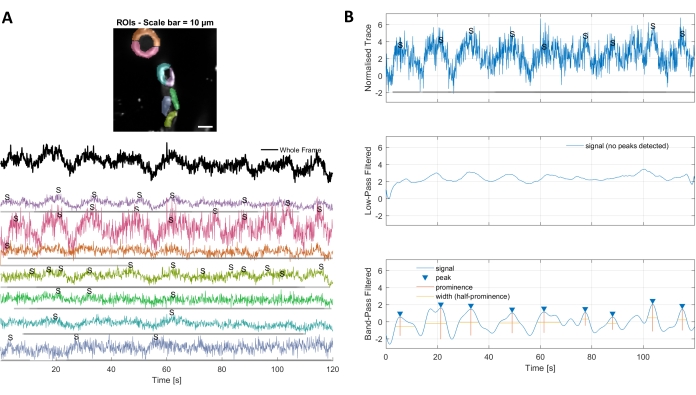
Abbildung 3. Handverlesene ROIs und optimierte Calciumspuren. A) In der verwendeten Bildverarbeitungssoftware ausgewählte Interessengebiete (Regenbogenformen) können zur Identifizierung von Kalziumsignalspuren verwendet werden. B) Signalspitzen von normalisierten Leiterbahnen werden durch Tiefpass- und Bandpassfilterung der Daten identifiziert. Wir definierten die Signalschwelle als das 3-fache der Standardabweichung des Basiszeitraums (erste 30 Frames) und alle Spitzen über diesem Schwellenwert wurden als Signal betrachtet (niedrigere Spur). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
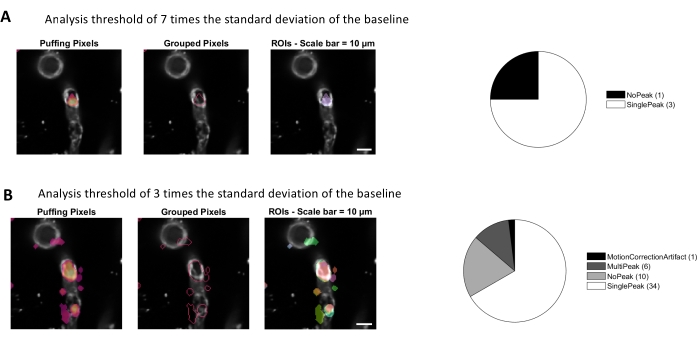
Abbildung 4. Automatisierte, aktivitätsbasierte ROIs für die Calciumanalyse. Die gleichen Daten wurden mit einem Schwellenwert von 7 mal der Standardabweichung der Baseline (A) und dem 3-fachen der Standardabweichung der Baseline (B) analysiert. Wenn Sie den Schwellenwert für die Identifizierung aktiver Pixel verringern, werden mehr ROIs (B) und Signalspitzen (Kreisdiagramm) innerhalb der Perizyten gefunden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
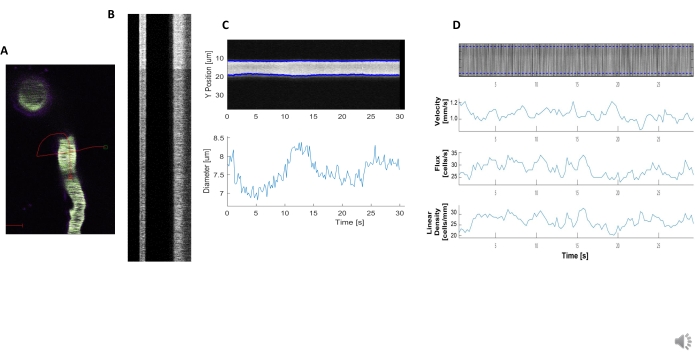
Abbildung 5. Kymograph hämodynamische Messungen. A) Beispiel Zeilenscan durch das Gefäß. B) Beispiel für genau definierte Kymographen für Durchmesser (links) und Geschwindigkeit (rechts). Die schwarzen Streifen innerhalb des rechten Fluoreszenzbandes entsprechen RBCs.C) Durchmesseranalyse mit deutlichen Vasomotionsschwankungen. D) Geschwindigkeitsanalyse mit Diagrammen für Y-Achse = RBC-Fluss (Zellen / s), Liniendichte (Zellen / mm), Geschwindigkeit (mm / s) und Streifenwinkel (Grad), Signal-Rausch-Verhältnis (beliebige Einheiten, a.u.), X-Achse = Zeit (Sek.). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
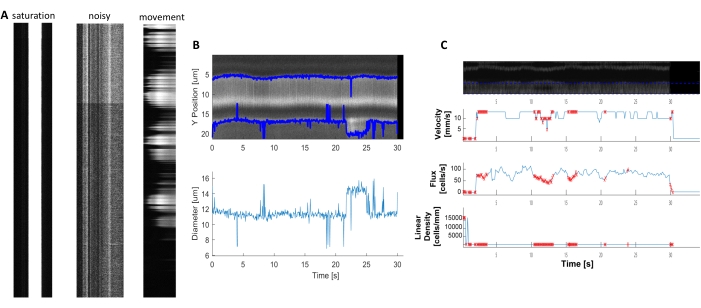
Abbildung 6. Darstellung von hämodynamischen Messungen von schlechter Qualität. A) Beispiele für Kymographen schlechter Qualität mit Fluoreszenzsättigung, schlechtem Signal-Rausch-Verhältnis oder Bewegung des Bildgebungsfeldes während der Aufnahme. B und C) Diagramme ähnlich Abbildung 7 der Durchmesser- und Geschwindigkeitsdaten, die aufgrund der schlechten Qualität der Kymographen Fehlerpunkte (rote Punkte) aufweisen. (Bild E, Y-Achse=Durchmesser (μm), X-Achse=Zeit (Sek.); Bild F, Y-Achse= RBC-Fluss(Zellen/s), Liniendichte (Zellen/mm), Geschwindigkeit (mm/s) und Streifenwinkel (Grad), Signal-Rausch-Verhältnis (a.u.), X-Achse=Zeit (Sek.). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die vorliegende Methode liefert Details zur Maus-Schwanzveneninjektion mit einem Katheter, Zwei-Photonen-Mikroskop-Bilderfassung für Tiefenstapel, Zellcalcium-Signalfilme, Erstellung hämodynamischer Kymographen sowie Calcium- und hämodynamische Analysen mit unseren Bildverarbeitungsalgorithmen17 (Abbildung 1). Diese Techniken haben mehrere Vorteile, die das In-vivo-Bildgebungsergebnis verbessern und Zeit, Ressourcen und Tierstress während der Sitzung reduzieren. Erstens bietet die Verwendung eines Katheters zur Injektion von Schwanzvenen mehr Kontrolle über die Nadel, die Spritze und die Menge an Substanz, die in den Kreislauf der Maus injiziert wird. Darüber hinaus verhindert es die Injektion von Farbstoffen in das Schwanzgewebe und spart teure Reagenzien. Zweitens verwenden wir transgene Mäuse, die genetisch kodierte Kalziumsensoren in umhüllenden Perizyten exprimieren und demonstrieren, wie sie innerhalb des Gefäßnetzwerks des Gehirns mit einem tiefen Z-Stack lokalisiert werden können, was die Zellidentifikation und -verlagerung in nachfolgenden Bildgebungssitzungen langfristig erleichtert. Dies ist ein wichtiger Faktor in Perizytenstudien und gewährleistet die korrekte Zellklassifizierung6,7. Drittens stellen wir unsere Parameter für die Erfassung von Kalziumfilmen und hämodynamischen Zeilenscandaten zur Verfügung, die ein guter Ausgangspunkt für die Messung dynamischer zellulärer Signale sind. Schließlich stellen wir unsere Bildverarbeitungsalgorithmen17vor, eine umfassende Bildverarbeitungs-Toolbox, die mehrere Ansätze für die Bildvorverarbeitung (z. B. spektrale Entmischung), Calciumbildanalyse und hämodynamische Analyse (Durchmesser, Geschwindigkeit usw.) enthält. Diese Algorithmen können Diagramme für eine schnelle und einfache Visualisierung der Daten generieren und gleichzeitig das für die Analyse der Ergebnisse erforderliche Benutzerwissen minimieren. Darüber hinaus kann es mit ein paar Zeilen Code automatisiert werden, um schnell mehrere Datensätze mit den gleichen Parametern zu verarbeiten. Dies kann die Datenvisualisierung und den Zeitaufwand des Forschers potenziell verbessern.
Der Schlüssel zur Erfassung guter Calcium-Bildgebungsdaten besteht darin, die Laserleistung und die PMT-Einstellungen für die Erfassung klarer Fluoreszenzsignale anzupassen, aber auch Daten mit einer ausreichenden Bildrate zu sammeln, um das gesamte Kalziumereignis zu erfassen. Die Daten in diesem Protokoll wurden mit 10-11 Bildern pro Sekunde erfasst, was die langsameren Kalziumschwingungen in umhüllenden Perizyten erfasst. Es gibt auch mehrere Schritte während der Analyse, die das Analyseergebnis verbessern können. Erstens ist die spektrale Entmischung vorteilhaft, wenn es signifikante Überschneidungen zwischen den Emissionsspektren von Fluorophoren gibt (Abbildung 2). Fluorescein-Dextran wurde in diesem Protokoll verwendet, da es sich um ein kostengünstiges und kommerziell erhältliches Dextrankonjugat handelt, das üblicherweise für hämodynamische Messungen verwendet wird5. Die spektrale Entmischung hilft, die Daten für eine verbesserte Detektion von Kalziumsignalen zu bereinigen, aber auch alternative Fluorophore mit engeren Emissionsspektren könnten verwendet werden. Zweitens ist die Handauswahl zellulärer Strukturen als ROIs (Abbildung 3) nützlich, um Kalziumereignisse in verschiedenen subzellulären Regionen wie dem Soma oder Prozesszweigen zu klassifizieren. Die aktivitätsbasierte ROI-Auswahl (Abbildung 4)16 liefert mehr räumliche und zeitliche Informationen über einzelne Kalziumereignisse. Dies kann hilfreich sein, wenn die Häufigkeit von Kalziumereignissen in einem bestimmten Bereich oder die Ausbreitung von Ereignissen auf andere zelluläre Bereiche bestimmt wird. Die Verwendung von Programmiersoftware zur Analyse von Bildgebungsdaten kann Forschern Stunden an Zeit sparen, wenn Daten batch-verarbeitet werden, aber es erfordert einige anfängliche Zeitinvestitionen, um die Parameter für optimale Ergebnisse anzupassen. Die wichtigsten Faktoren sind die erwartete Größe (inμm 2)des aktiven Bereichs sowie die Dauer des Signals (minimale Signalzeit und maximale Signalzeit müssen definiert werden). Forscher müssen zuerst einige Beispiele für Filme der T-Serie untersuchen, um am besten zu bestimmen, welche Parameter zu ihren Daten passen. Schließlich können am Mikroskop erfasste Daten von schlechter Qualität die Analyse von Kalzium und Hämodynamik stark behindern (Abbildung 6). Daher sollte zu Beginn darauf geachtet werden, die Mikroskopaufnahmeeinstellungen zu optimieren. Unter Berücksichtigung dieser Faktoren kann dieses Protokoll an die Kalziumbildgebung oder die Analyse anderer dynamischer zellulärer Signale (z. B. fluoreszierende Natrium-, Kalium-, Metaboliten- oder Spannungsschwankungen) in anderen Geweben oder Zelltypen angepasst werden.
Es gibt mehrere Einschränkungen für dieses Protokoll. Zuerst werden die Daten unter Anästhesie gesammelt, was die Gehirnaktivität beeinflusst und den Blutfluss beeinflussen könnte. Ähnliche Bildgebung kann bei wachen Mäusen durchgeführt werden, die darauf trainiert sind, eine Kopffixierung für physiologischere Ergebnisse zu akzeptieren. Darüber hinaus ist es wichtig, sich daran zu erinnern, dass wir 2-dimensionale Bilder einer 3-dimensionalen Zelle und eines Blutgefäßes in vivosammeln. Daher können wir nur eine Fraktion der Kalziumereignisse innerhalb dieser Zellen oder den Blutfluss in einem einzelnen Abschnitt des Blutgefäßes gleichzeitig erfassen.
Eine weitere zu beachtende Einschränkung ist, dass die Zwei-Photonen-Calcium-Bildgebung empfindlich auf Bewegungsartefakte reagiert, bei denen Bewegungen in und aus der Fokusebene mit Kalziumschwankungen verwechselt werden können. Dieses Protokoll wurde unter Anästhesie durchgeführt, was die Bewegung des Tieres einschränkt; Bewegungsartefakte können jedoch durch die Atemfrequenz der Maus, Herzfrequenz, mögliche Gewebeschwellungen und im Falle von umhüllenden Perizyten, Gefäßkontraktion oder Vasomotion 4,6,18,19eingeführt werden. Bewegungsartefakte können durch verschiedene Strategien gemildert werden. Die in diesem Protokoll verwendeten Bildverarbeitungspakete enthalten einen optionalen Bewegungskorrekturschritt, der eine 2D-Faltungs-Engine verwendet, um die Bilder innerhalb der T-Serie basierend auf dem sichtbarenGefäß 13,17auszurichten. Frames mit signifikanten Veränderungen in der Fokusebene werden durch diesen Algorithmus identifiziert und können von der Analyse ausgeschlossen werden. Darüber hinaus ist es möglich, statistische Strategien innerhalb der bildgebenden Verarbeitungspakete zu verwenden, z. B. einen Z-Score bei der Erzeugung der Fluoreszenzspuren, um die bewegungsinduzierten Kalziumfluktuationen zu normalisieren20. Der robusteste Ansatz zur Berücksichtigung von Bewegungsartefakten in der Zwei-Photonen-Bildgebung besteht darin, die Expression von zwei fluoreszierenden Indikatoren innerhalb derselben Zelle zu kombinieren, z. B. einen Kalziumindikator (z. B. GCaMP) und einen fluoreszierenden Reporter (z. B. mCherry), der kalziumunabhängig ist. Schwankungen im fluoreszierenden Reporter können dann auf Bewegung zurückgeführt werden und werden vom Kalziumindikatorsignal subtrahiert, um Bewegungsartefakte zu normalisieren.
Der Zweck dieses Protokolls ist es, ein klares Verständnis dafür zu vermitteln, wie optimale Kalziumbildgebungs- und Blutflussdaten in vivo gesammelt werden können, und neue Methoden und Analysewerkzeuge vorzustellen, die Forscher implementieren können, um ihre Ergebnisse zu verbessern. Diese Techniken können angewendet werden, um die Rolle verschiedener Perizytenpopulationen bei der Kontrolle des Blutflusses oder in verschiedenen Gehirnerkrankungszuständen zu untersuchen. Diese bildgebenden Parameter können auch verwendet werden, um Kalzium und Blutfluss in anderen Zelltypen und Organsystemen zu untersuchen, und ähnliche Prinzipien gelten für andere dynamische Bildgebungsverfahren, die durch andere genetisch kodierte Sensoren ermöglicht werden, die über Kalzium hinausgehen.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
J. Meza wird durch Stipendien von Mitacs und Research Manitoba unterstützt. Die Finanzierung dieser Arbeit wurde von Canadian Institutes for Health Research, Research Manitoba, Manitoba Medical Service Foundation, Start-up-Finanzierung von der University of Manitoba und Brain Canada über den Canada Brain Research Fund mit finanzieller Unterstützung von Health Canada und der Azrieli Foundation bereitgestellt. Die hierin zum Ausdruck gebrachten Ansichten geben nicht notwendigerweise die Ansichten des Gesundheitsministers oder der Regierung von Kanada dar.
Materialien
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
Referenzen
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -. A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -. F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a., et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402 (2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory Available from: https://www.jax.org/strain/028345 (2021)
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680 (2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297 (2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten