Method Article
生体内のトランスジェニックマウスにおける脳ペリサイトカルシウムと血行力学イメージング
要約
このプロトコルは、麻酔薬を使用したマウスの近くの血管から脳を包み込む周囲細胞からの蛍光カルシウム画像と血流データを取得して分析するステップを提示する。これらの技術は、壁画細胞生理学の研究に有用であり、任意の細胞型のカルシウム過渡症を調査するために適応することができる。
要約
近年のタンパク質生物学やマウス遺伝学の進歩により、 生体内の 脳細胞の細胞内カルシウム変動を測定し、これを局所的な群力学と相関させることが可能になりました。このプロトコルは、慢性脳蓋窓で調製されたトランスジェニックマウスを使用し、遺伝的にコードされたカルシウム指標であるRCaMP1.07を、α平滑筋アクチンプロモーターの下で、血管平滑筋細胞および血管周細胞などの壁画細胞に特異的に標識する。血流を追跡するための蛍光色素の静脈注射用尾静脈カテーテルの調製方法、ならびにケタミン/キシラジン麻酔の頭蓋窓を通して 生体内の 2つの光顕微鏡によって脳周血管カルシウムおよび局所血管血球血動態(直径、赤血球速度など)を測定する方法について概説する。最後に、バレットら2018年に開発された画像処理アルゴリズムを用いて、カルシウム変動や血流ムービーの解析について詳細を提供し、これらのプロセスを他の細胞イメージングデータにどのように適合させることができるかを強調した。
概要
中枢神経系血管系は、動脈、毛細血管、および上昇する小胞を貫通する。このネットワーク内では、血管平滑筋細胞などの壁画細胞は、動脈および周囲細胞を包み込み、第1の動脈管枝および毛細血管に沿って細胞過程を拡張する。脳内には、血液脳関門1、2、移行と運動性3、幹細胞の性質、脳血流4、5、6の調節など、いくつかの役割を持つよう見える。周辺細胞の機能的役割の多くは、これらの細胞の拡張または収縮を調節し得る細胞内カルシウムの変動に関連している4,5,6.
いくつかの最近の研究は、脳のペリサイトの異なるタイプを識別するための基準を設定しています7,8.貫通性動脈の最初の4枝内の壁画細胞は、収縮タンパク質α平滑筋アクチン(αSMA)の発現に基づいて周囲細胞を包み込み、その突出した、血管7、8、9を包み込むプロセスを有する突出した、球体ソマタである。このプロトコルは、包皮性ペリサイトのカルシウム変動を可視化するために、Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J10とも呼ばれる新しいトランスジェニックマウスライン、Acta2-RCaMP1.07を使用しています。これらのマウスは、赤い遺伝子組み換えカルシウム指標であるRCaMP1.07をαSMA発現細胞(血管平滑筋細胞および包面性ペリサイト)で発現する。繁殖コロニーは、ヘミジゴテと非キャリア動物を横断することによって維持される。RCaMP1.07は、カルモジュリン結合ドメインを有する赤色蛍光タンパク質であり、細胞内カルシウム10,11に結合すると蛍光が増加する。このプロトコルは、蛍光色素の尾静脈注入の手順、麻酔薬マウスでの顕微鏡画像取得、およびプログラミングプラットフォームによるデータ分析を含む2つの光子顕微鏡による、血管状のペリサイトと血流測定の複合カルシウムイメージングのステップを概説する(図1)。これらの技術は、壁画細胞生理学に関する質問に対処するのに有用であるが、脳または他の器官系内の任意の細胞型におけるカルシウム過渡症を研究するために適応することができる。
この記事で紹介した実験には、生後10ヶ月の女性Acta2-RCaMP1.07マウスが使用されました。マウスは2ヶ月前に慢性頭蓋窓と頭部ポスト移植の手術を受けた。外科プロトコルの詳細は、以前の研究で議論されています12, 13および同様の手順は、他の以前に公開されたプロトコルで行われています14,15.脈管は、緑色のフルオレセイン-デキストラン(70,000 MW、陰イオン溶液、2.5%w/v)を静脈内注射で標識する。この色素は費用対効果が高く、市販のソースから容易に入手できますが、RCaMP発光と重なり合い、顕微鏡画像取得中にブリードする可能性のあるより広い発光スペクトルを有します。これを回避するために、スペクトルを混ぜないする手順は、下のセクション4で概説されていますが、EGFPに基づくような狭い発光スペクトルを持つ他の緑色の染料も使用される可能性があります。
プロトコル
以下に概説する実験動物に関するすべての手順は、カナダ動物ケア評議会が管理するマニトバ大学の動物ケア委員会によって承認されています。
1. 手順のセットアップと準備
注:尾静脈カテーテル注射には、インスリン注射器、15cmのPE10チューブ、30G針、ガーゼ、生理食い、鉗子、緑色蛍光ペン、およびはさみがあります。また、注射セッションの前に注入されるケタミン/キシラジン麻酔で針を用意してください。
CRITICAL: ステップ 1 および 2 のすべての材料および装置は、70% エタノールでオートクレーブまたはリンスを使用する前に滅菌する必要があります。プライヤーを適切に殺菌できない場合は、大きな針ホルダーのペアを使用することをお勧めします。カテーテルアセンブリは、偶発的な針の穿刺を避けるために、ペンチと鉗子で行う必要があります。
- ポリエチレンチューブ、PE10(I.D.28ミリメートル)の約15〜20センチをカット。O.D. 61 mm)。
- 27Gインスリン注射器に0.9%の生理食音を充填し、注射器の針をポリエチレンチューブの先端に引き裂きます。漏れがないことを確認し、チューブを通して生理学を押します。
- プライヤーを使用して、ハブから切れるまで30G針(0.3mm x 25mm)を前後に曲げろ。針は曲がらずにきれいでなければなりません。
- 針を鉗子で持ち、生理食音充填された注射器に取り付けられたPE10チューブの端に針を慎重に挿入し、気泡を取り除きます。これは注射のためのカテーテルである。
- 注入前に13-25 μmフィルターを通して2.5%(w/v)フルオレセインデキストランのフィルター30 μL。
- デキストランの30 μLアリコートで別のインスリン注射器を充填し、充填されたシリンジに泡がないことを確認します。
2. 尾静脈注射
- イソフルラン(4%誘導、1.5%維持)またはケタミン/キシラジン(60mg/kg;10mg/kg;i.p.)でマウスを麻酔し、目の潤滑剤ゲルを塗布します。ケタミン/キシラジンは、イメージング中のより安定した血流測定のために推奨され、用量は90 mg /kgに増加させることができます;10 mg/kg ケタミン/キシラジン長いイメージングセッション.
- マウスが麻酔の外科用平面にある場合は、尾部に温水で満たされた手袋を置き、側面静脈を拡張します。
- 30s以降の手袋を取り出し、エタノールで尾部を汚します。
- 親指と中指の間に尾を置きます。尾部の人差し指で圧力を与えて静脈を拡張します。もう一方では、天井に向かってベゼルを上向きにする鉗子でカテーテルの針を拾います。
- 70%エタノールで尾部を洗浄した後、滑らかに、針を静脈に0°の角度で挿入し、カテーテルを通して生理食い物を静かに注入して、針が正しく配置されるようにします。
注:プランジャーに抵抗がなく、尾の腫れがない場合、針は静脈にあります。大きな抵抗や腫れがある場合は、針を取り除く必要があります。ステップ2.2-2.5は尾の両側に3回まで繰り返すことができる、配置が正しくなるまで、カテーテルの終わりの30G針を正しくなるまで、試験の終わりに30Gの針を交換する。 - 針が静脈に入ったら、カテーテルの端にある生理食音注射器をフルオレセインデキストランを含む注射器で切り替えます(ステップ1.6)。ゆっくりとカテーテルチューブにデキストランを注入し、チューブに入る泡がないことを確認します。気泡が見える場合は、気泡を含むチューブを切って取り除き、シリンジを再び取り付けます。
- デキストラン(30 μLアリコ)をすべて注入したら、注射器を取り出し、生理食塩水に交換します。チューブに残りのデキストランをマウスに注入し、チューブに染料が残らなくなるまで注入します。
- 針を尾から取り出し、出血が止まるまで10~30sのガーゼで圧力を与えます。
CRITICAL: 6回の試みの後尾静脈の注入が成功しなかった場合、動物は別のセッションで画像化されるべきです。また、マウスに注入される総容積(生理液およびデキストラン)は100 μLを超えてはならない。
3. 2つの光子顕微鏡
- 頭蓋ウィンドウに焦点を当てる
注:イソフルランよりも血管効果(血管拡張)が少ないため、データ取得中にケタミン/キシラジン麻酔を使用してください。上記の手順でイゾフルランを使用する場合は、イメージングの前にケタミン/キシラジンi.p.(上記の推奨用量)でマウスを注入します。- ヘッドポストを通してネジでマウスを取り付け、顕微鏡下に暖房パッドを付けたプラットフォームに固定します。
- マウスの目に目の潤滑剤を塗布します。
- 湿った歯科アプリケーターで頭蓋の窓をきれいにしなさい。イメージングプロセスに干渉する可能性のあるパーティクルが残っていないか確認します。
- 窓に超音波ゲルを適用します。
- 2光子顕微鏡の目的を通して、窓の下に大血管が見えるまで焦点を合わせます。
- マウスの呼吸を確認し、加熱パッドが十分な温度サポートを提供していることを確認します。
- 画像取得
注:この実験で使用される2光子顕微鏡は、試料に到達するレーザーの量を制御するポッケル細胞と蛍光励起のための調整可能なTi-Sapphireレーザーを有する。放出光は、検出用に595/50バンドパスフィルタ(赤)と525/70バンドパスフィルタ(緑)を備えた2つのGaAsPフォトマルチプライヤチューブ(PMT)に565ロングパス二色で分割されます。
ステップ 3.2 ~ 3.4 で説明されている手順は、このプロトコルの 2 光子顕微鏡の特定のソフトウェアを使用して実行されます ( 材料表を参照)。これらのステップは他の顕微鏡のソフトウェアおよび装置に合わせることができる。- 部屋のライトを消した後 、2-Pレーザー ボックスをクリックしてRCaMPとフルオレセインデキストランの両方を励起するために、顕微鏡ソフトウェアの希望の波長を990 nmに設定します。
- パワー/ゲインボックス/レーザーセクションをクリックし、Pockels 1セル電圧を30%または300のスケールで300の値に調整して、レーザーパワーを設定します。この設定でサンプルに到達したレーザーパワーは、以前~30mWと判定されました。
- 電源/ゲインボックス/PMTをクリックし、700-800に値を調整してPMT検出器の感度を設定します。
注: これらの値は、蛍光サンプルの強度に対して調整でき、部屋のライトを点灯する前にゼロに設定する必要があります。 - [イメージの解像度]セクションに移動し、512 x 512解像度をクリックすると、大きい画像サイズになります。
- 2-Pレーザー/オープンをクリックして2-Pレーザーシャッターを開きます。
- [スキャン] セクションに移動し、[ライブ スキャン] ボタンをクリックします。
注:これらのパラメータと高解像度のライブスキャン、RCaMP陽性壁画細胞および蛍光標識された血漿が見られます。信号が弱い場合は、画像が明確になるまでポッケル値を大きくすることができます。
CRITICAL: 表面組織層では、レーザーパワーは50 mWを超えてはならない、これはこの例のポッケルセルの設定では約600です。
- 壁画細胞と血管ネットワークの深層スタックを取得する
注: 血管ネットワーク内のペリシテを適切に配置するために深度スタックの取得をお勧めします。周囲の周囲の細胞は、貫通する動脈7、8、9から第1から第4の枝に位置しています。このプロトコルで使用される顕微鏡ソフトウェアは、深度スタックを「Zシリーズ」と呼びます。- X、Y、Z面で顕微鏡目的を移動させ、RCaMPの平滑筋細胞標識に基づいて脳の表面に大きな動脈を局在化する。
- Z シリーズボックスをクリックします。
- pial血管付近の組織の上部に焦点を合わせ、 現在のZシリーズ/スタート位置[μm] セクションをクリックして、Zシリーズスタックのゼロポイントとトップに設定します。4つの黒いストライプと上部に1つの赤いストライプを持つボックスをクリックします。
- 所望の深さにティッシュに焦点を合わせ、 現在のZシリーズ/停止位置[μm] セクションをクリックして、スタックの底としてこれを設定します。4つの黒いストライプと1つの赤いストライプが底に付いたボックスをクリックします。
- 各画像平面の厚さ(ステップサイズ)を1~2μmに設定するには、必要な値を「ステップサイズ」ボタンの下のボックスに入力します(ステップサイズ ボタンは Zシリーズ/現在のZシリーズセクションにローカライズされています)。これにより、スタックで取得される画像の数が定義されます。
- レーザー /PMT補正 ボックスをクリックし、[ 相対(指数勾配)]を選択して、顕微鏡がスタック内を深く移動するにつれて、レーザーパワーが指数関数的に増加するように設定します。
- ファイルに名前を付け、保存するフォルダを選択し 、[Z シリーズの開始] をクリックします。
- 取得後、イメージング処理ソフトウェアでZシリーズを開きます。
- 2つのチャンネルを色付き画像としてマージし、ボックスをクリックして目的のペリサイトや血管を探してスタックをスキャン |カラー|スプリットチャンネル;画像|カラー|チャネルの結合:
- ペリサイトを含む 対象領域 (ROI)を選択し、将来のイメージングセッションでこれらのスポットを再び見つけやすくするために位置を保存します。
- Tシリーズカルシウムイメージング動画取得(時間)
- 上の深度スタックと ROI を基準として使用し、目的のペリサイトが見つかるまで、ライブスキャンモード中に X、Y、Z 軸の顕微鏡目的を移動します。
- ペリサイトカルシウムイベントの動画を収集するには、 画像解像度 セクションに移動し 、[128x128] ボックスをクリックして、取得フレームレート(> 1秒あたり10フレーム)を増やします。
- T シリーズボックスをクリックし、時間を入力して、60 s にイメージング期間を設定します。
- [ 保存パス ] ボックスの横にある ボタンをクリックし、3 つのドットを付けて 、一意のファイル名で保存パスを更新します。
- 低解像度を考慮し、 光学ズーム[mag] セクションの値を調整することによって船舶を光学的にズームしてペリサイトの詳細を表示します。
- Tシリーズを開始をクリックして Tシリーズを取得します。
- キモグラフによるヘモダイナミクス測定(ラインスキャン)
- ライブスキャンモードで512 x 512-ピクセル解像度で興味のある容器に焦点を当てます。
- 血管径と赤血球速度を測定するには、 ラインスキャン をクリックして顕微鏡で1次元スキャンを開始します。
- スキャンの継続時間をミリ秒単位で設定します(30~60秒)。
- 目的の容器を二分し、容器に沿って平行に移動する線を描きます。これは、左側の血管径の円グラフを生成し、右側の血管を通過する赤血球の筋を生成します。
注:複数の血管は、同じ画像平面内にある限り、同じラインで測定することができます。 - ファイルに名前を付け、 開始ラインスキャン をクリックしてデータを取得します。
4. 画像解析
- カルシウムの映画の分析。
注: このプロトコルは、スペクトルのアンミックスの手順を概説します(図 2) 手動で選択した ROI ( 手動で選択した ROI を使用して、包薬ペリサイトカルシウムイベントを分析する 2 つの異なる方法図 3) および自動アクティビティベースの ROI 選択 (図 4)16,17.各ROIから正規化されたカルシウムトレースで信号ピークを検出して分類するために、データは長いパスとバンドパスフィルターでフィルタリングされ、振幅と幅推定のデータを平滑化し、また異なる形状のピーク(シングルピーク、マルチピーク、高原)を識別するのに役立ちます(図 3B).この分析のパラメータは、異なるタイプの動的な細胞信号を検出するように最適化することができます。以下の手順では、上記のようにカルシウム映画を分析するための異なるコードを含む画像処理パッケージを使用して、画像処理ソフトウェアとプログラミングソフトウェアを使用する必要があります。このプロトコルで使用されるプログラムとパッケージの完全なリストについては、資料表を参照してください。さまざまなタイプの顕微鏡からのイメージングデータは、画像からメタデータを維持するこれらのパッケージでインポートすることができます。
注:手順 4.1.1-4.1.7 手動カルシウム分析方法で使用する画像処理ソフトウェアで手動で ROI を選択する方法を説明します (ステップ 4.1.1.16)- .xmlファイルをソフトウェアツールバーにドラッグして、画像処理ソフトウェアにカルシウムイメージングTシリーズをロードします。 [OK]ボックス をクリックします。
- スタックの平均値を取得します (スタックの平均は、画像処理ソフトウェアによって"Z 投影" とラベル付けされます)。これは画像|をクリックして行うことができます スタック | ツールバーの Z 投影。
- 手順 3.3.9 のように、両方のチャンネルから色付きのイメージを作成します。
- [分析] ボックスをクリックして ROI マネージャ ウィンドウを開| ツール|ROI マネージャを使用するか、キーボードの文字"T"を押すだけです。
- 画像処理用のツール バーの ポリゴン シェイプ をクリックしてポリゴン ツールを選択し、相馬やプロセスなど、目に見える包み込んだペリサイト構造の輪郭を描きます。
- ROI マネージャ ウィンドウの [追加 ] ボタンをクリックして、ROI マネージャで選択した ROI を追加します。
- [名前の変更]ボタンをクリックして、対象地域ごとに一意の名前を付け、後で [詳細] をクリックしてプログラミング ソフトウェアに読み込むことができる zip フォルダとして保存します>> |保存.
注: ステップ 4.1.8-4.1.14 では、カルシウム T シリーズをプログラミング プラットフォームにインポートする方法と、顕微鏡 PMT によって検出された異なる蛍光ホルを異なるチャネルにアンミックスする方法について説明します (図 2)。 - プログラミング ソフトウェアを開き、イメージ処理パッケージのフォルダがパス上にあることを確認します ( 資料一覧を参照)。
- プログラム プラットフォームのコマンド ウィンドウで BioFormats 関数を呼び出して、カルシウム T シリーズをプログラミング ソフトウェアにインポートします。
- 目的の番号を入力して、各チャンネルの内容を定義します。このサンプル データでは、チャネル 1 の回答 =6 (cellular_signal)、チャネル 2 の回答 =1 (blood_plasma)。
- プロット関数を呼び出すことによって視覚化を容易にするために、プログラミングソフトウェア内でムービーとしてデータを プロット します。
- 赤い RCaMP チャネルにブリードするフルオレセインデキストランから緑の蛍光を除去するには、プログラミング プラットフォームのコマンド ウィンドウで unmix_chs 関数を呼び出して、画像処理パッケージのチャネルをアンミックスします。
- この場合はRCaMPなど、チャネル1のこの蛍光を含む領域を選択してください。
- この例では、この例では、血漿中のフルオレセインなどの蛍光2から蛍光のみを含む領域を選択する。
- 蛍光を持たない背景領域を蛍光を選択します。これにより、各チャンネルの各ピクセルに適用されるスペクトル寄与行列が生成されます。これは、これらの構造におけるカルシウムイベントの検出を強化するRCaMPシグナルの局在化を大幅に改善する。
注: 前述のように、画像処理パッケージ内でカルシウムイメージングデータを解析する方法は複数あります。ステップ 4.1.16-4.1.23 では、手動で選択した ROI を使用して、包み込むペリサイトカルシウムイベントを分析する方法について説明します。 - プログラミング プラットフォームのコマンド ウィンドウで CellScan 関数を呼び出して、混合されていないカルシウムムービーでセルラー シグナリング解析を実行します。
- コードは、「どの ROI 検出方法を使用しますか?」2 を 入力して、 手で選択した ROI をプログラミング プラットフォームにロードします。
- 先ほど手でペリサイトから選択した zip フォルダから対象の領域をロードします(ステップ 4.1.6)。
- コードは「スケールファクターは何ですか?」分析する画像シリーズを基準に、手で選択した ROI のスケール係数を決定し、スケールの数を入力します。この例では、ROI が 128x128 ピクセルのイメージで選択されているため、元のカルシウムムービーと同じ解像度であるため、ROI のサイズを変更する必要がないため、スケール係数は 1 です。
- 各 ROI および正規化されたカルシウムトレースのプロットを異なる色で生成します (図 3A)。
- コードが個々のトレース内のカルシウムイベントの大部分を検出しない場合は 、opt_config 関数を呼び出して値を調整することにより、構成最適化ボックス内の組み込みパラメーターを変更します。
- [最適化] ボックスの [ 処理 ] ボタンを選択して、新しいパラメータを適用します。
注:信号を検出して分類するために、正規化されたカルシウムトレースはロングパスとバンドパスフィルタ処理され、振幅および幅推定のデータを平滑化するのに役立ちますが、信号が単一のピーク、マルチピーク、またはプラトーであるかどうかを判断するのにも役立ちます(図3B)。 - コマンド ウィンドウで output_data 関数を呼び出して識別された対象地域とピークに関する空間情報を含む.csv ファイルとしてデータを出力します。統計プログラムでの分析を行う場合は、ファイルに一意の名前を付けます。
注: ステップ 4.1.24-4.1.31 では、アクティビティベースの ROI の解析を使用して、包み込むペリシテカルシウムイベントを分析する方法について説明します。 - 手順 4.1.8.-4.1.16 を繰り返して、カルシウムムービーをインポートし、チャンネルのミックスを解除し、プログラミング プラットフォームの CellScan 関数を呼び出します。
- コードは、「どの ROI 検出方法を使用しますか?」数値 6 を入力して、3 次元 (x、y、時間) の蛍光の活性と変化に基づいて、対象となる対象領域を選択します。「3D FLIKAアルゴリズム」)。
- 処理結果をプロットし、コマンド ウィンドウでプロセス関数とプロット関数を呼び出して、特定された対象領域を異なる色で表示します。各 ROI は時間と空間で区別され、オーバーレイマスクとして表されます (図 4)。
- 目ではっきりと見える ROI がアルゴリズムによって検出されない場合は 、opt_config 関数を呼び出して値を調整することにより、最適化ボックス内の組み込みパラメーターを変更します。
- 最適化ボックスでプロセスボタンを選択して、新しいパラメータを適用します。最適化プロセスでは、より多くのROIを特定する必要があります(図4B)。
- ROI をムービーとしてプロットし、最適化ウィンドウ内で デフォルト ボックスのモードを ムービー に変更して、アクティビティの領域(虹色で輪郭を描いたもの)を明確に識別し、さらに視覚化します。
- コマンド ウィンドウで output_data 関数を呼び出して、データを csv ファイルとして出力します。このファイルは、統計プログラムでさらに分析できます。
注:解析パラメータは、任意のタイプの動的な細胞信号(カルシウム、FRET比など)に合わせて調整できます。上記の手順はすべて、同じ設定で多くのカルシウムムービーをバッチ処理するために、簡単なプログラミングコードで自動化することができます。
- ラインスキャン血流解析.
- セクション3.5で取得したラインスキャンのキモグラフデータファイルをプログラミングソフトウェアにインポートします。
- コードは「チャンネル1と2に何が表示されますか?」プロンプトが表示されたら、各チャネルの内容を定義します。この例では、チャネル 1 は空白 ( タイプ 0)、チャネル 2 は blood_plasma (タイプ 1)です。
- LineScanDiam関数を呼び出してラインスキャンで直径解析機能を実行し、キモグラフ内の直径に対応する領域を選択するボックスを開きます (図 5B、左)。
- 血管径に対応するキモグラフ蛍光境界の外側にボックスを描画します。
- このデータクラスを処理するには、工程関数を呼び出して、容器径の全幅を半極大で測定し、プロット関数を使用してプロット(図5C)を生成します。
- コマンド ウィンドウで output_data 関数を呼び出して、データを csv ファイルとして出力します。このファイルは、統計プログラムでさらに分析できます。
- 速度ラドン変換解析を実行するには 、LineScanVel 関数を呼び出して、ボックスを開いて、キモグラフの RBC 速度に対応する領域を選択します (図 5B、右)。
- 血管速度に対応するキモグラフ蛍光の境界内にボックスを描きます。
- このデータクラスを処理するには、プロセス関数を呼び出して、蛍光中の筋の角度から赤血球の速度、流束、および線形密度を計算します。プロット関数を使用してプロット(図5D)を生成します。
- コマンド ウィンドウで output_data 関数を呼び出して、データを csv ファイルとして出力します。このファイルは、統計プログラムでさらに分析できます。
注意:直径と速度の解析を正確に行うには、黒いスペース間に明確に定義されたエッジを持つ明確な蛍光が必要です(図5A、B)。直交線と平行線を正確に描くのは非常に重要ですが、それ以外の場合は、カイモグラフの信頼性の高い分析は不可能です。画像処理アルゴリズムを使用したカルシウム解析と同様に、直径と速度の計算のパラメータを最適化できます。
結果
フルオレセインデキストランは、赤いチャネルに出血することができる広い発光スペクトルを有し、包面性ペリサイトにおけるRCaMP検出に影響を与える(図2A)。ソフトウェアプログラムでデータ取得後のスペクトルアンミックスは、フルオレセインの出血を低減し(図2B、低)、その後の分析ステップでのカルシウムシグナル検出を増強する。
このプロトコルで使用される画像処理アルゴリズムを用いたカルシウム解析により、ROIや細胞内カルシウムの変動(カルシウム信号)を同定する様々なアプローチが可能になります。細胞構造を手作業で選択すると、これらの領域内のカルシウム変動(図3A)を検出することができ、正規化されたカルシウムトレースがローパスおよびバンドパスフィルタリングされた後に、単一のピークやマルチピークなどの異なるタイプの信号ピークを含む(図3B)。さらに、RoIは、Ellefsenらによって開発された画像処理アルゴリズムを使用して時間の経過とともに蛍光強度が変化するアクティブピクセルをグループ化することによって識別され、2018年16日(図4)。これは、信号の予想されるサイズと形状を包含する時間、閾値および空間的パラメータを調整することによって、任意の動的なセルラー信号に適用することができます。信号識別のしきい値を下げると、関心のある領域が増えます (図 4B)。
明るく澄んだ血行力学的な動体を分析して、周囲細胞の近くの血管の直径とRBC速度を測定することができる(図5A、B)。直径は、蛍光の半分の最大で全幅から計算される(図5C)。RBC 速度は、ラベルなしの RBC から作成されたストリークから近似され、角度がラドン変換に入力され、速度、流束(セル/s)、および線形密度(セル/mm;)図5D)。蛍光飽和がある低品質のキモグラフ、ノイズ比の悪さ、またはイメージングフィールドの動き(図6A)は、データが特定できない誤差点(赤十字)を持つ信頼性の低いプロットを作成します(図6B、C)。取得したデータの品質は、良い結果を得る上で重要であり、このプロトコルで説明されている手順に従うことで、良好な結果が得られます。
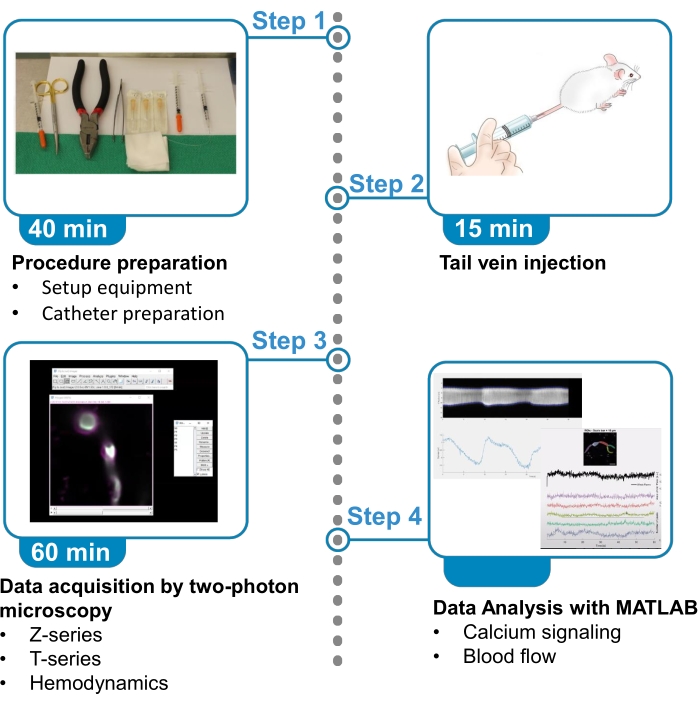
図 1.プロトコルの概要。 このプロトコルは、麻酔薬を使用したマウスの近くの血管から脳を包み込む周囲細胞からの蛍光カルシウム画像と血流データを取得して分析するステップを提示する。プロトコルは4つのステップに分かれています。1)手順の準備:機器やカテーテルの準備の設定。2)尾静脈注射;3) 2光子顕微鏡によるデータ取得4) 画像処理アルゴリズムによるデータ解析 この図の大きなバージョンを表示するには、ここをクリックしてください。
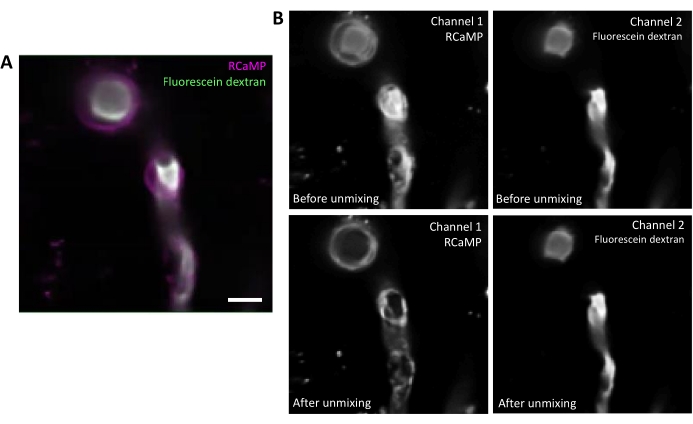
図 2.蛍光ホルのスペクトル非混合。 A) Tシリーズ取得から血管にラベルを付けたRCaMP包細胞およびフルオレセインデキストランの代表的な平均画像。スケールバー= 10 μm.B) アッパー:個々のチャンネルを考慮すると、チャンネル2からのブリードスルーはチャンネル1(左)で明らかです。下方:スペクトルのアンミックス後、ブリードスルーは減少し、RCaMPからの信号は、ペリサイト構造においてより顕著である。 この図の大きなバージョンを表示するには、ここをクリックしてください。
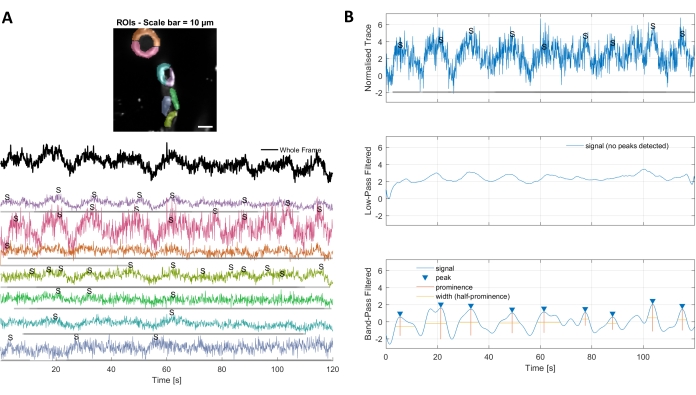
図 3.手で選択されたROIと最適化されたカルシウムの痕跡。 A) 使用画像処理ソフトで選択した対象領域(虹の形状)を用い、カルシウム信号のトレースを同定することができる。B) 正規化されたトレースからの信号ピークは、ローパスとバンドパスでデータをフィルタリングすることで識別されます。信号閾値はベースライン期間の標準偏差の3倍(最初の30フレーム)と定義し、この閾値を超えるピークは信号(低いトレース)とみなされました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
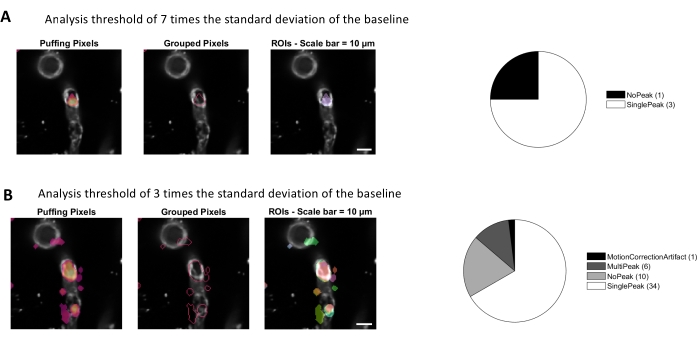
図 4.カルシウム分析のための自動化された活動ベースのROI。 同じデータを、ベースラインの標準偏差(A)の7倍、ベースライン(B)の標準偏差の3倍の閾値で分析した。アクティブピクセルを特定するしきい値を小さくすると、周囲の領域内で RO(B)と信号のピーク(円グラフ)が増加します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
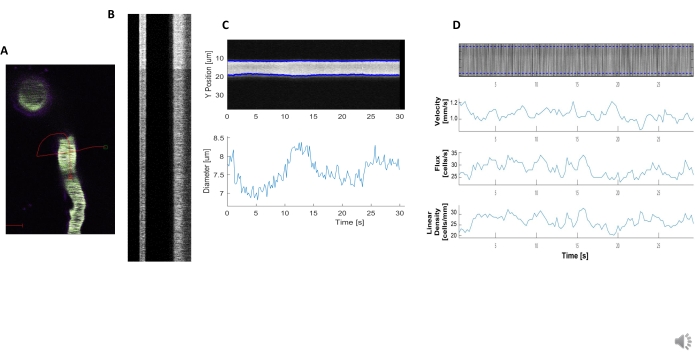
図 5.キモグラフ血力学的測定。 A)船舶を通してラインスキャンの例。B)直径(左)と速度(右)の明確に定義されたキモグラフの例。蛍光の右バンド内の黒い筋は、明確な血管動変動を伴うRMC.C)直径分析に対応しています。D) Y 軸= RBC フラックス(セル/s)、ライン密度(セル/mm)、速度(mm/s)、およびストリーク角度(度)、信号対雑音比(任意の単位、a.u.)、X 軸=時間(秒)のプロットを使用した速度分析 この図の大きなバージョンを表示するには、ここをクリックしてください。
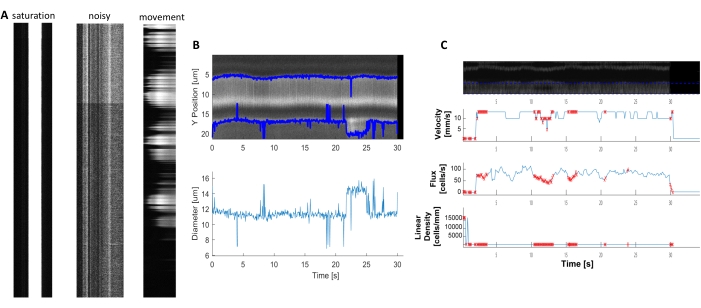
図 6.低品質の血行力学測定の表現。 A) 蛍光飽和、ノイズ比の悪さ、または取得中の撮像場の動きを有する低品質のキモグラフの例。BおよびC)は、キモグラフの品質が悪いために誤差点(赤い点)を有する直径と速度データの 図7 に類似したプロット。(画像 E、Y 軸=直径 (μm)、X 軸=時間(秒)、画像 F、Y 軸 = RBC フラックス(セル/s)、線密度(セル/mm)、速度(mm/s)、およびストリーク角度(度)、信号対雑音比(a.u.)、X 軸=時間(秒)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本方法は、カテーテルによるマウス尾部静脈注入、深度スタック用の2光子顕微鏡画像取得、細胞カルシウムシグナルムービー、血行力学的な動調の作成、および画像処理アルゴリズム17によるカルシウムおよび血行力学解析に関する詳細を提供する(図1)。これらの技術には、in vivoイメージングの結果を改善し、セッション中の時間、資源、および動物ストレスを軽減するいくつかの利点があります。まず、尾静脈注射用カテーテルを使用すると、針、注射器、およびマウスの循環に注入される物質の量をより細かく制御できます。さらに、それは、高価な試薬を節約し、尾部組織への染料注入を防ぎます。第二に、遺伝的にコードされたカルシウムセンサーを包面的なpericytesで発現するトランスジェニックマウスを使用し、その後のイメージングセッションで細胞同定と再配置を長期的に容易にする深度zスタックを用いて脳血管ネットワーク内でそれらを局所化する方法を実証する。これは、ペリサイト研究の重要な要因であり、適切な細胞分類6、7を保証します。第三に、動的な細胞信号を測定するための良い出発点であるカルシウム映画と血行スキャンデータを収集するためのパラメータを提供します。最後に、画像前処理(スペクトルアンミックスなど)、カルシウム画像解析、血行力学解析(直径、速度など)を含む包括的な画像処理ツールボックスである画像処理アルゴリズム17を紹介します。これらのアルゴリズムは、結果を分析するために必要なユーザーの専門知識のレベルを最小限に抑えながら、データを迅速かつ簡単に視覚化するためのプロットを生成できます。さらに、数行のコードで自動化して、同じパラメータを持つ複数のデータセットを迅速にバッチ処理できます。これにより、データの視覚化と研究者の時間投資が向上する可能性があります。
優れたカルシウムイメージングデータを収集する鍵は、蛍光シグナルの取得をクリアするためにレーザーパワーとPMT設定を調整する一方で、カルシウムイベント全体を捕捉するのに十分なフレームレートでデータを収集することです。このプロトコルのデータは毎秒10〜11フレームで取得され、包帯状のペリシテにおける遅いカルシウム振動を捕捉します。分析の結果を改善できるいくつかのステップもあります。まず、蛍光HOREの発光スペクトル間に有意な重複がある場合には、スペクトルの混入解除が有益である(図2)。フルオレセインデキストランは、血行力学測定に一般的に使用される費用対効果が高く、市販のデキストランコンジュゲートであるため、このプロトコルで使用された。スペクトルを混ぜずくましては、カルシウム信号の検出を強化するためのデータをクリーンアップするのに役立ちますが、より狭い発光スペクトルを持つ代替蛍光体も使用できます。第二に、細胞構造をROI(図3)として手で選択することは、ソーマまたはプロセス分岐などの異なるサブ細胞領域におけるカルシウム事象を分類するのに有用である。活動ベースの ROI 選択 (図 4)16は、個々のカルシウムイベントに関する空間的および時間的な情報を提供します。これは、特定の領域のカルシウムイベントの頻度や他の細胞領域へのイベントの伝播を決定する際に役立ちます。イメージングデータを解析するプログラミングソフトウェアを使用すると、データがバッチ処理される時間を研究者に節約できますが、最適な結果を得るためにパラメータを調整するには、初期の時間の投資が必要です。最も重要な要素は、アクティブ領域の予想サイズ(μm2)と信号の持続時間(最小信号時間と最大信号時間を定義する必要があります)です。研究者は、データに適合するパラメータを最もよく判断するために、最初にいくつかのサンプルTシリーズ映画を調べる必要があります。最後に、顕微鏡で得られる低品質のデータは、カルシウムとヘモダイナミクスの分析を大きく妨げる可能性があります(図6)。したがって、最初に顕微鏡の取得設定を最適化するために注意する必要があります。これらの要因を念頭に置いて、カルシウムイメージングまたは他の組織または細胞タイプの他の動的な細胞信号(例えば、蛍光ナトリウム、カリウム、代謝物、または電圧変動)の分析に合わせて適合させることができるこのプロトコル。
このプロトコルには、いくつかの制限があります。まず、データは麻酔下で収集され、脳活動に影響を与え、血流に影響を与える可能性があります。同様のイメージングは、より生理学的な結果のために頭部固定を受け入れるように訓練された目覚めのマウスで行うことができる。また、 生体内の3次元細胞と血管の2次元画像を収集することを覚えておくことが重要です。したがって、これらの細胞内のカルシウム事象のファクションまたは血管の単一のセクションの血流を一度に捕捉することしかできません。
注意すべきもう一つの制限は、2光子のカルシウムイメージングは、焦点面の出入りの動きがカルシウム変動と間違えられる運動アーティファクトに敏感であるということです。このプロトコルは、動物の動きを制限する麻酔下で行われました。しかし、動きのアーティファクトは、マウスの呼吸数、心拍数、組織の腫脹の可能性、および血管収縮または血管運動4、血管収縮または血管運動の場合には、19の呼吸数によって導入することができる。モーションアーティファクトは、いくつかの戦略で軽減できます。このプロトコルで使用される画像処理パッケージには、2D畳み込みエンジンを利用して、可視血管構造13,17に基づいてTシリーズ内の画像を整列させるオプションのモーション補正ステップが含まれる。焦点面に大きな変化を伴うフレームはこのアルゴリズムによって識別され、分析から除外することができます。また、蛍光トレースを生成する際のZスコアなどの画像処理パッケージ内での統計戦略を用い、カルシウム変動誘導運動20を正常化することができる。2光子イメージングにおける動きのアーティファクトを説明する最も堅牢なアプローチは、カルシウム指標(GCaMPなど)とカルシウム非依存性蛍光レポーター(例えば、mCherry)など、同じ細胞内の2つの蛍光指標の発現を組み合わせることです。蛍光レポーターの変動は、動きに起因し、運動アーティファクトを正常化するためにカルシウムインジケータ信号から差し引かれます。
本プロトコルの目的は、最適なカルシウムイメージングと血流データを 生体内で 収集する方法を明確に理解し、研究者が結果を改善するために実装できる新しい方法と分析ツールを提示することです。これらの技術は、血流制御または異なる脳疾患状態における異なるペリサイト集団の役割を研究するために適用することができる。これらのイメージングパラメータは、他の細胞型および器官系におけるカルシウムおよび血流を研究するためにも使用することができ、同様の原則は、カルシウムを超えて、他の遺伝的にコードされたセンサーによって可能になる他の動的イメージング技術に適用される。
開示事項
著者らは開示するものは何もない。
謝辞
J.メザはミタクとリサーチマニトバのフェローシップに支えられています。この研究のための資金は、カナダ保健研究所、研究マニトバ州、マニトバ医療サービス財団、カナダ脳研究基金を通じてマニトバ大学とカナダ脳大学からのスタートアップ資金によって提供されました, 健康カナダとアズリエリ財団の財政支援を受けて.ここに記載されている見解は、必ずしも保健大臣またはカナダ政府の見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Acta2-RCaMP1.07 | The Jackson Laboratory | 28345 | In the video protocol the animal model used is a female mouse of 10 months, 1 day old. |
| Applicators (Regular) | Bisco | X-80250P | |
| BioFormats package for MATLAB | NA | NA | Denominated in this protocol as "image processing packages". Available in: https://docs.openmicroscopy.org/bio-formats/ |
| CHIPS MATLAB toolbox | NA | NA | Denomitaded in this protocol as "image processing algorithms". Barrett MJP, Ferrari KD, Stobart JL, Holub M, Weber B. CHIPS: an Extensible Toolbox for Cellular and Hemodynamic Two-Photon Image Analysis. Neuroinformatics. 2018;16(1):145-147. doi:10.1007/s12021-017-9344-y. Available in: https://github.com/EIN-lab/CHIPS |
| Clear Ultrasound Gel, Medium viscosity | HealthCare Plus | UGC250 | |
| Dextran, fluorescein, 70,000 MW, anionic | Thermo Fisher Scientific | D1823 | |
| Dextran, Texas Red, 70,000 MW, neutral | Thermo Fisher Scientific | D1830 | |
| Eye Lube Plus | Optixcare | NA | |
| FIJI | Image J | NA | Denominated in this protocol as "image processor software". Available in: https://imagej.net/Fiji/Downloads |
| GCaMP6sfl/fl | The Jackson Laboratory | ||
| Head Post fixing platform | University of Zurich | NA | |
| Ketamine (Narketan 100 mg/mL) | Vetoquinol | 440893 | |
| MATLAB R2020b | NA | Denominated in this protocol as "programming platform ". Available in: https://www.mathworks.com/downloads/ | |
| Needle 0.3mmx25mm | BD PrecisionGlide | 305128 | |
| Objective XLUMPLFLN20XW | Olympus | NA | https://www.olympus-lifescience.com/en/objectives/lumplfln-w/ |
| PDGFRβ-CreERT2 | The Jackson Laboratory | 30201 | |
| Polyethylene Tubing, PE10 I.D. 28mm (0.11”) O.D. 61mm (.024”) | BD Intramedic | 427401 | |
| Prairie View | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Ultima In Vitro Multiphoton Microscope | Bruker Fluorescence Microscopy | NA | https://www.bruker.com/en/products-and-solutions/fluorescence-microscopy/multiphoton-microscopes/ultima-in-vitro.html |
| Under Tank Heater | Reptitherm U.T.H | E169064 | |
| Xylazine (Rompun 20 mg/mL) | Bayer HealthCare | 2169592 |
参考文献
- Armulik, A., Genové, G., Betsholtz, C. Pericytes: Developmental, physiological, and pathological perspectives, problems, and promises. Developmental Cell. 21 (2), 193-215 (2011).
- Armulik, A., et al. Pericytes regulate the blood-brain barrier. Nature. 468 (7323), 557-561 (2010).
- Berthiaume, A. -. A., et al. Dynamic remodeling of pericytes in vivo maintains capillary coverage in the adult mouse brain. Cell Reports. 22 (1), 8-16 (2018).
- Rungta, R. L., Chaigneau, E., Osmanski, B. -. F. F., Charpak, S. Vascular compartmentalization of functional hyperemia from the synapse to the pia. Neuron. 99 (2), 362-375 (2018).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nature Methods. 9 (3), 273-276 (2012).
- Gonzales, A. L., et al. Contractile pericytes determine the direction of blood flow at capillary junctions. Proceedings of the National Academy of Sciences of the United States of America. 117 (43), 27022-27033 (2020).
- Hartmann, D. a., et al. Pericyte structure and distribution in the cerebral cortex revealed by high-resolution imaging of transgenic mice. Neurophotonics. 2 (4), 041402 (2015).
- Grant, R. I., et al. Organizational hierarchy and structural diversity of microvascular pericytes in adult mouse cortex. Journal of Cerebral Blood Flow & Metabolism. 39 (3), 411-425 (2017).
- Hill, R. A., Tong, L., Yuan, P., Murikinati, S., Gupta, S., Grutzendler, J. Regional blood flow in the normal and ischemic brain is controlled by arteriolar smooth muscle cell contractility and not by capillary pericytes. Neuron. 87 (1), 95-110 (2015).
- 28345 - STOCK Tg(RP23-370F21-RCaMP1.07)B3-3Mik/J. Jackson Laboratory Available from: https://www.jax.org/strain/028345 (2021)
- Ohkura, M., Sasaki, T., Kobayashi, C., Ikegaya, Y., Nakai, J. An improved genetically encoded red fluorescent Ca2+ indicator for detecting optically evoked action potentials. PLoS ONE. 7 (7), (2012).
- Stobart, J. L., et al. Long-term in vivo calcium imaging of astrocytes reveals distinct cellular compartment responses to sensory stimulation. Cerebral Cortex. 28 (1), 184-198 (2018).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Mostany, R., Portera-Cailliau, C. A craniotomy surgery procedure for chronic brain imaging. JoVE. (12), e680 (2008).
- Lin, X., et al. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. JoVE. (143), e56297 (2019).
- Ellefsen, K. L., Settle, B., Parker, I., Smith, I. F. An algorithm for automated detection, localization and measurement of local calcium signals from camera-based imaging. Cell Calcium. 56 (3), 147-156 (2014).
- Barrett, M. J. P., Ferrari, K. D., Stobart, J. L., Holub, M., Weber, B. CHIPS: an extensible toolbox for cellular and hemodynamic two-photon image analysis. Neuroinformatics. 16, 145-147 (2018).
- Hall, C. N., et al. Capillary pericytes regulate cerebral blood flow in health and disease. Nature. 508 (1), 55-60 (2014).
- Nilsson, H., Aalkjaer, C. Vasomotion: mechanisms and physiological importance. Molecular interventions. 3 (2), 79-89 (2003).
- Rungta, R. L., et al. Vascular arbors in layer II / III somatosensory cortex. Communications Biology. , (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved