Method Article
ברייטפילד בו זמנית, פלואורסצנטיות והדמיה טומוגרפית קוהרנטית אופטית של התלקחות טרבקולה לב Ex Vivo
In This Article
Summary
פרוטוקול זה מציג אוסף של נתונים גיאומטריים סרקומר, סידן ומקרוסקופיים מ trabecula ex vivoמתכווצת באופן פעיל . מדידות סימולטניות אלה מתאפשרות על ידי שילוב של שלוש שיטות הדמיה.
Abstract
בשריר הלב, Ca2+ ארעי תאיים להפעיל myofilaments התכווצות, גרימת התכווצות, קיצור מקרוסקופי, ועיוות גיאומטרי. ההבנה שלנו של היחסים הפנימיים בין אירועים אלה הוגבלה מכיוון שאיננו יכולים 'לראות' בתוך השריר ולא לעקוב במדויק אחר הטבע המרחבי-זמני של דינמיקת עירור-התכווצות. כדי לפתור בעיות אלה, בנינו מכשיר המשלב חבילה של שיטות הדמיה. באופן ספציפי, הוא משלב מיקרוסקופ Brightfield כדי למדוד שינויים מקומיים של אורך sarcomere ומתח רקמות, מיקרוסקופ פלואורסצנטי כדי לדמיין את Ca2 + ארעי, וטומוגרפיה קוהרנטית אופטית כדי ללכוד את השינויים הגיאומטריים של הרקמה לאורך הזמן של מחזור הלב. אנו מציגים כאן את תשתית ההדמיה ואת מסגרת איסוף הנתונים המשויכת. נתונים נאספים ממבני רקמות מבודדים דמויי מוט המכונה קרנאה trabeculae. במכשיר שלנו, זוג ווים פלטינה הנשלטים על-ידי מיקום מחזיקים כל קצה של דגימת שריר ex vivo בזמן שהוא מועשר ללא הרף בתמיסת מלח עשירה בחומרים מזינים. הקרסים נמצאים תחת שליטה עצמאית, ומאפשרים שליטה בזמן אמת על אורך השריר וכוח. תרגום אורך מאפשר סריקה חלקה של המדגם, התגברות על מגבלות הקשורות לגודל היחסי של חלון הדמיית המיקרוסקופ (540 מיקרומטר על 540 מיקרומטר) ואורך של טרבקולה טיפוסית (>2000 מיקרומטר). אלקטרודות פלטינה משני קצות תא השרירים מעוררות את הטרבקולה בקצב המוגדר על ידי המשתמש. אנו מנצלים את אות הגירוי כגורם מפעיל לסנכרון הנתונים מכל חלון הדמיה כדי לשחזר את כל העוויתות של הדגימה בתנאי מצב יציב. החלת טכניקות עיבוד תמונה על נתוני הדמיה אלה של Brightfield מספקת עקירת רקמות ומפות אורך סרקומר. אוסף כזה של נתונים, כאשר הוא משולב בצינור מידול ניסויים, יספק הבנה עמוקה יותר של הומוגניות התכווצות שרירים והטרוגניות בפיזיולוגיה ובפתופיזיולוגיה.
Introduction
Superfusion של תכשירי רקמת שריר לב מבודדת הוא פרוטוקול סטנדרטי בשימוש נרחב לחקר הפעלה יונית לב ומכניקה1. בפרט, בידוד של trabeculae, מבנים דמויי מוט מקירות החדר, אפשר הערכה של תופעות כולל הפעלה תלוית אורך של התכווצות 2 ,תגובהתלוית מתיחה של התכווצות3,4, וצמיגות דיאסטולית5 של רקמת לב. טר קורס, היוזם של טכניקה זו של superfusing trabeculae מבודד, השתמש בתחילה בשילוב של הדמיית פלואורסצנטיות עבור מדידות Ca2 + עקיפה לייזר לקביעת אורכים סרקומר2,5. מאז מחקרים מוקדמים אלה, זה הפך נפוץ יותר ויותר כדי לחלץ מידע אורך sarcomere עם רזולוציה מרחבית גדולה יותר באמצעות 2D מהר פורייה טרנספורמציה (FFT) מבוסס טכניקות6 על תמונות מיקרוסקופיה Brightfield. שתי מערכות ההדמיה מאפשרות הערכה חלקית של היחסים הבסיסיים בין שחרור Ca2+ לבין ייצור כוח תלוי אורך Sarcomere.
שריר הלב מפוספס, עם פסים גלויים הקשורים סדרה בסיסית של יחידות התכווצות המורכבות חוטים עבים ועבים. האינטראקציה של חוטים מכוננים אלה המרכיבים sarcomeres ביסוד ייצור כוח, אשר מתחיל כדלקמן: אות חשמלי depolarizing, או פוטנציאל פעולה, גורם למתח תלוי L-סוג Ca2 + ערוצים בקרום התא לפתוח; הזרם התאי שלאחר מכן של Ca2+ עורר את שחרורו של Ca2+ מהניתוק הסרקופלסמי (SR), חנות Ca2+ תאית, בתהליך המכונה Ca2+- המושרה Ca2 + שחרור7; עלייה פתאומית זו בריכוז Ca2+ תאיים מננומולאר לטווח מיקרומולרי מאפשרת לייצור כוח להתרחש; Ca2 + משאבות ללא הרף extrude Ca2 + מתוך cytosol בחזרה לתוך SR ותא חוץ תאי; כאשר ריכוז Ca2+ תאיים חוזר לטווח nanomolar, ייצור כוח מפסיק, ואת השריר מרגיע. במהלך ייצור הכוח, הסיבים העבים והדקים המרכיבים מחליקים זה על זה. אורך הסרקום מכתיב את היקף החפיפה היחסי, ולכן את הפוטנציאל לייצור כוח של השריר מקרוסקופי.
במאמר זה, אנו מרחיבים טכניקות הדמיה פלואורסצנטיות-brightfield אלה כדי לכלול טומוגרפיה קוהרנטיות אופטית (OCT). OCT מנצל את העיקרון הפיזי של הפרעה ומסוגל להשיג את העיוות הגיאומטרי של הרקמה כדי להבין את ההטרוגניות התכווצות השריר8. המכשיר שלנו(איור 1)משתמש במערכת OCT (SD-OCT) דומיין ספקטרלי. ב-SD-OCT, מפצל קרן מפצל את האור מדיודה בעלת אורך-על קצרה באורך קוהרנטיות לזרועות ייחוס ומדידה. זרוע הייחוס מכילה מראה קבועה, וזרוע המדידה מכילה גלוונומטר 2D כדי לנווט את האור. אור אחורי שנקטף מהדגימה נאסף ומפריע לאור המוחזר בזרוע הייחוס כדי ליצור דפוס הפרעה. מידע העומק מקודד בתדר השוליים הספקטרליים. כדי לחלץ את המידע, האות מועבר דרך ספקטרומטר ו- FFT הפוך מוחל על התוצאה. האות 1D המתאים מייצג את המבנים בעומקים שונים, המתאימים לשינויים באינדקס שבירה9 (A-scan). על ידי היגוי הלייזר בציר יחיד, ניתן לבנות חתך רוחב של מדגם העניין (B-scan) ובאופן דומה, על ידי חזרה על התהליך בתבנית צעד-חכם בציר הנותר, ניתן ליצור תמונה תלת ממדית (C-scan). בהרחבה, ניתן לאסוף סדרה של סריקות B בפרוסה אחת עבור נושא משתנה בזמן חוזר המבוסס על גורם מפעיל חיצוני ולחזור על הפעולה כדי ליצור סריקה תלת ממדית, המייצגת תמונה מצוענת משתנה בזמן10.
בשילוב שלוש מערכות ההדמיה, שקלנו את שני העקרונות הבאים. ראשית, חיישני הדמיה לא צריכים לזהות אור ממודל הדמיה חלופי, ושנית, העיצוב הפיזי צריך להכיל שטח פנוי לשלושה מטוסי הדמיה בו זמנית לפחות. כדי לענות על הדרישה הראשונה, המיקרוסקופ Brightfield משתמש ב-LED אורך גל של 660 ננומטר כדי להאיר את הדגימה בתצורה הפוכה. מיקרוסקופ הפלואורסצנטיות נמצא בתצורת אפיפלואורסצנטיות שבה אותה עדשה אובייקטיבית משמשת הן לערעור והן לאוסף של האור הנפלט. לאור העירור יש אורך גל של בין 340 ננומטר ל-380 ננומטר, וצינור פוטומולטיפלייר (PMT) מודד את האור הנפלט באורך גל של 510 ננומטר. זוג מראות דיכרוכיות מאפשרים לשני הנתיבים האופטיים הללו לחלוק את אותה טביעת רגל פיזית מבלי להפריע למדידה ההפוכה (איור 2). לבסוף, OCT משתמש בפס רחב (רוחב ספקטרלי של 100 ננומטר) עם אורך גל מרכזי של 840 ננומטר, בנפרד משתי הדרכים האחרות. בשל האופי הנמוך של האור המשמש ל- OCT, כל אור מפוזר ממקורות הפלואורסצנטיות הבהירה לא יתרום לתבנית ההפרעה המקודדת מידע עומק. עבור הדרישה השנייה, עיצוב הדיור עבור הצינור נימי יש מסלולים אופטיים נגישים למישורים הנעשים, הנחותים והנעלים של המדגם. במהלך ניסויים, שני ווים פלטינה להחזיק trabecula בתוך צינור נימי חדור עם פתרון קרבס-Henseleit מחומצן (KH). ראש הגלוונומטר של ה-OCT מכוון באופן אורתוגונלי למסלול ההדמיה של ברייטפילד-פלואורסצנטי כדי לנצל את המישור האופטי האורתוגונל השלישי(איור 3).
מאמר זה מתאר את שיקולי התכנון לבניית מכשיר המסוגל להדמיה בו זמנית סידן, אורך סרקומר וגיאומטריית שרירים. כדי להדגים את יכולות המדידה הללו, אנו מתארים את תהליך בידוד הטרבקולה בחדר, הכנת פתרונות החיץ הדרושים, יחד עם השלבים הקריטיים הכרוכים בטיפול וטעינת פלואורסצנטיות של אקס ויוו טרבקולה. לבסוף, מאמר זה מתאר את התהליכים הדרושים לתרגום ערכת הנתונים לפריטים חזותיים שימושיים יותר.
Protocol
ועדת האתיקה של אוניברסיטת אוקלנד לאתיקה של בעלי חיים אישרה את הטיפול בחולדות והכנת דגימות רקמה.
1. כיול הדמיה
- כיול פיקסל מיקרוסקופ ברייטפילד
- ממלאים את תא המדידה במים מזוקקים.
- מניחים סורג עקיפה עם קווים ידועים לμm לתוך תא המדידה.
- הקש F1 כדי לאפשר את הלכידה ולהתאים את קצב הפריימים [Hz] עד שהסורגים של עקיפה גלויים בבירור(איור 4A). ודא שסורג עקיפה פועל במקביל לקצה המסגרת. הקש F1 שוב כדי להפסיק את הלכידה.
- הגדר את סה"כ תמונות ללכידה? לאחד, הקש Ctrl + Shift + S כדי להזרים נתונים לדיסק והקש F1 כדי ללכוד תמונה של סורג עקיפה.
- פתח את ImageJ וייבוא תמונת הסורגים של עקיפה (קובץ > פתח > בחר תמונת כיול). משמרת מחזיקה, למתוח קו הכולל 20 רצועות אור וכהות של סורג עקיפה.
- כייל את התמונה (ניתוח > קבע קנה מידה). אורך השורה מ- שלב 1.1.5 מגדיר את הערך מרחק בפיקסלים. הגדר את הערך מרחק ידוע לפי 20 מהקווים למדידת מיקרומטר ואת יחידת האורך ל- μm. ההופכי של קנה המידה הוא מספר המיקרומטרים המיוצגים על ידי פיקסל.
- כיול רזולוציית עומק OCT
- מדוד את העובי של שקופית מיקרוסקופ זכוכית באמצעות קליפרים של ורנייה.
- הפעל את מקור הלייזר OCT.
- כסו את ראש הגלוונומטר ולחצו על Get BG כדי למדוד את תבנית ההפרעה ברקע ולהפחית אותה מהמדידה (איור 4B).
- מהדק את שקופית מיקרוסקופ הזכוכית הנמדדת (החל בשלב 1.2.1) בזרוע המדידה של ה- OCT.
- לחץ על הזרמה חיה כדי להציג את תמונת OCT. כוונן את שקופית מיקרוסקופ הזכוכית עד שהיא תיראה בתוך סריקת B.
- כדי ללכוד את תמונת סריקת B, הגדר טווח Y (שלבים) לתמונה, לחץ על זרם B-סריקת נתונים?ולחץ על רכוש.
- יבא את תמונת סריקת B ל- ImageJ (קובץ > פתח > בחר סריקת B). הזזה, למתוח קו בין הגבולות של שקופית מיקרוסקופ זכוכית.
- הגדר את קנה המידה (ניתוח קנה מידה > הגדר). הגדר מרחק ידוע למדידה שנאספה בשלב 1.2.1.
- כדי לחשב את רזולוציית העומק באוויר, תקן את אינדקס השבירה של שקופית המיקרוסקופ (nglass = 1.5175)11 על-ידי הכפלת המדידה לערך פיקסל ב-n זכוכית.
הערה: n זכוכית מצוטט הוא עבור זכוכית בורוסיליקאט. שקופיות מיקרוסקופ יכולות להיות עשויות מחומרים שונים. השתמש באינדקס השבירה המתאים עבור השקופית שנמדדה. - כדי לשנות את קנה המידה של רזולוציית העומק עבור שריר הלב, חלק את הערך לשלב 1.2.9. על ידי nשריר הלב = 1.38 (ערך שדווח בעבר12).
2. הכנת דגימת שריר
- הכן את אסדת הניתוח.
- יוצקים חלק מתמיסת הניתוח (המתוארת בטבלה 1) לקערת מתכת קטנה ומכניסים למקפיא כשעה לפני כריתת הלב.
- הגדירו אסדת ניתוח המבטיחה פתרון ניתוח מחומצן היטב (100% חמצן) ושטפו את כל אחד מקווי הצינורות. ממלאים את תא הניתוח בתמיסת ביתור מחומצן וקושרים באופן רופף תפר 3/0 סביב צנתר זלוף.
- לחתוך את הלב.
- יש להנשים חולדת ויסטאר בת 8-10 שבועות באמצעות איזופלוראן גזי (< 5% בחמצן). אשר הרדמה על ידי צביטת זנב.
- מקם את החולדה המרידה בתנוחת על-עור והזרקו תת עורית באזור הבטן עם תמיסת הפרין (1000 IU/kg). לשמור על הרדמה במשך חמש דקות נוספות כדי לאפשר הפרין להסתובב.
- יש לאחזר את קערת המתכת המכילה תמיסת ביתור מהמקפיא ומניחים אותה ליד ספסל המתת החסד.
הערה: הימנע מהקפאת פתרון הניתוח לחלוטין כדי לאפשר את הטביעה המלאה של הלב הניתח. - העבר את החולדה מורדמת לספסל המתת חסד והמת חסד על ידי נקע צוואר הרחם.
- פתח את תיבת החולדה עם מספריים, תחילה חותך את קיר הגוף לאורך החלק התחתון של בית החזה, ולאחר מכן את הסרעפת, לפני שתמשיך לאורך הגבולות לרוחב של בית החזה. תרים את החזה מהדרך.
- תפוס את הלב ביד אחת בעוד היד השנייה משתמשת בזוג מספריים מעוקלים כדי לחתוך את כלי החיבור (העורקים, הוועד וכו ').
- שקוע במהירות את הלב בתמיסת הניתוח הקר.
- לבודד טרבקולה.
- זהה את העורקים בזמן שהלב נמצא בקערת המתכת, ואז העביר את הלב לתא הניתוח. בעזרת שני מלקחיים מעוקלים, משכו את צינור העורקים מעל צינורית ההזדוה.
- החזק את העורקים במקום עם מלקחיים אחד. בינתיים, פתח את קו הצינורות כדי לאפשר לפתרון הניתוח לזרום דרך צינורית זלוף.
הערה: כוון להשלים זלוף בתוך דקה לאחר כריתת הלב. - ברגע כלי הדם הכלילי מנוקה מדם והלב ספוג לחלוטין בתמיסת הניתוח, לעצור את זרימת זלוף, ולאבטח את העורקים במקום באמצעות תפר. הפעל את הזרימה בחזרה והפוך את הלב המנוקל.
- סובב את הצינורית כך העורק הכלילי השמאלי נראה על פני השטח העליונים. הצמידו את פסגת הלב לתחתית תא הניתוק(איור 5A). חתוך את שתי האטריה(איור 5B).
- בעזרת סט מספריים קפיצי, חתוכים לאורך צד ימין של המחיצה עד לשיא הלב (כפי שצוין באיור 5B). הצמידו את החדר השמאלי הפתוח לבסיס תא הניתוח. לאחר מכן חתכו לאורך הצד השמאלי של המחיצה, פתחו את החדר הימני והצמידו אותו גם לבסיס תא החיתוך(איור 5C).
הערה: על מנת להצמיד את החדרים במצב פתוח, כמה שרירי papillary יהיה צריך להיות חתוך. זהה טרבקולה חופשית בחדר הימני(איור 5D-E). - באמצעות מספריים באביב ומלקחיים, לחתוך את רקמת הקיר המקיף את trabecula, ולאחר מכן לחתוך את רקמת הקיר לחצי אורתוגונית לכיוון הטרבקולה. לקצץ את רקמת הקיר עד הממד שלה מתאים לתצורת הרכבה בשימוש. במקרה זה, כמחצית מגודלו של זרעי שומשום(איור 5F).
הערה: ניתן לנתח את Trabeculae מחדרי ימין ושמאל, אך אלה משמאל הם בדרך כלל עקשים יותר ופחות ישימים למדידות סרקומר וגיאומטריה. - השאירו את הטרבקולה הנבלעת בתא הניתוח, ללא הרף משתלטת על פתרון הניתוח.
3. פרוטוקול ניסיוני
הערה: המכשיר13 המשמש לניסוי זה נבנה בתוך הבית ומשתמש בקוד בקרה מותאם אישית. השיקולים הדרושים לתכנון התקן שנבנה כדי לשכפל נתונים אלה הם שני ווים להרכבה המופעלים באופן עצמאי, תא מדידה עם שלושה צירים ברורים אופטית(איור 3)וקו הדק חיצוני המסנכרן את מצלמות Brightfield ו- OCT עם הממריץ. מתח PMT ואות כוח נאספו באמצעות כרטיסי DAQ אנלוגיים, התמונות ממיקרוסקופ OCT ו- Brightfield נאספו באמצעות כרטיסי תופס מסגרת Camera Link, ואות הגירוי נאסף באמצעות כרטיס קלט/פלט דיגיטלי. הנתונים אוחסנו במצב לא מקוון באמצעות קבוצה של לולאות צרכניות מפיקות כדי לשמור על יישור זמני.
- הכינו את מד הקרדיומיומטר.
- מים חמים (~ 60 מעלות צלזיוס), מים מזוקקים (טמפרטורת החדר), ולאחר מכן פתרון superfusate דרך תא המדידה. בועה ברציפות את פתרון superfusate עם קרבוגן.
- הפעל את מקור תאורת המיקרוסקופ הבהיר והקש F1 כדי לאפשר לכידה (איור 4A). כוונן ידנית את הוו במורד הזרם עד שהוא ירוכז בתמונת Brightfield. לחץ על ציר אפס במורד הזרםולאחר מכן על השבתת הזרם במורד כדי להפוך את המנוע לזמין ( איור4C). הזז את המחוון DS Setpoint [um] עד שסוף הוו יתיישר לקצה אזור העניין המוגדר כברירת מחדל.
- אפס מחדש את הציר במורד הזרם ולאחר מכן הזז את המחוון DS Setpoint [um] ל- 1000. חזור על התהליך עם הוו במעלה הזרם, אך אל תזיז את המחוון SETpoint [um] בארה"ב.
- לחץ על העבר להרכבה (איור 4C).
- הפעל את מערכת תאורת הפלואורסצנטיות על-ידי החלפת מתג המנורה לפני שתפעיל במהירות את מערכות המשנה של הבקר על-ידי החלפת המתג הראשי.
הערה: מקורות אור UV מסוימים מייצרים כמויות גדולות של אוזון. במקרה זה, חבר מחלץ אוזון לפתח האוורור של מקור האור וודא שהוא פועל לפני הפעלת מקור התאורה של הפלואורסצנטיות. - עבור את המצב התפעולי ל- Turbo-Blanking על-ידי לחיצה על לחצן מצב בלוח הקדמי, ואחריו 2ולאחר מכן 1. לחץ על לחצן מקוון כדי לאפשר לקוד הבקרה להודיע על הפעולה.
- הר הטרבקולה.
- השהה את זרימת העל דרך תא המדידה. מלא את תא ההרכבה בפתרון הניתוח.
- בעזרת מזרק של 1 מ"ל, העבירו את הטרבקולה מתא הניתוח לתא ההרכבה(איור 5G).
- כדי להעביר את trabecula, למקם את המזרק אנכית במגע עם פני השטח של פתרון תא הרכבה. אפשר לטרבקולה לרדת לתא הרכבה באמצעות כוח המשיכה(איור 5H).
- להוריד את רמת הנוזל בתא הרכבה, כך שהוא ברמה עם החלק האמצעי של הקרסים.
- התאם את המרחק בין הווים כדי לשקף את אורך המרווח של הטרבקולה על-ידי הזזת המחוון DS Setpoint [um].
- באמצעות מיקרוסקופ כדי לסייע בהדמיה, לאחוז קלות את אחת מחתיכות רקמת הקצה במלקחיים ולהרכיב אותה על הוו במעלה הזרם. הרכיבו את פיסת רקמת הקצה השנייה על הוו במורד הזרם(איור 5I).
- לאחר ההרכבה המאובטחת, הזיזו את הטרבקולה בחזרה לתא המדידה(איור 5J)על ידי לחיצה על העבר לתא (איור 4C). לחדש זרימה superfusate ומיצוי נוזלים.
- הגדר את תדירות הגירוי [Hz] ל- 1, משך הגירוי [ms] עד 10 ומתח גירוי ל- 10. להתחיל גירוי על ידי לחיצה על גירוי על?.
- הכן את הטרבקולה.
- לאחר כ 1 שעות של התאקלמות, בהדרגה להקטין את מתח הגירוי ואת משך הגירוי בשלבים 1 V ו 1 ms, בהתאמה. ערכת ערכים טיפוסית היא 3 V ו- 3 אלפיות שני.
- הפעל את מערכת התאורה של הבהירות. הקש F1 ובחר אזור עניין המקיף אזור מפוסק בממשק המשתמש. לחץ על חשב SL? כדי לחשב את אורך הסרקום הממוצע באזור המסומן. הגדל את אורך השריר עד שאורך הסרקום הממוצע הוא 2.32 מיקרומטר על-ידי הגדלת המחוון 'נקודת הפרדה'.
הערה: לחשב SL? משתמש ב- FFT דו-ממדי המתואר בשלב 4.3. אזור העניין המשמש לחישוב אורך הסרקום הממוצע הוא בדרך כלל 100 מיקרומטר עד 150 מיקרומטר מרובע. לכן, כמו השריר מתקרב אורך sarcomere אופטימלי, 43 עד 65 sarcomeres משמשים לחישוב אורך sarcomere הממוצע. - הזז את השריר על-ידי התאמת המחוון Center Setpoint [um] בכרטיסיה"מרכז ובקרת הפרדה " (איור 4C) כך שהקצה של הוו במורד הזרם נראה רק בתוך תמונת הבהירים. לאסוף את מידע פלואורסצנטיות עבור עשר עוויתות.
- הגדל את ערך נקודת המרכז ב- 200 ואסוף מידע פלואורסצנטי נוסף בשווי 10 עוויתות. חזור על תהליך זה עד שתמונת Brightfield תכילה את הוו במעלה הזרם. לאסוף את שווה של החלון הסופי של מידע פלואורסצנטיות.
- החזר את הטרבקולה למיקום מרכזי על-ידי הגדרת הערך נקודת הקבע המרכזית ל- 0.
- הפחיתו את תדר הגירוי ל-0.2 הרץ ועברו מ-KH superfusate לפתרון הטעינה Fura-2 (מפורט בטבלה 1).
- מדוד את אות הפלואורסצנטיות כל 10 דקות על-ידי לחיצה על אפשר מקור פלואורסצנטיות בכרטיסיה Stim ו- Data. דמיין את אות הפלואורסצנטיות בכרטיסיה אות PMT.
- לאחר אות 360 ננומטר גדל על ידי גורם של 10 או משך הליך הטעינה עלה על 2 שעות, להחזיר את תדר הגירוי ל 1 הרץ ולחזור לפתרון סופר-פוזאט KH.
- בדוק את מדידת היחס כל 10 דקות עד שמדידת היחס מתייצבת, ובשלב זה איסוף הנתונים יכול להתחיל.
- לאסוף נתוני הדמיית ברייפילד ופלואורסצנטיות.
- החזר את השריר למצב שבו הקצה של וו במורד הזרם הוא רק נוכח בתוך התמונה Brightfield. התחל להזרים נתוני חומרה על-ידי לחיצה על זרם נתונים לדיסק בכרטיסיה Stim ו- Data של ממשק המשתמש של בקרת החומרה. לכוד מידע פלואורסצנטי על-ידי לחיצה על אפשר מקור פלואורסצנטי.
- בממשק המשתמש של הדמיית Brightfield, הגדר את מצב הלכידה לגורם מפעיל חיצוני, הגדל את קצב הפריימים ל- 100 הרץ והגדר את מספר התמונות ללכידה ל- 100. הקש Ctrl + Shift + S ואחריו F1 כדי להקליט את נתוני ההדמיה של Brightfield עבור חלון זה.
- הגדל את ערך נקודת הקבע של המרכז ב- 200 וחזור על שלב 3.4.2. המשך בפרוטוקול הסריקה עד לאיסוף נתוני ההדמיה עבור החלון הסופי מ- שלב 3.3.4.
- החזר את הטרבקולה למיקום מרכזי על-ידי הגדרת הערך נקודת הקבע המרכזית ל- 0.
- איסוף נתוני הדמיה OCT.
- הפעל את מקור הלייזר OCT על-ידי הפיכת המפתח הראשי | סמל, לחיצה על לחצן ההפעלה, ואחריו לחצן SLDs.
- כסו את ראש הגלוונומטר ולחצו על Get BG כדי למדוד את תבנית ההפרעה ברקע ולהפחית אותה מהמדידה (איור 4B).
- הגדר את מצב לכידת התמונה לתצוגה חיה.
- כוונן את מיקום ה- yעד שתמונת סריקת B תכילה את הוו במעלה הזרם בלבד. חלק את אורך השריר המוצג בלוח הבקרה הקדמי (איור 4B) בשתיים והפחת את מיקום ה- yהנוכחי. הזן ערך זה בקלט "היסטy". התאםאת הערך "x-היסט" עד שהחתך של הטרבקולה ירוכז במסגרת.
- כאשר הטרבקולה ממורכזת, סרוק לאורך ציר ה- yעל-ידי התאמת מיקום ה- yכדי למצוא את המיקומים המתאימים לווים במעלה הזרם ובמורד הזרם. שים לב למיקומים אלה כלפי מטה. הגדר טווח Y (שלבים) להבדל המוחלט בין ערכים אלה חלקי עשרה.
- הגדר את מצב לכידת התמונה לגירוי מופעל?, טווח X (שלבים) ל- 100 ולחץ על לחצן הגדר פרמטרים פעילים.
- לחץ על זרם B-סריקת נתונים?ולאחר מכן רכוש.
הערה: פרוטוקול ההדמיה המגודרת דורש 200 עוויתות כדי ללכוד את כל גיאומטריית השריר עבור מדגם 2 מ"מ אורך, אשר מתאים לזמן לכידה של ~ 3 דקות 20 s.
4. עיבוד ערכת הנתונים של התמונה של Brightfield
- הכן את התמונות לניתוח.
- יבא תמונות ל- ImageJ (קובץ > ייבוא > רצף תמונות > בחר תמונה).
- הגדל את חדות התמונה(תמונה > התאם > בהירות/ניגודיות > הזז מחוונים מינימליים ומקסימום כדי לרכז את היסטוגרמה של התמונה).
- חידדו את התמונות(מעבדים מסנני > > בטל חידוד מסיכה > להגדיר רדיוס (סיגמא) ל-1.0 פיקסלים ומשקל מסיכה (0.1-0.9) עד 0.6).
- יצא את רצף התמונות (שמור כ> רצף תמונות > הגדר את העיצוב ל- PNG, התחל ב- 0 וספרות (1-8) עד 4).
- תפרו את התמונות, מדדו את ההעתקה המותאמת לשפות מקומיות וחשבו את אורכי הסרקום המקומיים.
- פתח את "TrabeculaProcessing.m" (זמין על פי בקשה) והגדר את המשתנה FolderPath לתיקיה הראשית המכילה את כל הנתונים, ואת ImagePath לתיקיה שבה נשמר רצף התמונה מ- שלב 4.1.4. הגדר מקטעים למספר חלונות ההדמיה והמסגרות למספר המסגרות שנלכדו בכל חלון.
- תריץ את הקוד.
הערה: הפלטים יהיו נוכחים בנתיב תיקיית הפלט שצוין על-ידי המשתמש. (כברירת מחדל, הנתיב מוגדר ל- FolderPath/Output).
- טכניקת אורך סרקומר FFT
- השתמש בתוכנת עיבוד תמונה כדי לבצע FFT באזור בתמונה שבו סרקומורים גלויים מאוד.
- הכפל את הפיקסלים לכיול מיקרומטר תוצאות שלב 1.1.6 על 1.6 מיקרומטר ו- 3.0 מיקרומטר לפני חישוב ההופכי כדי לקבל את טווח התדרים המרחביים של עניין.
- התאם מעריכי לתוצאת ה- FFT, תוך התעלמות ממידע התדרים בטווח התדרים המחושב בשלב 4.3.2, והפחת אותו מתוצאת ההמרה כדי להסיר את מונח ה- DC.
- התאם עקומת גאוס לרצועת התדירות של עניין.
- חשב את ההופכי של פסגת העקומה הגאוסית. זהו אורך הסרקום הממוצע לאזור העניין.
הערה: חישוב FFT והתאמה של משוואות מעריכיות וגאוסיות בוצעו באמצעות קוד LabVIEW מותאם אישית.
5. לעבד את נתוני הפלואורסצנטיות
- הפחת את ההזרמה האוטומטית התלויה בחלון מהחלון המתאים וחשב את כמות האותות המשויכים לאורכי הגל של 340 ננומטר ו- 380 ננומטר.
6. עיבוד נתוני הדמיית OCT
- הכן את ערכת התמונה OCT לפילוח.
- פתח את ImageJ וייבוא התמונות (קובץ > ייבוא > רצף תמונות). בחלון סייר הקבצים, פעולה זו נפתחת, אתר את התמונות, בחר אחת ולחץ על פתח.
הערה: אם קוד הפקד עבור OCT אינו מאחסן את התמונות בתבנית הניתנת לקריאה על-ידי ImageJ, המר אותן ל- PNG. - כדי להקל על הפריט החזותי, ארגן את רצף התמונה בערימת-על (תמונה > Hyperstacks > מחסנית לערימת-על). בתיבת הדו-שיח שנפתחת, הגדר את מספר הפרוסות למספר סריקות B לפרוסה ואת ה- X למספר הפרוסות לאורך הטרבקולה.
- צייר מלבן שמקיף את הטרבקולה. ודא שהוא מקיף את עוצמת הקול כולה לאורך זמן באמצעות המחוונים בחלון ההיפר-ערק. חתוך את התמונה לחלון (תמונה > חיתוך).
- הסר פרוסות המכילות תמונות של ווים הרכבה (ערימות > כלים > שומר פרוסות). בחר את טווח הפרוסות המכיל מידע trabecula בלבד.
- פתח את ImageJ וייבוא התמונות (קובץ > ייבוא > רצף תמונות). בחלון סייר הקבצים, פעולה זו נפתחת, אתר את התמונות, בחר אחת ולחץ על פתח.
- פילוח WEKA רכבת.
- פתח את פילוח WEKA (פלחון תוספים > > פילוח Weka ניתן להתאמן).
- הגדר את מצב הבחירה כ- Freehand.
- לחץ על הגדרות והתאם את הגדרות המסווג וההדרכה. (עבור מודל זה, נעשה שימוש בתכונות האימון הבאות: טשטוש גאוסי, מסנן סובל, הסיאן, הבדל של גאוסים, הקרנות ממברנה, דו-צדדי וליפשיץ. עובי הממברנה הוגדר 1, גודל תיקון ממברנה ל 8, סיגמא מינימלית ל 1, וסיגמא מקסימלית ל 32. המסווג הוגדר כ- FastRandomForest ואפשרויות המסווג הוגדרו כ: batchSize 100, maxDepth עד 32, numFeatures ל- 32, numThreads ל- 0 ו- numTrees ל- 200.)
- פלח תמונות באופן ידני עד שההכשרה גורמת לפילוח משביע רצון.
- שמור את המסווג.
- פלח את סריקות ה-B המעובדות
- הפעל פילוח WEKA בעקבות שלב 6.2.1.
- טען את המסווג מ- שלב 6.2.5.
- לחץ על צור תוצאה.
- המר את התמונות ל- 8 סיביות (תמונה > סוג > 8 סיביות).
- המר את התמונות לקבצים בינאריים (תהליך > בינארי > הפוך > בינארי לפעולת ברירת מחדל ורקע ברירת מחדל).
- שמור כרצף תמונות (PNG).
- חשב את CSA הממוצע בתמונות B-סריקה מקוטעות.
- ספרו את מספר הפיקסלים הלבנים בתמונת סריקת B בינארית.
- הכפל את אזור הפיקסלים ברזולוציית העומק המכוילת (מ- שלב 1.2) ו- 10 מיקרומטר (המרחק בין סריקות A שכנות).
- חזור על הפעולה עבור כל סריקות B בין הווים וממוצע המדידות.
- המרת תמונה מקוטעת לרשת-רשת.
- פתח את "OCTmain.m" (זמין על פי בקשה) והגדר תמונהDirectory לתיקיה המכילה את הפלט מ- שלב 6.3.6. הגדר את הפלטPath לפי הצורך.
- הגדר פרוסות לערך של "טווח Y (שלבים)" (שלב 3.5.5) ומסגרות לערך של "חזור על X" (שלב 3.5.6), z_dim לרזולוציית העומק (שלב 1.2.10) ו- x_dim y_dim לערך שהוקצה ל- 10.
- לחץ על הפעל.
תוצאות
על מנת ללכוד את המידע האזורי Ca2+ ו brightfield לכל אורכו של trabecula שהוצג כאן, שבע עמדות שריר נדרשו. איור 6 מצביע על כך שכוח העווית לא הופרע על ידי תנועה זו, וחשף כי לא הייתה תלות בעמדה של ייצור הכוח הפעיל.
סריקות B שנאספו באמצעות טומוגרפיה קוהרנטית אופטית בקצב של 100 הרץ נותחו באמצעות תוסף ImageJ WEKA14 (איור 7A). כל חתך נראה מעוות בשל ההבדל בין הרזולוציות לרוחב (10 מיקרומטר) ועומק (1.73 מיקרומטר (בשריר הלב)). עיוות זה תוקן על-ידי שינוי קנה המידה של ציר העומק של התמונה על-ידי יחס רזולוציית הרזולוציה-עומק לרוחב. איור 7B,C מדגים כי לאחר שינוי קנה המידה של C-scan הגולמי של הטרבקולה הוא גלילי בקירוב בגיאומטריה. ההשתקפות של קיר תא המדידה יכולה לפעמים לחפוף עם נתוני השרירים (איור 7A,B),אך ניתן לאמן את תוכנת הפילוח כדי להסביר זאת (איור 7D,E). לאחר החתך, ניתן לחשב את האזור החתך לאורך השריר לאורך כל העווית(איור 7F). שים לב כי trabecula מסוים זה יש תוספת קטנה המסתעפת ממנו. התנועה של הענף ניכרת ~ 0.75 מ"מ לאורך trabecula. לבסוף, ניתן להמיר את התמונות המפולח לרשתות כדי לסייע בבניית מודלים גיאומטריים(איור 7G).
נתוני הדמיה שנלכדו בכל אחת ממיקומים שונים של טרבקולה בקצב של 100 fps נתפרו יחד כדי ליצור תמונה מלאה אחת של הטרבקולה(איור 8A). הרזולוציה של תמונות אלה היא 0.535 מיקרומטר/פיקסל. השימוש בפונקציות שקלול ליניאריות באזורים החופפים של חלונות שכנים מסייע להדמיה וממזער את ההשפעה של הסצנה הקיימת בתמונות Brightfield. כדי למדוד את האות הפלואורסצנטי, חלון 540 מיקרומטר על 540 מיקרומטר של הטרבקולה מואר באופן מחזורי עם 340 ננומטר, 365 ננומטר ואור אורך גל של 380 ננומטר בקצב של 600 הרץ. היחס בין הפלואורסצנטיות הנפלטת הקשורה לאור העירור של 340 ננומטר ו-380 ננומטר תואם לסידן התאי לאחר שהטרבקולה נטענת ב-Fura-2. מכיוון שמדידה זו היא יחס, קצב המדידה האפקטיבי הוא 200 הרץ. הממוצע (n = 10) ארעי Ca2+ תאיים מכל חלון מיושר עם האזור שהם צולמו (איור 8B). בעוד שיא הארעיים נראה עקבי למדי, הדיאסטולי [Ca2+] נמוך יותר בתוך האזור בין 900 מיקרומטר ל 1800 מיקרומטר לאורך הטרבקולה. באופן דומה, התוצאות של מעקב ההעתקה (איור 8C) וחישובי אורך הסרקום(איור 8D)מצביעים גם הם על נוכחות של שונות אזורית. טכניקת המעקב ללא סמן המשמשת מסוגלת לעבד את ההעתקה של כל פיקסל, בהינתן ניגודיות מספקת. בעת מיפוי ההתפלגות של אורכי sarcomere בדואר, אזור מתאם צולב של 128 פיקסלים על ידי 128 פיקסלים (~ 67 מיקרומטר על 67 מיקרומטר) שימש לחישוב אורך sarcomere אזורי. אזור זה עוטף כ-29 סרקומרים כאשר סגירת המדגם קרובה לאורך סרקומר אופטימלי. גודל השלב (הן בכיווני x והן ב- y-כיוונים) בין המרכז של כל חלון מתאם צולב הוגדר ל- 50 פיקסלים (~ 26 מיקרומטר) לעיבוד נתונים אלה. ההתאמה של הערכות אורך sarcomere נבדקו בהתבסס על הרוחב והמשרעת של ההתאמה הגאוסית לאות FFT. תנאים אלה לא התקיימו באזור השריר בין 0μm ו 500 מיקרומטר ולכן לא ניתן לחשב שם מידע באורך סרקומר. בהתחשב בתזוזות הקשורות, סביר להניח כי sarcomeres באזור זה התארכו במהלך שלב התכווצות. בהתאם לספקולציות אלה, אורכו הממוצע של הסרקום בצד ימין של הטרבקולה מתקצר בתקופה זו. על ידי שילוב המידע המסופק על ידי כל אחד מהלוחות, נראה כי האזור עם האזור החתך הגדול ביותר אינו מייצר את הכוח המשמעותי ביותר. בהנחה כי השונות האזורית של Ca2 + ארעי יש שיפוע חלקה בקירוב, איור 8B מציין כי המשרעת הגדולה ביותר Ca2 + ארעי מתרחש איפשהו בין 1300 מיקרומטר ו 1600 מיקרומטר לאורך trabecula. מפת ההעתקה מציינת שהאזור שעובר את התנועה הנמוכה ביותר מיישר קו עם שיא Ca2+ ארעי. עם זאת, באזור זה יש את האזורים הקטנים ביותר בחתך של המדגם. עם נתונים אלה בחשבון, אפשר להסיק כי אזור זה יצר את הלחץ ביותר.

איור 1: תמונה ביאורית של הקרדיומיומטר. כל אחד מהרכיבים האופטיים העיקריים הוא מתואר. ה- Inset מכיל תקריב, מבט אחורי, של מטרת המיקרוסקופ במקום, מתחת לתא המדידה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
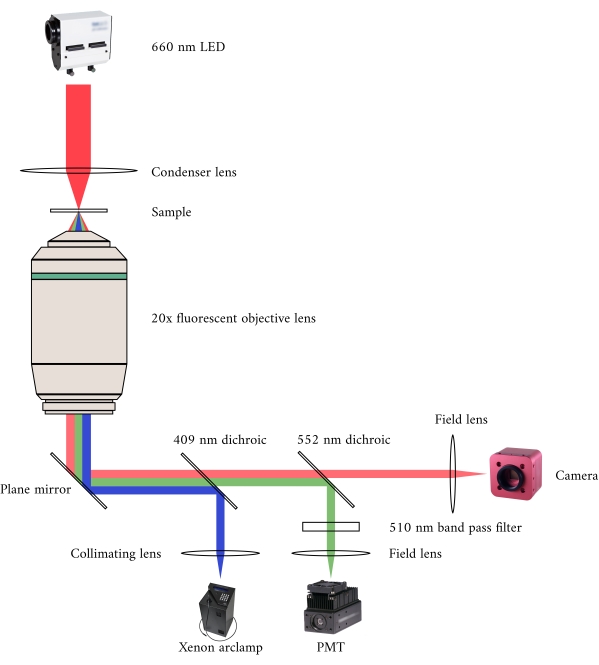
איור 2: מסלול אופטי למיקרוסקופיה בו זמנית של ברייטפילד ופלואורסצנטיות. מקור התאורה של מיקרוסקופ הפלואורסצנטיות הוא מנורת קשת קסנון, שהפלט שלה עובר מחזורית בין 340 ננומטר, 365 ננומטר ואור של 380 ננומטר. נתיב פלט מנורת הקשת מכיל מראה דיכרואית עם אורך גל מנותק של 409 ננומטר המשקף את אור UV על מראה המכווונים את האור למטרה מיקרוסקופ פלואורסצנטית. העדשה ממקדת את אור העירור על המדגם ואוסף את האור הנפלט, אשר יש אורך גל ארוך יותר של 510 ננומטר. אור זה הנפלט עובר דרך המראה הדיכרואית הראשונה, אך לא השנייה, מכיוון שיש לה אורך גל מנותק של 552 ננומטר. לאחר מכן, עדשת שדה ממקדת את האור המוחזרים על החיישן של ה- PMT. בינתיים, מקור התאורה (660 ננומטר LED) עבור מיקרוסקופ Brightfield ממוקם מעל המדגם. האור המועבר מתמקד במדגם על ידי עדשת מרוכז, ומטרת הפלואורסצנטיות × 20 לוכדת את תמונת השידור המתקבלת. אורך הגל המשמש להארה בהירה עולה על אורך הגל החתוך של כל מראה דיכרואית, כך שהוא עובר דרך שניהם לפני שהתמונה מתמקדת בחיישן של מצלמת CMOS. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
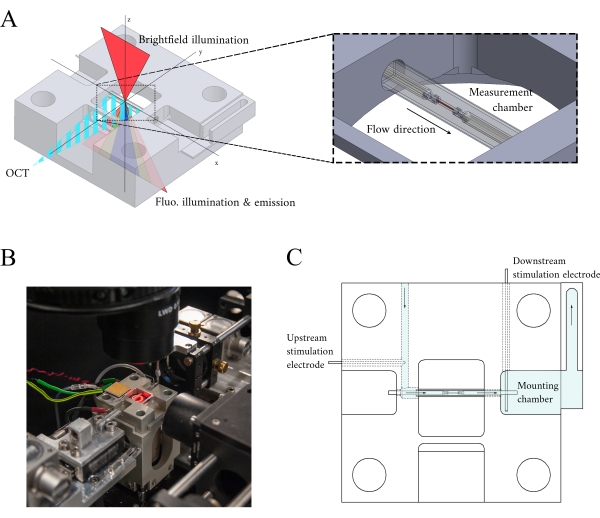
איור 3: עיצוב מחזיק תא מדידה. (A)תצוגה איזומטרית של מחזיק תא המדידה עם נתיבים אופטיים. תאורת ברייטפילד מתרחשת מפני השטח המעולים(z-ציר); תאורת פלואורסצנטיות מתרחשת מפני השטח הנחותים(z-ציר), וזרוע המדידה OCT אות הוא אורתוגונל לציר התאורה האחר (ציר y). במהלך הניסוי, שני ווים פלטינה מחזיקים טרבקולה בתוך צינור נימי זכוכית המתפקד כתא המדידה. מנועי סליל קול שולטים בכל וו ומיקומים שלהם נמדדים באמצעות אינטרפרומטריה לייזר. המיקום הנוכחי מושווה לנקודת הגדרה המוגדרת על-ידי המשתמש, ובאמצעות בקר PID המקודד בתוך FPGA, השגיאה ממוזערת. (B)תא מדידה במקום עם תאורת שדה בהיר מופעלת. התצוגה האחורית מוצגת ב- Inset איור 1 . (C)סכמטי של זרימת superfusate דרך מחזיק תא המדידה. Superfusate נכנס לחלק האחורי של הבלוק וזורם בכיוון המצוין על ידי חצים. האלקטרודות במעלה ובמורד הזרם מבססות את גירוי השדה לזיונים של טרבקולה רכובה בתא המדידה. הצללה כחולה מציינת את האזורים שבהם הסופר-מפוזר זורם במהלך ניסוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
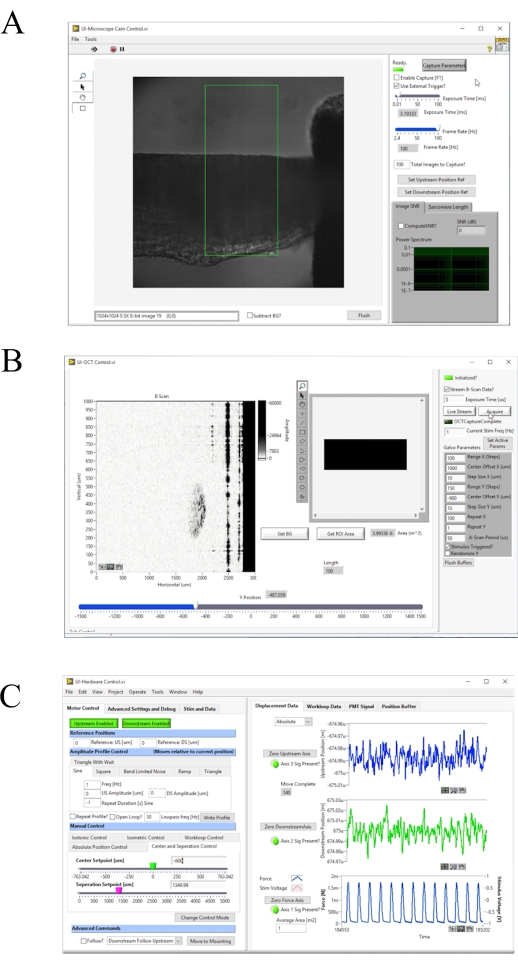
איור 4: הלוח הקדמי של תוכנת רכישת התמונה ובקרת התמונות. (A)ממשק משתמש הדמיה ברייטפילד. (B)ממשק משתמש של הדמיית OCT. (C)ממשק משתמש של בקרת חומרה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
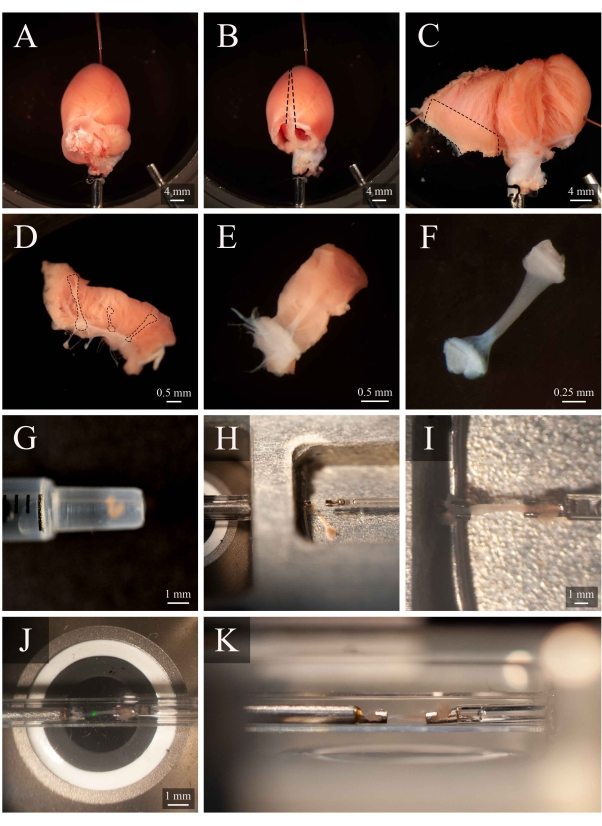
איור 5: ניתוח טרבקולה ופרוטוקול הרכבה. (א)לב עכברוש חדיר לנגנדורף בתא הניתוח. (ב) אותו לב עם האטריה הוסרה. קווים מקווקווים מציינים את מסלול כריתת הצואה כדי לפתוח את החדרים. (ג)לב פתוח כדי לחשוף את הפנים של שני החדרים. התיבה המקווקות מציינת את האזור שבו נמצאים בדרך כלל טרבקולה. (D)אזור קיר חדר ימני שנמחה (זהה לזה שצוין בתיבה המקווקות ב- C). קווים מקווקווים מדגישים שלושה טרבקולה. (ה)טרבקולה שנבחרה מהשלושה ב- D. (ו)הטרבקולה מלוח E עם רקמת הקיר הוסרה. (G)הטרבקולה המבודדת בסוף מזרק של 1 מ"ל. (ח)הטרבקולה בתא הרכבה. הטרבקולהרכובה בין שני קרסי פלטינה. הטרבקולה, המותקנת בין ווים, בתוך תא המדידה(איור 3B). הנקודה הירוקה היא חפץ מהמסנן הדיכרי הראשון. (K)זווית משנית של הטרבקולה המותקנת בתוך תא המדידה. המרחק בין הטרבקולה לעדשת המטרה של המיקרוסקופ הוא כ-1 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
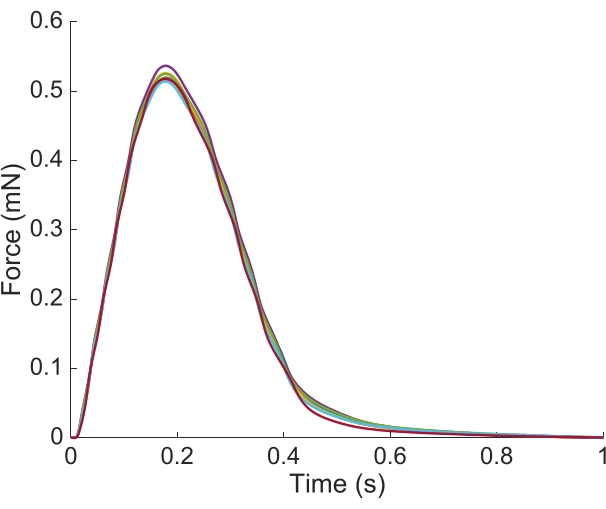
איור 6: מיקום התלות במדידת הכוח. הכוח המיוצר על ידי השריר מכל אחת ממיקומים הדמיה (n = 7) overlaided. ייצור הכוח הפעיל הממוצע היה 0.527 mN ± 0.003 mN, זמן להתכווצות 50 % 77.1 ms ± 0.3 ms, וזמן ל 50 % הרפיה 328.1 ms ± 0.9 ms (כל הנתונים מוצגים כממוצע ± SE). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
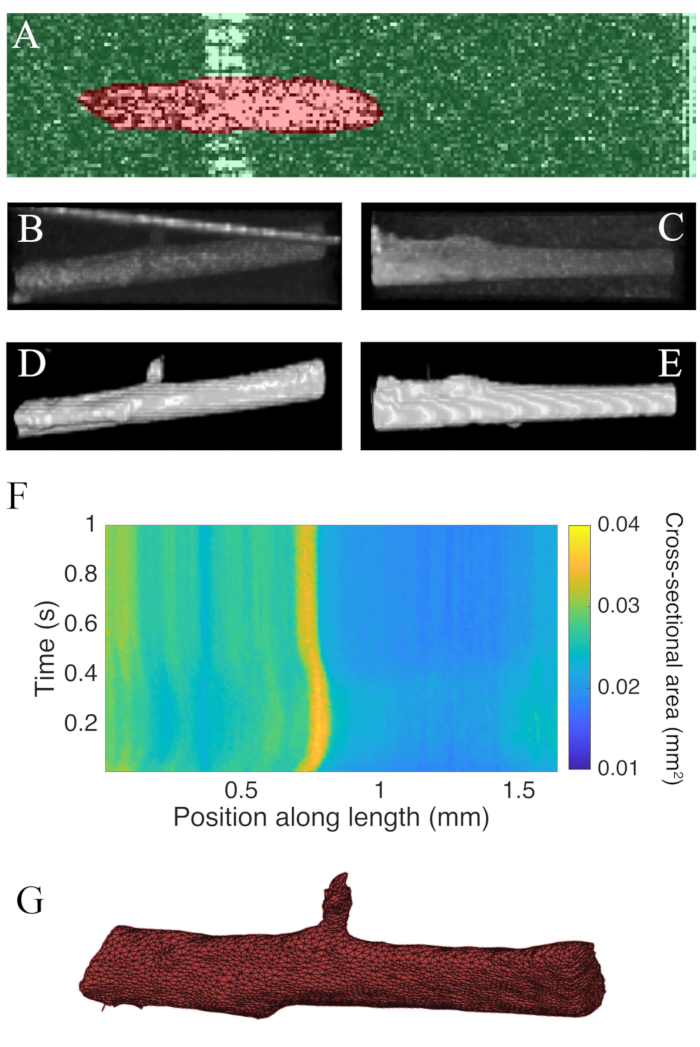
איור 7: ניתוח הדמיה OCT. (A)דוגמה לפילוח WEKA. חתך הרוחב של השריר מודגש באדום, והרקע מודגש בירוק. (B)תצוגה מעולה של נתוני סריקת C גולמיים של טרבקולה. הקו הזוויתי הבהיר לכיוון החלק העליון של התמונה הוא ההשתקפות של קיר תא המדידה. (C)מבט רוחבי של נתוני סריקת C גולמיים של טרבקולה. (D)תצוגה מעולה של נתוני OCT המפולחים. (ה)תצוגה לרוחב של נתוני OCT המפולחים. (F)האזור החתך לאורך הטרבקולה(ציר x)לאורך זמן(ציר y). האזור החתך הממוצע לאורך אורך השריר היה 0.0326 מ"מ2 ± 0.0005 מ"מ2 (ממוצע ± S.E.) (ז)רשת של הטרבקולה. רשת המערכת כבר מיושר בקירב עם חלקת שטח חתך של לוח F. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
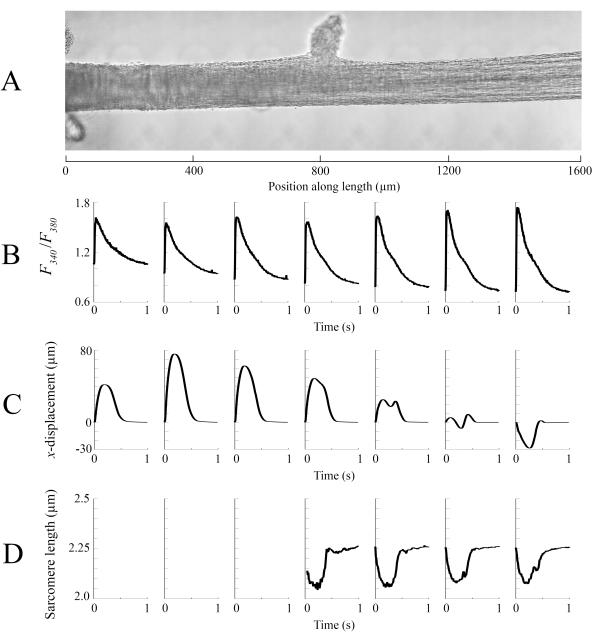
איור 8: ניתוח הדמיית ברייטפילד ופלואורסצנטיות. (A)תמונה תפורה (שבעה חלונות הדמיה) של הטרבקולה. (B)כ- 2 + ארעי לאורך הטרבקולה. (C)עקירת xממוצעת מכל חלון הדמיה. תזוזה חיובית מייצגת תנועה ימינה ושלילית שמאלה. (D)אורכים סרקומריים ממוצעים מכל חלון הדמיה עם ניגודיות התמונה הדרושה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה 1: רשימת הפתרונות אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
במחקר זה, אנו מציגים תצורה המאפשרת הרכבה של שלוש מערכות אופטיות המשלבות ברייטפילד, פלואורסצנטיות והדמיה OCT כדי לאסוף נתונים מטרבקה לבית אקס ויואו (איור 1 ואיור 2). שילוב מתוזמר כזה אפשרי הודות לעיצוב תא המדידה (איור 3) כדי לאפשר את הסידור האורתוגונלי של OCT לציר הפלואורסצנטיות הבהירה. מערכת הרכבת השרירים ממלאת תפקיד חשוב לא פחות בהצלחת כימותים סימולטניים של מדדים מרכזיים באפיון דינמיקת עירור-התכווצות שרירי הלב. החידוש שלו נהדף לאפשר הליכי סריקת שרירים ללא הפרעה נראית לעין לביצועים המכניים של השריר(איור 6). עם תצורת ההדמיה המשולבת ומערכת הקרס הממונע למדידת כוח, מערכת זו יכולה להעריך את ההטרוגניות האזורית באורך הארעי, ההעתקה והסרקום של Ca2+ , יחד עם מידע גיאומטרי מקרוסקופי של טרבקולה מתכווצת לאורך כל מהלך הזמן של העווית (איורים 7 ואיור 8).
בהתחשב בכל מקום של מערכות הדמיה brightfield-epifluorescence בתוך מעבדות מחקר לב, רבייה של תוצאות אלה ניתן להשיג עם כמה שיקולי חומרה קלים. כאן, אנו מציגים את ערכת הכלים לעיבוד תמונה לשילוב של אפיפלואורסצנטיות ברייטפילד ו- OCT, החיונית בניתוח ההטרוגניות התכווצות הבסיסית. השילוב של OCT דורש נתיב אופטי ללא הפרעה, בעוד ההדמיה המגודרת דורשת קו הדק חיצוני בין הגירוי לבין מצלמת ההדמיה OCT ו- Brightfield, ווים להרכבה על השרירים המסוגלים להזיז את הדגימה בכל תא המדידה. התוכנה והשיטות הנדרשות לאחר העיבוד זמינות באופן חופשי. בפרט, תוכנת פילוח בשימוש, WEKA14, הוא קוד פתוח. הטכניקה של מעקב ללא סמן של נקודות חומר 8 ,אורךsarcomere, הדמיה נפחית מגודרת10, וקודי דור רשת נגישים גם הם וניתן להיות זמינים על פי בקשה מהמחבר המתאים.
כדאיות שרירים, טעינה אופטימלית של Fura-2 ומיקוד תמונה הם שלושת העמודים המהווים את היסודות של ניסוי מוצלח. שימוש בתמיסת ביתור המכילה BDM למניעת התכווצות, הובלת השריר במזרק, חמצון מתמשך של הפתרון והכנת פתרונות ניסיוניים חדשים ביום הניסוי, כל אלה תורמים לשיעור כדאיות שרירים גבוה. לפני טעינת trabecula עם Fura-2AM, autofluorescence חייב להיות נאסף עבור כל תנאי אחד מעוניין ללמוד כפי שהוא יכול להיות השפעה משמעותית על Ca2 + ארעי15. חמצון של פתרון טעינת Fura-2AM מסובך על ידי הכללה הכרחית של pluronic-F127 פעילי שטח כדי לסייע טעינת צבע. כדי להילחם היווצרות בועה עודפת שנוצרה הנגרמת על ידי פעילי שטח זה, טיפה קטנה של אנטי קצף בפתרון הטעינה מאפשר למשתמש להגדיל את קצב חמצון, ובכך לשפר את הסיכוי כי trabecula שומר על כדאיות תפקודית לאורך כל תהליך הטעינה. לבסוף, מוקד ההדמיה חייב להיות אחיד לאורך השריר כדי למקסם את יחס האות לרעש של מידע Brightfield ופלואורסצנטיות.
ישנן שתי מגבלות שיש לקחת בחשבון עם השיטות המוצגות כאן. הראשון הוא הרזולוציה המרחבית של מיקרוסקופ הפלואורסצנטיות. בעוד שהרזולוציות המרחביות של הדמיית OCT ו- brightfield גבוהות, הרזולוציה של מיקרוסקופ הפלואורסצנטיות מוגבלת לאינטגרל של הפלואורסצנטיות מהנפח שנתפס בחלון הדמיה של 540 מיקרומטר על 540 מיקרומטר. יש היקף כדי להגדיל את הרזולוציה המרחבית של מיקרוסקופ פלואורסצנטיות באמצעות מצלמת התקן מצמיד טעינה גבוהה, במקום PMT, כדי ללכוד את אות הפלואורסצנטי על חשבון אות ליחס רעש16. השני הוא קוטר הטרבקולה שניתן ללמוד במונחים של אורך סרקומר מדיד ועומק גיאומטרי. גישת החלונות-FFT למחשוב אורך סרקומר מנצלת את היתרון של רזולוציה מרחבית משופרת אך קשורה לחוסן מופחת(איור 8D). במקרים שבהם יש לחקור טרבקולה קודרת או בקוטר גדול, פתירה מחדש של FFT תצטמצם מאוד בשל הניגודיות המופחתת הקשורה לרצועות סרקומריות בדגימות רקמות גדולות יותר. כמו כן, בתוך OCT, השתקפויות הגב מעומק הדמיה של יותר מ 300 מיקרומטר יהיה חלש מדי כדי להיפתר במהלך שלב הפילוח. לפיכך, הטכניקה שלנו מוגבלת trabeculae של קוטר פחות מ 300 מיקרומטר. עם זאת, לא מומלץ ללמוד דגימות קוטר גדול כמו ייתכנו בעיות עם חמצון מפוזר של ליבת השריר במהלך שיעורים גבוהים של גירוי17.
השיטה שלנו מאפשרת הערכה של תפקוד מכני יוני בשיתוף עם גיאומטריית שרירים בשרירים בריאים וחולים, ומספקת גישה חזקה להבנת פיזיולוגיה של שריר הלב, פתופיזיולוגיה ופרמקולוגיה. צינור עיבוד התמונה המתואר כאן מחלץ נתונים שיהיו מכריעים להבנה עמוקה יותר של הטרוגניות מתכווצת. אחת הדרכים למימוש מלא של הפוטנציאל של ערכת נתונים כה עשירה היא בבניית מודלים מתמטיים המשלבים ומפרשים נתונים אלה, ולבצע תחזיות שניתן לבחון באופן ניסיוני באמצעות המכשיר שלנו.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי מלגות דוקטורט מאוניברסיטת אוקלנד (הוענק ל- JD ו- MC), סר צ'ארלס הרקוס מלגות מחקר בריאות (20/011 ו-21/116) מהמועצה לחקר הבריאות של ניו זילנד (הוענק ל- J-CH ל- KT, בהתאמה), מלגת דוקטורט שהוענקה על ידי קרן הלב הלאומית (הוענקה ל- AA), מענקי התחלה מהירה של מרסדן (UOA1504 ו- UOA1703) מהחברה המלכותית של ניו זילנד (הוענקה ל- J-CH ו- KT, בהתאמה), ומלגת מחקר של ג'יימס קוק מהחברה המלכותית של ניו זילנד (הוענקה ל- AT). הפיתוח המקורי של מכשיר זה מומן על ידי מענק מרסדן (11-UOA-199) מהחברה המלכותית של ניו זילנד (הוענק ל- AT ו- PN).
Materials
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
References
- Han, J. -C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250(2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398(2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved