Method Article
Imaging tomografico simultaneo a campo luminoso, fluorescenza e coerenza ottica di trabecole cardiache contraenti ex vivo
In questo articolo
Riepilogo
Questo protocollo presenta una raccolta di dati geometrici sarcomere, calcio e macroscopici da una trabecola cardiaca attivamente contratta ex vivo. Queste misurazioni simultanee sono rese possibili dall'integrazione di tre modalità di imaging.
Abstract
Nel muscolo cardiaco, i transitori intracellulari Di Ca2+ attivano miofilamenti contrattili, causando contrazione, accorciamento macroscopico e deformazione geometrica. La nostra comprensione delle relazioni interne tra questi eventi è stata limitata perché non possiamo né "vedere" all'interno del muscolo né tracciare con precisione la natura spazio-temporale delle dinamiche eccitazione-contrazione. Per risolvere questi problemi, abbiamo costruito un dispositivo che combina una suite di modalità di imaging. In particolare, integra un microscopio a campo luminoso per misurare i cambiamenti locali della lunghezza del sarcomero e della deformazione del tessuto, un microscopio a fluorescenza per visualizzare il transitorio Ca2+ e un tomografo a coerenza ottica per catturare i cambiamenti geometrici del tessuto durante il corso temporale di un ciclo cardiaco. Presentiamo qui l'infrastruttura di imaging e il framework di raccolta dati associato. I dati vengono raccolti da strutture tissutali isolate simili a bastoncelli note come trabeculae carneae. Nel nostro strumento, una coppia di ganci in platino controllati dalla posizione tiene ciascuna estremità di un campione muscolare ex vivo mentre è continuamente sovrafuso con una soluzione salina ricca di sostanze nutritive. I ganci sono sotto controllo indipendente, consentendo il controllo in tempo reale della lunghezza e della forza muscolare. La traslazione longitudinale consente la scansione frammentare del campione, superando le limitazioni associate alle dimensioni relative della finestra di imaging del microscopio (540 μm per 540 μm) e alla lunghezza di una trabecola tipica (>2000 μm). Gli elettrodi di platino alle due estremità della camera muscolare stimolano la trabecola a una velocità definita dall'utente. Sfruttiamo il segnale di stimolazione come trigger per sincronizzare i dati da ciascuna finestra di imaging per ricostruire l'intero campione che si contrae in condizioni di stato stazionario. L'applicazione di tecniche di elaborazione delle immagini a questi dati di imaging a campo luminoso fornisce mappe di spostamento dei tessuti e di lunghezza del sarcomero. Tale raccolta di dati, quando incorporata in una pipeline di modellazione degli esperimenti, fornirà una comprensione più profonda dell'omogeneità contrattile muscolare e dell'eterogeneità in fisiologia e fisiopatologia.
Introduzione
La superfusione di preparati isolati di tessuto muscolare cardiaco è un protocollo standard e ampiamente utilizzato per lo studio dell'attivazione ionica cardiaca e della meccanica1. In particolare, l'isolamento delle trabecole, strutture simili a bastoncelli dalle pareti ventricolari, ha permesso la valutazione di fenomeni tra cui l'attivazione dipendente dalla lunghezza della contrazione2,la risposta stretch-dipendente della contrazione3,4e la viscoelasticità diastolica5 del tessuto cardiaco. Ter Keurs, l'iniziatore di questa tecnica di superfusing di trabecole isolate, inizialmente utilizzava una combinazione di imaging a fluorescenza per le misurazioni di Ca2+ e diffrazione laser per determinare le lunghezze del sarcomero2,5. Da questi primi studi, è diventato sempre più comune estrarre informazioni sulla lunghezza del sarcomero con una maggiore risoluzione spaziale utilizzando tecniche 2D basate sulla trasformata di Fourier veloce (FFT)6 su immagini al microscopio a campo luminoso. I due sistemi di imaging consentono una valutazione parziale della relazione sottostante tra il rilascio di Ca2+ e la produzione di forza dipendente dalla lunghezza del sarcomero.
Il muscolo cardiaco è striato, con la banda visibile associata a una serie sottostante di unità contrattili costituite da filamenti spessi e spessi. L'interazione di questi filamenti costituenti che compongono i sarcomeri è alla base della generazione di forza, che inizia come segue: un segnale elettrico depolarizzante, o potenziale d'azione, provoca l'apertura dei canali Ca2+ di tipo L dipendenti dalla tensione nella membrana cellulare; il conseguente afflusso cellulare di Ca2+ induce il rilascio di Ca2+ dal reticolo sarcoplasmatico (SR), un deposito intracellulare di Ca2+, in un processo noto come Ca2+-indotto Da Ca2+ rilascio7; questo improvviso aumento della concentrazione intracellulare di Ca2+ dall'intervallo nanomolare a quello micromolare consente la produzione di forza; Le pompe Ca2+ estruggono continuamente Ca2+ dal citosol nel compartimento SR ed extracellulare; quando la concentrazione intracellulare di Ca2+ ritorna nell'intervallo nanomolare, la produzione di forza cessa e il muscolo si rilassa. Durante la produzione di forza, i filamenti spessi e sottili costituenti scivolano l'uno sull'altro. La lunghezza del sarcomero determina l'estensione relativa della sovrapposizione e, quindi, il potenziale di produzione di forza del muscolo macroscopicamente.
In questo articolo, estendiamo queste tecniche di imaging a fluorescenza-campo luminoso per includere la tomografia a coerenza ottica (OCT). OCT utilizza il principio fisico dell'interferenza ed è in grado di raccogliere la deformazione geometrica del tessuto per comprendere l'eterogeneità contrattile muscolare8. Il nostro dispositivo (Figura 1) utilizza un sistema OCT (SD-OCT) a dominio spettrale. In SD-OCT, uno splitter a fascio divide la luce da un diodo superluminescente a banda larga a breve lunghezza di coerenza in bracci di riferimento e di misurazione. Il braccio di riferimento contiene uno specchio fisso e il braccio di misura contiene un galvanometro 2D per guidare la luce. La luce retrodifferenziata dal campione viene raccolta e interferisce con la luce riflessa nel braccio di riferimento per formare un modello di interferenza. Le informazioni sulla profondità sono codificate nella frequenza della frangia spettrale. Per estrarre le informazioni, il segnale viene fatto passare attraverso uno spettrometro e un FFT inverso viene applicato al risultato. Il segnale 1D corrispondente rappresenta le strutture a diverse profondità, corrispondenti alle variazioni dell'indice di rifrazione9 (A-scan). Guidando il laser su un singolo asse, si può costruire una sezione trasversale del campione di interesse (B-scan) e, allo stesso modo, ripetendo il processo in un modello graduale nell'asse rimanente, è possibile generare un'immagine tridimensionale (C-scan). Per estensione, è possibile raccogliere una serie di scansioni B in una singola fetta per un soggetto variabile nel tempo ripetuto in base a un trigger esterno e ripetere per generare una scansione tridimensionale, che rappresenta un'immagine planare variabile nel tempo10.
Nell'integrare i tre sistemi di imaging, abbiamo considerato i seguenti due principi. In primo luogo, i sensori di imaging non dovrebbero rilevare la luce da una modalità di imaging alternativa e, in secondo luogo, il design fisico dovrebbe contenere spazio libero per almeno tre piani di imaging simultanei. Per soddisfare il primo requisito, il microscopio a campo luminoso utilizza un LED a lunghezza d'onda di 660 nm per illuminare il campione in una configurazione invertita. Il microscopio a fluorescenza è in una configurazione di epifluorescenza in cui la stessa lente obiettivo viene utilizzata sia per l'eccitazione che per la raccolta della luce emessa. La luce di eccitazione ha una lunghezza d'onda compresa tra 340 nm e 380 nm e un tubo fotomoltiplicatore (PMT) misura la luce emessa a una lunghezza d'onda di 510 nm. Una coppia di specchi dicroici consente a questi due percorsi ottici di condividere la stessa impronta fisica senza interferire con la misura opposta (Figura 2). Infine, l'OCT utilizza la luce a banda larga (larghezza spettrale di 100 nm) con una lunghezza d'onda centrale di 840 nm, distinta dalle altre due modalità. A causa della natura a bassa coerenza della luce utilizzata per l'OCT, qualsiasi luce diffusa dalle sorgenti di fluorescenza a campo luminoso non contribuirà al modello di interferenza che codifica le informazioni sulla profondità. Per il secondo requisito, il design dell'alloggiamento per il tubo capillare ha percorsi ottici accessibili ai piani anteriore, inferiore e superiore del campione. Durante gli esperimenti, due ganci di platino trattengono una trabecola all'interno di un tubo capillare perfuso con soluzione ossigenata di Krebs-Henseleit (KH). La testa del galvanometro dell'OCT è orientata ortogonalmente alla via di imaging a campo luminoso-fluorescenza per sfruttare il terzo piano ottico ortogonale (Figura 3).
Questo documento delinea le considerazioni di progettazione per la costruzione di un dispositivo in grado di imaging simultaneo di calcio, lunghezza del sarcomero e geometria muscolare. Per dimostrare queste capacità di misurazione, descriviamo il processo di isolamento di una trabecola ventricolare, la preparazione delle soluzioni tampone necessarie, insieme alle fasi critiche coinvolte nella manipolazione e nel carico di fluorescenza di una trabecola ex vivo. Infine, questo documento delinea i processi necessari per tradurre il set di dati in visualizzazioni più utili.
Protocollo
Il Comitato etico animale dell'Università di Auckland ha approvato la manipolazione dei ratti e la preparazione di campioni di tessuto.
1. Calibrazione dell'immagine
- Calibrazione dei pixel del microscopio a campo luminoso
- Riempire la camera di misura con acqua distillata.
- Posizionare un reticolo di diffrazione con linee note per μm nella camera di misura.
- Premere F1 per abilitare l'acquisizione e regolare la frequenza dei fotogrammi [Hz] fino a quando il reticolo di diffrazione non è chiaramente visibile (Figura 4A). Assicurarsi che il reticolo di diffrazione funzioni parallelamente al bordo del telaio. Premere di nuovo F1 per interrompere l'acquisizione.
- Impostare total images to Capture? su uno, premere Ctrl + Maiusc + S per trasmettere i dati su disco e premere F1 per acquisire un'immagine del reticolo di diffrazione.
- Aprire ImageJ e importare l'immagine del reticolo di diffrazione (File > Apri > Seleziona immagine di calibrazione). Tenendo premuto lo spostamento, disegna una linea che comprende 20 bande chiare e scure del reticolo di diffrazione.
- Calibrare l'immagine (Analizza > Imposta scala). La lunghezza della linea dal passaggio 1.1.5 imposta il valore Distanza in pixel. Impostare il valore di Distanza nota su 20 volte le linee per misura μm e l'unità di lunghezza su μm. L'inverso della scala è il numero di micrometri rappresentati da un pixel.
- Calibrazione della risoluzione di profondità dello Strumento di personalizzazione di Office
- Misurare lo spessore di un vetrino per microscopio in vetro utilizzando le pinze Vernier.
- Accendere la sorgente laser dello Strumento di personalizzazione di Office.
- Coprire la testa del galvanometro e fare clic su Ottieni BG per misurare il modello di interferenza di sfondo e sottrarlo dalla misurazione (Figura 4B).
- Bloccare il vetrino misurato del microscopio di vetro (dal punto 1.2.1) nel braccio di misura del PTOM.
- Fare clic su Live Stream per visualizzare l'immagine dello Strumento di personalizzazione di Office. Regolare il vetrino del microscopio di vetro fino a quando non è visibile all'interno della B-scan.
- Per acquisire l'immagine B-scan, impostare Intervallo Y (Passi) su uno, fare clic su Stream B-scan Data?e fare clic su Acquisisci.
- Importare l'immagine B-scan in ImageJ (File > Apri > Seleziona B-scan). Tenendo premuto il turno, disegna una linea tra i confini del vetrino del microscopio di vetro.
- Impostare la scala (Analizza > Imposta scala). Impostare Distanza nota per la misurazione raccolta nel passaggio 1.2.1.
- Per calcolare la risoluzione di profondità in aria, correggere l'indice di rifrazione del vetrino del microscopio (nvetro = 1,5175)11 moltiplicando il valore di misurazione per pixel per nvetro.
NOTA: Il vetro n citato è per vetro borosilicato. I vetrini per microscopio possono essere realizzati con materiali diversi. Utilizzare l'indice di rifrazione appropriato per la diapositiva misurata. - Per scalare la risoluzione di profondità per il miocardio, dividere il valore dal passaggio 1.2.9. di nmiocardio = 1,38 (valore riportato in precedenza12).
2. Preparazione del campione muscolare
- Preparare il banco di dissezione.
- Versare parte della soluzione di dissezione (descritta nella Tabella 1)in una piccola ciotola di metallo e metterla nel congelatore circa un'ora prima dell'escissione cardiaca.
- Impostare un impianto di dissezione assicurando che la soluzione di dissezione sia ben ossigenata (ossigeno al 100%) e che sia stata lavata attraverso ciascuna delle linee di tubazione. Riempire la camera di dissezione con soluzione di dissezione ossigenata e legare liberamente la sutura 3/0 attorno al catetere di perfusione.
- Asporta il cuore.
- Anestetizzare il ratto Wistar di 8-10 settimane usando isoflurano gassoso (< 5% in ossigeno). Confermare l'anestesia pizzicando la coda.
- Posizionare il ratto anestetizzato in posizione supina e iniettare per via sottocutanea nella zona addominale con soluzione di eparina (1000 UI/kg). Mantenere l'anestesia per altri cinque minuti per consentire all'eparina di circolare.
- Recuperare la ciotola metallica contenente la soluzione di dissezione dal congelatore e posizionarla vicino al banco di eutanasia.
NOTA: Evitare di congelare completamente la soluzione di dissezione per consentire la completa immersione del cuore sezionato. - Trasferire il ratto anestetizzato al banco di eutanasia ed eutanasizzare per lussazione cervicale.
- Aprire il petto del ratto con le forbici, tagliando prima la parete del corpo lungo la parte inferiore della gabbia toracica, quindi il diaframma, prima di procedere lungo i bordi laterali della gabbia toracica. Solleva il petto dalla strada.
- Afferra il cuore con una mano mentre l'altra mano usa un paio di forbici curve per tagliare i vasi di collegamento (aorta, vena cava, ecc.).
- Sommergono rapidamente il cuore nella soluzione di dissezione a freddo.
- Isolare una trabecola.
- Identificare l'aorta mentre il cuore è nella ciotola di metallo, quindi trasferire il cuore nella camera di dissezione. Usando due pinca curva, tirare l'aorta sulla cannula di perfusione.
- Tenere l'aorta in posizione con una pinp. Nel frattempo, aprire la linea del tubo per consentire alla soluzione di dissezione di fluire attraverso la cannula di perfusione.
NOTA: Mirare a completare la perfusione entro il minuto successivo all'escissione cardiaca. - Una volta che la vascolarizzazione coronarica viene ripulita dal sangue e il cuore è completamente perfuso con la soluzione di dissezione, arrestare il flusso di perfusione e fissare l'aorta in posizione utilizzando la sutura. Riaccendi il flusso e perfondi il cuore cannulato.
- Ruotare la cannula in modo che l'arteria coronaria sinistra sia visibile sulla superficie superiore. Fissare l'apice del cuore sul fondo della camera di dissezione (Figura 5A). Tagliare entrambi gli atri (Figura 5B).
- Con una serie di forbici a molla, tagliare lungo il lato destro del setto fino all'apice del cuore (come indicato nella Figura 5B). Fissare il ventricolo sinistro aperto alla base della camera di dissezione. Quindi tagliare lungo il lato sinistro del setto, aprire il ventricolo destro e fissarlo anche alla base della camera di dissezione (Figura 5C).
NOTA: Per fissare i ventricoli in posizione aperta, alcuni muscoli papillari dovranno essere tagliati. Identificare una trabecola a corsa libera nel ventricolo destro (Figura 5D-E). - Usando la forbice a molla e una pinza, tagliare il tessuto della parete che circonda la trabecola, quindi tagliare il tessuto della parete a metà ortogonalmente alla direzione della trabecola. Tagliare il tessuto della parete fino a quando la sua dimensione è appropriata per la configurazione di montaggio utilizzata. In questo caso, circa la metà delle dimensioni di un seme di sesamo (Figura 5F).
NOTA: Le trabecole possono essere sezionate dai ventricoli destro e sinistro, ma quelle da sinistra sono in genere più torbide e meno applicabili per le misurazioni del sarcomero e della geometria. - Lasciare la trabecola asportata nella camera di dissezione, sovrafondendo continuamente con la soluzione di dissezione.
3. Protocollo sperimentale
NOTA: il dispositivo13 utilizzato per questo esperimento è stato creato internamente e utilizza un codice di controllo personalizzato. Le considerazioni necessarie per la progettazione di un dispositivo costruito per replicare questi dati sono due ganci di montaggio ad azionamento indipendente, una camera di misura con tre assi otticamente chiari (Figura 3) e una linea di trigger esterna che sincronizza le telecamere brightfield e OCT con lo stimolatore. La tensione PMT e il segnale di forza sono stati raccolti utilizzando schede DAQ analogiche, le immagini del microscopio OCT e brightfield sono state raccolte utilizzando le schede frame-grabber Camera Link e il segnale di stimolo è stato raccolto utilizzando una scheda I/O digitale. I dati sono stati archiviati offline utilizzando una serie di cicli di consumo del produttore per mantenere l'allineamento temporale.
- Preparare il cardiomiometro.
- Sciacquare acqua calda (~60 °C), acqua distillata (temperatura ambiente) e quindi infondere la soluzione attraverso la camera di misurazione. Bolle continuamente la soluzione di superfusato con carbogeno.
- Accendere la sorgente di illuminazione del microscopio a campo luminoso e premere F1 per abilitare l'acquisizione (Figura 4A). Regolare manualmente il gancio a valle fino a quando non è centrato nell'immagine in campo luminoso. Fare clic su Asse zero a valle, quindi su Downstream disabilitato per abilitare il motore (Figura 4C). Spostate il dispositivo di scorrimento Setpoint DS [um] fino a quando la fine del gancio non si allinea con lo spigolo della regione di interesse predefinita.
- Azzerare nuovamente l'asse a valle, quindi spostare il dispositivo di scorrimento Setpoint [um] di DS su 1000. Ripetere il processo con il gancio a monte, ma non spostare il dispositivo di scorrimento US Setpoint [um].
- Fare clic su Sposta in montaggio (Figura 4C).
- Avviare il sistema di illuminazione a fluorescenza attivando l'interruttore della lampada prima di accendere rapidamente i sottosistemi del controller attivando o disattivando l'interruttore principale.
NOTA: Alcune sorgenti di luce UV producono grandi quantità di ozono. In questo caso, collegare un estrattore di ozono allo sfiato di uscita della sorgente luminosa e assicurarsi che sia in funzione prima di accendere la sorgente di illuminazione a fluorescenza. - Passare la modalità operativa a Turbo-Blanking premendo il pulsante Mode sul pannello frontale, seguito da 2, quindi 1. Premere il pulsante On-line per consentire al codice di controllo di informare il funzionamento.
- Montare la trabecola.
- Mettere in pausa il flusso superfusato attraverso la camera di misurazione. Riempire la camera di montaggio con la soluzione di dissezione.
- Utilizzando una siringa da 1 mL, trasportare la trabecola dalla camera di dissezione alla camera di montaggio (Figura 5G).
- Per trasferire la trabecola, posizionare la siringa verticalmente e a contatto con la superficie della soluzione della camera di montaggio. Lasciare che la trabecola scenda nella camera di montaggio per gravità (Figura 5H).
- Abbassare il livello del fluido nella camera di montaggio in modo che sia in piano con la sezione centrale dei ganci.
- Regolare la distanza tra i ganci per riflettere la lunghezza lenta della trabecola spostando il cursore DS Setpoint [um].
- Usando un microscopio per facilitare la visualizzazione, afferra leggermente uno dei pezzi di tessuto finale con una pinca e montalo sul gancio a monte. Montare l'altro pezzo di tessuto finale sul gancio a valle (Figura 5I).
- Una volta montata saldamente, spostare nuovamente la trabecola nella camera di misura (Figura 5J) premendo Sposta in camera ( Figura4C). Riprendere il flusso di superfusato e l'estrazione del fluido.
- Impostare la frequenza dello stimolo [Hz] su 1, la durata dello stimolo [ms] su 10 e la tensione dello stimolo su 10. Inizia la stimolazione premendo Stimulus On?.
- Preparare la trabecola.
- Dopo circa 1 ora di acclimatazione, diminuire gradualmente la tensione di stimolo e la durata dello stimolo in passi di 1 V e 1 ms, rispettivamente. Un insieme tipico di valori è 3 V e 3 ms.
- Accendere il sistema di illuminazione a campo luminoso. Premere F1 e selezionare un'area di interesse che racchiude un'area striata nell'interfaccia utente. Fare clic su Calcola SL? per calcolare la lunghezza media del sarcomero nell'area evidenziata. Aumentare la lunghezza muscolare fino a quando la lunghezza media del sarcomero è di 2,32 μm aumentando il cursore Setpoint di separazione [um].
NOTA: Compute SL? utilizza un FFT 2D descritto nel passaggio 4.3. La regione di interesse utilizzata per calcolare la lunghezza media del sarcomero è in genere un quadrato da 100 μm a 150 μm. Pertanto, man mano che il muscolo si avvicina alla lunghezza ottimale del sarcomero, vengono utilizzati da 43 a 65 sarcomeri per calcolare la lunghezza media del sarcomero. - Muovi il muscolo regolando il cursore Setpoint centrale [um] nella scheda" Centro e controllo separazione ( Figura4C) in modo che il bordo del gancio a valle sia visibile solo all'interno dell'immagine in campo luminoso. Raccogli le informazioni sulla fluorescenza per dieci contrazioni.
- Aumentare il valore del setpoint centrale [um] di 200 e raccogliere altre dieci contrazioni di informazioni sulla fluorescenza. Ripetere questo processo fino a quando l'immagine brightfield contiene l'hook a monte. Raccogli le informazioni sulla fluorescenza della finestra finale.
- Riportare la trabecola in una posizione centrale impostando il valore del setpoint centrale [um] su 0.
- Ridurre la frequenza di stimolo a 0,2 Hz e passare dal superfusato KH alla soluzione di carico Fura-2 (dettagliato nella Tabella 1).
- Misurare il segnale di fluorescenza ogni 10 minuti facendo clic su Abilita sorgente di fluorescenza nella scheda Stim e dati. Visualizza il segnale di fluorescenza nella scheda Segnale PMT.
- Dopo che il segnale a 360 nm è aumentato di un fattore 10 o la durata della procedura di carico ha superato le 2 ore, riportare la frequenza di stimolo a 1 Hz e tornare alla soluzione di superfusato KH.
- Controllare la misurazione del rapporto ogni 10 minuti fino a quando la misurazione del rapporto non si stabilizza, a quel punto può iniziare la raccolta dei dati.
- Raccogli dati di imaging a campo luminoso e a fluorescenza.
- Riportare il muscolo nella posizione in cui il bordo del gancio a valle è appena presente all'interno dell'immagine in campo luminoso. Avviare lo streaming di dati hardware facendo clic su Trasmetti dati su disco nella scheda Stim e dati dell'interfaccia utente di controllo hardware. Acquisire informazioni sulla fluorescenza facendo clic su Abilita sorgente di fluorescenza.
- Nell'interfaccia utente di imaging a campo luminoso, impostare la modalità di acquisizione su un trigger esterno, aumentare la frequenza dei fotogrammi a 100 Hz e impostare il numero di immagini da acquisire su 100. Premi Ctrl + Maiusc + S seguito da F1 per registrare i dati di imaging brightfield per questa finestra.
- Aumentare il valore del setpoint centrale [um] di 200 e ripetere il passaggio 3.4.2. Continuare con il protocollo di scansione fino a quando i dati di imaging non sono stati raccolti per la finestra finale dal passaggio 3.3.4.
- Riportare la trabecola in una posizione centrale impostando il valore del setpoint centrale [um] su 0.
- Raccogliere i dati di imaging dello Strumento di personalizzazione di Office.
- Accendere la sorgente laser dello Strumento di personalizzazione di Office ruotando la chiave master sul | , premendo il pulsante di accensione, seguito dal pulsante SD.
- Coprire la testa del galvanometro e fare clic su Ottieni BG per misurare il modello di interferenza di sfondo e sottrarlo dalla misurazione (Figura 4B).
- Impostare la modalità di acquisizione dell'immagine su live-view.
- Regolare la posizione yfino a quando l'immagine B-scan contiene solo il gancio a monte. Dividere la lunghezza muscolare visualizzata sul pannello frontale di controllo (Figura 4B) per due e sottrarre la posizione ycorrente. Immettere questo valore nell'input"y-offset". Regolate il valore"x-offset" fino a quando la sezione trasversale della trabecola non è centrata nel fotogramma.
- Con la trabecola centrata, scansiona lungo l'asse yregolando la posizione yper trovare le posizioni corrispondenti ai ganci a monte e a valle. Annotare queste posizioni verso il basso. Impostare Intervallo Y (passi) sulla differenza assoluta tra questi valori divisa per dieci.
- Impostare la modalità di acquisizione dell'immagine su Stimolo attivato?, Intervallo X (passi) su 100 e fare clic sul pulsante Imposta parametri attivi.
- Fare clic su Stream B-Scan Data?, quindi su Acquisisci.
NOTA: il protocollo di imaging gated richiede 200 contrazioni per catturare l'intera geometria muscolare per un campione di 2 mm di lunghezza, che corrisponde a un tempo di acquisizione di ~ 3 min 20 s.
4. Elaborare il set di dati dell'immagine brightfield
- Preparare le immagini per l'analisi.
- Importa immagini in ImageJ (File > Import > Image Sequence > Select image).
- Aumentare il contrastodell'immagine ( Image > Adjust > Brightness/Contrast > Move minimum e Maximum sliders per centralizzare l'istogramma dell'immagine).
- Affinare le immagini (Process > Filters > Unsharp Mask > impostare Radius (Sigma) su 1.0 pixel e Mask Weight (0.1-0.9) su 0.6).
- Esportare la sequenza di immagini (Salva con nome > Sequenza di immagini > Imposta il formato su PNG, Inizia da 0 e Cifre (1-8) da 4).
- Cucire le immagini, misurare lo spostamento localizzato e calcolare le lunghezze del sarcomero locale.
- Aprire "TrabeculaProcessing.m" (disponibile su richiesta) e impostare la variabile FolderPath sulla cartella principale contenente tutti i dati e ImagePath sulla cartella in cui è stata salvata la sequenza di immagini del passaggio 4.1.4. Impostare le sezioni sul numero di finestre e fotogrammi di imaging in base al numero di fotogrammi acquisiti per finestra.
- Eseguire il codice.
NOTA: gli output saranno presenti nel percorso della cartella di output specificato dall'utente. (Per impostazione predefinita, il percorso è impostato su FolderPath/Output).
- Tecnica della lunghezza del sarcomero FFT
- Utilizzare un software di elaborazione delle immagini per eseguire un FFT su una regione dell'immagine in cui i sarcomeri sono altamente visibili.
- Moltiplicare i pixel per μm risultati della calibrazione dal passo 1.1.6 per 1,6 μm e 3,0 μm prima di calcolare l'inverso per ottenere la gamma di frequenze spaziali di interesse.
- Adattare un esponenziale al risultato FFT, ignorando le informazioni sulla frequenza nell'intervallo di frequenza calcolato nel passaggio 4.3.2 e sottrarlo dal risultato della trasformazione per rimuovere il termine DC.
- Adatta una curva gaussiana alla banda di frequenza di interesse.
- Calcola l'inverso del picco della curva gaussiana. Questa è la lunghezza media del sarcomero per la regione di interesse.
NOTA: Il calcolo FFT e il fitting delle equazioni esponenziali e gaussiane sono stati eseguiti utilizzando codice LabVIEW personalizzato.
5. Elaborare i dati di fluorescenza
- Sottrarre l'autofluorescenza dipendente dalla finestra dalla rispettiva finestra e calcolare il quoziente dei segnali associati alle lunghezze d'onda di eccitazione di 340 nm e 380 nm.
6. Elaborare i dati di imaging dello Strumento di personalizzazione di Office
- Preparare il set di immagini dello Strumento di personalizzazione di Office per la segmentazione.
- Aprire ImageJ e importare le immagini (File > Import > Image Sequence). Nella finestra esplora file, si apre, individua le immagini, selezionane una e fai clic su Apri.
Nota : se il codice di controllo per lo Strumento di personalizzazione di Office non memorizza le immagini in un formato leggibile da ImageJ, convertirle in PNG. - Per facilitare la visualizzazione, organizzare la sequenza di immagini in un hyperstack (Image > Hyperstacks > Stack to Hyperstack). Nella finestra di dialogo che si apre, impostare il numero di sezioni sul numero di scansioni B per fetta e la X sul numero di fette lungo la lunghezza della trabecola.
- Disegna un rettangolo che racchiude la trabecola. Verificare che racchiudo l'intero volume nel tempo utilizzando i cursori nella finestra hyperstack. Ritaglia l'immagine nella finestra (Immagine > Ritaglia).
- Rimuovere le sezioni che contengono immagini dei ganci di montaggio (Stacks > Tools > Slice Keeper). Selezionare l'intervallo di sezioni che contiene solo informazioni sulla trabecola.
- Aprire ImageJ e importare le immagini (File > Import > Image Sequence). Nella finestra esplora file, si apre, individua le immagini, selezionane una e fai clic su Apri.
- Formare la segmentazione WEKA.
- Segmentazione WEKA aperta (Plugin > Segmentazione > Segmentazione Weka addestrabile).
- Impostare la modalità di selezione su Freehand.
- Fare clic su Impostazioni e regolare il classificatore e le impostazioni di allenamento. (Per questo modello, sono state utilizzate le seguenti caratteristiche di allenamento: sfocatura gaussiana, filtro Sobel, Hessian, differenza di gaussiani, proiezioni di membrana, bilaterale e Lipschitz. Lo spessore della membrana è stato impostato su 1, la dimensione del cerotto della membrana su 8, il sigma minimo a 1 e il sigma massimo su 32. Il classificatore è stato impostato su FastRandomForest e le opzioni del classificatore sono state impostate su: batchSize 100, maxDepth su 32, numFeatures su 32, numThreads su 0 e numTrees su 200.)
- Segmenta manualmente le immagini fino a quando l'allenamento non si traduce in segmentazioni soddisfacenti.
- Salvare il classificatore.
- Segmentare le scansioni B elaborate
- Avvia la segmentazione WEKA seguendo il passaggio 6.2.1.
- Caricare il classificatore dal passaggio 6.2.5.
- Fare clic su Crea risultato.
- Convertire le immagini a 8 bit (Image > Type > 8-bit).
- Converti le immagini in binario (Process > Binary > Make Binary > Default method and default background).
- Salva come sequenza di immagini (PNG).
- Calcola il CSA medio nelle immagini B-scan segmentate.
- Contare il numero di pixel bianchi in un'immagine binaria B-scan.
- Moltiplicare l'area dei pixel per la risoluzione di profondità calibrata (dal passaggio 1.2) e 10 μm (la distanza tra le scansioni A vicine).
- Ripetere l'operazione per tutte le scansioni B tra i ganci e fare la media delle misurazioni.
- Converti l'immagine segmentata in una mesh.
- Aprire "OCTmain.m" (disponibile su richiesta) e impostare imageDirectory nella cartella contenente l'output del passaggio 6.3.6. Impostare outputPath in modo necessario.
- Impostare le sezioni sul valore di "Intervallo Y (passaggi)" (Passaggio 3.5.5) e i fotogrammi sul valore di "Ripeti X" (Passaggio 3.5.6), z_dim alla risoluzione di profondità (Passaggio 1.2.10) e x_dim e y_dim al valore assegnato a 10.
- Fare clic su Esegui.
Risultati
Al fine di acquisire le informazioni regionali Ca2+ e brightfield per l'intera lunghezza della trabecola qui presentata, sono state richieste sette posizioni muscolari. La Figura 6 suggerisce che la forza di contrazione era indisturbata da questo movimento, rivelando che non c'era dipendenza dalla posizione della produzione di forza attiva.
Le scansioni B raccolte utilizzando la tomografia a coerenza ottica ad una velocità di 100 Hz sono state segmentate utilizzando il plugin ImageJ WEKA14 (Figura 7A). Ogni sezione trasversale appare distorta a causa della differenza tra le risoluzioni laterale (10 μm) e di profondità (1,73 μm (nel miocardio)). Questa distorsione è stata corretta ridimensionando l'asse di profondità dell'immagine in modo da un rapporto risoluzione laterale-profondità. Figura 7B,C dimostrano che dopo aver ridimensionato la scansione C grezza della trabecola è approssimativamente cilindrica in geometria. La riflessione della parete della camera di misura a volte può sovrapporsi ai dati muscolari (Figura 7A,B), ma il software di segmentazione può essere addestrato per tenere conto di questo (Figura 7D,E). Una volta segmentata, l'area della sezione trasversale lungo la lunghezza del muscolo può essere calcolata durante la contrazione (Figura 7F). Si noti che questa particolare trabecola ha una piccola appendice che si ramifica da essa. Il movimento del ramo è evidente ~ 0,75 mm lungo la trabecola. Infine, le immagini segmentate possono essere convertite in mesh per facilitare la costruzione di modelli geometrici (Figura 7G).
I dati di imaging acquisiti in ciascuna delle diverse posizioni della trabecola ad una velocità di 100 fps sono stati cuciti insieme per creare un'unica immagine completa della trabecola (Figura 8A). La risoluzione di queste immagini è di 0,535 μm/pixel. L'uso di funzioni di ponderazione lineare nelle regioni sovrapposte delle finestre vicine aiuta la visualizzazione e riduce al minimo l'impatto della vignetta presente nelle immagini in campo luminoso. Per misurare il segnale fluorescente, una finestra di 540 μm per 540 μm della trabecola viene ciclicamente illuminata con luce a 340 nm, 365 nm e 380 nm di lunghezza d'onda ad una velocità di 600 Hz. Il rapporto tra la fluorescenza emessa associata alla luce di eccitazione a 340 nm e 380 nm è correlato al calcio intracellulare dopo che la trabecola è stata caricata con Fura-2. Poiché questa misurazione è un rapporto, la velocità di misurazione effettiva è di 200 Hz. I transienti intracellulari Ca2+ medi (n = 10) da ciascuna finestra sono allineati con la regione in cui sono stati ripresi (Figura 8B). Mentre il picco dei transienti appare ragionevolmente consistente, il diastolico [Ca2+] è inferiore all'interno della regione tra 900 μm e 1800 μm lungo la trabecola. Allo stesso modo, i risultati del tracciamento dello spostamento (Figura 8C) e dei calcoli della lunghezza del sarcomero (Figura 8D) indicano anche la presenza di variabilità regionale. La tecnica di tracciamento senza marcatori utilizzata è in grado di elaborare lo spostamento di ciascun pixel, dato un contrasto sufficiente. Quando si mappa la distribuzione delle lunghezze del sarcomero in post, è stata utilizzata un'area di correlazione incrociata di 128 pixel per 128 pixel (~ 67 μm per 67 μm) per calcolare la lunghezza del sarcomero regionale. Quest'area incapsula circa 29 sarcomeri quando la chiusura del campione è vicina alla lunghezza ottimale del sarcomero. La dimensione del passo (in entrambe le direzioni x e y)tra il centroide di ciascuna finestra di correlazione incrociata è stata impostata su 50 pixel (~ 26 μm) per l'elaborazione di questi dati. L'idoneità delle stime della lunghezza del sarcomero è stata testata in base alla larghezza e all'ampiezza dell'adattamento gaussiano al segnale FFT. Queste condizioni non erano soddisfatte nella regione muscolare tra 0 μm e 500 μm, quindi non è stato possibile calcolare alcuna informazione sulla lunghezza del sarcomero. Dati gli spostamenti associati, è probabile che i sarcomeri in questa regione si siano allungati durante la fase contrattile. In linea con questa speculazione, le lunghezze medie del sarcomero sul lato destro della trabecola si accorciano durante quel periodo. Combinando le informazioni fornite da ciascuno dei pannelli, sembra che la regione con la più grande area della sezione trasversale non produca la forza più significativa. Supponendo che la variazione regionale dei transienti Ca2+ abbia un gradiente approssimativamente regolare, la Figura 8B indica che la più grande ampiezza Ca2+ transitorio si verifica da qualche parte tra 1300 μm e 1600 μm lungo la trabecola. La mappa di spostamento indica che la regione che subisce il minor movimento si allinea bene con il picco Ca2+ transitorio. Tuttavia, questa regione ha le aree di sezione trasversale più piccole del campione. Con questi dati in mente, si potrebbe dedurre che questa regione ha generato il maggior stress.

Figura 1: Immagine annotata del cardiomiometro. Ciascuno dei principali componenti ottici è delineato. L'inserto contiene un primo piano, retrovisore, dell'obiettivo del microscopio in situ,sotto la camera di misura. Fare clic qui per visualizzare una versione più grande di questa figura.
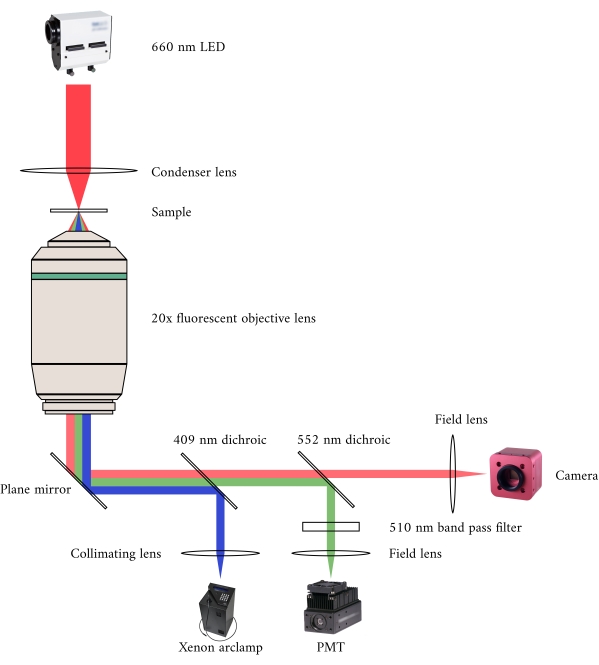
Figura 2: Percorso ottico per microscopia simultanea a campo luminoso e fluorescenza. La fonte di illuminazione per il microscopio a fluorescenza è una lampada ad arco allo xeno, la cui emissione commuta ciclicamente tra 340 nm, 365 nm e 380 nm di luce. Il percorso di uscita della lampada ad arco contiene uno specchio dicroico con una lunghezza d'onda di taglio di 409 nm che riflette la luce UV su uno specchio che dirige la luce in un obiettivo del microscopio a fluorescenza. La lente focalizza la luce di eccitazione sul campione e raccoglie la luce emessa, che ha una lunghezza d'onda più lunga di 510 nm. Questa luce emessa passa attraverso il primo specchio dicroico, ma non il secondo, in quanto ha una lunghezza d'onda di taglio di 552 nm. Una lente di campo focalizza quindi la luce riflessa sul sensore del PMT. Nel frattempo, la sorgente di illuminazione (LED da 660 nm) per il microscopio a campo luminoso si trova sopra il campione. La luce trasmessa viene focalizzata sul campione da una lente a condensatore e l'obiettivo a fluorescenza 20× cattura l'immagine di trasmissione risultante. La lunghezza d'onda utilizzata per l'illuminazione a campo luminoso supera la lunghezza d'onda di taglio di ogni specchio dicroico, quindi passa attraverso entrambi prima che l'immagine venga focalizzata sul sensore di una fotocamera CMOS. Fare clic qui per visualizzare una versione più grande di questa figura.
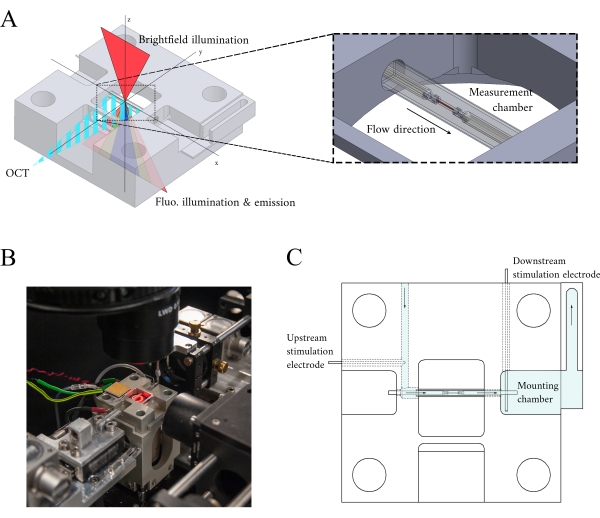
Figura 3: Progettazione del supporto della camera di misura. (A) Vista isometrica del supporto della camera di misura con percorsi ottici sovrapposti. L'illuminazione a campo luminoso avviene dalla superficie superiore (assez); L'illuminazione a fluorescenza avviene dalla superficie inferiore (assez)e il segnale OCT del braccio di misura è ortogonale all'altro asse di illuminazione (assey). Durante l'esperimento, due ganci di platino tengono una trabecola all'interno di un tubo capillare di vetro che funge da camera di misurazione. I motori a bobina vocale controllano ogni gancio e le loro posizioni vengono misurate utilizzando l'interferometria laser. La posizione corrente viene confrontata con un set point definito dall'utente e, utilizzando un controller PID codificato all'interno di un FPGA, l'errore viene ridotto al minimo. (B) Camera di misura in situ con l'illuminazione a campo luminoso accesa. La vista posteriore è mostrata nell'inserto della Figura 1 . (C) Schema del flusso superfusato attraverso il supporto della camera di misura. Superfusate entra nella parte posteriore del blocco e scorre nella direzione indicata dalle frecce. Gli elettrodi a monte e a valle stabiliscono la stimolazione del campo per suscitare la contrazione di una trabecola montata nella camera di misura. L'ombreggiatura blu indica le regioni in cui scorre il superfusato durante un esperimento. Fare clic qui per visualizzare una versione più grande di questa figura.
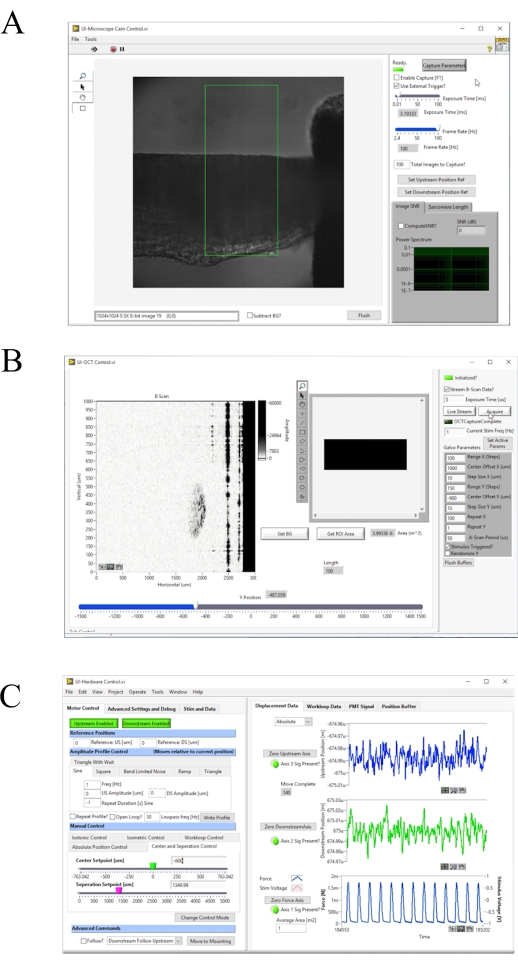
Figura 4: Pannello frontale del software di acquisizione e controllo delle immagini. (A) Interfaccia utente di imaging Brightfield. (B) Interfaccia utente di imaging dello Strumento di personalizzazione di Office. (C) Interfaccia utente di controllo hardware. Fare clic qui per visualizzare una versione più grande di questa figura.
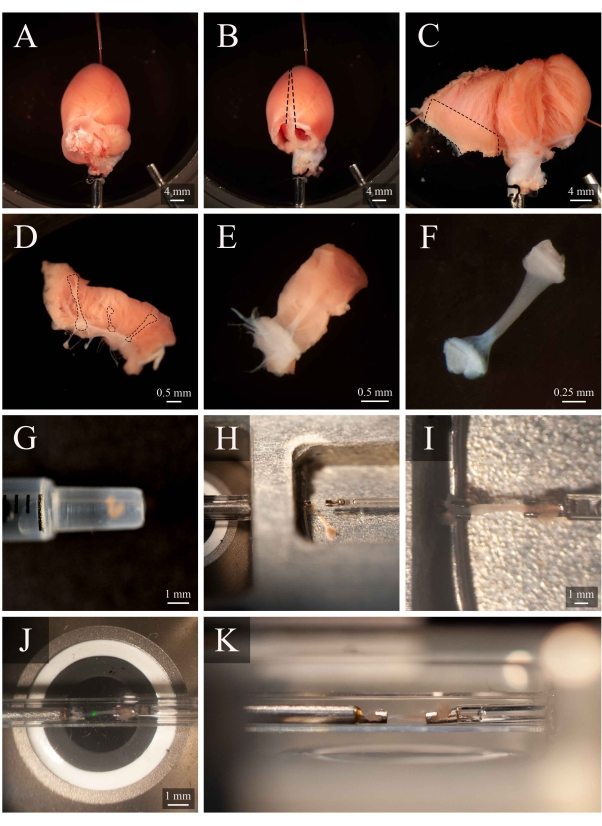
Figura 5: Dissezione della trabecola e protocollo di montaggio. ( A )Cuoredi ratto perfuso di Langendorff nella camera di dissezione. (B ) Lo stesso cuore con gli atri rimossi. Le linee tratteggiate indicano la traiettoria di escissione per aprire i ventricoli. (C) Un cuore aperto per esporre l'interno di entrambi i ventricoli. La casella tratteggiata indica la regione in cui si trovano tipicamente le trabecole. (D) Regione della parete ventricolare destra asportata (la stessa indicata dal riquadro tratteggiato in C). Le linee tratteggiate evidenziano tre trabecole. (E) Una trabecola selezionata tra le tre in D. (F) La trabecola dal pannello E con il tessuto della parete rimosso. (G) La trabecola isolata all'estremità di una siringa da 1 mL. (H) La trabecola nella camera di montaggio. (I) La trabecola montata tra due ganci di platino. (J) La trabecola, montata tra ganci, all'interno della camera di misura (Figura 3B). La macchia verde è un artefatto del primo filtro dicroico. (K) Angolo secondario della trabecola montata all'interno della camera di misura. La distanza tra la trabecola e la lente dell'obiettivo del microscopio è di circa 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
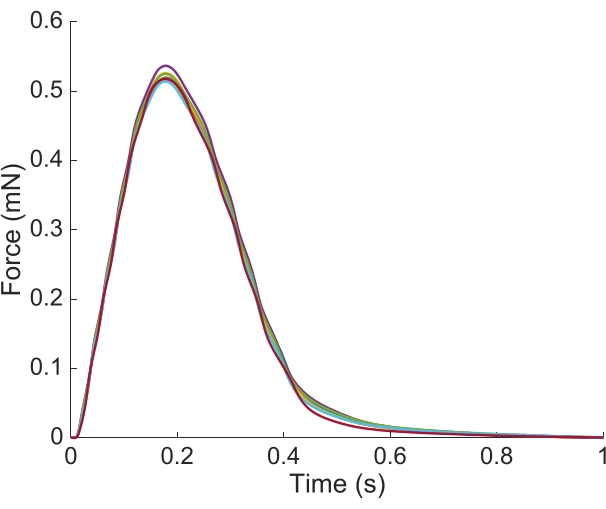
Figura 6: Dipendenza dalla posizione della misurazione della forza. La forza prodotta dal muscolo da ciascuna delle posizioni di imaging(n = 7) sovrapposta. La produzione media di forza attiva è stata di 0,527 mN ± 0,003 mN, il tempo di contrazione del 50 % 77,1 ms ± 0,3 ms e il tempo al 50 % di rilassamento 328,1 ms ± 0,9 ms (tutti i dati sono presentati come la media ± SE). Fare clic qui per visualizzare una versione più grande di questa figura.
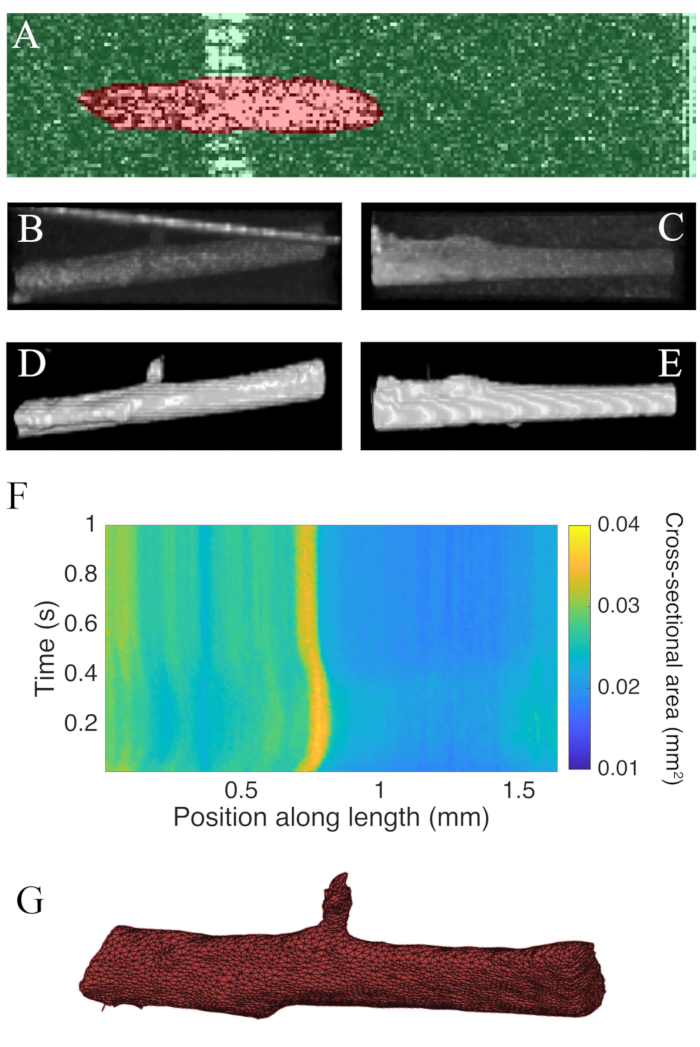
Figura 7: Analisi di imaging OCT. (A) Esempio di segmentazione WEKA. La sezione trasversale segmentata del muscolo è evidenziata in rosso e lo sfondo è evidenziato in verde. (B) Vista superiore dei dati grezzi di C-scan di una trabecola. La linea luminosa angolata verso la parte superiore dell'immagine è il riflesso della parete della camera di misurazione. (C) Vista laterale dei dati grezzi di C-scan di una trabecola. (D) Visualizzazione superiore dei dati PTOM segmentati. (E) Visualizzazione laterale dei dati PTOM segmentati. (F) L'area della sezione trasversale lungo la lunghezza della trabecola ( assex)attraverso il tempo ( assey). L'area media della sezione trasversale lungo la lunghezza muscolare era di 0,0326 mm2 ± 0,0005 mm2 (± S.E.) (G) Una maglia della trabecola. La mesh è stata approssimativamente allineata con il grafico dell'area della sezione trasversale del pannello F. Fare clic qui per visualizzare una versione più grande di questa figura.
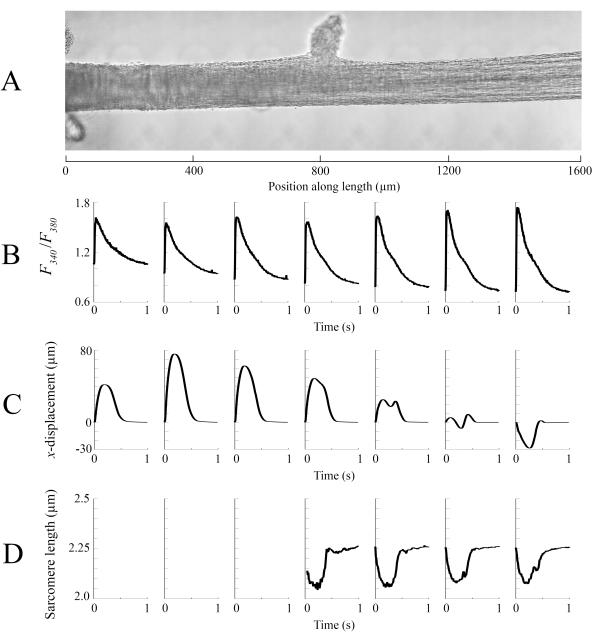
Figura 8: Analisi di imaging a campo luminoso e fluorescenza. (A) Immagine cucita (sette finestre di imaging) della trabecola. (B) Ca2+ transitori lungo la lunghezza della trabecola. (C) Medio x-spostamento da ogni finestra di imaging. Uno spostamento positivo rappresenta un movimento a destra e negativo a sinistra. (D) Lunghezze medie del sarcomero da ogni finestra di imaging che aveva il contrasto dell'immagine necessario. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Tabella delle soluzioni Fare clic qui per scaricare questa tabella.
Discussione
In questo studio, presentiamo una configurazione che consente l'assemblaggio di tre sistemi ottici che combinano campo luminoso, fluorescenza e imaging OCT per raccogliere dati da una trabecola cardiaca ex vivo attivamente contraente (Figura 1 e Figura 2). Tale integrazione orchestrata è possibile grazie alla progettazione della camera di misura (Figura 3) per consentire la disposizione ortogonale dell'OCT all'asse campo luminoso-fluorescenza. Il sistema di montaggio muscolare svolge un ruolo altrettanto importante nel successo delle quantificazioni simultanee degli indici chiave nella caratterizzazione delle dinamiche di eccitazione-contrazione del muscolo cardiaco. La sua novità risiede nell'abilitare procedure di scansione muscolare senza apparente disturbo alle prestazioni meccaniche del muscolo (Figura 6). Con la configurazione combinata di imaging e il sistema a gancio motorizzato per la misurazione della forza, questo sistema può valutare l'eterogeneità regionale nel transitorio, nello spostamento e nella lunghezza del sarcomero di Ca2+, insieme alle informazioni geometriche macroscopiche di una trabecola contraente durante il corso temporale della contrazione (Figure 7 e Figura 8).
Data l'ubiquità dei sistemi di imaging a campo luminoso-epifluorescenza all'interno dei laboratori di ricerca cardiaca, la riproduzione di questi risultati può essere ottenuta con alcune considerazioni hardware minori. Qui, presentiamo il toolkit di elaborazione delle immagini per combinare campo luminoso-epifluorescenza e OCT, che è essenziale per analizzare l'eterogeneità contrattile sottostante. L'integrazione dell'OCT richiede un percorso ottico senza ostacoli, mentre l'imaging gated richiede una linea di trigger esterna tra lo stimolo e la telecamera di imaging OCT e brightfield e ganci di montaggio muscolare in grado di spostare il campione in tutta la camera di misurazione. Il software e i metodi di post-elaborazione richiesti sono disponibili gratuitamente. In particolare, il software di segmentazione utilizzato, WEKA14, è open-source. Anche la tecnica di tracciamento senza marcatori dei punti materiali8,della lunghezza del sarcomero, dell'imaging volumetrico gated10e dei codici di generazione delle maglie è accessibile e può essere resa disponibile su richiesta dell'autore corrispondente.
La vitalità muscolare, il carico ottimale di Fura-2 e la messa a fuoco dell'immagine sono i tre pilastri che costituiscono le basi di un esperimento di successo. L'utilizzo di una soluzione di dissezione contenente BDM per prevenire la contrattura, il trasporto del muscolo in una siringa, l'ossigenazione continua della soluzione e la preparazione di nuove soluzioni sperimentali il giorno di un esperimento, contribuiscono tutti ad un alto tasso di vitalità muscolare. Prima di caricare la trabecola con Fura-2AM, l'autofluorescenza deve essere raccolta per ogni condizione che si è interessati a studiare in quanto può avere un effetto significativo sul Ca2+ transitoriomisurato 15. L'ossigenazione della soluzione di carico Fura-2AM è complicata dalla necessaria inclusione del tensioattivo pluronic-F127 per facilitare il carico del colorante. Per combattere la conseguente formazione di bolle in eccesso causata da questo tensioattivo, una piccola goccia di antischiuma nella soluzione di carico consente all'utente di aumentare la velocità di ossigenazione, migliorando così la possibilità che la trabecola mantenga la vitalità funzionale durante tutto il processo di carico. Infine, la messa a fuoco dell'imaging deve essere uniforme lungo la lunghezza muscolare per massimizzare il rapporto segnale/rumore delle informazioni sul campo luminoso e sulla fluorescenza.
Ci sono due limitazioni da considerare con i metodi presentati qui. Il primo è la risoluzione spaziale del microscopio a fluorescenza. Mentre le risoluzioni spaziali dell'OCT e dell'imaging a campo luminoso sono elevate, la risoluzione del microscopio a fluorescenza è limitata all'integrale della fluorescenza dal volume catturato all'interno di una finestra di imaging di 540 μm per 540 μm. C'è spazio per aumentare la risoluzione spaziale del microscopio a fluorescenza utilizzando una fotocamera del dispositivo ad alto guadagno accoppiato alla carica, invece di un PMT, per catturare il segnale di fluorescenza a scapito del rapporto segnale/ rumore16. Il secondo è il diametro della trabecola che può essere studiato in termini di lunghezza del sarcomero misurabile e profondità geometrica. L'approccio windowed-FFT per il calcolo della lunghezza del sarcomero sfrutta il vantaggio di una migliore risoluzione spaziale ma è associato a una ridotta robustezza (Figura 8D). Nei casi in cui devono essere studiate trabecole torbide o di grande diametro, la risolvibilità della FFT sarà notevolmente ridotta a causa del ridotto contrasto associato alla banda sarcomerica in campioni di tessuto più grandi. Allo stesso modo, all'interno dell'OCT, le retroriflessioni da una profondità di imaging superiore a 300 μm saranno troppo deboli per essere risolte durante la fase di segmentazione. Quindi, la nostra tecnica è limitata a trabecole di diametro inferiore a 300 μm. Tuttavia, non è consigliabile studiare campioni di grande diametro in quanto potrebbero esserci problemi con l'ossigenazione diffusiva del nucleo muscolare durante alti tassi di stimolazione17.
Il nostro metodo consente la valutazione della funzione meccanica ionica in associazione con la geometria muscolare in muscoli sani e malati, fornendo un potente approccio alla comprensione della fisiologia del muscolo cardiaco, della fisiopatologia e della farmacologia. La pipeline di elaborazione delle immagini qui delineata estrae i dati che saranno fondamentali per ottenere una comprensione più profonda dell'eterogeneità contrattile. Una strada per realizzare appieno il potenziale di un set di dati così ricco è nella costruzione di modelli matematici che integrano e interpretano questi dati e per fare previsioni che possono essere testate sperimentalmente utilizzando il nostro dispositivo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato finanziato da borse di dottorato dell'Università di Auckland (assegnate a JD e MC), Sir Charles Hercus Health Research Fellowships (20/011 e 21/116) dal Consiglio di ricerca sanitaria della Nuova Zelanda (assegnate a J-CH a KT, rispettivamente), una borsa di studio di dottorato assegnata dalla National Heart Foundation (assegnata ad AA), marsden Fast-Start grants (UOA1504 e UOA1703) dalla Royal Society of New Zealand (assegnata a J-CH e KT, rispettivamente), e una James Cook Research Fellowship della Royal Society of New Zealand (assegnata ad AT). Lo sviluppo originale di questo strumento è stato finanziato da una sovvenzione Marsden (11-UOA-199) della Royal Society of New Zealand (assegnata ad AT e PN).
Materiali
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
Riferimenti
- Han, J. -C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250(2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398(2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon