Method Article
동시 브라이트필드, 형광, 및 수축 심장 Trabeculae Ex Vivo의 광학 일관성 지형 이미징
요약
이 프로토콜은 적극적으로 수축심장 trabecula ex vivo에서sarcomere, 칼슘 및 거시적 기하학적 기하학적 데이터의 컬렉션을 제공합니다. 이러한 동시 측정은 세 가지 이미징 양식의 통합에 의해 가능하게됩니다.
초록
심장 근육에서, 세포 내 Ca2+ 과도는 수축 근막을 활성화, 수축을 일으키는, 거시적 단축, 기하학적 변형. 우리는 근육 내부의 '볼'도 정확하게 흥분 수축 역학의 현시적 특성을 추적 할 수 없기 때문에 이러한 이벤트 사이의 내부 관계에 대한 우리의 이해는 제한되었습니다. 이러한 문제를 해결하기 위해 이미징 양식 제품군을 결합한 장치를 구축했습니다. 특히, 그것은 sarcomere 길이와 조직 긴장의 국소 변화를 측정하기 위해 밝은 필드 현미경을 통합, Ca2 + 과도를 시각화하는 형광 현미경, 심장 사이클의 시간 과정을 통해 조직의 기하학적 변화를 캡처하는 광학 일관성 토모그래프. 이미징 인프라 및 관련 데이터 수집 프레임워크를 소개합니다. 데이터는 trabeculae 카네아로 알려진 고립 된 막대 같은 조직 구조에서 수집됩니다. 우리의 악기에서, 위치 제어 백금 후크 한 쌍은 지속적으로 영양이 풍부한 식염수 용액으로 슈퍼파이드하는 동안 전 생체 근육 샘플의 각 끝을 보유합니다. 후크는 독립적 인 통제하에 있으며 근육 길이와 힘의 실시간 제어를 허용합니다. 세로로 변환하면 시료를 조각적으로 스캔할 수 있으며, 현미경 이미징 창(540 μm x 540μm)과 일반적인 트라베큘라(>200 μm)의 길이와 관련된 상대적 크기와 관련된 한계를 극복합니다. 근육 실의 양쪽 끝에 있는 백금 전극은 사용자 정의 속도로 trabecula를 자극한다. 각 이미징 창에서 데이터를 동기화하여 정상 상태 조건에서 전체 샘플 경련을 재구성하기 위한 트리거로 자극 신호를 활용합니다. 이러한 브라이트필드 이미징 데이터에 이미지 처리 기술을 적용하면 조직 변위와 사컴 길이 맵이 제공됩니다. 이러한 데이터 수집은 실험 모델링 파이프라인에 통합될 때 생리학 및 병리학분야에서 근육 수축 균질성 및 이질성에 대한 심층적인 이해를 제공할 것입니다.
서문
격리된 심장 근육 조직 제제의 과융합은 심장 이온 활성화 및 역학1을공부하기 위한 표준적이고 널리 사용되는 프로토콜이다. 특히, 심실 벽으로부터 의 석영, 막대형 구조물의 분리는 수축2의길이 의존적 활성화, 수축3,4,및 심장 조직의 확장기 점성 탄성5의 스트레치 의존적 반응을 포함하는 현상의 평가를 가능하게 하였다. Ter Keurs, 고립 된 trabeculae를 초첩하는이 기술의 이 기술의 시공자, 처음에 사코메 길이 를 결정하기위한 Ca2 + 측정 및 레이저 회절에 대한 형광 이미징의 조합을 사용2,5. 이러한 초기 연구 이후, 브라이트 필드 현미경이미지에 2D 빠른 Fourier 변환 (FFT) 기반 기술을 사용하여 더 큰 공간 해상도와 사코레 길이 정보를 추출하는 것이 점점 더 일반화되고있다. 두 이미징 시스템은 Ca2+ 릴리스와 sarcomere 길이 종속 력 생산 사이의 근본적인 관계에 대한 부분적인 평가를 허용합니다.
심장 근육은 두껍고 두꺼운 필라멘트로 구성된 수축 단위의 기본 시리즈와 관련된 눈에 보이는 밴딩으로, striated. sarcomeres를 구성하는 이러한 구성 필라멘트의 상호 작용은 다음과 같이 시작되는 힘 생성의 근간을 나타냅니다: 탈극화 전기 신호, 또는 작용 잠재력은 세포막에 있는 전압 의존형 L형 Ca2+ 채널을 열어 놓습니다; Ca2+의 후속 세포 유입은 Ca2+ -유도된 Ca 2+ 릴리스7로알려진 프로세스에서 세포내 Ca2+ 저장소인 사코플라즈마 망상(SR)으로부터 Ca2+의방출을 유도합니다. 나노 몰러에서 마이크로 몰라 범위에 세포 내 Ca2+ 농도의 이 급격한 증가는 힘 생산이 발생할 수 있습니다; Ca2+ 펌프는 지속적으로 SR 및 세포 외 구획으로 다시 사이토솔에서 Ca2 + 를 돌출; 세포 내 Ca2+ 농도가 나노 몰라 범위로 돌아오면 강제 생산이 중단되고 근육이 이완됩니다. 강제 생산 중에 구성 성분이 두껍고 얇은 필라멘트가 서로 미끄러져 나아있습니다. 사코머 길이는 겹치는 상대적 정도를 지시하므로 근육의 강제 생산 가능성은 거시적으로 결정됩니다.
이 논문에서, 우리는 광학 일관성 단층 촬영 (OCT)를 포함하는 이 형광-밝은 필드 화상 진찰 기술을 확장합니다. OCT는 간섭의 물리적 원리를 이용하고 근육 수축 이질성을 이해하기 위하여 조직의 기하학적 변형을 얻을 수 있습니다8. 우리의 장치(그림 1)스펙트럼 도메인 OCT (SD-OCT) 시스템을 사용합니다. SD-OCT에서 빔 스플리터는 광대역 짧은 응고 길이초발광 다이오드에서 빛을 참조 및 측정 암으로 분할합니다. 기준 암에는 고정 거울이 포함되어 있으며 측정 팔에는 빛을 조종하는 2D 갈바노미터가 포함되어 있습니다. 샘플에서 백산된 빛이 수집되고 참조 암에 반사된 빛을 방해하여 간섭 패턴을 형성합니다. 깊이 정보는 스펙트럼 프린지의 주파수로 인코딩됩니다. 정보를 추출하기 위해 신호는 분광계를 통과하고 역 FFT가 결과에 적용됩니다. 해당 1D 신호는 굴절률 9(A-스캔)의 변화에 대응하는 서로 다른 깊이의 구조를 나타냅니다. 레이저를 단일 축으로 조향함으로써, 하나는 관심 있는 시료(B-scan)의 단면을 구성할 수 있으며, 마찬가지로, 남은 축에서 단계별 패턴으로 공정을 반복함으로써, 3차원 영상을 생성할 수 있다(C-s스캔). 확장하여, 외부 트리거를 기반으로 반복 시간 변화 피사체에 대한 단일 슬라이스에서 일련의 B 스캔을 수집하고 시간 변화 평면이미지(10)를나타내는 3차원 스캔을 생성하기 위해 반복할 수 있다.
3개의 화상 진찰 시스템을 통합에서, 우리는 다음 두 가지 원리를 고려했습니다. 첫째, 이미징 센서는 대체 이미징 양식에서 빛을 감지해서는 안되며, 둘째, 물리적 설계에는 적어도 3개의 동시 이미징 평면에 대한 여유 공간이 포함되어야 합니다. 첫 번째 요구 사항을 해결하기 위해 밝은 필드 현미경은 660 nm 파장 LED를 사용하여 반전 된 구성으로 샘플을 조명합니다. 형광 현미경은 동일한 객관적인 렌즈가 방출된 빛의 여기 및 수집을 위해 사용되는 상피 성화 구성에 있습니다. 흥분광은 340nm에서 380nm 사이의 파장을 가지며, 광증 튜브(PMT)는 510nm의 파장에서 방출된 빛을 측정한다. 한 쌍의 이색 거울을 사용하면 반대측정(그림 2)을방해하지 않고 이 두 개의 광학 경로를 동일한 물리적 발자국을 공유할 수 있습니다. 마지막으로 OCT는 광대역(100nm 스펙트럼 폭) 라이트를 사용하여 중앙 파장이 840nm로 다른 두 양식과 구별됩니다. OCT에 사용되는 빛의 낮은 일관성 특성으로 인해 밝은 필드 형광 원에서 산란 된 빛은 깊이 정보를 인코딩하는 간섭 패턴에 기여하지 않습니다. 두 번째 요구 사항에 대해, 모세관 튜브에 대한 하우징 디자인은 샘플의 전방, 열등, 우수한 평면에 접근 광학 경로를 가지고있다. 실험 중, 두 개의 백금 후크는 산소 크렙스 헨셀레이트 (KH) 용액으로 인하여 모세관 튜브 내에서 trabecula를 개최합니다. OCT의 갈바노미터 헤드는 제3직기 광학평면(그림 3)을활용하기 위해 밝은 필드 형광 이미징 경로에 직교를 지향한다.
이 논문은 칼슘, 사코메 길이 및 근육 기하학을 동시에 이미징할 수 있는 장치를 구축하기 위한 설계 고려 사항을 설명합니다. 이러한 측정 기능을 입증하기 위해, 당사는 전 생체 내 trabecula의 처리 및 형광 로딩과 관련된 중요한 단계와 함께 심실 trabecula, 필요한 완충 솔루션의 제조를 격리하는 과정을 설명합니다. 마지막으로 이 백서는 데이터 집합을 보다 유용한 시각화로 변환하는 데 필요한 프로세스를 간략하게 설명합니다.
프로토콜
오클랜드 대학 동물 윤리위원회는 쥐의 처리와 조직 샘플의 준비를 승인했다.
1. 이미징 교정
- 브라이트필드 현미경 픽셀 교정
- 측정 챔버를 증류수로 채웁니다.
- 측정 챔버에 μm 당 알려진 라인으로 회절 격자를 배치합니다.
- F1을 눌러 회절 격자가 명확하게 표시될 때까지 프레임 속도 [Hz]를 캡처하고 조정할 수 있습니다(그림4A). 회절 격자가 프레임 가장자리와 평행하게 실행되는지 확인합니다. 캡처를 중지하려면 F1을 다시 누릅니다.
- 총 이미지를 캡처하도록 설정하려면 Ctrl + Shift + S를 눌러 데이터를 디스크로 스트리밍하고 F1을 눌러 회절 격자이미지를 캡처합니다.
- ImageJ를 열고 회절 격자 이미지를가져옵니다(파일 > 열기 > 캘리브레이션 이미지 선택). 시프트를 잡고 회절 격자의 20 개의 빛과 어두운 밴드를 포함하는 선을 그립니다.
- 이미지를 보정합니다(>설정 배율 분석). 1.1.5 단계의 줄 길이는 픽셀의 거리 값을 설정합니다. 알려진 거리 값을 μm 측정당 라인의 20배, 길이 단위에서 μm단위로 설정합니다. 배율의 역은 픽셀로 표시되는 마이크로미터의 수입니다.
- OCT 깊이 해상도 교정
- 버니어 캘리퍼를 사용하여 유리 현미경 슬라이드의 두께를 측정합니다.
- OCT 레이저 소스를 켭니다.
- 갈바노미터 헤드를 덮고 BG를 클릭하여 배경 간섭 패턴을 측정하고 측정(도4B)에서빼십시오.
- 10월의 측정 암에서 측정된 유리 현미경 슬라이드(1.2.1 단계부터)를 고정합니다.
- 라이브 스트림을 클릭하여 OCT 이미지를 봅니다. 유리 현미경 슬라이드가 B 스캔 내에서 보일 때까지 조정합니다.
- B-스캔 이미지를 캡처하려면 범위 Y(단계)를 하나로 설정하려면 B-스캔 데이터 스트림을클릭하고 획득을 클릭합니다.
- 이미지J(파일 > 오픈 >B-스캔 선택으로B 스캔 이미지를 가져옵니다. 시프트를 잡고 유리 현미경 슬라이드의 경계 사이에 선을 그립니다.
- 배율을 설정합니다(설정배율 > 분석). 1.2.1 단계에서 수집된 측정에 대한 알려진 거리를 설정합니다.
- 공기 중의 깊이 해상도를 계산하려면, 현미경슬라이드(nglass = 1.5175)의 굴절률에 대해 정확하11은 n유리로픽셀 값당 측정값을 곱하여 올바르게 한다.
참고 : 인용 된 n유리는 보로실리케이트 유리입니다. 현미경 슬라이드는 다른 재료로 만들 수 있습니다. 측정된 슬라이드에 적합한 굴절률을 사용합니다. - 심근의 깊이 해상도를 조정하려면 값을 1.2.9 단계에서 나눕니다. n심근 = 1.38 (값은 이전에보고 된 값 12).
2. 근육 샘플 준비
- 해부 리그를 준비합니다.
- 해부 용액의 일부를 붓고 (표 1에설명) 작은 금속 그릇에 넣고 심장 절제 하기 전에 약 한 시간 전에 냉동실에 놓습니다.
- 해부 용액이 산소가 잘 공급되고 (100 % 산소)가 잘 산소가 되고 각 튜브 라인을 통해 플러시되도록 해부 장비를 설치합니다. 해부 챔버를 산소 분약 용액으로 채우고 관류 카테터 주위에 3/0 봉합사를 느슨하게 묶습니다.
- 마음을 흥분시다.
- 기체 이소플루란 (산소 < 5 %)을 사용하여 8-10 주 오래 된 Wistar 쥐를 마취합니다. 꼬리 꼬집기로 마취를 확인합니다.
- 마취된 쥐를 스핀 위치에 배치하고 헤파린 용액(1000 IU/kg)으로 복부 부위에 피하주사를 주입한다. 헤파린이 순환할 수 있도록 5분 이상 마취를 유지한다.
- 냉동고에서 해부 용액이 들어있는 금속 그릇을 검색하고 안락사 벤치 근처에 놓습니다.
참고: 해부 된 심장의 완전한 침수를 가능하게하기 위해 해부 용액을 완전히 동결하지 마십시오. - 마취 된 쥐를 안락사 벤치로 옮기고 자궁 경부 탈구로 안락사하십시오.
- 가위로 쥐 가슴을 열고 먼저 흉곽의 밑면을 따라 바디 벽을 절단한 다음 횡격막을 절단한 다음 흉곽의 측면 경계를 따라 진행하십시오. 길에서 가슴을 들어 올립니다.
- 다른 손으로 심장을 잡고 다른 한편으로는 연결된 혈관 (대르타, 베나 카바 등)을 잘라 곡선 가위 쌍을 사용합니다.
- 차가운 해부 용액에서 심장을 빠르게 잠급합니다.
- 트라베큘라를 분리합니다.
- 심장이 금속 그릇에 있는 동안 대동맥을 확인한 다음 심장을 해부 실로 옮습니다. 두 개의 곡선 된 집게를 사용하여 관류 캐뉼라 위에 대어타를 당깁니다.
- 대개를 하나의 집게로 제자리에 잡습니다. 한편, 해부 용액이 관류 캐뉼라를 통해 흐를 수 있도록 튜브 라인을 엽니다.
참고: 심장 절제 후 1분 이내에 관류를 완료하는 것을 목표로 합니다. - 관상 동맥 혈관이 혈액을 지워지고 심장이 해부 용액으로 완전히 침투되면 관류 흐름을 중단하고 봉합사를 사용하여 대동맥을 고정하십시오. 흐름을 다시 켜고 수양된 심장을 감내십시오.
- 왼쪽 관상 동맥이 우수한 표면에 보이도록 캐뉼라를 회전합니다. 해부 챔버의 바닥에 심장의 정점을 고정(도 5A). 두 atria(그림 5B)를모두 잘라냅니다.
- 스프링 가위 세트로 중격의 오른쪽을 따라 심장 정점에 잘라냅니다 (그림 5B에표시된 대로). 열린 좌심실을 해부 챔버의 베이스에 고정합니다. 그런 다음 중격의 왼쪽을 따라 잘라 오른쪽 심실을 열고 해부 챔버의 기지에고정(도 5C).
참고: 통풍관을 열린 위치에 고정하려면 일부 유두 근육을 잘라야 합니다. 오른쪽 심실에서 자유 실행 trabecula를 식별(그림 5D-E). - 스프링 가위와 집게를 사용하여, trabecula를 둘러싼 벽 조직을 잘라, 다음 trabecula의 방향으로 반 직교로 벽 조직을 잘라. 치수가 사용되는 마운팅 구성에 적합한 때까지 벽 조직을 다듬습니다. 이 경우 참깨의 약 절반크기(도 5F).
참고: Trabeculae는 오른쪽 및 왼쪽 심실에서 해부될 수 있지만, 왼쪽에서 나온 심실은 일반적으로 더 탁이 많고 사코메르 및 기하학 측정에 덜 적용됩니다. - 절제된 trabecula를 해부 챔버에 두고 해부 용액을 지속적으로 중첩시하십시오.
3. 실험 프로토콜
참고: 이 실험에 사용된 장치13은 사내에서 제작되었으며 사용자 지정 제어 코드를 사용합니다. 이러한 데이터를 복제하기 위해 구축된 장치의 설계에 필요한 고려 사항은 독립적으로 작동되는 장착 후크 2개, 광학적으로 선명한 3개축(그림 3)이있는 측정 챔버, 그리고 브라이트필드 및 OCT 카메라를 자극기와 동기화하는 외부 트리거 라인입니다. PMT 전압 및 힘 신호는 아날로그 DAQ 카드를 사용하여 수집되었고, 10월 및 브라이트필드 현미경의 이미지는 카메라 링크 프레임 그래버 카드를 사용하여 수집되었고, 자극 신호는 디지털 I/O 카드를 사용하여 수집되었다. 데이터는 시간적 정렬을 유지하기 위해 생산자 소비자 루프 세트를 사용하여 오프라인으로 저장되었습니다.
- 심근계를 준비합니다.
- 뜨거운 (~60°C) 물, 증류수(실온)를 플러시한 다음 측정 챔버를 통해 용액을 과압합니다. 카보젠으로 중첩 용액을 지속적으로 거품을 낸다.
- 밝은 필드 현미경 조명 원을 켜고 캡처를 가능하게 F1을 누릅니다(그림 4A). 밝은 필드 이미지에 중심이 될 때까지 다운스트림 후크를 수동으로 조정합니다. 0 다운스트림 축을클릭한 다음 다운스트림 비활성화되어 모터를 활성화합니다(그림4C). 후크가 끝날 때까지 DS Setpoint [um] 슬라이더를 이동하여 기본 관심 영역의 가장자리와 정렬합니다.
- 다운스트림 축을 다시 0으로 설정한 다음 DS Setpoint [um] 슬라이더를 1000으로 이동합니다. 업스트림 후크로 프로세스를 반복하지만 미국 Setpoint [um] 슬라이더를 이동하지 는 않습니다.
- 마운팅으로 이동을 클릭합니다(그림4C).
- 메인 스위치를 전환하여 컨트롤러 하위 시스템을 빠르게 켜기 전에 램프 스위치를 전환하여 형광 조명 시스템을 시작합니다.
참고: 일부 UV 광원은 다량의 오존을 생성합니다. 이 경우 오존 추출기를 광원의 출구 통풍구에 연결하고 형광 조명 원을 켜기 전에 실행되고 있는지 확인합니다. - 전면 패널의 모드 버튼을 누르고 2,다음 1을눌러 작동 모드를 터보 블랭킹으로 전환합니다. 온라인 버튼을 눌러 컨트롤 코드가 작동을 알릴 수 있도록 합니다.
- 트라베큘라를 마운트합니다.
- 측정 챔버를 통해 슈퍼퍼서트 흐름을 일시 중지합니다. 마운팅 챔버를 해부 용액으로 채웁니다.
- 1 mL 주사기를 사용하여, 마운팅 챔버(도 5G)로해부 챔버에서 trabecula를 수송한다.
- 트라베큘라를 전송하려면 주사기를 수직으로 배치하고 장착 챔버 용액의 표면과 접촉하십시오. 트라베큘라가중력(그림 5H)을통해 마운팅 챔버로 내려갑니다.
- 후크의 중간 부와 수준에 있도록 장착 챔버의 유체 수준을 낮춥다.
- DS Setpoint [um] 슬라이더를 이동하여 트래베큘라의 여유 길이를 반영하도록 후크 사이의 거리를 조정합니다.
- 현미경을 사용하여 시각화를 돕고, 집게로 엔드 티슈 조각 중 하나를 가볍게 잡고 업스트림 후크에 장착하십시오. 다운스트림후크(도 5I)에엔드 티슈의 다른 조각을 마운트합니다.
- 일단 단단히 장착되면, 챔버로 이동을 눌러 측정 챔버(도 5J)로다시 trabecula를 이동(도 4C). 슈퍼퍼퍼자이트 흐름 및 유체 추출을 재개합니다.
- 자극 주파수 [Hz]를 1로 설정하고, 자극 지속 시간 [ms]를 10으로 설정하고, 자극 전압을 10으로 설정합니다. 자극을 눌러 자극을 시작?.
- 트라베큘라를 준비한다.
- 약 1h의 적응 후, 1V 및 1 ms 단계에서 자극 전압 및 자극 지속 시간을 각각 점진적으로 감소시다. 일반적인 값 집합은 3 V 및 3 ms입니다.
- 밝은 필드 조명 시스템을 켭니다. F1을 누르고 사용자 인터페이스에서 줄어든 영역을 둘러싸는 관심 영역을 선택합니다. 계산 SL을 클릭하여 강조 표시된 영역의 평균 사코메 길이를 계산합니다. 분리 세트점 [um] 슬라이더를 증가시켜 평균 사커메 길이가 2.32 μm이 될 때까지 근육 길이를 늘립니다.
참고: 컴퓨팅 SL? 4.3 단계에서 설명된 2D FFT를 사용합니다. 평균 사컴 길이를 계산하는 데 사용되는 관심 영역은 일반적으로 100 μm ~ 150 μm 정사각형이다. 따라서 근육이 최적의 사카머 길이에 접근함에 따라 43~65개의 사마머가 평균 사카머 길이를 계산하는 데 사용됩니다. - 다운스트림 후크의 가장자리가 밝은 필드 이미지 내에서 볼 수 있도록 "센터 및 분리 제어 탭(그림 4C)에 센터 세트 포인트 [um] 슬라이더를 조정하여 근육을 이동합니다. 10개의 경련에 대한 형광 정보를 수집합니다.
- 센터 세트포인트 [um] 값을 200까지 늘리고 형광 정보의 10 가지 가치가 있는 또 다른 트위치 정보를 수집합니다. 브라이트필드 이미지에 업스트림 후크가 들어올 때까지 이 프로세스를 반복합니다. 최종 창의 형광 정보를 수집합니다.
- 센터 세트포인트 [um] 값을 0으로 설정하여 trabecula를 중앙 위치로 되돌려 놓습니다.
- 자극 주파수를 0.2Hz로 줄이고 KH 가퍼퍼셋에서 후라-2 로딩 솔루션으로 전환합니다(표 1에자세히 설명).
- Stim 및 데이터 탭에서 형광 소스 사용(활성화)을 클릭하여 10분마다 형광 신호를 측정합니다. PMT 신호 탭에서 형광 신호를 시각화합니다.
- 360 nm 신호가 10배 또는 로딩 절차의 지속 시간이 2h를 초과한 후, 자극 주파수를 1Hz로 되돌리고 KH 가압 솔루션으로 다시 전환한다.
- 비율 측정이 안정화될 때까지 10분마다 비율 측정을 확인하며, 이 때 데이터 수집이 시작될 수 있습니다.
- 밝은 필드 및 형광 이미징 데이터를 수집합니다.
- 다운스트림 후크의 가장자리가 밝은 필드 이미지 내에 있는 위치로 근육을 반환합니다. 하드웨어 제어 사용자 인터페이스의 Stim 및 데이터 탭에서 디스크로 데이터 스트림을 클릭하여 하드웨어 데이터 스트리밍을 시작합니다. 형광 소스 사용 활성화를클릭하여 형광 정보를 캡처합니다.
- 브라이트필드 이미징 사용자 인터페이스에서 캡처 모드를 외부 트리거로 설정하고 프레임 속도를 100Hz로 늘리고 캡처할 이미지 수를 100으로 설정합니다. Ctrl + 시프트 + S를 누르고 F1이 창에 대한 밝은 필드 이미징 데이터를 기록합니다.
- 센터 세트점 [um] 값을 200으로 늘리고 3.4.2 단계를 반복합니다. 3.3.4 단계에서 최종 창에 대해 이미징 데이터가 수집될 때까지 스캐닝 프로토콜을 계속 합니다.
- 센터 세트포인트 [um] 값을 0으로 설정하여 trabecula를 중앙 위치로 되돌려 놓습니다.
- OCT 이미징 데이터를 수집합니다.
- 마스터 키를 | 켜서 OCT 레이저 소스를 켭니다. 기호, 전원 버튼을 누르면, SD 버튼 다음.
- 갈바노미터 헤드를 덮고 BG를 클릭하여 배경 간섭 패턴을 측정하고 측정(도4B)에서빼십시오.
- 이미지 캡처 모드를 라이브 뷰로 설정합니다.
- B-스캔 이미지에 업스트림 후크만 포함될 때까지 y-위치를조정합니다. 제어 전면패널(도 4B)에표시된 근육 길이를 2개로 나누고 현재 y-위치를뺍니다. 이 값을"y-offset"입력에 입력합니다. trabecula의 단면이 프레임의 중심이 될 때까지"x-offset"값을 조정합니다.
- trabecula를 중심으로 y-축을따라 스캔하여 y-위치를조정하여 업스트림 및 다운스트림 후크에 해당하는 위치를 찾습니다. 이러한 위치를 아래로 기록합니다. 10으로 나눈 이러한 값 간의 절대 차이로 범위 Y(단계)를 설정합니다.
- 이미지 캡처 모드를 트리거된 자극으로 설정하려면, 범위 X(단계)를 100으로 설정하고 활성 매개 변수 설정 단추를 클릭합니다.
- B-스캔 데이터 스트림을클릭한 다음 .
참고: 게이트 이미징 프로토콜은 200개의 트위치가 필요하며, 이는 ~3분 20초의 캡처 시간에 해당하는 샘플 2mm 길이의 전체 근육 형상을 캡처합니다.
4. 브라이트필드 이미지 데이터 세트 처리
- 분석을 위해 이미지를 준비합니다.
- ImageJ(이미지 >이미지 시퀀스를 > 이미지 시퀀스를 선택하기 > >이미지 로 가져옵니다.
- 이미지 대비 를 증가(이미지 > 밝기 / 대비 >를 조정> 이미지 히스토그램을 중앙 집중화하기 위해 최소 및 최대 슬라이더를 이동).
- 이미지를 선명하게(프로세스> 필터 > 표시되지 않은 마스크 > 반경(시그마)을 1.0픽셀로 설정하고 마스크 중량(0.1-0.9)에서 0.6으로 설정합니다.
- 이미지 시퀀스를 내보냅니다(>이미지 시퀀스로 저장> 형식을 PNG로 설정하고,0으로 시작하고 숫자(1-8)를 4로 설정합니다.
- 이미지를 스티치하고, 지역화된 변위를 측정하고, 로컬 사코메 길이를 계산합니다.
- "TrabeculaProcessing.m"(요청 시 사용 가능)를 열고 모든 데이터를 포함하는 기본 폴더에 FolderPath 변수를 설정하고 4.1.4 단계의 이미지 시퀀스가 저장된 폴더에 ImagePath를 설정합니다. 섹션은 이미징 창 및 프레임 수로 창을 캡처한 프레임 수로 설정합니다.
- 코드를 실행합니다.
참고: 출력은 사용자가 지정한 출력 폴더 경로에 표시됩니다. 기본적으로 경로는 폴더패스/출력으로 설정됩니다.
- FFT 사프로플러 길이 기술
- 이미지 처리 소프트웨어를 사용하여 sarcomere가 눈에 잘 띄는 이미지 영역에서 FFT를 수행합니다.
- μm 보정 결과 1.1.6 x 1.6 μm 및 3.0 μm의 픽셀을 곱한 후 반전을 계산하여 관심 있는 공간 주파수의 범위를 얻습니다.
- 4.3.2 단계에서 계산된 주파수 범위의 주파수 정보를 무시하고, FFT 결과에 지수에 맞게 변환 결과에서 빼고 DC 용어를 제거한다.
- 관심의 주파수 밴드에 가우시안 곡선을 맞춥시다.
- 가우시안 곡선의 피크의 반전을 계산합니다. 이것은 관심 지역의 평균 사카레 길이입니다.
참고: FFT 계산및 지수 및 가우시안 방정식의 피팅은 사용자 지정 LabVIEW 코드를 사용하여 수행되었습니다.
5. 형광 데이터 처리
- 각 창에서 창에 의존하는 자동 형광을 빼고 340 nm 및 380 nm 흥분 파장과 관련된 신호의 지수를 계산합니다.
6. OCT 이미징 데이터 처리
- 세분화를 위해 OCT 이미지 세트를 준비합니다.
- ImageJ를 열고 이미지를가져옵니다(파일 > 이미지 시퀀스를 > 가져오기). 파일 탐색기 창에서 이 창이 열리고, 이미지를 찾고, 하나를 선택하고, 열립니다.
참고: OCT의 제어 코드가 ImageJ에서 읽을 수 있는 형식으로 이미지를 저장하지 않는 경우 PNG로 변환합니다. - 시각화를 용이하게 하려면 이미지 시퀀스를 하이퍼스택(이미지> 하이퍼스택에서 하이퍼스택으로 스택으로 >)으로 구성합니다. 열리는 대화 상자에서 슬라이스 수를 슬라이스당 B 스캔 수와 x로 트래베큘라 길이를 따라 슬라이스 수로 설정합니다.
- trabecula를 둘러싸는 사각형을 그립니다. 하이퍼 스택 창의 슬라이더를 사용하여 시간 동안 전체 볼륨을 둘러싸는지 확인합니다. 이미지를 창으로 자르기(이미지> 자르기).
- 장착 후크의 이미지가 포함된 슬라이스를제거합니다(> 도구 > > 조각 키퍼). trabecula 정보만 포함된 슬라이스 범위를 선택합니다.
- ImageJ를 열고 이미지를가져옵니다(파일 > 이미지 시퀀스를 > 가져오기). 파일 탐색기 창에서 이 창이 열리고, 이미지를 찾고, 하나를 선택하고, 열립니다.
- WEKA 세분화를 교육합니다.
- 오픈 WEKA 세분화(플러그인 > 세분화 > 기차 웨카 세분화).
- 선택 모드를 프리핸드로 설정합니다.
- 설정을 클릭하고 분류기 및 교육 설정을 조정합니다. (이 모델의 경우 가우시안 블러, 소벨 필터, 헤시안, 가우시안의 차이, 멤브레인 프로젝션, 양자 간 및 Lipschitz : 이 모델의 경우 다음과 같은 교육 기능이 사용되었습니다. 멤브레인 두께는 1, 멤브레인 패치 크기를 8로, 최소 시그마에서 1로, 최대 시그마는 32로 설정하였다. 분류기는 FastRandomForest로 설정되었으며 분류자 옵션은 batchSize 100, 최대 깊이에서 32로, numFeatures에서 32로, numThreads에서 0으로, numTrees를 200으로 설정했습니다.
- 교육이 만족스러운 세분화될 때까지 이미지를 수동으로 세분화합니다.
- 분류기 저장합니다.
- 처리된 B 스캔 세그먼트
- 6.2.1 단계에 이어 WEKA 세분화를 시작합니다.
- 6.2.5 단계에서 분류원을 로드합니다.
- 결과 만들기를클릭합니다.
- 이미지를 8비트(이미지> 유형 > 8비트)로 변환합니다.
- 이미지를 바이너리로 변환합니다(프로세스> 바이너리 > 기본 메서드 및 기본 배경을 > 바이너리 만들기).
- 이미지 시퀀스(PNG)로 저장합니다.
- 분할된 B-스캔 이미지에서 평균 CSA를 계산합니다.
- 이진 B 스캔 이미지에서 흰색 픽셀 수를 계산합니다.
- 보정된 깊이 해상도(1.2단계에서) 및 10 μm(인접한 A-scans 사이의 거리)에 의해 픽셀 영역을 곱합니다.
- 후크 사이의 모든 B 스캔과 평균 측정값에 대해 반복합니다.
- 분할된 이미지를 메시로 변환합니다.
- "OCTmain.m"(요청 시 사용 가능)을 열고 6.3.6 단계의 출력을 포함하는 폴더에 이미지를 설정합니다. 필요에 따라 출력경로를 설정합니다.
- 슬라이스를 "Range Y(step)"(단계 3.5.5) 값으로 설정하고 프레임은 "반복 X"(3.5.6단계), 깊이 해상도(1.2.10단계)에 z_dim, x_dim 및 y_dim 10에 할당된 값으로 설정합니다.
- 실행 실행을클릭합니다.
결과
여기에 제시 된 trabecula의 전체 길이에 대한 지역 Ca2 + 및 밝은 필드 정보를 캡처하기 위해, 일곱 근육 위치가 필요했다. 그림 6은 트위치 힘이 이 동작에 방해받지 않았다는 것을 시사하며, 액티브 포스 생산에 대한 위치 의존도가 없음을 드러낸다.
100Hz의 속도로 광학 일관성 단층 촬영을 사용하여 수집된 B스캔은 ImageJ 플러그인 WEKA14(도 7A)를이용하여 분할하였다. 각 단면은 측면(10 μm)과 깊이(1.73 μm(심근)의 해상도 의 차이로 인해 왜곡된 것으로 나타납니다. 이 왜곡은 측면 해상도 깊이 해상도 비율로 이미지의 깊이 축을 배율 조정하여 수정되었습니다. 도 7B,C는 트라베큘라의 원시 C 스캔을 스케일링한 후 기하학에서 대략 원통형임을 보여준다. 측정 챔버 벽의 반사는 때때로 근육 데이터(도 7A,B)와겹칠 수 있지만 세분화 소프트웨어는 이를 고려하여 훈련 될 수 있습니다(그림 7D,E). 일단 분할되면, 근육의 길이를 따라 단면 영역은 트위치(도7F)를통해 계산될 수 있다. 이 특정 trabecula는 그것에서 분기 작은 부속기를 가지고 있습니다. 분기의 움직임은 trabecula를 따라 ~ 0.75 mm분명합니다. 마지막으로, 분할된 이미지는 기하학적모델(그림 7G)의생성을 돕기 위해 메스로 변환될 수 있다.
각각의 상이한 trabecula 위치에서 캡처된 이미징 데이터는 100fps의 속도로 함께 꿰매어 trabecula(그림8A)의단일 완전한 이미지를 생성하였다. 이러한 이미지의 해상도는 0.535 μm/픽셀입니다. 인접한 창의 겹치는 영역에서 선형 가중치 함수를 사용하면 시각화를 지원하고 밝은 필드 이미지에 있는 비네팅의 영향을 최소화합니다. 형광 신호를 측정하기 위해, 트라베큘라의 540 μm 바이 540 μm 창은 600Hz의 속도로 340 nm, 365 nm 및 380 nm 파장 빛으로 순환 조명된다. 340nm 및 380 nm 흥분광과 관련된 방출형광의 비율은 트라베큘라가 후 세포내 칼슘과 상관관계가 있다. 이 측정값은 비율이기 때문에 유효 측정 속도는 200Hz입니다. 각 창에서평균(n =10) 세포내 Ca2+ 과도는 이미지된 영역과 정렬됩니다(그림8B). 과도의 피크가 합리적으로 일관되게 보이지만, 확장기 [Ca2+]는트라베큘라를 따라 900 μm과 1800 μm 사이의 영역 내에서 낮습니다. 유사하게, 변위 추적(도8C)및 사코프레길이(도 8D)계산의 결과는 또한 지역 적 변동성의 존재를 나타낸다. 사용되는 마커리스 추적 기법은 충분한 콘트라스트를 감안할 때 각 픽셀의 변위를 처리할 수 있습니다. 포스트에서 사컴 길이의 분포를 매핑할 때 128픽셀의 상관관계 영역을 128픽셀(~67 μm x 67 μm)으로 사용하여 지역 사카머 길이를 계산하였다. 이 지역은 시료를 닫을 때 약 29 개의 사혜성을 캡슐화하여 최적의 사카필 길이에 가깝습니다. 각 상관 관계 창의 중심 사이의 단계 크기(x 및 y-방향모두)는 이러한 데이터를 처리하기 위해 50픽셀(~26 μm)으로 설정되었습니다. 사메레 길이 추정치의 적합성은 FFT 신호에 맞는 가우시안의 폭과 진폭에 기초하여 테스트되었습니다. 이러한 조건은 0 μm에서 500 μm 사이의 근육 영역에서 충족되지 않았기 때문에 sarcomere 길이 정보를 계산할 수 없었습니다. 관련 변위를 감안할 때, 수축 단계에서 이 지역의 사코메레스가 길어질 가능성이 높습니다. 이 추측에 따라, 그 기간 동안 trabecula 단축의 오른쪽에 평균 sarcomere 길이. 각 패널에서 제공하는 정보를 결합하여 가장 큰 단면 영역이 있는 영역이 가장 중요한 힘을 생성하지 않는 것으로 보입니다. Ca2+ 과도의 지역 적 변화가 대략 매끄러운 그라데이션을 가지고 있다는 가정하에, 도 8B는 가장 큰 진폭 Ca2+ 과도가 트라베큘라를 따라 1300 μm과 1600 μm 사이 어딘가에 발생함을 나타냅니다. 변위 맵은 최소 모션을 받는 영역이 피크 Ca2+ 과도와 잘 정렬된다는 것을 나타냅니다. 그러나 이 영역은 샘플의 가장 작은 단면 영역을 가지고 있습니다. 이러한 데이터를 염두에 두고 이 지역이 가장 스트레스를 많이 발생했다고 추론할 수 있습니다.

그림 1: 심근계의 부가 된 이미지. 각 주요 광학 부품이 설명되어 있습니다. 인셋에는 측정 챔버 아래, 그 자리에서현미경 목표의 클로즈업, 후방 보기가 포함되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
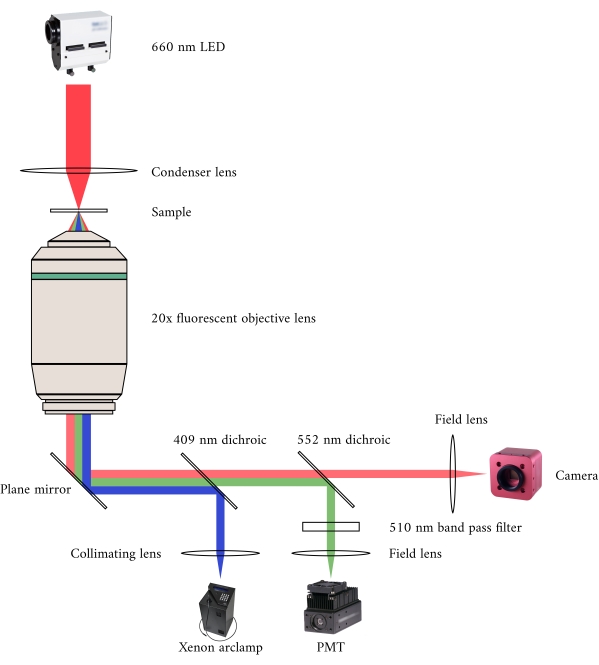
그림 2: 동시 밝은 필드 및 형광 현미경 검사를위한 광학 경로. 형광 현미경의 조명 소스는 340 nm, 365 nm 및 380 nm 빛 사이 순환 전환하는 제논 아크 램프입니다. 아크 램프 출력 경로에는 빛을 형광 현미경 목표로 유도하는 거울에 UV 빛을 반사하는 409 nm의 컷오프 파장이 있는 이색 거울이 포함되어 있습니다. 렌즈는 샘플에 흥분 빛을 초점을 맞추고 510 nm의 긴 파장을 가지고 방출 된 빛을 수집합니다. 이 방출된 광은 552nm의 컷오프 파장을 가지고 있기 때문에 첫 번째 이색 거울을 통과하지만 두 번째는 통과하지 않습니다. 필드 렌즈는 반사된 빛을 PMT 센서에 집중합니다. 한편, 밝은 필드 현미경에 대한 조명 소스 (660 nm LED)는 샘플 위에 위치한다. 전송된 빛은 응축기 렌즈에 의해 샘플에 초점을 맞추고, 20× 형광 목적은 결과 전송 영상을 캡처합니다. 밝은 필드 조명에 사용되는 파장은 각 이색 거울의 컷 오프 파장을 초과하므로 이미지가 CMOS 카메라의 센서에 집중되기 전에 두 가지 를 모두 통과합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
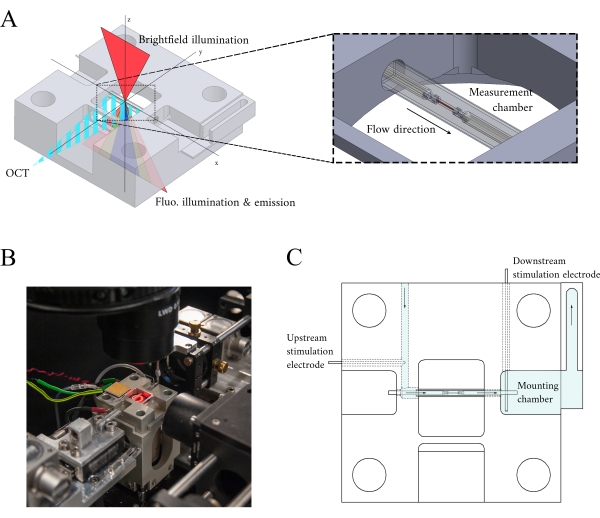
도 3: 측정 챔버 홀더 설계. (A)광학 경로가 겹쳐진 측정 챔버 홀더의 이소메트릭 뷰. 브라이트필드 조명은 우수한 표면(z-축)에서 발생합니다. 형광 조명은 열등한 표면(z-축)에서발생하며, 측정 암 OCT 신호는 다른 조명 축(y-축)에직교이다. 실험 중, 두 개의 백금 후크는 측정 챔버로 작동하는 유리 모세관 튜브 내에서 trabecula를 보유합니다. 음성 코일 모터는 각 후크를 제어하며 그 위치는 레이저 간섭을 사용하여 측정됩니다. 현재 위치는 사용자 정의 집합 점과 비교되며 FPGA 내에서 인코딩된 PID 컨트롤러를 사용하여 오류를 최소화합니다. (B)밝은 필드 조명이 켜진 현장에서 측정 챔버. 백뷰는 그림 1 인셋에표시됩니다. (C)측정 챔버 홀더를 통해 슈퍼퍼자스 플로우의 회로도. 슈퍼퍼자이스는 블록의 후면으로 들어가 화살표로 표시된 방향으로 흐른다. 상류 및 하류 전극은 측정 챔버에서 장착된 trabecula의 수축을 유도하기 위한 필드 자극을 확립합니다. 파란색 차도는 실험 중에 중첩이 흐르는 영역을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
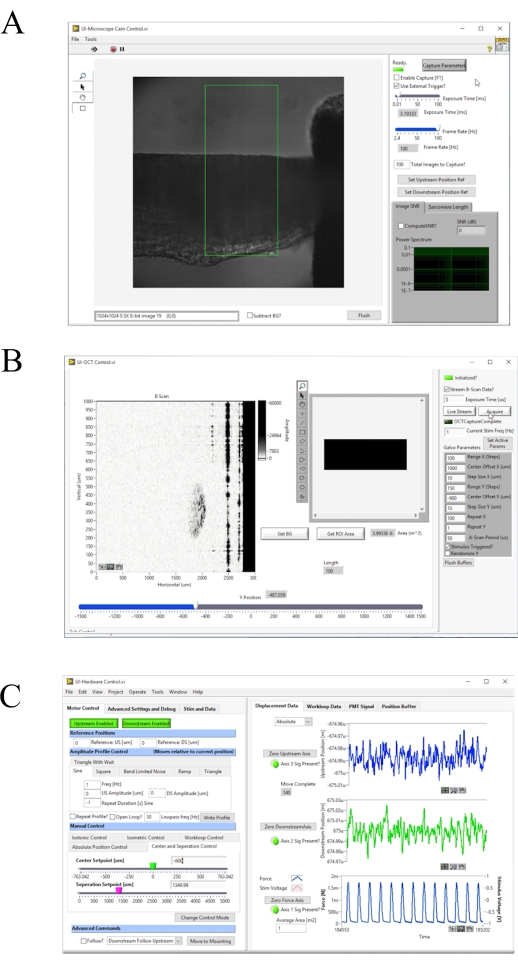
그림 4: 이미지 수집 및 제어 소프트웨어의 전면 패널. (A)브라이트필드 이미징 사용자 인터페이스. (B)OCT 이미징 사용자 인터페이스. (C)하드웨어 제어 사용자 인터페이스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
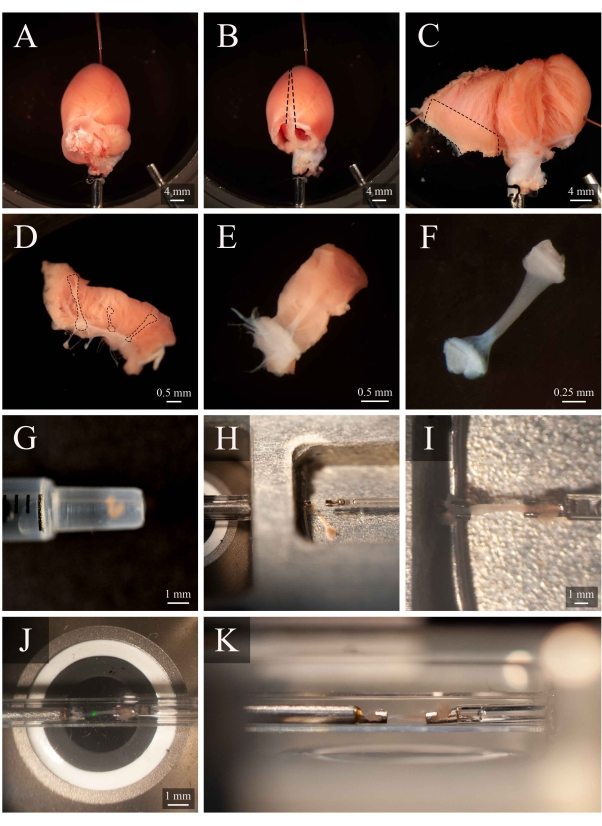
그림 5: Trabecula 해부 및 장착 프로토콜. (A)하벤도르프 -perfused 쥐 심장해부 챔버. (B) 아리아와 같은 심장이 제거됩니다. 대선은 심실을 여는 절제 궤적을 나타냅니다. (C)두 심실의 내부를 노출하는 열린 심장. 파선 된 상자는 trabeculae가 일반적으로 발견되는 영역을 나타냅니다. (D)절제된 오른쪽 심실 벽 영역(C의 대시 박스에 의해 표시된 것과 동일). 대시 라인은 세 개의 trabeculae을 강조합니다. (E)벽 조직 제거패널 E로부터 의3개 중에서 선택된 트라베큘라. (G)1 mL 주사기의 끝에 있는 분리된 trabecula. (H)장착 챔버내의 트라베큘라. (I)두 개의 백금 후크 사이에 장착된 트라베큘라. (J)측정 챔버 내에서 후크 사이에 장착된 trabecula(도3B). 녹색 반점은 첫 번째 이색 필터의 유물입니다. (K)측정 챔버 내에서 장착 된 trabecula의 이차 각도. trabecula와 현미경 목표 렌즈 사이의 거리는 약 1mm입니다.
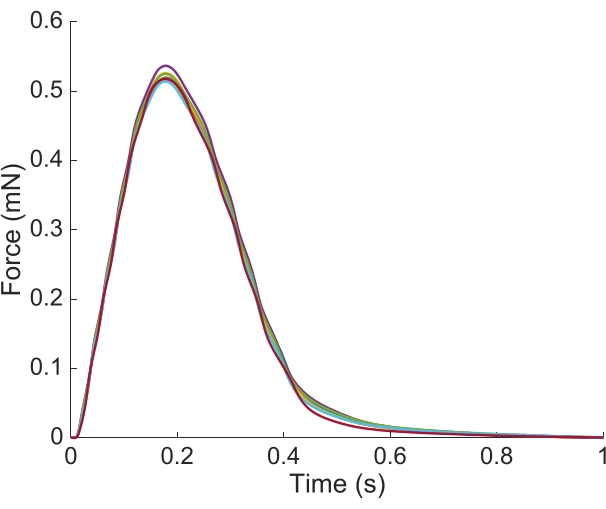
그림 6: 힘 측정의 위치 의존도. 각 이미징 위치에서 근육에 의해 생성된힘(n =7)이 겹쳐져 있다. 평균 활성력 생산은 0.527mN ± 0.003mN, 시간 50% 수축 77.1 ms ± 0.3ms, 그리고 시간 50% 릴렉스 328.1 ms ± 0.9 ms (모든 데이터는 평균 ± SE로 제시된다). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
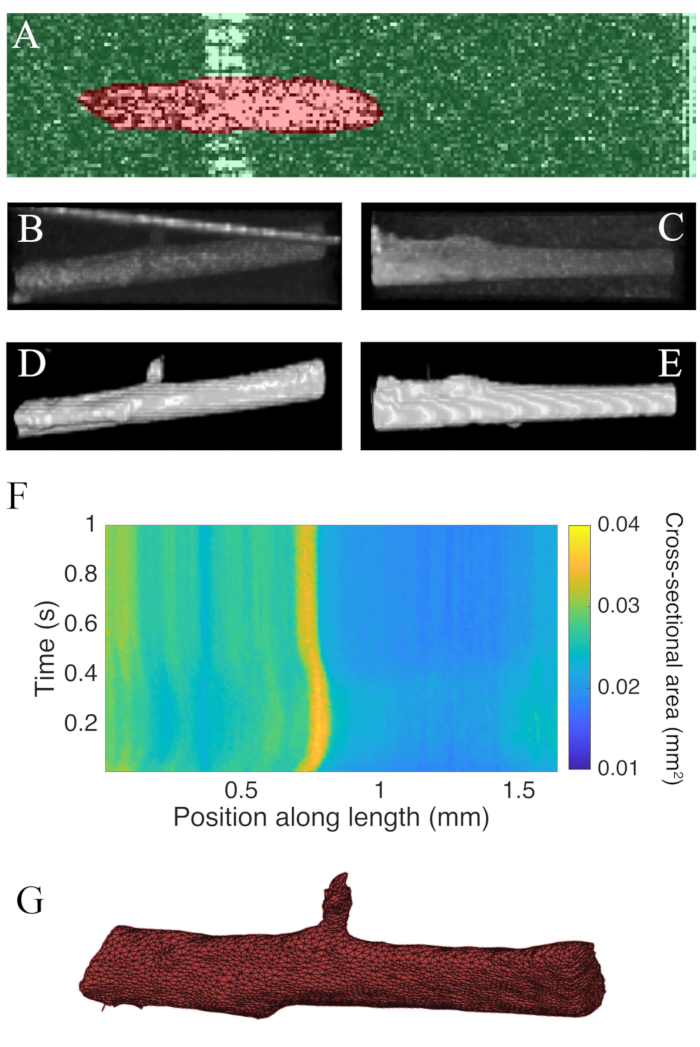
그림 7: OCT 이미징 분석. (a)WEKA 세분화의 예. 근육의 분할 된 단면은 빨간색으로 강조 표시되고 배경이 녹색으로 강조 표시됩니다. (B)trabecula의 원시 C 스캔 데이터의 우수한 보기. 이미지 의 상단을 향한 밝은 각진 선은 측정 챔버 벽의 반사입니다. (C)trabecula의 원시 C 스캔 데이터의 측면 보기. (D)분할된 OCT 데이터의 우수한 보기. (E)분할된 OCT 데이터의 측면 보기. (F)트라베큘라(x-축)의 길이를 따라시간(y축)을따라 단면 면적. 근육 길이를 따라 평균 단면 영역은 0.0326 mm2 ± 0.0005 mm2 (평균 ± S.E.) (G)트라베큘라의 메쉬. 메쉬는 패널 F의 단면 영역 플롯과 대략 정렬되어 있습니다.
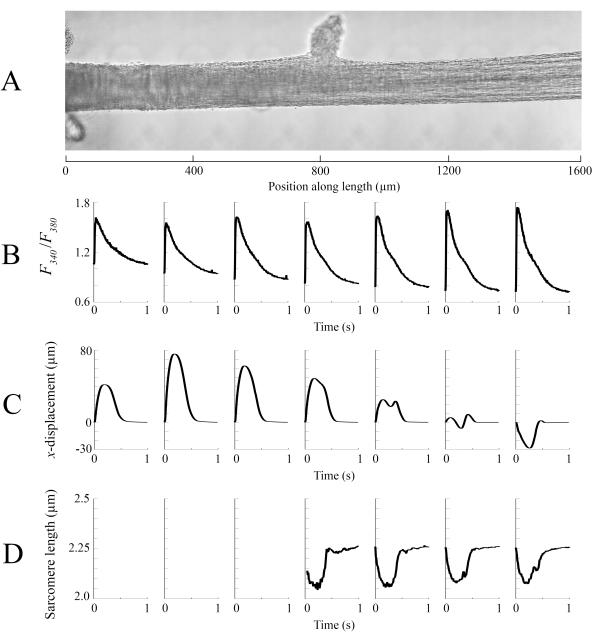
그림 8: 브라이트필드 및 형광 이미징 분석. (A)트라베큘라의 스티치 이미지(7개의 이미징 창). (B)trabecula의 길이를 따라 Ca2+ 과도. (C)각 이미징 창에서 평균 x-변위. 양수 변위는 오른쪽으로 의 움직임과 왼쪽에 음수를 나타냅니다. (D)필요한 이미지 대비를 가진 각 이미징 창에서 평균 사컴 길이. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 솔루션 테이블은 여기를 클릭하여 이 표를 다운로드하십시오.
토론
본 연구에서는, 브라이트필드, 형광, OCT 이미징을 결합한 3개의 광학 시스템의 조립이 능동적으로 수축된 전 생체 내 심장 트라베큘라(도1 및 도 2)로부터데이터를 수집할 수 있는 구성을 제시한다. 이러한 오케스트레이션된 통합은 10월의 직교 배열을 능장 형광축으로 가능하게 하기 때문에 측정챔버(도 3)의설계로 인해 가능하다. 근육 장착 시스템은 심장 근육 흥분 수축 역학을 특성화하는 주요 지수의 동시 정량화의 성공에 동등하게 중요한 역할을한다. 그 참신은 근육의 기계적 성능에 명백한 방해없이 근육 스캐닝 절차를 가능하게에 상주(그림 6). 힘 측정을 위한 이미징 구성 및 동력 후크 시스템을 결합한 이 시스템은 Twitch의 시간 과정 전반에 걸쳐 수축 trabecula의 거시적 기하학적 정보와 함께 Ca2+ 과도, 변위 및 사코메르 길이의 지역 이질성을 평가할 수있습니다(그림 7 및 도 8).
심장 연구 실험실 내의 밝은 필드 과민성 이미징 시스템의 보편성을 감안할 때, 이러한 결과의 재생은 몇 가지 사소한 하드웨어 고려 사항으로 달성 될 수있다. 여기서는 기본 수축 이질성을 분석하는 데 필수적인 브라이트필드-에피플루오시스와 OCT를 결합하기 위한 이미지 처리 툴킷을 소개합니다. OCT의 통합은 방해받지 않는 광학 경로를 필요로 하며, 게이트 이미징은 자극과 OCT 및 브라이트필드 이미징 카메라, 측정 챔버 전체에서 시료를 이동할 수 있는 근육 장착 후크 사이의 외부 트리거 라인을 필요로 합니다. 필요한 후처리 소프트웨어 및 방법을 자유롭게 사용할 수 있습니다. 특히, 사용되는 세분화 소프트웨어, WEKA14,오픈 소스입니다. 재료 점8,사코메 길이, 게이트 볼륨이미징(10)및 메쉬 생성 코드의 마커리스 추적 기술은 마찬가지로 접근 가능하며 해당 저자의 요청에 따라 사용할 수 있습니다.
근육 생존가능성, 후라-2의 최적의 로딩, 이미지 포커스는 성공적인 실험의 기초를 형성하는 세 가지 기둥입니다. BDM을 함유한 해부 용액을 사용하여 수축, 주사기에서 근육 의 수송, 용액의 지속적인 산소화, 실험 당일에 새로운 실험 용액을 준비하는 등 모두 높은 근육 생존율에 기여한다. 후라-2AM으로 trabecula를 로드하기 전에, 자동 불발은 측정 된 Ca2 + 과도15에상당한 영향을 미칠 수 있으므로 공부에 관심이각 조건에 대해 수집해야합니다. 후라-2AM 로딩 용하액의 산소화는 염료 하중을 돕기 위해 계면활성제 황색-F127을 필요에 포함시킴으로써 복잡하다. 이러한 계면활성제에 의한 과도한 버블 형성에 대처하기 위해, 로딩 용액에서 약간의 항폼 방울을 통해 사용자는 산소화 속도를 증가시킬 수 있으므로, 이로써 trabecula가 로딩 공정 전반에 걸쳐 기능적 생존력을 유지할 가능성을 향상시킵니다. 마지막으로, 이미징 포커스는 밝은 필드 및 형광 정보의 소음 비율에 대한 신호를 최대화하기 위해 근육 길이를 따라 균일해야합니다.
여기에 제시된 방법을 고려해야 할 두 가지 제한 사항이 있습니다. 첫째는 형광 현미경의 공간 해상도입니다. OCT 및 브라이트필드 이미징의 공간 해상도는 높지만 형광 현미경의 해상도는 540 μm 내에 포획된 부피로부터 형광의 일체로 제한되며 540 μm x 540 μm 이미징 창. PMT 대신 고이득 충전 결합 장치 카메라를 사용하여 형광 현미경의 공간 해상도를 증가시켜 신호 대 잡음비(16)를희생하여 형광 신호를 캡처할 수 있는 범위가 있다. 두 번째는 측정 가능한 sarcomere 길이와 기하학적 깊이의 관점에서 연구 할 수있는 trabecula의 직경입니다. sarcomere 길이를 계산하기 위한 창-FFT 접근 방식은 향상된 공간 해상도의 이점을 활용하지만 향상된 견고성(그림8D)과관련이 있습니다. 혼탁또는 직경이 큰 trabeculae를 연구해야 하는 경우, 더 큰 조직 샘플에서 육종 밴딩과 관련된 감소된 대비로 인해 FFT의 재발성이 크게 감소될 것이다. 마찬가지로, 10월 내에서 300μm 이상의 이미징 깊이에서 반사가 너무 약하여 세분화 단계에서 해결될 수 있습니다. 따라서, 우리의 기술은 300 μm 미만 직경의 trabeculae로 제한됩니다. 그러나, 자극의 높은 속도 동안 근육 코어의 확산 산소화에 문제가있을 수 있으므로 큰 직경 샘플을 연구하는 것이 좋습니다17.
우리의 방법은 건강하고 병들인 근육에 있는 근육 기하학과 관련있는 이온 기계 기능의 평가를 가능하게 합니다, 심장 근육 생리학, 병리생리학 및 약리학을 이해하는 강력한 접근을 제공하는. 여기에 설명된 이미지 처리 파이프라인은 수축 이질성에 대한 심층적인 이해를 얻는 데 중추적인 데이터가 추출됩니다. 이러한 풍부한 데이터 집합의 잠재력을 완전히 실현하는 한 가지 방법은 이러한 데이터를 통합하고 해석하는 수학적 모델을 구성하고 장치를 사용하여 실험적으로 테스트할 수 있는 예측을 하는 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 뉴질랜드 건강 연구 위원회에서 오클랜드 대학 (JD 및 MC에게 수여), 경 찰스 헤커스 건강 연구 펠로우십 (20/011 및 21/116)에서 박사 장학금에 의해 투자되었다 (KT에 J-CH에 수여, 각각 국립심장재단(AA 수여) 박사장학금, 뉴질랜드 왕립학회(J-CH, KT에 수여) 마스덴 패스트스타트 보조금(UOA1504, UOA1703) 각각) 뉴질랜드 왕립 학회에서 제임스 쿡 연구 펠로우십 (AT에 수여). 이 악기의 원래 개발은 뉴질랜드 왕립 학회 (AT와 PN에 수여)에서 마스덴 보조금 (11-UOA-199)에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
참고문헌
- Han, J. -C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250(2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398(2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유