Method Article
Brightfield simultâneo, Fluorescência e Imagem Tomográfica de Coerência Óptica de Contrair Trabeculae Cardíaca Ex Vivo
Neste Artigo
Resumo
Este protocolo apresenta uma coleção de dados geométricos sarcomere, cálcio e macroscópico de uma trabecula cardíaca ex vivo. Essas medidas simultâneas são possíveis pela integração de três modalidades de imagem.
Resumo
No músculo cardíaco, transitórios intracelulares Ca2+ ativam miofilamentos contratuais, causando contração, encurtamento macroscópico e deformação geométrica. Nossa compreensão das relações internas entre esses eventos tem sido limitada porque não podemos nem "ver" dentro do músculo nem acompanhar precisamente a natureza esposte-temporal da dinâmica excitação-contração. Para resolver esses problemas, construímos um dispositivo que combina um conjunto de modalidades de imagem. Especificamente, ele integra um microscópio de campo brilhante para medir mudanças locais de comprimento de sarcomere e tensão tecidual, um microscópio de fluorescência para visualizar o transitório Ca2+ e um tomógrafo óptico de coerência para capturar as mudanças geométricas do tecido ao longo do tempo de um ciclo cardíaco. Apresentamos aqui a infraestrutura de imagem e a estrutura de coleta de dados associada. Os dados são coletados de estruturas de tecidos isoladas semelhantes a varas conhecidas como trabeculae carneae. Em nosso instrumento, um par de ganchos de platina controlados por posição seguram cada extremidade de uma amostra muscular ex vivo enquanto é continuamente superfusada com solução salina rica em nutrientes. Os ganchos estão sob controle independente, permitindo o controle em tempo real do comprimento e força muscular. A tradução longa permite a digitalização fragmentada da amostra, superando limitações associadas ao tamanho relativo da janela de imagem do microscópio (540 μm por 540 μm) e o comprimento de uma trabecula típica (>2000 μm). Eletrodos de platina em cada extremidade da câmara muscular estimulam a trabecula a uma taxa definida pelo usuário. Exploramos o sinal de estimulação como um gatilho para sincronizar os dados de cada janela de imagem para reconstruir toda a amostra contraindo em condições de estado estável. A aplicação de técnicas de processamento de imagens nesses dados de imagem de campo brilhante fornece mapas de deslocamento de tecido e comprimento sarcomere. Tal coleta de dados, quando incorporada em um pipeline de modelagem de experimentos, fornecerá uma compreensão mais profunda da homogeneidade contratil muscular e heterogeneidade na fisiologia e fisiopatologia.
Introdução
A superfusão de preparações isoladas de tecido muscular cardíaco é um protocolo padrão e amplamente utilizado para o estudo da ativação cardíaca iônica e da mecânica1. Em particular, o isolamento das estruturas trabeculas, semelhantes a varas das paredes ventriculares, permitiu a avaliação de fenômenos incluindo a ativação dependente de comprimento da contração2,resposta de estiramento dependente da contração3,4, e viscoelasticidade diastólica5 do tecido cardíaco. Ter Keurs, o iniciador desta técnica de superfusing trabeculae isolada, inicialmente usou uma combinação de imagens de fluorescência para medidas ca2+ e difração a laser para determinar comprimentos de sarcomere2,5. Desde esses primeiros estudos, tornou-se cada vez mais comum extrair informações de comprimento de sarcomere com uma maior resolução espacial usando técnicas baseadas em transformação 2D fast Fourier (FFT)6 em imagens de microscopia de campo brilhante. Os dois sistemas de imagem permitem uma avaliação parcial da relação subjacente entre a liberação de Ca2+ e a produção de força dependente de comprimento de sarcomere.
O músculo cardíaco é estriado, com a faixa visível associada a uma série subjacente de unidades contratuais consistindo de filamentos espessos e grossos. A interação desses filamentos constituintes que compõem sarcomeres está por trás da geração de força, que começa da seguinte forma: um sinal elétrico despolarizador, ou potencial de ação, faz com que canais L-tipo Ca2+ dependentes de tensão na membrana celular se abram; o fluxo celular resultante do Ca2+ induz a liberação de Ca2+ do reticulum sarcoplasmático (SR), uma loja intracelular Ca2+, em um processo conhecido como Ca2+-induzido ca2+ versão7; esse aumento repentino na concentração intracelular de Ca2+ de nanomolar para micromolar permite que a produção de força ocorra; As bombas Ca2+ extrudam continuamente o Ca2+ do citosol de volta para o compartimento de RS e extracelular; quando a concentração intracelular ca2+ retorna à faixa de nanomolar, a produção de força cessa e o músculo relaxa. Durante a produção de força, os filamentos grossos e finos do constituinte deslizam um sobre o outro. O comprimento do sarcomere dita a extensão relativa da sobreposição e, portanto, o potencial de produção de força do músculo macroscopicamente.
Neste artigo, estendemos essas técnicas de imagem fluorescência-brightfield para incluir a tomografia óptica de coerência (OCT). O OCT utiliza o princípio físico da interferência e é capaz de obter a deformação geométrica do tecido para entender a heterogeneidade contraíxica muscular8. Nosso dispositivo (Figura 1) usa um sistema oct de domínio espectral (SD-OCT). Em SD-OCT, um divisor de feixe divide a luz de um diodo superluminescente de curto comprimento de banda larga em braços de referência e medição. O braço de referência contém um espelho fixo, e o braço de medição contém um galvanômetro 2D para guiar a luz. A luz requescattered da amostra é coletada e interfere com a luz refletida no braço de referência para formar um padrão de interferência. As informações de profundidade são codificadas na frequência da franja espectral. Para extrair as informações, o sinal é passado através de um espectrômetro e um FFT inverso é aplicado ao resultado. O sinal 1D correspondente representa as estruturas em diferentes profundidades, correspondendo a alterações no índice de refração9 (A-scan). Ao direcionar o laser em um único eixo, pode-se construir uma seção transversal da amostra de interesse (B-scan) e, da mesma forma, repetindo o processo em um padrão passo-sábio no eixo restante, uma imagem tridimensional pode ser gerada (C-scan). Por extensão, pode-se coletar uma série de varreduras B em uma única fatia para um assunto repetitivo de tempo variando com base em um gatilho externo e repetir para gerar uma varredura tridimensional, representando uma imagem planar de variação de tempo10.
Ao integrar os três sistemas de imagem, consideramos os dois princípios seguintes. Primeiro, os sensores de imagem não devem detectar luz de uma modalidade alternativa de imagem, e segundo, o design físico deve conter espaço livre para pelo menos três planos de imagem simultâneas. Para atender ao primeiro requisito, o microscópio brightfield usa um LED de comprimento de onda de 660 nm para iluminar a amostra em uma configuração invertida. O microscópio de fluorescência está em uma configuração de epifluorescência onde a mesma lente objetiva é usada tanto para excitação quanto para coleta da luz emitida. A luz de excitação tem um comprimento de onda entre 340 nm e 380 nm, e um tubo fotomultiplier (PMT) mede a luz emitida em um comprimento de onda de 510 nm. Um par de espelhos dicroicos permitem que esses dois caminhos ópticos compartilhem a mesma pegada física sem interferir na medição oposta(Figura 2). Finalmente, o OCT usa luz de banda larga (100 nm de largura espectral) com um comprimento de onda central de 840 nm, distinto das outras duas modalidades. Devido à natureza de baixa coerência da luz usada para OCT, qualquer luz dispersa das fontes de fluorescência de campo brilhante não contribuirá para o padrão de interferência que codifica informações de profundidade. Para o segundo requisito, o projeto de habitação para o tubo capilar possui vias ópticas acessíveis para os planos anterior, inferior e superior da amostra. Durante os experimentos, dois ganchos de platina seguram uma trabecula dentro de um tubo capilar perfumado com solução krebs-henseleit oxigenada (KH). O chefe galvanômetro do OCT é orientado ortogonalmente para a via de imagem brightfield-fluorescence para aproveitar o terceiro plano óptico ortogonal(Figura 3).
Este artigo descreve as considerações de design para a construção de um dispositivo capaz de imagem simultânea de cálcio, comprimento de sarcomere e geometria muscular. Para demonstrar essas capacidades de medição, descrevemos o processo de isolamento de uma trabecula ventricular, a preparação das soluções tampão necessárias, juntamente com as etapas críticas envolvidas no manuseio e carregamento de fluorescência de um ex vivo trabecula. Finalmente, este artigo descreve os processos necessários para traduzir o conjunto de dados em visualizações mais úteis.
Protocolo
O Comitê de Ética Animal da Universidade de Auckland aprovou o manuseio de ratos e a preparação de amostras de tecido.
1. Calibração de imagem
- Calibração de pixels de microscópio brightfield
- Encha a câmara de medição com água destilada.
- Coloque uma grade de difração com linhas conhecidas por μm na câmara de medição.
- Pressione F1 para habilitar a captura e ajustar a Taxa de Quadros [Hz] até que a grade de difração esteja claramente visível(Figura 4A). Certifique-se de que a grade de difração funcione paralelamente à borda do quadro. Pressione a F1 novamente para parar a captura.
- Defina as imagens totais para capturar? para uma, pressione Ctrl + Shift + S para transmitir dados para disco e pressione F1 para capturar uma imagem da grade de difração.
- Abra imageJ e importe a imagem de grade de difração(Arquivo > Abra > Selecione a imagem de calibração). Segurando o turno, desenhe uma linha que engloba 20 faixas claras e escuras da grade de difração.
- Calibrar a imagem(Analisar > escala de conjunto). O comprimento da linha da Etapa 1.1.5 define o valor distância em Pixels. Defina o valor de distância conhecida para 20 vezes a medição de μm e a unidade de comprimento para μm. O inverso da escala é o número de micrômetros representados por um pixel.
- Calibração da resolução de profundidade de OUTUBRO
- Meça a espessura de um slide de microscópio de vidro usando pinças Vernier.
- Ligue a fonte de laser OCT.
- Cubra a cabeça do galvanômetro e clique em Obter BG para medir o padrão de interferência de fundo e subtrai-lo da medição ( Figura4B).
- Fixar o slide do microscópio de vidro medido (a partir da etapa 1.2.1) no braço de medição do OCT.
- Clique em Transmissão ao vivo para ver a imagem OCT. Ajuste o slide do microscópio de vidro até que esteja visível dentro da varredura B.
- Para capturar a imagem de varredura B, defina Range Y (Steps) em um, clique em Dados de varredura do fluxo B?e clique em Adquirir.
- Importe a imagem de varredura B em ImageJ (Arquivo > Abra > Selecione B-scan). Segurando o turno, desenhe uma linha entre os limites do deslizamento do microscópio de vidro.
- Defina a escala (Analisar > escala de conjunto). Definir distância conhecida à medição coletada na Etapa 1.2.1.
- Para calcular a resolução de profundidade no ar, corrija para o índice de refração do slide do microscópio (nvidro = 1,5175)11 multiplicando a medição por pixel de valor por nvidro.
NOTA: O n vidro citado é para vidro borossilicato. Slides de microscópio podem ser feitos a partir de diferentes materiais. Use o índice de refração adequado para o slide medido. - Para dimensionar a resolução de profundidade para miocárdio, divida o valor da Etapa 1.2.9. por nmiocárdio = 1,38 (valor relatado anteriormente12).
2. Preparação da amostra muscular
- Prepare a plataforma de dissecção.
- Despeje um pouco da solução de dissecção (delineada na Tabela 1) em uma tigela de metal pequena e coloque no congelador cerca de uma hora antes da excisão cardíaca.
- Configure uma plataforma de dissecção garantindo que a solução de dissecção seja bem oxigenada (100% oxigênio) e tenha sido lavada através de cada uma das linhas de tubulação. Encha a câmara de dissecção com solução de dissecção oxigenada e amarre 3/0 de sutura ao redor do cateter de perfusão.
- Extira o coração.
- Anestesiar 8-10 semanas de idade rato Wistar usando isoflurane gasoso (< 5% em oxigênio). Confirme a anestesia por beliscar a cauda.
- Posicione o rato anestesiado em posição supina e injete subcutâneamente na área abdominal com solução de heparina (1000 UI/kg). Mantenha a anestesia por mais cinco minutos para permitir que a heparina circule.
- Recupere a tigela de metal contendo solução de dissecção do congelador e coloque-a perto do banco de eutanásia.
NOTA: Evite congelar completamente a solução de dissecção para permitir a submersão completa do coração dissecado. - Transfira o rato anestesiado para o banco de eutanásia e eutanásia por deslocamento cervical.
- Abra o baú de rato com uma tesoura, primeiro cortando a parede do corpo ao longo da parte inferior da caixa torácica, depois o diafragma, antes de proceder ao longo das bordas laterais da caixa torácica. Levante o peito para fora do caminho.
- Pegue o coração com uma mão enquanto a outra mão usa um par de tesouras curvas para cortar os vasos de conexão (aorta, vena cava, etc.).
- Submerse rapidamente o coração na solução de dissecção a frio.
- Isolar uma trabecula.
- Identifique a aorta enquanto o coração está na tigela de metal, em seguida, transfira o coração para a câmara de dissecção. Usando duas fórceps curvas, puxe a aorta sobre a cânula de perfusão.
- Mantenha a aorta no lugar com um fórceps. Enquanto isso, abra a linha de tubos para permitir que a solução de dissecção flua através da cânula de perfusão.
NOTA: Mire em completar a perfusão no minuto seguinte à excisão cardíaca. - Uma vez que a vasculatura coronária é limpa de sangue e o coração é completamente perfundido com a solução de dissecção, parar o fluxo de perfusão, e proteger a aorta no lugar usando a sutura. Ligue o fluxo e perfunda o coração cânulado.
- Gire a cânula para que a artéria coronária esquerda seja visível na superfície superior. Fixar o ápice do coração no fundo da câmara de dissecção(Figura 5A). Corte ambas as atrias(Figura 5B).
- Com um conjunto de tesouras de mola, corte ao longo do lado direito do septo até o ápice do coração (como indicado na Figura 5B). Fixar o ventrículo esquerdo aberto na base da câmara de dissecção. Em seguida, corte ao longo do lado esquerdo do septo, abra o ventrículo direito e fixe-o na base da câmara de dissecção, também(Figura 5C).
NOTA: Para fixar os ventrículos em posição aberta, alguns músculos papilares terão que ser cortados. Identifique um trabecula de execução livre no ventrículo direito(Figura 5D-E). - Usando a tesoura de mola e um fórceps, corte o tecido da parede ao redor da trabecula, em seguida, corte o tecido da parede ao meio ortogonalmente até a direção da trabecula. Corte o tecido da parede até que sua dimensão seja apropriada para a configuração de montagem utilizada. Neste caso, aproximadamente metade do tamanho de uma semente de gergelim(Figura 5F).
NOTA: A trabecula pode ser dissecada a partir dos ventrículos direito e esquerdo, mas as da esquerda são tipicamente mais turvas e menos aplicáveis para medições de sarcomere e geometria. - Deixe o trabecula excizado na câmara de dissecção, continuamente superfusando com a solução de dissecção.
3. Protocolo experimental
NOTA: O dispositivo13 usado para este experimento foi construído internamente e usa código de controle personalizado. As considerações necessárias para o design de um dispositivo construído para replicar esses dados são dois ganchos de montagem acionados independentemente, uma câmara de medição com três eixos opticamente claros(Figura 3), e uma linha de gatilho externa que sincroniza as câmeras brightfield e OCT com o estimulador. A tensão pmt e o sinal de força foram coletados usando cartões DAQ analógicos, as imagens do oct e microscópio brightfield foram coletadas usando cartões de agarrador de quadros Camera Link, e o sinal de estímulo foi coletado usando um cartão de I/O digital. Os dados foram armazenados offline usando um conjunto de loops de consumo do produtor para manter o alinhamento temporal.
- Prepare o cardiomímetro.
- Lave água quente (~60 °C), água destilada (temperatura ambiente) e, em seguida, solução de superfusato através da câmara de medição. Bolha contínua a solução superfusada com carbogen.
- Ligue a fonte de iluminação do microscópio de campo brilhante e pressione F1 para habilitar a captura (Figura 4A). Ajuste manualmente o gancho a jusante até que esteja centrado na imagem de campo brilhante. Clique em Zero Downstream Axis, e depois Downstream Disabled para habilitar o motor ( Figura4C). Mova o controle deslizante DS Setpoint [um] até que o final do gancho se alinhe com a borda da região padrão de juros.
- Re-zero o eixo a jusante, em seguida, mova o slider DS Setpoint [um] para 1000. Repita o processo com o gancho upstream, mas não mova o controle deslizante do Setpoint [um] dos EUA.
- Clique em Mover para Montagem ( Figura4C).
- Inicie o sistema de iluminação de fluorescência rebocando o interruptor da lâmpada antes de ligar rapidamente os subsistemas do controlador, alternando o interruptor Principal.
NOTA: Algumas fontes de luz UV produzem grandes quantidades de ozônio. Se este for o caso, conecte um extrator de ozônio à saída da fonte de luz e certifique-se de que ele esteja funcionando antes de ligar a fonte de iluminação da fluorescência. - Mude o modo operacional para Turbo-Blanking pressionando o botão Mode no painel frontal, seguido por 2, depois 1. Pressione o botão On-line para permitir que o código de controle informe a operação.
- Monte o trabecula.
- Pausa o fluxo de superfusato através da câmara de medição. Encha a câmara de montagem com a solução de dissecção.
- Utilizando uma seringa de 1 mL, transporte o trabecula da câmara de dissecção para a câmara demontagem (Figura 5G).
- Para transferir o trabecula, coloque a seringa verticalmente e em contato com a superfície da solução da câmara de montagem. Permita que a trabecula desça na câmara de montagem através da gravidade(Figura 5H).
- Abaixe o nível de fluido na câmara de montagem para que esteja nivelado com a seção média dos ganchos.
- Ajuste a distância entre os ganchos para refletir o comprimento da trabecula movendo o controle deslizante DS Setpoint [um].
- Usando um microscópio para ajudar na visualização, segure levemente um dos pedaços do tecido final com fórceps e monte-o no gancho upstream. Monte o outro pedaço de tecido final no gancho a jusante(Figura 5I).
- Uma vez montado com segurança, mova o trabecula de volta para a câmara de medição(Figura 5J) pressionando Move to Chamber (Figura 4C). Retome o fluxo de superfusato e a extração de fluidos.
- Definir a frequência de estímulo [Hz] para 1, duração de estímulo [ms] a 10 e tensão de estímulo para 10. Iniciar a estimulação pressionando estímulos ligados?.
- Prepare o trabecula.
- Após cerca de 1h de aclimatação, diminua gradualmente a tensão de estímulo e a duração do estímulo em etapas de 1 V e 1 ms, respectivamente. Um conjunto típico de valores é 3 V e 3 ms.
- Ligue o sistema de iluminação brightfield. Pressione f1 e selecione uma região de interesse que inclua uma área estriada na interface do usuário. Clique em Compute SL? para calcular o comprimento médio de sarcomere na região destacada. Aumente o comprimento muscular até que o comprimento médio do sarcomere seja de 2,32 μm aumentando o controle deslizante de ponto de separação [um].
NOTA: Compute SL? usa um FFT 2D descrito no Passo 4.3. A região de interesse usada para calcular o comprimento médio de sarcomere é tipicamente de 100 μm a 150 μm quadrado. Portanto, à medida que o músculo se aproxima do comprimento ideal do sarcomere, 43 a 65 sarcomeres são usados para calcular o comprimento médio do sarcomere. - Mova o músculo ajustando o controle deslizante do Ponto de Ajuste Central [um] na guia " Controle de Centro eSeparação (Figura 4C) de modo que a borda do gancho a jusante seja apenas visível dentro da imagem de campo brilhante. Colete as informações de fluorescência para dez contrações.
- Aumente o valor do Ponto de Ponto central [um] em 200 e colete outros dez twitches de informações de fluorescência. Repita este processo até que a imagem brightfield contenha o gancho upstream. Colete o valor da janela final de informações de fluorescência.
- Retorne o trabecula para uma posição central definindo o valor do Ponto de Ajuste central para 0.
- Reduza a frequência de estímulo para 0,2 Hz e mude do superfusato KH para a solução de carregamento Fura-2 (detalhada na Tabela 1).
- Meça o sinal de fluorescência a cada 10 minutos clicando em Ativar fonte de fluorescência na guia Stim e Data. Visualize o sinal de fluorescência na guia sinal PMT.
- Após o sinal de 360 nm ter aumentado por um fator de 10 ou a duração do procedimento de carregamento tenha excedido 2h, retorne a frequência de estímulo para 1 Hz e mude de volta para a solução de superfusato KH.
- Verifique a medição da razão a cada 10 minutos até que a medição da razão se estabilize, momento em que a coleta de dados pode começar.
- Colete dados de imagens de campo brilhante e fluorescência.
- Retorne o músculo para a posição onde a borda do gancho a jusante está apenas presente dentro da imagem de campo brilhante. Comece a transmitir dados de hardware clicando em transmitir dados para disco na guia Stim e Data da interface do usuário de controle de hardware. Capture informações de fluorescência clicando em Ativar fonte de fluorescência.
- Na interface do usuário de imagem brightfield, defina o modo de captura como um gatilho externo, aumente a taxa de quadros para 100 Hz e defina o número de imagens para capturar para 100. Pressione Ctrl + Shift + S seguido de F1 para registrar os dados de imagem de brightfield para esta janela.
- Aumente o valor do Ponto de Ponto central [um] em 200 e repita o Passo 3.4.2. Continue com o protocolo de digitalização até que os dados de imagem foram coletados para a janela final da Etapa 3.3.4.
- Retorne o trabecula para uma posição central definindo o valor do Ponto de Ajuste central para 0.
- Coletar dados de imagem DE OUTUBRO.
- Ligue a fonte laser OCT girando a chave principal para o | símbolo, pressionando o botão de alimentação, seguido pelo botão SLDs.
- Cubra a cabeça do galvanômetro e clique em Obter BG para medir o padrão de interferência de fundo e subtrai-lo da medição ( Figura4B).
- Defina o modo de captura de imagem para visualização ao vivo.
- Ajuste a posição yaté que a imagem b-scan contenha apenas o gancho a montante. Divida o comprimento do músculo exibido no painel frontal de controle(Figura 4B) por dois e subtraia a posição atual y. Digite esse valor na entrada"y-offset". Ajuste o valor "x-offset" até que a seção transversal da trabecula esteja centrada no quadro.
- Com o trabecula centrado, escaneie ao longo do eixo yajustando a posição ypara encontrar as posições correspondentes aos ganchos rio acima e rio abaixo. Anote essas posições para baixo. Definir o Range Y (passos) para a diferença absoluta entre esses valores divididos por dez.
- Defina o modo de captura de imagem como estímulo acionado? , Faixa X (passos) para 100 e clique no botão Definir parâmetros ativos.
- Clique em Transmitir Dados de Varredura B?, em seguida, Adquirir.
NOTA: O protocolo de imagem fechado requer 200 contrações para capturar toda a geometria muscular para uma amostra de 2 mm de comprimento, o que corresponde a um tempo de captura de ~3 min 20 s.
4. Processe o conjunto de dados de imagem brightfield
- Prepare as imagens para análise.
- Importe imagens em ImageJ (Arquivo > importar > sequência de imagem > selecionar imagem).
- Aumente o contraste da imagem (Imagem > Ajuste > brilho/contraste > Mova controles mínimos e máximos para centralizar o histograma da imagem).
- Afiar as imagens (Processe > Filtros > Máscara Unsharp > definir Raio (Sigma) para 1,0 pixels e Peso da Máscara (0,1-0,9) a 0,6).
- Exporte a sequência de imagem (Salve como > sequência de imagem > definir o formato para PNG, Iniciar em 0 e Dígitos (1-8) a 4).
- Costure as imagens, meça o deslocamento localizado e calcule os comprimentos de sarcomere locais.
- Abra "TrabeculaProcessando.m" (disponível depois) e defina a variável FolderPath para a pasta principal contendo todos os dados e o ImagePath para a pasta onde a sequência de imagem do Passo 4.1.4 foi salva. Defina seções para o número de janelas e quadros de imagem para o número de quadros capturados por janela.
- Execute o código.
NOTA: As saídas estarão presentes no caminho da pasta de saída especificado pelo usuário. (Por padrão, o caminho está definido como FolderPath/Output).
- Técnica de comprimento de sarcomere FFT
- Use um software de processamento de imagem para executar um FFT em uma região da imagem onde os sarcomeres são altamente visíveis.
- Multiplique os pixels por calibração de μm a partir da etapa 1.1.6 por 1,6 μm e 3,0 μm antes de calcular o inverso para obter a faixa de frequências espaciais de interesse.
- Encaixe um resultado exponencial ao FFT, ignorando as informações de frequência na faixa de frequência calculada na Etapa 4.3.2, e subtrai-as do resultado de transformação para remover o termo DC.
- Coloque uma curva gaussiana na faixa de frequência de interesse.
- Calcule o inverso do pico da curva gaussiana. Este é o comprimento médio de sarcomere para a região de interesse.
NOTA: O cálculo FFT e o encaixe das equações exponenciais e gaussianas foram realizados usando o código LabVIEW personalizado.
5. Processe os dados de fluorescência
- Subtrair a autofluorescência dependente da janela da respectiva janela e calcular o quociente dos sinais associados aos comprimentos de onda de excitação de 340 nm e 380 nm.
6. Processe os dados de imagem oct
- Prepare o conjunto de imagens OCT para segmentação.
- Abra imageJ e importe as imagens(Arquivo > Import > Image Sequence). Na janela do explorador de arquivos, isso se abre, localiza as imagens, seleciona uma e clique em Abrir.
NOTA: Se o código de controle do OCT não armazenar as imagens em um formato legível pelo ImageJ, converta-as em PNG. - Para facilitar a visualização, organize a sequência de imagem em um hyperstack (Image > Hyperstacks > Stack to Hyperstack). Na caixa de diálogo que abre, defina o número de fatias para o número de B-scans por fatia e o X para o número de fatias ao longo do comprimento do trabecula.
- Desenhe um retângulo que envolve o trabecula. Confirme se ele inclui todo o volume ao longo do tempo usando os controles deslizantes na janela do hiperso. Lavo a imagem na janela(Image > Crop).
- Remova fatias que contenham imagens dos ganchos de montagem(Stacks > Tools > Slice Keeper). Selecione a gama de fatias que contém apenas informações de trabecula.
- Abra imageJ e importe as imagens(Arquivo > Import > Image Sequence). Na janela do explorador de arquivos, isso se abre, localiza as imagens, seleciona uma e clique em Abrir.
- Treine a segmentação WEKA.
- Segmentação WEKA Aberta(Plugins > Segmentação > Segmentação Weka Treável).
- Defina o modo de seleção como Freehand.
- Clique em Configurações e ajuste as configurações de classificação e treinamento. (Para este modelo, foram utilizadas as seguintes características de Treinamento: borrão gaussiano, filtro Sobel, Hessian, Diferença de Gaussianos, projeções de membrana, Bilateral e Lipschitz. A espessura da membrana foi definida para 1, tamanho do patch de membrana para 8, sigma mínimo para 1 e sigma máximo para 32. O classificador foi definido como FastRandomForest e as opções de classificadores foram definidas para: batchSize 100, maxDepth a 32, numFeatures to 32, numThreads to 0 e numTrees para 200.)
- Segmentar manualmente imagens até o treinamento resulta em segmentações satisfatórias.
- Salve o classificador.
- Segmentar os B-scans processados
- Inicie a segmentação WEKA seguindo o Passo 6.2.1.
- Carregue o classificador a partir do passo 6.2.5.
- Clique em Criar Resultado.
- Converta as imagens em 8 bits (Image > Type > de 8 bits).
- Converta as imagens em binários(Processe > binário > tornar binário > método padrão e fundo padrão).
- Salvar como sequência de imagem (PNG).
- Calcule o CSA médio nas imagens segmentadas de varredura B.
- Conte o número de pixels brancos em uma imagem binária de varredura B.
- Multiplique a área do pixel pela resolução de profundidade calibrada (a partir da etapa 1.2) e de 10 μm (a distância entre as varreduras A vizinhas).
- Repita para todas as varreduras B entre os ganchos e a média das medidas.
- Converta imagem segmentada em uma malha.
- Abra "OCTmain.m" (disponível diretamente na pasta contendo a saída do Passo 6.3.6. Defina saídaSo em vias conforme necessário.
- Defina fatias no valor de "Range Y (passos)" (Etapa 3.5.5) e quadros ao valor de "Repeat X" (Passo 3.5.6), z_dim à resolução de profundidade (Passo 1.2.10) e x_dim & y_dim ao valor atribuído a 10.
- Clique em Executar.
Resultados
Para capturar as informações regionais ca2+ e brightfield para toda a extensão da trabecula apresentada aqui, foram necessárias sete posições musculares. A Figura 6 sugere que a força de contração não foi perturbada por esse movimento, revelando que não havia dependência de posição da produção da força ativa.
As tomografias B coletadas utilizando tomografia de coerência óptica a uma taxa de 100 Hz foram segmentadas utilizando o plugin ImageJ WEKA14 (Figura 7A). Cada seção transversal aparece distorcida devido à diferença entre as resoluções lateral (10 μm) e profundidade (1,73 μm (no miocárdio)). Essa distorção foi corrigida pelo dimensionamento do eixo de profundidade da imagem pela relação resolução lateral de profundidade de resolução. Figura 7B,C demonstram que após o dimensionamento da c-scan bruta da trabecula é aproximadamente cilíndrico em geometria. O reflexo da parede da câmara de medição pode às vezes se sobrepor aos dados musculares(Figura 7A,B),mas o software de segmentação pode ser treinado para explicar isso (Figura 7D,E). Uma vez segmentada, a área transversal ao longo do comprimento do músculo pode ser calculada ao longo da contração (Figura 7F). Observe que este trabecula em particular tem um pequeno apêndice ramificando-se a partir dele. O movimento do ramo é evidente ~0,75 mm ao longo da trabecula. Por fim, as imagens segmentadas podem ser convertidas em malhas para auxiliar na construção de modelos geométricos(Figura 7G).
Dados de imagem capturados em cada uma das diferentes posições de trabecula a uma taxa de 100 fps foram costurados juntos para criar uma única imagem completa do trabecula (Figura 8A). A resolução dessas imagens é de 0,535 μm/pixel. O uso de funções de ponderação linear nas regiões sobrepostas das janelas vizinhas auxilia na visualização e minimiza o impacto da vinheta presente nas imagens de campo brilhante. Para medir o sinal fluorescente, uma janela de 540 μm por 540 μm da trabecula é ciclicamente iluminada com 340 nm, 365 nm e luz de comprimento de onda de 380 nm a uma taxa de 600 Hz. A razão da fluorescência emitida associada à luz de excitação de 340 nm e 380 nm correlaciona-se com o cálcio intracelular após o trabecula ter sido carregado com Fura-2. Como esta medição é uma razão, a taxa de medição efetiva é de 200 Hz. Os transitórios intracelulares Ca2+ de cada janela estão alinhados com a região em que foram visualizados (Figura 8B). Enquanto o pico dos transitórios parece razoavelmente consistente, a diastólica [Ca2+] é menor dentro da região entre 900 μm e 1800 μm ao longo da trabecula. Da mesma forma, os resultados dos cálculos de rastreamento de deslocamento(Figura 8C) e de sarcomere(Figura 8D) também indicam a presença de variabilidade regional. A técnica de rastreamento sem marcador usada é capaz de processar o deslocamento de cada pixel, dado contraste suficiente. Ao mapear a distribuição de comprimentos de sarcomere no poste, uma área de correlação cruzada de 128 pixels por 128 pixels (~67 μm por 67 μm) foi usada para calcular o comprimento regional de sarcomere. Esta área encapsula aproximadamente 29 sarcomeres quando perto a amostra está perto do comprimento ideal de sarcomere. O tamanho do passo (tanto nas direções x quanto em y)entre o centroide de cada janela de correlação cruzada foi definido em 50 pixels (~26 μm) para o processamento desses dados. A adequação das estimativas de comprimento de sarcomere foi testada com base na largura e amplitude do ajuste gaussiano ao sinal FFT. Estas condições não foram atendidas na região muscular entre 0 μm e 500 μm para que nenhuma informação de comprimento de sarcomere pudesse ser computada lá. Dado os deslocamentos associados, é provável que os sarcomeres nesta região alongados durante a fase contraída. De acordo com essa especulação, os comprimentos médios de sarcomere no lado direito do trabecula encurtam durante esse período. Ao combinar as informações fornecidas por cada um dos painéis, parece que a região com a maior área transversal não produz a força mais significativa. Pressuposto de que a variação regional dos transitórios Ca2+ tem um gradiente aproximadamente suave, a Figura 8B indica que a maior amplitude ca2+ transitória ocorre entre 1300 μm e 1600 μm ao longo da trabecula. O mapa de deslocamento indica que a região que sofre menos movimento se alinha bem com o pico Ca2+ transitório. No entanto, essa região possui as menores áreas transversais da amostra. Com esses dados em mente, pode-se inferir que essa região gerou mais estresse.

Figura 1: Imagem anotada do cardiomímetro. Cada um dos principais componentes ópticos é delineado. O inset contém um close-up, retrovisor, do objetivo do microscópio in situ, abaixo da câmara de medição. Clique aqui para ver uma versão maior desta figura.
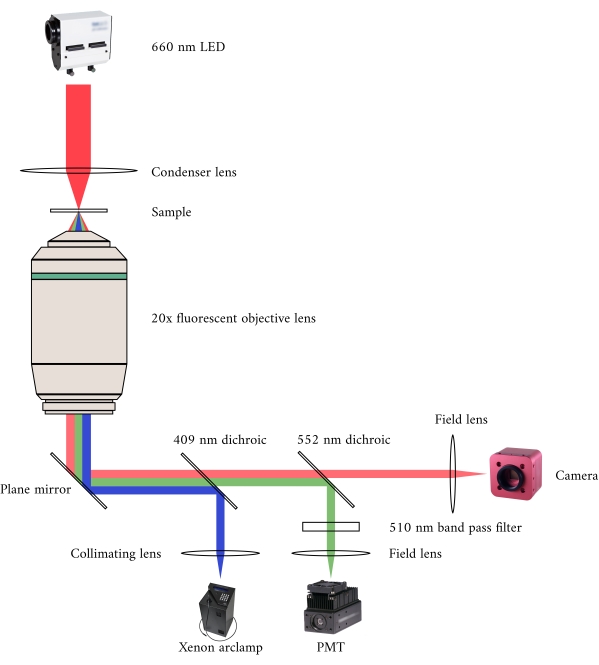
Figura 2: Caminho óptico para microscopia de campo brilhante e fluorescência simultânea. A fonte de iluminação para o microscópio de fluorescência é uma lâmpada de arco Xenon, a saída da qual ciclicamente alterna entre 340 nm, 365 nm e 380 nm de luz. O caminho de saída da lâmpada de arco contém um espelhodicróico com um comprimento de onda de 409 nm que reflete a luz UV em um espelho que direciona a luz para um objetivo de microscópio de fluorescência. A lente concentra a luz de excitação na amostra e coleta a luz emitida, que tem um comprimento de onda mais longo de 510 nm. Esta luz emitida passa pelo primeiro espelho dicroico, mas não o segundo, pois tem um comprimento de onda de 552 nm. Uma lente de campo então concentra a luz refletida no sensor do PMT. Enquanto isso, a fonte de iluminação (LED de 660 nm) para o microscópio de campo brilhante está localizada acima da amostra. A luz transmitida é focada na amostra por uma lente condensadora, e o objetivo de fluorescência de 20 × captura a imagem de transmissão resultante. O comprimento de onda usado para iluminação de campo brilhante excede o comprimento de onda de corte de cada espelhodicróico, por isso passa por ambos antes que a imagem seja focada no sensor de uma câmera CMOS. Clique aqui para ver uma versão maior desta figura.
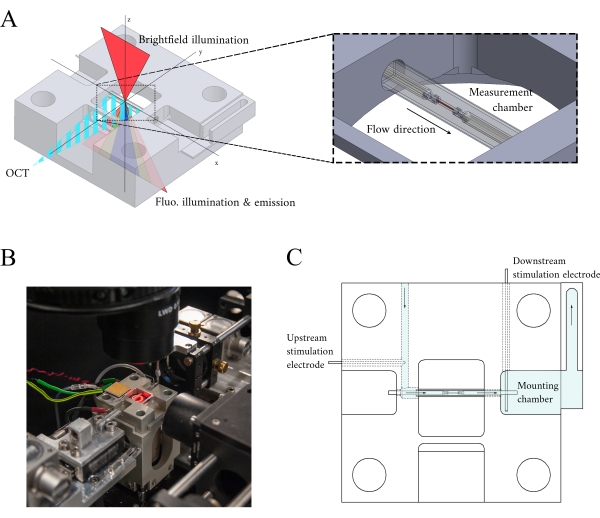
Figura 3: Desenho do titular da câmara demedição. (A) Visão isométrica do titular da câmara de medição com caminhos ópticos sobrepostos. A iluminação de Campo Brilhante ocorre a partir da superfície superior(eixo z); a iluminação da fluorescência ocorre a partir da superfície inferior (eixoz),e o sinal oct do braço de medição é ortogonal para o outro eixo de iluminação(y-eixo). Durante o experimento, dois ganchos de platina seguram uma trabecula dentro de um tubo capilar de vidro que funciona como a câmara de medição. Os motores de bobina de voz controlam cada gancho e suas posições são medidas usando interferometria laser. A posição atual é comparada com um set point definido pelo usuário e, usando um controlador PID codificado dentro de um FPGA, o erro é minimizado. (B) Câmara de medição in situ com a iluminação de campo brilhante ligada. A visão traseira é mostrada no inset da Figura 1 . (C) Esquema do fluxo de superfusato através do titular da câmara de medição. O superfusato entra na parte traseira do bloco e flui na direção indicada por setas. Os eletrodos a montante e a jusante estabelecem a estimulação de campo para provocar a contração de uma trabecula montada na câmara de medição. O sombreamento azul indica as regiões onde o superfusato flui durante um experimento. Clique aqui para ver uma versão maior desta figura.
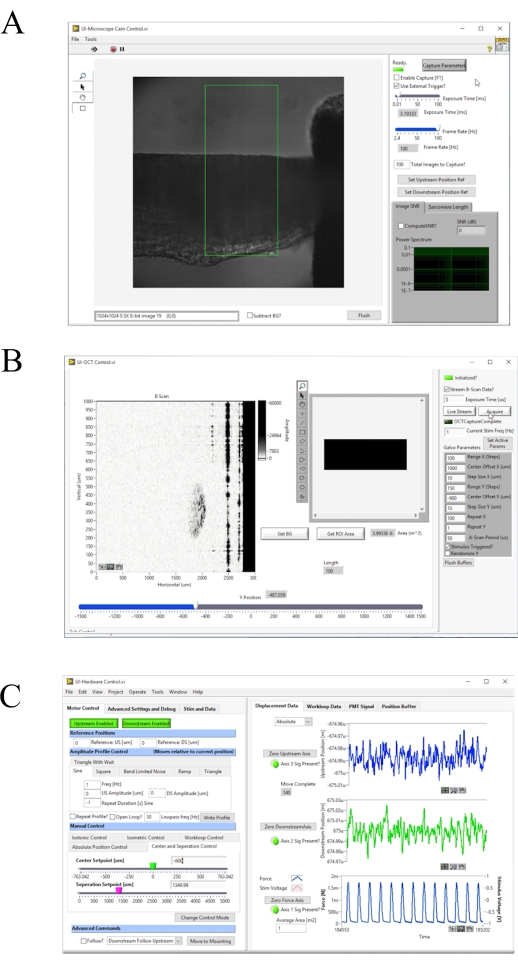
Figura 4: Painel frontal do software de aquisição e controle de imagens de imagem. (A) Interface do usuário de imagem Brightfield. (B) Interface de usuário de imagem OCT. (C) Interface de usuário de controle de hardware. Clique aqui para ver uma versão maior desta figura.
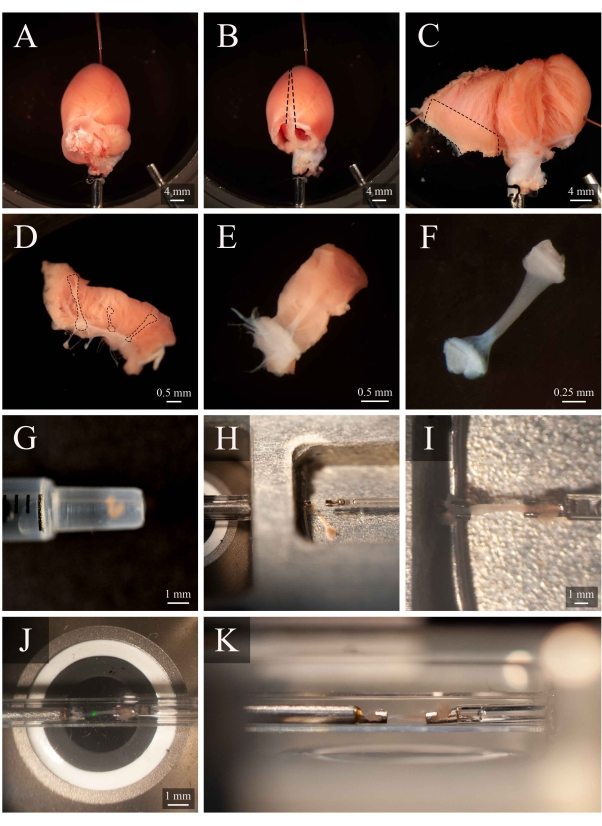
Figura 5: Dissecção de trabecula e protocolo de montagem. (A) Coração de rato perfusado langendorff na câmara de dissecção. (B) O mesmo coração com a atria removida. Linhas tracejadas indicam a trajetória de excisão para abrir os ventrículos. (C) Um coração aberto para expor o interior de ambos os ventrículos. A caixa tracejada indica a região onde as trabeculas são tipicamente encontradas. (D) Região da parede de ventilação direita excisada (a mesma indicada pela caixa tracejada em C). Linhas tracejadas destacam três trabeculas. (E) Uma trabecula selecionada entre os três em D. (F) O trabecula do painel E com o tecido da parede removido. (G) A trabecula isolada no final de uma seringa de 1 mL. (H) A trabecula na câmara de montagem. (I) A trabecula montada entre dois ganchos de platina. (J) A trabecula, montada entre ganchos, dentro da câmara de medição(Figura 3B). A mancha verde é um artefato do primeiro filtrodicróico. (K) Ângulo secundário da trabecula montada dentro da câmara de medição. A distância entre o trabecula e a lente objetiva do microscópio é de aproximadamente 1 mm. Clique aqui para ver uma versão maior desta figura.
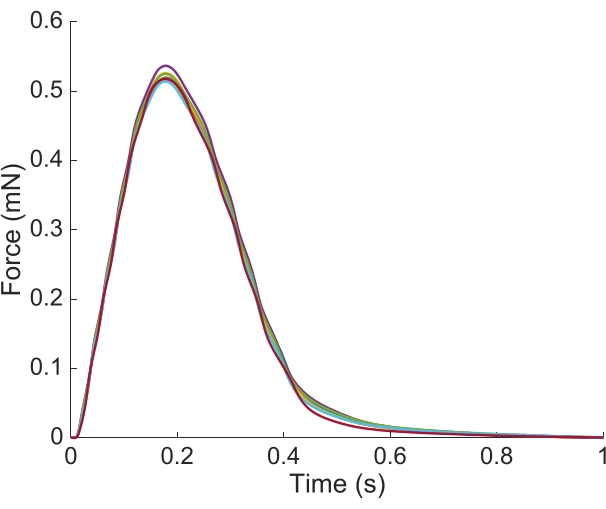
Figura 6: Dependência de posição da medição da força. A força produzida pelo músculo a partir de cada uma das posições de imagem (n = 7) sobreposta. A produção média de força ativa foi de 0,527 mN ± 0,003 mN, tempo de contração de 50 % 77,1 ms ± 0,3 ms, e tempo para 50 % de relaxamento 328,1 ms ± 0,9 ms (todos os dados são apresentados como média ± SE). Clique aqui para ver uma versão maior desta figura.
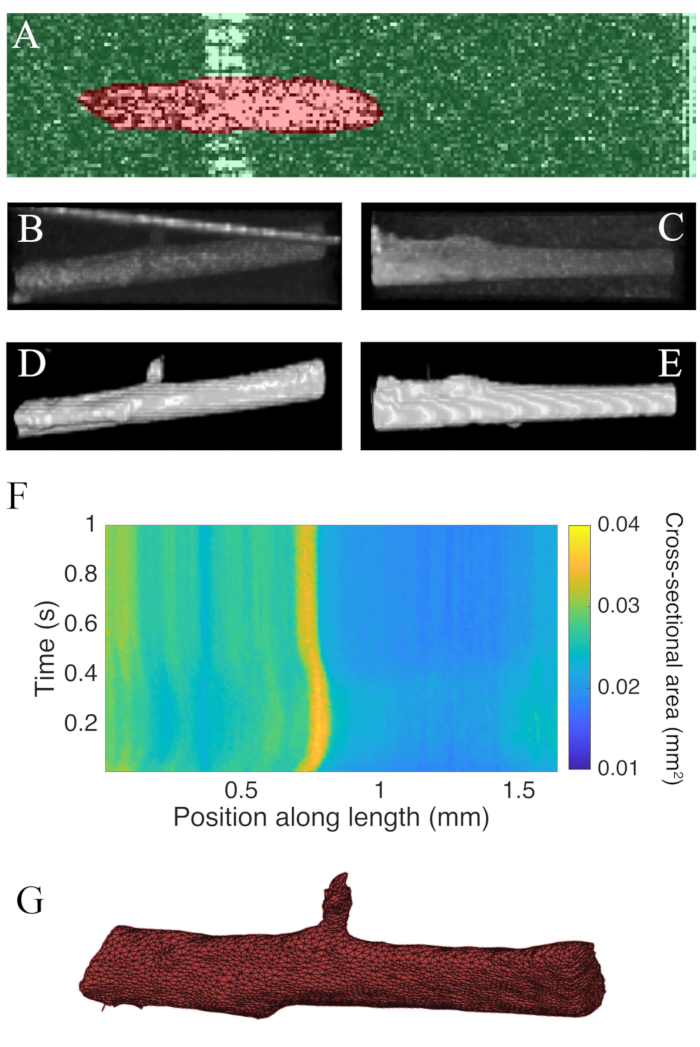
Figura 7: Análise de imagem de OCT. (A) Exemplo de segmentação WEKA. A seção transversal segmentada do músculo é destacada em vermelho, e o fundo é destacado em verde. (B) Visão superior dos dados brutos de tomografia C de uma trabecula. A linha angular brilhante em direção ao topo da imagem é o reflexo da parede da câmara de medição. (C) Visão lateral dos dados brutos de tomografia C de uma trabecula. (D) Visão superior dos dados de OCT segmentados. (E) Visão lateral dos dados de OCT segmentados. (F) A área transversal ao longo do comprimento do trabecula(eixo x)através do tempo(y-eixo). A área transversal média ao longo do comprimento muscular foi de 0,0326 mm2 ± 0,0005 mm2 (média ± S.E.) Umamalha da trabecula. A malha foi aproximadamente alinhada com o enredo de área transversal do painel F. Clique aqui para ver uma versão maior desta figura.
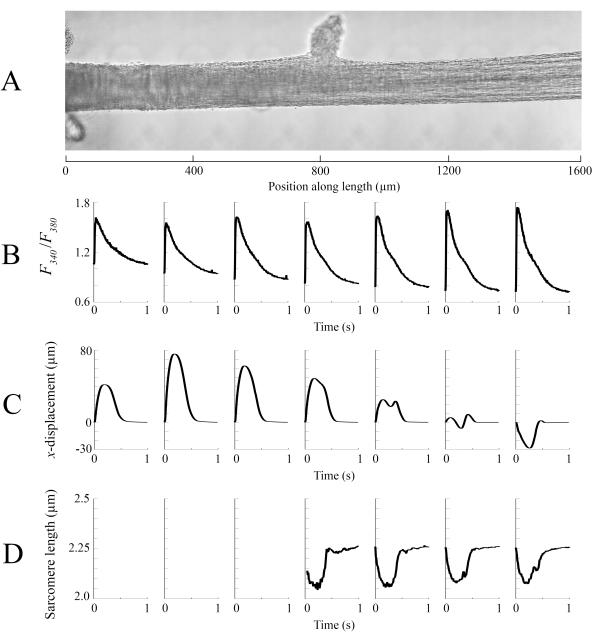
Figura 8: Análise de imagem de brightfield e fluorescência. (A) Imagem costurada (sete janelas de imagem) da trabecula. (B) Transitórios Ca2+ ao longo do comprimento da trabecula. (C) Deslocamento médio xde cada janela de imagem. Um deslocamento positivo representa um movimento para a direita e negativo para a esquerda. (D) Comprimentos médios de sarcomere de cada janela de imagem que tinham o contraste de imagem necessário. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Tabela de Soluções Clique aqui para baixar esta Tabela.
Discussão
Neste estudo, apresentamos uma configuração que permite a montagem de três sistemas ópticos que combinam imagens brightfield, fluorescência e OCT para coletar dados de uma trabecula cardíaca ex vivo ( Figura1 e Figura 2). Tal integração orquestrada é possível devido ao desenho da câmara de medição (Figura 3) para permitir o arranjo ortogonal do OCT para o eixo brightfield-fluorescence. O sistema de montagem muscular desempenha um papel igualmente importante no sucesso das quantificações simultâneas dos principais índices na caracterização da dinâmica de excitação muscular cardíaca. Sua novidade reside na habilitação de procedimentos de escaneamento muscular sem perturbação aparente ao desempenho mecânico do músculo (Figura 6). Com a configuração combinada de imagem e sistema de gancho motorizado para medição de força, este sistema pode avaliar a heterogeneidade regional no comprimento transitório, de deslocamento e sarcomere ca2+, juntamente com informações geométricas macroscópicas de um trabecula de contração ao longo do curso do tempo da contração (Figuras 7 e Figura 8).
Dada a onipresença dos sistemas de imagem de epifluorescência de campo brilhante dentro dos laboratórios de pesquisa cardíaca, a reprodução desses resultados pode ser alcançada com algumas pequenas considerações de hardware. Aqui, apresentamos o kit de ferramentas de processamento de imagem para combinar brilho-epifluorescência e OCT, o que é essencial na análise da heterogeneidade contraída subjacente. A integração do OCT requer um caminho óptico desobstruído, enquanto a imagem fechada requer uma linha de gatilho externa entre o estímulo e a câmera de imagem OCT e brightfield, e ganchos de montagem muscular capazes de mover a amostra por toda a câmara de medição. Os softwares e métodos de pós-processamento necessários estão disponíveis gratuitamente. Em particular, o software de segmentação utilizado, WEKA14,é de código aberto. A técnica de rastreamento sem marcadores dos pontos de material8, comprimento de sarcomere, imagem volumosa fechada10e códigos de geração de malha também são acessíveis e podem ser disponibilizados a pedido do autor correspondente.
Viabilidade muscular, carregamento ideal de Fura-2 e foco de imagem são os três pilares que formam os fundamentos de um experimento bem sucedido. Utilizando uma solução de dissecção contendo BDM para evitar contratura, transporte do músculo em uma seringa, oxigenação contínua da solução e preparação de novas soluções experimentais no dia de um experimento, todos contribuem para uma alta taxa de viabilidade muscular. Antes de carregar a trabecula com Fura-2AM, a autofluorescência deve ser coletada para cada condição que se tenha interesse em estudar, pois pode ter um efeito significativo sobre o transitório Ca2+ medido 15. A oxigenação da solução de carregamento Fura-2AM é complicada pela necessária inclusão do plurônico-F127 surfactante para ajudar o carregamento de tingimento. Para combater a consequente formação de bolhas em excesso causada por este surfactante, uma pequena gota de anti-espuma na solução de carregamento permite ao usuário aumentar a taxa de oxigenação, melhorando assim a chance de que o trabecula mantenha a viabilidade funcional durante todo o processo de carregamento. Finalmente, o foco de imagem deve ser uniforme ao longo do comprimento muscular para maximizar a relação sinal/ruído das informações de campo brilhante e fluorescência.
Há duas limitações a serem consideradas com os métodos aqui apresentados. A primeira é a resolução espacial do microscópio de fluorescência. Embora as resoluções espaciais do OCT e da imagem de brightfield sejam altas, a resolução do microscópio de fluorescência é limitada à integral da fluorescência do volume capturado dentro de uma janela de imagem de 540 μm por 540 μm. Há escopo para aumentar a resolução espacial do microscópio de fluorescência usando uma câmera de dispositivo acoplada a carga de alto ganho, em vez de um PMT, para capturar o sinal de fluorescência em detrimento do sinal para a razão de ruído16. Em segundo lugar está o diâmetro da trabecula que pode ser estudado em termos de comprimento sarcomere mensurável e profundidade geométrica. A abordagem de FFT com janelas para a computação de comprimento sarcomere explora o benefício da melhor resolução espacial, mas está associada à redução da robustez(Figura 8D). Nos casos em que as trabeculas turvas ou de grande diâmetro devem ser estudadas, a resolutividade do FFT será muito reduzida devido ao contraste reduzido associado à banda sarcomerica em amostras de tecido maiores. Da mesma forma, dentro do OCT, os reflexos traseiros de uma profundidade de imagem superior a 300 μm serão muito fracos para serem resolvidos durante a fase de segmentação. Assim, nossa técnica está limitada a trabeculas de diâmetro inferior a 300 μm. No entanto, não é recomendável estudar amostras de grande diâmetro, pois pode haver problemas com oxigenação difusa do núcleo muscular durante altas taxas de estimulação17.
Nosso método permite a avaliação da função mecânica iônica em associação com a geometria muscular em músculos saudáveis e doentes, fornecendo uma abordagem poderosa para entender a fisiologia muscular cardíaca, a fisiopatologia e a farmacologia. O pipeline de processamento de imagens descrito aqui extrai dados que serão fundamentais para obter uma compreensão mais profunda da heterogeneidade contraída. Um caminho para perceber completamente o potencial de um conjunto de dados tão rico está na construção de modelos matemáticos que integram e interpretam esses dados, e para fazer previsões que podem ser testadas experimentalmente usando nosso dispositivo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi financiado por Bolsas de Doutorado da Universidade de Auckland (concedidas a JD e MC), Sir Charles Hercus Health Research Fellowships (20/011 e 21/116) do Conselho de Pesquisa em Saúde da Nova Zelândia (concedido à J-CH à KT, respectivamente), uma bolsa de doutorado concedida pela National Heart Foundation (concedida à AA), bolsas Marsden Fast-Start (UOA1504 e UOA1703) da Royal Society of New Zealand (concedida à J-CH e KT, respectivamente), e uma Bolsa de Pesquisa James Cook da Royal Society of New Zealand (concedida à AT). O desenvolvimento original deste instrumento foi financiado por uma subvenção de Marsden (11-UOA-199) da Royal Society of New Zealand (concedida à AT e PN).
Materiais
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
Referências
- Han, J. -. C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250 (2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398 (2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -. C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados