Method Article
Imagerie tomographique simultanée en champ lumineux, en fluorescence et par cohérence optique de trabécules cardiaques contractants ex vivo
Dans cet article
Résumé
Ce protocole présente une collection de données géométriques sarcomères, calciques et macroscopiques provenant d’une trabécule cardiaque en contraction active ex vivo. Ces mesures simultanées sont rendues possibles par l’intégration de trois modalités d’imagerie.
Résumé
Dans le muscle cardiaque, les transitoires intracellulaires Ca2+ activent les myofilaments contractiles, provoquant une contraction, un raccourcissement macroscopique et une déformation géométrique. Notre compréhension des relations internes entre ces événements a été limitée parce que nous ne pouvons ni « voir » à l’intérieur du muscle ni suivre avec précision la nature spatio-temporelle de la dynamique excitation-contraction. Pour résoudre ces problèmes, nous avons construit un appareil qui combine une suite de modalités d’imagerie. Plus précisément, il intègre un microscope à fond clair pour mesurer les changements locaux de la longueur du sarcomère et de la déformation tissulaire, un microscope à fluorescence pour visualiser le transitoire Ca2+ et un tomographe à cohérence optique pour capturer les changements géométriques du tissu tout au long du cycle cardiaque. Nous présentons ici l’infrastructure d’imagerie et le cadre de collecte de données associé. Les données sont recueillies à partir de structures tissulaires isolées en forme de bâtonnets connues sous le nom de trabeculae carneae. Dans notre instrument, une paire de crochets en platine à position contrôlée maintient chaque extrémité d’un échantillon musculaire ex vivo alors qu’il est continuellement superfusé avec une solution saline riche en nutriments. Les crochets sont sous contrôle indépendant, ce qui permet un contrôle en temps réel de la longueur et de la force musculaires. La translation longitudinale permet de numériser l’échantillon par morceaux, en surmontant les limites associées à la taille relative de la fenêtre d’imagerie du microscope (540 μm par 540 μm) et à la longueur d’une trabécule typique (>2000 μm). Les électrodes de platine à chaque extrémité de la chambre musculaire stimulent la trabécule à une vitesse définie par l’utilisateur. Nous exploitons le signal de stimulation comme déclencheur pour synchroniser les données de chaque fenêtre d’imagerie afin de reconstruire l’ensemble des contractions de l’échantillon dans des conditions d’équilibre. L’application de techniques de traitement d’images à ces données d’imagerie en champ clair fournit des cartes de déplacement tissulaire et de longueur de sarcomère. Une telle collection de données, lorsqu’elle est incorporée dans un pipeline de modélisation expérimentale, fournira une compréhension plus approfondie de l’homogénéité et de l’hétérogénéité contractiles musculaires en physiologie et en physiopathologie.
Introduction
La superfusion de préparations isolées de tissu musculaire cardiaque est un protocole standard et largement utilisé pour étudier l’activation ionique cardiaque et la mécanique1. En particulier, l’isolement des trabécules, des structures en forme de bâtonnets des parois ventriculaires, a permis d’évaluer des phénomènes tels que l’activation dépendante de la longueur de la contraction2,la réponse dépendante de l’étirement de la contraction3,4et la viscoélasticité diastolique5 du tissu cardiaque. Ter Keurs, l’initiateur de cette technique de surfusage de trabécules isolés, a d’abord utilisé une combinaison d’imagerie par fluorescence pour les mesures de Ca2+ et de diffraction laser pour déterminer les longueurs de sarcomères2,5. Depuis ces premières études, il est devenu de plus en plus courant d’extraire des informations sur la longueur des sarcomères avec une plus grande résolution spatiale en utilisant des techniques 2D à transformée de Fourier rapide (FFT)6 sur des images de microscopie en champ clair. Les deux systèmes d’imagerie permettent une évaluation partielle de la relation sous-jacente entre la libération de Ca2+ et la production de force dépendante de la longueur du sarcomère.
Le muscle cardiaque est strié, avec la bande visible associée à une série sous-jacente d’unités contractiles constituées de filaments épais et épais. L’interaction de ces filaments constitutifs qui composent les sarcomères sous-tend la génération de force, qui commence comme suit: un signal électrique dépolarisant, ou potentiel d’action, provoque l’ouverture de canaux Ca2+ de type L dépendants de la tension dans la membrane cellulaire; l’afflux cellulaire de Ca2+ qui s’ensuit induit la libération de Ca2+ par le réticulum sarcoplasmique (SR), un magasin intracellulaire de Ca2+, dans un processus connu sous le nom de Ca2+induit par la libération de Ca2+ 7; cette augmentation soudaine de la concentration intracellulaire de Ca2+ de la gamme nanomolaire à la gamme micromolaire permet la production de force; Les pompes Ca2+ extrudent continuellement le Ca2+ du cytosol dans le SR et le compartiment extracellulaire; lorsque la concentration intracellulaire de Ca2+ revient à la gamme nanomolaire, la production de force cesse et le muscle se détend. Pendant la production de force, les filaments épais et minces constitutifs glissent les uns sur les autres. La longueur du sarcomère dicte l’étendue relative du chevauchement et, par conséquent, le potentiel de production de force du muscle macroscopiquement.
Dans cet article, nous étendons ces techniques d’imagerie par fluorescence et en champ clair pour inclure la tomographie par cohérence optique (OCT). OCT utilise le principe physique de l’interférence et est capable d’obtenir la déformation géométrique des tissus pour comprendre l’hétérogénéité contractile musculaire8. Notre appareil(Figure 1)utilise un système OCT (SD-OCT) à domaine spectral. Dans SD-OCT, un séparateur de faisceau divise la lumière d’une diode superluminescente à large bande de courte longueur de cohérence en bras de référence et de mesure. Le bras de référence contient un miroir fixe et le bras de mesure contient un galvanomètre 2D pour diriger la lumière. La lumière rétrodéclante de l’échantillon est collectée et interfère avec la lumière réfléchie dans le bras de référence pour former un motif d’interférence. Les informations de profondeur sont codées dans la fréquence de la frange spectrale. Pour extraire l’information, le signal est passé à travers un spectromètre et une FFT inverse est appliquée au résultat. Le signal 1D correspondant représente les structures à différentes profondeurs, correspondant aux changements d’indice de réfraction9 (A-scan). En dirigeant le laser sur un seul axe, on peut construire une coupe transversale de l’échantillon d’intérêt (B-scan) et, de même, en répétant le processus par étapes dans l’axe restant, une image tridimensionnelle peut être générée (C-scan). Par extension, on peut collecter une série de B-scans sur une seule tranche pour un sujet répétitif variant dans le temps en fonction d’un déclencheur externe et répéter pour générer un scan tridimensionnel, représentant une image plane variant dans le temps10.
Lors de l’intégration des trois systèmes d’imagerie, nous avons pris en compte les deux principes suivants. Premièrement, les capteurs d’imagerie ne doivent pas détecter la lumière d’une autre modalité d’imagerie, et deuxièmement, la conception physique doit contenir de l’espace libre pour au moins trois plans d’imagerie simultanés. Pour répondre à la première exigence, le microscope à champ lumineux utilise une LED de longueur d’onde de 660 nm pour éclairer l’échantillon dans une configuration inversée. Le microscope à fluorescence est dans une configuration d’épifluorescence où la même lentille d’objectif est utilisée à la fois pour l’excitation et la collecte de la lumière émise. La lumière d’excitation a une longueur d’onde comprise entre 340 nm et 380 nm, et un tube photomultiplicateur (PMT) mesure la lumière émise à une longueur d’onde de 510 nm. Une paire de miroirs dichroïques permet à ces deux chemins optiques de partager la même empreinte physique sans interférer avec la mesure opposée(Figure 2). Enfin, l’OCT utilise une lumière à large bande (largeur spectrale de 100 nm) avec une longueur d’onde centrale de 840 nm, distincte des deux autres modalités. En raison de la faible cohérence de la lumière utilisée pour l’OCT, toute lumière diffusée provenant des sources de fluorescence en champ lumineux ne contribuera pas au modèle d’interférence qui code les informations de profondeur. Pour la deuxième exigence, la conception du boîtier du tube capillaire comporte des voies optiques accessibles vers les plans antérieur, inférieur et supérieur de l’échantillon. Au cours des expériences, deux crochets en platine maintiennent une trabécule dans un tube capillaire perfusé avec une solution oxygénée de Krebs-Henseleit (KH). La tête du galvanomètre de l’OCT est orientée orthogonalement vers la voie d’imagerie par fluorescence en champ lumineux pour tirer parti du troisième plan optique orthogonal(Figure 3).
Cet article décrit les considérations de conception pour la construction d’un dispositif capable d’imager simultanément le calcium, la longueur du sarcomère et la géométrie musculaire. Pour démontrer ces capacités de mesure, nous décrivons le processus d’isolement d’un trabécule ventriculaire, la préparation des solutions tampons nécessaires, ainsi que les étapes critiques impliquées dans la manipulation et la charge de fluorescence d’un trabécule ex vivo. Enfin, cet article décrit les processus nécessaires pour traduire l’ensemble de données en visualisations plus utiles.
Protocole
Le comité d’éthique animale de l’Université d’Auckland a approuvé la manipulation des rats et la préparation d’échantillons de tissus.
1. Étalonnage de l’imagerie
- Étalonnage des pixels de microscope en champ clair
- Remplissez la chambre de mesure avec de l’eau distillée.
- Placer un réseau de diffraction avec des lignes connues par μm dans la chambre de mesure.
- Appuyez sur F1 pour activer la capture et régler la fréquence d’images [Hz] jusqu’à ce que le réseau de diffraction soit clairement visible (Figure 4A). Assurez-vous que le réseau de diffraction est parallèle au bord du cadre. Appuyez à nouveau sur F1 pour arrêter la capture.
- Définissez le total des images à Capturer ? sur un, appuyez sur Ctrl + Maj + S pour diffuser des données sur le disque, puis appuyez sur F1 pour capturer une image du réseau de diffraction.
- Ouvrez ImageJ et importez l’image de grille de diffraction (Fichier > Ouvrir > Sélectionner l’image d’étalonnage). En maintenant le décalage, tracez une ligne qui englobe 20 bandes claires et sombres du réseau de diffraction.
- Calibrer l’image (Analyser > Définir l’échelle). La longueur de la ligne de l’étape 1.1.5 définit la valeur Distance en pixels. Définissez la valeur Distance connue sur 20 fois les lignes par mesure μm et l’unité de longueur sur μm. L’inverse de l’échelle est le nombre de micromètres représentés par un pixel.
- Calibrage de la résolution de profondeur de l’OPO
- Mesurez l’épaisseur d’une lame de microscope en verre à l’aide d’étriers Vernier.
- Allumez la source laser OCT.
- Couvrez la tête du galvanomètre et cliquez sur Obtenir BG pour mesurer le motif d’interférence d’arrière-plan et le soustraire de la mesure (Figure 4B).
- Serrez la lame de microscope en verre mesurée (à partir de l’étape 1.2.1) dans le bras de mesure de l’OCT.
- Cliquez sur Diffusion en direct pour afficher l’image de l’OPO. Ajustez la lame du microscope en verre jusqu’à ce qu’elle soit visible dans le B-scan.
- Pour capturer l’image B-scan, définissez plage Y (étapes) sur un, cliquez sur Stream B-scan Data?, puis cliquez sur Acquire.
- Importez l’image B-scan dans ImageJ (Fichier > Ouvrir > Sélectionner B-scan). En maintenant la touche Maj enfoncée, tracez une ligne entre les limites de la lame du microscope en verre.
- Définissez l’échelle (Analyser > Définir l’échelle). Réglez la distance connue sur la mesure collectée à l’étape 1.2.1.
- Pour calculer la résolution de profondeur dans l’air, corriger l’indice de réfraction de la lame du microscope (nverre = 1,5175)11 en multipliant la valeur de mesure par pixel par nverre.
REMARQUE: Le n verre cité est pour le verre borosilicate. Les lames de microscope peuvent être fabriquées à partir de différents matériaux. Utilisez l’indice de réfraction approprié pour la diapositive mesurée. - Pour mettre à l’échelle la résolution de profondeur du myocarde, divisez la valeur de l’étape 1.2.9. par nmyocarde = 1,38 (valeur rapportée précédemment12).
2. Préparation de l’échantillon musculaire
- Préparez la plate-forme de dissection.
- Verser une partie de la solution de dissection (décrite dans le tableau 1)dans un petit bol en métal et placer au congélateur environ une heure avant l’excision cardiaque.
- Installez une plate-forme de dissection en vous assurant que la solution de dissection est bien oxygénée (100% d’oxygène) et a rincé à travers chacune des conduites de tuyauterie. Remplissez la chambre de dissection avec une solution de dissection oxygénée et attachez lâchement la suture 3/0 autour du cathéter de perfusion.
- Excisez le cœur.
- Anesthésier un rat Wistar âgé de 8 à 10 semaines à l’aide d’isoflurane gazeux (< 5% en oxygène). Confirmez l’anesthésie par pincement de la queue.
- Positionner le rat anesthésié en position couchée et injecter par voie sous-cutanée dans la région abdominale avec une solution d’héparine (1000 UI / kg). Maintenez l’anesthésie pendant cinq minutes de plus pour permettre à l’héparine de circuler.
- Récupérez le bol métallique contenant la solution de dissection du congélateur et placez-le près du banc d’euthanasie.
REMARQUE: Évitez de congeler complètement la solution de dissection pour permettre la submersion complète du cœur disséqué. - Transférer le rat anesthésié au banc d’euthanasie et l’euthanasier par luxation cervicale.
- Ouvrez la poitrine du rat avec des ciseaux, en coupant d’abord la paroi du corps le long de la face inférieure de la cage thoracique, puis le diaphragme, avant de continuer le long des bords latéraux de la cage thoracique. Soulevez la poitrine hors du chemin.
- Attrapez le cœur d’une main tandis que l’autre main utilise une paire de ciseaux incurvés pour couper les vaisseaux de connexion (aorte, veine cave, etc.).
- Imersez rapidement le cœur dans la solution de dissection à froid.
- Isoler un trabécule.
- Identifiez l’aorte lorsque le cœur est dans le bol en métal, puis transférez le cœur dans la chambre de dissection. À l’aide de deux pinces incurvées, tirez l’aorte sur la canule de perfusion.
- Maintenez l’aorte en place avec une pince. Pendant ce temps, ouvrez la ligne de tuyauterie pour permettre à la solution de dissection de s’écouler à travers la canule de perfusion.
REMARQUE: Essayez de terminer la perfusion dans la minute suivant l’excision cardiaque. - Une fois que le système vasculaire coronaire est débarrassé du sang et que le cœur est complètement perfusé avec la solution de dissection, arrêtez le flux de perfusion et fixez l’aorte en place à l’aide de la suture. Rallumez le flux et perfuser le cœur cannulé.
- Faites pivoter la canule de sorte que l’artère coronaire gauche soit visible sur la surface supérieure. Épinglez l’apex du cœur au bas de la chambre de dissection (Figure 5A). Couper les deux oreillettes (Figure 5B).
- Avec un jeu de ciseaux à ressort, couper le long du côté droit du septum jusqu’à l’apex du cœur (comme indiqué sur la figure 5B). Épinglez le ventricule gauche ouvert à la base de la chambre de dissection. Ensuite, coupez le long du côté gauche du septum, ouvrez le ventricule droit et épinglez-le également à la base de la chambre de dissection (Figure 5C).
REMARQUE: Afin d’épingler les ventricules en position ouverte, certains muscles papillaires devront être coupés. Identifier une trabécule libre dans le ventricule droit (Figure 5D-E). - À l’aide du ciseau à ressort et d’une pince, coupez le tissu mural entourant la trabécule, puis coupez le tissu mural en deux orthogonalement dans la direction de la trabécule. Coupez le tissu mural jusqu’à ce que sa dimension soit adaptée à la configuration de montage utilisée. Dans ce cas, environ la moitié de la taille d’une graine de sésame (Figure 5F).
REMARQUE: Les trabécules peuvent être disséquées à partir des ventricules droit et gauche, mais ceux de gauche sont généralement plus troubles et moins applicables aux mesures de sarcomère et de géométrie. - Laisser la trabécule excisée dans la chambre de dissection, en superfusant continuellement avec la solution de dissection.
3. Protocole expérimental
REMARQUE: Le périphérique13 utilisé pour cette expérience a été construit en interne et utilise un code de contrôle personnalisé. Les considérations nécessaires pour la conception d’un dispositif conçu pour reproduire ces données sont deux crochets de montage actionnés indépendamment, une chambre de mesure avec trois axes optiquement clairs(Figure 3)et une ligne de déclenchement externe qui synchronise les caméras à fond clair et OCT avec le stimulateur. Le signal de tension et de force PMT a été collecté à l’aide de cartes DAQ analogiques, les images de l’OCT et du microscope à champ lumineux ont été collectées à l’aide de cartes d’acquisition d’images Camera Link, et le signal de stimulus a été collecté à l’aide d’une carte d’E/S numérique. Les données ont été stockées hors ligne à l’aide d’un ensemble de boucles de consommateurs producteurs pour maintenir l’alignement temporel.
- Préparez le cardiomyomètre.
- Rincer l’eau chaude (~60 °C), l’eau distillée (température ambiante), puis la solution de superfusate à travers la chambre de mesure. Buller continuellement la solution de superfusate avec du carbogène.
- Allumez la source d’éclairage du microscope en champ clair et appuyez sur F1 pour activer la capture(Figure 4A). Ajustez manuellement le crochet en aval jusqu’à ce qu’il soit centré dans l’image en fond clair. Cliquez sur Axe zéro en aval, puis sur Désactivé en aval pour activer le moteur (Figure 4C). Déplacez le curseur DS Setpoint [um] jusqu’à ce que la fin du crochet s’aligne sur le bord de la région d’intérêt par défaut.
- Remettez à zéro l’axe aval, puis déplacez le curseur DS Setpoint [um] sur 1000. Répétez le processus avec le hook en amont, mais ne déplacez pas le curseur US Setpoint [um].
- Cliquez sur Déplacer vers le montage ( Figure4C).
- Démarrez le système d’éclairage par fluorescence en basculant l’interrupteur De lampe avant d’allumer rapidement les sous-systèmes du contrôleur en basculant l’interrupteur principal.
REMARQUE: Certaines sources de lumière UV produisent de grandes quantités d’ozone. Si tel est le cas, connectez un extracteur d’ozone à l’évent de sortie de la source lumineuse et assurez-vous qu’il fonctionne avant d’allumer la source d’éclairage de fluorescence. - Basculez le mode de fonctionnement sur Turbo-Blanking en appuyant sur le bouton Mode sur le panneau avant, suivi de 2, puis 1. Appuyez sur le bouton En ligne pour permettre au code de contrôle d’informer le fonctionnement.
- Montez la trabecula.
- Mettre en pause l’écoulement du superfusate à travers la chambre de mesure. Remplissez la chambre de montage avec la solution de dissection.
- À l’aide d’une seringue de 1 mL, transporter les trabécules de la chambre de dissection à la chambre de montage(Figure 5G).
- Pour transférer le trabécule, placez la seringue verticalement et en contact avec la surface de la solution de la chambre de montage. Laisser les trabécules descendre dans la chambre de montage par gravité(Figure 5H).
- Abaissez le niveau de fluide dans la chambre de montage afin qu’il soit au niveau de la section médiane des crochets.
- Ajustez la distance entre les crochets pour refléter la longueur relâchée de la trabécule en déplaçant le curseur DS Setpoint [um].
- À l’aide d’un microscope pour faciliter la visualisation, saisissez légèrement l’un des morceaux de tissu d’extrémité avec une pince et montez-le sur le crochet en amont. Montez l’autre morceau de tissu d’extrémité sur le crochet en aval (Figure 5I).
- Une fois solidement monté, déplacez le trabécule dans la chambre de mesure (Figure 5J) en appuyant sur Déplacer vers la chambre ( Figure4C). Reprendre l’écoulement du superfusate et l’extraction du fluide.
- Réglez la fréquence de stimulus [Hz] sur 1, la durée de stimulus [ms] sur 10 et la tension de stimulus sur 10. Commencez la stimulation en appuyant sur Stimulus On?.
- Préparez la trabécule.
- Après environ 1 h d’acclimatation, diminuez progressivement la tension de stimulus et la durée du stimulus par pas de 1 V et 1 ms, respectivement. Un ensemble typique de valeurs est de 3 V et 3 ms.
- Allumez le système d’éclairage en champ lumineux. Appuyez sur F1 et sélectionnez une région d’intérêt qui entoure une zone striée de l’interface utilisateur. Cliquez sur Calculer SL? pour calculer la longueur moyenne du sarcomère dans la région en surbrillance. Augmentez la longueur musculaire jusqu’à ce que la longueur moyenne du sarcomère soit de 2,32 μm en augmentant le curseur Point de consigne de séparation [um].
REMARQUE: Calculer SL? utilise un FFT 2D décrit à l’étape 4.3. La région d’intérêt utilisée pour calculer la longueur moyenne du sarcomère est généralement un carré de 100 μm à 150 μm. Par conséquent, à mesure que le muscle se rapproche de la longueur optimale du sarcomère, 43 à 65 sarcomères sont utilisés pour calculer la longueur moyenne du sarcomère. - Déplacez le muscle en ajustant le curseur Point de consigne central [um] sur l’onglet " Contrôle du centre et de laséparation (Figure 4C) de sorte que le bord du crochet en aval soit simplement visible dans l’image en champ clair. Collectez les informations de fluorescence pour dix contractions.
- Augmentez la valeur du point de consigne central [um] de 200 et collectez dix autres contractions d’informations de fluorescence. Répétez ce processus jusqu’à ce que l’image en champ clair contienne le crochet en amont. Recueillez la valeur des informations de fluorescence de la fenêtre finale.
- Remettez le trabécule à une position centrale en définissant la valeur Point de consigne central [um] sur 0.
- Réduisez la fréquence de stimulation à 0,2 Hz et passez du superfusate KH à la solution de charge Fura-2 (détaillé dans le tableau 1).
- Mesurez le signal de fluorescence toutes les 10 minutes en cliquant sur Activer la source de fluorescence dans l’onglet Stim et données. Visualisez le signal de fluorescence sur l’onglet Signal PMT.
- Une fois que le signal de 360 nm a été multiplié par 10 ou que la durée de la procédure de chargement a dépassé 2 h, ramener la fréquence de stimulation à 1 Hz et revenir à la solution de superfusate de KH.
- Vérifiez la mesure du rapport toutes les 10 minutes jusqu’à ce que la mesure du rapport se stabilise, moment auquel la collecte de données peut commencer.
- Collectez des données d’imagerie en champ clair et en fluorescence.
- Relévez le muscle à la position où le bord du crochet en aval est juste présent dans l’image en champ lumineux. Commencez à diffuser des données matérielles en continu en cliquant sur Diffuser les données sur le disque sous l’onglet Stim et données de l’interface utilisateur de contrôle matériel. Capturez les informations de fluorescence en cliquant sur Activer la source de fluorescence.
- Sur l’interface utilisateur d’imagerie en champ clair, définissez le mode de capture sur un déclencheur externe, augmentez la fréquence d’images à 100 Hz et définissez le nombre d’images à capturer sur 100. Appuyez sur Ctrl + Maj + S suivi de F1 pour enregistrer les données d’imagerie en champ clair pour cette fenêtre.
- Augmentez la valeur du point de consigne central [um] de 200 et répétez l’étape 3.4.2. Poursuivez avec le protocole de numérisation jusqu’à ce que les données d’imagerie aient été collectées pour la dernière fenêtre de l’étape 3.3.4.
- Remettez le trabécule à une position centrale en définissant la valeur Point de consigne central [um] sur 0.
- Collectez les données d’imagerie de l’OPO.
- Allumez la source laser OCT en tournant la touche principale sur la | , en appuyant sur le bouton d’alimentation, suivi du bouton SLDs.
- Couvrez la tête du galvanomètre et cliquez sur Obtenir BG pour mesurer le motif d’interférence d’arrière-plan et le soustraire de la mesure (Figure 4B).
- Réglez le mode de capture d’image sur live-view.
- Ajustez la position yjusqu’à ce que l’image B-scan contienne uniquement le crochet en amont. Divisez la longueur musculaire affichée sur le panneau avant de commande(Figure 4B)par deux et soustrayez la position yactuelle. Entrez cette valeur dansl’entrée" y- offset « . Ajustez la valeur "x-offset " jusqu’à ce que la section transversale de la trabécule soit centrée dans le cadre.
- Avec la trabécule centrée, balayez le long de l’axe yen ajustant la position y pourtrouver les positions correspondant aux crochets en amont et en aval. Notez ces positions vers le bas. Définissez plage Y (étapes) sur la différence absolue entre ces valeurs divisée par dix.
- Définissez le mode de capture d’image sur Stimulus Triggered?, Range X (étapes) sur 100, puis cliquez sur le bouton Définir les paramètres actifs.
- Cliquez sur Stream B-Scan Data ?, puis sur Acquire.
REMARQUE: Le protocole d’imagerie fermée nécessite 200 contractions pour capturer toute la géométrie musculaire pour un échantillon de 2 mm de longueur, ce qui correspond à un temps de capture d’environ 3 min 20 s.
4. Traiter le jeu de données d’images en champ clair
- Préparez les images pour l’analyse.
- Importer des images dans ImageJ (Fichier > Importer > Séquence d’images > Sélectionner une image).
- Augmenter le contrastede l’image ( Image > Ajuster > Luminosité/Contraste > Déplacer les curseurs Minimum et Maximum pour centraliser l’histogramme de l’image).
- Netteté des images (Process > Filters > Unsharp Mask > définir Radius (Sigma) sur 1,0 pixels et Mask Weight (0,1-0,9) sur 0,6).
- Exportez la séquence d’images (Enregistrer sous > Séquence d’images > Définissez le format sur PNG, Commencez à 0 et Chiffres (1-8) sur 4).
- Assemblez les images, mesurez le déplacement localisé et calculez les longueurs locales des sarcomères.
- Ouvrez « TrabeculaProcessing.m » (disponible sur demande) et définissez la variable FolderPath sur le dossier principal contenant toutes les données, et ImagePath sur le dossier où la séquence d’images de l’étape 4.1.4 a été enregistrée. Définissez les sections sur le nombre de fenêtres d’imagerie et le nombre d’images capturées par fenêtre.
- Exécutez le code.
REMARQUE : Les sorties seront présentes dans le chemin du dossier de sortie spécifié par l’utilisateur. (Par défaut, le chemin d’accès est défini sur FolderPath/Output).
- Technique de longueur de sarcomère FFT
- Utilisez un logiciel de traitement d’image pour effectuer une FFT sur une région de l’image où les sarcomères sont très visibles.
- Multipliez les pixels par μm des résultats d’étalonnage de l’étape 1.1.6 par 1,6 μm et 3,0 μm avant de calculer l’inverse pour obtenir la plage de fréquences spatiales d’intérêt.
- Ajustez une exponentielle au résultat FFT, en ignorant les informations de fréquence dans la plage de fréquences calculée à l’étape 4.3.2, et soustrayez-la du résultat de la transformation pour supprimer le terme DC.
- Ajuster une courbe gaussienne à la bande de fréquences d’intérêt.
- Calculer l’inverse du pic de la courbe gaussienne. Il s’agit de la longueur moyenne du sarcomère pour la région d’intérêt.
REMARQUE: Le calcul FFT et l’ajustement des équations exponentielles et gaussiennes ont été effectués à l’aide de code LabVIEW personnalisé.
5. Traiter les données de fluorescence
- Soustrayez l’autofluorescence dépendante de la fenêtre de la fenêtre respective et calculez le quotient des signaux associés aux longueurs d’onde d’excitation de 340 nm et 380 nm.
6. Traiter les données d’imagerie de l’OPO
- Préparez le jeu d’images de l’OPO pour la segmentation.
- Ouvrez ImageJ et importez les images (Fichier > Importer > Séquence d’images). Dans la fenêtre de l’explorateur de fichiers, cela s’ouvre, localisez les images, sélectionnez-en une et cliquez sur Ouvrir.
Remarque : Si le code de contrôle de l’OPO ne stocke pas les images dans un format lisible par ImageJ, convertissez-les au format PNG. - Pour faciliter la visualisation, organisez la séquence d’images dans une hyperstack (Image > Hyperstacks > Stack to Hyperstack). Dans la boîte de dialogue qui s’ouvre, définissez le nombre de tranches sur le nombre de B-scans par tranche et le X sur le nombre de tranches le long de la trabécule.
- Dessinez un rectangle qui entoure la trabécule. Vérifiez qu’il entoure l’ensemble du volume dans le temps à l’aide des curseurs de la fenêtre hyperstack. Recadrez l’image dans la fenêtre (Image > Recadrer).
- Supprimez les tranches qui contiennent des images des crochets de montage (Stacks > Tools > Slice Keeper). Sélectionnez la plage de tranches qui contient uniquement des informations sur les trabécules.
- Ouvrez ImageJ et importez les images (Fichier > Importer > Séquence d’images). Dans la fenêtre de l’explorateur de fichiers, cela s’ouvre, localisez les images, sélectionnez-en une et cliquez sur Ouvrir.
- Former la segmentation WEKA.
- Ouvrez la segmentation WEKA (Plugins > Segmentation > Segmentation Weka entraînable).
- Réglez le mode de sélection sur Main levée.
- Cliquez sur Paramètres et ajustez le classificateur et les paramètres de formation. (Pour ce modèle, les caractéristiques d’entraînement suivantes ont été utilisées : flou gaussien, filtre de Sobel, hessois, différence de gaussiens, projections membranaires, bilatérale et Lipschitz. L’épaisseur de la membrane a été réglée sur 1, la taille du patch membranaire sur 8, le sigma minimum sur 1 et le sigma maximum sur 32. Le classificateur a été défini sur FastRandomForest et les options du classificateur ont été définies sur : batchSize 100, maxDepth à 32, numFeatures à 32, numThreads à 0 et numTrees à 200.)
- Segmentez manuellement les images jusqu’à ce que la formation aboutie à des segmentations satisfaisantes.
- Enregistrez le classificateur.
- Segmenter les B-scans traités
- Lancez la segmentation WEKA après l’étape 6.2.1.
- Chargez le classificateur à partir de l’étape 6.2.5.
- Cliquez sur Créer un résultat.
- Convertissez les images en 8 bits (Image > Type > 8 bits).
- Convertissez les images en binaire (Process > Binary > Make Binary > Default method and default background).
- Enregistrer en tant que séquence d’images (PNG).
- Calculez le CSA moyen dans les images B-scan segmentées.
- Comptez le nombre de pixels blancs dans une image binaire B-scan.
- Multipliez la surface des pixels par la résolution de profondeur calibrée (à partir de l’étape 1.2) et 10 μm (la distance entre les balayages A voisins).
- Répétez l’opération pour tous les balayages B entre les crochets et la moyenne des mesures.
- Convertissez une image segmentée en maillage.
- Ouvrez « OCTmain.m » (disponible sur demande) et définissez imageDirectory sur le dossier contenant la sortie de l’étape 6.3.6. Définissez outputPath si nécessaire.
- Définissez les tranches sur la valeur « Plage Y (étapes) » (Étape 3.5.5) et les images sur la valeur « Répéter X » (Étape 3.5.6), z_dim sur la résolution de profondeur (Étape 1.2.10) et x_dim & y_dim sur la valeur affectée à 10.
- Cliquez sur Exécuter.
Résultats
Afin de capturer les informations régionales Ca2+ et de champ lumineux sur toute la longueur des trabécules présentées ici, sept positions musculaires étaient nécessaires. La figure 6 suggère que la force de contraction n’a pas été perturbée par ce mouvement, révélant qu’il n’y avait aucune dépendance de position de la production de force active.
Les B-scans collectés à l’aide de la tomographie par cohérence optique à une vitesse de 100 Hz ont été segmentés à l’aide du plugin ImageJ WEKA14 (Figure 7A). Chaque section transversale semble déformée en raison de la différence entre les résolutions latérales (10 μm) et de profondeur (1,73 μm (dans le myocarde)). Cette distorsion a été corrigée en mettant à l’échelle l’axe de profondeur de l’image par le rapport résolution latérale-profondeur. La figure 7B,C montrequ’après mise à l’échelle du C-scan brut de la trabécule, il est approximativement cylindrique en géométrie. La réflexion de la paroi de la chambre de mesure peut parfois se chevaucher avec les données musculaires (Figure 7A, B), mais le logiciel de segmentation peut être entraîné pour en tenir compte ( Figure7D, E). Une fois segmentée, la section transversale le long de la longueur du muscle peut être calculée tout au long de la contraction(Figure 7F). Notez que ce trabecula particulier a un petit appendice ramifié à partir de celui-ci. Le mouvement de la branche est évident ~0,75 mm le long de la trabécule. Enfin, les images segmentées peuvent être converties en maillages pour faciliter la construction de modèles géométriques(Figure 7G).
Les données d’imagerie capturées à chacune des différentes positions de trabécule à une vitesse de 100 ips ont été assemblées pour créer une seule image complète de la trabécule (Figure 8A). La résolution de ces images est de 0,535 μm/pixel. L’utilisation de fonctions de pondération linéaire dans les régions qui se chevauchent des fenêtres voisines facilite la visualisation et minimise l’impact de la vignette présente dans les images en champ clair. Pour mesurer le signal fluorescent, une fenêtre de 540 μm par 540 μm de la trabécule est éclairée cycliquement avec une lumière de longueur d’onde de 340 nm, 365 nm et 380 nm à une vitesse de 600 Hz. Le rapport de la fluorescence émise associée à la lumière d’excitation de 340 nm et 380 nm est corrélé au calcium intracellulaire après que la trabécule a été chargée de Fura-2. Comme cette mesure est un ratio, le taux de mesure effectif est de 200 Hz. Les transitoires ca2+ intracellulaires moyens(n = 10) de chaque fenêtre sont alignés avec la région où ils ont été imagés (Figure 8B). Alors que le pic des transitoires semble raisonnablement constant, le diastolique [Ca2+] est plus bas dans la région entre 900 μm et 1800 μm le long de la trabécule. De même, les résultats des calculs du suivi du déplacement (Figure 8C) et de la longueur du sarcomère (Figure 8D) indiquent également la présence d’une variabilité régionale. La technique de suivi sans marqueur utilisée est capable de traiter le déplacement de chaque pixel, avec suffisamment de contraste. Lors de la cartographie de la distribution des longueurs de sarcomères en post, une zone de corrélation croisée de 128 pixels par 128 pixels (~ 67 μm par 67 μm) a été utilisée pour calculer la longueur régionale des sarcomères. Cette zone encapsule environ 29 sarcomères lorsque la fermeture de l’échantillon est proche de la longueur optimale des sarcomères. La taille de l’étape (dans les directions x et y)entre le centroïde de chaque fenêtre de corrélation croisée a été définie sur 50 pixels (~ 26 μm) pour le traitement de ces données. La pertinence des estimations de longueur de sarcomère a été testée en fonction de la largeur et de l’amplitude de l’ajustement gaussien au signal FFT. Ces conditions n’étaient pas remplies dans la région musculaire comprise entre 0 μm et 500 μm, de sorte qu’aucune information sur la longueur du sarcomère n’a pu y être calculée. Compte tenu des déplacements associés, il est probable que les sarcomères de cette région se soient allongés pendant la phase contractile. Conformément à cette spéculation, les longueurs moyennes de sarcomères sur le côté droit de la trabécule raccourcissent au cours de cette période. En combinant les informations fournies par chacun des panneaux, il apparaît que la région ayant la plus grande section transversale ne produit pas la force la plus importante. En supposant que la variation régionale des transitoires Ca2+ a un gradient approximativement lisse, la figure 8B indique que la plus grande amplitude ca2+ transitoire se produit quelque part entre 1300 μm et 1600 μm le long de la trabécule. La carte de déplacement indique que la région qui subit le moins de mouvement s’aligne bien avec le pic Ca2+ transitoire. Cependant, cette région a les plus petites zones transversales de l’échantillon. Avec ces données à l’esprit, on pourrait en déduire que cette région a généré le plus de stress.

Figure 1: Image annotée du cardiomyomètre. Chacun des principaux composants optiques est décrit. L’encart contient un gros plan, vue arrière, de l’objectif du microscope in situ,sous la chambre de mesure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
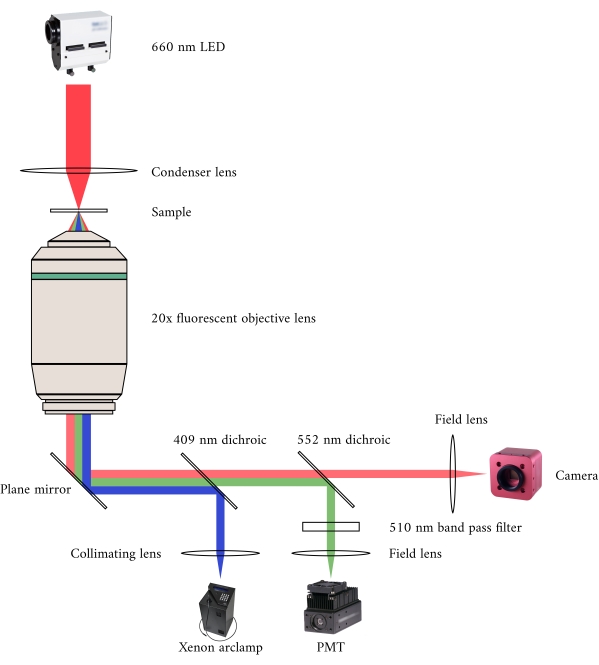
Figure 2: Voie optique pour la microscopie simultanée à fond clair et à fluorescence. La source d’éclairage du microscope à fluorescence est une lampe à arc au xénon, dont la sortie bascule cycliquement entre une lumière de 340 nm, 365 nm et 380 nm. Le chemin de sortie de la lampe à arc contient un miroir dichroïque avec une longueur d’onde de coupure de 409 nm qui réfléchit la lumière UV sur un miroir qui dirige la lumière vers un objectif de microscope à fluorescence. La lentille concentre la lumière d’excitation sur l’échantillon et recueille la lumière émise, qui a une longueur d’onde plus longue de 510 nm. Cette lumière émise passe à travers le premier miroir dichroïque, mais pas le second, car il a une longueur d’onde de coupure de 552 nm. Une lentille de champ focalise ensuite la lumière réfléchie sur le capteur du PMT. Pendant ce temps, la source d’éclairage (LED 660 nm) pour le microscope à fond clair est située au-dessus de l’échantillon. La lumière transmise est focalée sur l’échantillon par une lentille de condensateur, et l’objectif de fluorescence 20× capture l’image de transmission résultante. La longueur d’onde utilisée pour l’éclairage en champ lumineux dépasse la longueur d’onde de coupure de chaque miroir dichroïque, de sorte qu’elle traverse les deux avant que l’image ne soit focalisé sur le capteur d’une caméra CMOS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
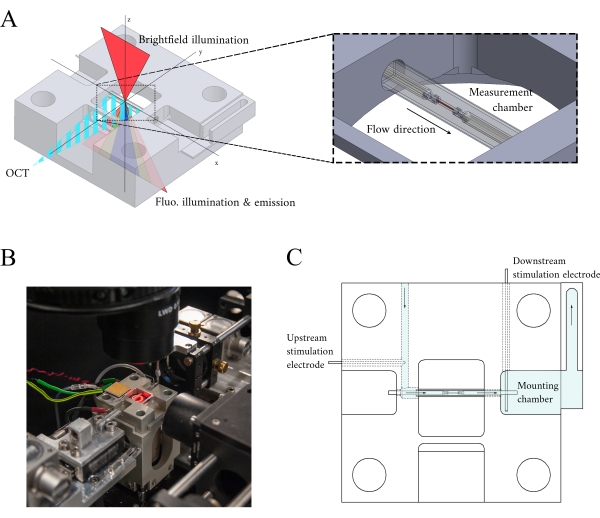
Figure 3: Conception du support de chambre de mesure. (A) Vue isométrique du support de chambre de mesure avec des chemins optiques superposés. L’éclairage en champ lumineux se produit à partir de la surface supérieure (axez); l’éclairage de fluorescence se produit à partir de la surface inférieure (axez),et le signal OCT du bras de mesure est orthogonal à l’autre axe d’éclairage (axey). Au cours de l’expérience, deux crochets en platine maintiennent une trabécule dans un tube capillaire en verre qui fonctionne comme la chambre de mesure. Les moteurs à bobine vocale contrôlent chaque crochet et leurs positions sont mesurées à l’aide de l’interférométrie laser. La position actuelle est comparée à un point de consigne défini par l’utilisateur et, à l’aide d’un contrôleur PID codé dans un FPGA, l’erreur est minimisée. (B) Chambre de mesure in situ avec l’éclairage en champ lumineux allumé. La vue arrière est illustrée dans l’encart de la figure 1. (C) Schéma de l’écoulement du superfusate à travers le support de la chambre de mesure. Le superfusate pénètre à l’arrière du bloc et s’écoule dans la direction indiquée par des flèches. Les électrodes en amont et en aval établissent la stimulation du champ pour provoquer la contraction d’une trabécule montée dans la chambre de mesure. L’ombrage bleu indique les régions où le superfusate s’écoule au cours d’une expérience. Veuillez cliquer ici pour voir une version agrandie de cette figure.
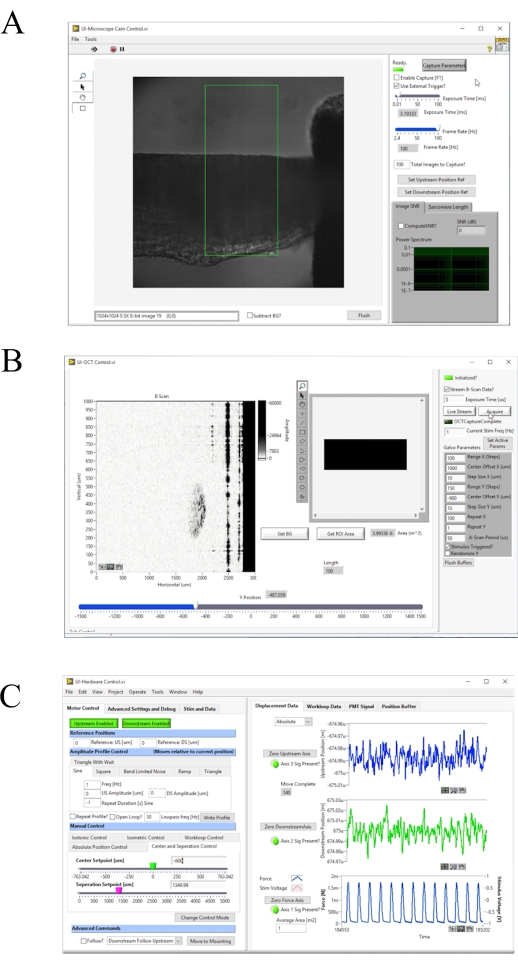
Figure 4: Panneau avant du logiciel d’acquisition et de contrôle d’images. (A) Interface utilisateur d’imagerie en champ clair. ( B )Interfaceutilisateur d’imagerie de l’OPO. (C) Interface utilisateur de contrôle matériel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
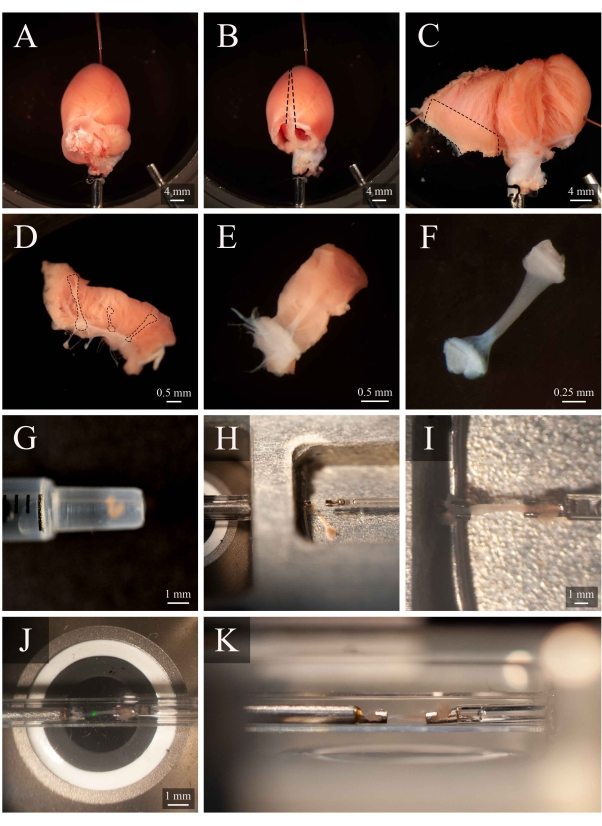
Figure 5: Dissection de Trabecula et protocole de montage. (A) Cœur de rat perfusé de Langendorff dans la chambre de dissection. (B ) Le même cœur avec les oreillettes enlevées. Les lignes pointillées indiquent la trajectoire d’excision pour ouvrir les ventricules. (C) Un cœur ouvert pour exposer l’intérieur des deux ventricules. La case pointillée indique la région où se trouvent généralement les trabécules. (D) Région de la paroi ventriculaire droite excisée (la même que celle indiquée par la case en pointillés en C). Les lignes pointillées mettent en évidence trois trabécules. (E) Une trabécule choisie parmi les trois en D. (F) La trabécule du panneau E avec le tissu mural enlevé. (G) Trabécule isolé à l’extrémité d’une seringue de 1 mL. (H) La trabécule dans la chambre de montage. (I) La trabécule montée entre deux crochets en platine. (J) La trabécule, montée entre crochets, à l’intérieur de la chambre de mesure (Figure 3B). La tache verte est un artefact du premier filtre dichroïque. (K) Angle secondaire de la trabécule montée à l’intérieur de la chambre de mesure. La distance entre la trabécule et la lentille de l’objectif du microscope est d’environ 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
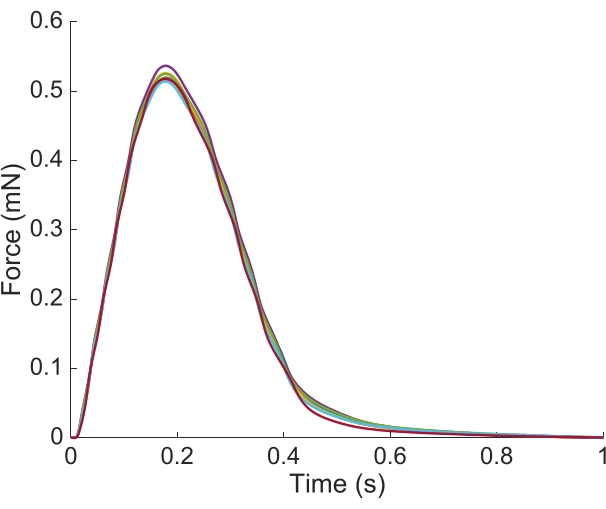
Figure 6: Dépendance de la position de la mesure de la force. La force produite par le muscle à partir de chacune des positions d’imagerie (n = 7) superposée. La production moyenne de force active était de 0,527 mN ± 0,003 mN, le temps jusqu’à 50 % de contraction 77,1 ms ± 0,3 ms, et le temps jusqu’à 50 % de relaxation 328,1 ms ± 0,9 ms (toutes les données sont présentées comme la moyenne ± SE). Veuillez cliquer ici pour voir une version agrandie de cette figure.
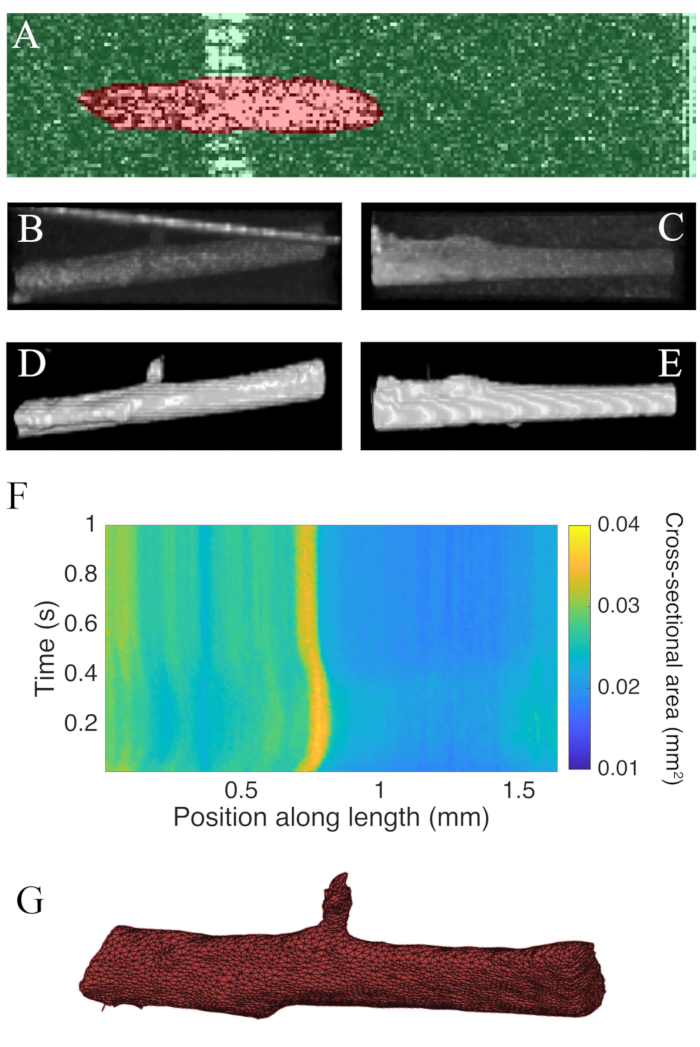
Figure 7: Analyse d’imagerie OCT. (A) Exemple de segmentation WEKA. La section transversale segmentée du muscle est surlignée en rouge et l’arrière-plan est surligné en vert. (B) Vue supérieure des données brutes C-scan d’un trabecula. La ligne inclinée brillante vers le haut de l’image est le reflet de la paroi de la chambre de mesure. (C) Vue latérale des données brutes C-scan d’un trabecula. (D) Vue supérieure des données segmentées de l’OPO. (E) Vue latérale des données segmentées de l’OCT. (F) La section transversale le long de la trabécule (axedes x)à travers le temps (axedes y). La section transversale moyenne le long de la longueur musculaire était de 0,0326 mm2 ± 0,0005 mm2 (moyenne ± S.E.) (G) Maille de la trabécule. Le maillage a été approximativement aligné avec le tracé en coupe transversale du panneau F. Veuillez cliquer ici pour voir une version plus grande de cette figure.
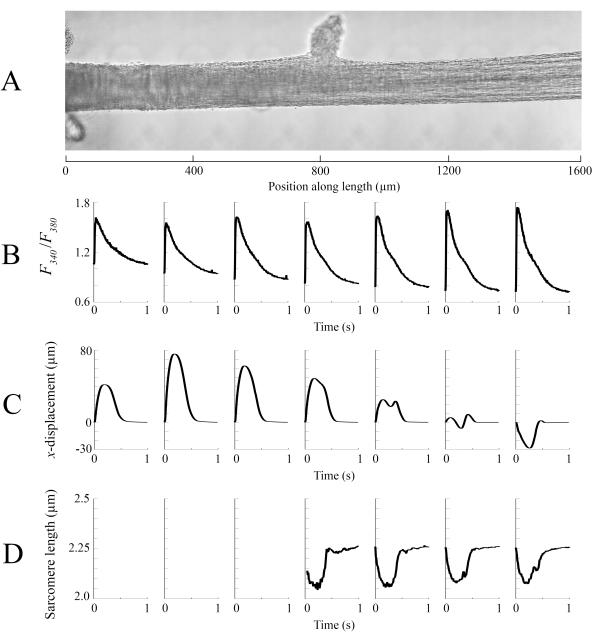
Figure 8: Analyse par imagerie en champ clair et en fluorescence. (A) Image cousue (sept fenêtres d’imagerie) de la trabécule. (B) Ca2+ transitoires le long de la trabécule. (C) Déplacement xmoyen de chaque fenêtre d’imagerie. Un déplacement positif représente un mouvement vers la droite et un mouvement négatif vers la gauche. (D) Longueurs moyennes des sarcomères de chaque fenêtre d’imagerie pouvant avoir le contraste d’image nécessaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Tableau des solutions Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Dans cette étude, nous présentons une configuration qui permet l’assemblage de trois systèmes optiques combinant l’imagerie en champ lumineux, en fluorescence et en OCT pour recueillir des données à partir d’un trabécule cardiaque ex vivo en contraction active(Figure 1 et Figure 2). Une telle intégration orchestrée est possible grâce à la conception de la chambre de mesure(Figure 3)pour permettre la disposition orthogonale de l’OCT à l’axe champ lumineux-fluorescence. Le système de montage musculaire joue un rôle tout aussi important dans le succès des quantifications simultanées d’indices clés dans la caractérisation de la dynamique d’excitation-contraction du muscle cardiaque. Sa nouveauté réside dans la possibilité de procédures de balayage musculaire sans perturbation apparente des performances mécaniques du muscle (Figure 6). Avec la configuration d’imagerie combinée et le système de crochet motorisé pour la mesure de la force, ce système peut évaluer l’hétérogénéité régionale dans la longueur transitoire, le déplacement et le sarcomère Ca2+, ainsi que les informations géométriques macroscopiques d’un trabécule en contraction tout au long du cours du temps de la contraction (Figures 7 et Figure 8).
Compte tenu de l’omniprésence des systèmes d’imagerie par épifluorescence en champ clair au sein des laboratoires de recherche cardiaque, la reproduction de ces résultats peut être obtenue avec quelques considérations matérielles mineures. Nous présentons ici la boîte à outils de traitement d’image pour combiner l’épifluorescence en champ clair et l’OCT, ce qui est essentiel pour analyser l’hétérogénéité contractile sous-jacente. L’intégration de l’OCT nécessite un chemin optique dégagé, tandis que l’imagerie fermée nécessite une ligne de déclenchement externe entre le stimulus et la caméra d’imagerie OCT et en champ lumineux, ainsi que des crochets de montage musculaire capables de déplacer l’échantillon dans toute la chambre de mesure. Les logiciels et méthodes de post-traitement requis sont disponibles gratuitement. En particulier, le logiciel de segmentation utilisé, WEKA14, est open-source. La technique de suivi sans marqueur des points dematériau 8,de la longueur du sarcomère, de l’imagerie volumétrique fermée10et des codes de génération de maillage est également accessible et peut être mise à disposition sur demande auprès de l’auteur correspondant.
La viabilité musculaire, la charge optimale de Fura-2 et la mise au point de l’image sont les trois piliers qui forment les bases d’une expérience réussie. L’utilisation d’une solution de dissection contenant du BDM pour prévenir la contracture, le transport du muscle dans une seringue, l’oxygénation continue de la solution et la préparation de nouvelles solutions expérimentales le jour d’une expérience contribuent tous à un taux de viabilité musculaire élevé. Avant de charger le trabecula avec Fura-2AM, l’autofluorescence doit être collectée pour chaque condition que l’on est intéressé à étudier car elle peut avoir un effet significatif sur le transitoire Ca2+ mesuré15. L’oxygénation de la solution de charge Fura-2AM est compliquée par l’inclusion nécessaire du tensioactif pluronic-F127 pour faciliter la charge de colorant. Pour lutter contre la formation excessive de bulles résultante de ce tensioactif, une petite goutte d’anti-mousse dans la solution de chargement permet à l’utilisateur d’augmenter le taux d’oxygénation, améliorant ainsi les chances que le trabecula maintienne sa viabilité fonctionnelle tout au long du processus de chargement. Enfin, la mise au point de l’imagerie doit être uniforme le long de la longueur musculaire pour maximiser le rapport signal/bruit des informations de champ lumineux et de fluorescence.
Il y a deux limites à considérer avec les méthodes présentées ici. Le premier est la résolution spatiale du microscope à fluorescence. Alors que les résolutions spatiales de l’OCT et de l’imagerie en champ clair sont élevées, la résolution du microscope à fluorescence est limitée à l’intégrale de la fluorescence à partir du volume capturé dans une fenêtre d’imagerie de 540 μm par 540 μm. Il est possible d’augmenter la résolution spatiale du microscope à fluorescence en utilisant une caméra à couplage de charge à gain élevé, au lieu d’un PMT, pour capturer le signal de fluorescence au détriment du rapport signal / bruit16. Le deuxième est le diamètre de la trabécule qui peut être étudié en termes de longueur de sarcomère mesurable et de profondeur géométrique. L’approche FFT fenêtrée pour le calcul de la longueur des sarcomères exploite l’avantage d’une résolution spatiale améliorée mais est associée à une robustesse réduite(Figure 8D). Dans les cas où des trabécules troubles ou de grand diamètre doivent être étudiées, la résolvabilité de la FFT sera considérablement réduite en raison du contraste réduit associé à la bande sarcomérique dans des échantillons de tissus plus grands. De même, dans l’OCT, les rétroréflexions d’une profondeur d’imagerie supérieure à 300 μm seront trop faibles pour être résolues pendant la phase de segmentation. Par conséquent, notre technique est limitée aux trabécules d’un diamètre inférieur à 300 μm. Cependant, il n’est pas recommandé d’étudier des échantillons de grand diamètre car il peut y avoir des problèmes d’oxygénation diffusive du noyau musculaire lors de taux élevés de stimulation17.
Notre méthode permet d’évaluer la fonction mécanique ionique en association avec la géométrie musculaire dans les muscles sains et malades, fournissant une approche puissante pour comprendre la physiologie, la physiopathologie et la pharmacologie du muscle cardiaque. Le pipeline de traitement d’images décrit ici extrait des données qui seront essentielles pour mieux comprendre l’hétérogénéité contractile. Une façon de réaliser pleinement le potentiel d’un ensemble de données aussi riche est la construction de modèles mathématiques qui intègrent et interprètent ces données, et de faire des prédictions qui peuvent être testées expérimentalement à l’aide de notre appareil.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par des bourses de doctorat de l’Université d’Auckland (attribuées à JD et MC), des bourses de recherche en santé Sir Charles Hercus (20/011 et 21/116) du Health Research Council of New Zealand (attribuées à J-CH à KT, respectivement), une bourse de doctorat décernée par la National Heart Foundation (attribuée à AA), des subventions Marsden Fast-Start (UOA1504 et UOA1703) de la Royal Society of New Zealand (décernées à J-CH et KT, respectivement), et une bourse de recherche James Cook de la Royal Society of New Zealand (décernée à AT). Le développement original de cet instrument a été financé par une subvention Marsden (11-UOA-199) de la Royal Society of New Zealand (attribuée à AT et PN).
matériels
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
Références
- Han, J. -C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250(2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398(2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon