Method Article
في وقت واحد برايتفيلد، فلورسينس، والتصوير الطبوغرافي التماسك البصري من التعاقد ترابيكولاي القلب السابق فيفو
In This Article
Summary
يقدم هذا البروتوكول مجموعة من ساركومير والكالسيوم والبيانات الهندسية العيانية من ترابيكولا القلب المتعاقدة بنشاط مع الجسم الحي السابق. ويمكن إجراء هذه القياسات المتزامنة من خلال دمج ثلاث طرق للتصوير.
Abstract
في عضلة القلب، يقوم العابرون داخل الخلية Ca2+ بتنشيط العضلات العضلية المنقبضة، مما يسبب انكماشا وتقصيرا بالمنظار وتشوها هندسيا. كان فهمنا للعلاقات الداخلية بين هذه الأحداث محدودا لأننا لا نستطيع "الرؤية" داخل العضلة ولا تتبع بدقة الطبيعة الزمنية لديناميكيات الإثارة والانكماش. لحل هذه المشاكل، قمنا ببناء جهاز يجمع بين مجموعة من طرائق التصوير. على وجه التحديد ، فإنه يدمج المجهر مشرق لقياس التغيرات المحلية من طول الساركومير وسلالة الأنسجة ، ومجهر مضان لتصور Ca2 + عابرة ، ودموغرافيا التماسك البصري لالتقاط التغيرات الهندسية للأنسجة طوال الدورة الزمنية لدورة القلب. نقدم هنا البنية التحتية للتصوير وإطار جمع البيانات المرتبط به. يتم جمع البيانات من هياكل الأنسجة المعزولة الشبيهة بالقضبان المعروفة باسم trabeculae carneae. في أداتنا، زوج من السنانير البلاتينية التي تسيطر عليها الموقف عقد كل نهاية عينة العضلات فيفو السابقين في حين يتم فرضه باستمرار مع محلول ملحي الغنية بالمغذيات. السنانير تحت سيطرة مستقلة، مما يسمح السيطرة في الوقت الحقيقي من طول العضلات والقوة. تتيح الترجمة بالطول المسح الضوئي للعينة، والتغلب على القيود المرتبطة بالحجم النسبي لنافذة التصوير بالمجهر (540 ميكرومتر في 540 ميكرومتر) وطول ترابيكولا نموذجي (>2000 ميكرومتر). الأقطاب البلاتينية في أي من طرفي غرفة العضلات تحفز trabecula بمعدل يحدده المستخدم. نحن نستغل إشارة التحفيز كمحفز لمزامنة البيانات من كل نافذة تصوير لإعادة بناء العينة بأكملها في ظل ظروف ثابتة. تطبيق تقنيات معالجة الصور على هذه البيانات التصوير brightfield يوفر إزاحة الأنسجة وخرائط طول الساركومير. ومن شأن هذه المجموعة من البيانات، عند دمجها في خط أنابيب لنمذجة التجارب، أن توفر فهما أعمق لتجانس العضلات الانقباشية وعدم التجانس في علم وظائف الأعضاء والفيزيولوجيا المرضية.
Introduction
Superfusion من مستحضرات أنسجة عضلة القلب المعزولة هو بروتوكول قياسي ويستخدم على نطاق واسع لدراسة تنشيط القلب الأيونية والميكانيكا1. على وجه الخصوص ، فإن عزل trabeculae ، الهياكل الشبيهة بالقضبان من الجدران البطينية ، مكن من تقييم الظواهر بما في ذلك التنشيط المعتمد على الطول للانكماش2، والاستجابة المعتمدة على التمدد للانكماش3،4، واللزوجة الانبساطية 5 منأنسجة القلب. تير Keurs، البادئ من هذه التقنية من الترابكولا المعزولة superfusing، استخدمت في البداية مزيجا من التصوير الفلوري للقياسات Ca2 + والحيود الليزر لتحديد أطوال ساركومير2،5. منذ هذه الدراسات المبكرة ، أصبح من الشائع بشكل متزايد استخراج معلومات طول الساركومير بدقة مكانية أكبر باستخدام تقنيات تحويل فورييه السريعة 2D (FFT) المستندة إلى6 على صور المجهر المشرق. يسمح نظاما التصوير بتقييم جزئي للعلاقة الأساسية بين إطلاق Ca2+ وإنتاج القوة المعتمدة على طول الساركومير.
يتم إعادة محاولة عضلة القلب ، مع ربط مرئية المرتبطة سلسلة الكامنة وراء وحدات انقباش تتكون من خيوط سميكة وسميكة. التفاعل بين هذه خيوط المكونة التي تشكل sarcomeres يكمن وراء توليد القوة، والتي تبدأ على النحو التالي: إشارة كهربائية إزالة الاستقطاب، أو إمكانات العمل، ويسبب الجهد تعتمد على نوع L قنوات Ca2 + في غشاء الخلية لفتح؛ تدفق الخلوية التي تلت ذلك من Ca2 + يحفز الإفراج عن Ca2 + من reticulum الساركوبلازمي (ريال)، وهو مخزن Ca2 + داخل الخلية، في عملية تعرف باسم Ca2 +-المستحث Ca2 + الإصدار7؛ هذه الزيادة المفاجئة في تركيز Ca2 + داخل الخلية من نانومولار إلى نطاق الكائنات الدقيقة تمكن من إنتاج القوة. مضخات Ca2+ تقذف باستمرار Ca2+ من السيتوسول مرة أخرى إلى المقصورة SR وخارج الخلية؛ عندما يعود تركيز Ca2+ داخل الخلية إلى نطاق النانومولار ، يتوقف إنتاج القوة ، وتسترخي العضلات. أثناء إنتاج القوة، تنزلق خيوط سميكة ورقيقة مكونة فوق بعضها البعض. طول الساركومير يملي المدى النسبي للتداخل، وبالتالي، فإن إمكانية إنتاج القوة من العضلات بالمنظار.
في هذه الورقة، نقوم بتوسيع تقنيات التصوير الفلورية-برايتفيلد لتشمل التصوير المقطعي للتماسك البصري (OCT). أكتوبر يستخدم المبدأ المادي للتدخل وقادرة على الحصول على تشوه هندسي من الأنسجة لفهم العضلات الانقباش التغايرية8. يستخدم جهازنا(الشكل 1)نظام OCT (SD-OCT) الطيفي. في SD-OCT، يقسم مقسم الحزمة الضوء من صمام ثنائي فائق الوميض قصير النطاق بطول التماسك إلى أذرع مرجعية وقياسية. الذراع المرجعية تحتوي على مرآة ثابتة، وذراع القياس يحتوي على مقياس 2D-galvanometer لتوجيه الضوء. يتم جمع ضوء backscattered من العينة ويتداخل مع الضوء المنعكس في الذراع المرجعية لتشكيل نمط التداخل. يتم ترميز معلومات العمق في تردد هامش الطيفية. لاستخراج المعلومات، يتم تمرير الإشارة من خلال مطياف ويتم تطبيق FFT معكوس على النتيجة. تمثل الإشارة 1D المقابلة الهياكل في أعماق مختلفة ، بما يتوافق مع التغيرات في مؤشر الانكسار9 (A-scan). من خلال توجيه الليزر في محور واحد ، يمكن للمرء بناء مقطع عرضي من عينة من الاهتمام (B - المسح الضوئي) ، وبالمثل ، عن طريق تكرار العملية في نمط خطوة الحكمة في المحور المتبقي ، يمكن إنشاء صورة ثلاثية الأبعاد (C - المسح الضوئي). وبالتالي ، يمكن للمرء أن جمع سلسلة من باء بمسح في شريحة واحدة لتكرار الوقت متفاوتة الموضوع على أساس الزناد الخارجي وتكرار لتوليد مسح ثلاثي الأبعاد ، وهو ما يمثل صورة مخطط متغيرة زمنيا10.
في دمج أنظمة التصوير الثلاثة، قمنا بالنظر في المبدأين التاليين. أولا، لا ينبغي لأجهزة استشعار التصوير أن تكتشف الضوء من طريقة تصوير بديلة، وثانيا، ينبغي أن يحتوي التصميم المادي على مساحة حرة لثلاث طائرات تصوير متزامنة على الأقل. لمعالجة المطلب الأول، يستخدم المجهر برايتفيلد الصمام الطول الموجي 660 نانومتر لإلقاء الضوء على العينة في تكوين مقلوب. المجهر الفلوري هو في تكوين epifluorescence حيث يتم استخدام نفس العدسة الموضوعية لكل من الإثارة وجمع الضوء المنبعث. ضوء الإثارة لديه الطول الموجي بين 340 نانومتر و 380 نانومتر، وأنبوب فوتوموليبير (PMT) يقيس الضوء المنبعث على طول موجي من 510 نانومتر. زوج من المرايا ديكهرويك تمكين هذين المسارين البصرية لتقاسم نفس البصمة المادية دون التدخل في القياس المعاكس(الشكل 2). وأخيرا، يستخدم OCT ضوء النطاق العريض (100 نانومتر عرض الطيفي) مع الطول الموجي المركزي من 840 نانومتر، متميزة عن الطريقتين الأخريين. ونظرا لطبيعة الإضاءة المستخدمة في أكتوبر منخفضة التماسك، فإن أي ضوء متناثر من مصادر التوهج الساطع لن يساهم في نمط التداخل الذي يشفر معلومات العمق. بالنسبة للشرط الثاني ، يحتوي تصميم السكن للأنبوب الشعري على مسارات بصرية يمكن الوصول إليها إلى الطائرات الأمامية والدنيئة والمتفوقة للعينة. خلال التجارب، يحمل خطان بلاتينيان ترابيكولا داخل أنبوب شعري متغلغل في محلول كريبس-هنسيليت (KH) المؤكسيج. رئيس galvanometer من أكتوبر هو موجه بشكل متعامد إلى مسار التصوير مشرق مضان للاستفادة من الطائرة البصرية المتعامدة الثالثة(الشكل 3).
تحدد هذه الورقة اعتبارات التصميم لبناء جهاز قادر على تصوير الكالسيوم وطول الساركومير وهندسة العضلات في وقت واحد. ولإثبات قدرات القياس هذه، فإننا نصف عملية عزل الترابيكولا البطينية، وإعداد الحلول العازلة اللازمة، إلى جانب الخطوات الحاسمة التي ينطوي عليها التعامل مع الترابيكولا في الجسم الحي السابق وتحميلها بفلور. وأخيرا، توضح هذه الورقة العمليات المطلوبة لترجمة مجموعة البيانات إلى مرئيات أكثر فائدة.
Protocol
ووافقت لجنة أخلاقيات الحيوانات في جامعة أوكلاند على التعامل مع الجرذان وإعداد عينات من الأنسجة.
1. معايرة التصوير
- معايرة بكسل المجهر برايتفيلد
- ملء غرفة القياس بالماء المقطر.
- ضع صريف الحيود مع خطوط معروفة لكل ميكرومتر في غرفة القياس.
- اضغط F1 لتمكين التقاط وضبط معدل الإطار [هرتز] حتى صريف الحيود مرئيا بوضوح(الشكل 4A). تأكد من أن صريف الحيود يسير بالتوازي مع حافة الإطار. اضغط F1 مرة أخرى لإيقاف الالتقاط.
- تعيين إجمالي الصور لالتقاط؟ إلى واحد، اضغط على Ctrl + Shift + S لبث البيانات إلى القرص، واضغط F1 لالتقاط صورة لصر الحيود.
- فتح ImageJ واستيراد صورة صريف الحيود (ملف > فتح > حدد صورة المعايرة). عقد التحول ، ورسم خط يشمل 20 عصابات الضوء والظلام من صريف الحيود.
- معايرة الصورة (تحليل > تعيين مقياس). طول السطر من الخطوة 1.1.5 تعيين المسافة في قيمة بكسل. تعيين قيمة المسافة المعروفة إلى 20 مرة الخطوط لكل قياس ميكرومتر ووحدة الطول إلى μm. عكس المقياس هو عدد الميكرومترات التي يمثلها بكسل.
- معايرة دقة عمق OCT
- قياس سمك شريحة المجهر الزجاجي باستخدام الفرجار فيرنييه.
- قم بتشغيل مصدر ليزر OCT.
- قم بتغطية رأس مقياس الغالفانوميتر وانقر على الحصول على BG لقياس نمط التداخل الخلفي وطرحه من القياس(الشكل 4B).
- قم بتثبيت شريحة المجهر الزجاجي المقاس (من الخطوة 1.2.1) في ذراع القياس في OCT.
- انقر فوق البث المباشر لعرض صورة OCT. اضبط شريحة المجهر الزجاجي حتى تصبح مرئية داخل المسح الضوئي B.
- لالتقاط صورة المسح الضوئي B، قم بتعيين النطاق Y (خطوات) إلى واحد، انقر فوق Stream B-scan Data؟، وانقر فوق الحصول على.
- استيراد صورة المسح الضوئي B إلى ImageJ (ملف > فتح > حدد B-المسح الضوئي). عقد التحول ، ورسم خط فاصل بين حدود الشريحة المجهر الزجاجي.
- تعيين المقياس (تحليل مقياس مجموعة >). تعيين المسافة المعروفة إلى القياس الذي تم جمعه في الخطوة 1.2.1.
- لحساب دقة العمق في الهواء، قم بتصحيح مؤشر الانكسار لشريحة المجهر(n glass = 1.5175)11 بضرب القياس لكل قيمة بكسل بالزجاجn.
ملاحظة: الزجاج n مقتبس هو للزجاج البوروسيليكات. يمكن إجراء شرائح المجهر من مواد مختلفة. استخدم الفهرس الانكسار المناسب للشريحة التي تم قياسها. - لتوسيع نطاق دقة العمق لميكارديوم، قسم القيمة من الخطوة 1.2.9. بواسطة nعضلة القلب = 1.38 (القيمة التي تم الإبلاغ عنها سابقا12).
2. إعداد عينة العضلات
- إعداد تلاعب تشريح.
- صب بعض من حل تشريح (المبينة في الجدول 1)في وعاء معدني صغير ووضعها في الثلاجة حوالي ساعة قبل استئصال القلب.
- إعداد جهاز تشريح ضمان حل تشريح هو المؤوكسجين بشكل جيد (100٪ الأكسجين) ومسح من خلال كل من خطوط الأنابيب. ملء غرفة تشريح مع محلول تشريح المؤوكسجين وربط فضفاضة 3/0 خياطة حول القسطرة perfusion.
- استأصل القلب.
- تخدير الفئران Wistar 8-10 أسابيع من العمر باستخدام isoflurane الغازية (< 5٪ في الأكسجين). تأكيد التخدير عن طريق قرص الذيل.
- وضع الفئران تخدير في موقف سوبين وحقن تحت الجلد في منطقة البطن مع محلول الهيبارين (1000 وحدة دولية / كجم). الحفاظ على التخدير لمدة خمس دقائق أخرى للسماح للهابارين لتعميم.
- استرداد وعاء معدني يحتوي على حل تشريح من الثلاجة ووضعه بالقرب من مقاعد البدلاء القتل الرحيم.
ملاحظة: تجنب تجميد محلول التشريح تماما لتمكين الغمر الكامل للقلب المسلخ. - نقل الفئران المخدرة إلى مقاعد البدلاء القتل الرحيم والقتل الرحيم عن طريق خلع عنق الرحم.
- فتح الصدر الفئران مع مقص، أولا قطع جدار الجسم على طول الجانب السفلي من القفص الصدري، ثم الحجاب الحاجز، قبل المضي قدما على طول الحدود الجانبية لل القفص الصدري. ارفع الصدر عن الطريق
- الاستيلاء على القلب بيد واحدة في حين أن اليد الأخرى يستخدم زوج من مقص منحني لقطع الأوعية ربط (الشريان الأورطي، فينا كافا، الخ).
- غمر القلب بسرعة في محلول تشريح الباردة.
- عزل ترابيكولا.
- التعرف على الشريان الأورطي بينما القلب في وعاء معدني، ثم نقل القلب إلى غرفة تشريح. باستخدام اثنين من ملقط منحني، سحب الشريان الأورطي على قنية التغلغل.
- عقد الشريان الأورطي في مكان مع ملقط واحد. وفي الوقت نفسه، افتح خط الأنابيب للسماح لمحلول التشريح بالتدفق عبر قنية التشوه.
ملاحظة: تهدف إلى إكمال التخبط في غضون دقيقة بعد استئصال القلب. - بمجرد تطهير الأوعية التاجية من الدم ويتم تغلغل القلب تماما مع محلول التشريح ، ووقف تدفق التشوه ، وتأمين الشريان الأورطي في مكانه باستخدام الغرز. بدوره تدفق مرة أخرى على وتشويش القلب cannulated.
- تدوير القنية بحيث الشريان التاجي الأيسر مرئيا على السطح متفوقة. دبوس قمة القلب إلى أسفل غرفة تشريح (الشكل 5A). قطع كل من الأذينين (الشكل 5B).
- مع مجموعة من مقص الربيع، وقطع على طول الجانب الأيمن من الحاجز إلى قمة القلب (كما هو مبين في الشكل 5B). تثبيت البطين الأيسر فتح إلى قاعدة غرفة تشريح. ثم قطع على طول الجانب الأيسر من الحاجز، وفتح البطين الأيمن، ودبوس على قاعدة غرفة تشريح، أيضا(الشكل 5C).
ملاحظة: من أجل تثبيت البطينين في وضع مفتوح، يجب قطع بعض العضلات الحليمية. تحديد trabecula حرة في البطين الأيمن (الشكل 5D-E). - باستخدام مقص الربيع ومملقط، وقطع أنسجة الجدار المحيطة trabecula، ثم قطع أنسجة الجدار في نصف متعامدة إلى اتجاه trabecula. تقليم أنسجة الجدار حتى بعدها هو المناسب لتكوين تصاعد المستخدمة. في هذه الحالة، ما يقرب من نصف حجم بذور السمسم (الشكل 5F).
ملاحظة: يمكن تشريح ترابيكولا من البطينين الأيمن والأيسر، ولكن تلك من اليسار عادة ما تكون أكثر عكر وأقل قابلية للتطبيق لقياسات الساركومير والهندسة. - ترك trabecula المقتطعة في غرفة تشريح، والتخبط باستمرار مع حل تشريح.
3. البروتوكول التجريبي
ملاحظة: تم إنشاء الجهاز13 المستخدم لهذه التجربة في المنزل ويستخدم رمز التحكم المخصص. الاعتبارات اللازمة لتصميم جهاز بنيت لتكرار هذه البيانات هما خطاطيف تصاعد تعمل بشكل مستقل، وغرفة قياس مع ثلاثة محاور واضحة بصريا(الشكل 3)،وخط الزناد الخارجي الذي يتزامن مع الكاميرات brightfield وأكتوبر مع المحفز. تم جمع الجهد PMT وإشارة القوة باستخدام بطاقات DAQ التناظرية ، وتم جمع الصور من أكتوبر والمجهر برايتفيلد باستخدام بطاقات الكاميرا لينك الإطار المختطف ، وتم جمع إشارة التحفيز باستخدام بطاقة الإدخال / إخراج رقمية. تم تخزين البيانات دون اتصال باستخدام مجموعة من حلقات المستهلك المنتج للحفاظ على المحاذاة الزمنية.
- إعداد مقياس عضلة القلب.
- تدفق المياه الساخنة (~ 60 درجة مئوية) ، والمياه المقطرة (درجة حرارة الغرفة) ، ومن ثم حل superfusate من خلال غرفة القياس. فقاعة باستمرار الحل superfusate مع كاربوجين.
- بدوره على مصدر الإضاءة المجهر brightfield واضغط F1 لتمكين التقاط (الشكل 4A). ضبط خطاف المصب يدويا حتى يتم توسيطه في صورة brightfield. انقر فوق محور المصب صفر، ثم المصب معطل لتمكين المحرك (الشكل 4C). حرك شريط تمرير DS Setpoint [um] حتى تتم محاذاة نهاية الخطاف مع حافة منطقة الاهتمام الافتراضية.
- أعد صفر محور المصب، ثم حرك شريط تمرير DS Setpoint [um] إلى 1000. كرر العملية باستخدام خطاف المنبع، ولكن لا تقم بنقل شريط التمرير Setpoint [um] في الولايات المتحدة.
- انقر فوق نقل إلى تصاعد ( الشكل4C).
- ابدأ نظام الإضاءة الفلورية عن طريق تبديل مفتاح المصباح قبل تشغيل النظم الفرعية لوحدة التحكم بسرعة عن طريق تبديل المفتاح الرئيسي.
ملاحظة: تنتج بعض مصادر الأشعة فوق البنفسجية كميات كبيرة من الأوزون. إذا كان هذا هو الحال، قم بتوصيل مستخرج الأوزون بفتحة منفذ مصدر الضوء وتأكد من تشغيله قبل تشغيل مصدر الإضاءة الفلوري. - قم بتبديل الوضع التشغيلي إلى Turbo-Blanking بالضغط على زر الوضع على اللوحة الأمامية، يليه 2ثم 1. اضغط على زر "تشغيل الخط" للسماح لرمز التحكم بإبلاغ العملية.
- جبل ترابكولا.
- وقفة تدفق فائقة من خلال غرفة القياس. ملء غرفة تصاعد مع حل تشريح.
- باستخدام حقنة 1 مل، نقل trabecula من غرفة تشريح إلى غرفة تصاعد(الشكل 5G).
- لنقل trabecula، ضع المحقنة عموديا وعلى اتصال مع سطح محلول غرفة التركيب. السماح لtrabecula النزول إلى غرفة تصاعد عن طريق الجاذبية (الشكل 5H).
- خفض مستوى السوائل في غرفة التركيب بحيث يكون في مستوى مع القسم الأوسط من السنانير.
- ضبط المسافة بين السنانير لتعكس طول فترة سماح من trabecula عن طريق تحريك شريط التمرير DS Setpoint [um].
- باستخدام المجهر للمساعدة في التصور ، قبضة طفيفة واحدة من قطعة من الأنسجة نهاية مع ملقط وجبل على هوك المنبع. جبل قطعة أخرى من الأنسجة نهاية على هوك المصب(الشكل 5I).
- مرة واحدة شنت بشكل آمن، نقل trabecula مرة أخرى إلى غرفة القياس (الشكل 5J) عن طريق الضغط على الانتقال إلى الغرفة ( الشكل4C). استئناف تدفق فائقة واستخراج السوائل.
- تعيين تردد التحفيز [هرتز] إلى 1، ومدة التحفيز [مللي ثانية] إلى 10، والجهد التحفيزي إلى 10. بدء التحفيز عن طريق الضغط على التحفيز؟. . .
- أعد التراكيكولا.
- بعد حوالي 1 ساعة من التأقلم، خفض تدريجيا الجهد التحفيز ومدة التحفيز في 1 V و 1 ms الخطوات، على التوالي. مجموعة نموذجية من القيم هي 3 V و 3 مللي ثانية.
- تشغيل نظام الإضاءة برايتفيلد. اضغط F1 وحدد منطقة الاهتمام التي تحيط منطقة المخطط على واجهة المستخدم. انقر فوق حساب SL؟ لحساب متوسط طول الساركومير في المنطقة المميزة. زيادة طول العضلات حتى متوسط طول الساركومير هو 2.32 ميكرومتر عن طريق زيادة شريط التمرير الفاصل Setpoint [um].
ملاحظة: حساب SL؟ يستخدم FFT 2D الموضحة في الخطوة 4.3. منطقة الفائدة المستخدمة لحساب متوسط طول الساركومير عادة ما تكون 100 ميكرومتر إلى 150 ميكرومتر مربع. لذلك ، مع اقتراب العضلات من الطول الأمثل للساركومير ، يتم استخدام 43 إلى 65 ساركومير لحساب متوسط طول الساركومير. - تحريك العضلات عن طريق ضبط مركز Setpoint [um] المنزلق على "مركز وفصل التحكم علامة التبويب ( الشكل4C) بحيث حافة هوك المصب مرئيا فقط داخل الصورة brightfield. جمع المعلومات الفلورية لعشر ارتعاشات.
- زيادة قيمة مركز Setpoint [um] بنسبة 200 وجمع عشر ارتعاشات أخرى بقيمة معلومات الفلورسينس. كرر هذه العملية حتى تحتوي الصورة brightfield على خطاف المنبع. جمع قيمة النافذة النهائية من المعلومات الفلورية.
- أعد الترابيكولا إلى موضع مركزي عن طريق تعيين قيمة مركز Setpoint [um] إلى 0.
- خفض تردد التحفيز إلى 0.2 هرتز والتحول من سخى KH إلى محلول التحميل Fura-2 (مفصلة في الجدول 1).
- قياس إشارة الفلورسينس كل 10 دقيقة عن طريق النقر فوق تمكين مصدر الفلورسينس على علامة التبويب ستيم والبيانات. تصور إشارة الفلورسينس على علامة التبويب إشارة PMT.
- بعد زيادة إشارة 360 نانومتر بعامل 10 أو تجاوزت مدة إجراء التحميل 2 ساعة، أعد تردد التحفيز إلى 1 هرتز وبدل مرة أخرى إلى محلول KH الفائق.
- تحقق من قياس النسبة كل 10 دقائق حتى يستقر قياس النسبة، وعند هذه النقطة يمكن أن يبدأ جمع البيانات.
- جمع بيانات التصوير الساطع والمضان.
- إعادة العضلات إلى الموقف حيث حافة هوك المصب هو مجرد وجود داخل صورة brightfield. بدء تدفق بيانات الأجهزة بالنقر فوق دفق البيانات إلى القرص على علامة التبويب Stim و Data من واجهة المستخدم التحكم في الأجهزة. التقاط معلومات الفلورسينس بالنقر فوق تمكين مصدر الفلورسينس.
- في واجهة مستخدم التصوير في brightfield، قم بتعيين وضع الالتقاط إلى مشغل خارجي، ثم قم بزيادة معدل الإطار إلى 100 هرتز، ثم قم بتعيين عدد الصور لالتقاطها إلى 100. اضغط على Ctrl + Shift + S متبوعا ب F1 لتسجيل بيانات التصوير في brightfield لهذه النافذة.
- زيادة قيمة نقطة الوسط [um] بمقدار 200 وتكرار الخطوة 3.4.2. استمر في استخدام بروتوكول المسح الضوئي حتى يتم جمع بيانات التصوير للنافذة النهائية من الخطوة 3.3.4.
- أعد الترابيكولا إلى موضع مركزي عن طريق تعيين قيمة مركز Setpoint [um] إلى 0.
- جمع بيانات التصوير أكتوبر.
- قم بتشغيل مصدر ليزر OCT عن طريق تحويل المفتاح الرئيسي إلى | الرمز، والضغط على زر الطاقة، متبوعا بزر SLDs.
- قم بتغطية رأس مقياس الغالفانوميتر وانقر على الحصول على BG لقياس نمط التداخل الخلفي وطرحه من القياس(الشكل 4B).
- تعيين وضع التقاط الصورة إلى عرض مباشر.
- ضبط y-positionحتى صورة B-المسح يحتوي على ربط المنبع فقط. تقسيم طول العضلات المعروضة على لوحة التحكم الأمامية (الشكل 4B) على اثنين وطرح الحالي y-position. أدخل هذه القيمة في إدخال"y-offset". ضبط قيمة"x-offset"حتى يتم توسيط المقطع العرضي من trabecula في الإطار.
- مع توسيط trabecula، تفحص على طول المحور ص عنطريق ضبط موقف ص للعثورعلى المواقف المقابلة لالفوام والمصب السنانير. لاحظ هذه المواقف لأسفل. تعيين نطاق Y (الخطوات) إلى الفرق المطلق بين هذه القيم مقسوما على عشرة.
- تعيين وضع التقاط الصورة إلى التحفيز المشغلة؟، النطاق العاشر (خطوات) إلى 100 ، وانقر فوق تعيين المعلمات النشطة الزر.
- انقر فوق Stream B-Scan Data؟، ثم احصل على.
ملاحظة: يتطلب بروتوكول التصوير المسور 200 ارتعاش لالتقاط هندسة العضلات بأكملها لعينة طولها 2 مم ، وهو ما يتوافق مع وقت التقاط ~ 3 دقائق و 20 s.
4. معالجة مجموعة بيانات الصور brightfield
- إعداد الصور للتحليل.
- استيراد الصور إلى ImageJ (ملف > استيراد > تسلسل الصور > حدد الصورة).
- زيادة تباين الصورة (صورة > ضبط > السطوع / التباين > نقل الحد الأدنى والحد الأقصى المتزلجون إلى مركزية الرسم البياني للصورة).
- شحذ الصور (معالجة > مرشحات > قناع unsharp > مجموعة نصف قطرها (سيغما) إلى 1.0 بكسل وقناع الوزن (0.1-0.9) إلى 0.6).
- تصدير تسلسل الصورة (حفظ كما > تسلسل الصورة > تعيين التنسيق إلى PNG، تبدأ من 0 والأرقام (1-8) إلى 4).
- قم بخياطة الصور وقياس الإزاحة المترجمة وحساب أطوال الساركومير المحلية.
- فتح "TrabeculaProcessing.m" (متوفر عند الطلب) وتعيين متغير FolderPath إلى المجلد الرئيسي الذي يحتوي على كافة البيانات، و ImagePath إلى المجلد حيث تم حفظ تسلسل الصورة من الخطوة 4.1.4. تعيين المقاطع إلى عدد إطارات وإطارات التصوير إلى عدد الإطارات الملتقطة لكل إطار.
- تشغيل التعليمات البرمجية.
ملاحظة: الإخراجات ستكون موجودة في مسار مجلد الإخراج المحدد من قبل المستخدم. (افتراضيا، يتم تعيين المسار إلى FolderPath/Output).
- FFT تقنية طول ساركومير
- استخدم برنامج معالجة الصور لتنفيذ FFT على منطقة من الصورة حيث تكون ال ساركومير مرئية للغاية.
- اضرب البيكسلات لكل μm نتائج المعايرة من الخطوة 1.1.6 في 1.6 ميكرومتر و 3.0 ميكرومتر قبل حساب العكسي للحصول على نطاق الترددات المكانية ذات الاهتمام.
- احتواء الأسي إلى نتيجة FFT تجاهل معلومات التردد في نطاق التردد المحسوبة في الخطوة 4.3.2 وطرحه من نتيجة التحويل لإزالة مصطلح DC.
- تناسب منحنى الغاوسية إلى نطاق التردد من الفائدة.
- حساب عكس ذروة منحنى الغاوسية. هذا هو متوسط طول الساركومير لمنطقة الاهتمام.
ملاحظة: تم تنفيذ حساب FFT وتركيب المعادلات الأسية والغاوسية باستخدام رمز LabVIEW مخصص.
5. معالجة بيانات الفلورسينس
- طرح autofluorescence تعتمد على النافذة من النافذة المعنية وحساب حاصل الإشارات المرتبطة أطوال موجية 340 نانومتر و 380 نانومتر الإثارة.
6. معالجة بيانات التصوير أكتوبر
- قم بإعداد مجموعة صور OCT للتجزئة.
- فتح ImageJ واستيراد الصور (ملف > استيراد > تسلسل الصورة). في إطار مستكشف الملفات، يفتح هذا، حدد موقع الصور، وحدد واحدة وانقر فوق فتح.
ملاحظة: إذا لم تقم بتخزين رمز التحكم ل OCT الصور بتنسيق قابل للقراءة بواسطة ImageJ، تحويلها إلى PNG. - لتسهيل التصور ، وتنظيم تسلسل الصورة في hyperstack (صورة > Hyperstacks > المكدس إلى Hyperstack). في مربع الحوار الذي يفتح، تعيين عدد الشرائح إلى عدد من B-بمسح لكل شريحة وX إلى عدد من شرائح على طول trabecula.
- رسم مستطيل الذي يحيط trabecula. تأكد من أنه يرفق وحدة التخزين بأكملها عبر الوقت باستخدام المتزلجون على إطار hyperstack. اقتصاص الصورة إلى النافذة (صورة > قص).
- إزالة الشرائح التي تحتوي على صور من السنانير تصاعد (أكوام > أدوات > شريحة حارس). حدد نطاق الشرائح التي تحتوي على معلومات trabecula فقط.
- فتح ImageJ واستيراد الصور (ملف > استيراد > تسلسل الصورة). في إطار مستكشف الملفات، يفتح هذا، حدد موقع الصور، وحدد واحدة وانقر فوق فتح.
- تدريب تقسيم WEKA.
- فتح WEKA تجزئة (الإضافات > تجزئة > قابلة للتدريب ويكا تجزئة).
- تعيين وضع التحديد إلى "اليد الحرة".
- انقر فوق إعدادات وضبط إعدادات المصنف والتدريب. (لهذا النموذج، استخدمت ميزات التدريب التالية: طمس الغاوسية، مرشح سوبيل، هيسيان، الاختلاف من الغاوسيين، إسقاطات الغشاء، الثنائية، وLipchitz. تم تعيين سمك الغشاء إلى 1 ، حجم التصحيح الغشاء إلى 8 ، الحد الأدنى سيغما إلى 1 ، والحد الأقصى سيغما إلى 32. تم تعيين المصنف إلى FastRandomForest وتم تعيين خيارات المصنف إلى: batchSize 100، maxDepth إلى 32، numFeatures إلى 32، numThreads إلى 0، و numTrees إلى 200.)
- تقسيم الصور يدويا حتى نتائج التدريب في تجزئة مرضية.
- حفظ المصنف.
- تقسيم عمليات المسح B المعالجة
- إطلاق تجزئة WEKA بعد الخطوة 6.2.1.
- تحميل المصنف من الخطوة 6.2.5.
- انقر فوق إنشاء نتيجة.
- تحويل الصور إلى 8 بت(صورة > نوع > 8 بت).
- تحويل الصور إلى ثنائي(عملية > ثنائي > جعل ثنائي > الأسلوب الافتراضي والخلفية الافتراضية).
- حفظ لتسلسل الصورة (PNG).
- حساب متوسط CSA في الصور B-المسح الضوئي مجزأة.
- عد عدد وحدات البكسل البيضاء في صورة B-scan ثنائية.
- قم بضرب منطقة البكسل بدقة العمق المعايرة (من الخطوة 1.2) و10 ميكرومتر (المسافة بين الفحص A المجاور).
- كرر لجميع من B-بمسح بين السنانير ومتوسط القياسات.
- تحويل الصورة المقسمة إلى شبكة.
- فتح "OCTmain.m" (متوفر عند الطلب) وتعيين imageDirectory إلى المجلد الذي يحتوي على الإخراج من الخطوة 6.3.6. تعيين outputPath حسب الضرورة.
- تعيين شرائح إلى قيمة "النطاق ص (الخطوات)" (الخطوة 3.5.5) وإطارات لقيمة "كرر X" (الخطوة 3.5.6) ، z_dim إلى دقة العمق (الخطوة 1.2.10) ، x_dim & y_dim إلى القيمة المعينة إلى 10.
- انقر فوق تشغيل.
النتائج
من أجل التقاط الإقليمية Ca2 + ومعلومات brightfield لكامل طول trabecula المقدمة هنا، كانت هناك حاجة إلى سبعة مواقف العضلات. ويشير الشكل 6 إلى أن قوة الارتعاش لم تزعجها هذه الحركة، مما يكشف عن عدم وجود اعتماد على موقع إنتاج القوة النشطة.
تم تقسيم B-بمسح تم جمعها باستخدام التصوير المقطعي التماسك البصري بمعدل 100 هرتز باستخدام البرنامج المساعد ImageJ WEKA14 (الشكل 7A). يظهر كل مقطع عرضي مشوها بسبب الفرق بين الدقة الجانبية (10 ميكرومتر) والعمق (1.73 ميكرومتر (في عضلة القلب)). تم تصحيح هذا التشويه عن طريق قياس محور عمق الصورة بنسبة الدقة الجانبية العمق. الشكل 7B، C تثبت أنه بعد توسيع نطاق الخام C - مسح trabecula هو أسطواني تقريبا في الهندسة. انعكاس جدار غرفة القياس يمكن أن تتداخل في بعض الأحيان مع بيانات العضلات (الشكل 7A، ب)، ولكن يمكن تدريب برنامج تجزئة لحساب هذا(الشكل 7D، ه). مرة واحدة مجزأة، يمكن حساب المنطقة المقطعية العرضية على طول العضلات في جميع أنحاء نشل(الشكل 7F). لاحظ أن هذا trabecula خاصة لديه ملحق صغيرة تتفرع منه. حركة الفرع واضح ~ 0.75 ملم على طول trabecula. وأخيرا، يمكن تحويل الصور المجزأة إلى شبكات للمساعدة في بناء نماذج هندسية(الشكل 7G).
تم خياطة بيانات التصوير التي تم التقاطها في كل من المواقف المختلفة trabecula بمعدل 100 إطارا في الثانية معا لخلق صورة واحدة كاملة من trabecula (الشكل 8A). دقة هذه الصور هي 0.535 ميكرومتر / بكسل. استخدام وظائف الترجيح الخطي في المناطق المتداخلة من النوافذ المجاورة يساعد التصور ويقلل من تأثير المقالة القصيرة الموجودة في صور brightfield. لقياس إشارة الفلورسنت، يتم إضاءة نافذة 540 ميكرومتر في 540 ميكرومتر من التربيكولا دوريا مع 340 نانومتر، 365 نانومتر، و 380 نانومتر ضوء الطول الموجي بمعدل 600 هرتز. ترتبط نسبة الفلورسينس المنبعثة المرتبطة بضوء الإثارة 340 نانومتر و380 نانومتر بالكالسيوم داخل الخلايا بعد تحميل الترابيكولا ب Fura-2. وبما أن هذا القياس هو نسبة، فإن معدل القياس الفعال هو 200 هرتز. المتوسط(ن = 10) داخل الخلية Ca2 + العابرين من كل نافذة يتم محاذاتها مع المنطقة التي تم تصويرها (الشكل 8B). في حين أن ذروة العابرين تبدو متسقة بشكل معقول ، فإن الانبساطي [Ca2 +] أقل داخل المنطقة بين 900 ميكرومتر و 1800 ميكرومتر على طول ترابكولا. وبالمثل، تشير نتائج عمليات تتبع الإزاحة(الشكل 8C)وطول الساركومير(الشكل 8D)أيضا إلى وجود تباين إقليمي. تقنية التتبع بدون علامات المستخدمة قادرة على معالجة إزاحة كل بكسل ، نظرا للتباين الكافي. عند رسم خرائط لتوزيع أطوال الساركومير في آخر، تم استخدام منطقة عبر الارتباط من 128 بكسل في 128 بكسل (~ 67 ميكرومتر في 67 ميكرومتر) لحساب طول الساركومير الإقليمي. هذه المنطقة تغلف ما يقرب من 29 sarcomeres عند إغلاق العينة على مقربة من طول الساركومير الأمثل. تم تعيين حجم الخطوة (في كل من الاتجاهين س و ص)بين السنترويد لكل إطار عبر الارتباط إلى 50 بكسل (~ 26 ميكرومتر) لمعالجة هذه البيانات. تم اختبار مدى ملاءمة تقديرات طول الساركومير على أساس عرض وسعة الغاوسي المناسب لإشارة FFT. لم يتم استيفاء هذه الشروط في منطقة العضلات بين 0 ميكرومتر و 500 ميكرومتر لذلك لا يمكن حساب أي معلومات طول الساركومير هناك. وبالنظر إلى حالات التشريد المرتبطة بها، فمن المرجح أن تكون الساركومير في هذه المنطقة ممدودة خلال مرحلة الانكماش. وتمشيا مع هذه التكهنات، فإن متوسط أطوال الساركومير على الجانب الأيمن من التربيكولا يقصر خلال تلك الفترة. ومن خلال الجمع بين المعلومات التي يقدمها كل فريق من الأفرقة، يبدو أن المنطقة التي تضم أكبر منطقة مقطعية لا تنتج أهم قوة. على افتراض أن الاختلاف الإقليمي للعاببين Ca2 + له تدرج سلس تقريبا ، يشير الشكل 8B إلى أن أكبر سعة Ca2 + عابرة تحدث في مكان ما بين 1300 ميكرومتر و 1600 ميكرومتر على طول التربيكولا. تشير خريطة الإزاحة إلى أن المنطقة التي تمر بأقل حركة تتماشى بشكل جيد مع ذروة Ca2+ عابرة. ومع ذلك، هذه المنطقة لديها أصغر المناطق المقطعية العرضية للعينة. ومع مراعاة هذه البيانات، يمكن للمرء أن يستنتج أن هذه المنطقة ولدت أكبر قدر من الإجهاد.

الشكل 1:صورة مشروحة لمقياس عضلة القلب. ويرد كل من المكونات البصرية الرئيسية. يحتوي الداخل على رؤية خلفية عن قرب لهدف المجهر في الموقع، أسفل غرفة القياس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
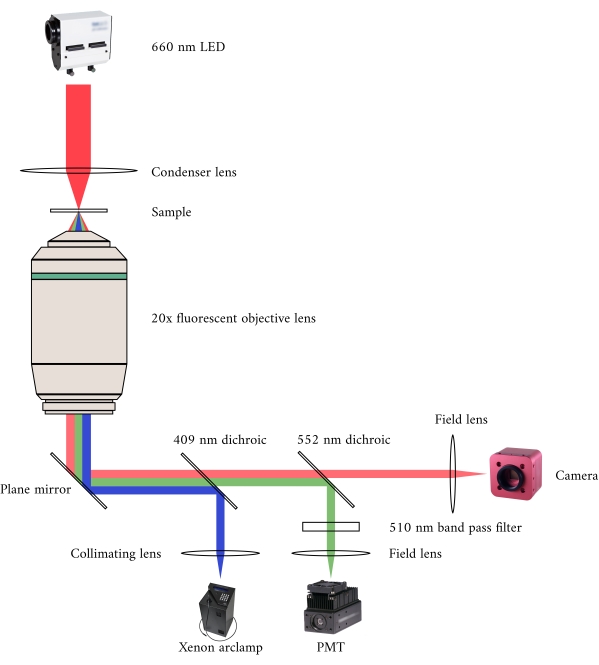
الشكل 2:المسار البصري للمجهر المشرق والمضان المتزامن. مصدر الإضاءة للمجهر الفلوري هو مصباح قوس زينون ، والذي يتحول إخراجه دوريا بين 340 نانومتر ، 365 نانومتر ، وضوء 380 نانومتر. يحتوي مسار إخراج مصباح القوس على مرآة ديكهروبية بطول موجي مقطوع يبلغ 409 نانومتر يعكس ضوء الأشعة فوق البنفسجية على مرآة توجه الضوء إلى هدف المجهر الفلوري. تركز العدسة ضوء الإثارة على العينة وتجمع الضوء المنبعث ، الذي له طول موجي أطول من 510 نانومتر. يمر هذا الضوء المنبعث عبر المرآة الديكهروية الأولى ، ولكن ليس الثاني ، حيث يبلغ طوله الموجي 552 نانومتر. ثم تركز عدسة الحقل الضوء المنعكس على مستشعر PMT. وفي الوقت نفسه، يقع مصدر الإضاءة (660 نانومتر LED) لمجهر برايتفيلد فوق العينة. يركز الضوء المرسل على العينة بواسطة عدسة مكثف ، ويلتقط هدف الفلورسينس × 20 صورة الإرسال الناتجة. الطول الموجي المستخدم لإضاءة برايتفيلد يتجاوز الطول الموجي المقطوع لكل مرآة ديكهروبية ، لذلك يمر عبر كليهما قبل أن تركز الصورة على مستشعر كاميرا CMOS. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
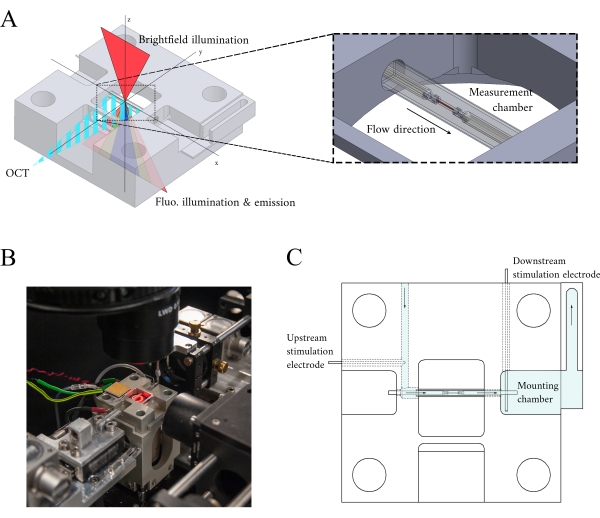
الشكل 3: تصميم حامل غرفة القياس. (أ) عرض متساوي القياس لحامل غرفة القياس مع مسارات بصرية مضافة. الإضاءة برايتفيلد يحدث من السطح المتفوق(ضالمحور)؛ الإضاءة الفلورية يحدث من السطح السفلي(ضالمحور)، وقياس الذراع إشارة أكتوبر متعامدة إلى محور الإضاءة الأخرى(صالمحور). خلال التجربة، يحمل خطان بلاتينيان ترابيكولا داخل أنبوب زجاجي شعري يعمل كغرفة قياس. تتحكم محركات لفائف الصوت في كل خطاف ويتم قياس مواقعها باستخدام قياس التداخل بالليزر. تتم مقارنة الموضع الحالي مع نقطة تعيين معرفة من قبل المستخدم و، باستخدام وحدة تحكم PID المرمزة داخل FPGA، يتم تقليل الخطأ. (ب) غرفة القياس في الموقع مع الإضاءة brightfield تشغيل. يتم عرض الخلفية في الشكل 1 inset. (ج) تخطيطي لتدفق السخانات الفائقة من خلال حامل غرفة القياس. Superfusate يدخل الجزء الخلفي من كتلة ويتدفق في الاتجاه المشار إليه من قبل السهام. تقوم أقطاب المنبع والمصب بإنشاء التحفيز الميداني للحصول على تقلص ترابيكولا مثبتة في غرفة القياس. يشير التظليل الأزرق إلى المناطق التي تتدفق فيها التدفقات الفائقة أثناء التجربة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
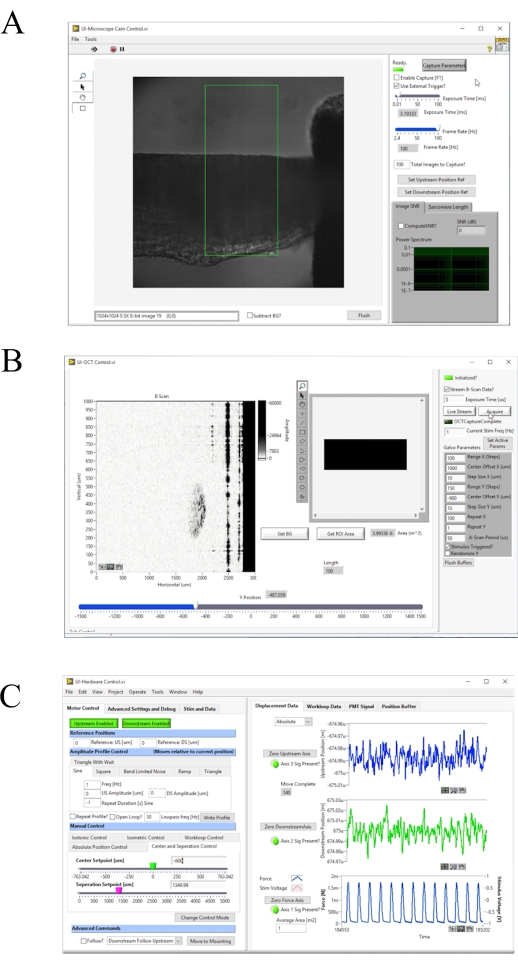
الشكل 4: لوحة أمامية من الحصول على صورة والتحكم البرمجيات. (أ) برايتفيلد واجهة المستخدم التصوير. (ب) أكتوبر واجهة المستخدم التصوير. (C) واجهة المستخدم التحكم في الأجهزة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
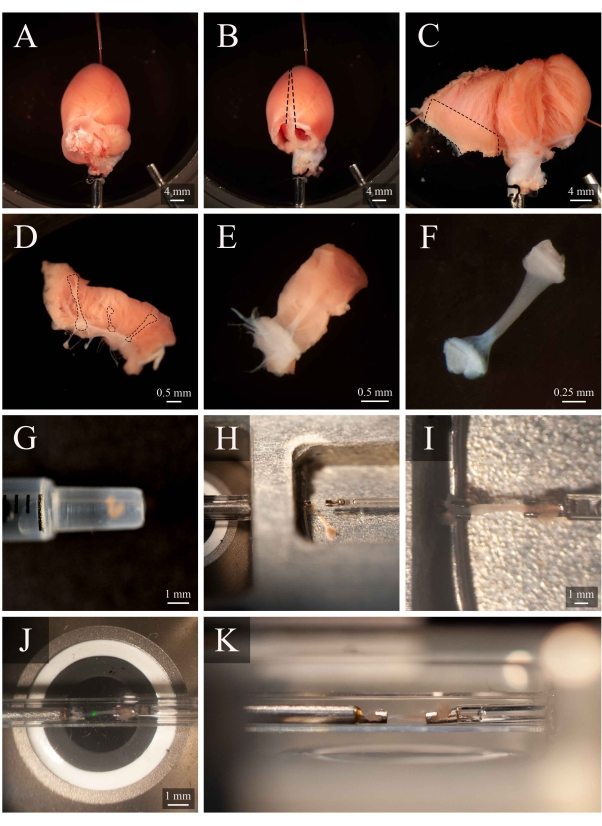
الشكل 5: تشريح Trabecula وتركيب البروتوكول. (أ) Langendorff-perfused قلب الفئران في غرفة تشريح. (ب ) نفس القلب مع إزالة الأذين. خطوط متقطعة تشير إلى مسار ختان لفتح البطينين. (ج) فتح القلب لفضح الداخلية من البطينين على حد سواء. يشير المربع المتقطع إلى المنطقة التي توجد فيها عادة trabeculae. (D) منطقة الجدار البطين الأيمن المقتطعة (نفس ما يشير إليه المربع المتقطع في C). خطوط متقطعة تسليط الضوء على ثلاثة trabeculae. (ه) ترابيكولا مختارة من الثلاثة في D. (F) وtrabecula من لوحة E مع إزالة نسيج الجدار. (G) ترابيكولا معزولة في نهاية حقنة 1 مل. (H)وtrabecula في غرفة تصاعد. (I)ركبت trabecula بين اثنين من السنانير البلاتين. (J) وtrabecula، التي شنت بين السنانير، داخل غرفة القياس (الشكل 3B). البقعة الخضراء هي قطعة أثرية من أول فلتر ديكهروي. (ك) زاوية ثانوية من trabecula شنت داخل غرفة القياس. المسافة بين trabecula وعدسة الهدف المجهر هو ما يقرب من 1 ملم. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
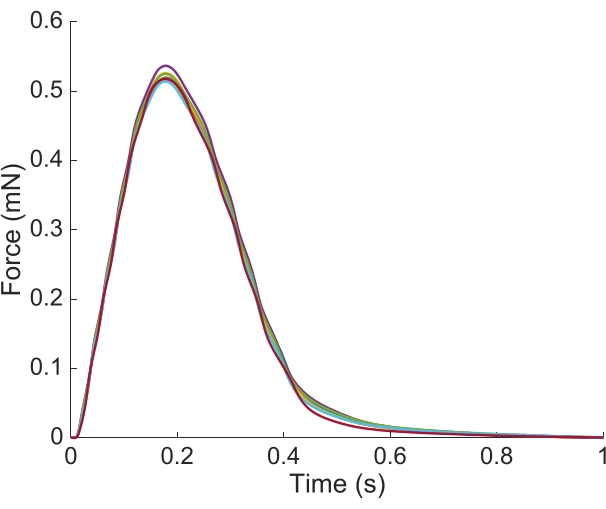
الشكل 6: اعتماد موضع قياس القوة. القوة التي تنتجها العضلات من كل من مواقع التصوير(ن = 7) مضافا. وكان متوسط إنتاج القوة النشطة 0.527 mN ± 0.003 mN، والوقت إلى 50 ٪ انكماش 77.1 مللي ثانية ± 0.3 مللي ثانية، والوقت إلى 50 ٪ الاسترخاء 328.1 مللي ثانية ± 0.9 مللي ثانية (يتم تقديم جميع البيانات على أنها متوسط ± SE). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
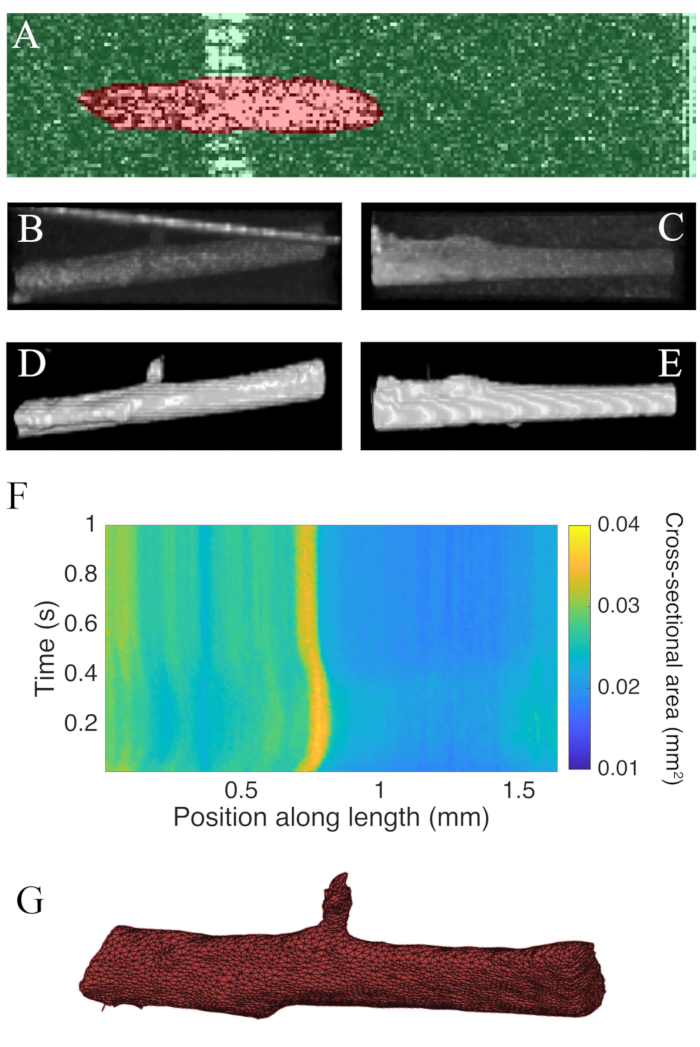
الشكل 7: أكتوبر تحليل التصوير. (أ)مثال على تقسيم واكا. يتم تمييز المقطع العرضي المجزأ من العضلات باللون الأحمر ، ويتم تمييز الخلفية باللون الأخضر. (ب) عرض متفوقة من البيانات الخام C-مسح ترابيكولا. خط الزاوية الساطع نحو الجزء العلوي من الصورة هو انعكاس جدار غرفة القياس. (ج) عرض الجانبي للبيانات الخام C-مسح ترابيكولا. (D) عرض متفوقة للبيانات أكتوبر مجزأة. (ه) عرض الجانبي للبيانات أكتوبر مجزأة. (F) المنطقة المقطعية العرضية بطول التراكيكولا(المحور س)عبر الزمن (المحور ص). وكان متوسط منطقة المقطع العرضي على طول العضلات 0.0326 مم2 ± 0.0005 مم2 (متوسط ± S.E.) (G) شبكة من ترابكولا. وقد تم محاذاة شبكة تقريبا مع مؤامرة منطقة مقطعية من لوحة F. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
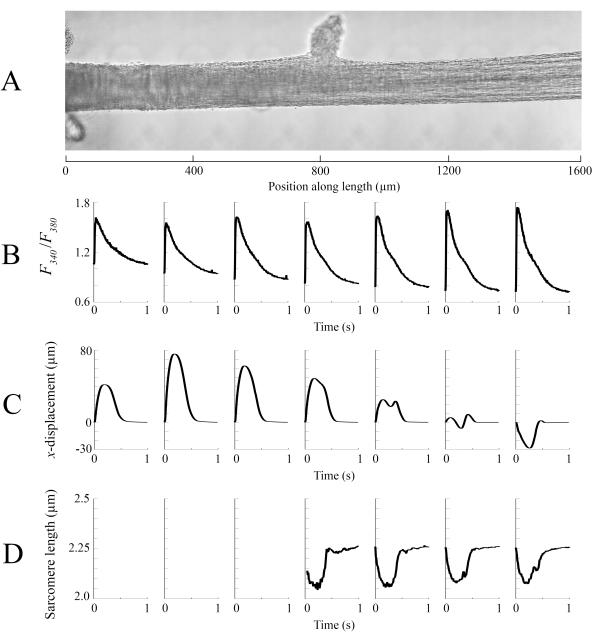
الشكل 8: تحليل التصوير الساطع والمضان. (أ) صورة مخيط (سبع نوافذ التصوير) من trabecula. (ب) Ca2 + عابرين على طول ترابكولا. (C) متوسط x-displacementمن كل نافذة تصوير. يمثل الإزاحة الإيجابية حركة إلى اليمين وسلبية إلى اليسار. (D) متوسط أطوال ساركومير من كل نافذة التصوير التي كان التباين الصورة اللازمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: جدول الحلول يرجى الضغط هنا لتحميل هذا الجدول.
Discussion
في هذه الدراسة، نقدم التكوين الذي يمكن تجميع ثلاثة أنظمة بصرية تجمع بين برايتفيلد، مضان، والتصوير أكتوبر لجمع البيانات من الترابكولا القلب السابقين التعاقد بنشاط(الشكل 1 والشكل 2). مثل هذا التكامل المنظم ممكن بسبب تصميم غرفة القياس (الشكل 3) لتمكين الترتيب المتعامد من أكتوبر إلى محور مشرق الفلورسينس. يلعب نظام تركيب العضلات دورا مهما بنفس القدر في نجاح التحديدات الكمية المتزامنة للمؤشرات الرئيسية في توصيف ديناميكيات انقباض عضلات القلب. تكمن حداثتها في تمكين إجراءات مسح العضلات دون أي اضطراب واضح في الأداء الميكانيكي للعضلات(الشكل 6). مع تكوين التصوير المشترك ونظام الخطاف الآلي لقياس القوة ، يمكن لهذا النظام تقييم التغايرية الإقليمية في Ca2 + عابرة ، والتشريد ، وطول الساركومير ، جنبا إلى جنب مع المعلومات الهندسية العيانية من trabecula التعاقد طوال الدورة الزمنية للارتعاش(الشكلين 7 والشكل 8).
وبالنظر إلى انتشار أنظمة التصوير الساطعة في مختبرات أبحاث القلب، يمكن تحقيق إعادة إنتاج هذه النتائج مع بعض الاعتبارات البسيطة للأجهزة. هنا ، نقدم مجموعة أدوات معالجة الصور للجمع بين برايتفيلد - epifluorescence و OCT ، وهو أمر ضروري في تحليل التغاير الانكماشي الأساسي. يتطلب تكامل OCT مسارا بصريا دون عائق ، في حين يتطلب التصوير المسور خط تشغيل خارجي بين التحفيز وكاميرا التصوير OCT و brightfield ، وخطافات تركيب العضلات القادرة على تحريك العينة في جميع أنحاء غرفة القياس. تتوفر البرامج والأساليب المطلوبة بعد المعالجة مجانا. على وجه الخصوص ، فإن برنامج التقسيم المستخدم ، WEKA14، مفتوح المصدر. تقنية تتبع بدون علامات من النقاط المادية8، طول الساركومير ، التصوير الحجمي المسور10، ورموز توليد الشبكة يمكن الوصول إليها بالمثل ويمكن توفيرها بناء على طلب المؤلف المقابل.
إن قابلية العضلات للحياة، والتحميل الأمثل ل Fura-2، وتركيز الصورة هي الركائز الثلاث التي تشكل أسس تجربة ناجحة. باستخدام محلول تشريح يحتوي على BDM لمنع انقباط ، ونقل العضلات في حقنة ، والأوكسجين المستمر للمحلول ، وإعداد حلول تجريبية جديدة في يوم التجربة ، وكلها تسهم في ارتفاع معدل صلاحية العضلات. قبل تحميل trabecula مع Fura-2AM، يجب أن يتم جمع autofluorescence لكل شرط واحد مهتم في دراسة كما يمكن أن يكون لها تأثير كبير على قياس Ca2 + عابرة 15. إن أكسجة محلول التحميل Fura-2AM معقد بسبب الإدراج الضروري ل pluronic-F127 المتفاعلة على السطح للمساعدة في تحميل الصبغة. لمكافحة تكوين الفقاعة الزائدة الناتجة عن هذا السطحي ، يتيح قطرة صغيرة من الرغوة المضادة في محلول التحميل للمستخدم زيادة معدل الأكسجين ، وبالتالي تحسين فرصة أن يحافظ trabecula على الجدوى الوظيفية طوال عملية التحميل. وأخيرا، يجب أن يكون تركيز التصوير موحدا بطول العضلات لزيادة نسبة الإشارة إلى الضوضاء لمعلومات brightfield و fluorescence.
هناك نوعان من القيود للنظر مع الأساليب المعروضة هنا. الأول هو الاستبانة المكانية للمجهر الفلوري. في حين أن القرارات المكانية للتصوير OCT و brightfield عالية ، فإن دقة المجهر الفلوري تقتصر على جزء لا يتجزأ من الفلورسينس من الحجم الذي تم التقاطه داخل نافذة تصوير 540 ميكرومتر في 540 ميكرومتر. هناك مجال لزيادة الدقة المكانية للمجهر الفلوري باستخدام كاميرا جهاز ذات زيادة عالية ، بدلا من PMT ، لالتقاط إشارة الفلورسينس على حساب نسبة الإشارة إلى الضوضاء16. ثانيا هو قطر trabecula التي يمكن دراستها من حيث طول ساركومير قابلة للقياس وعمق هندسي. نهج نافذة -FFT لحساب طول ساركومير يستغل الاستفادة من تحسين الدقة المكانية ولكن يرتبط مع انخفاض متانة(الشكل 8D). في الحالات التي يكون فيها ترابيكولاي عكر أو كبير القطر لدراسة, سيتم تخفيض قابلية حل FFT إلى حد كبير بسبب انخفاض التباين المرتبطة ربط الساركومريك في عينات الأنسجة أكبر. وبالمثل، داخل أكتوبر، فإن الانعكاسات الخلفية من عمق التصوير أكبر من 300 ميكرومتر تكون أضعف من أن يتم حلها خلال مرحلة التقسيم. وبالتالي، يقتصر أسلوبنا على trabeculae قطرها أقل من 300 ميكرومتر. ومع ذلك، فإنه لا ينصح لدراسة عينات قطرها كبيرة كما قد يكون هناك مشاكل مع الأوكسجين نشرها من قلب العضلات خلال معدلات عالية من التحفيز17.
تمكن طريقتنا من تقييم الوظيفة الميكانيكية الأيونية بالتعاون مع هندسة العضلات في العضلات السليمة والممرضة ، مما يوفر نهجا قويا لفهم فسيولوجيا عضلة القلب ، والفيزيولوجيا المرضية ، وعلم الصيدلة. يستخرج خط أنابيب معالجة الصور المبين هنا بيانات ستكون محورية للحصول على فهم أعمق للتغايرية الانقبالية. أحد السبل لتحقيق إمكانات مجموعة البيانات الغنية هذه بشكل كامل هو بناء نماذج رياضية تدمج هذه البيانات وتفسرها ، وإجراء تنبؤات يمكن اختبارها تجريبيا باستخدام جهازنا.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم تمويل هذه الدراسة من منح الدكتوراه من جامعة أوكلاند (التي منحت لJD وMC)، السير تشارلز هيركوس زمالات البحوث الصحية (20/011 و 21/116) من مجلس البحوث الصحية في نيوزيلندا (منحت لJ-CH إلى KT، على التوالي)، منحة دكتوراه تمنحها المؤسسة الوطنية للقلب (تمنح إلى AA)، منح مارسدن للبدء السريع (UOA1504 و UOA1703) من الجمعية الملكية في نيوزيلندا (تمنح إلى J-CH و KT، على التوالي) ، وزمالة أبحاث جيمس كوك من الجمعية الملكية في نيوزيلندا (منحت لمنظمة AT). تم تمويل التطوير الأصلي لهذه الأداة من منحة مارسدن (11-UOA-199) من الجمعية الملكية في نيوزيلندا (تمنح لجمعية AT وPN).
Materials
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
References
- Han, J. -. C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250 (2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398 (2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -. C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved