Method Article
同时布莱特菲尔德, 荧光, 和光学相干断层成像收缩心脏特拉贝库莱 Ex Vivo
摘要
本协议提供了来自主动收缩的心脏气管 前体内的肉瘤、钙和宏观几何数据的集合。这些同时测量是通过整合三种成像方式实现的。
摘要
在心脏肌肉中,细胞内 Ca2+ 瞬态激活收缩肌肌,导致收缩、宏观缩短和几何变形。我们对这些事件之间的内部关系的理解是有限的,因为我们既不能"看到"肌肉内部,也不能精确跟踪激发收缩动力学的时空性质。为了解决这些问题,我们构建了一个结合了一套成像模式的设备。具体来说,它集成了一个明亮的场显微镜来测量肉瘤长度和组织应变的局部变化,一个荧光显微镜来可视化Ca2+ 瞬态,以及一个光学相干断层仪来捕捉组织在整个心脏周期过程中的几何变化。我们在此处展示成像基础设施和相关数据收集框架。数据是从称为特拉贝库莱卡内亚的孤立棒状组织结构中收集的。在我们的仪器中,一对位置控制的铂金钩可固定 前体 肌肉样本的每一端,同时不断与富含营养的盐水溶液相叠入。钩子在独立控制下,允许实时控制肌肉长度和力量。纵向翻译可对样品进行逐件扫描,克服与显微镜成像窗口相对大小(540 μm 乘 540 μm)和典型气管长度(> 2000 μm)相关的限制。肌肉室两端的白金电极以用户定义的速度刺激气管。我们利用刺激信号作为触发器,同步来自每个成像窗口的数据,以重建在稳定状态条件下的整个样本抽搐。将图像处理技术应用于这些明亮的场成像数据,可提供组织位移和肉瘤长度图。这种数据收集,如果纳入实验建模管道,将更深入地了解肌肉收缩同质性和生理学和病理生理学中的异质性。
引言
分离心脏肌肉组织制剂的超级输液是研究心脏离子活化和力学1的标准和广泛使用的方案。特别是,从心室壁中分离出类似杆状结构的气管,能够评估各种现象,包括收缩2的长度依赖激活、收缩3、4和心脏组织扩张粘度5的拉伸依赖反应。Ter Keurs,这种超融合分离性气管技术的发起人,最初使用荧光成像相结合的Ca2+测量和激光衍射来确定肉瘤长度2,5。自这些早期研究以来,使用基于2D快速 Fourier 变换 (FFT) 的技术 6 在亮场显微镜图像上提取具有更大空间分辨率的肉瘤长度信息变得越来越普遍。这两个成像系统允许部分评估Ca2+释放和肉瘤长度依赖力生产之间的基本关系。
心脏肌肉被收缩,可见的带状物与由厚和厚的细丝组成的一系列潜在的收缩单元相关联。构成肉瘤的这些组成丝的相互作用是力生成的基础,其开始如下:去极化电信号或作用电位,导致细胞膜中依赖电压的 L 型 Ca2+ 通道打开;随后的细胞流入Ca2+ 诱导Ca2+ 从肉瘤再细胞(SR),细胞内Ca2+ 存储释放,这个过程称为Ca2+诱导Ca2+ 释放7;细胞内Ca2+ 浓度从纳米摩尔突然增加到微摩尔范围,使力生产发生;Ca2+ 泵不断挤出细胞 溶胶,再挤出细胞溶胶回 SR 和细胞外隔间;当细胞内Ca2+ 浓度回到纳米摩尔范围时,强制生产停止,肌肉放松。在力生产过程中,成分之一的厚细细丝相互滑动。肉瘤长度决定了重叠的相对程度,因此,从宏观上决定肌肉的力生成潜力。
本文将这些荧光亮场成像技术扩展到光学相干断层扫描 (OCT)。OCT利用干扰的物理原理,能够获得组织的几何变形,以理解肌肉收缩异质性8。我们的设备 (图 1)使用光谱域 OCT (SD-OCT) 系统。在 SD-OCT 中,光束分离器将光从宽带短一致性长度的超发光二极管中分离成参考和测量臂。参考臂包含固定镜,测量臂包含二维电压计来引导光线。收集从样品中反散射的光线并干扰参考臂中的反射光,形成干扰模式。深度信息以光谱边缘的频率进行编码。要提取信息,信号通过光谱仪传递,结果应用反向 FFT。相应的 1D 信号表示不同深度的结构,对应折射指数9 (A 扫描) 的变化。通过在单轴中引导激光,可以构建感兴趣的示例(B 扫描)的横截面,并且,通过在剩余轴的步进模式中重复该过程,可以生成三维图像(C 扫描)。通过扩展,人们可以在一个切片上收集一系列B扫描,以便根据外部触发器重复时间变化的主题,并重复生成三维扫描,代表一个时间变化的平面图像10。
在整合三个成像系统时,我们考虑了以下两个原则。首先,成像传感器不应从替代成像方式检测光线:其次,物理设计应包含至少三个同时成像平面的自由空间。为了满足第一个要求,亮场显微镜使用 660 nm 波长 LED 以倒置配置照亮样品。荧光显微镜采用表观配置,用于激发和收集发射的光。激发光的波长在 340 nm 到 380 nm 之间,光电管 (PMT) 测量 510 nm 的波长发射的光。一对二色反射镜使这两个光学路径共享相同的物理足迹,而不会干扰相反的测量(图2)。最后,OCT 使用中央波长为 840 nm 的宽带(100 nm 光谱宽度)光,与其他两种模式不同。由于 OCT 所用光的低一致性,来自亮场荧光源的任何散射光都无助于编码深度信息的干扰模式。对于第二个要求,毛细管的外壳设计具有可访问到样品前部、劣质和高级平面的光学通路。在实验中,两个铂金钩在毛细管内持有一个带氧的克雷布斯-亨塞莱特(KH)溶液的管子。OCT 的镀锌仪头正交定向到亮场荧光成像通路,以利用第三个正交光学平面(图 3)。
本文概述了构建能够同时成像钙、肉瘤长度和肌肉几何形状的设备的设计考虑。为了证明这些测量能力,我们描述了隔离心室气管的过程,准备必要的缓冲解决方案,以及处理和荧光负荷 前气管 的关键步骤。最后,本文概述了将数据集转换为更有用的可视化所需的流程。
研究方案
奥克兰大学动物伦理委员会批准了对老鼠的处理和组织样本的制备。
1. 成像校准
- 布莱特菲尔德显微镜像素校准
- 将蒸馏水填满测量室。
- 将每 μm 已知线的衍射光栅放入测量室。
- 按 F1 以启用捕获和调整 帧速率 [Hz], 直到衍射光栅清晰可见(图 4A)。确保衍射光栅与框架边缘平行运行。再次按 F1 以停止捕获。
- 将 要捕获的总图像设置 为 1 个,按 Ctrl + Shift + S 将数据流式传输到磁盘,并按 F1 以捕获衍射光栅的图像。
- 打开图像J并导入衍射光栅图像(文件>打开>选择校准图像)。保持换档,绘制一条包含 20 个衍射光栅的光和暗带的线。
- 校准图像(分析>设置刻度)。第 1.1.5 步的行长度以 像素 值设置距离。将 已知距离 值设置为每 μm 测量线的 20 倍,将 长度单位 设置为 μm。比例表的反面是以像素表示的微米数。
- OCT 深度分辨率校准
- 使用维尼尔卡钳测量玻璃显微镜滑梯的厚度。
- 打开 OCT 激光源。
- 盖住电压计头,单击获取 BG以测量背景干扰模式,并从测量中减去它(图 4B)。
- 夹住 10 月测量臂中测量的玻璃显微镜滑梯(从步骤 1.2.1 开始)。
- 单击 实时流 查看 OCT 图像。调整玻璃显微镜滑动,直到在 B 扫描中可见。
- 要捕获 B 扫描图像,请将 范围 Y(步骤) 设置为一个,单击 流 B 扫描数据?,然后单击 "获取"。
- 将 B 扫描图像导入 ImageJ(文件>打开>选择 B 扫描)。保持移位,在玻璃显微镜滑梯的边界之间画一条线。
- 设置刻度(分析>设置刻度)。设置 已知距离 到第 1.2.1 步中收集的测量值。
- 要计算空气中的深度分辨率,请通过将每像素值的测量值乘以n玻璃,正确计算显微镜滑动的折射率(n玻璃= 1.5175)11。
注:引用 的 n玻璃 用于硅酸盐玻璃。显微镜幻灯片可以由不同的材料制成。使用适当的折射指数进行测量的幻灯片。 - 要缩放心肌的深度分辨率,将值从步骤 1.2.9 中除以。由 n心肌 = 1.38 (以前报告的价值12)。
2. 肌肉样本制备
- 准备解剖钻机。
- 将一些解剖溶液( 表1中概述)倒入一个小金属碗中,在心脏切除前约一小时放入冰柜中。
- 设置解剖钻机,确保解剖液氧氧充足(100% 含氧),并冲过每条管线。用含氧解剖溶液填充解剖室,并在灌注导管周围松散地系上3/0缝合线。
- 切除心脏。
- 麻醉8-10周大的威斯塔大鼠使用气态异黄素(<5%的氧气)。通过尾捏确认麻醉。
- 将麻醉大鼠定位在苏平位置,皮下注射腹腔内肝素溶液(1000 IU/kg)。再保持麻醉五分钟,使肝素循环。
- 从冰柜中取回装有解剖溶液的金属碗,并将其放在安乐死长凳附近。
注意:避免完全冻结解剖溶液,以便完全淹没解剖的心脏。 - 将麻醉鼠转移到安乐死长凳上,通过颈椎错位进行安乐死。
- 用剪刀打开鼠胸,先沿着肋骨的下侧切割身体壁,然后用隔膜切割,然后沿着肋骨的横向边界前进。把胸部抬起来
- 一只手抓住心脏,另一只手用一把弯曲的剪刀切割连接血管(主动脉、维纳卡瓦等)。
- 在冷解剖溶液中快速浸入心脏。
- 隔离一个特拉贝库拉。
- 当心脏在金属碗中时识别主动脉,然后将心脏转移到解剖室。使用两个弯曲的钳子,将主动脉拉过灌注罐。
- 用一个钳子将主动脉保持到位。同时,打开管线,让解剖液流过灌注罐。
注意:目标是在心脏切除后的一分钟内完成灌注。 - 一旦冠状血管清除血液,心脏完全充满解剖溶液,停止灌注流动,并使用缝合线固定主动脉到位。重新打开流量,使罐装心脏香水化。
- 旋转管状动脉,使左冠状动脉在上层表面可见。将心脏的顶点固定在解剖室的底部(图5A)。切断两个阿丽亚 (图 5B)。
- 用一套弹簧剪刀,沿着隔膜的右侧切到心脏的顶点(如图5B所示)。将打开的左心室固定到解剖室的底部。然后沿着隔膜的左侧切割,打开右心室,并将其固定在解剖室的底部(图5C)。
注:为了将心室固定在一个开放的位置,一些肌肉将不得不被削减。在右心室中识别自由奔跑的气管(图5D-E)。 - 使用弹簧剪刀和钳子,切开四周气管周围的壁组织,然后将壁组织切成两半,直切至气管的方向。修剪壁组织,直到其尺寸适合使用的安装配置。在这种情况下,大约是芝麻种子大小的一半(图5F)。
注:Trabeculae 可以从左右心室进行解剖,但左心室通常更浑浊,不太适用于肉瘤和几何测量。 - 将切除的四叶虫留在解剖室中,不断与解剖溶液进行超融合。
3. 实验协议
注:用于此实验的设备 13 内部构建,并使用自定义控制代码。设计用于复制这些数据的设备的必要考虑因素是两个独立激活的安装钩、一个具有三个光学清晰轴(图 3)的测量室,以及一个外部触发线,该线可与刺激器同步亮场和 OCT 摄像机。PMT 电压和力信号是使用模拟 DAQ 卡收集的,来自 OCT 和亮场显微镜的图像是使用相机链接帧抓取卡收集的,刺激信号是使用数字 I/O 卡收集的。数据使用一组生产者消费者循环离线存储,以保持时间对齐。
- 准备心仪。
- 冲洗热 (+60 °C) 水,蒸馏水(室温),然后通过测量室将溶液超融合。不断用卡博根泡沫超级融合溶液。
- 打开亮场显微镜照明源并按 F1 以实现捕获(图 4A)。手动调整下游挂钩,直到它以明亮的场图像为中心。单击 零下游轴,然后 下游禁用 ,使电机(图4C)。移动 DS 设置点 [嗯] 滑块,直到挂钩的末端与默认感兴趣区域的边缘对齐。
- 重新归零下游轴,然后将 DS 设置点 [嗯] 滑块移动到 1000。使用上游挂钩重复此过程,但不要移动 美国设置点 [嗯] 滑块。
- 单击 移动到安装 (图 4C)。
- 启动荧光照明系统时,先扭动 灯 开关,然后通过切换 主 开关快速打开控制器子系统。
注:一些紫外线光源产生大量的臭氧。如果是这样的话,将臭氧萃取器连接到光源的出口通风口,并确保在打开荧光照明源之前运行。 - 通过按前面板上的模式按钮将操作模式切换到涡轮增压,然后是2,然后是1。按下在线按钮,使控制代码能够通知操作。
- 安装特拉贝库拉。
- 暂停通过测量室的超融合流。将安装室填充解剖溶液。
- 使用 1 mL 注射器,将气管从解剖室传输到安装室(图 5G)。
- 要转移气管,请垂直放置注射器,并与安装室解决方案的表面接触。让特拉贝库拉通过重力进入安装室(图5H)。
- 降低安装室中的液位,使其与钩子的中段平起平位。
- 通过移动 DS 设置点 [嗯] 滑块来调整挂钩之间的距离,以反映气管的松弛长度。
- 使用显微镜帮助可视化,用钳子轻轻抓住一个末端组织碎片,并将其安装到上游钩上。将另一块端组织安装到下游钩上(图5I)。
- 安装安全后,通过按移到腔室(图 4C),将 trabecula 移回测量室(图 5J)。恢复超融合流和流体提取。
- 将刺激频率 [Hz]设置为 1,将刺激持续时间 [ms]设置为 10,将刺激电压设置为 10。开始刺激按刺激打开? . .
- 准备特拉贝库拉。
- 经过约1小时的适应,分别在1V和1ms步骤中逐渐降低刺激电压和刺激持续时间。一组典型的值是 3 V 和 3 ms。
- 打开明亮的电场照明系统。按 F1 并选择用户界面上包围条纹区域的感兴趣区域。单击 计算 SL? 以计算突出区域的平均肉瘤长度。通过增加 分离设置点 [嗯] 滑块,增加肌肉长度,直到平均肉瘤长度为 2.32 μm。
注: 计算 SL? 使用第 4.3 步概述的 2D FFT。用于计算平均肉瘤长度的感兴趣区域通常是 100 μm 到 150 μm 平方。因此,当肌肉接近最佳肉瘤长度时,43 到 65 个肉瘤用于计算平均肉瘤长度。 - 通过调整"中心和分离控制选项卡(图 4C)上的中心设置点 [嗯]滑块来移动肌肉,以便下游挂钩的边缘在亮场图像中可见。收集十次抽搐的荧光信息。
- 将 中心设置点 [嗯] 值增加 200 个,并收集另外 10 个抽搐值的荧光信息。重复此过程,直到亮场图像包含上游挂钩。收集最后一个窗口的荧光信息。
- 将中心 设置点 [嗯] 值设置为 0,将特拉贝库拉返回到中心位置。
- 将刺激频率降低到 0.2 Hz,并从 KH 超级融合切换到 Fura-2 装载解决方案(详见表 1)。
- 每 10 分钟单击"支持 荧光源 " 和"数据 "选项卡,测量荧光信号。可视化 PMT 信号选项卡上的荧光信号。
- 在 360 nm 信号增加 10 倍或加载过程持续时间超过 2 h 后,将刺激频率返回到 1 Hz 并切换回 KH 超融合解决方案。
- 每 10 分钟检查一次比率测量,直到比率测量稳定下来,此时可以开始数据收集。
- 收集亮场和荧光成像数据。
- 将肌肉返回到下游钩的边缘刚刚存在于亮场图像中的位置。通过单击硬件控制用户界面的Stim 和数据选项卡上的"流数据"到磁盘,开始流式传输硬件数据。点击启用荧光源捕捉荧光信息。
- 在亮场成像用户界面上,将捕获模式设置为外部触发器,将帧速率提高到 100 Hz,并将捕获的图像数设置为 100。按 Ctrl + Shift = S, 然后是 F1, 以记录此窗口的亮场成像数据。
- 将 中心设置点 [嗯] 值增加 200,并重复步骤 3.4.2。继续扫描协议,直到从第 3.3.4 步收集到最终窗口的成像数据。
- 将中心 设置点 [嗯] 值设置为 0,将特拉贝库拉返回到中心位置。
- 收集 OCT 成像数据。
- 打开 OCT 激光源,将主密钥转动到|符号,按下电源按钮,然后是 SLD 按钮。
- 盖住电压计头,单击获取 BG以测量背景干扰模式,并从测量中减去它(图 4B)。
- 将图像捕获模式设置为实时查看。
- 调整 y位置,直到 B 扫描图像仅包含上游钩。将控制前面板(图4B)上显示的肌肉长度除以2,并减去当前 的y位置。将此值输入"y-偏移"输入。调整"x-偏移"值,直到特拉贝库拉的横截面以框架为中心。
- 以特拉贝库拉为中心,通过调整 y 位置来扫描 y 轴,以找到与上下游挂钩对应的位置。请注意这些位置向下。将范围 Y(步骤)设置为这些值除以 10 的绝对差异。
- 将图像捕获模式设置为"刺激触发",将范围 X(步骤)设置为 100,然后单击"设置活动参数"按钮。
- 单击 流 B 扫描数据?,然后 获取。
注:门控成像协议需要 200 个抽搐才能捕获整个肌肉几何形状,样本长度为 2 毫米,对应于捕获时间为 +3 分 20 秒。
4. 处理亮场图像数据集
- 准备图像进行分析。
- 将图像导入图像J(文件>导入>图像序列>选择图像)。
- 增加图像对比度(图像>调整>亮度/对比度>移动最小和最大滑块以集中图像直方图)。
- 锐化图像(处理>滤镜>脱沙面膜>设置半径(西格玛) 到1.0像素和 面具重量 (0.1-0.9)到0.6)。
- 导出图像序列(保存为>图像序列>将格式设置为 PNG,从 0 开始,数字 (1-8) 到 4)。
- 拼接图像,测量局部位移,并计算局部肉瘤长度。
- 打开"Trabecula 处理.m"(可应要求提供),并将文件夹路径变量设置为包含所有数据的主文件夹,并将图像路径设置为保存第 4.1.4 步图像序列的文件夹。将部分设置为成像窗口和帧数,以设置为每个窗口捕获的帧数。
- 运行代码。
注:输出将存在于用户指定的输出文件夹路径中。(默认情况下,路径设置为文件夹路径/输出)。
- FFT 肉瘤长度技术
- 使用图像处理软件在图像高度可见的区域执行 FFT。
- 在计算反向以获得感兴趣的空间频率范围之前,将步骤 1.1.6 的像素从步骤 1.1.6 乘以 1.6 μm 和 3.0 μm。
- 将指数与 FFT 结果相符,忽略步骤 4.3.2 中计算的频率范围内的频率信息,并将其从转换结果中减去以删除直流术语。
- 将高斯曲线与感兴趣的频段相契合。
- 计算高斯曲线峰值的反向。这是感兴趣的区域的平均肉瘤长度。
注:FFT 计算和指数和高斯方程的拟合是使用自定义 LabVIEW 代码执行的。
5. 处理荧光数据
- 从各自的窗口减去窗口依赖的自动流变,并计算与 340 nm 和 380 nm 激发波长相关的信号的商数。
6. 处理 OCT 成像数据
- 准备 OCT 图像集进行细分。
- 打开图像J并导入图像(文件>导入>图像序列)。在文件浏览器窗口上,打开、定位图像、选择图像并单击 "打开"。
注:如果 OCT 的控制代码没有以 ImageJ 可读的格式存储图像,则将其转换为 PNG。 - 为了便于可视化,将图像序列组织成超堆栈(图像>超堆栈>堆栈到超堆栈)。在打开的对话框中,将切片数量设置为每片 B 扫描次数,X 将切片数量设置为沿特拉贝库拉长度的切片数量。
- 绘制一个矩形,包围特拉贝库拉。使用超堆栈窗口上的滑块确认它通过时间封闭整个音量。将图像裁剪到窗口(图像>作物)。
- 删除包含安装挂钩图像的切片(堆栈>工具>切片守护者)。选择仅包含特拉贝库拉信息的切片范围。
- 打开图像J并导入图像(文件>导入>图像序列)。在文件浏览器窗口上,打开、定位图像、选择图像并单击 "打开"。
- 火车韦卡分割。
- 打开 WEKA 分割 (插件>分割>可训练的韦卡分割) 。
- 将选择模式设置为手。
- 单击 "设置" 并调整分类器和培训设置。(对于此模型,使用了以下培训功能:高斯模糊、索贝尔滤镜、赫西安、高斯差异、膜投影、双边和利普斯基茨。膜厚度设置为 1,膜贴片大小为 8,最小西格玛设置为 1,最大西格玛设置为 32。分类器设置为快速兰多姆森林,分类器选项设置为:批量大小 100,最大深到 32,数字功能到 32,数字数字到 0,和数字树到 200。
- 手动分割图像,直到培训结果达到令人满意的细分。
- 保存分类器。
- 分割经过处理的 B 扫描
- 在步骤 6.2.1 之后启动 WEKA 细分。
- 加载第 6.2.5 步的分类器。
- 单击 "创建结果"。
- 将图像转换为 8 位(图像> 类型> 8 位)。
- 将图像转换为二进制(处理>二进制>使二进制>默认方法和默认背景)。
- 保存为图像序列 (PNG)。
- 计算分段 B 扫描图像中的平均 CSA。
- 计算二进制 B 扫描图像中的白色像素数。
- 将像素面积乘以校准深度分辨率(从步骤 1.2)和 10 μm(相邻 A 扫描之间的距离)。
- 重复所有挂钩之间的 B 扫描和平均测量。
- 将分段图像转换为网格。
- 打开"OCTmain.m"(可应要求提供),并将图像定向到包含第 6.3.6 步输出的文件夹。根据需要设置输出路径。
- 将切片设置为"范围 Y(步骤)"(步骤 3.5.5)和帧到"重复 X"(步骤 3.5.6)、z_dim深度分辨率(步骤 1.2.10)和x_dim = y_dim到分配给 10 的值。
- 单击 "运行"。
结果
为了捕捉区域Ca2+ 和明亮的领域信息,为整个长度的特拉贝库拉呈现在这里,需要7个肌肉位置。 图6 表明抽搐力不受这一运动干扰,表明活力生产没有位置依赖性。
使用光学相干断层扫描收集的B扫描以100 Hz的速度被分割使用图像J插件WEKA14(图7A)。由于横向(10 μm)和深度(1.73 μm(心肌))分辨率之间的差异,每个横截面都出现扭曲。通过横向分辨率深度分辨率比缩放图像的深度轴来纠正此失真。图7B,C表明,在缩放了特拉贝库拉的原始C扫描后,它大约是几何中的圆柱形。测量室壁的反射有时可能与肌肉数据重叠(图7A,B),但分割软件可以训练来解释这一点(图7D,E)。一旦分割,沿着肌肉长度的横截面区域可以计算整个抽搐(图7F)。请注意,这个特殊的特拉贝库拉有一个小的附属分支从它。分支的运动是明显的 +0.75 毫米沿特拉贝库拉。最后,分割图像可以转换成网格,以帮助构建几何模型(图7G)。
以100 fps的速度在每个不同气管位置捕获的成像数据被拼接在一起,以创建一个单一的特拉贝库拉图像(图8A)。这些图像的分辨率为 0.535 μm/像素。在相邻窗口重叠区域使用线性加权功能有助于可视化,并最大限度地减少亮场图像中出现的晕影的影响。为了测量荧光信号,以 340 nm、365 nm 和 380 nm 波长的光周期性照明,速度为 600 Hz。在特拉贝库拉加载 Fura-2 后,与 340 nm 和 380 nm 激发光相关的发射荧光比例与细胞内钙相关。由于此测量是一个比率,有效测量速率为 200 Hz。每个窗口的平均(n = 10) 细胞内 Ca2+ 瞬态与它们被映像的区域对齐 (图 8B)。虽然瞬态的峰值看起来相当一致,但沿特拉贝库拉的区域内的舒张剂 [Ca2]较低,在 900 μm 和 1800 μm 之间。同样,位移跟踪(图8C)和肉瘤长度(图8D)计算的结果也表明存在区域变异性。使用的无标记跟踪技术能够处理每个像素的位移,给予足够的对比度。在绘制帖子中肉瘤长度分布图时,使用 128 像素乘 128 像素(+67 μm 乘 67 μm)的交叉相关区域来计算区域肉瘤长度。当接近样本接近最佳肉瘤长度时,此区域将封装约 29 个肉瘤。每个交叉关联窗口中心之间的步进大小(在 x 和 y 方向上)被设置为 50 像素(+26 μm),用于处理这些数据。根据高斯式适合 FFT 信号的宽度和振幅测试了肉瘤长度估计的适用性。这些条件在 0 μm 和 500 μm 之间的肌肉区域未满足,因此无法在那里计算肉瘤长度信息。鉴于相关的位移,该地区肉瘤很可能在收缩阶段拉长。与这种推测一致,在此期间,特拉贝库拉右侧的平均肉瘤长度缩短。通过结合每个小组提供的信息,具有最大横截面面积的区域似乎不会产生最重要的力量。假设 Ca2+ 瞬态的区域变异具有大致平滑的梯度, 图 8B 表示最大振幅 Ca2+ 瞬态发生在特拉贝库拉的 1300 μm 和 1600 μm 之间。位移图表明,运动最少的区域与峰值 Ca2+ 瞬态非常一致。但是,此区域具有样本中最小的横截面区域。考虑到这些数据,我们可以推断出这个区域产生的压力最大。

图1:心仪的注释图像。 概述了每个主要光学组件。内嵌件包含显微镜目标的特写后视图, 位于测量室下方。 请单击此处查看此图的较大版本。
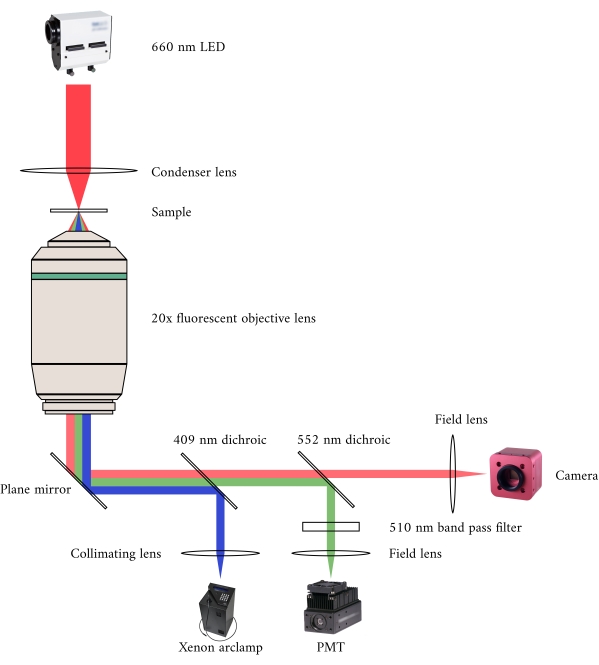
图2:同时进行亮场和荧光显微镜的光学通路。 荧光显微镜的照明源是 Xenon 弧形灯,其输出周期性地在 340 nm、365 nm 和 380 nm 光之间切换。电弧灯输出路径包含一个分色镜,截断波长为 409 nm,可将紫外线反射到将光线引导到荧光显微镜目标的镜面上。镜头将激发光聚焦在样品上,并收集发射的光,其波长较长为 510 nm。这种发射的光穿过第一面二色镜,而不是第二面,因为它的断断波长为552纳米。然后,现场透镜将反射光对焦到 PMT 的传感器上。同时,亮场显微镜的照明源(660 nm LED)位于样品上方。传输的光通过冷凝器透镜聚焦到样品上,20×荧光目标可捕获由此产生的传输图像。用于亮场照明的波长超过每个二色镜的截断波长,因此在图像聚焦到 CMOS 摄像机的传感器之前,波长会穿过这两个波长。 请单击此处查看此图的较大版本。
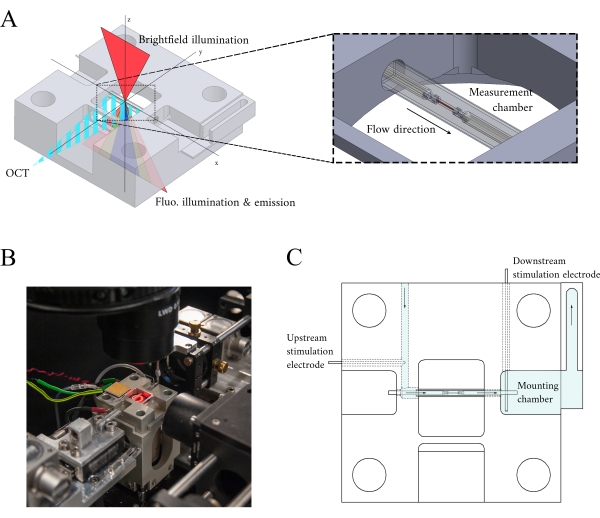
图3:测量室支架设计。(A)测量室支架的测定视图,光学路径覆盖。亮场照明来自上部表面(z轴):荧光照明来自劣质表面(z轴),测量臂 OCT 信号正交到其他照明轴(y-axis)。在实验过程中,两个铂金钩在作为测量室的玻璃毛细管内持有一个气管。语音线圈电机控制每个挂钩,其位置使用激光干涉测量测量。当前位置与用户定义的设定点进行比较,并且使用 FPGA 中编码的 PID 控制器,将错误降至最低。(B) 测量室就地打开,亮场照明打开。后视图显示在图 1插图中。(C) 超融合流通过测量室支架的示意图。超级融合进入方块的后部,并流向箭头指示的方向。上部和下游电极建立现场刺激,以引起测量室中安装的气管的收缩。蓝色阴影表示实验期间超级融合流动的区域。请单击此处查看此图的较大版本。
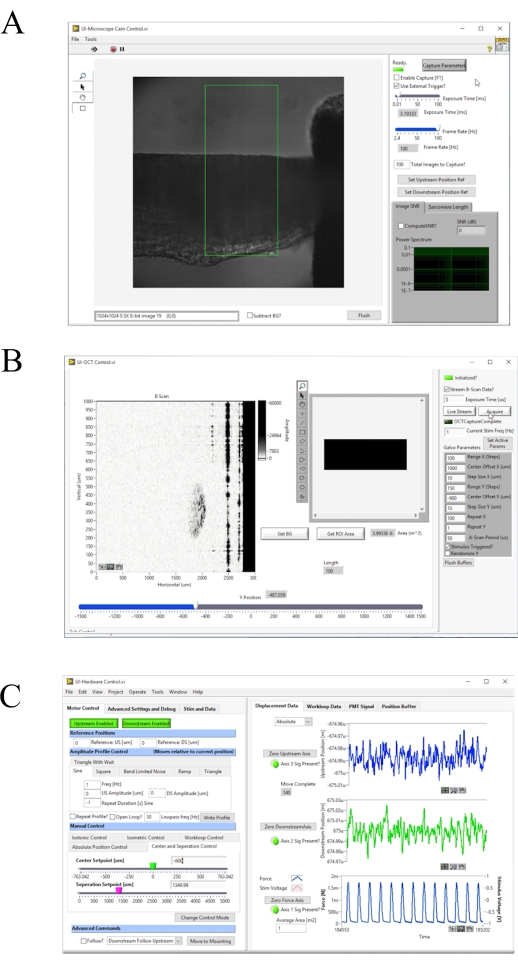
图4:图像采集与控制软件的前面板。 (A) 布莱特菲尔德成像用户界面。(B) OCT 成像用户界面。(C) 硬件控制用户界面。 请单击此处查看此图的较大版本。
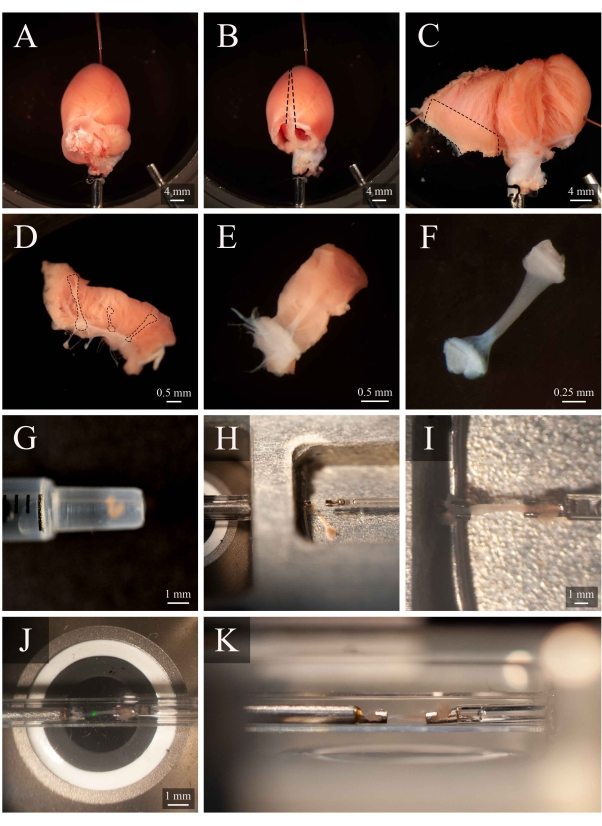
图5:解剖和安装方案。 (A) 解剖室中兰根多夫香老鼠心脏。 (B ) 同一颗心与阿丽亚删除。虚线表示切除轨迹以打开心室。(C) 一颗敞开的心,露出两个心室的内部。破折号框表示通常发现气管的区域。(D) 切除右心室壁区域(与 C 中的破折号框所示)。虚线突出显示三个气管。(E) 从 D .(F) 中的三个中挑选出的特拉贝库拉, 从 E 面板中取出, 将壁组织移除。(G) 1 mL 注射器末端的隔离气管。(H) 安装室中的特拉贝库拉。(I) 安装在两个铂金钩之间的特拉贝库拉。(J) 安装在钩子之间的特拉贝库拉,在测量室内(图3B)。绿点是来自第一个二色滤芯的人工制品。(K) 测量室内安装的特拉贝库拉的次要角度。特拉贝库拉和显微镜客观透镜之间的距离约为 1 毫米,请单击此处查看此图的较大版本。
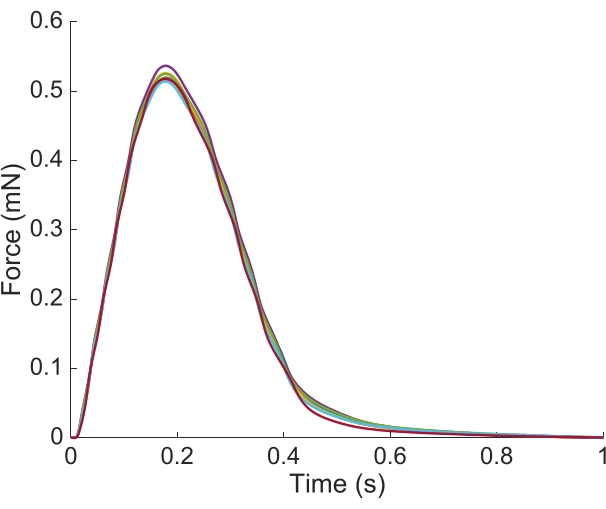
图6:力量测量的位置依赖性。 肌肉从每个成像位置产生的力(n = 7) 覆盖。平均活性力生产为0.527 mN±0.003 mN,收缩时间为50%,收缩77.1ms±0.3ms,时间为50%放松328.1ms±0.9ms(所有数据均以SE±表示)。 请单击此处查看此图的较大版本。
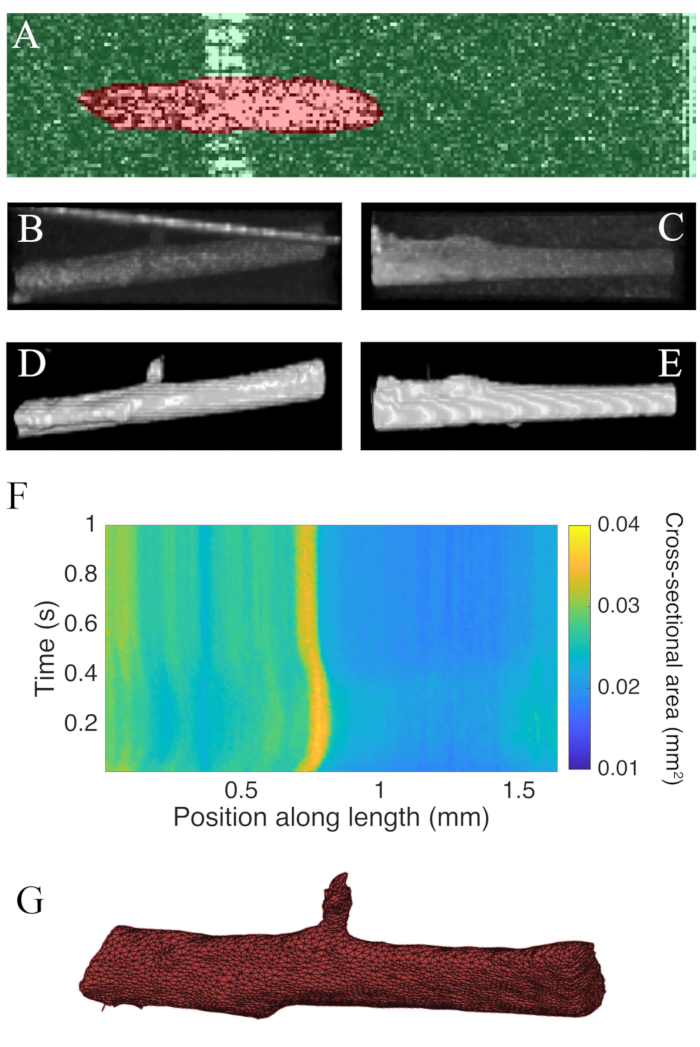
图7: OCT成像分析。 (A) WEKA 分割示例。肌肉的分割横截面以红色突出显示,背景以绿色突出显示。(B) 对特拉贝库拉原始 C 扫描数据的高级视图。朝向图像顶部的亮角线是测量室壁的反射。(C) 横向查看特拉贝库拉的原始 C 扫描数据。(D) 对细分的 OCT 数据的高级视图。(E) 对分段 OCT 数据的横向视图。(F) 沿特拉贝库拉(x 轴) 长度的横截面区域(y轴)。沿肌肉长度的平均横截面面积为 0.0326 mm2 ± 0.0005 mm2( 平均± S.E.)(G) 特拉贝库拉的网格。网格已大致与面板 F 的横截面区域图对齐。 请单击此处查看此图的较大版本。
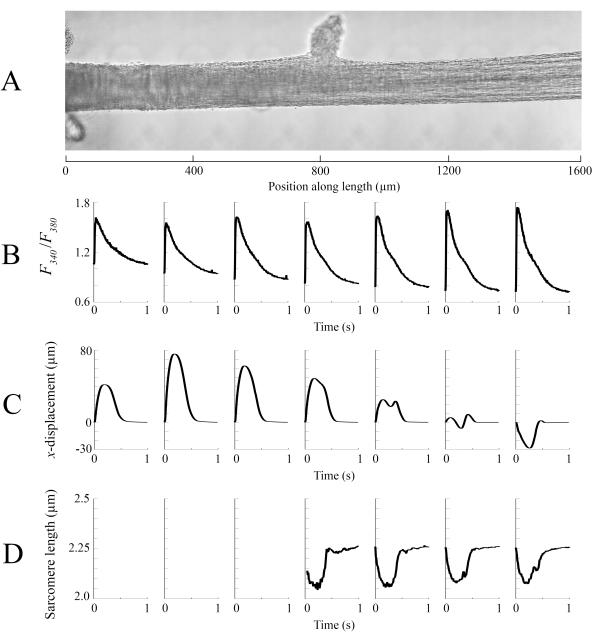
图8:光明场和荧光成像分析。 (A) 缝合图像(七个成像窗口)的气管。(B) 沿特拉贝库拉长度的ca2+瞬态。(C) 每个成像窗口的平均 x位移。正位移表示向右的运动,向左表示向右运动的向右运动。(D) 每个具有必要图像对比度成像窗口的平均肉瘤长度。 请单击此处查看此图的较大版本。
表1:解决方案表请点击这里下载此表。
讨论
在这项研究中,我们提出了一个配置,使三个光学系统的组装结合了亮场,荧光和OCT成像,以收集数据从积极收缩的前体内心脏气管(图1和图2)。这种精心策划的集成是可能的,因为测量室(图3)的设计,使OCT的正交排列到明亮的场荧光轴。肌肉安装系统在心脏肌肉激发收缩动力学特征的关键指标同时量化的成功中起着同样重要的作用。它的新颖性在于使肌肉扫描程序没有明显的干扰肌肉的机械性能(图6)。该系统结合成像配置和电动钩系统进行力测量,可评估Ca2+瞬态、位移和肉瘤长度的区域异质性,以及在抽搐过程中收缩的气管的宏观几何信息(图7和图8)。
鉴于心脏研究实验室中明亮的场-表光成像系统无处不在,这些结果的复制可以通过一些次要的硬件考虑来实现。在这里,我们介绍了图像处理工具包,用于结合亮场-表光和OCT,这在分析潜在的收缩异质性方面至关重要。OCT 的集成需要畅通无阻的光学路径,而门控成像需要刺激和 OCT 和亮场成像摄像机之间的外部触发线,以及能够将样品移动到整个测量室的肌肉安装钩。所需的后处理软件和方法可免费获得。特别是,使用的细分软件WEKA14是开源的。材料点8、肉瘤长度、门控体积成像10和网状生成代码的无标记跟踪技术同样可访问,并可应相应作者的要求提供。
肌肉生存能力、Fura-2 的最佳负载和图像对焦是构成成功实验基础的三大支柱。使用含有BDM的解剖溶液来防止收缩、注射器中肌肉的输送、溶液的连续氧合,以及在实验当天准备新的实验解决方案,所有这些都有助于提高肌肉的生存率。在用 Fura-2AM 装载特拉贝库拉之前,必须收集对每种情况的自动荧光,因为这会对测量的 Ca2+ 瞬态15产生重大影响。Fura-2AM 装载解决方案的氧合由于需要加入表面活性剂普鲁尼奇-F127 以帮助染料装载而变得复杂。为了对抗这种表面活性剂引起的过度气泡形成,装载溶液中的一小滴防泡沫使用户能够提高氧化率,从而提高 trabecula 在整个装载过程中保持功能活力的机会。最后,成像焦点必须沿肌肉长度均匀,以最大限度地提高亮场和荧光信息的信号与噪声比。
此处提出的方法有两个限制需要考虑。首先是荧光显微镜的空间分辨率。虽然 OCT 的空间分辨率和亮场成像率很高,但荧光显微镜的分辨率仅限于从 540 μm 乘 540 μm 成像窗口内捕获的体积中捕获的荧光的完整性。使用高增益耦合装置摄像头(而不是 PMT)来捕获荧光信号,以牺牲信号与噪声比16为代价,从而增加荧光显微镜的空间分辨率。第二是气管的直径,可以从可测量的肉瘤长度和几何深度来研究。用于计算肉瘤长度的窗口式 FFT 方法利用了改进空间分辨率的好处,但与降低稳健性相关(图 8D)。在需要研究浑浊或大直径气管的情况下,由于与较大组织样本中的肉瘤带相关的对比度降低,FFT 的可溶性将大大降低。同样,在 OCT 中,来自大于 300 μm 的成像深度的背反射将太弱,无法在分割阶段解决。因此,我们的技术仅限于直径小于 300 μm 的气管。然而,不建议研究大直径样品,因为在高刺激率17期间,肌肉核心的扩散氧合可能有问题。
我们的方法使离子机械功能与健康和患病肌肉中的肌肉几何学相关,为理解心脏肌肉生理学、病理生理学和药理学提供了强有力的方法。此处概述的图像处理管道提取的数据对于更深入地了解收缩异质性至关重要。充分实现如此丰富的数据集潜力的一个途径是构建集成和解释这些数据的数学模型,并做出可使用我们的设备进行实验性测试的预测。
披露声明
作者没有什么可透露的。
致谢
这项研究由奥克兰大学(授予JD和MC)、查尔斯·赫库斯爵士健康研究奖学金(20/011和21/116)的新西兰健康研究理事会(授予J-CH至KT) 的博士奖学金资助。 分别由国家心脏基金会(授予AA)、新西兰皇家学会颁发的马斯登快速启动助学金(UOA1504和UOA1703)颁发的博士学位(授予J-CH和KT, 分别)和来自新西兰皇家学会的詹姆斯·库克研究奖学金(授予美国之友协会)。该仪器的最初开发由新西兰皇家学会(授予美国之和军用)的马斯登赠款(11-UOA-199)资助。
材料
| Name | Company | Catalog Number | Comments |
| 2,3-Butanedione monoxime | Acros Organics | 150375000 | |
| 20× microscope lens | Nikon | CFI Super Fluor 20× | NA 0.75 |
| 2D Galvanometer | Thorlabs | GVSM002/M | |
| 50-50 beam splitter | Thorlabs | FC850-40-50-APC | |
| 90-10 beam-splitter | Thorlabs | TW850R2A2 | |
| Analogue input module | National Instruments | NI-9205 | Records the PMT signal at 200 kHz |
| Brightfield imaging light source | CoolLED | PE-2 | 660 nm LAM |
| Broadband light source | Superlum | Broadlighter-840 | |
| CaCl2 | Sigma-Aldrich | C4901 | |
| Cameralink card | National Instruments | NI-1429 | Brightfield imaging frame grabber |
| Carbogen 5 | BOC | Gas code: 181 | |
| Condensor lens | Nikon | LWD 0.52 | |
| D(+)-Glucose | Merck | 108337 | |
| DAQ | National Instruments | NI-6259 | Triggers the galvanometer movement |
| Dichroic mirror 1 | Semrock | FF409-Di03 | |
| Dichroic mirror 2 | Semrock | FF552-Di02 | |
| Diffraction grating | Wasatch Photonics | 1200 lines/mm @840 nm | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855 | |
| Direct-Q 3 UV System | Merck Millipore | ZRQSVR3WW | Distilled water machine |
| Dry bath | Corning | 6875-SB | LSE digital dry bath |
| FIJI | ImageJ | Open-source image processing software | |
| Fura-2AM pentapotassium salt | Thermofisher | F14186 | |
| Hardware FPGA card | National Instruments | NI-7813R | Also controls the triggering of the brightfield capture |
| Heparin | Pfizer | 61024 | |
| HEPES | PanReac AppliChem | A1069 | |
| Inverted microscope | Nikon | TI-DH illumination pillar | |
| Isofluorane | MedSource | VAPDRUGISO250 | |
| KCl | Sigma-Aldrich | P9541 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Line-scan camera | Basler | spL2048-70km | Spectrometer camera |
| Magnetic stirrer | IKA | 3810000 | RCT basic |
| Matlab | Mathworks | Data processing code | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| MgSO4.7H2O | Sigma-Aldrich | M1880 | |
| NaCl | Sigma-Aldrich | 71376 | |
| NaH2PO4.2H2O | Sigma-Aldrich | 71505 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| OCT FPGA card | National Instruments | NI-1483R | |
| Oxygen tank | BOC | Gas code: 100D | |
| pH meter | Mettler Toledo | MP220 | |
| Photomultiplier tube | Hamamatsu | H7422-20 | |
| Powerload | Thermofisher | P10020 | |
| Superluminescent diode | Broadlighter | D-840 | |
| Transimpedance amplifier | Custom | ||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 252859 | |
| Wistar rat | Vernon Jansen Unit | 8 – 10 weeks | |
| Xenon arc lamp | Sutter Instrument | DG-4 | Lambda DG-4 |
参考文献
- Han, J. -. C., et al. Energetics of stress production in isolated cardiac trabeculae from the rat. American Journal of Physiology. Heart and circulatory physiology. 299 (5), 1382-1394 (2010).
- Ter Keurs, H. E. D. J., Rijnsburger, W. H., Van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Shen, X., Cannell, M. B., Ward, M. L. Effect of SR load and pH regulatory mechanisms on stretch-dependent Ca2+ entry during the slow force response. Journal of Molecular and Cellular Cardiology. 63, 37-46 (2013).
- Dowrick, J. M., et al. The slow force response to stretch: Controversy and contradictions. Acta Physiologica. 226 (1), 13250 (2019).
- Stuyvers, B. D. M. Y., Miura, M., Ter Keurs, H. E. D. J. Diastolic viscoelastic properties of rat cardiac muscle; involvement of Ca2+. Advances in Experimental Medicine and Biology. 430, 13-28 (1997).
- Tang, E. J. L. P., Laven, R. C., Hajirassouliha, A., Nielsen, P. M. F., Taberner, A. J. Measurement of displacement in isolated heart muscle cells using markerless subpixel image registration. Conference Record - IEEE International Instrumentation and Measurement Technology Conference. , (2019).
- Bers, D. M. Cardiac excitation-contraction coupling. Nature. 415 (6868), 198-205 (2002).
- Cheuk, M. L., et al. A method for markerless tracking of the strain distribution of actively contracting cardiac muscle preparations. Experimental Mechanics. 61 (1), 95-106 (2020).
- Lippok, N., Coen, S., Nielsen, P., Vanholsbeeck, F. Dispersion compensation in Fourier domain optical coherence tomography using the fractional Fourier transform. Optics Express. 20 (21), 23398 (2012).
- Cheuk, M. L., et al. Four-Dimensional imaging of cardiac trabeculae contracting in vitro using gated OCT. IEEE Transactions on Biomedical Engineering. 64 (1), 218-224 (2017).
- Ritland, H. N. Relation between refractive index and density of a glass at constant temperature. Journal of the American Ceramic Society. 38 (2), 86-88 (1955).
- Tuchina, D. K., Bashkatov, A. N., Genina, E. A., Tuchin, V. V. Quantification of glucose and glycerol diffusion in myocardium. Journal of Innovative Optical Health Sciences. 8 (3), (2015).
- Taberner, A., et al. A dynamometer for nature's engines. IEEE Instrumentation and Measurement Magazine. 22 (2), 10-16 (2019).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: A machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Jiang, Y., Julian, F. J. Pacing rate, halothane, and BDM affect fura 2 reporting of [Ca2+](i) in intact rat trabeculae. American Journal of Physiology - Cell Physiology. 273 (6), 2046-2056 (1997).
- Miura, M., Boyden, P. A., Ter Keurs, H. E. D. J. Ca2+ waves during triggered propagated contractions in intact trabeculae. American Journal of Physiology - Heart and Circulatory Physiology. 274 (1), (1998).
- Han, J. -. C., et al. Radius-dependent decline of performance in isolated cardiac muscle does not reflect inadequacy of diffusive oxygen supply. American Journal of Physiology-Heart and Circulatory Physiology. 300 (4), 1222-1236 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。