Method Article
אופטוגנטיקה ביולומינסנטית 2.0: רתימת ביולומינציה להפעלת חלבונים פוטו-חושיים במבחנה וב-Vivo
In This Article
Summary
אור ביולומינציה הנפלט על ידי אנזים לוציפראז המחמצן מצע של מולקולה קטנה, ניתן לרתום לוציפרין כדי להפעיל חלבונים פוטו-חושיים, ובכך להוסיף ממד נוסף לגירוי האור ולאפשר מניפולציה של שפע של פונקציות בתיווך אור בתאים על פני קשקשים זמניים ומרחביים.
Abstract
ביולומינציה - אור הנפלט על ידי אנזים לוציפראז המחמצן מצע מולקולה קטן, לוציפרין - שימש במבחנה וב - vivo להפעלת תעלות יונים ומשאבות מגודרות אור בתאי עצב. בעוד שגישה זו של אופטוגנטיקה ביו-זוהרת (BL-OG) מעניקה רכיב כימי לכלים אופטוגנטיים, היא אינה מוגבלת לשימוש במדעי המוח. במקום זאת, bioluminescence ניתן לרתום כדי להפעיל כל חלבון פוטואורי, ובכך לאפשר מניפולציה של שפע של פונקציות בתיווך אור בתאים. ניתן להתאים מגוון זוגות לוציפראז-לוציפרין לחלבונים פוטו-חושיים הדורשים אורכי גל שונים של עוצמות אור ואור.
בהתאם ליישום הספציפי, אספקת אור יעילה יכולה להיות מושגת באמצעות חלבוני היתוך לוציפראז-photoreceptor או על ידי שיתוף פעולה פשוט. חלבונים פוטו-חושיים המבוססים על דימריזציה תלוית אור או שינויים קונפורמציה יכולים להיות מונעים על ידי ביו-לומינציה כדי להשפיע על תהליכים תאיים מלוקליזציה של חלבונים, ויסות מסלולי איתות תאיים לשעלול. הפרוטוקול שלהלן מפרט את הביצוע הניסיוני של הפעלת ביולומינציה בתאים ובאורגניזמים ומתאר את התוצאות באמצעות רקומבינסים מונעי ביו-לומינציה וגורמי שעתוק. הפרוטוקול מספק לחוקרים את ההליכים הבסיסיים לביצוע אופטוגנטיקה ביולומינסנטית במבחנה וב - vivo. ניתן להרחיב עוד יותר את הגישות המתוארות ולהתאים אותן למגוון פרדיגמות ניסיוניות שונות.
Introduction
חלבונים פוטו-חושיים יכולים להיות מופעלים על ידי אור ממקור אור פיזי או מאנזים לוציפראז בנוכחות המצע שלו, לוציפרין, כדי ליצור ביולומינציה. עבור יישומים הדורשים צירי זמן של מילי-או אפילו פמטו-שניות ו/או רזולוציה מרחבית של תא יחיד, מקורות אור פיזיים (לייזרים ודיודות פולטות אור (נורות LED)) הם היחידים הנטויים לקשקשים אלה. דוגמאות הן ההגבלה המרחבית של אור המשמש לגירוי קטבים מנוגדים בפיתוח זחלי Drosophila עם שליטה זמנית אלפית שנייה1 או גירוי מדויק של מבנים תת-תאיים בודדים כגון צינורות מיטוכונדריאליים2. עם זאת, ליישומים רבים אחרים למתגים אופטיים יש סדרי עדיפויות שונים, כולל שליטה מרחבית מורחבת ויישום חוזר ונשנה באופן לא פולשני וללא נזק קל, אך עם שליטה זמנית מוגדרת בצירי זמן זעירים ובעוצמות טונה. כאן, באמצעות לוציפראזים כמקור אור חלופי להפעלת תחומים חישת אור יש מספר יתרונות. בניגוד להפעלת אור סיב אופטי, ביולומינציה מגיעה לכל תחום חישת אור המתבטא באוכלוסיית תאי היעד כאשר מקור האור מקודד גנטית. שימוש בביולומינציה מקל על החששות מפני נזק לרקמות ולתאים על ידי סיבים אופטיים וחשיפה ממושכת לאור פיזי. האור מופעל עם היישום של מצע לוציפראז. ההתחלה היא מיידית במבחנה ו in vivo בהתאם לתוואי הממשל ונמשך ~ 15-30 דקות; נוכחות ממושכת או גירוי פאזי של אור ניתן להשיג עם לוציפרינים שונים עם יישומים נוספים או חוזרים ונשנים של מצע3. לבסוף, פליטת bioluminescence ניתן לכוונן על ידי שינוי הריכוז של לוציפרין.
השימוש בביולומינציה להפעלת קולטני אור הנעים ביון, כלומר, אלמנטים אופטוגנטיים, כגון channelrhodopsins או משאבות, הוכח בהרחבה4,5,5,6,7,8. גישה זו של OptoGeneticscent BioLuminescent (BL-OG) נוצלה בניסויי vivo בעכברים ובחולדות5,6,7,9,9,10,11,12. BL-OG הפעלה של opsins נמצאה לדרוש כמות של bioluminescence של לפחות ~ 33 μW / mm2, עם יעילות ההפעלה גדל עם פליטת אור גבוהה יותר6,9. קולטני אור חושיים נעים-יונים הם תת-קבוצה של הנציגות הגדולה של קולטני אור חושיים הנמצאים בטבע שאינם נעים ב-13,14. ההרחבה של ביולומינציה להפעלת קולטני אור שאינם יון, כגון פוטו-חישת תחומים מצמחים או חיידקים, מעודדת על ידי דיווחים15,16 כי פוטו-צנזורים הנעים שאינם יון רגישים יותר לאור באופן משמעותי מאשר channelrhodopsins, הבטחת כונן טוב עוד יותר של חיישני אור עם bioluminescence ממה שכבר הושג עם אלמנטים אופטוגנטיים נעים יונים. לאחרונה, מספר פרסומים דיווחו על שימוש בביולומינציה כמקור אור להפעלה של מגוון קולטני אור, כולל תחומים של חישת מתח-אור-חמצן (LOV), תחומים של אור כחול-באמצעות-פלאבין (BLUF) וכריכומים קריפטוגרפיים (CRYs)3,17,18,19,20,20,21,22 (טבלה 12) ). יישומים להפעלה מונעת ביו-לומינציה של מתגים אופטיים התמקדו בתהליכים תאיים, החל ממוות תאים המושרה על ידי מינים של חמצן תגובתי, סינתזת קנבוסה, גיוס חלבונים ופירוק לרקומבינציה גנומית ואינדוקציה של שעתוק.
פרוטוקול זה מתאר את העיצוב הכללי של כלים אופטוגנטיים מונחי ביולומינציה ומפרט את ההליכים לביצוע ניסיוני של הפעלת ביולומינציה בתאים ובאורגניזמים. הוא כולל תיאורים כיצד להקים חדר, מכסה המנוע של תרבית הרקמות והאינקובטור, ומיקרוסקופ לעבודה עם ביולומינציה, כמו גם את השלבים מהכנת הלוציפרין ליישום זה. פרוטוקול זה מספק לחוקרים את ההליכים הבסיסיים לביצוע BioLuminescent OptoGenetics (BL-OG) במבחנה וב - vivo. ניתן להרחיב עוד יותר את הגישות המתוארות ולהתאים אותן לפרדיגמות ניסיוניות שונות. אנו צופים פרוטוקול זה כדי להקל על אימוץ השימוש ביולומינציה במחקרים ביולוגיים אופטוגנטיים.
Protocol
כל ההליכים במחקר הנוכחי בוצעו באמצעות הוועדה המוסדית לטיפול בבעלי חיים ושימוש (IACUC) אישר פרוטוקולים לטיפול בבעלי חיים באוניברסיטת מרכז מישיגן, MI.
1. הפעלה ביולומינציה של חלבונים פוטו-חושיים במבחנה
- מבנים
- בחר רצף לוציפראז או רצף היתוך חלבון לוציפראז-פלואורסצנטי שיביא לביטוי של פולט אור המייצר אור של אורך גל התואם את קולט האור שיופעל.
הערה: לדוגמה, לוציפראזים פולטי אור כחול, כגון וריאנטים של גאוסיה לוציפראז או NanoLuc, ניתנים להתאמה עם קולטני אור כחולים כגון CRY/Ca2+- וחלבון מחייב אינטגרין (CIB), LOV או Vivid (VVD). - אם עדיין לא זמין מחוקרים אחרים או מרבצי פלסמיד, השתמש בטכניקות ביולוגיה מולקולרית סטנדרטיות כדי לשכפל את ה- DNA לביטוי יונקים פלסמיד.
הערה: בחירת היזמים מוכתבת על ידי הצורך לספק ביטוי חזק ומרכיב של המודול פולט האור, כגון זה המסופק על ידי מקדמי CAG ו- CMV. - למחקרים ראשוניים, השתמשו בפלסמידים נפרדים להעברה משותפת של פולט האור וחיישן האור. צור חלבוני היתוך של שני moieties לפי הצורך ולמחקרים הבאים.
- קבל DNAs פלסמיד באיכות גבוהה באמצעות ערכות מיני, מידי או maxiprep בהתאם לפרוטוקולי היצרן.
- בחר רצף לוציפראז או רצף היתוך חלבון לוציפראז-פלואורסצנטי שיביא לביטוי של פולט אור המייצר אור של אורך גל התואם את קולט האור שיופעל.
- תרבית תאים והעברה
הערה: תאי HeLa ותאי HEK293 משמשים כדוגמאות בפרוטוקול זה.- תאי לוחיות בתבניות ובמספרים בהתאם לשימוש הסופי הרצוי.
הערה: דוגמאות ספציפיות ניתנות בטבלה 2. צפיפות התאים בזמן הציפוי תקבע כמה מהר תאים יכולים להיות מועברים.- להערכת שעתוק המופעל על ידי ביו-לומינציה על ידי מיקרוסקופיה פלואורסצנטית, תאי לוח HEK293 על פולי-D-ליזין (PDL) מצופה 12 מ"מ כיסויים להציב מנות 24-wells.
- להערכת שעתוק המופעל על-ידי ביו-לומינציה על-ידי מדידת פליטת אור מעיתונאי אורתוגונלי לוציפראז בלומינומטר, תאי HeLa צלחת בתחילה ב 6- או 12-well מנות עבור transfection אבל צלחת אותם מחדש לאחר transfection (ראה שלב 4).
- אם גירוי ביו-לומינציה חוזרת תבוצע בתאי הדמיה של תאים חיים, בחר כיסויים בגודל המתאים והנח אותם בלוחות מרובי בארות בגודל המתאים (לוחות 24-well עבור כיסויים של 12 מ"מ; לוחות 12-well עבור 15 מ"מ ו 18 מ"מ כיסויים). זרע את התאים מעל נקודות הכיסוי באמצעות מספרי התאים שצוינו בטבלה 2. אם סוג התא שנבחר אינו נצמד היטב לפני השטח של התרבות, יש למרוח את התאים על כלים מצופים PDL.
- בצע טרנספקטיה על ידי lipofection על פי המלצת היצרן או להשתמש בכל שיטת transfection המתאים לסוג התא שנבחר.
הערה: טבלה 3 מפרטת ניסויי טרנספקטיה עבור שני קולטני אור שונים, EL222 ו- CRY2/CIB, ופלזמידות הכתבים המתאימות שלהם, בנוסף לחלבונים פולטי אור שונים. היחסים של הפלסמידים השונים פועלים היטב עבור הדוגמאות שנבחרו, אך יצטרכו להיות ממוטבים עבור כל זוג פולט אור / חיישן אור. - לאחר ההעברה, הניחו את התאים באינקובטור אטום לחלוטין לאור (איור 1).
- בהתאם לשימוש הסופי הרצוי, להשתמש בתאים לגירוי bioluminescence למחרת הבארות המקוריות שלהם / כלים, או צלחת אותם מחדש 3-4 שעות לאחר lipofection. לקריאת תמלול של גן כתב לוציפראז גחלילית באור, צלחת מחדש את התאים בלוחות לבנים 96-well.
הערה: בצעו את כל המניפולציות בחדר מואר במכסה מנוע זרימה למינארי המואר באור אדום (איור 2).- לשטוף את התאים שהושפעו פעם אחת עם מדיום נשר שונה של Dulbecco (DMEM) או מלוחים חוצצים פוספט (PBS).
- הוסף את הנפח המינימלי של ריאגנט trypsinizing לבארות (24-well: 100 μL; 12-well: 150 μL; 6-well: 300 μL) ודגר את התאים במשך 3 דקות ב 37 °C (37 °F).
- הוסף מדיום תרבית כדי להשיג ריכוז תאים שיניב את צפיפות התא המתאימה לשלב הציפוי הבא (לדוגמה, resuspend תאים בבאר 24-well בנפח סופי של 1.2 מ"ל לציפוי ב 10 בארות של צלחת 96 בארות; resuspend תאים ב 12-well בנפח סופי של 2.4 מ"ל לציפוי ב 20 בארות של צלחת 96-well). מאגר התאים שהושפעו ממספר בארות בהתאם למספר הבארות הדרושות בסופו של דבר.
- צלחת התאים שהודבקו במתכונתם הסופית והחזרת הלוחות לאינקובטור המוגן באור.
- תאי לוחיות בתבניות ובמספרים בהתאם לשימוש הסופי הרצוי.
- הפעלת ביו-לומינציה in vitro
- מכינים את מצע הלוציפראז (לוציפרין).
- הכן 50 mM מניות על ידי המסת 5 מ"ג של coelenterazine lyophilized (CTZ) ב 250 μL של הממס הספציפי שלה. ודא כי כל CTZ לאורך הקירות של הבקבוקון מומס על ידי צנרת או מערבולת. הגן על הבקבוקון מאור ישיר.
- הכן 50 μL aliquots ב 0.5 מ"ל צינורות microcentrifuge שחור ולאחסן ב -80 °C (80 °F) לשימוש עתידי.
הערה: CTZ מומס בממס אינו קופא ב -80 °C (80 °F). ניתן להסיר Aliquots מהמקפיא ולהחזירו למקפיא מספר פעמים להכנת פתרונות עבודה כל עוד החשיפה לאור וטמפרטורת החדר נשמרת למינימום.
- גירוי אור ביו-לומינציה יחיד
הערה: כל המניפולציות מתבצעות בחדר מואר וצמוד במכסה זרימה למינארי המואר באור אדום (איור 2).- הכן פתרון עבודה של לוציפרין במדיום תרבית התא (DMEM או NeuroBasal). התאם את הריכוז של לוציפרין כך הריכוז הסופי הוא 100 מיקרומטר. הכן את כל הדילולים של CTZ בינוני זמן קצר לפני הוספת לתאים, כמו CTZ מתחמצן לאורך זמן.
הערה: אם כל אמצעי האחסון של מדיום יוחלף, פתרון העבודה יהיה 100 μM. אם מדיום המכיל לוציפרין מתווסף לתאים, הריכוז יהיה גבוה יותר על ידי גורם הדילול (לדוגמה, הוספת 50 μL של מדיום המכיל 300 μM לוציפרין ל 100 μM לוציפרין ל 100 μL של בינוני בבאר יגרום דילול 1:3 ובכך בריכוז הסופי 100 מיקרומטר של לוציפרין). - הוסיפו מדיום המכיל לוציפרין לתאים ודגרו למשך הזמן הרצוי של גירוי אור.
הערה: זה יכול להיות קצר כמו 1 דקה או עד 15 דקות ועשוי להיות אפילו קצר יותר או ארוך יותר. משך הזמן להשארת המדיום המכיל לוציפרין בתאים תלוי במחצית החיים ובקינטיקה של שילוב לוציפראז-לוציפרין שנבחר. - לפקח על פליטת אור בריכוז לוציפרין סופי 100 מיקרומטר בעין לאחר כיבוי האור האדום; המתן מספר שניות עד שהעיניים יסתגלו לחשיכה מוחלטת. תעד את פליטת האור על ידי צילום תמונה (אפילו עם טלפון סלולרי).
- לסיים את גירוי האור על ידי הסרת המדיום המכיל לוציפרין והחלפתו במדיום תרבות. בהתאם לרגישות של הניסויים, לשטוף את התאים עם מדיום תרבית פעם או פעמיים לאחר הסרת המדיום המכיל לוציפרין כדי לחסל את כל לוציפרין. אם התאים אינם דבקים היטב על פני השטח התרבותיים, צלחת אותם על כלים מצופים PDL, כדי למנוע לאבד את התאים במהלך שטיפות.
- החזירו את התאים לחממה המוגנת באור למשך 16-24 שעות.
- הכן פתרון עבודה של לוציפרין במדיום תרבית התא (DMEM או NeuroBasal). התאם את הריכוז של לוציפרין כך הריכוז הסופי הוא 100 מיקרומטר. הכן את כל הדילולים של CTZ בינוני זמן קצר לפני הוספת לתאים, כמו CTZ מתחמצן לאורך זמן.
- גירוי אור ביו-לומינציה חוזרת ונשנית
הערה: כל המניפולציות מתבצעות בחדר שניתן להפוך אותו לאור הדוק ולהאיר באור אדום.- תארגן את תא ההדמיה של התא החי. צרו תא הדוק סביב מיקרוסקופ ההדמיה של התא החי באמצעות קופסה ויריעות פלסטיק שחורות או וילונות שחורים (איור 3). כסו את כל מקורות האור הקיימים בתוך התא הצמוד לאור והחדר (למשל, מחווני LED במיקרוסקופ או במכשירים).
- הגדר את מערכת הזלוף עם הפתרון הרצוי לצריכה ואת היציאה התא המובילה מיכל פסולת.
הערה: לדוגמה, פתרון ההדמיה יכול להיות הפתרון של Tyrode (נתרן כלורי (124 מ"מ), אשלגן כלורי (3 מ"מM), HEPES (10 מ"מ), סידן כלוריד דיהידרט (2 מ"מ), מגנזיום כלוריד הקסהידרט (1 מ"מ), D-גלוקוז (20 מ"מ)). - הכן פתרון עבודה של לוציפרין בתמיסת ההדמיה. Aliquot לתוך צינורות microcentrifuge רבים כמו מספר גירויים חוזרים. התאם את הריכוז של לוציפרין כך הריכוז הסופי בתא ההדמיה הוא 100 מיקרומטר.
- מניחים כיסוי עם תאים שהודבקו בתא.
- תוך שמירה על המשאבה פועלת, להסיר את צינור הכניסה של המשאבה מן הצריכה במהירות לטבול אותו בתמיסת לוציפרין, שמירה על זמן המעבר קצר ככל האפשר כדי למנוע כל חלל אוויר בצינורות.
- ברגע פתרון לוציפרין כבר נלקח, למקם את צינור הכניסה בחזרה לתוך הצריכה. חזור על תהליך זה כמה פעמים לפי הצורך ובמרווחים של כמה דקות עד שעות, בהתאם לתבנית הפיזיולוגית שאליה התאים אמורים להיחשף.
- החזר את התאים לאינקובטור המוגן באור למשך 16-24 שעות לשעתוק, או למשך הזמן יש להעריך את השפעת גירוי האור.
- מכינים את מצע הלוציפראז (לוציפרין).
2. הפעלה ביו-זוהרת של חלבונים פוטו-חושיים ב-vivo
- מבנים
- בחר רצף לוציפראז או רצף היתוך חלבון לוציפראז-פלואורסצנטי שיביא לביטוי של פולט אור המייצר אור של אורך גל התואם את קולט האור שיופעל.
- השתמש בטכניקות ביולוגיה מולקולרית סטנדרטיות כדי לשכפל את ה- DNA לפלסמיד pAAV, אם לא זמין כבר מחוקרים אחרים או מרבצי פלסמיד.
- בחר מקדמים חזקים לביטוי המודולים פולטי האור, כגון CAG או CMV.
- השתמש בגישות סטנדרטיות להכנת מניות ויראליות גבוהות6 או הכינו וקטורים ויראליים באופן מסחרי.
- עבור מחקרים ראשוניים, השתמש בוקטורים ויראליים נפרדים להעברה משותפת של פולט האור וחיישן האור כדי לאפשר התאמה של היחסים של הרכיבים השונים במידת הצורך.
- טרנסדוקציה AAV
- הזרקו לאיבר היעד של החיה הניסיונית וקטורים ויראליים של פולט האור, חיישן האור והכתב המקבילים ליחסי הריכוז המשמשים לטרנספקטים במבחנה (טבלה 3).
- להחזיר את החיות לכלובים הבית שלהם לפחות 2 שבועות כדי לאפשר ביטוי מקסימלי של כל הרכיבים.
הערה: אם איבר המטרה נמצא בתוך הגוף ומוגן מפני אור הסביבה, ניתן לשכן את בעלי החיים בתנאי אור רגילים.
- הפעלת ביולומינציה ב- vivo
- מכינים את מצע הלוציפראז (לוציפרין).
- מוציאים בקבוקון CTZ מסיס במים מהמקפיא של 80 °C (80 °F) ומניחים לו להתחמם לטמפרטורת החדר. שמור אותו מוגן מפני אור.
- לכל בקבוקון 500 מיקרוגרם, להוסיף 250 μL של מים סטריליים, באמצעות מזרק או על ידי פתיחת הבקבוקון והוספת מים עם פיפטה, ולאחר מכן לשים את פקק הגומי בחזרה על בקבוקון הזכוכית.
- לדגור על בקבוקון זכוכית משוחזר באמבט מים 55 °C (55 °F) במשך כמה דקות כדי להמיס לחלוטין את האבקה.
- מעבירים את התמיסה לצינור מיקרו-צנטריפוגה שחור. לשטוף את הקירות של בקבוקון זכוכית כדי לאחזר את כל CTZ.
- הסר את כמות הפתרון הדרושה ליום. אחסן את הפתרון הנותר בטמפרטורה של 4 °C (60 °F) לשימוש למחרת. אל תקפאו!
- בצע את אותם שלבים (2.3.1.1.-2.3.1.5) עבור בקבוקון של רכב.
- גירוי אור ביולומינציה
- הסר את נפח הלוציפרין/ הרכב הדרוש לגודל החיה ומסלול היישום שנבחר (טבלה 4).
- להזריק את החיות עם לוציפרין או רכב. חזור על גירוי אור bioluminescence לפי העיצוב הניסיוני. לדוגמה, אם הפעלה של רקומבינאז רצויה במהלך פרדיגמה התנהגותית ספציפית, להזריק את בעלי החיים ממש לפני הבדיקה ההתנהגותית. אם שעתוק פאזי של מולקולה הוא המטרה, הזריקו את החיות שוב ושוב במשך ימים.
- אסוף נתונים מבעלי החיים המעוררים ביו-לומינציה כמתוכנן.
- מכינים את מצע הלוציפראז (לוציפרין).
תוצאות
ישנם אירועים תאיים רבים שניתן לתמרן עם מפעילים המגיבים לאור, והם מקובלים על הפעלה דו-מודאלית עם מקורות אור פיזיים וביולוגיים. להלן דוגמאות המשתמשות באינטגרטור סידן לאור (Ca2+), טרנסלוקציה של חלבון המושרה באור, גורם שעתוק של חישת אור ורקומבינאז רגיש לאור. הדוגמאות ממחישות את ההיתכנות של שימוש ביולומינציה להפעלת סוגים שונים של קולטני אור. הניסויים שהוצגו לא היו ממוטבים במיוחד ביחס ליישום דיודה פולטת אור (LED), הלוציפראז שנבחר, או ביחס לריכוזים ותזמון של יישום לוציפרין.
ביטוי מוסדר אור מהיר ופעילות (FLARE) היא מערכת אופטוגנטית המאפשרת שעתוק של גן עיתונאי עם שכיחות משותפת של Ca2+ תאיים מוגברים ו- light23 (איור 4A). נוכחותו של Ca2+ נדרשת להביא את הפרוטאז בסמיכות לאתר מחשוף הפרוטאז הנגיש רק עם גירוי קל, וכתוצאה מכך שחרורו של גורם התמלול. תאי HEK293 הועברו בשיתוף עם רכיבי FLARE המקוריים, מבנה כפול של כתב Firefly (FLuc)-dTomato, וגרסה מעוגנת ממברנה של גאוסיה לוציפראז sbGLuc6. בנוכחות Ca2 תאיים מוגברת + באמצעות חשיפה של תאים 2 μM ionomycin ו 5 mM סידן כלוריד (CaCl2), היישום של LED כחול הוביל לביטוי חזק של כתב פלואורסצנטיות לעומת תאים שנותרו בחושך, כמו גם את הביטוי של FLuc נקבע על ידי מדידת luminescence בעת הוספת מצע FLuc, די-לוציפרין. רמות דומות של ביטוי FLuc הושגו עם bioluminescence הנפלט על ידי sbGLuc עם היישום של מצע sbGLuc (CTZ) יחד עם ionomycin ו CaCl2. שים לב כי לוציפראזים המשמשים להפעלה קלה (sbGLuc) ולדיווח על ההשפעה של הפעלה קלה (שעתוק של FLuc) רק לייצר אור עם לוציפרינים שלהם בהתאמה (CTZ לעומת D-לוציפרין) ולא להצליב להגיב.
רכיבים שונים שולבו כדי ליצור מערכת שעתוק לאור המבוססת על הטרודימריזציה של cryptochromes23,24 (איור 4B). CRY2 הותך לפרוטאז בזמן שה-CIB הקשור לממברנה הותך לאתר מחשוף הפרוטאז ולגורם שעתוק. טרנסלוקציה של חלבון המושרה באור שחררה את גורם שעתוק, מה שהוביל לביטוי FLuc ו-dTomato, כפי שמוצג באיור 4A. בעוד נוכחותו של רכיב גורם שעתוק לבדה הביאה לאות רקע ניכר אולי בשל פרוטאוליזה ספונטנית, הן אור פיזי (LED) והן ביולומינציה (CTZ) הגדילו בחוזקה את הביטוי של FLuc כפי שנמדד במערכת הדמיה in vivo (IVIS).
בסדרה אחרת של ניסויים, NanoLuc (לוציפרין: furimazine או hCTZ) הועסק עבור רגולציה אופטוגנטית של שעתוק באמצעות עמעום של CRY / CIB ואת גורם שעתוק רגיש לאור, EL22225,26,27. איור 5A,B מציג את השרטוטים של הרכיבים השונים במצבים הכהים והאור, ואת הלוציפראז שהודבק או הותך לחיישן האור. השוואות שונות מוצגות באיור 5C. Bioluminescence, המושרה על ידי הוספת hCTZ לתאי HEK293 המבטאים את המבנים והסרתם לאחר 15 דקות, הייתה יעילה יותר בהנעת שעתוק עיתונאי מאשר 20 דקות של חשיפה לאור LED הן CRY / CIB והן EL222. עבור CRY / CIB, שעה של חשיפה LED היה מספיק כדי להגיע לרמה של שעתוק דומה 15 דקות של bioluminescence. לעומת זאת, עבור EL222, אפילו 60 דקות של LED היו בקושי חצי יעיל כמו חשיפה קצרה bioluminescence. לא היו הבדלים משמעותיים ביעילות התמלול בין שתי המערכות כאשר הם עברו שיתוף, אם כי חלבוני ההיתוך של CRY/ CIB היו יעילים יותר מאלה של EL222. עבור שתי המערכות, חלבוני ההיתוך הובילו לרמות שעתוק גבוהות משמעותית מאשר הרכיבים המשותפים. CRY/CIB הראה רמות רקע גבוהות יותר באופן עקבי עם יישום רכב בהשוואה ל- EL222, שהיה בעל תמלול רקע זניח. להגברת הריכוזים של HCTZ לבדה לא הייתה השפעה על שעתוק הגן העיתונאי.
רקומבינות פוטואקטיביות מספקות כלי רב-תכליתי למניפולציות אופטוגנומיות. בדקנו הפעלה ביו-לומינציה של רקומבינאז מפוצל רגיש לאור המבוסס על חלבון Vivid LOV, iCreV28. איור 6A מציג שרטוט של הרכיבים השונים, sbGLuc, iCreV וכתב פלואורסצנטיות של lox-stop-lox (tdTomato) לפני ואחרי היישום של CTZ. התוצאות מיישום CTZ ביחס לפקדים (ללא CTZ או LED) מוצגות באיור 6B. יש ביטוי רקע גם בחושך (אין CTZ); עם זאת, בנוכחות CTZ, הביטוי גדל בחוזקה על הרקע ודומה לזה המושרה עם יישום LED.

איור 1: אינקובטור אטום באור. דש קופסת קרטון המכסה את האור מלוח הבקרה המואר (חץ עליון). כיסוי אטום לאור מעל דלת הזכוכית של האינקובטור (החץ התחתון) כדי להגן על התאים מפני חשיפה לאור. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: מכסה המנוע לזרימה למינארי מואר באור אדום. התקנה המציגה מכסה מנוע סטנדרטי לתרבית רקמת זרימה למינארית המואר באור אדום. חץ מציין מנורת שולחן עבודה סטנדרטית עם נורה אדומה. כל המניפולציות תחת אור אדום מתבצעות בחדר חשוך אחר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: תאים הדוקים באור סביב מיקרוסקופי הדמיה של תאים חיים. שתי דוגמאות להגדרות מיקרוסקופ הדמיה של תאים חיים המציגות את השימוש בקופסה מוצקה עם וילונות פלסטיק רק בצד הקדמי (לוחות שמאליים: למעלה ולמטה) או וילונות שחורים בכל רחבי מערך ההדמיה (לוחות ימניים: למעלה ולמטה). הצדדים הקדמיים בשתי הדוגמאות נשארים פתוחים ומסוגרים כאשר אינם בשימוש (לוחות עליונים: שמאל וימין). הווילונות השחורים הקדמיים מגולגלים כלפי מטה כדי למנוע מכל אור בחדר (למשל, מסכי מחשב) מלהיכנס לאזור ההדמיה בעת ביצוע גירוי ביו-לומינציה של תאים חיים ו/או הדמיה (לוחות תחתון: שמאל וימין). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
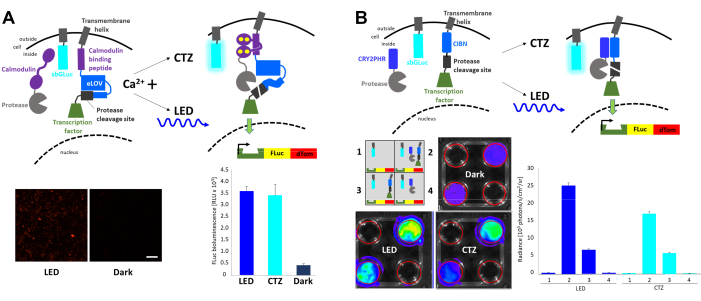
איור 4: ביו-לומינציה לשילוב אירועי איתות תאיים. (א) שרטוטים של רכיבי FLARE שהועברו במשותף עם sbGLuc. בנוכחות Ca2+ והקרבה המתקבלת של הפרוטאז לאתר מחשוף הפרוטאז, או bioluminescence או LED יוביל להתפתחות של LOV, חשיפה של אתר המחשוף, ושחרור של גורם התמלול. תאים נחשפו LED (מחזור החובה 33%, 2 s on/4 s כבוי במשך 40 דקות; 3.5 mW כוח אור, 4.72 mW / cm2 הקרנה) או bioluminescence (100 μM CTZ ריכוז סופי במשך 15 דקות) או נשאר בחושך. תמונות מיקרוסקופיות של תאי HEK293 המבטאים את הרכיבים לעיל לאחר הטיפול כדי להגדיל את רמות Ca2+ וחשיפה LED (משמאל). זוהר FLuc נמדד בלומינומטר המשווה חשיפה ל- LED, ביולומינציה (CTZ) או שמאל בחושך (מימין). (ב) שרטוטים של מערכת שעתוק שאינה תלויה Ca2+, שהועברה בשיתוף עם sbGLuc. תאי HEK293 בלוחות של 4 בארות הועברו עם ארבעה סידורים שונים של רכיבים כפי שמתואר בסכמטי. לוחות נחשפו או LED (מחזור החובה 33%, 2 s על/4 s כבוי במשך 40 דקות; 3.5 mW כוח אור, 4.72 mW / cm2 הקרנה) או bioluminescence (100 μM CTZ ריכוז סופי) על ידי הוספת CTZ ולהשאיר אותו על במשך 15 דקות; לוחות בקרה הושארו בחושך. תמלול של כתב FLuc נמדד ב- IVIS. תמונות IVIS של מנות ייצוגיות מוצגות משמאל; מדידות זוהר ממספר שכפולים מקו בסיס לפקדים הכהים מוצגות מימין. סרגל קנה מידה = 100 מיקרומטר. קיצורים: FLARE = ביטוי מהיר של אור ופעילות מווסתת; LOV = אור-חמצן-מתח-חישה; LED = דיודת פולטת אור; CTZ = coelenterazine; FLuc = לוציפראז גחלילית; dTom = dTomato; CRY2 = cryptochrome 2; CRY2PHR = CRY2 אזור ההומולוגיה פוטוליאז; CIB1 = Ca2+- וחלבון מחייב integrin 1; CIBN = N-טרמינל של CIB1; IVIS = במערכת הדמיה vivo . לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
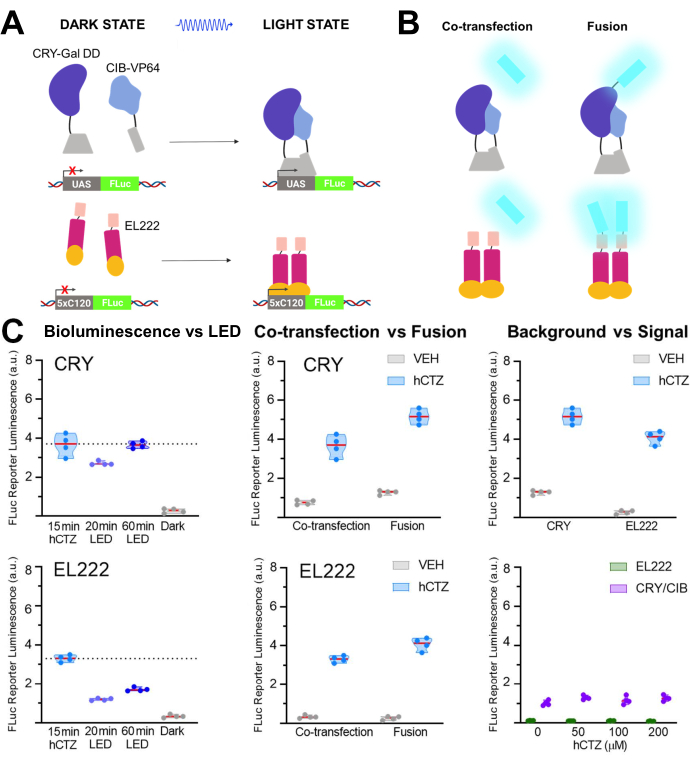
איור 5: ביו-לומינציה לתמלול נהיגה. (א) שרטוטים של שתי מערכות שעתוק פוטואקטיביות במצבים האפלים והאוריים שלהם. (B) NanoLuc היה גם שיתוף transfected או הותך moieties חישת אור כפי שתואר (N-NanoLuc-CRY-GalDD-C; N-NanoLuc-VP16-EL222-C). (ג) השוואות באמצעות שתי המערכות לגבי מקורות אור, עיצוב מבנה ואות לרעש. תאים נחשפו LED (מחזור החובה 33%, 2 s on/4 s כבוי במשך 40 דקות; 3.5 mW כוח אור, 4.72 mW / cm2 הקרנה) או bioluminescence במשך 15 דקות (100 μM hCTZ ריכוז סופי; למעט כאשר ריכוזים שונים נרשמים). צלחות כהות לא נגעו באינקובטור בין הטרנספורמציה הראשונית של פלסמידים לבין מדידת FLuc; VEH, לוחיות טופלו זהה לאלה שקיבלו HCTZ, אבל קיבל רכב במקום. הבדלים ברמות התמלול: hCTZ, CRY משותף לעומת EL222 - לא משמעותי; hCTZ, לוציפראז - פוטופרוטאין היתוך CRY לעומת EL222 - p < 0.005; hCTZ, CRY co-transfection לעומת היתוך - p < 0.005; hCTZ, EL222 co-transfection לעומת היתוך - p < 0.01; רכב, CRY לעומת EL222 - p < 0.05. קיצורים: UAS = רצף הפעלה במעלה הזרם; LED = דיודת פולטת אור; CTZ = coelenterazine; FLuc = לוציפראז גחלילית; CRY = cryptochrome; CIB = Ca2+- וחלבון מחייב integrin; VEH = רכב. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
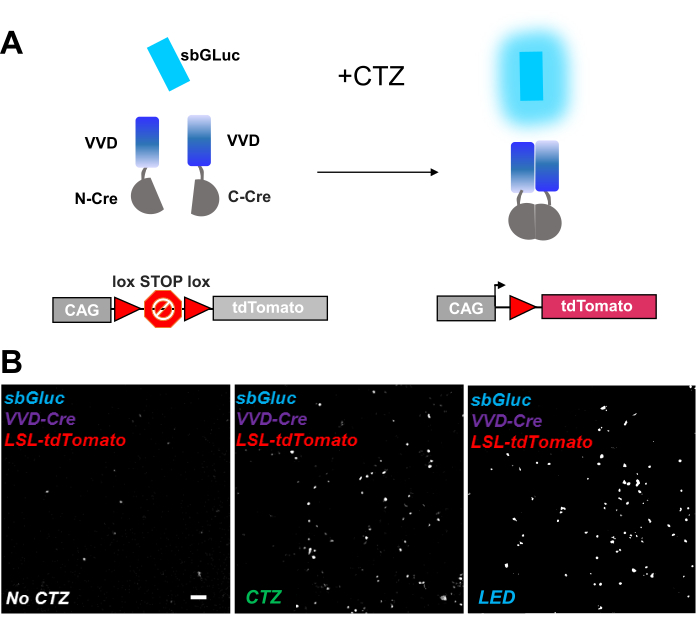
איור 6: ביולומינציה למניפולציה אופטוגנומית. (A) שרטוטים של מניפולציה אופטוגונומית מונחית ביולומינציה באמצעות sbGLuc, רכיבי iCreV המפוצלים וקלטת כתב LSL, לפני ואחרי יישום האור. (B) תאי HEK293 היו נגועים בפלסמידים, ואז נשמרו בחושך. עשרים וארבע שעות מאוחר יותר, התאים טופלו במשך 30 דקות עם רק בינוני (ללא CTZ) או עם CTZ (100 μM ריכוז סופי) או עם LED (מחזור החובה 25%, 5 s on/15 s כבוי במשך 5 דקות; 14.81 mW כוח אור, 20 mW / cm2 הקרנה) כמו שליטה חיובית. תמונות מיקרוסקופיות של פלואורסצנטיות tdTomato באמצעות תנאים כפי שצוין. סרגל קנה מידה = 100 מיקרומטר. קיצורים: LSL = lox-stop-lox; CTZ = coelenterazine; LED = דיודת פולטת אור; VVD = חי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה 1: הפעלה ביו-לומינציה של קולטני אור. לחץ כאן כדי להוריד טבלה זו.
טבלה 2: הנחיות לציפוי והעברה של תאים בפורמטים שונים. לחץ כאן כדי להוריד טבלה זו.
טבלה 3: יחס של פלסמידים שונים עבור טרנספקטיבה. לחץ כאן כדי להוריד טבלה זו.
טבלה 4: מסלולי הזרקה, כרכים וריכוזים של לוציפרין עבור יישומי vivo (25 גרם עכבר). לחץ כאן כדי להוריד טבלה זו.
Discussion
יש מגוון של לוציפראזים ולוציפרינים עם אורכי גל פליטת אור התואמים את ספקטרום ההפעלה של חלבונים פוטו-חושיים מאור כחול לאדום14,29. מלבד יישור אורכי גל של פליטה ועיעור, אין דרך אמינה לקבוע מראש איזה זיווג יעבוד בצורה הטובה ביותר. לכן, הצורך לקבוע באופן ניסיוני כיצד זוגות לוציפרין-לוציפראז פועלים בתאים ואורגניזמים בהנעת מערכות פוטו-חושיות.
הפרוטוקולים המתוארים במצגת זו מתארים כיצד להכין את הלוציפרין וכיצד ליישם אותו במבחנה וב - vivo, יחד עם הנחיות לגבי הקמת חדרים, ברדסים לתרבות רקמות, אינקובטורים ומיקרוסקופים לניסויים המשתמשים בביולומינציה. בניסויים הייצוגיים, לוציפראזים שונים (NanoLuc, Gaussia luciferase) עם מספר חלבונים פוטו-חושיים (CRY/CIB, EL222, VVD, LOV) שימשו, הדגמת ההשפעות של ביולומינציה לעומת אור פיזי, שיתוף-transfection לעומת חלבוני היתוך, השוואות אות לרעש, ובדיקות קריאה שונות. יישומים נוספים של bioluminescence הפעלת חלבונים פוטו-חושיים מתוארים בפרסומים ממספר קבוצות, מיקוד אינדוקציה של מוות תאים, סינתזת המחנה, ותנועת חלבון בנוסף שעתוק (טבלה 1).
פשוט שיתוף פעולה עם רכיבי פולטי אור וחישת אור הוא התחלה טובה. משתנים הם היחסים הטוחנים של פולט וחיישן; לא ידועים הם רמות הרקע של פעילות החיישנים בחושך, פעילות החיישן ביחס לעוצמת האור ומשך הזמן, והיעילות של הפעלת חיישנים המשווה אור פיזי וביולוגי. בעוד מבני היתוך יש את היתרון של שמירה על היחס הטוחן של פולט וחיישן ב 1:1 ולהביא את פולט האור קרוב לתחום חישת האור, שיקולים אחרים באים לידי ביטוי, כגון איפה לקשור (N- או C-מסוף) וכיצד לקשר (אורך קישור והרכב) מבלי להשפיע על הביצועים של מפעיל photoensory.
עבור ניסויים הן במבחנה והן ב- vivo, ישנן אפשרויות מרובות לכוונון פליטת אור ביולומינסנט, או על ידי שינוי הריכוז של לוציפרין, ו/או על ידי שינוי הזמן הלוציפרין זמין לחיישן המתאים. הכמות והזמן המינימליים נקבעים על ידי נוכחות או היעדר האפקט הצפוי עם הפעלה קלה. לעומת זאת, המקסימה המתאימה נקבעת בעיקר על ידי סובלנות של תאים לריכוזים גבוהים של לוציפרין על פני זמנים ממושכים. הריכוז של CTZ שנבחר בדוגמאות לעיל, 100 μM, קרוב לגבול העליון עבור סוגי תאים שונים, מתאי HEK293 לנוירונים. המטרה היא להשתמש בריכוז נמוך ככל האפשר לזמן הקצר ביותר כדי להשיג הפעלה של תחום ההסתגלות הביולוגית הממוקד. זה יושג בקלות רבה יותר באמצעות לוציפראזים עם פליטת אור גבוהה קולטני אור עם רגישות גבוהה לאור.
Bioluminescence עבור נהיגה קולטני אור שימש מכרסמים (עכברים, חולדות) עם חלבונים לאור המתבטא בכבד, שריר, חוט השדרה, והמוח, כמו גם באמצעות תאים מבטאים photoreceptor מושתלים תת עורית או תוך-גופית. באופן עקרוני, אין גבולות המונעים את החלת הגישה על מינים שונים, מפרימטים שאינם אנושיים לדגים או זבובים. בהתאם חדירות של האורגניזם עבור לוציפרין, היישום עשוי להיות קל כמו החלת לוציפרין על המים שמסביב (למשל, בזחלי דגים30). לפני השימוש BL-OG בכל אורגניזם חדש, ניסויי פיילוט חייב להתבצע כדי להבטיח כי לוציפרין מגיע ליעדיו באמצעות מסלול היישום שנבחר.
היבטים קריטיים של העיצוב הניסיוני הם הפקדים השונים החשובים לפרשנות התוצאות. תאים המבטאים כתב מונע על ידי לוציפראז הפועל על חלבון פוטואורולוגי יש להשוות תאים חסרים לוציפראז או חסר חלבון פוטואורי. יתר על כן, השוואות צריך להיעשות בין תאים שנחשפו לוציפרין, רכב, או נשמר בחושך. חשוב גם להבין את המגבלות של בדיקות שונות להערכת ההשפעות של הפעלה photoreceptor מונחה bioluminescence. לדוגמה, היעילות של שעתוק המופעל על ידי ביולומינציה יכולה להיבדק בדרכים שונות, בהתאם לשאלה אם הגן הכתב הוא לוציפראז אורתוגונלי (לומינומטר, IVIS), או חלבון פלואורסצנטי (מיון תאים המופעלים על ידי פלואורסצנטיות, ניתוח תמונה מיקרוסקופי). בעוד ההשפעות הבסיסיות צריך להיות לשחזור על פני פלטפורמות בדיקה, ההיבטים הכמותיים של ההשפעות עשויים להשתנות במידה ניכרת.
ההפעלה הביולומינציה של קולטני האור הודגמה עד כה עבור מספר מוגבל של לוציפראזות וחלבונים פוטו-חושיים, בהתאמה, הן במבחנה והן ב- vivo. זה יכול להיות מורחב לסוג הגדול של קולטני אור להפעלת תהליכים ביולוגיים רבים יותר. הרחבה כזו של הגישה מקודמת עוד יותר על ידי התפתחות מתמשכת של לוציפראזים חדשניים וזוגות חלבון לוציפראז-פלואורסצנטי עם פליטת אור גבוהה בהרבה מאשר לוציפראזים טבעיים ועם תכונות קינטיות ליישומים שונים. התקדמות זו מקבילה על ידי הדור של לוציפרינים חדשניים, מה שמוסיף עוד יותר בהירות מוגברת ופלטות צבע29. פלטפורמת כלים זו מציעה יישומים לתפעל ולחקור דינמיקה תאית ואינטראקציות תאים בתוך תאים חיים, רקמות ואורגניזמים.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לעמיתינו על מבנים, במיוחד א. טינג על פרוטאז Ca-FLARE, גורם שעתוק וכתב (Addgene # 922214, 92213, 92202), H. Kwon עבור TM-CIBN-BLITz1-TetR-VP16 ו- NES-CRY2PHR-TevC (Addgene # 89878, 89877, 89877), C. Tucker for CRY-GalΔDD (B1013) ו- CIB-VP64 (B1016) (Addgene # 92035, 92037), M. Walsh for pGL2-GAL4-UAS-Luc (Addgene #33020), K. Gardner for VP-EL222 ו- C120-Fluc, ו- A. Cetin and H. Zeng על הפיכת iCreV לזמין לפני הפרסום. עבודה זו נתמכה על ידי מענקים מ- NSF (NeuroNex 1707352), NIH (U01NS0999709), קרן W.M. קק ומועצת המחקר השוודית ל- A.B ( 2016-06760).
Materials
| Name | Company | Catalog Number | Comments |
| ABI 25W Deep Red 660 nm LED Light Bulb | Amazon | to be used with any lamp stand | |
| Black Microcentrifuge Tubes, 0.5 mL, Argos Technologies | Fisher Scientific | 03-391-166 | |
| Black Microcentrifuge Tubes, 1.5 mL, Argos Technologies | Fisher Scientific | 03-391-161 | |
| Black Nylon, Polyurethane-Coated Fabric (1.5 m x 2.7 m) x 0.12 mm (thick) | THOR LABS | BK-5 | |
| C120-Fluc | K. Gardner | ||
| CaCl2 | Sigma | C8106; CAS: 10035-04-8 | |
| Ca-FLARE protease, transcription factor and reporter | Addgene # 92214, 92213, 92202 | A. Ting | |
| CIB-VP64 (B1016) | Addgene # 92037 | C. Tucker | |
| CRY-GalΔDD (B1013) | Addgene # 92035 | C. Tucker | |
| CTZ | Prolume Inc. (NanoLight) | 303 | formulation for in vitro applications with Gaussia luciferases |
| CTZ (Water soluble native coelenterazine) | Prolume Inc. (NanoLight) | 3031 | formulation for in vivo applications with Gaussia luciferases |
| D-(+)-Glucose | Sigma | G8270; CAS: 50-99-7 | |
| D-Luciferin, Potassium Salt | Gold Biotechnology | LUCK | |
| DMEM | Thermo Fisher | 11960044 | |
| D-PBS, no calcium, no magnesium | Thermo Fisher | 14190144 | |
| hCTZ | Prolume Inc. (NanoLight) | 301 | formulation for in vitro applications with Oplophorus luciferases |
| HEK293 | ATCC | CRL-1573 | |
| HeLa | ATCC | CCL-2 | |
| HEPES | Sigma | H3375; CAS: 7365-45-9 | |
| iCreV | A. Cetin and H. Zeng | ||
| In Vivo Imaging System (IVIS) | Perkin-Elmer | Lumina LT | |
| KCl | Sigma | P5405; CAS: 7447-40-7 | |
| LED Array Driver | Amuza | LAD-1 | |
| LED Array for Multiwell Plates | Amuza | LEDA-x | |
| Lipofectamine 2000 Reagent | Invitrogen | 11668-019 | Transfection reagent |
| Luminometer | Molecular Devices | SpectraMax L | |
| MgCl2 Hexahydrate | Sigma | M2670; CAS: 7791-18-6 | |
| NaCl | Sigma | S7653; CAS: 7647-14-5 | |
| NanoFuel Solvent | Prolume Inc. (NanoLight) | 399 | for dissolving CTZ preparations for in vitro use |
| NaOH | Sigma | 221465; CAS: 1310-73-2 | |
| NES-CRY2PHR-TevC | Addgene # 89877 | H. Kwon | |
| Opti-MEM | Thermo Fisher | 11058021 | transfection medium |
| PDL coated coverslips (12 mm, 15 mm, 18 mm) | Neuvitro Corporation | GG-12-PDL, GG-15-PDL , GG-18-PDL | |
| pGL2-GAL4-UAS-Luc | Addgene #33020 | M. Walsh | |
| Prizmatix USB Pulser TTL Generator for Optogenetics | Goldstone Scientific | ||
| TM-CIBN-BLITz1-TetR-VP16 | Addgene # 89878 | H. Kwon | |
| TrypLE Express | Gibco | 12604-013 | |
| Vehicle (Water-soluble carrier without CTZ) | Prolume Inc. (NanoLight) | 3031C | control for in vivo applications with CTZ |
| VP-EL222 | K. Gardner |
References
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Wang, Y., et al. Photostimulation by femtosecond laser triggers restorable fragmentation in single mitochondrion. Journal of Biophotonics. 10 (2), 286-293 (2017).
- Li, T., et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nature Communications. 12 (1), 615(2021).
- Berglund, K., Birkner, E., Augustine, G. J., Hochgeschwender, U. Light-emitting channelrhodopsins for combined optogenetic and chemical-genetic control of neurons. PLoS One. 8 (3), 59759(2013).
- Tung, J. K., Gutekunst, C. -A., Gross, R. E. Inhibitory luminopsins: genetically-encoded bioluminescent opsins for versatile, scalable, and hardware-independent optogenetic inhibition. Scientific Reports. 5, 14366(2015).
- Berglund, K., et al. Luminopsins integrate opto- and chemogenetics by using physical and biological light sources for opsin activation. Proceedings of the National Academy of Sciences of the United States of America. 113 (3), 358-367 (2016).
- Gomez-Ramirez, M., More, A. I., Friedman, N. G., Hochgeschwender, U., Moore, C. I. The BioLuminescent-OptoGenetic in vivo response to coelenterazine is proportional, sensitive and specific in neocortex. Journal of Neuroscience Research. 98 (3), 471-480 (2020).
- Moore, C. I., Berglund, K. BL-OG: BioLuminescent-OptoGenetics. Journal of Neuroscience Research. 98 (3), 469-470 (2020).
- Park, S. Y., et al. Novel luciferase-opsin combinations for improved luminopsins. Journal of Neuroscience Research. 98 (3), 410-421 (2020).
- Jaiswal, P. B., Tung, J. K., Gross, R. E., English, A. W. Motoneuron activity is required for enhancements in functional recovery after peripheral nerve injury in exercised female mice. Journal of Neuroscience Research. 98 (3), 448-457 (2020).
- Zenchak, J. R., et al. Bioluminescence-driven optogenetic activation of transplanted neural precursor cells improves motor deficits in a Parkinson's disease mouse model. Journal of Neuroscience Research. 98 (3), 458-468 (2020).
- Tung, J. K., Shiu, F. H., Ding, K., Gross, R. E. Chemically activated luminopsins allow optogenetic inhibition of distributed nodes in an epileptic network for non-invasive and multi-site suppression of seizure activity. Neurobiology of Disease. 109, Pt A 1-10 (2018).
- Hegemann, P. Algal sensory photoreceptors. Annual Review of Plant Biology. 59, 167-189 (2008).
- Losi, A., Gardner, K. H., Moglich, A. Blue-light receptors for optogenetics. Chemical Reviews. 118 (21), 10659-10709 (2018).
- Proshkina, G. M., Shramova, E. I., Shilova, O. N., Ryabova, A. V., Deyev, S. M. Phototoxicity of flavoprotein miniSOG induced by bioluminescence resonance energy transfer in genetically encoded system NanoLuc-miniSOG is comparable with its LED-excited phototoxicity. Journal of Photochemistry and Photobiology B: Biology. 188, 107-115 (2018).
- Kawano, F., Okazaki, R., Yazawa, M., Sato, M. A photoactivatable Cre-loxP recombination system for optogenetic genome engineering. Nature Chemical Biology. 12 (12), 1059-1064 (2016).
- Shramova, E. I., Proshkina, G. M., Chumakov, S. P., Khodarovich, Y. M., Deyev, S. M. Flavoprotein miniSOG cytotoxisity can be induced by bioluminescence resonance energy transfer. Acta Naturae. 8 (4), 118-123 (2016).
- Naim, N., et al. Luminescence-activated nucleotide cyclase regulates spatial and temporal cAMP synthesis. Journal of Biological Chemistry. 294 (4), 1095-1103 (2019).
- Kim, C. K., Cho, K. F., Kim, M. W., Ting, A. Y. Luciferase-LOV BRET enables versatile and specific transcriptional readout of cellular protein-protein interactions. Elife. 8, 43826(2019).
- Parag-Sharma, K., et al. Engineered BRET-based biologic light sources enable spatiotemporal control over diverse optogenetic systems. ACS Synthetic Biology. 9 (1), 1-9 (2020).
- Kim, E. H., et al. Self-luminescent photodynamic therapy using breast cancer targeted proteins. Science Advances. 6 (37), (2020).
- Kim, C. K., et al. A Molecular calcium integrator reveals a striatal cell type driving aversion. Cell. 183 (7), 2003-2019 (2020).
- Wang, W., et al. A light- and calcium-gated transcription factor for imaging and manipulating activated neurons. Nature Biotechnology. 35 (9), 864-871 (2017).
- Lee, D., Hyun, J. H., Jung, K., Hannan, P., Kwon, H. -B. A calcium- and light-gated switch to induce gene expression in activated neurons. Nature Biotechnology. 35 (9), 858-863 (2017).
- Pathak, G. P., et al. Bidirectional approaches for optogenetic regulation of gene expression in mammalian cells using Arabidopsis cryptochrome 2. Nucleic Acids Research. 45 (20), 167(2017).
- Nishio, H., Walsh, M. J. CCAAT displacement protein/cut homolog recruits G9a histone lysine methyltransferase to repress transcription. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11257-11262 (2004).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Yao, S., et al. RecV recombinase system for in vivo targeted optogenomic modifications of single cells or cell populations. Nature Methods. 17 (4), 422-429 (2020).
- Love, A. C., Prescher, J. A. Seeing (and using) the light: Recent developments in bioluminescence technology. Cell Chemical Biology. 27 (8), 904-920 (2020).
- Naumann, E. A., Kampff, A. R., Prober, D. A., Schier, A. F., Engert, F. Monitoring neural activity with bioluminescence during natural behavior. Nature Neuroscience. 13 (4), 513-520 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved