Method Article
Biyolüminesan Optogenetik 2.0: Fotosensör Proteinleri In Vitro ve In Vivo'yu Aktive Etmek için Biyolüminesanstan Yararlanma
Bu Makalede
Özet
Küçük moleküllü bir substratı oksitleyen bir lusiferaz enzimi tarafından yayılan biyolüminesans ışığı, bir lusiferin, fotosensoriyel proteinleri aktive etmek için kullanılabilir, böylece ışık stimülasyonuna başka bir boyut ekler ve hücrelerde zamansal ve mekansal ölçeklerde çok sayıda ışık aracılı fonksiyonun manipülasyonunu sağlar.
Özet
Biyolüminesans - küçük bir molekül substratını, bir lusiferini oksitleyen bir lusiferaz enzimi tarafından yayılan ışık - nöronlardaki ışık kapılı iyon kanallarını ve pompaları aktive etmek için in vitro ve in vivo olarak kullanılmıştır. Bu biyolüminesan optogenetik (BL-OG) yaklaşımı, optogenetik araçlara kemogenetik bir bileşen kazandırırken, sinirbilimde kullanımla sınırlı değildir. Daha ziyade, biyolüminesans, herhangi bir fotosensör proteinini aktive etmek için kullanılabilir, böylece hücrelerde çok sayıda ışık aracılı fonksiyonun manipülasyonunu sağlar. Çeşitli lusiferaz-lusiferin çiftleri, farklı ışık dalga boyları ve ışık yoğunlukları gerektiren fotosensoriyel proteinlerle eşleştirilebilir.
Spesifik uygulamaya bağlı olarak, lusiferaz-fotoreseptör füzyon proteinleri kullanılarak veya basit ko-transfeksiyon ile verimli ışık dağıtımı sağlanabilir. Işığa bağımlı dimerizasyon veya konformasyonel değişikliklere dayanan fotosensoriyel proteinler, protein lokalizasyonundan, hücre içi sinyal yollarının transkripsiyona kadar hücresel süreçleri etkilemek için biyolüminesans tarafından yönlendirilebilir. Aşağıdaki protokol, hücrelerde ve organizmalarda biyolüminesans aktivasyonunun deneysel olarak yürütülmesini detaylandırmakta ve biyolüminesans güdümlü rekombinazlar ve transkripsiyon faktörleri kullanılarak sonuçları açıklamaktadır. Protokol, araştırmacılara in vitro ve in vivo biyolüminesan optogenetiği gerçekleştirmek için temel prosedürleri sağlar. Açıklanan yaklaşımlar daha da genişletilebilir ve çok sayıda farklı deneysel paradigmaya bireyselleştirilebilir.
Giriş
Fotosensoriyel proteinler, biyolüminesans oluşturmak için substratı lusiferin varlığında fiziksel bir ışık kaynağından veya bir lusiferaz enziminden gelen ışıkla aktive edilebilir. Milisaniyelik veya hatta femtosaniyelik zaman ölçekleri ve/veya tek hücreli uzamsal çözünürlük gerektiren uygulamalar için, fiziksel ışık kaynakları (lazerler ve ışık yayan diyotlar (LED'ler)) bu ölçeklere uygun olan tek kaynaklardır. Örnekler, milisaniye zamansal kontrol1 ile Drosophila larvalarının geliştirilmesinde zıt kutupları uyarmak için kullanılan ışığın mekansal kısıtlaması1 veya mitokondriyal tübüller2 gibi tek hücre altı yapıların hassas bir şekilde uyarılmasıdır. Bununla birlikte, optik anahtarlar için diğer birçok uygulama, genişletilmiş mekansal kontrol ve invaziv olmayan ve hafif hasar görmeyen, ancak dakika zaman ölçeklerinde ve ayarlanabilir yoğunluklarda tanımlanmış zamansal kontrol ile tekrarlanan uygulama dahil olmak üzere farklı önceliklere sahiptir. Burada, ışık algılama alanlarını aktive etmek için alternatif bir ışık kaynağı olarak lusiferazların kullanılmasının çeşitli avantajları vardır. Optik fiber ışık aktivasyonunun aksine, biyolüminesans, ışık kaynağı genetik olarak kodlandığı için hedef hücre popülasyonunda ifade edilen her ışık algılama alanına ulaşır. Biyolüminesans kullanımı, fiber optikler ve uzun süreli fiziksel ışığa maruz kalma nedeniyle doku ve hücre hasarı konusundaki endişeleri hafifletir. Işık, lusiferaz substratının uygulanmasıyla açılır. Başlangıç, uygulama yoluna bağlı olarak in vitro ve in vivo'dur ve ~ 15-30 dakika sürer; Işığın uzatılmış varlığı veya fazik stimülasyonu, farklı lusiferinlerle ve substratın ek veya tekrarlanan uygulamaları ile elde edilebilir3. Son olarak, biyolüminesans emisyonu, lusiferin konsantrasyonunu değiştirerek ayarlanabilir.
İyon hareket eden fotoreseptörleri, yani kanalrodopsinler veya pompalar gibi optogenetik elementleri aktive etmek için biyolüminesans kullanımı kapsamlı bir şekilde gösterilmiştir4,5,6,7,8. Bu Biyolüminesan OptoGenetik (BL-OG) yaklaşımı, farelerde ve sıçanlarda in vivo deneylerde kullanılmıştır5,6,7,9,10,11,12. Opsinlerin BL-OG aktivasyonunun en az ~ 33 μW / mm2 biyolüminesans gerektirdiği, aktivasyon etkinliğinin daha yüksek ışık emisyonu ile arttığı bulunmuştur6,9. İyon hareket eden duyusal fotoreseptörler, doğada bulunan ve iyon hareketi olmayan büyük duyusal fotoreseptör birliğinin bir alt grubudur13,14. Biyolüminesansın, bitkilerden veya bakterilerden gelen fotosensing alanları gibi iyon olmayan hareketli fotoreseptörleri aktive etmeye genişletilmesi, iyon olmayan hareketli fotosensörlerin kanalrodopsinlerden önemli ölçüde ışığa duyarlı olduğu ve biyolüminesanslı ışık sensörlerinin iyon hareketli optogenetik elementlerle elde edilenden daha iyi bir şekilde yönlendirilmesini sağladığı raporlarla teşvik edilmektedir15,16. Son zamanlarda, birkaç yayın, ışık-oksijen-voltaj-algılayıcı (LOV) alanları, mavi-ışık-kullanan-flavin (BLUF) alanları ve kriptokromlar (CRY'lar) dahil olmak üzere çeşitli fotoreseptörlerin aktivasyonu için bir ışık kaynağı olarak biyolüminesans kullanımını bildirmiştir (Tablo 1 ). Optik anahtarların biyolüminesans güdümlü aktivasyonu için uygulamalar, reaktif oksijen türlerinin neden olduğu hücre ölümü, cAMP sentezi, protein alımı ve ayrışmasından genomik rekombinasyona ve transkripsiyonun indüksiyonuna kadar değişen hücre içi süreçleri hedeflemiştir.
Bu protokol, biyolüminesans güdümlü optogenetik araçların genel tasarımını özetlemekte ve hücrelerde ve organizmalarda biyolüminesans aktivasyonunun deneysel olarak yürütülmesi için prosedürleri detaylandırmaktadır. Bir odanın, bir doku kültürü başlığının ve inkübatörün ve biyolüminesans ile çalışmak için bir mikroskobun nasıl kurulacağına dair açıklamaların yanı sıra lusiferinin hazırlanmasından uygulanmasına kadar geçen adımları içerir. Bu protokol, araştırmacılara BioLuminescent OptoGenetics'i (BL-OG) in vitro ve in vivo olarak yürütmek için temel prosedürleri sağlar. Açıklanan yaklaşımlar daha da genişletilebilir ve farklı deneysel paradigmalara bireyselleştirilebilir. Bu protokolün, optogenetik biyolojik çalışmalarda biyolüminesans kullanımının benimsenmesini kolaylaştıracağını öngörüyoruz.
Protokol
Mevcut çalışmadaki tüm prosedürler, Central Michigan Üniversitesi, MI'deki hayvan kullanımı için Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) onaylı protokoller kullanılarak gerçekleştirilmiştir.
1. Fotosensoriyel proteinlerin in vitro biyolüminesans aktivasyonu
- Yapıları
- Bir lusiferaz dizisi veya lusiferaz-floresan protein füzyon dizisi seçin, bu da aktive edilecek fotoreseptörle eşleşen bir dalga boyunda ışık üreten bir ışık yayıcısının ekspresyonuyla sonuçlanacaktır.
NOT: Örneğin, Gaussia luciferase varyantları veya NanoLuc gibi mavi ışık yayan lusiferazlar, CRY / Ca2 + ve integrin bağlayıcı protein (CIB), LOV veya Vivid (VVD) gibi mavi ışık algılayan fotoreseptörlerle eşleştirilebilir. - Diğer araştırmacılardan veya plazmid birikintilerinden zaten mevcut değilse, DNA'yı bir memeli ekspresyonu plazmidine klonlamak için standart moleküler biyoloji tekniklerini kullanın.
NOT: Destekleyicilerin seçimi, CAG ve CMV destekleyicileri tarafından sağlananlar gibi ışık yayan modülün güçlü ve kurucu ifadesini sağlama ihtiyacı tarafından belirlenir. - İlk çalışmalar için, ışık yayıcısının ve ışık sensörünün ko-transfeksiyonu için ayrı plazmidler kullanın. Gerektiğinde ve sonraki çalışmalar için iki moieti'nin füzyon proteinlerini üretin.
- Üreticinin protokollerine göre mini, midi veya maxiprep kitleri kullanarak yüksek kaliteli plazmid DNA'ları elde edin.
- Bir lusiferaz dizisi veya lusiferaz-floresan protein füzyon dizisi seçin, bu da aktive edilecek fotoreseptörle eşleşen bir dalga boyunda ışık üreten bir ışık yayıcısının ekspresyonuyla sonuçlanacaktır.
- Hücre kültürü ve transfeksiyon
NOT: HeLa hücreleri ve HEK293 hücreleri bu protokolde örnek olarak kullanılmıştır.- İstenilen son kullanıma göre format ve sayılarda plaka hücreleri.
NOT: Belirli örnekler Tablo 2'de verilmiştir. Kaplama sırasındaki hücre yoğunluğu, hücrelerin ne kadar sürede transfekte edilebileceğini belirleyecektir.- Floresan mikroskobu ile biyolüminesans ile aktive edilen transkripsiyonu değerlendirmek için, poli-D-lizin (PDL) kaplı 12 mm kapaklar üzerindeki HEK293 hücrelerini 24 delikli kaplara yerleştirir.
- Bir luminometrede ortogonal bir muhabir lusiferazdan gelen ışık emisyonunu ölçerek biyolüminesans ile aktive edilen transkripsiyonu değerlendirmek için, HeLa hücrelerini başlangıçta transfeksiyon için 6 veya 12 kuyucuklu tabaklarda plakalayın, ancak transfeksiyondan sonra yeniden plakalayın (bkz. adım 4).
- Canlı hücre görüntüleme odalarında tekrarlanan biyolüminesans stimülasyonu yapılacaksa, uygun boyuttaki kapak kapaklarını seçin ve bunları uygun boyutta çok kuyucuklu plakalara yerleştirin (12 mm kapak kaymaları için 24 delikli plakalar; 15 mm ve 18 mm kapak kaymaları için 12 delikli plakalar). Tablo 2'de belirtilen hücre numaralarını kullanarak kapakların üstündeki hücreleri tohumlayın. Seçilen hücre tipi kültür yüzeyine iyi yapışmazsa, hücreleri PDL kaplı tabaklara tabaklayın.
- Üreticinin tavsiyesine göre lipofeksiyon ile transfeksiyon yapın veya seçilen hücre tipine uygun herhangi bir transfeksiyon yöntemi kullanın.
NOT: Tablo 3 , farklı ışık yayan proteinlere ek olarak, iki farklı fotoreseptör, EL222 ve CRY2 / CIB ve bunların ilgili muhabir plazmidleri için transfeksiyon deneylerini detaylandırmaktadır. Çeşitli plazmidlerin oranları seçilen örnekler için iyi çalışır, ancak her ışık yayıcı/ışık sensörü çifti için optimize edilmesi gerekir. - Transfeksiyondan sonra, hücreleri tamamen ışık geçirmez bir inkübatöre yerleştirin (Şekil 1).
- İstenilen son kullanıma bağlı olarak, hücreleri ertesi gün orijinal kuyularında / tabaklarında biyolüminesans stimülasyonu için kullanın veya lipofeksiyondan 3-4 saat sonra tekrar tabaklayın. Bir luminometrede bir ateşböceği lusiferaz muhabir geninin transkripsiyonunu okumak için, hücreleri beyaz 96 kuyucuklu plakalarda yeniden plakalayın.
NOT: Tüm manipülasyonları, kırmızı ışıkla aydınlatılmış laminer bir akış başlığı içinde, ışık geçirmez bir odada gerçekleştirin (Şekil 2).- Transfekte edilen hücreleri bir kez Dulbecco'nun modifiye edilmiş Eagle ortamı (DMEM) veya fosfat tamponlu salin (PBS) ile yıkayın.
- Tripsinizan bir reaktifin minimum hacmini kuyucuklara ekleyin (24 kuyucuk: 100 μL; 12 kuyucuk: 150 μL; 6 delik: 300 μL) ve hücreleri 37 ° C'de 3 dakika boyunca inkübe edin.
- Bir sonraki kaplama adımı için uygun hücre yoğunluğunu sağlayacak bir hücre konsantrasyonu elde etmek için kültür ortamı ekleyin (örneğin, 96 delikli bir plakanın 10 kuyucuğunda kaplamak için 24 kuyucuktaki hücreleri 1,2 mL'lik son hacimde yeniden askıya alın; 96 delikli bir plakanın 20 kuyucuğunda kaplama için 2,4 mL'lik son hacimde hücreleri 12 kuyucukta askıya alın). Transfekte edilen hücreleri, sonunda ihtiyaç duyulan kuyu sayısına bağlı olarak birkaç kuyudan havuzlayın.
- Transfekte edilmiş hücreleri son formatlarında plakalayın ve plakaları ışık korumalı inkübatöre geri gönderin.
- İstenilen son kullanıma göre format ve sayılarda plaka hücreleri.
- Biyolüminesans aktivasyonu in vitro
- Lusiferaz substratını (lusiferin) hazırlayın.
- 5 mg liyofilize koelenterazini (CTZ) spesifik çözücüsünün 250 μL'sinde çözerek 50 mM stokları hazırlayın. Flakon duvarları boyunca tüm CTZ'lerin pipetleme veya vorteks ile çözüldüğünden emin olun. Şişeyi doğrudan ışıktan koruyun.
- 0,5 mL siyah mikrosantrifüj tüplerinde 50 μL alikot hazırlayın ve ileride kullanmak üzere -80 °C'de saklayın.
NOT: Çözücü içinde çözünmüş CTZ -80 °C'de donmaz. Alikotlar, ışığa maruz kalma ve oda sıcaklığının minimumda tutulması koşuluyla çalışma çözeltileri yapmak için birkaç kez dondurucudan çıkarılabilir ve dondurucuya geri gönderilebilir.
- Tek biyolüminesans ışık stimülasyonu
NOT: Tüm manipülasyonlar, kırmızı ışıkla aydınlatılmış laminer bir akış başlığında ışık geçirmez bir odada gerçekleştirilir (Şekil 2).- Hücre kültürü ortamında (DMEM veya NeuroBasal) çalışan bir lusiferin çözeltisi hazırlayın. Lusiferin konsantrasyonunu, nihai konsantrasyon 100 μM olacak şekilde ayarlayın. CTZ'nin tüm seyreltmelerini, CTZ zamanla oksitlendiğinden, hücrelere eklemeden kısa bir süre önce orta derecede hazırlayın.
NOT: Ortamın tüm hacmi değiştirilecekse, çalışma çözeltisi 100 μM olacaktır. Hücrelere lusiferin içeren ortam eklenirse, seyreltme faktörü ile konsantrasyon daha yüksek olacaktır (örneğin, kuyudaki 100 μL ortama 300 μM lusiferin içeren 50 μL ortam eklenmesi, 1: 3 seyreltmeye ve dolayısıyla 100 μM nihai lusiferin konsantrasyonuna neden olacaktır). - Hücrelere lusiferin içeren ortam ekleyin ve istenen ışık stimülasyonu süresi boyunca inkübe edin.
NOT: Bu, 1 dakika kadar kısa veya 15 dakika kadar uzun olabilir ve daha kısa veya daha uzun olabilir. Lusiferin içeren ortamı hücreler üzerinde bırakma süresinin uzunluğu, seçilen lusiferaz-lusiferin kombinasyonunun yarı ömrüne ve kinetiğine bağlıdır. - Kırmızı ışığı kapattıktan sonra 100 μM nihai lusiferin konsantrasyonunda ışık emisyonunu gözle izleyin; gözler tamamen karanlığa uyum sağlayana kadar birkaç saniye bekleyin. Bir fotoğraf çekerek ışık emisyonunu belgeleyin (cep telefonuyla bile).
- Lusiferin içeren ortamı çıkararak ve kültür ortamı ile değiştirerek ışık stimülasyonunu sonlandırın. Deneylerin hassasiyetine bağlı olarak, tüm lusiferini ortadan kaldırmak için lusiferin içeren ortamı çıkardıktan sonra hücreleri bir veya iki kez kültür ortamı ile yıkayın. Hücreler kültür yüzeyine iyi yapışmazsa, yıkamalar sırasında hücreleri kaybetmemek için PDL kaplı bulaşıklara tabaklayın.
- Hücreleri 16-24 saat boyunca ışık korumalı inkübatöre geri döndürün.
- Hücre kültürü ortamında (DMEM veya NeuroBasal) çalışan bir lusiferin çözeltisi hazırlayın. Lusiferin konsantrasyonunu, nihai konsantrasyon 100 μM olacak şekilde ayarlayın. CTZ'nin tüm seyreltmelerini, CTZ zamanla oksitlendiğinden, hücrelere eklemeden kısa bir süre önce orta derecede hazırlayın.
- Tekrarlanan biyolüminesans ışık stimülasyonu
NOT: Tüm manipülasyonlar, ışık geçirmez hale getirilebilen ve kırmızı ışıkla aydınlatılabilen bir odada gerçekleştirilir.- Canlı hücre görüntüleme odasını ayarlayın. Bir kutu ve siyah plastik tabakalar veya siyah örtüler kullanarak canlı hücre görüntüleme mikroskobunun etrafında ışık geçirmez bir bölme oluşturun (Şekil 3). Işık geçirmez bölmenin ve odanın içinde bulunan tüm ışık kaynaklarını örtün (örneğin, mikroskop veya aletlerdeki LED göstergeler).
- Perfüzyon sistemini, giriş için istenen çözelti ile kurun ve hazne, bir atık konteynerine giden çıkış portunu dışarı çıkarın.
NOT: Örneğin, görüntüleme çözeltisi Tyrode Çözeltisi (sodyum klorür (124 mM), potasyum klorür (3 mM), HEPES (10 mM), kalsiyum klorür dihidrat (2 mM), magnezyum klorür hekzahidrat (1 mM), D-glikoz (20 mM)) olabilir. - Görüntüleme çözeltisinde çalışan bir lusiferin çözeltisi hazırlayın. Aliquot, tekrarlanan stimülasyonların sayısı kadar çok sayıda mikrosantrifüj tüpüne girer. Lusiferin konsantrasyonunu, görüntüleme odasındaki son konsantrasyon 100 μM olacak şekilde ayarlayın.
- Odaya transfekte hücrelere sahip bir kapak kapağı yerleştirin.
- Pompayı çalışır durumda tutarken, pompanın giriş borusunu giriş kabından çıkarın ve hızlı bir şekilde lusiferin çözeltisine batırın, böylece borudaki herhangi bir hava boşluğunu önlemek için geçiş süresini mümkün olduğunca kısa tutun.
- Lusiferin çözeltisi alınır alınmaz, giriş tüpünü tekrar giriş kabına yerleştirin. Bu işlemi, hücrelerin maruz kalması gereken fizyolojik modele bağlı olarak, gerektiği kadar ve birkaç dakika ila saat aralıklarla tekrarlayın.
- Transkripsiyon için hücreleri ışık korumalı inkübatöre 16-24 saat boyunca geri döndürün veya ışık stimülasyonunun etkisinin değerlendirileceği süre boyunca.
- Lusiferaz substratını (lusiferin) hazırlayın.
2. Fotosensoriyel proteinlerin in vivo biyolüminesans aktivasyonu
- Yapıları
- Bir lusiferaz dizisi veya lusiferaz-floresan protein füzyon dizisi seçin, bu da aktive edilecek fotoreseptörle eşleşen bir dalga boyunda ışık üreten bir ışık yayıcısının ekspresyonuyla sonuçlanacaktır.
- DNA'yı bir pAAV plazmidine klonlamak için standart moleküler biyoloji tekniklerini kullanın, eğer diğer araştırmacılardan veya plazmid birikintilerinden mevcut değilse.
- CAG veya CMV gibi ışık yayan modüllerin ifadesi için güçlü destekleyiciler seçin.
- Yüksek titreli viral stoklar hazırlamak için standart yaklaşımlar kullanın6 veya viral vektörleri ticari olarak hazırlayın.
- İlk çalışmalar için, gerekirse farklı bileşenlerin oranlarının ayarlanmasına izin vermek için ışık yayıcısının ve ışık sensörünün birlikte iletimi için ayrı viral vektörler kullanın.
- AAV transdüksiyonu
- Deney hayvanının hedef organına, in vitro transfeksiyonlar için kullanılan konsantrasyon oranlarına benzer şekilde ışık yayıcı, ışık sensörü ve muhabirin viral vektörleri enjekte edin (Tablo 3).
- Tüm bileşenlerin maksimum ifadesine izin vermek için hayvanları en az 2 hafta boyunca ev kafeslerine geri getirin.
NOT: Hedef organ vücudun içindeyse ve ortam ışığından korunuyorsa, hayvanlar normal ışık koşullarında barındırılabilir.
- Biyolüminesans aktivasyonu in vivo
- Lusiferaz substratını (lusiferin) hazırlayın.
- -80 °C dondurucudan suda çözünür bir CTZ şişesi çıkarın ve oda sıcaklığına kadar ısınmasına izin verin. Işıktan koruyun.
- 500 μg şişe başına, bir şırınga kullanarak veya şişeyi açıp bir pipetle su ekleyerek, ardından kauçuk tıpayı cam şişeye geri koyarak 250 μL steril su ekleyin.
- Tozu tamamen çözmek için yeniden yapılandırılmış cam şişeyi 55 ° C'lik bir su banyosunda birkaç dakika inkübe edin.
- Çözeltiyi siyah bir mikrosantrifüj tüpüne aktarın. Tüm CTZ'yi almak için cam şişenin duvarlarını durulayın.
- Gün için gereken çözelti miktarını kaldırın. Kalan çözeltiyi ertesi gün kullanmak üzere 4 ° C'de saklayın. Donmayın!
- Bir araç şişesi için aynı adımları (2.3.1.1.-2.3.1.5) uygulayın.
- Biyolüminesans ışık stimülasyonu
- Seçilen hayvanın büyüklüğü ve uygulama yolu için gerekli olan lusiferin/araç hacmini ortadan kaldırın (Tablo 4).
- Hayvanlara lusiferin veya araç enjekte edin. Biyolüminesans ışık stimülasyonunu deneysel tasarıma göre tekrarlayın. Örneğin, belirli bir davranışsal paradigma sırasında bir rekombinazın aktivasyonu isteniyorsa, davranışsal testten hemen önce hayvanlara enjekte edin. Bir molekülün fazik transkripsiyonu amaçsa, hayvanlara günlerce tekrar tekrar enjekte edin.
- Biyolüminesans ile uyarılan hayvanlardan tasarlandığı gibi veri toplayın.
- Lusiferaz substratını (lusiferin) hazırlayın.
Sonuçlar
Işığa tepki veren aktüatörlerle manipüle edilebilen ve fiziksel ve biyolojik ışık kaynaklarıyla bimodal aktivasyona uygun çok sayıda hücre içi olay vardır. Aşağıda, ışığa duyarlı kalsiyum (Ca2+) entegratörü, ışığa bağlı protein translokasyonu, ışığı algılayan transkripsiyon faktörü ve ışığa duyarlı bir rekombinaz kullanan örnekler verilmiştir. Örnekler, çeşitli fotoreseptörleri aktive etmek için biyolüminesans kullanmanın fizibilitesini göstermektedir. Sunulan deneyler, ışık yayan diyot (LED) uygulaması, seçilen lusiferaz veya lusiferin uygulamasının konsantrasyonları ve zamanlaması açısından özel olarak optimize edilmemiştir.
Hızlı ışık ve aktivite düzenlemeli ekspresyon (FLARE), bir muhabir geninin artmış hücre içi Ca2 + ve light23 insidansı ile transkripsiyonuna izin veren optogenetik bir sistemdir (Şekil 4A). Ca2 + 'nın varlığı, proteazı sadece ışık stimülasyonu ile erişilebilen proteaz bölünme bölgesine yaklaştırmak için gereklidir ve bu da transkripsiyon faktörünün salınmasına neden olur. HEK293 hücreleri, orijinal FLARE bileşenleri, çift Firefly (FLuc)-dDomates muhabir yapısı ve membrana bağlı Gaussia lusiferaz varyantı sbGLuc6 ile birlikte transfekte edildi. Hücrelerin 2 μM iyonomisin ve 5 mM kalsiyum klorüre (CaCl2) maruz kalması yoluyla hücre içi Ca2 + 'nın artması durumunda, mavi LED'in uygulanması, karanlıkta bırakılan hücrelere kıyasla floresan raporlayıcısının sağlam ekspresyonuna ve FLuc substratının eklenmesi üzerine lüminesans ölçülerek belirlenen FLuc ekspresyonuna yol açmıştır. D-lusiferin. Benzer FLuc ekspresyon seviyeleri, iyonomisin ve CaCl2 ile birlikte sbGLuc substratının (CTZ) uygulanması üzerine sbGLuc tarafından yayılan biyolüminesans ile elde edildi. Işık aktivasyonu (sbGLuc) ve ışık aktivasyonunun etkisini bildirmek için kullanılan lusiferazların (FLuc'un transkripsiyonu) sadece ilgili lusiferinleriyle (CTZ vs D-lusiferin) ışık ürettiğini ve çapraz reaksiyona girmediğini unutmayın.
Kriptokromların heterodimerizasyonuna dayanan ışık kaynaklı bir transkripsiyon sistemi oluşturmak için farklı bileşenler birleştirildi23,24 (Şekil 4B). CRY2 bir proteaz ile kaynaştırılırken, membrana bağlı CIB proteaz bölünme bölgesi ve transkripsiyon faktörü ile kaynaştırıldı. Işık kaynaklı protein translokasyonu, transkripsiyon faktörünü serbest bırakarak, Şekil 4A'da gösterildiği gibi FLuc ve dTomato'nun ekspresyonuna yol açtı. Transkripsiyon faktörü bileşeninin varlığı tek başına muhtemelen spontan proteolize bağlı olarak önemli bir arka plan sinyaline neden olurken, hem fiziksel ışık (LED) hem de biyolüminesans (CTZ), in vivo görüntüleme sisteminde (IVIS) ölçülen FLuc ekspresyonunu sağlam bir şekilde arttırmıştır.
Başka bir deney setinde, NanoLuc (lusiferin: furimazin veya hCTZ), KRI / CIB ve ışığa duyarlı transkripsiyon faktörü EL22225,26,27'nin dimerizasyonu yoluyla transkripsiyonun optogenetik düzenlenmesi için kullanılmıştır. Şekil 5A,B, karanlık ve aydınlık hallerdeki farklı bileşenlerin şemalarını ve ışık sensörüne birlikte transfekte edilen veya kaynaştırılan lusiferazı göstermektedir. Çeşitli karşılaştırmalar Şekil 5C'de gösterilmiştir. Yapıları ifade eden HEK293 hücrelerine hCTZ eklenerek ve 15 dakika sonra çıkarılarak indüklenen biyolüminesans, muhabir transkripsiyonunu sürmede hem CRY / CIB hem de EL222 için 20 dakikalık LED ışık maruziyetinden daha etkiliydi. CRY / CIB için, bir saatlik LED maruziyeti, 15 dakikalık biyolüminesans ile karşılaştırılabilir bir transkripsiyon seviyesine ulaşmak için yeterliydi. Buna karşılık, EL222 için, 60 dakikalık LED bile biyolüminesansa kısa bir süre maruz kalmanın yarısı kadar etkiliydi. Ko-transfekte edildiğinde iki sistem arasındaki transkripsiyon etkinliğinde anlamlı bir fark yoktu, ancak CRY / CIB'nin füzyon proteinleri EL222'ninkinden daha verimliydi. Her iki sistem için de füzyon proteinleri, ko-transfekte edilen bileşenlerden önemli ölçüde daha yüksek transkripsiyon seviyelerine yol açtı. CRY / CIB, ihmal edilebilir arka plan transkripsiyonuna sahip olan EL222'ye kıyasla araç uygulamasıyla sürekli olarak daha yüksek arka plan seviyeleri gösterdi. Tek başına artan hCTZ konsantrasyonlarının, muhabir geninin transkripsiyonu üzerinde hiçbir etkisi yoktu.
Fotoaktiva edilebilir rekombinazlar, optogenomik manipülasyonlar için çok yönlü bir araç sağlar. Canlı LOV proteini iCreV28'e dayanan ışığa duyarlı bölünmüş Cre rekombinazının biyolüminesans aktivasyonunu test ettik. Şekil 6A , CTZ uygulamasından önce ve sonra farklı bileşenlerin, sbGLuc, iCreV ve bir lox-stop-lox floresan muhabirinin (tdTomato) bir şemasını göstermektedir. Kontrollere göre CTZ uygulamasından elde edilen sonuçlar (CTZ veya LED yok) Şekil 6B'de gösterilmiştir. Karanlıkta bile bazı arka plan ifadeleri vardır (CTZ yok); Bununla birlikte, CTZ varlığında, ifade arka plan üzerinde sağlam bir şekilde arttırılır ve LED uygulamasıyla indüklenene benzer.

Resim 1: Hafif kapalı inkübatör. Işıklı kontrol panelinden gelen ışığı kaplayan karton kutu kapağı (üst ok). Hücreleri ışığa maruz kalmaktan korumak için inkübatörün cam kapısının (alt ok) üzerindeki ışık geçirimsiz kapak. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 2: Kırmızı ışıkla aydınlatılmış laminer akış başlığı. Kırmızı ışıkla aydınlatılan standart bir laminer akış doku kültürü davlumbazını gösteren kurulum. Ok, kırmızı ampullü standart bir masaüstü lambasını gösterir. Kırmızı ışık altındaki tüm manipülasyonlar, aksi takdirde karanlık ışık geçirmez bir odada gerçekleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Canlı hücre görüntüleme mikroskoplarının etrafındaki ışık geçirmez bölmeler. Sadece ön tarafta plastik perdeli katı bir kutunun (sol paneller: üst ve alt) veya görüntüleme kurulumunun her yerinde siyah perdelerin (sağ paneller: üst ve alt) kullanımını gösteren iki canlı hücre görüntüleme mikroskobu kurulumuna örnek. Her iki örnekte de ön taraflar kullanılmadığında açık ve yuvarlanmış olarak kalır (üst paneller: sol ve sağ). Ön siyah perdeler, canlı hücre biyolüminesansı stimülasyonu ve / veya görüntüleme (alt paneller: sol ve sağ) gerçekleştirirken odadaki herhangi bir ışığın (örneğin, bilgisayar ekranları) görüntüleme alanına girmesini önlemek için aşağı doğru yuvarlanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
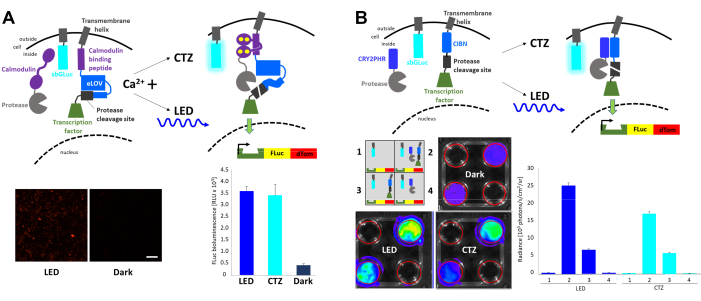
Şekil 4: Hücre içi sinyal olaylarını entegre etmek için biyolüminesans. (A) FLARE bileşenlerinin şemaları, sbGLuc ile birlikte transfekte edilmiştir. Ca2 + varlığında ve proteazın proteaz bölünme bölgesine yakınlığında, biyolüminesans veya LED, LOV'un açılmasına, bölünme bölgesinin maruz kalmasına ve transkripsiyon faktörünün serbest bırakılmasına yol açacaktır. Hücreler LED'e (görev döngüsü %33, 40 dakika boyunca 2 s açık/4 s kapalı; 3,5 mW ışık gücü, 4,72 mW/cm2 ışıma) veya biyolüminesansa (15 dakika boyunca 100 μM CTZ son konsantrasyonu) maruz bırakıldı veya karanlıkta bırakıldı. Ca2 + seviyelerini ve LED'e maruz kalmayı arttırmak için tedaviden sonra yukarıdaki bileşenleri ifade eden HEK293 hücrelerinin mikroskobik görüntüleri (solda). FLuc lüminesansı, LED, biyolüminesans (CTZ) veya karanlıkta sola (sağda) maruz kalmayı karşılaştıran bir luminometrede ölçülmüştür. (B) SbGLuc ile birlikte transfekte edilen Ca2+ bağımlı olmayan bir transkripsiyon sisteminin şemaları. 4 kuyucuklu plakalardaki HEK293 hücreleri, şemada gösterildiği gibi dört farklı bileşen düzenlemesi ile transfekte edildi. Plakalar, CTZ eklenerek ve 15 dakika boyunca açık bırakılarak LED (görev döngüsü% 33, 2 s açık / 4 s kapalı; 3.5 mW ışık gücü, 4.72 mW / cm2 ışınım) veya biyolüminesansa (100 μM CTZ son konsantrasyonu) maruz bırakıldı; kontrol plakaları karanlıkta bırakıldı. FLuc muhabirinin transkripsiyonu bir IVIS'te ölçüldü. Temsili yemeklerin IVIS görüntüleri solda gösterilmiştir; Karanlık kontrollere taban çizgisinde birkaç replikadan yayılan parlaklık ölçümleri sağda gösterilmiştir. Ölçek çubuğu = 100 μm. Kısaltmalar: FLARE = Hızlı ışık ve etkinlik düzenlemeli ifade; LOV = ışık-oksijen-voltaj-algılama; LED = ışık yayan diyot; CTZ = coelenterazine; FLuc = ateşböceği lusiferaz; dTom = dDomates; CRY2 = kriptokrom 2; CRY2PHR = CRY2 fotoliyaz homoloji bölgesi; CIB1 = Ca2+- ve integrin bağlayıcı protein 1; CIBN = CIB1'in N-terminusu; IVIS = in vivo görüntüleme sistemi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
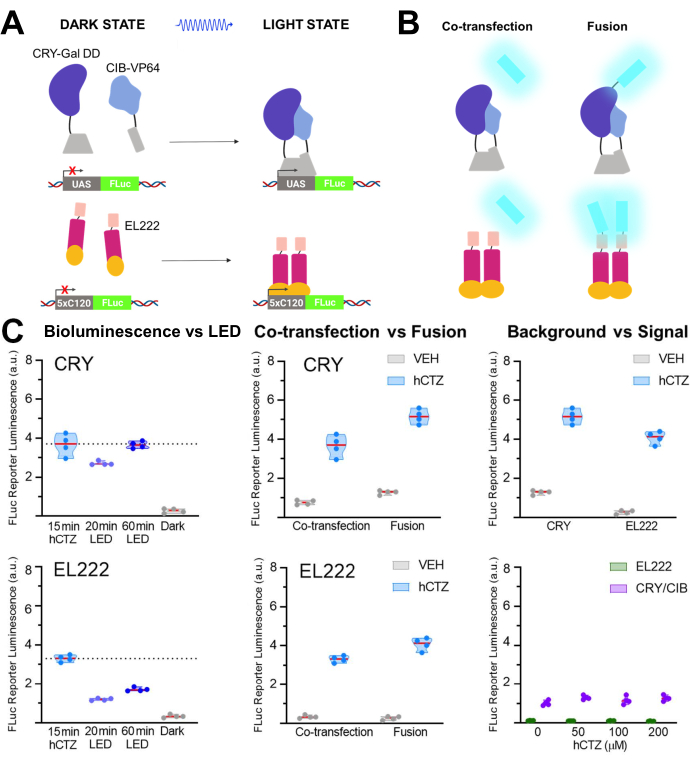
Şekil 5: Transkripsiyonu sürmek için biyolüminesans . (A) İki fotoaktif transkripsiyon sisteminin karanlık ve aydınlık hallerinde şemaları. (B) NanoLuc ya birlikte transfekte edildi ya da tasvir edildiği gibi ışığı algılayan moieties ile kaynaştırıldı (N-NanoLuc-CRY-GalDD-C; N-NanoLuc-VP16-EL222-C). (C) Işık kaynakları, yapı tasarımı ve sinyalden gürültüye ilişkin her iki sistemi de kullanarak yapılan karşılaştırmalar. Hücreler LED'e (görev döngüsü% 33, 40 dakika boyunca 2 s açık / 4 s kapalı; 3.5 mW ışık gücü, 4.72 mW / cm2 ışınım) veya 15 dakika boyunca biyolüminesansa (100 μM hCTZ nihai konsantrasyon; farklı konsantrasyonların kaydedildiği durumlar hariç) maruz bırakıldı. Koyu, plazmidlerin ilk dönüşümü ile FLuc ölçümü arasında inkübatörde plakalara dokunulmadan bırakıldı; VEH, plakalar hCTZ alanlarla aynı şekilde ele alındı, ancak bunun yerine araç alındı. Transkripsiyon düzeylerindeki farklılıklar: hCTZ, eş-transfekte CRY vs EL222 - anlamlı değil; hCTZ, lusiferaz - fotoprotein füzyonu CRY vs EL222 - p < 0.005; hCTZ, CRY ko-transfeksiyon ve füzyon - p < 0.005; hCTZ, EL222 ko-transfeksiyon ve füzyon - p < 0.01; araç, CRY vs EL222 - p < 0.05. Kısaltmalar: UAS = yukarı akış etkinleştirme sırası; LED = ışık yayan diyot; CTZ = coelenterazine; FLuc = ateşböceği lusiferaz; CRY = kriptokrom; CIB = Ca2+- ve integrin bağlayıcı protein; VEH = araç. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
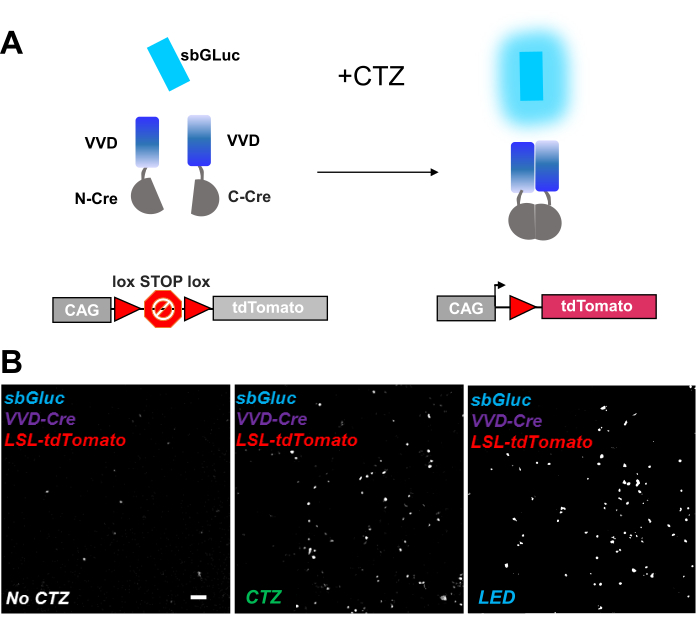
Şekil 6: Optogenomik manipülasyon için biyolüminesans. (A) Işığın uygulanmasından önce ve sonra sbGLuc, bölünmüş iCreV bileşenleri ve LSL muhabir kaseti kullanılarak biyolüminesans güdümlü optogenomik manipülasyonun şemaları. (B) HEK293 hücreleri plazmidlerle lipofekte edildi, daha sonra karanlıkta tutuldu. Yirmi dört saat sonra, hücreler pozitif bir kontrol olarak sadece orta (CTZ yok) veya CTZ (100 μM nihai konsantrasyon) veya LED (görev döngüsü% 25, 5 dakika boyunca 5 s açık / 15 s kapalı; 14.81 mW ışık gücü, 20 mW / cm2 ışıma) ile 30 dakika boyunca tedavi edildi. TdDomates floresansının mikroskobik görüntüleri, belirtildiği gibi koşulları kullanarak. Ölçek çubuğu = 100 μm. Kısaltmalar: LSL = lox-stop-lox; CTZ = coelenterazine; LED = ışık yayan diyot; VVD = Canlı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tablo 1: Fotoreseptörlerin biyolüminesans aktivasyonu. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Hücreleri farklı biçimlerde kaplamak ve transfekte etmek için kılavuzlar. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 3: Transfeksiyon için çeşitli plazmidlerin oranları. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 4: İn vivo uygulamalar için enjeksiyon yolları, hacimleri ve lusiferin konsantrasyonları (25 g fare). Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Fotosensoriyel proteinlerin aktivasyon spektrumlarını maviden kırmızı ışığa eşleştiren ışık emisyonu dalga boylarına sahip bir dizi lusiferaz ve lusiferin vardır14,29. Emisyon ve uyarma dalga boylarını hizalamanın yanı sıra, hangi eşleştirmenin en iyi şekilde çalışacağını a priori olarak belirlemenin güvenilir bir yolu yoktur. Bu nedenle, lusiferin-lusiferaz çiftlerinin fotosensoriyel sistemleri yönlendirmede hücrelerde ve organizmalarda nasıl çalıştığını deneysel olarak belirleme ihtiyacı.
Bu sunumda özetlenen protokoller, lusiferinin nasıl hazırlanacağını ve in vitro ve in vivo olarak nasıl uygulanacağını, biyolüminesans kullanan deneyler için odalar, doku kültürü davlumbazları, inkübatörler ve mikroskoplar kurma kılavuzlarıyla birlikte açıklamaktadır. Temsili deneylerde, biyolüminesansının fiziksel ışığa karşı etkilerini, füzyon proteinlerine karşı ko-transfeksiyonun, sinyal-gürültü karşılaştırmalarını ve farklı okuma testlerini gösteren çeşitli fotosensoriyel proteinlerle (CRY / CIB, EL222, VVD, LOV) farklı lusiferazlar (NanoLuc, Gaussia lusiferaz) kullanılmıştır. Fotosensoriyel proteinleri aktive eden biyolüminesansın daha fazla uygulaması, transkripsiyona ek olarak hücre ölümünün, cAMP sentezinin ve protein hareketinin indüksiyonunu hedefleyen çeşitli gruplardan yayınlarda tanımlanmıştır (Tablo 1).
Işık yayan ve ışığı algılayan bileşenleri basitçe birlikte transfekte etmek iyi bir başlangıçtır. Değişkenler, yayıcı ve sensörün molar oranlarıdır; bilinmeyenler, karanlıktaki sensör aktivitesinin arka plan seviyeleri, ışık yoğunluğu ve süresiyle ilgili sensör aktivitesi ve fiziksel ve biyolojik ışığı karşılaştıran sensör aktivasyonunun verimliliğidir. Füzyon yapıları, yayıcı ve sensörün molar oranını 1: 1'de tutma ve ışık yayıcıyı ışık algılama alanına yaklaştırma avantajına sahip olsa da, fotosensör aktüatörünün performansını etkilemeden nereye bağlanacağı (N veya C-terminus) ve nasıl bağlanacağı (bağlayıcı uzunluğu ve kompozisyonu) gibi diğer hususlar da devreye girer.
Hem in vitro hem de in vivo deneyler için, lusiferin konsantrasyonunu değiştirerek ve / veya lusiferinin ilgili sensöre sunulduğu süreyi değiştirerek biyolüminesan ışık emisyonunu ayarlamak için birden fazla seçenek vardır. Minimum miktar ve süre, ışık aktivasyonu ile beklenen etkinin varlığı veya yokluğu ile belirlenir. Buna karşılık, ilgili maksimumlar esas olarak hücrelerin uzun süreler boyunca yüksek konsantrasyonlarda lusiferin toleransı ile belirlenir. Yukarıdaki örneklerde seçilen CTZ konsantrasyonu, 100 μM, HEK293 hücrelerinden nöronlara kadar çeşitli hücre tipleri için üst sınıra yakındır. Amaç, hedeflenen fotosensing alanının aktivasyonunu sağlamak için en kısa süre için mümkün olduğunca düşük bir konsantrasyon kullanmaktır. Bu, yüksek ışık emisyonuna sahip lusiferazlar ve yüksek ışık hassasiyetine sahip fotoreseptörler kullanılarak daha kolay elde edilecektir.
Fotoreseptörleri sürmek için biyolüminesans, karaciğer, kas, omurilik ve beyinde eksprese edilen fotorens proteinleri olan kemirgenlerde (fareler, sıçanlar) ve ayrıca deri altından veya intraperitoneal olarak nakledilen fotoreseptör eksprese eden hücreler aracılığıyla kullanılmıştır. Prensip olarak, yaklaşımın insan olmayan primatlardan balıklara veya sineklere kadar farklı türlere uygulanmasını engelleyen hiçbir sınır yoktur. Organizmanın lusiferin için geçirgenliğine bağlı olarak, uygulama lusiferini çevreleyen suya uygulamak kadar kolay olabilir (örneğin, balık larvalarında30). BL-OG'yi herhangi bir yeni organizmada kullanmadan önce, lusiferinin seçilen uygulama yolu üzerinden hedeflerine ulaşmasını sağlamak için pilot deneyler yapılmalıdır.
Deneysel tasarımın kritik yönleri, sonuçların yorumlanması için önemli olan çeşitli kontrollerdir. Fotosensoriyel bir proteine etki eden bir lusiferaz tarafından yönlendirilen bir muhabiri ifade eden hücreler, lusiferaz içermeyen veya fotosensoriyel proteinden yoksun hücrelerle karşılaştırılmalıdır. Ayrıca, lusiferine, araca maruz kalan veya karanlıkta tutulan hücreler arasında karşılaştırmalar yapılmalıdır. Biyolüminesans güdümlü fotoreseptör aktivasyonunun etkilerini değerlendirmek için farklı testlerin sınırlamalarını fark etmek de önemlidir. Örneğin, biyolüminesans ile aktive edilen transkripsiyonun etkinliği, muhabir genin bir ortogonal lusiferaz (luminometre, IVIS) veya bir floresan protein (floresan ile aktive edilen hücre sıralama, mikroskopi görüntü analizi) olup olmadığına bağlı olarak farklı şekillerde test edilebilir. Temel etkilerin test platformları arasında tekrarlanabilir olması gerekirken, etkilerin nicel yönleri önemli ölçüde değişebilir.
Fotoreseptörlerin biyolüminesans aktivasyonu, sırasıyla hem in vitro hem de in vivo olarak sınırlı sayıda lusiferaz ve fotosensoriyel protein için şimdiye kadar gösterilmiştir. Daha birçok biyolojik işlemi aktive etmek için büyük fotoreseptör sınıfına genişletilebilir. Yaklaşımın bu şekilde genişlemesi, doğal olarak oluşan lusiferazlardan çok daha yüksek ışık emisyonuna sahip ve farklı uygulamalara uygun kinetik özelliklere sahip yeni lusiferazların ve lusiferaz-floresan protein çiftlerinin sürekli gelişimi ile daha da desteklenmektedir. Bu ilerlemeler, yeni lusiferinlerin üretilmesiyle paralellik göstererek artan parlaklık ve renk paletlerine daha da katkıda bulunur29. Bu araç platformu, canlı hücreler, dokular ve organizmalar içindeki hücre içi dinamikleri ve hücre etkileşimlerini manipüle etmek ve araştırmak için uygulamalar sunar.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Meslektaşlarımıza, özellikle Ca-FLARE proteaz, transkripsiyon faktörü ve muhabir için A. Ting (Addgene # 92214, 92213, 92202), TM-CIBN-BLITz1-TetR-VP16 ve NES-CRY2PHR-TevC (Addgene # 89878, 89877), CRY-GalΔDD için C. Tucker (B1013) ve CIB-VP64 (B1016) (Addgene # 92035, 92037), pGL2-GAL4-UAS-Luc için M. Walsh (Addgene #33020), VP-EL222 ve C120-Fluc için K. Gardner ve iCreV'yi yayınlanmadan önce kullanılabilir hale getirdiği için A. Cetin ve H. Zeng'e teşekkür ederiz. Bu çalışma, NSF (NeuroNex 1707352), NIH (U01NS099709), W.M. Keck Vakfı ve İsveç Araştırma Konseyi'nden A.B. (2016-06760) hibeleriyle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ABI 25W Deep Red 660 nm LED Light Bulb | Amazon | to be used with any lamp stand | |
| Black Microcentrifuge Tubes, 0.5 mL, Argos Technologies | Fisher Scientific | 03-391-166 | |
| Black Microcentrifuge Tubes, 1.5 mL, Argos Technologies | Fisher Scientific | 03-391-161 | |
| Black Nylon, Polyurethane-Coated Fabric (1.5 m x 2.7 m) x 0.12 mm (thick) | THOR LABS | BK-5 | |
| C120-Fluc | K. Gardner | ||
| CaCl2 | Sigma | C8106; CAS: 10035-04-8 | |
| Ca-FLARE protease, transcription factor and reporter | Addgene # 92214, 92213, 92202 | A. Ting | |
| CIB-VP64 (B1016) | Addgene # 92037 | C. Tucker | |
| CRY-GalΔDD (B1013) | Addgene # 92035 | C. Tucker | |
| CTZ | Prolume Inc. (NanoLight) | 303 | formulation for in vitro applications with Gaussia luciferases |
| CTZ (Water soluble native coelenterazine) | Prolume Inc. (NanoLight) | 3031 | formulation for in vivo applications with Gaussia luciferases |
| D-(+)-Glucose | Sigma | G8270; CAS: 50-99-7 | |
| D-Luciferin, Potassium Salt | Gold Biotechnology | LUCK | |
| DMEM | Thermo Fisher | 11960044 | |
| D-PBS, no calcium, no magnesium | Thermo Fisher | 14190144 | |
| hCTZ | Prolume Inc. (NanoLight) | 301 | formulation for in vitro applications with Oplophorus luciferases |
| HEK293 | ATCC | CRL-1573 | |
| HeLa | ATCC | CCL-2 | |
| HEPES | Sigma | H3375; CAS: 7365-45-9 | |
| iCreV | A. Cetin and H. Zeng | ||
| In Vivo Imaging System (IVIS) | Perkin-Elmer | Lumina LT | |
| KCl | Sigma | P5405; CAS: 7447-40-7 | |
| LED Array Driver | Amuza | LAD-1 | |
| LED Array for Multiwell Plates | Amuza | LEDA-x | |
| Lipofectamine 2000 Reagent | Invitrogen | 11668-019 | Transfection reagent |
| Luminometer | Molecular Devices | SpectraMax L | |
| MgCl2 Hexahydrate | Sigma | M2670; CAS: 7791-18-6 | |
| NaCl | Sigma | S7653; CAS: 7647-14-5 | |
| NanoFuel Solvent | Prolume Inc. (NanoLight) | 399 | for dissolving CTZ preparations for in vitro use |
| NaOH | Sigma | 221465; CAS: 1310-73-2 | |
| NES-CRY2PHR-TevC | Addgene # 89877 | H. Kwon | |
| Opti-MEM | Thermo Fisher | 11058021 | transfection medium |
| PDL coated coverslips (12 mm, 15 mm, 18 mm) | Neuvitro Corporation | GG-12-PDL, GG-15-PDL , GG-18-PDL | |
| pGL2-GAL4-UAS-Luc | Addgene #33020 | M. Walsh | |
| Prizmatix USB Pulser TTL Generator for Optogenetics | Goldstone Scientific | ||
| TM-CIBN-BLITz1-TetR-VP16 | Addgene # 89878 | H. Kwon | |
| TrypLE Express | Gibco | 12604-013 | |
| Vehicle (Water-soluble carrier without CTZ) | Prolume Inc. (NanoLight) | 3031C | control for in vivo applications with CTZ |
| VP-EL222 | K. Gardner |
Referanslar
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Wang, Y., et al. Photostimulation by femtosecond laser triggers restorable fragmentation in single mitochondrion. Journal of Biophotonics. 10 (2), 286-293 (2017).
- Li, T., et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nature Communications. 12 (1), 615(2021).
- Berglund, K., Birkner, E., Augustine, G. J., Hochgeschwender, U. Light-emitting channelrhodopsins for combined optogenetic and chemical-genetic control of neurons. PLoS One. 8 (3), 59759(2013).
- Tung, J. K., Gutekunst, C. -A., Gross, R. E. Inhibitory luminopsins: genetically-encoded bioluminescent opsins for versatile, scalable, and hardware-independent optogenetic inhibition. Scientific Reports. 5, 14366(2015).
- Berglund, K., et al. Luminopsins integrate opto- and chemogenetics by using physical and biological light sources for opsin activation. Proceedings of the National Academy of Sciences of the United States of America. 113 (3), 358-367 (2016).
- Gomez-Ramirez, M., More, A. I., Friedman, N. G., Hochgeschwender, U., Moore, C. I. The BioLuminescent-OptoGenetic in vivo response to coelenterazine is proportional, sensitive and specific in neocortex. Journal of Neuroscience Research. 98 (3), 471-480 (2020).
- Moore, C. I., Berglund, K. BL-OG: BioLuminescent-OptoGenetics. Journal of Neuroscience Research. 98 (3), 469-470 (2020).
- Park, S. Y., et al. Novel luciferase-opsin combinations for improved luminopsins. Journal of Neuroscience Research. 98 (3), 410-421 (2020).
- Jaiswal, P. B., Tung, J. K., Gross, R. E., English, A. W. Motoneuron activity is required for enhancements in functional recovery after peripheral nerve injury in exercised female mice. Journal of Neuroscience Research. 98 (3), 448-457 (2020).
- Zenchak, J. R., et al. Bioluminescence-driven optogenetic activation of transplanted neural precursor cells improves motor deficits in a Parkinson's disease mouse model. Journal of Neuroscience Research. 98 (3), 458-468 (2020).
- Tung, J. K., Shiu, F. H., Ding, K., Gross, R. E. Chemically activated luminopsins allow optogenetic inhibition of distributed nodes in an epileptic network for non-invasive and multi-site suppression of seizure activity. Neurobiology of Disease. 109, Pt A 1-10 (2018).
- Hegemann, P. Algal sensory photoreceptors. Annual Review of Plant Biology. 59, 167-189 (2008).
- Losi, A., Gardner, K. H., Moglich, A. Blue-light receptors for optogenetics. Chemical Reviews. 118 (21), 10659-10709 (2018).
- Proshkina, G. M., Shramova, E. I., Shilova, O. N., Ryabova, A. V., Deyev, S. M. Phototoxicity of flavoprotein miniSOG induced by bioluminescence resonance energy transfer in genetically encoded system NanoLuc-miniSOG is comparable with its LED-excited phototoxicity. Journal of Photochemistry and Photobiology B: Biology. 188, 107-115 (2018).
- Kawano, F., Okazaki, R., Yazawa, M., Sato, M. A photoactivatable Cre-loxP recombination system for optogenetic genome engineering. Nature Chemical Biology. 12 (12), 1059-1064 (2016).
- Shramova, E. I., Proshkina, G. M., Chumakov, S. P., Khodarovich, Y. M., Deyev, S. M. Flavoprotein miniSOG cytotoxisity can be induced by bioluminescence resonance energy transfer. Acta Naturae. 8 (4), 118-123 (2016).
- Naim, N., et al. Luminescence-activated nucleotide cyclase regulates spatial and temporal cAMP synthesis. Journal of Biological Chemistry. 294 (4), 1095-1103 (2019).
- Kim, C. K., Cho, K. F., Kim, M. W., Ting, A. Y. Luciferase-LOV BRET enables versatile and specific transcriptional readout of cellular protein-protein interactions. Elife. 8, 43826(2019).
- Parag-Sharma, K., et al. Engineered BRET-based biologic light sources enable spatiotemporal control over diverse optogenetic systems. ACS Synthetic Biology. 9 (1), 1-9 (2020).
- Kim, E. H., et al. Self-luminescent photodynamic therapy using breast cancer targeted proteins. Science Advances. 6 (37), (2020).
- Kim, C. K., et al. A Molecular calcium integrator reveals a striatal cell type driving aversion. Cell. 183 (7), 2003-2019 (2020).
- Wang, W., et al. A light- and calcium-gated transcription factor for imaging and manipulating activated neurons. Nature Biotechnology. 35 (9), 864-871 (2017).
- Lee, D., Hyun, J. H., Jung, K., Hannan, P., Kwon, H. -B. A calcium- and light-gated switch to induce gene expression in activated neurons. Nature Biotechnology. 35 (9), 858-863 (2017).
- Pathak, G. P., et al. Bidirectional approaches for optogenetic regulation of gene expression in mammalian cells using Arabidopsis cryptochrome 2. Nucleic Acids Research. 45 (20), 167(2017).
- Nishio, H., Walsh, M. J. CCAAT displacement protein/cut homolog recruits G9a histone lysine methyltransferase to repress transcription. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11257-11262 (2004).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Yao, S., et al. RecV recombinase system for in vivo targeted optogenomic modifications of single cells or cell populations. Nature Methods. 17 (4), 422-429 (2020).
- Love, A. C., Prescher, J. A. Seeing (and using) the light: Recent developments in bioluminescence technology. Cell Chemical Biology. 27 (8), 904-920 (2020).
- Naumann, E. A., Kampff, A. R., Prober, D. A., Schier, A. F., Engert, F. Monitoring neural activity with bioluminescence during natural behavior. Nature Neuroscience. 13 (4), 513-520 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır