Method Article
生物発光光遺伝学2.0:生体内および生体内で光感覚タンパク質を活性化するための生物発光の利用
要約
小分子基質であるルシフェリンを酸化するルシフェラーゼ酵素によって放出される生物発光光は、光感覚タンパク質を活性化するために利用することができ、それによって光刺激に別の次元を加え、時間的および空間的スケールにわたって細胞内の多数の光媒介機能の操作を可能にする。
要約
生物発光−小分子基質を酸化するルシフェラーゼ酵素によって放出される光、ルシフェリン−は、ニューロン内の光依存性イオンチャネルおよびポンプを活性化するためにインビトロおよびインビボで使用されてきた。この生物発光光遺伝学(BL-OG)アプローチは、化学遺伝学的要素を光遺伝学的ツールに付与するが、神経科学における使用に限定されない。むしろ、生物発光を利用して任意の光感覚タンパク質を活性化することができ、したがって、細胞における多数の光媒介機能の操作を可能にする。様々なルシフェラーゼ - ルシフェリン対を、異なる波長の光および光強度を必要とする光感覚タンパク質と適合させることができる。
特定の用途に応じて、ルシフェラーゼ-光受容体融合タンパク質を使用するか、または単純な同時トランスフェクションによって、効率的な光送達を達成することができます。光依存性二量体化または立体構造変化に基づく光感覚タンパク質は、タンパク質局在化、細胞内シグナル伝達経路の調節から転写までの細胞プロセスに影響を及ぼす生物発光によって駆動され得る。以下のプロトコルは、細胞および生物における生物発光活性化の実験的実行を詳述し、生物発光駆動型リコンビナーゼおよび転写因子を用いた結果を記載する。このプロトコルは、 インビトロ および インビボで生物発光光遺伝学を実施するための基本的な手順を研究者に提供します。記載されたアプローチは、多数の異なる実験パラダイムにさらに拡張および個別化することができる。
概要
光感覚タンパク質は、物理的な光源またはルシフェラーゼ酵素からの光によって、その基質であるルシフェリンの存在下で活性化され、生物発光を生成することができる。ミリまたはフェムト秒のタイムスケールおよび/またはシングルセルの空間分解能を必要とするアプリケーションでは、物理光源(レーザーおよび発光ダイオード(LED))のみがこれらのスケールに調整可能です。例としては、ミリ秒の時間的制御1でショウジョウバエの幼虫を発達させる際に対極を刺激するために使用される光の空間的制限1や、ミトコンドリア尿細管などの単一の細胞内構造の正確な刺激2があります。しかし、光スイッチの他の多くのアプリケーションには、拡張された空間制御や、非侵襲的かつ光損傷のない繰り返しアプリケーションなど、さまざまな優先順位がありますが、微細なタイムスケールと調整可能な強度で定義された時間制御を備えています。ここで、光感知ドメインを活性化するための代替光源としてルシフェラーゼを使用することには、いくつかの利点がある。光ファイバ光活性化とは対照的に、生物発光は、光源が遺伝的にコードされるにつれて、標的細胞集団において発現されるすべての光感知ドメインに到達する。生物発光を使用すると、光ファイバーによる組織や細胞の損傷や長時間の物理的光曝露に対する懸念が軽減されます。光は、ルシフェラーゼ基質の適用によりオンになる。発症は、投与経路に応じてインビトロおよびインビボで即時であり、〜15〜30分間持続する。光の長時間の存在または位相刺激は、異なるルシフェリンおよび基質3の追加または反復適用によって達成することができる。最後に、生物発光発光は、ルシフェリンの濃度を変えることによって調整することができる。
イオン移動光受容体、すなわちチャネルロドプシンまたはポンプなどの光遺伝学的要素を活性化するための生物発光の使用は、広範囲に実証されている4,5,6,7,8。このBioLuminescent OptoGenetics(BL-OG)アプローチは、マウスおよびラットにおけるin vivo実験で採用されています5,6,7,9,10,11,12。オプシンのBL-OG活性化は、少なくとも〜33μW/mm2の生物発光量を必要とし、活性化の効率はより高い発光とともに増加することが見出された6,9。イオン移動感覚感光体は、非イオン移動である自然界に見られる感覚感光体の大きな偶発事象のサブグループです13,14。植物や細菌からの光感知ドメインなどの非イオン移動光受容体を活性化するための生物発光の拡張は、非イオン移動光センサーがチャネルロドプシンよりも有意に光感受性が高く、イオン移動光遺伝学的要素で既に得られているよりも生物発光を伴う光センサーのさらに優れた駆動を保証するという報告15,16によって奨励されている。最近、いくつかの出版物は、光 - 酸素 - 電圧感知(LOV)ドメイン、青色光使用 - フラビン(BLUF)ドメイン、およびクリプトクロム(CRI)を含む様々な光受容体の活性化のための光源としての生物発光の使用を報告した3、17、18、19、20、21、22(表1).活性酸素種誘発細胞死、cAMP合成、タンパク質の動員および解離からゲノム組換えおよび転写誘導に至るまで、細胞内プロセスを標的とした光スイッチの生物発光駆動活性化のためのアプリケーション。
このプロトコルは、生物発光駆動型光遺伝学的ツールの一般的な設計を概説し、細胞および生物における生物発光活性化の実験的実行手順を詳述する。これには、部屋、組織培養フードとインキュベーター、生物発光を扱うための顕微鏡のセットアップ方法、およびルシフェリンの準備から適用までの手順の説明が含まれています。このプロトコルは、インビトロおよびインビボでバイオルミネッセンスオプトジェネティクス(BL-OG)を実施するための基本的な手順を研究者に提供します。記載されたアプローチは、異なる実験パラダイムにさらに拡張および個別化することができる。我々は、このプロトコルが、光遺伝学的生物学的研究における生物発光の使用の採用を促進すると期待している。
プロトコル
現在の研究におけるすべての手順は、ミシガン州セントラルミシガン大学の動物取り扱いに関する施設動物ケアおよび使用委員会(IACUC)承認のプロトコルを使用して実施されました。
1. 光感覚タンパク質の生体発光活性化
- 構築
- 活性化する感光体と一致する波長の光を生成する発光体の発現をもたらすルシフェラーゼ配列またはルシフェラーゼ - 蛍光タンパク質融合配列を選択する。
注:例えば、 ガウシア ルシフェラーゼ変異体またはNanoLucなどの青色発光ルシフェラーゼは、CRY/Ca2+-およびインテグリン結合タンパク質(CIB)、LOV、またはビビッド(VVD)などの青色光感光受容体と組み合わせることができる。 - 他の研究者またはプラスミド寄託物からまだ入手できない場合は、標準的な分子生物学技術を使用して、DNAを哺乳動物発現プラスミドにクローニングします。
注:プロモーターの選択は、CAGおよびCMVプロモーターによって提供されるような、発光モジュールの強力で構成的な発現を提供する必要性によって決定される。 - 初期研究では、発光体と光センサーの同時トランスフェクションに別々のプラスミドを使用してください。必要に応じて、およびその後の研究のために、2つの部分の融合タンパク質を生成する。
- メーカーのプロトコルに従って、ミニ、ミディ、またはマキシプレップキットを使用して高品質のプラスミドDNAを入手してください。
- 活性化する感光体と一致する波長の光を生成する発光体の発現をもたらすルシフェラーゼ配列またはルシフェラーゼ - 蛍光タンパク質融合配列を選択する。
- 細胞培養とトランスフェクション
注:HeLa細胞およびHEK293細胞は、このプロトコルの例として使用される。- 目的の最終用途に応じた書式と数字のプレートセル。
注:具体例を 表2に示す。プレーティング時の細胞密度は、細胞をトランスフェクトできる速さを決定します。- 蛍光顕微鏡による生物発光活性化転写を評価するために、ポリD-リジン(PDL)コーティングされた12mmカバースリップ上のプレートHEK293細胞を24ウェルディッシュに入れた。
- 直交レポータールシフェラーゼからの発光をルミノメーターで測定することによって生物発光活性化転写を評価するために、HeLa細胞を最初にトランスフェクションのために6ウェルまたは12ウェルディッシュにプレートするが、トランスフェクション後にそれらを再プレートする(ステップ4参照)。
- 生細胞イメージングチャンバーで生物発光刺激を繰り返し行う場合は、適切なサイズのカバースリップを選択し、適切なサイズのマルチウェルプレート(12mmカバースリップの場合は24ウェルプレート、15mmおよび18mmカバースリップの場合は12ウェルプレート)に配置します。 表 2 に指定されたセル番号を使用して、カバースリップの上にセルをシードします。選択した細胞種が培養面に良好に接着しない場合は、PDLコーティングされたディッシュ上に細胞をプレートする。
- メーカーの推奨に従ってリポフェクションによるトランスフェクションを実行するか、選択した細胞タイプに適したトランスフェクション方法を使用します。
注: 表3は 、異なる発光タンパク質に加えて、EL222およびCRY2/CIB、ならびにそれらのそれぞれのレポータープラスミドの2つの異なる光受容体に対するトランスフェクション実験の詳細である。さまざまなプラスミドの比率は、選択した例ではうまく機能しますが、発光体/光センサーのペアごとに最適化する必要があります。 - トランスフェクション後、完全に光密封されたインキュベーターに細胞を置きます(図1)。
- 所望の最終用途に応じて、翌日に元のウェル/ディッシュで生物発光刺激のために細胞を使用するか、リポフェクションの3〜4時間後にそれらを再プレートする。ホタルルシフェラーゼレポーター遺伝子の転写をルミノメーターで読み取るために、細胞を白い96ウェルプレートに再プレートします。
メモ:すべての操作は、赤色光で照らされた層流フード内の明るい部屋で行ってください(図2)。- トランスフェクトした細胞をダルベッコの改変イーグル培地(DMEM)またはリン酸緩衝生理食塩水(PBS)で1回洗浄します。
- 最小容量のトリプシン処理試薬をウェルに加え(24ウェル:100 μL;12ウェル:150 μL;6ウェル:300 μL)、細胞を37°Cで3分間インキュベートする。
- 培養培地を加えて、次のプレーティング工程で適切な細胞密度が得られる細胞濃度を達成します(例えば、96ウェルプレートの10ウェルにプレーティングするために、最終容量1.2mLで24ウェルの細胞を再懸濁し、96ウェルプレートの20ウェルにプレーティングするために、最終容量2.4mLで12ウェルの細胞を再懸濁する)。最終的に必要なウェルの数に応じて、いくつかのウェルからトランスフェクトされた細胞をプールします。
- 形質移入した細胞を最終フォーマットでプレートし、プレートを光で保護されたインキュベーターに戻します。
- 目的の最終用途に応じた書式と数字のプレートセル。
- 生物発光活性化 in vitro
- ルシフェラーゼ基質(ルシフェリン)を調製する。
- 凍結乾燥セレンテラジン(CTZ)5mgを250μLの特定の溶媒に溶解して50mMストックを調製する。バイアルの壁に沿ったすべてのCTZがピペッティングまたはボルテックスによって溶解されていることを確認してください。バイアルを直接光から保護します。
- 0.5 mL の黒色微量遠心チューブに 50 μL のアリコートを用意し、将来の使用のために -80 °C で保存します。
注:溶媒に溶解したCTZは-80°Cで凍結しない。 アリコートは、光と室温への暴露が最小限に抑えられている限り、作業溶液を作るために冷凍庫から数回取り出して冷凍庫に戻すことができます。
- 単一生物発光光刺激
メモ:すべての操作は、赤色光で照らされた層流フード内の明るい部屋で行われます(図2)。- 細胞培養培地(DMEMまたはNeuroBasal)中のルシフェリンの作用溶液を調製する。最終濃度が100μMになるようにルシフェリンの濃度を調整し、CTZが時間の経過とともに酸化するので、細胞に添加する直前にCTZのすべての希釈液を培地に調製する。
注:培地の全容量を交換する場合、作業溶液は100μMになります。ルシフェリン含有培地を細胞に添加する場合、濃度は希釈因子によって高くなる(例えば、ウェル内の100μLの培地に300μMルシフェリンを含む50μLの培地を添加すると、1:3の希釈、したがって100μMの最終濃度のルシフェリンが得られる)。 - ルシフェリン含有培地を細胞に加え、所望の光刺激期間にわたってインキュベートする。
注: これは 1 分または 15 分まで短くてもかまいませんが、さらに短くても長くてもかまいません。ルシフェリン含有培地を細胞上に残す時間の長さは、選択されたルシフェラーゼ - ルシフェリン組み合わせの半減期および動態に依存する。 - 赤色光を消した後、目で100μMの最終ルシフェリン濃度での発光を監視する。目が完全な暗闇に適応するまで数秒間待ちます。写真を撮って発光を記録します(携帯電話でも)。
- ルシフェリン含有培地を除去し、培養培地と交換することにより、光刺激を終了する。実験の感度に応じて、ルシフェリン含有培地を除去した後に培養培地で細胞を1回または2回洗浄し、全てのルシフェリンを除去した。細胞が培養面によく接着しない場合は、洗浄中に細胞が失われないように、PDLコーティングされた皿に細胞をプレートします。
- 細胞を光で保護されたインキュベーターに16〜24時間戻します。
- 細胞培養培地(DMEMまたはNeuroBasal)中のルシフェリンの作用溶液を調製する。最終濃度が100μMになるようにルシフェリンの濃度を調整し、CTZが時間の経過とともに酸化するので、細胞に添加する直前にCTZのすべての希釈液を培地に調製する。
- 繰り返し生物発光光刺激
注:すべての操作は、ライトタイトにし、赤色の光で照らすことができる部屋で行われます。- 生細胞イメージングチャンバーをセットアップします。生細胞イメージング顕微鏡の周囲に、箱と黒いプラスチックシートまたは黒いドレープを使用して、光密なコンパートメントを作成します(図3)。ライトタイトなコンパートメントと部屋の中に存在するすべての光源(顕微鏡や機器のLEDインジケータなど)を覆います。
- 吸気のための所望の溶液と廃容器につながるチャンバ出口で灌流システムをセットアップする。
注:例えば、イメージング溶液は、チロード溶液(塩化ナトリウム(124mM)、塩化カリウム(3mM)、HEPES(10mM)、塩化カルシウム二水和物(2mM)、塩化マグネシウム6水和物(1mM)、D-グルコース(20mM))であり得る。 - イメージング溶液中のルシフェリンの作用溶液を調製する。反復刺激の数と同じ数の微量遠心チューブにアリコートする。イメージングチャンバ内の最終濃度が100μMとなるようにルシフェリンの濃度を調整する。
- トランスフェクトされた細胞を含むカバースリップをチャンバー内に配置します。
- ポンプを作動させたまま、ポンプの入口チューブを吸気ビーカーから取り外し、すぐにルシフェリン溶液に浸漬し、チューブ内の空気空隙を避けるために移行時間をできるだけ短く保ちます。
- ルシフェリン溶液が取り込まれたらすぐに、導入チューブを吸気ビーカーに戻します。このプロセスを、細胞が露出するはずの生理学的パターンに応じて、必要な回数だけ、数分から数時間の間隔で繰り返す。
- 細胞を光保護インキュベーターに16〜24時間戻し、転写のために、または光刺激の効果が評価される時間の長さの間。
- ルシフェラーゼ基質(ルシフェリン)を調製する。
2. 生体内における光感覚タンパク質の生物発光活性化
- 構築
- 活性化する感光体と一致する波長の光を生成する発光体の発現をもたらすルシフェラーゼ配列またはルシフェラーゼ - 蛍光タンパク質融合配列を選択する。
- 標準的な分子生物学技術を使用して、DNAをpAAVプラスミドにクローニングします(他の研究者またはプラスミドデポジットからまだ入手できない場合は)。
- CAGまたはCMVなどの発光モジュールの発現のための強力なプロモーターを選択する。
- 高力価のウイルスストック6 を調製するための標準的なアプローチを使用するか、またはウイルスベクターを商業的に調製する。
- 初期の研究では、発光体と光センサーの共形質導入に別々のウイルスベクターを使用して、必要に応じて異なる成分の比率を調整できるようにします。
- AAV形質導入
- イン ビトロ トランスフェクションに用いた濃度比に類似した発光体、光センサー、およびレポーターのウイルスベクターを実験動物の標的器官に注入する(表3)。
- すべての成分を最大限に発現させるために、動物を少なくとも2週間自宅のケージに戻してください。
注:標的器官が体内にあり、周囲光から保護されている場合、動物は通常の光条件下で飼育することができます。
- 生体内発光活性化
- ルシフェラーゼ基質(ルシフェリン)を調製する。
- -80°Cの冷凍庫から水溶性CTZのバイアルを取り出し、室温まで温めます。光から保護してください。
- 500μgのバイアルあたり、シリンジを使用するか、バイアルを開けてピペットで水を加え、ゴム栓をガラスバイアルに戻すことによって、250μLの滅菌水を加える。
- 再構成されたガラスバイアルを55°Cの水浴中で数分間インキュベートし、粉末を完全に溶解させた。
- 溶液を黒色微量遠心管に移す。ガラスバイアルの壁をすすぎ、すべてのCTZを取得します。
- その日に必要な量の溶液を除去します。残りの溶液を4°Cで保存し、翌日使用する。凍らないでください!
- 車両のバイアルに対して同じ手順(2.3.1.1.-2.3.1.5)を実行します。
- 生物発光光刺激
- 動物のサイズと選択した適用経路に必要なルシフェリン/車両の量を削除します(表4)。
- 動物にルシフェリンまたはビヒクルを注射する。生物発光光刺激を実験計画に従って繰り返す。例えば、特定の行動パラダイム中にリコンビナーゼの活性化が必要な場合は、行動試験の直前に動物を注射する。分子の位相転写が目標である場合は、動物に数日間にわたって繰り返し注射する。
- 設計どおりに生物発光刺激動物からデータを収集します。
- ルシフェラーゼ基質(ルシフェリン)を調製する。
結果
光に応答するアクチュエータで操作することができ、物理的および生物学的光源による二峰性活性化に順応する多数の細胞内事象が存在する。以下は、光感知カルシウム(Ca2+)インテグレーター、光誘起タンパク質転座、光感知転写因子、および感光性リコンビナーゼを採用した例である。実施例は、生物発光を使用して様々な種類の光受容体を活性化することの実現可能性を示す。提示された実験は、発光ダイオード(LED)適用、選択されたルシフェラーゼ、またはルシフェリン適用の濃度およびタイミングに関して特に最適化されなかった。
高速光および活性調節発現(FLARE)は、細胞内Ca2+および光23の同時発生率の増加を伴うレポーター遺伝子の転写を可能にする光遺伝学的システムである(図4A)。Ca2+の存在は、プロテアーゼを光刺激によってのみアクセス可能なプロテアーゼ切断部位に近接させるために必要であり、転写因子の放出をもたらす。HEK293細胞を、元のFLARE成分、二重ホタル(FLuc)-dTomatoレポーター構築物、および膜固定ガウシアルシフェラーゼ変異体sbGLuc6で共トランスフェクトした。2μMのイオノマイシンおよび5mMの塩化カルシウム(CaCl2)への細胞の曝露による細胞内Ca2+の増加の存在下で、青色LEDの適用は、暗闇に残された細胞と比較して蛍光レポーターの堅牢な発現をもたらし、ならびにFLuc基質を添加したときの発光を測定することによって決定されたFLucの発現に、 D-ルシフェリン。同様のレベルのFLuc発現が、イオノマイシンおよびCaCl2と共にsbGLuc基質(CTZ)を塗布した際にsbGLucによって放出される生物発光によって達成された。光活性化(sbGLuc)および光活性化の効果(FLucの転写)を報告するために使用されるルシフェラーゼは、それぞれのルシフェリン(CTZ対D-ルシフェリン)とのみ光を生成し、交差反応しないことに留意されたい。
異なる成分を組み合わせ、クリプトクロム23、24 のヘテロ二量体化に基づく光誘導転写系を生成した(図4B)。CRY2をプロテアーゼに融合させ、膜結合CIBをプロテアーゼ切断部位および転写因子に融合させた。光誘導タンパク質転座は転写因子を放出し、 図4Aに示すようにFLucおよびdTomatoの発現をもたらした。転写因子成分のみの存在は、おそらく自発的なタンパク質分解に起因するかなりのバックグラウンドシグナルをもたらしたが、物理的光(LED)および生物発光(CTZ)の両方が、 in vivo イメージングシステム(IVIS)で測定されたFLucの発現を堅牢に増加させた。
別の実験セットでは、NanoLuc(ルシフェリン:フリマジンまたはhCTZ)が、CRY/CIBと感光性転写因子EL22225,26,27の二量体化による転写の光遺伝学的調節に使用された。図5A、Bは、暗黒状態および明状態における異なる成分の概略図を示し、ルシフェラーゼを光センサに同時トランスフェクトまたは融合させた。様々な比較を図5Cに示す。構築物を発現するHEK293細胞にhCTZを添加し、15分後に除去することによって誘導される生物発光は、CRY/CIBおよびEL222の両方について、20分間のLED光曝露よりもレポーター転写の駆動においてより効率的であった。CRY/CIBの場合、1時間のLED曝露は、15分間の生物発光に匹敵する転写レベルに達するのに十分であった。対照的に、EL222の場合、60分のLEDでさえ、生物発光への短時間の暴露の半分の効果しかありませんでした。CRY/CIBの融合タンパク質はEL222の融合タンパク質よりも効率的であったが、同時トランスフェクトした場合の両系間の転写有効性に有意差はなかった。両方の系において、融合タンパク質は、共形質移入された成分よりも有意に高い転写レベルをもたらした。CRY/CIBは、バックグラウンド転写がごくわずかであったEL222と比較して、ビヒクルアプリケーションで一貫して高いバックグラウンドレベルを示しました。hCTZ単独の濃度の増加は、レポーター遺伝子の転写に影響を及ぼさなかった。
光活性化可能なリコンビナーゼは、光ゲノム操作のための汎用性の高いツールを提供します。我々は、ビビッドLOVタンパク質iCreV28に基づく感光性スプリットCreリコンビナーゼの生物発光活性化を試験した。 図6Aは 、異なる成分、sbGLuc、iCreV、およびCTZの適用前後のロックス・ストップ・ロックス蛍光レポーター(tdTomato)の概略を示す。コントロール(CTZまたはLEDなし)に対するCTZアプリケーションの結果を 図6Bに示します。暗闇の中でも背景表現があります(CTZなし)。しかしながら、CTZの存在下では、発現はバックグラウンドにわたって堅牢に増加し、LED適用で誘導されるものと同様である。

図1:ライト密閉インキュベーター。 照明付きコントロールパネルからの光を覆う段ボール箱フラップ(上矢印)。インキュベーターのガラスドア(下矢印)の上に光不透過性のカバーは、光曝露から細胞を保護する。 この図の拡大版を表示するには、ここをクリックしてください。

図2:赤色光に照らされた層流フード。 赤色光により照明される標準層流組織培養フードを示すセットアップ。矢印は、赤い電球の付いた標準のデスクトップランプを示します。赤色光の下でのすべての操作は、そうでなければ暗い明るい部屋で行われます。 この図の拡大版を表示するには、ここをクリックしてください。

図3:生細胞イメージング顕微鏡の周囲の薄暗い区画 生細胞イメージング顕微鏡のセットアップの2つの例は、前面にのみプラスチックドレープ(左パネル:上と下)またはイメージングセットアップ全体に黒いドレープ(右パネル:上と下)のいずれかを使用することを示しています。両方の例の前面は開いたままで、使用していないときはロールアップされています(トップパネル:左右)。生細胞生物発光刺激および/またはイメージングを行う際に、室内の光(コンピュータスクリーンなど)がイメージング領域に侵入するのを防ぐために、前面の黒いドレープがロールダウンされています(下部パネル:左右)。 この図の拡大版を表示するには、ここをクリックしてください。
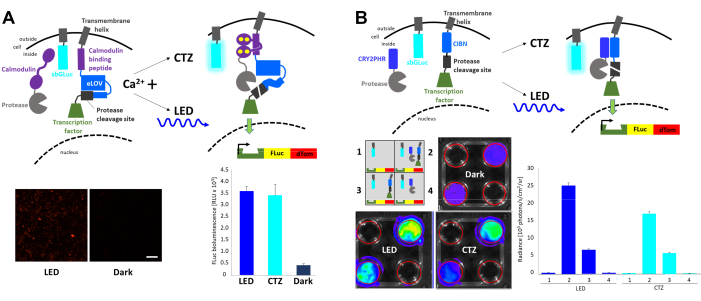
図4:細胞内シグナル伝達事象を統合するための生物発光。 (a)sbGLucと同時トランスフェクトしたFLARE成分の概略図。Ca2+ の存在下およびプロテアーゼ切断部位へのプロテアーゼの近接の結果として生じる場合、生物発光またはLEDのいずれかが、LOVの展開、切断部位の露出、および転写因子の放出をもたらす。細胞をLED(デューティサイクル33%、2秒オン/4秒オフ40分、3.5mW光パワー、4.72mW/cm2 放射照度)または生物発光(100μM CTZ最終濃度15分間)に曝露するか、暗所に放置した。Ca2+レベルを上昇させ、LEDに曝露した後に上記の成分を発現するHEK293 細胞の顕微鏡像(左)。ルミノメーターで測定されたFLucルミネッセンスは、LEDへの曝露、生物発光(CTZ)、または暗闇での左(右)を比較した。(B)sbGLucと同時トランスフェクトした非Ca2+依存性転写系の概略図。4ウェルプレート中のHEK293細胞を、回路図に描かれているように4つの異なる配置の成分でトランスフェクトした。プレートをLED(デューティサイクル33%、2秒オン/4秒オフ40分、3.5mW光パワー、4.72mW/cm2 放射照度)または生物発光(100μM CTZ最終濃度)のいずれかにCTZを添加して15分間オンのままにして暴露した。コントロールプレートは暗闇の中に残された。FLucレポーターの転写はIVISで測定した。代表的な料理のIVIS画像を左側に示します。ベースラインからダークコントロールまでのいくつかの反復からの放射輝度測定値が右側に表示されます。スケールバー = 100 μm。略語: FLARE = 高速光および活性調節発現;LOV = 光 - 酸素 - 電圧検出;LED = 発光ダイオード;CTZ = セレンテラジン;FLuc = ホタルルシフェラーゼ;dTom = dTomato;CRY2 = クリプトクロム 2;CRY2PHR=CRY2フォトリアーゼ相同性領域;CIB1 = Ca2+-およびインテグリン結合タンパク質1;CIBN = CIB1のN末端;IVIS= インビボ イメージングシステム。 この図の拡大版を表示するには、ここをクリックしてください。
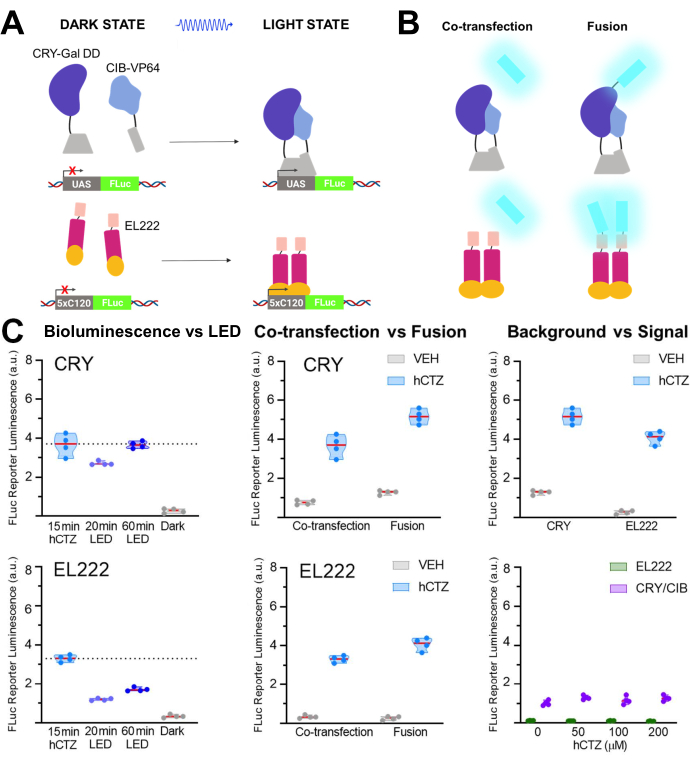
図5:転写を駆動するための生物発光 。 (A)暗状態および明状態における2つの光活性化可能な転写系の回路図。(B)ナノリュックは、図のように光感知部分に同時トランスフェクトまたは融合された(N-NanoLuc-CRY-GalDD-C;N-ナノラック-VP16-EL222-C)。(C)光源、構造設計、信号対雑音に関する両システムを用いた比較。細胞をLED(デューティサイクル33%、2秒オン/4秒オフ40分;3.5mW光パワー、4.72mW/cm2 放射照度)または生物発光に15分間(100μM hCTZ最終濃度;異なる濃度が認められる場合を除き)暴露した。暗く、プレートは、プラスミドの初期形質転換とFLuc測定との間のインキュベーター内に手つかずのまま残した;VEH、プレートはhCTZを受けたものと同じ扱いでしたが、代わりに車両を受け取りました。転写レベルの差:hCTZ、同時トランスフェクトCRY対EL222 - 有意ではない。hCTZ、ルシフェラーゼ-光タンパク質融合CRY対EL222 - p<0.005;hCTZ、CRYコトランスフェクション対融合 - p<0.005;hCTZ, EL222 コトランスフェクション vs. 融合 - p < 0.01;車両, CRY 対 EL222 - p < 0.05.略語: UAS = アップストリーム活性化シーケンス;LED = 発光ダイオード;CTZ = セレンテラジン;FLuc = ホタルルシフェラーゼ;CRY = クリプトクロム;CIB = Ca2+-およびインテグリン結合タンパク質;VEH = 車両。 この図の拡大版を表示するには、ここをクリックしてください。
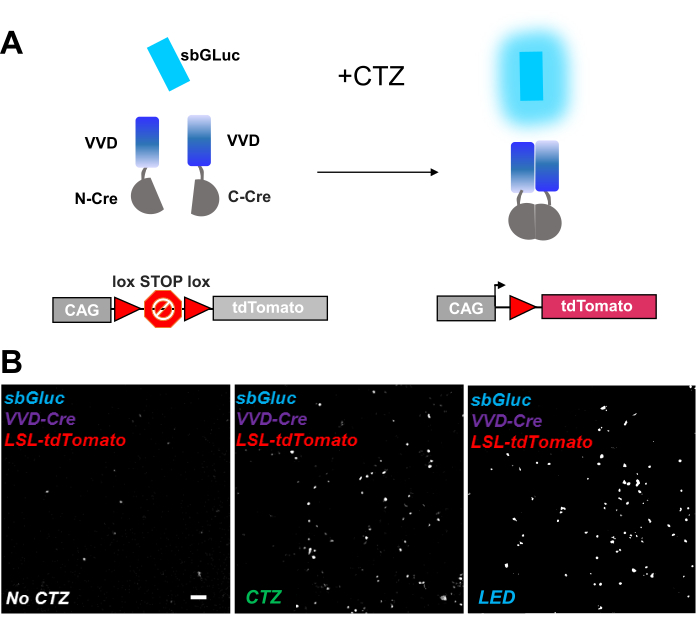
図6:光ゲノム操作のための生物発光 。 (A)光の適用前後のsbGLuc、分割iCreV成分、およびLSLレポーターカセットを用いた生物発光駆動型光ゲノム操作の概略図。(b)HEK293細胞をプラスミドでリポフェクトし、次いで暗所に保持した。24時間後、細胞を培地のみ(CTZなし)またはCTZ(100μM最終濃度)またはLED(デューティサイクル25%、5分間5秒オン/15秒オフ;14.81mW光パワー、20mW/cm2 放射照度)で30分間処理した。tdトマト蛍光の顕微鏡像は、指示されたような条件を用いた。スケールバー = 100 μm。略語: LSL = lox-stop-lox;CTZ = セレンテラジン;LED = 発光ダイオード;VVD = 鮮やか。 この図の拡大版を表示するには、ここをクリックしてください。
表1:光受容体の生物発光活性化。この表をダウンロードするには、ここをクリックしてください。
表 2: 異なるフォーマットの細胞をプレーティングおよびトランスフェクトするためのガイドライン。 この表をダウンロードするには、ここをクリックしてください。
表3:トランスフェクションのための様々なプラスミドの比率。 この表をダウンロードするには、ここをクリックしてください。
表4:in vivo適用のためのルシフェリンの注射経路、体積、および濃度 (25gマウス)。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
青色光から赤色光までの光感覚タンパク質の活性化スペクトルと一致する発光波長を有するルシフェラーゼおよびルシフェリンの範囲が存在する14,29。発光波長と励起波長を揃えること以外に、どのペアリングが最も効果的かを先験的に決定する信頼できる方法はありません。したがって、ルシフェリン - ルシフェラーゼ対が光感覚系を駆動する細胞および生物においてどのように作用するかを実験的に決定する必要がある。
このプレゼンテーションで概説したプロトコルでは、ルシフェリンの調製方法、およびイン ビトロ およびイン ビボでの適用方法を、生物発光を利用する実験のための部屋、組織培養フード、インキュベーター、および顕微鏡の設置に関するガイドラインとともに説明しています。代表的な実験では、いくつかの光感覚タンパク質(CRY/CIB、EL222、VVD、LOV)を有する異なるルシフェラーゼ(NanoLuc、 ガウシア ルシフェラーゼ)を使用し、生物発光対物理的光、共トランスフェクション対融合タンパク質、シグナル対ノイズ比較、および異なる読み出しアッセイの効果を実証した。光感覚タンパク質を活性化する生物発光のより多くの用途は、転写に加えて細胞死の誘導、cAMP合成、およびタンパク質移動を標的とするいくつかのグループからの刊行物に記載されている(表1)。
発光コンポーネントと光センシングコンポーネントを単に同時トランスフェクトするだけで、良いスタートを切ることができます。変数は、エミッタとセンサのモル比です。未知数は、暗闇でのセンサー活動の背景レベル、光の強度と持続時間に関連するセンサー活動、および物理的光と生物学的光を比較するセンサー活性化の効率です。融合コンストラクトは、エミッタとセンサのモル比を1:1に保ち、発光体を光感知ドメインに近づけるという利点を有するが、光感覚アクチュエータの性能に影響を与えずにテザーする場所(N末端またはC末端)およびリンク方法(リンカの長さおよび組成)などの他の考慮事項が作用する。
イン ビトロ および インビボの両方の実験では、ルシフェリンの濃度を変えることによって、および/またはルシフェリンがそれぞれのセンサーで利用可能になる時間を変えることによって、生物発光発光を調整するための複数の選択肢がある。最小量および時間は、光活性化で期待される効果の有無によって決定される。対照的に、それぞれの最大値は、主に、長期間にわたる高濃度のルシフェリンに対する細胞の耐性によって決定される。上記の実施例で選択したCTZの濃度である100μMは、HEK293細胞からニューロンまで、様々な細胞型の上限に近い。目標は、標的光感知ドメインの活性化を達成するために、できるだけ低い濃度を最短時間で使用することである。これは、高い発光を有するルシフェラーゼおよび高い光感度を有する感光体を用いて、より容易に達成されるであろう。
光受容体を駆動するための生物発光は、肝臓、筋肉、脊髄、および脳に発現する光感タンパク質を有するげっ歯類(マウス、ラット)において、ならびに皮下または腹腔内に移植された光受容体発現細胞を介して使用されてきた。原則として、このアプローチがヒト以外の霊長類から魚やハエまで、さまざまな種に適用されることを妨げる制限はありません。ルシフェリンに対する生物の透過性に応じて、適用は、ルシフェリンを周囲の水(例えば、魚の幼虫30)に適用するのと同じくらい容易であり得る。BL-OGを新しい生物に使用する前に、ルシフェリンが選択された適用経路を介して標的に到達することを保証するためにパイロット実験を実施しなければならない。
実験計画の重要な側面は、結果の解釈に重要なさまざまなコントロールです。光感覚タンパク質に作用するルシフェラーゼによって駆動されるレポーターを発現する細胞は、ルシフェラーゼを欠く細胞または光感覚タンパク質を欠く細胞と比較されるべきである。さらに、ルシフェリンに曝露された細胞、ビヒクル、または暗闇に保持された細胞間で比較が行われるべきである。また、生物発光駆動型光受容体活性化の効果を評価するための異なるアッセイの限界を認識することも重要である。例えば、生物発光活性化転写の有効性は、レポーター遺伝子が直交ルシフェラーゼ(ルミノメーター、IVIS)であるか、蛍光タンパク質(蛍光活性化細胞選別、顕微鏡画像解析)であるかに応じて、異なる方法で試験することができる。基本的な効果はテストプラットフォーム間で再現可能である必要がありますが、効果の定量的側面はかなり異なる場合があります。
光受容体の生物発光活性化は、イン ビトロ および インビボの両方で、それぞれ限られた数のルシフェラーゼおよび光感覚タンパク質について、これまでに実証されてきた。これは、より多くの生物学的プロセスを活性化するための光受容体の大きなクラスに拡張することができます。このようなアプローチの拡大は、天然に存在するルシフェラーゼよりもはるかに高い発光を有し、異なる用途に同調可能な動力学的特徴を有する新規ルシフェラーゼおよびルシフェラーゼ - 蛍光タンパク質対の継続的な開発によってさらに促進される。これらの進歩は、新しいルシフェリンの生成と並行して行われ、明るさとカラーパレットの増加をさらに増やします29。このツールプラットフォームは、生きた細胞、組織、生物内の細胞内ダイナミクスと細胞相互作用を操作および調査するアプリケーションを提供します。
開示事項
著者らは、開示する利益相反はありません。
謝辞
我々は、コンストラクト、特にCa-FLAREプロテアーゼ、転写因子およびレポーター(Addgene # 92214, 92213, 92202)のA. Ting、TM-CIBN-BLITz1-TetR-VP16およびNES-CRY2PHR-TevC(Addgene # 89878, 89877)のC. Tucker、CRY-GalΔDD(B1013)およびCIB-VP64(B1016)(Addgene # 92035、92037)、pGL2-GAL4-UAS-Luc(Addgene #33020)のM. Walsh、VP-EL222およびC120-FlucのK. Gardner、および出版前にiCreVを利用可能にしたA. CetinおよびH. Zengに感謝します。この研究は、NSF(NeuroNex 1707352)、NIH(U01NS099709)、W.M. Keck Foundation、およびSwedish Research CouncilからA.B.(2016-06760)への助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| ABI 25W Deep Red 660 nm LED Light Bulb | Amazon | to be used with any lamp stand | |
| Black Microcentrifuge Tubes, 0.5 mL, Argos Technologies | Fisher Scientific | 03-391-166 | |
| Black Microcentrifuge Tubes, 1.5 mL, Argos Technologies | Fisher Scientific | 03-391-161 | |
| Black Nylon, Polyurethane-Coated Fabric (1.5 m x 2.7 m) x 0.12 mm (thick) | THOR LABS | BK-5 | |
| C120-Fluc | K. Gardner | ||
| CaCl2 | Sigma | C8106; CAS: 10035-04-8 | |
| Ca-FLARE protease, transcription factor and reporter | Addgene # 92214, 92213, 92202 | A. Ting | |
| CIB-VP64 (B1016) | Addgene # 92037 | C. Tucker | |
| CRY-GalΔDD (B1013) | Addgene # 92035 | C. Tucker | |
| CTZ | Prolume Inc. (NanoLight) | 303 | formulation for in vitro applications with Gaussia luciferases |
| CTZ (Water soluble native coelenterazine) | Prolume Inc. (NanoLight) | 3031 | formulation for in vivo applications with Gaussia luciferases |
| D-(+)-Glucose | Sigma | G8270; CAS: 50-99-7 | |
| D-Luciferin, Potassium Salt | Gold Biotechnology | LUCK | |
| DMEM | Thermo Fisher | 11960044 | |
| D-PBS, no calcium, no magnesium | Thermo Fisher | 14190144 | |
| hCTZ | Prolume Inc. (NanoLight) | 301 | formulation for in vitro applications with Oplophorus luciferases |
| HEK293 | ATCC | CRL-1573 | |
| HeLa | ATCC | CCL-2 | |
| HEPES | Sigma | H3375; CAS: 7365-45-9 | |
| iCreV | A. Cetin and H. Zeng | ||
| In Vivo Imaging System (IVIS) | Perkin-Elmer | Lumina LT | |
| KCl | Sigma | P5405; CAS: 7447-40-7 | |
| LED Array Driver | Amuza | LAD-1 | |
| LED Array for Multiwell Plates | Amuza | LEDA-x | |
| Lipofectamine 2000 Reagent | Invitrogen | 11668-019 | Transfection reagent |
| Luminometer | Molecular Devices | SpectraMax L | |
| MgCl2 Hexahydrate | Sigma | M2670; CAS: 7791-18-6 | |
| NaCl | Sigma | S7653; CAS: 7647-14-5 | |
| NanoFuel Solvent | Prolume Inc. (NanoLight) | 399 | for dissolving CTZ preparations for in vitro use |
| NaOH | Sigma | 221465; CAS: 1310-73-2 | |
| NES-CRY2PHR-TevC | Addgene # 89877 | H. Kwon | |
| Opti-MEM | Thermo Fisher | 11058021 | transfection medium |
| PDL coated coverslips (12 mm, 15 mm, 18 mm) | Neuvitro Corporation | GG-12-PDL, GG-15-PDL , GG-18-PDL | |
| pGL2-GAL4-UAS-Luc | Addgene #33020 | M. Walsh | |
| Prizmatix USB Pulser TTL Generator for Optogenetics | Goldstone Scientific | ||
| TM-CIBN-BLITz1-TetR-VP16 | Addgene # 89878 | H. Kwon | |
| TrypLE Express | Gibco | 12604-013 | |
| Vehicle (Water-soluble carrier without CTZ) | Prolume Inc. (NanoLight) | 3031C | control for in vivo applications with CTZ |
| VP-EL222 | K. Gardner |
参考文献
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Wang, Y., et al. Photostimulation by femtosecond laser triggers restorable fragmentation in single mitochondrion. Journal of Biophotonics. 10 (2), 286-293 (2017).
- Li, T., et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nature Communications. 12 (1), 615(2021).
- Berglund, K., Birkner, E., Augustine, G. J., Hochgeschwender, U. Light-emitting channelrhodopsins for combined optogenetic and chemical-genetic control of neurons. PLoS One. 8 (3), 59759(2013).
- Tung, J. K., Gutekunst, C. -A., Gross, R. E. Inhibitory luminopsins: genetically-encoded bioluminescent opsins for versatile, scalable, and hardware-independent optogenetic inhibition. Scientific Reports. 5, 14366(2015).
- Berglund, K., et al. Luminopsins integrate opto- and chemogenetics by using physical and biological light sources for opsin activation. Proceedings of the National Academy of Sciences of the United States of America. 113 (3), 358-367 (2016).
- Gomez-Ramirez, M., More, A. I., Friedman, N. G., Hochgeschwender, U., Moore, C. I. The BioLuminescent-OptoGenetic in vivo response to coelenterazine is proportional, sensitive and specific in neocortex. Journal of Neuroscience Research. 98 (3), 471-480 (2020).
- Moore, C. I., Berglund, K. BL-OG: BioLuminescent-OptoGenetics. Journal of Neuroscience Research. 98 (3), 469-470 (2020).
- Park, S. Y., et al. Novel luciferase-opsin combinations for improved luminopsins. Journal of Neuroscience Research. 98 (3), 410-421 (2020).
- Jaiswal, P. B., Tung, J. K., Gross, R. E., English, A. W. Motoneuron activity is required for enhancements in functional recovery after peripheral nerve injury in exercised female mice. Journal of Neuroscience Research. 98 (3), 448-457 (2020).
- Zenchak, J. R., et al. Bioluminescence-driven optogenetic activation of transplanted neural precursor cells improves motor deficits in a Parkinson's disease mouse model. Journal of Neuroscience Research. 98 (3), 458-468 (2020).
- Tung, J. K., Shiu, F. H., Ding, K., Gross, R. E. Chemically activated luminopsins allow optogenetic inhibition of distributed nodes in an epileptic network for non-invasive and multi-site suppression of seizure activity. Neurobiology of Disease. 109, Pt A 1-10 (2018).
- Hegemann, P. Algal sensory photoreceptors. Annual Review of Plant Biology. 59, 167-189 (2008).
- Losi, A., Gardner, K. H., Moglich, A. Blue-light receptors for optogenetics. Chemical Reviews. 118 (21), 10659-10709 (2018).
- Proshkina, G. M., Shramova, E. I., Shilova, O. N., Ryabova, A. V., Deyev, S. M. Phototoxicity of flavoprotein miniSOG induced by bioluminescence resonance energy transfer in genetically encoded system NanoLuc-miniSOG is comparable with its LED-excited phototoxicity. Journal of Photochemistry and Photobiology B: Biology. 188, 107-115 (2018).
- Kawano, F., Okazaki, R., Yazawa, M., Sato, M. A photoactivatable Cre-loxP recombination system for optogenetic genome engineering. Nature Chemical Biology. 12 (12), 1059-1064 (2016).
- Shramova, E. I., Proshkina, G. M., Chumakov, S. P., Khodarovich, Y. M., Deyev, S. M. Flavoprotein miniSOG cytotoxisity can be induced by bioluminescence resonance energy transfer. Acta Naturae. 8 (4), 118-123 (2016).
- Naim, N., et al. Luminescence-activated nucleotide cyclase regulates spatial and temporal cAMP synthesis. Journal of Biological Chemistry. 294 (4), 1095-1103 (2019).
- Kim, C. K., Cho, K. F., Kim, M. W., Ting, A. Y. Luciferase-LOV BRET enables versatile and specific transcriptional readout of cellular protein-protein interactions. Elife. 8, 43826(2019).
- Parag-Sharma, K., et al. Engineered BRET-based biologic light sources enable spatiotemporal control over diverse optogenetic systems. ACS Synthetic Biology. 9 (1), 1-9 (2020).
- Kim, E. H., et al. Self-luminescent photodynamic therapy using breast cancer targeted proteins. Science Advances. 6 (37), (2020).
- Kim, C. K., et al. A Molecular calcium integrator reveals a striatal cell type driving aversion. Cell. 183 (7), 2003-2019 (2020).
- Wang, W., et al. A light- and calcium-gated transcription factor for imaging and manipulating activated neurons. Nature Biotechnology. 35 (9), 864-871 (2017).
- Lee, D., Hyun, J. H., Jung, K., Hannan, P., Kwon, H. -B. A calcium- and light-gated switch to induce gene expression in activated neurons. Nature Biotechnology. 35 (9), 858-863 (2017).
- Pathak, G. P., et al. Bidirectional approaches for optogenetic regulation of gene expression in mammalian cells using Arabidopsis cryptochrome 2. Nucleic Acids Research. 45 (20), 167(2017).
- Nishio, H., Walsh, M. J. CCAAT displacement protein/cut homolog recruits G9a histone lysine methyltransferase to repress transcription. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11257-11262 (2004).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Yao, S., et al. RecV recombinase system for in vivo targeted optogenomic modifications of single cells or cell populations. Nature Methods. 17 (4), 422-429 (2020).
- Love, A. C., Prescher, J. A. Seeing (and using) the light: Recent developments in bioluminescence technology. Cell Chemical Biology. 27 (8), 904-920 (2020).
- Naumann, E. A., Kampff, A. R., Prober, D. A., Schier, A. F., Engert, F. Monitoring neural activity with bioluminescence during natural behavior. Nature Neuroscience. 13 (4), 513-520 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved