Method Article
Биолюминесцентная оптогенетика 2.0: использование биолюминесценции для активации фотосенсорных белков in vitro и in vivo
В этой статье
Резюме
Биолюминесценция - свет, излучаемый ферментом люциферазы, окисляющим низкомолекулярный субстрат, люциферин, - может быть использован для активации фотосенсорных белков, тем самым добавляя еще одно измерение к световой стимуляции и позволяя манипулировать множеством светоопосредованных функций в клетках во временном и пространственном масштабах.
Аннотация
Биолюминесценция - свет, излучаемый ферментом люциферазы, окисляющим субстрат небольшой молекулы, люциферин - использовался in vitro и in vivo для активации световых ионных каналов и насосов в нейронах. Хотя этот биолюминесцентный подход к оптогенетике (BL-OG) наделяет хемогенетический компонент оптогенетическими инструментами, он не ограничивается использованием в нейробиологии. Скорее, биолюминесценция может быть использована для активации любого фотосенсорного белка, что позволяет манипулировать множеством светоопосредованных функций в клетках. Различные пары люцифераза-люциферин могут быть сопоставлены с фотосенсорными белками, требующими различных длин волн света и интенсивности света.
В зависимости от конкретного применения эффективная доставка света может быть достигнута с помощью белков слияния люциферазы и фоторецепторов или путем простой котрансфекции. Фотосенсорные белки, основанные на светозависимой димеризации или конформационных изменениях, могут быть обусловлены биолюминесценцией для воздействия на клеточные процессы от локализации белка, регуляции внутриклеточных сигнальных путей до транскрипции. В приведенном ниже протоколе подробно описывается экспериментальное выполнение активации биолюминесценции в клетках и организмах и описываются результаты с использованием рекомбиназ, управляемых биолюминесценцией, и факторов транскрипции. Протокол предоставляет исследователям основные процедуры для проведения биолюминесцентной оптогенетики in vitro и in vivo. Описанные подходы могут быть дополнительно расширены и индивидуализированы до множества различных экспериментальных парадигм.
Введение
Фотосенсорные белки могут быть активированы светом либо от физического источника света, либо от фермента люциферазы в присутствии его субстрата, люциферина, для генерации биолюминесценции. Для приложений, требующих милли- или даже фемтосекундных временных шкал и/или одноэлементного пространственного разрешения, физические источники света (лазеры и светодиоды (СВЕТОДИОДы)) являются единственными, настроенными на эти масштабы. Примерами являются пространственное ограничение света, используемое для стимуляции противоположных полюсов в развитии личинок дрозофилы с миллисекундным временным контролем1 или точная стимуляция одиночных субклеточных структур, таких как митохондриальные канальцы2. Однако многие другие приложения для оптических переключателей имеют другие приоритеты, включая расширенное пространственное управление и повторное применение неинвазивно и без повреждения светом, но с определенным временным управлением в минутных временных масштабах и настраиваемых интенсивностях. Здесь использование люцифераз в качестве альтернативного источника света для активации светочувствительных доменов имеет несколько преимуществ. В отличие от активации оптического волокна света, биолюминесценция достигает каждого светочувствительного домена, экспрессируемого в популяции клеток-мишеней, поскольку источник света генетически закодирован. Использование биолюминесценции снимает опасения по поводу повреждения тканей и клеток волоконной оптикой и расширенным физическим воздействием света. Свет включается при нанесении субстрата люциферазы. Начало происходит немедленно in vitro и in vivo в зависимости от пути введения и длится ~15-30 мин; расширенное присутствие или фазовая стимуляция света может быть достигнута с помощью различных люциферинов и при дополнительном или повторном применении субстрата3. Наконец, биолюминесцентное излучение может быть настроено путем изменения концентрации люциферина.
Широко продемонстрировано использование биолюминесценции для активации ионно-движущихся фоторецепторов, т.е. оптогенетических элементов, таких как канальные родопсины или насосы4,5,6,7,8. Этот подход BioLuminescent OptoGenetics (BL-OG) был использован в экспериментах in vivo на мышах и крысах5,6,7,9,10,11,12. Было обнаружено, что активация BL-OG опсинов требует количества биолюминесценции не менее ~33 мкВт/мм2, при этом эффективность активации увеличивается при более высоком световом излучении6,9. Ион-движущиеся сенсорные фоторецепторы представляют собой подгруппу большого контингента сенсорных фоторецепторов, обнаруженных в природе, которые являются неионными движущимися13,14. Распространение биолюминесценции на активацию неионных движущихся фоторецепторов, таких как фотозоны растений или бактерий, поощряется сообщениями15,16 о том, что неионные движущиеся фотодатчики значительно более светочувствительны, чем канальныеродопсины, обеспечивая еще лучший привод датчиков света с биолюминесценцией, чем уже полученные с ионными оптогенетическими элементами. Недавно в нескольких публикациях сообщалось об использовании биолюминесценции в качестве источника света для активации различных фоторецепторов, включая домены, чувствительные к напряжению света (LOV), домены, использующие синий свет (BLUF) и криптохромы (CRYs)3,17,18,19,20,21,22 (Таблица 1 ). Приложения для биолюминесцентной активации оптических переключателей нацелены на внутриклеточные процессы, начиная от гибели клеток, вызванной активными формами кислорода, синтеза цАМФ, рекрутирования и диссоциации белка до геномной рекомбинации и индукции транскрипции.
В этом протоколе излагается общая конструкция оптогенетических инструментов, управляемых биолюминесценцией, и подробно описываются процедуры экспериментального выполнения активации биолюминесценции в клетках и организмах. Он включает в себя описания того, как настроить комнату, вытяжку для культивирования тканей и инкубатор, а также микроскоп для работы с биолюминесценцией, а также этапы от подготовки люциферина до его применения. Этот протокол предоставляет исследователям основные процедуры для проведения биолюминесцентной оптогенетики (BL-OG) in vitro и in vivo. Описанные подходы могут быть дополнительно расширены и индивидуализированы для различных экспериментальных парадигм. Мы ожидаем, что этот протокол облегчит использование биолюминесценции в оптогенетических биологических исследованиях.
протокол
Все процедуры в текущем исследовании были выполнены с использованием утвержденных Комитетом по уходу и использованию животных (IACUC) протоколов для обработки животных в Центральном Мичиганском университете, штат Мичиган.
1. Активация биолюминесценции фотосенсорных белков in vitro
- Конструкции
- Выберите последовательность люциферазы или последовательность слияния люциферазы-флуоресцентного белка, которая приведет к экспрессии излучателя света, производящего свет длины волны, соответствующей активируемому фоторецептору.
ПРИМЕЧАНИЕ: Например, синие светоизлучающие люциферазы, такие как варианты люциферазы Гауссии или NanoLuc, могут быть сопряжены с синими светочувствительными фоторецепторами, такими как CRY / Ca2 + - и интегрин-связывающий белок (CIB), LOV или Vivid (VVD). - Если это еще не доступно от других исследователей или плазмидных отложений, используйте стандартные методы молекулярной биологии для клонирования ДНК в плазмиду экспрессии млекопитающих.
ПРИМЕЧАНИЕ: Выбор промоутеров продиктован необходимостью обеспечения сильного и конститутивного выражения светоизлучающего модуля, такого как то, которое обеспечивается промоутерами CAG и CMV. - Для первоначальных исследований используют отдельные плазмиды для совместной трансфекции излучателя света и датчика освещенности. Генерируйте белки слияния двух фрагментов по мере необходимости и для последующих исследований.
- Получайте высококачественные плазмидные ДНК с помощью мини-, миди- или максипреп-комплектов в соответствии с протоколами производителя.
- Выберите последовательность люциферазы или последовательность слияния люциферазы-флуоресцентного белка, которая приведет к экспрессии излучателя света, производящего свет длины волны, соответствующей активируемому фоторецептору.
- Клеточная культура и трансфекция
ПРИМЕЧАНИЕ: Клетки HeLa и HEK293 используются в качестве примеров в этом протоколе.- Пластинчатые ячейки в форматах и номерах в соответствии с желаемым конечным использованием.
ПРИМЕЧАНИЕ: Конкретные примеры приведены в таблице 2. Плотность клеток во время покрытия будет определять, как скоро клетки могут быть трансфектированы.- Для оценки биолюминесцентно-активированной транскрипции с помощью флуоресцентной микроскопии пластинчатые клетки HEK293 на покрытых поли-D-лизином (PDL) 12 мм обложек помещены в 24-луночные чашки.
- Для оценки биолюминесцентно-активированной транскрипции путем измерения светового излучения от ортогональной репортерной люциферазы в люминометре пластинчатые клетки HeLa первоначально в 6- или 12-луночных чашках для трансфекции, но повторно накладывают их после трансфекции (см. шаг 4).
- Если повторная биолюминесцентная стимуляция будет проводиться в камерах визуализации живых клеток, выберите крышки соответствующего размера и поместите их в многоскважинные пластины соответствующего размера (24-луночные пластины для 12-мм облицовочных полос; 12-луночные пластины для 15 мм и 18 мм крышки). Засевайте ячейки поверх обложек, используя номера ячеек, указанные в таблице 2. Если выбранный тип клеток плохо прилипает к поверхности культуры, нанесите клетки на посуду, покрытую PDL.
- Выполняйте трансфекцию путем липофекции в соответствии с рекомендацией производителя или используйте любой метод трансфекции, подходящий для выбранного типа клеток.
ПРИМЕЧАНИЕ: В таблице 3 подробно описаны эксперименты по трансфекции для двух различных фоторецепторов, EL222 и CRY2/CIB, и их соответствующих репортерных плазмид, в дополнение к различным светоизлучающим белкам. Соотношения различных плазмид хорошо работают для выбранных примеров, но должны быть оптимизированы для каждой пары излучатель / датчик света. - После трансфекции поместите клетки в инкубатор, который полностью светонепроницаем (рисунок 1).
- В зависимости от желаемого конечного использования, используйте клетки для стимуляции биолюминесценции на следующий день в их оригинальных лунках / блюдах или повторно накройте их через 3-4 ч после липофекции. Для считывания транскрипции репортерного гена светлячка люциферазы в люминометре повторно обложите клетки белыми 96-луночными пластинами.
ПРИМЕЧАНИЕ: Проводить все манипуляции в светло-герметичном помещении в ламинарной вытяжке, освещенной красным светом (рисунок 2).- Промыть трансфектированные клетки один раз модифицированной средой Dulbecco Eagle (DMEM) или фосфат-буферным физиологическим раствором (PBS).
- Добавьте в скважины минимальный объем трипсинизирующего реагента (24-лунка: 100 мкл; 12-лунка: 150 мкл; 6-лунка: 300 мкл) и инкубируйте клетки в течение 3 мин при 37 °C.
- Добавляют культуральную среду для достижения концентрации клеток, которая даст соответствующую плотность клеток для следующей стадии гальванического покрытия (например, повторное суспендирование клеток в 24-лунке в конечном объеме 1,2 мл для покрытия в 10 скважинах 96-луночной пластины; повторное суспендирование клеток в 12-лунке в конечном объеме 2,4 мл для покрытия в 20 скважинах 96-луночной пластины). Объедините трансфектированные ячейки из нескольких скважин в зависимости от количества скважин, необходимых в конечном итоге.
- Обложите трансфектированные клетки в их окончательном формате и верните пластины в защищенный светом инкубатор.
- Пластинчатые ячейки в форматах и номерах в соответствии с желаемым конечным использованием.
- Активация биолюминесценции in vitro
- Готовят субстрат люциферазы (люциферин).
- Получают 50 мМ запасов, растворяя 5 мг лиофилизированного коэлентеразина (CTZ) в 250 мкл его специфического растворителя. Убедитесь, что все CTZ вдоль стенок флакона растворены путем пипетирования или вихря. Защитите флакон от прямого света.
- Приготовьте 50 мкл аликвот в черных микроцентрифужных трубках объемом 0,5 мл и храните при -80 °C для будущего использования.
ПРИМЕЧАНИЕ: CTZ, растворенный в растворителе, не замерзает при -80°C. Аликвоты могут быть извлечены из морозильной камеры и возвращены в морозильную камеру несколько раз для приготовления рабочих решений при условии, что воздействие света и комнатной температуры сведено к минимуму.
- Единичная биолюминесцентная световая стимуляция
ПРИМЕЧАНИЕ: Все манипуляции проводятся в светонепроницаемом помещении в ламинарной вытяжке, освещенной красным светом (рисунок 2).- Готовят рабочий раствор люциферина в клеточной культуральной среде (DMEM или NeuroBasal). Отрегулируйте концентрацию люциферина таким образом, чтобы конечная концентрация составляла 100 мкМ. Подготовьте все разведения CTZ в среде незадолго до добавления в клетки, так как CTZ окисляется с течением времени.
ПРИМЕЧАНИЕ: Если весь объем среды будет заменен, рабочий раствор составит 100 мкМ. Если к клеткам добавить люциферинсодержащую среду, концентрация будет выше на коэффициент разбавления (например, добавление 50 мкл среды, содержащей 300 мкМ люциферина, к 100 мкл среды в скважине приведет к разбавлению 1:3 и, таким образом, к конечной концентрации люциферина 100 мкМ). - Добавьте к клеткам среду, содержащую люциферин, и инкубируйте в течение желаемой продолжительности световой стимуляции.
ПРИМЕЧАНИЕ: Это может быть до 1 минуты или до 15 минут и может быть еще короче или длиннее. Продолжительность времени выхода люциферинсодержащей среды на клетки зависит от периода полураспада и кинетики выбранной комбинации люцифераза-люциферин. - Мониторинг светового излучения при конечной концентрации люциферина 100 мкМ на глаз после выключения красного света; подождите несколько секунд, пока глаза не приспособятся к полной темноте. Документируйте световое излучение, делая фотографию (даже с помощью мобильного телефона).
- Прекратите световую стимуляцию, удалив люциферинсодержащую среду и заменив ее питательной средой. В зависимости от чувствительности экспериментов промывайте клетки питательной средой один или два раза после удаления люциферинсодержащей среды, чтобы устранить весь люциферин. Если клетки плохо прилипают к поверхности культуры, нанесите их на посуду, покрытую PDL, чтобы избежать потери клеток во время промывки.
- Верните клетки в светозащитный инкубатор на 16-24 ч.
- Готовят рабочий раствор люциферина в клеточной культуральной среде (DMEM или NeuroBasal). Отрегулируйте концентрацию люциферина таким образом, чтобы конечная концентрация составляла 100 мкМ. Подготовьте все разведения CTZ в среде незадолго до добавления в клетки, так как CTZ окисляется с течением времени.
- Повторная биолюминесцентная световая стимуляция
ПРИМЕЧАНИЕ: Все манипуляции проводятся в помещении, которое можно сделать светонепроницаемым и освещать красным светом.- Настройте камеру визуализации живых клеток. Создайте светонепроницаемый отсек вокруг микроскопа визуализации живых клеток, используя коробку и черные пластиковые листы или черные шторы (рисунок 3). Охватите все источники света, присутствующие внутри светонепроницаемого отсека и комнаты (например, светодиодные индикаторы на микроскопе или приборах).
- Настройте перфузионную систему с желаемым раствором для забора и выходом камеры, ведущей к контейнеру для отходов.
ПРИМЕЧАНИЕ: Например, раствор для визуализации может представлять собой раствор Тирода (хлорид натрия (124 мМ), хлорид калия (3 мМ), HEPES (10 мМ), дигидрат хлорида кальция (2 мМ), гексагидрат хлорида магния (1 мМ), D-глюкоза (20 мМ)). - Подготовьте рабочий раствор люциферина в растворе для визуализации. Аликвота в столько же микроцентрифужных трубок, сколько и количество повторных стимуляций. Отрегулируйте концентрацию люциферина таким образом, чтобы конечная концентрация в камере визуализации составляла 100 мкМ.
- Поместите в камеру крышку с трансфектированными клетками.
- Поддерживая работу насоса, снимите впускную трубку насоса с впускного стакана и быстро погрузите ее в раствор люциферина, сохраняя время перехода как можно короче, чтобы избежать любой воздушной пустоты в трубке.
- Как только раствор люциферина будет принят, поместите входную трубку обратно в всасывающий стакан. Повторяйте этот процесс столько раз, сколько необходимо, и с интервалом от нескольких минут до часов, в зависимости от физиологического паттерна, которому должны подвергаться клетки.
- Верните клетки в светозащитный инкубатор на 16-24 ч для транскрипции или на время оценки эффекта световой стимуляции.
- Готовят субстрат люциферазы (люциферин).
2. Активация биолюминесценции фотосенсорных белков in vivo
- Конструкции
- Выберите последовательность люциферазы или последовательность слияния люциферазы-флуоресцентного белка, которая приведет к экспрессии излучателя света, производящего свет длины волны, соответствующей активируемому фоторецептору.
- Используйте стандартные методы молекулярной биологии для клонирования ДНК в плазмиду pAAV, если она еще не доступна у других исследователей или плазмидных отложений.
- Выбирайте сильные промоутеры для выражения светоизлучающих модулей, таких как CAG или CMV.
- Использовать стандартные подходы к получению высокотитерных вирусных запасов6 или иметь вирусные векторы коммерчески подготовленными.
- Для первоначальных исследований используйте отдельные вирусные векторы для совместной трансдукции светоизлучателя и датчика освещенности, чтобы при необходимости можно было регулировать соотношения различных компонентов.
- Трансдукция AAV
- Вводят в орган-мишень подопытного животного вирусные векторы светоизлучателя, датчика света и репортера, аналогичные соотношениям концентраций, используемым для трансфекции in vitro (таблица 3).
- Верните животных в их домашние клетки на срок не менее 2 недель, чтобы обеспечить максимальное выражение всех компонентов.
ПРИМЕЧАНИЕ: Если орган-мишень находится внутри тела и защищен от окружающего света, животные могут быть размещены в нормальных условиях освещения.
- Активация биолюминесценции in vivo
- Готовят субстрат люциферазы (люциферин).
- Достаньте флакон водорастворимого CTZ из морозильной камеры -80 °C и дайте ему нагреться до комнатной температуры. Держите его защищенным от света.
- На флакон 500 мкг добавьте 250 мкл стерильной воды, используя либо шприц, либо открыв флакон и добавив воду пипеткой, а затем положив резиновую пробку обратно на стеклянный флакон.
- Инкубируйте восстановленный стеклянный флакон на водяной бане при температуре 55 °C в течение нескольких минут, чтобы полностью растворить порошок.
- Переложите раствор в черную микроцентрифужную трубку. Промойте стенки стеклянного флакона, чтобы извлечь все CTZ.
- Удалите количество раствора, необходимое в течение дня. Хранить оставшийся раствор при 4 °C для использования на следующий день. Не замерзайте!
- Выполнить те же действия (пункты 2.3.1.1.-2.3.1.5) в отношении флакона транспортного средства.
- Биолюминесцентная световая стимуляция
- Удалите объем люциферина/транспортного средства, необходимый для размера животного и выбранного маршрута применения (таблица 4).
- Вводите животным люциферин или транспортное средство. Повторите биолюминесцентную световую стимуляцию в соответствии с экспериментальным дизайном. Например, если активация рекомбиназы желательна во время определенной поведенческой парадигмы, вводите животным непосредственно перед поведенческим тестированием. Если целью является фазовая транскрипция молекулы, вводите животным несколько раз в течение нескольких дней.
- Соберите данные от животных, стимулируемых биолюминесценцией, как это было задумано.
- Готовят субстрат люциферазы (люциферин).
Результаты
Существует множество внутриклеточных событий, которыми можно манипулировать с помощью исполнительных механизмов, реагирующих на свет, и которые поддаются бимодальной активации с помощью физических и биологических источников света. Ниже приведены примеры использования интегратора фотосенсора кальция (Ca2+), светоиндуцированной белковой транслокации, светочувствительного транскрипционного фактора и светочувствительной рекомбиназы. Примеры иллюстрируют целесообразность использования биолюминесценции для активации различных видов фоторецепторов. Представленные эксперименты не были специально оптимизированы в отношении применения светодиодов (LED), выбранной люциферазы или в отношении концентраций и сроков применения люциферина.
Быстрая свето- и активность-регулируемая экспрессия (FLARE) представляет собой оптогенетическую систему, которая позволяет транскрипцию репортерного гена с сопутствующим возникновением повышенного внутриклеточного Ca2+ и light23 (рисунок 4A). Присутствие Ca2+ требуется для того, чтобы привести протеазу в непосредственной близости к месту расщепления протеазы, доступному только при световой стимуляции, что приводит к высвобождению транскрипционного фактора. Клетки HEK293 были совместно трансфектированы оригинальными компонентами FLARE, двойной конструкцией репортера Firefly (FLuc)-dTomato и мембранным вариантом люциферазы Gaussia sbGLuc6. При наличии повышенного внутриклеточного Ca2+ за счет воздействия на клетки 2 мкМ иономицина и 5 мМ хлорида кальция (CaCl2) применение синего светодиода приводило к надежной экспрессии флуоресцентного репортера по сравнению с клетками, оставленными в темноте, а также к экспрессии FLuc, определяемой измерением люминесценции при добавлении субстрата FLuc, D-люциферин. Аналогичные уровни экспрессии FLuc были достигнуты при биолюминесценции, испускаемой sbGLuc при применении субстрата sbGLuc (CTZ) вместе с иономицином и CaCl2. Обратите внимание, что люциферазы, используемые для активации света (sbGLuc) и для сообщения об эффекте световой активации (транскрипция FLuc), производят свет только с их соответствующими люциферинами (CTZ против D-люциферина) и не реагируют перекрестно.
Различные компоненты были объединены для создания светоиндуцированной системы транскрипции, основанной на гетеродимеризации криптохромов23,24 (рисунок 4B). CRY2 был слит с протеазой, в то время как связанный с мембраной CIB был слит с местом расщепления протеазы и фактором транскрипции. Светоиндуцированная транслокация белка высвобождала фактор транскрипции, что приводило к экспрессии FLuc и dTomato, как показано на рисунке 4A. В то время как присутствие одного только компонента транскрипционного фактора приводило к значительному фоновому сигналу, возможно, из-за спонтанного протеолиза, как физический свет (LED), так и биолюминесценция (CTZ) надежно увеличивали экспрессию FLuc, измеренную в системе визуализации in vivo (IVIS).
В другой серии экспериментов NanoLuc (люциферин: фуримазин или hCTZ) использовался для оптогенетической регуляции транскрипции посредством димеризации CRY/CIB и фоточувствительного фактора транскрипции EL22225,26,27. На рисунке 5A,B показаны схемы различных компонентов в темном и светлом состояниях и люциферазы, котрансфедированной или слитой с датчиком освещенности. Различные сравнения показаны на рисунке 5C. Биолюминесценция, индуцированная добавлением hCTZ к клеткам HEK293, экспрессирующим конструкции и удаляющим их через 15 минут, была более эффективной в управлении репортерной транскрипцией, чем 20 минут воздействия светодиодного света как для CRY / CIB, так и для EL222. Для CRY/CIB часа воздействия светодиодов было достаточно, чтобы достичь уровня транскрипции, сопоставимого с 15 мин биолюминесценции. Напротив, для EL222 даже 60 минут светодиодов были едва ли вдвое менее эффективными, чем кратковременное воздействие биолюминесценции. Не было никаких существенных различий в эффективности транскрипции между двумя системами при котрансфекции, хотя белки слияния CRY / CIB были более эффективными, чем белки EL222. Для обеих систем слияние белков привело к значительно более высоким уровням транскрипции, чем котрансфектные компоненты. CRY/CIB показали стабильно более высокие фоновые уровни при применении транспортного средства по сравнению с EL222, который имел незначительную фоновую транскрипцию. Увеличение концентрации hCTZ само по себе не влияло на транскрипцию репортерного гена.
Фотоактивируемые рекомбиназы являются универсальным инструментом для оптогеномных манипуляций. Мы протестировали активацию биолюминесценции фоточувствительной расщепленной рекомбиназы Cre на основе белка Vivid LOV, iCreV28. На рисунке 6A показана схема различных компонентов, sbGLuc, iCreV и флуоресцентного репортера lox-stop-lox (tdTomato) до и после применения CTZ. Результаты применения CTZ относительно элементов управления (без CTZ или LED) показаны на рисунке 6B. Есть некоторое фоновое выражение даже в темноте (без CTZ); однако в присутствии CTZ экспрессия надежно увеличивается на заднем плане и аналогична той, которая индуцируется при применении светодиодов.

Рисунок 1: Легкий герметичный инкубатор. Створка картонной коробки, закрывающая свет от подсвеченной панели управления (стрелка вверху). Светонепроницаемая крышка над стеклянной дверцей инкубатора (нижняя стрелка) для защиты клеток от воздействия света. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Ламинарный вытяжка, освещенная красным светом. Установка, показывающая стандартный ламинарный вытяжной колпак для культивирования тканей, освещаемый красным светом. Стрелка указывает на стандартную настольную лампу с красной лампой. Все манипуляции при красном свете проводятся в темном светло-плотном помещении. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Светонепроницаемые отсеки вокруг микроскопов визуализации живых клеток. Два примера настроек микроскопа визуализации живых клеток, показывающих использование либо твердой коробки с пластиковыми шторами только на передней стороне (левые панели: верхняя и нижняя), либо черных штор по всей установке визуализации (правые панели: верхняя и нижняя). Лицевые стороны в обоих примерах остаются открытыми и свернутыми, когда они не используются (верхние панели: левая и правая). Передние черные шторы скатываются вниз, чтобы предотвратить попадание света в комнату (например, экраны компьютеров) в область визуализации при выполнении стимуляции биолюминесценции живых клеток и / или визуализации (нижние панели: левая и правая). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
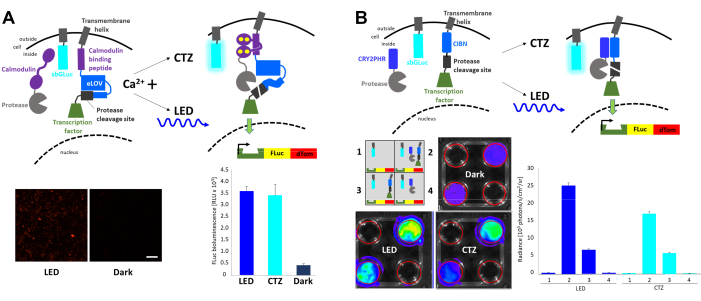
Рисунок 4: Биолюминесценция для интеграции внутриклеточных сигнальных событий. (A) Схемы компонентов FLARE, совместно трансфектированных sbGLuc. В присутствии Ca2+ и результирующей близости протеазы к месту расщепления протеазы либо биолюминесценция, либо светодиод приведет к развертыванию LOV, воздействию места расщепления и высвобождению фактора транскрипции. Ячейки подвергались воздействию светодиода (рабочий цикл 33%, 2 с вкл/4 с выключения в течение 40 мин; световая мощность 3,5 мВт, излучение 4,72 мВт/см2 ) или биолюминесценции (конечная концентрация КТЗ 100 мкМ в течение 15 мин) или оставляли в темноте. Микроскопические изображения клеток HEK293, экспрессирующих вышеуказанные компоненты после лечения для повышения уровня Ca2+ и воздействия светодиода (слева). Люминесценция FLuc измеряется в люминометре, сравнивающем воздействие светодиода, биолюминесценции (CTZ) или слева в темноте (справа). (B) Схемы не-Ca2+-зависимой системы транскрипции, котрансфектированной sbGLuc. Ячейки HEK293 в 4-луночных пластинах были трансфектированы четырьмя различными расположениями компонентов, как показано на схеме. Пластины подвергались воздействию либо светодиода (рабочий цикл 33%, 2 с включения/4 с выключения в течение 40 мин; световая мощность 3,5 мВт, излучение 4,72 мВт/см2 ), либо биолюминесценции (конечная концентрация КТЗ 100 мкМ) путем добавления КТЗ и оставления его включенным в течение 15 мин; контрольные пластины были оставлены в темноте. Транскрипция репортера FLuc была измерена в IVIS. Слева показаны изображения репрезентативных блюд IVIS; Измерения сияния от нескольких реплик с базовой линией до темных элементов управления показаны справа. Шкала шкалы = 100 мкм. Сокращения: FLARE = Экспрессия, регулируемая быстрым светом и активностью; LOV = свет-кислород-напряжение-сенсибилизация; LED = светодиод; CTZ = коэлентеразин; FLuc = люцифераза светлячка; dTom = dTomato; CRY2 = криптохром 2; CRY2PHR = область гомологии фотолиаза CRY2; CIB1 = Ca2+- и интегрин-связывающий белок 1; CIBN = N-конечная точка CIB1; IVIS = система визуализации in vivo . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
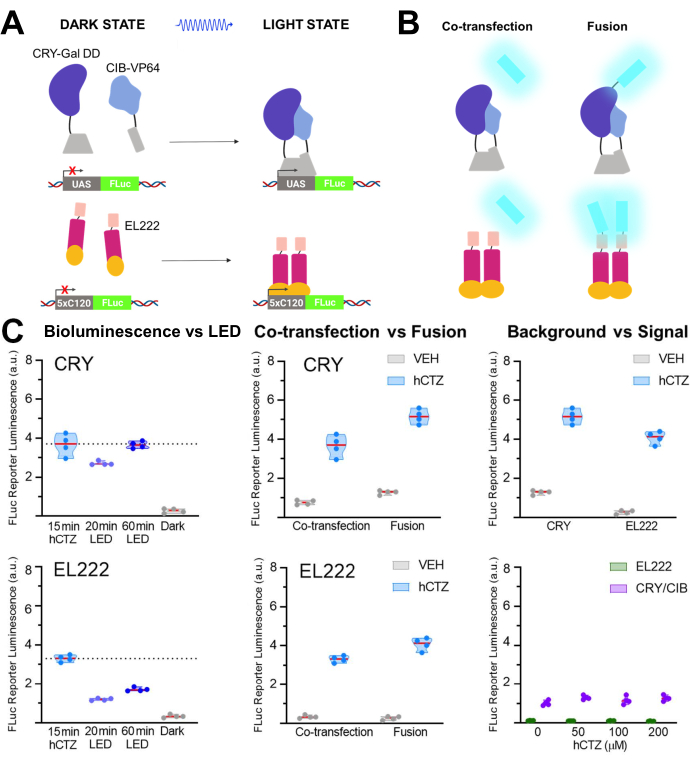
Рисунок 5: Биолюминесценция для управления транскрипцией. (A) Схемы двух фотоактивируемых систем транскрипции в их темном и светлом состояниях. (B) NanoLuc был либо котрансфектирован, либо слит со светочувствительными фрагментами, как показано на рисунке (N-NanoLuc-CRY-GalDD-C; N-NanoLuc-VP16-EL222-C). (C) Сопоставления с использованием обеих систем в отношении источников света, конструкции конструкции и сигнала к шуму. Клетки подвергались воздействию светодиода (рабочий цикл 33%, 2 с в/4 с выключения в течение 40 мин; световой мощности 3,5 мВт, излучение 4,72 мВт/см2 ) или биолюминесценции в течение 15 мин (конечная концентрация 100 мкМ hCTZ; за исключением случаев, когда отмечаются различные концентрации). Темные пластины оставались нетронутыми в инкубаторе между начальным преобразованием плазмид и измерением FLuc; VEH, номерные знаки обрабатывались так же, как и те, которые получали hCTZ, но вместо этого получали транспортное средство. Различия в уровнях транскрипции: hCTZ, котрансфектный CRY против EL222 - незначителен; hCTZ, люцифераза - слияние фотопротеинов CRY и EL222 - p < 0,005; hCTZ, КРИ котрансфекция vs. слияние - p < 0,005; hCTZ, EL222 совместная трансфекция vs. синтез - p < 0,01; автомобиль, CRY vs. EL222 - p < 0.05. Сокращения: UAS = восходящая последовательность активации; LED = светодиод; CTZ = коэлентеразин; FLuc = люцифераза светлячка; CRY = криптохром; CIB = Ca2+- и интегрин-связывающий белок; VEH = транспортное средство. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
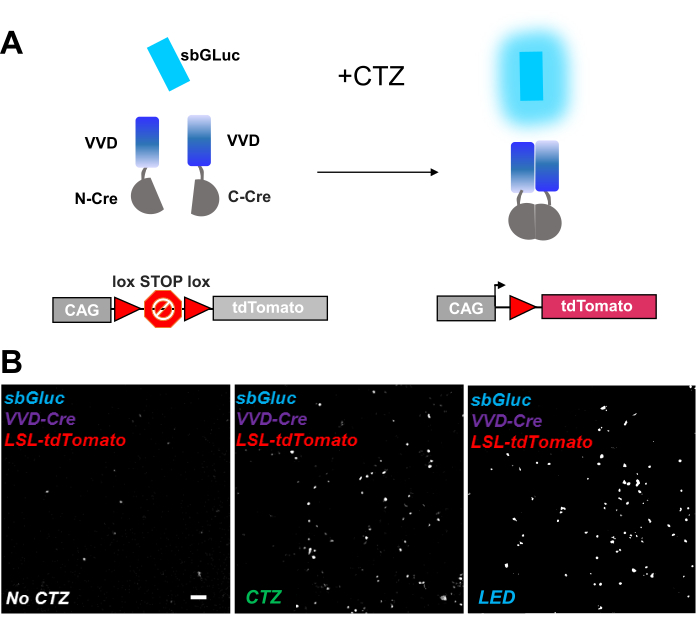
Рисунок 6: Биолюминесценция для оптогеномных манипуляций. (A) Схемы биолюминесцентных оптогеномных манипуляций с использованием sbGLuc, разделенных компонентов iCreV и репортерной кассеты LSL до и после применения света. (B) Клетки HEK293 были липо инфицированы плазмидами, а затем содержались в темноте. Двадцать четыре часа спустя клетки обрабатывали в течение 30 мин только средой (без CTZ) или CTZ (конечная концентрация 100 мкМ) или светодиодом (рабочий цикл 25%, 5 с в/15 с выключение в течение 5 мин; световая мощность 14,81 мВт, излучение 20 мВт/см2 ) в качестве положительного контроля. Микроскопические изображения флуоресценции tdTomato с использованием указанных условий. Шкала шкалы = 100 мкм. Сокращения: LSL = lox-stop-lox; CTZ = коэлентеразин; LED = светодиод; VVD = Яркий. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Биолюминесцентная активация фоторецепторов. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Руководство по нанесению покрытий и трансфекции ячеек в различных форматах. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 3: Соотношения различных плазмид для трансфекции. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 4: Пути инъекции, объемы и концентрации люциферина для применения in vivo (25 г мыши). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Существует ряд люцифераз и люциферинов с длинами волн светового излучения, соответствующими спектрам активации фотосенсорных белков от синего до красного света14,29. Помимо выравнивания длин волн излучения и возбуждения, нет надежного способа определить априори, какое сопряжение будет работать лучше всего. Таким образом, необходимо экспериментально определить, как работают пары люциферин-люцифераза в клетках и организмах при управлении фотосенсорными системами.
Протоколы, изложенные в этой презентации, описывают, как готовить люциферин и как применять его in vitro и in vivo, а также руководящие принципы по созданию комнат, вытяжек для культивирования тканей, инкубаторов и микроскопов для экспериментов с использованием биолюминесценции. В репрезентативных экспериментах использовались различные люциферазы (NanoLuc, Gaussia luciferase) с несколькими фотосенсорными белками (CRY/CIB, EL222, VVD, LOV), демонстрирующие эффекты биолюминесценции по сравнению с физическим светом, котрансфекции по сравнению с белками слияния, сравнения сигнал-шум и различные анализы считывания. Более широкое применение биолюминесцентных активирующих фотосенсорных белков описано в публикациях из нескольких групп, нацеленных на индукцию гибели клеток, синтез цАМФ и движение белка в дополнение к транскрипции (таблица 1).
Простое совместное трансфектирование светоизлучающих и светочувствительных компонентов является хорошим началом. Переменными являются молярные соотношения излучателя и датчика; Неизвестными являются фоновые уровни активности датчиков в темноте, активность датчиков по отношению к интенсивности и продолжительности света, а также эффективность активации датчика при сравнении физического и биологического света. В то время как конструкции синтеза имеют преимущество в том, что они сохраняют молярное соотношение излучателя и датчика на уровне 1:1 и приближают излучатель света к области светочувствительного, в игру вступают другие соображения, такие как где привязать (N- или C-конец) и как связать (длина и состав линкера), не влияя на производительность фотосенсорного привода.
Для экспериментов как in vitro , так и in vivo существует несколько вариантов настройки биолюминесцентного излучения света, либо путем изменения концентрации люциферина, либо путем изменения времени, в течение которого люциферин становится доступным для соответствующего датчика. Минимальное количество и время определяются наличием или отсутствием эффекта, ожидаемого при световой активации. Напротив, соответствующие максимумы в основном определяются толерантностью клеток к высоким концентрациям люциферина в течение длительного времени. Концентрация CTZ, выбранная в приведенных выше примерах, 100 мкМ, близка к верхнему пределу для различных типов клеток, от клеток HEK293 до нейронов. Цель состоит в том, чтобы использовать как можно более низкую концентрацию в течение кратчайшего времени для достижения активации целевого фотозона. Это будет достигнуто более легко с помощью люцифераз с высоким световым излучением и фоторецепторов с высокой светочувствительностью.
Биолюминесценция для управления фоторецепторами использовалась у грызунов (мышей, крыс) с фотосенсорными белками, экспрессируемыми в печени, мышцах, спинном мозге и головном мозге, а также через фоторецептор-экспрессирующие клетки, пересаженные подкожно или внутрибрюшинно. В принципе, нет никаких ограничений, препятствующих применению этого подхода к различным видам, от нечеловеческих приматов до рыб или мух. В зависимости от проницаемости организма для люциферина, применение может быть таким же простым, как нанесение люциферина в окружающую воду (например, в личинках рыб30). Перед использованием BL-OG в любом новом организме необходимо провести пилотные эксперименты, чтобы убедиться, что люциферин достигает своих целей по выбранному маршруту применения.
Критическими аспектами экспериментального проектирования являются различные элементы управления, которые важны для интерпретации результатов. Клетки, экспрессирующие репортер, управляемый люциферазой, действующей на фотосенсорный белок, следует сравнивать с клетками, в которых отсутствует люцифераза или отсутствует фотосенсорный белок. Кроме того, следует проводить сравнения между клетками, подвергшимися воздействию люциферина, транспортным средством или содержащимися в темноте. Также важно осознать ограничения различных анализов для оценки эффектов активации фоторецепторов, управляемых биолюминесценцией. Например, эффективность биолюминесцентно-активированной транскрипции может быть проверена различными способами, в зависимости от того, является ли ген-репортер ортогональной люциферазой (люминометр, IVIS) или флуоресцентным белком (флуоресцентно-активированная сортировка клеток, анализ изображений микроскопии). Хотя основные эффекты должны быть воспроизводимыми на всех платформах тестирования, количественные аспекты эффектов могут значительно различаться.
До настоящего времени была продемонстрирована активация биолюминесценции фоторецепторов для ограниченного числа люцифераз и фотосенсорных белков, соответственно, как in vitro , так и in vivo. Он может быть распространен на большой класс фоторецепторов для активации многих других биологических процессов. Такому расширению подхода способствует непрерывная разработка новых люцифераз и люциферазно-флуоресцентных белковых пар с гораздо более высоким световым излучением, чем естественные люциферазы, и с кинетическими особенностями, настраиваемыми для различных применений. Эти достижения параллельны генерации новых люциферинов, что еще больше увеличивает яркость и цветовые палитры29. Эта инструментальная платформа предлагает приложения для манипулирования и исследования внутриклеточной динамики и клеточных взаимодействий внутри живых клеток, тканей и организмов.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим наших коллег за конструкции, в частности, А. Тинга за протеазу Ca-FLARE, транскрипционный фактор и репортер (Addgene # 92214, 92213, 92202), Х. Квона для TM-CIBN-BLITz1-TetR-VP16 и NES-CRY2PHR-TevC (Addgene # 89878, 89877), C. Tucker для CRY-GalΔDD (B1013) и CIB-VP64 (B1016) (Addgene # 92035, 92037), М. Уолша для pGL2-GAL4-UAS-Luc (Addgene #33020), К. Гарднера за VP-EL222 и C120-Fluc, а также А. Цетина и Х. Зенга за то, что они сделали iCreV доступным перед публикацией. Эта работа была поддержана грантами NSF (NeuroNex 1707352), NIH (U01NS099709), Фонда W.M. Keck и Шведского исследовательского совета A.B. (2016-06760).
Материалы
| Name | Company | Catalog Number | Comments |
| ABI 25W Deep Red 660 nm LED Light Bulb | Amazon | to be used with any lamp stand | |
| Black Microcentrifuge Tubes, 0.5 mL, Argos Technologies | Fisher Scientific | 03-391-166 | |
| Black Microcentrifuge Tubes, 1.5 mL, Argos Technologies | Fisher Scientific | 03-391-161 | |
| Black Nylon, Polyurethane-Coated Fabric (1.5 m x 2.7 m) x 0.12 mm (thick) | THOR LABS | BK-5 | |
| C120-Fluc | K. Gardner | ||
| CaCl2 | Sigma | C8106; CAS: 10035-04-8 | |
| Ca-FLARE protease, transcription factor and reporter | Addgene # 92214, 92213, 92202 | A. Ting | |
| CIB-VP64 (B1016) | Addgene # 92037 | C. Tucker | |
| CRY-GalΔDD (B1013) | Addgene # 92035 | C. Tucker | |
| CTZ | Prolume Inc. (NanoLight) | 303 | formulation for in vitro applications with Gaussia luciferases |
| CTZ (Water soluble native coelenterazine) | Prolume Inc. (NanoLight) | 3031 | formulation for in vivo applications with Gaussia luciferases |
| D-(+)-Glucose | Sigma | G8270; CAS: 50-99-7 | |
| D-Luciferin, Potassium Salt | Gold Biotechnology | LUCK | |
| DMEM | Thermo Fisher | 11960044 | |
| D-PBS, no calcium, no magnesium | Thermo Fisher | 14190144 | |
| hCTZ | Prolume Inc. (NanoLight) | 301 | formulation for in vitro applications with Oplophorus luciferases |
| HEK293 | ATCC | CRL-1573 | |
| HeLa | ATCC | CCL-2 | |
| HEPES | Sigma | H3375; CAS: 7365-45-9 | |
| iCreV | A. Cetin and H. Zeng | ||
| In Vivo Imaging System (IVIS) | Perkin-Elmer | Lumina LT | |
| KCl | Sigma | P5405; CAS: 7447-40-7 | |
| LED Array Driver | Amuza | LAD-1 | |
| LED Array for Multiwell Plates | Amuza | LEDA-x | |
| Lipofectamine 2000 Reagent | Invitrogen | 11668-019 | Transfection reagent |
| Luminometer | Molecular Devices | SpectraMax L | |
| MgCl2 Hexahydrate | Sigma | M2670; CAS: 7791-18-6 | |
| NaCl | Sigma | S7653; CAS: 7647-14-5 | |
| NanoFuel Solvent | Prolume Inc. (NanoLight) | 399 | for dissolving CTZ preparations for in vitro use |
| NaOH | Sigma | 221465; CAS: 1310-73-2 | |
| NES-CRY2PHR-TevC | Addgene # 89877 | H. Kwon | |
| Opti-MEM | Thermo Fisher | 11058021 | transfection medium |
| PDL coated coverslips (12 mm, 15 mm, 18 mm) | Neuvitro Corporation | GG-12-PDL, GG-15-PDL , GG-18-PDL | |
| pGL2-GAL4-UAS-Luc | Addgene #33020 | M. Walsh | |
| Prizmatix USB Pulser TTL Generator for Optogenetics | Goldstone Scientific | ||
| TM-CIBN-BLITz1-TetR-VP16 | Addgene # 89878 | H. Kwon | |
| TrypLE Express | Gibco | 12604-013 | |
| Vehicle (Water-soluble carrier without CTZ) | Prolume Inc. (NanoLight) | 3031C | control for in vivo applications with CTZ |
| VP-EL222 | K. Gardner |
Ссылки
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Wang, Y., et al. Photostimulation by femtosecond laser triggers restorable fragmentation in single mitochondrion. Journal of Biophotonics. 10 (2), 286-293 (2017).
- Li, T., et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nature Communications. 12 (1), 615 (2021).
- Berglund, K., Birkner, E., Augustine, G. J., Hochgeschwender, U. Light-emitting channelrhodopsins for combined optogenetic and chemical-genetic control of neurons. PLoS One. 8 (3), 59759 (2013).
- Tung, J. K., Gutekunst, C. -. A., Gross, R. E. Inhibitory luminopsins: genetically-encoded bioluminescent opsins for versatile, scalable, and hardware-independent optogenetic inhibition. Scientific Reports. 5, 14366 (2015).
- Berglund, K., et al. Luminopsins integrate opto- and chemogenetics by using physical and biological light sources for opsin activation. Proceedings of the National Academy of Sciences of the United States of America. 113 (3), 358-367 (2016).
- Gomez-Ramirez, M., More, A. I., Friedman, N. G., Hochgeschwender, U., Moore, C. I. The BioLuminescent-OptoGenetic in vivo response to coelenterazine is proportional, sensitive and specific in neocortex. Journal of Neuroscience Research. 98 (3), 471-480 (2020).
- Moore, C. I., Berglund, K. BL-OG: BioLuminescent-OptoGenetics. Journal of Neuroscience Research. 98 (3), 469-470 (2020).
- Park, S. Y., et al. Novel luciferase-opsin combinations for improved luminopsins. Journal of Neuroscience Research. 98 (3), 410-421 (2020).
- Jaiswal, P. B., Tung, J. K., Gross, R. E., English, A. W. Motoneuron activity is required for enhancements in functional recovery after peripheral nerve injury in exercised female mice. Journal of Neuroscience Research. 98 (3), 448-457 (2020).
- Zenchak, J. R., et al. Bioluminescence-driven optogenetic activation of transplanted neural precursor cells improves motor deficits in a Parkinson's disease mouse model. Journal of Neuroscience Research. 98 (3), 458-468 (2020).
- Tung, J. K., Shiu, F. H., Ding, K., Gross, R. E. Chemically activated luminopsins allow optogenetic inhibition of distributed nodes in an epileptic network for non-invasive and multi-site suppression of seizure activity. Neurobiology of Disease. 109, 1-10 (2018).
- Hegemann, P. Algal sensory photoreceptors. Annual Review of Plant Biology. 59, 167-189 (2008).
- Losi, A., Gardner, K. H., Moglich, A. Blue-light receptors for optogenetics. Chemical Reviews. 118 (21), 10659-10709 (2018).
- Proshkina, G. M., Shramova, E. I., Shilova, O. N., Ryabova, A. V., Deyev, S. M. Phototoxicity of flavoprotein miniSOG induced by bioluminescence resonance energy transfer in genetically encoded system NanoLuc-miniSOG is comparable with its LED-excited phototoxicity. Journal of Photochemistry and Photobiology B: Biology. 188, 107-115 (2018).
- Kawano, F., Okazaki, R., Yazawa, M., Sato, M. A photoactivatable Cre-loxP recombination system for optogenetic genome engineering. Nature Chemical Biology. 12 (12), 1059-1064 (2016).
- Shramova, E. I., Proshkina, G. M., Chumakov, S. P., Khodarovich, Y. M., Deyev, S. M. Flavoprotein miniSOG cytotoxisity can be induced by bioluminescence resonance energy transfer. Acta Naturae. 8 (4), 118-123 (2016).
- Naim, N., et al. Luminescence-activated nucleotide cyclase regulates spatial and temporal cAMP synthesis. Journal of Biological Chemistry. 294 (4), 1095-1103 (2019).
- Kim, C. K., Cho, K. F., Kim, M. W., Ting, A. Y. Luciferase-LOV BRET enables versatile and specific transcriptional readout of cellular protein-protein interactions. Elife. 8, 43826 (2019).
- Parag-Sharma, K., et al. Engineered BRET-based biologic light sources enable spatiotemporal control over diverse optogenetic systems. ACS Synthetic Biology. 9 (1), 1-9 (2020).
- Kim, E. H., et al. Self-luminescent photodynamic therapy using breast cancer targeted proteins. Science Advances. 6 (37), (2020).
- Kim, C. K., et al. A Molecular calcium integrator reveals a striatal cell type driving aversion. Cell. 183 (7), 2003-2019 (2020).
- Wang, W., et al. A light- and calcium-gated transcription factor for imaging and manipulating activated neurons. Nature Biotechnology. 35 (9), 864-871 (2017).
- Lee, D., Hyun, J. H., Jung, K., Hannan, P., Kwon, H. -. B. A calcium- and light-gated switch to induce gene expression in activated neurons. Nature Biotechnology. 35 (9), 858-863 (2017).
- Pathak, G. P., et al. Bidirectional approaches for optogenetic regulation of gene expression in mammalian cells using Arabidopsis cryptochrome 2. Nucleic Acids Research. 45 (20), 167 (2017).
- Nishio, H., Walsh, M. J. CCAAT displacement protein/cut homolog recruits G9a histone lysine methyltransferase to repress transcription. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11257-11262 (2004).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Yao, S., et al. RecV recombinase system for in vivo targeted optogenomic modifications of single cells or cell populations. Nature Methods. 17 (4), 422-429 (2020).
- Love, A. C., Prescher, J. A. Seeing (and using) the light: Recent developments in bioluminescence technology. Cell Chemical Biology. 27 (8), 904-920 (2020).
- Naumann, E. A., Kampff, A. R., Prober, D. A., Schier, A. F., Engert, F. Monitoring neural activity with bioluminescence during natural behavior. Nature Neuroscience. 13 (4), 513-520 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены