Method Article
Biolumineszente Optogenetik 2.0: Nutzung der Biolumineszenz zur Aktivierung photosensorischer Proteine in vitro und in vivo
In diesem Artikel
Zusammenfassung
Biolumineszenz-Licht, das von einem Luciferase-Enzym emittiert wird, das ein niedermolekulares Substrat, ein Luciferin, oxidiert, kann genutzt werden, um photosensorische Proteine zu aktivieren, wodurch der Lichtstimulation eine weitere Dimension hinzugefügt und die Manipulation einer Vielzahl von lichtvermittelten Funktionen in Zellen über zeitliche und räumliche Skalen hinweg ermöglicht wird.
Zusammenfassung
Biolumineszenz - Licht, das von einem Luciferase-Enzym emittiert wird, das ein niedermolekulares Substrat, ein Luciferin, oxidiert, wurde in vitro und in vivo verwendet, um lichtgesteuerte Ionenkanäle und Pumpen in Neuronen zu aktivieren. Während dieser biolumineszente optogenetische (BL-OG) Ansatz den optogenetischen Werkzeugen eine chemogenetische Komponente verleiht, ist er nicht auf den Einsatz in den Neurowissenschaften beschränkt. Vielmehr kann die Biolumineszenz genutzt werden, um jedes photosensorische Protein zu aktivieren und so die Manipulation einer Vielzahl von lichtvermittelten Funktionen in Zellen zu ermöglichen. Eine Vielzahl von Luciferase-Luciferin-Paaren kann mit photosensorischen Proteinen kombiniert werden, die unterschiedliche Wellenlängen von Licht und Lichtintensitäten erfordern.
Abhängig von der spezifischen Anwendung kann eine effiziente Lichtabgabe durch den Einsatz von Luciferase-Photorezeptor-Fusionsproteinen oder durch einfache Co-Transfektion erreicht werden. Photosensorische Proteine, die auf lichtabhängiger Dimerisierung oder Konformationsänderungen basieren, können durch Biolumineszenz angetrieben werden, um zelluläre Prozesse von der Proteinlokalisierung über die Regulation intrazellulärer Signalwege bis hin zur Transkription zu beeinflussen. Das folgende Protokoll beschreibt die experimentelle Durchführung der Biolumineszenzaktivierung in Zellen und Organismen und beschreibt die Ergebnisse unter Verwendung von Biolumineszenz-gesteuerten Rekombinasen und Transkriptionsfaktoren. Das Protokoll bietet den Forschern die grundlegenden Verfahren zur Durchführung der biolumineszenten Optogenetik in vitro und in vivo. Die beschriebenen Ansätze können weiter erweitert und auf eine Vielzahl unterschiedlicher experimenteller Paradigmen individualisiert werden.
Einleitung
Photosensorische Proteine können durch Licht entweder von einer physikalischen Lichtquelle oder von einem Luciferase-Enzym in Gegenwart seines Substrats, Luciferin, aktiviert werden, um Biolumineszenz zu erzeugen. Für Anwendungen, die Millisekunden- oder sogar Femtosekunden-Zeitskalen und/oder eine räumliche Einzelzellauflösung erfordern, sind physikalische Lichtquellen (Laser und Leuchtdioden (LEDs)) die einzigen, die auf diese Skalen abgestimmt werden können. Beispiele sind die räumliche Beschränkung des Lichts, die zur Stimulation entgegengesetzter Pole bei der Entwicklung von Drosophila-Larven mit Millisekunden-Zeitkontrolle1 verwendet wird, oder die präzise Stimulation einzelner subzellulärer Strukturen wie mitochondrialer Tubuli2. Viele andere Anwendungen für optische Schalter haben jedoch andere Prioritäten, einschließlich erweiterter räumlicher Kontrolle und wiederholter Anwendung nicht-invasiv und ohne Lichtschädigung, aber mit definierter zeitlicher Kontrolle in winzigen Zeitskalen und abstimmbaren Intensitäten. Hier hat die Verwendung von Luciferasen als alternative Lichtquelle zur Aktivierung von Lichtsensordomänen mehrere Vorteile. Im Gegensatz zur Lichtaktivierung von Glasfasern erreicht die Biolumineszenz jede lichtempfindliche Domäne, die in der Zielzellpopulation ausgedrückt wird, da die Lichtquelle genetisch kodiert ist. Die Verwendung von Biolumineszenz lindert Bedenken hinsichtlich Gewebe- und Zellschäden durch Faseroptik und verlängerte physikalische Lichtexposition. Das Licht wird mit dem Auftragen des Luciferase-Substrats eingeschaltet. Der Beginn ist sofort in vitro und in vivo je nach Verabreichungsweg und dauert ~ 15-30 min; Eine längere Präsenz oder phasische Stimulation des Lichts kann mit verschiedenen Luciferinen und mit zusätzlichen oder wiederholten Anwendungen von Substrat erreicht werden3. Schließlich kann die Biolumineszenzemission durch Variation der Konzentration von Luciferin eingestellt werden.
Die Verwendung von Biolumineszenz zur Aktivierung ionenbewegender Photorezeptoren, d.h. optogenetischer Elemente wie Kanalrhodopsine oder Pumpen, wurde ausführlich nachgewiesen4,5,6,7,8. Dieser BioLuminescent OptoGenetics (BL-OG) Ansatz wurde in In-vivo-Experimenten an Mäusen und Ratten eingesetzt5,6,7,9,10,11,12. Es wurde festgestellt, dass die BL-OG-Aktivierung von Opsinen eine Biolumineszenz von mindestens ~ 33 μW/mm2 erfordert, wobei die Effizienz der Aktivierung mit höherer Lichtemission zunimmt6,9. Ionenbewegende sensorische Photorezeptoren sind eine Untergruppe des großen Kontingents sensorischer Photorezeptoren in der Natur, die sich nicht ionenbewegen13,14. Die Ausweitung der Biolumineszenz auf die Aktivierung von nicht-ionenbeweglichen Photorezeptoren, wie z.B. photosensing domains von Pflanzen oder Bakterien, wird durch Berichte gefördert15,16, dass nicht-ionenbewegte Photosensoren signifikant lichtempfindlicher sind als Kanalrhodopsine, was einen noch besseren Antrieb von Lichtsensoren mit Biolumineszenz gewährleistet als bereits mit ionenbewegenden optogenetischen Elementen. In jüngster Zeit berichteten mehrere Publikationen über die Verwendung von Biolumineszenz als Lichtquelle für die Aktivierung einer Vielzahl von Photorezeptoren, einschließlich Licht-Sauerstoff-Spannungs-Sensing-Domänen (LOV), Blaulicht-verwenden-Flavin (BLUF) -Domänen und Cryptochrome (CRYs) 3,17,18,19,20,21,22 (Tabelle 1 ). Anwendungen für die biolumineszenzgesteuerte Aktivierung optischer Schalter zielten auf intrazelluläre Prozesse ab, die vom reaktiven Sauerstoffspezies-induzierten Zelltod, der cAMP-Synthese, der Proteinrekrutierung und -dissoziation bis hin zur genomischen Rekombination und Induktion der Transkription reichten.
Dieses Protokoll beschreibt das allgemeine Design von biolumineszenzgetriebenen optogenetischen Werkzeugen und beschreibt die Verfahren zur experimentellen Durchführung der Biolumineszenzaktivierung in Zellen und Organismen. Es enthält Beschreibungen zur Einrichtung eines Raumes, einer Gewebekulturhaube und eines Inkubators sowie eines Mikroskops für die Arbeit mit Biolumineszenz sowie die Schritte von der Vorbereitung des Luciferins bis zur Anwendung. Dieses Protokoll bietet Forschern die grundlegenden Verfahren zur Durchführung der Biolumineszenz-Optogenetik (BL-OG) in vitro und in vivo. Die beschriebenen Ansätze können weiter erweitert und auf verschiedene experimentelle Paradigmen individualisiert werden. Wir gehen davon aus, dass dieses Protokoll die Einführung der Verwendung von Biolumineszenz in optogenetischen biologischen Studien erleichtern wird.
Protokoll
Alle Verfahren in der aktuellen Studie wurden unter Verwendung der vom Institutional Animal Care and Use Committee (IACUC) genehmigten Protokolle für den Umgang mit Tieren an der Central Michigan University, MI, durchgeführt.
1. Biolumineszenzaktivierung photosensorischer Proteine in vitro
- Konstrukte
- Wählen Sie eine Luciferase-Sequenz oder eine Luciferase-fluoreszierende Proteinfusionssequenz, die zur Expression eines Lichtemitters führt, der Licht einer Wellenlänge erzeugt, die dem zu aktivierenden Photorezeptor entspricht.
HINWEIS: Zum Beispiel können blaues Licht emittierende Luciferasen wie Gaussia luciferase-Varianten oder NanoLuc mit blaulichtempfindlichen Photorezeptoren wie CRY / Ca2 + - und integrinbindendem Protein (CIB), LOV oder Vivid (VVD) gepaart werden. - Wenn nicht bereits von anderen Forschern oder Plasmidablagerungen verfügbar, verwenden Sie molekularbiologische Standardtechniken, um die DNA in ein Säugetierexpressionsplasmid zu klonen.
HINWEIS: Die Wahl der Promotoren wird durch die Notwendigkeit bestimmt, einen starken und konstitutiven Ausdruck des lichtemittierenden Moduls zu liefern, wie er von den CAG- und CMV-Promotoren bereitgestellt wird. - Für erste Studien verwenden Sie separate Plasmide für die Co-Transfektion des Lichtemitters und des Lichtsensors. Erzeugen Sie Fusionsproteine der beiden Einheiten nach Bedarf und für nachfolgende Studien.
- Erhalten Sie hochwertige Plasmid-DNAs mit Mini-, Midi- oder Maxiprep-Kits gemäß den Protokollen des Herstellers.
- Wählen Sie eine Luciferase-Sequenz oder eine Luciferase-fluoreszierende Proteinfusionssequenz, die zur Expression eines Lichtemitters führt, der Licht einer Wellenlänge erzeugt, die dem zu aktivierenden Photorezeptor entspricht.
- Zellkultur und Transfektion
HINWEIS: HeLa-Zellen und HEK293-Zellen werden in diesem Protokoll als Beispiele verwendet.- Plattenzellen in Formaten und Stückzahlen entsprechend der gewünschten Endverwendung.
ANMERKUNG: Konkrete Beispiele sind in Tabelle 2 aufgeführt. Die Zelldichte zum Zeitpunkt der Beschichtung bestimmt, wie schnell Zellen transfiziert werden können.- Zur Beurteilung der biolumineszenzaktivierten Transkription durch Fluoreszenzmikroskopie werden HEK293-Zellen auf Poly-D-Lysin (PDL)-beschichteten 12-mm-Deckgläsern in 24-Well-Schalen gelegt.
- Zur Beurteilung der biolumineszenzaktivierten Transkription durch Messung der Lichtemission von einer orthogonalen Reporter-Luciferase in einem Luminometer werden HeLa-Zellen zunächst in 6- oder 12-Well-Schalen für die Transfektion plattiert, aber nach der Transfektion neu plattiert (siehe Schritt 4).
- Wenn die wiederholte Biolumineszenzstimulation in Lebendzell-Bildgebungskammern durchgeführt wird, wählen Sie Deckgläser der entsprechenden Größe aus und legen Sie sie in Multi-Well-Platten der entsprechenden Größe (24-Well-Platten für 12-mm-Deckgläser; 12-Well-Platten für 15-mm- und 18-mm-Deckgläser). Säen Sie die Zellen auf den Deckgläsern mit den in Tabelle 2 angegebenen Zellnummern. Wenn der ausgewählte Zelltyp nicht gut an der Kulturoberfläche haftet, beschichten Sie die Zellen auf PDL-beschichtetem Geschirr.
- Führen Sie die Transfektion durch Fettfektion gemäß der Empfehlung des Herstellers durch oder verwenden Sie eine für den ausgewählten Zelltyp geeignete Transfektionsmethode.
HINWEIS: Tabelle 3 beschreibt Transfektionsexperimente für zwei verschiedene Photorezeptoren, EL222 und CRY2/CIB, und ihre jeweiligen Reporterplasmide sowie verschiedene lichtemittierende Proteine. Die Verhältnisse der verschiedenen Plasmide funktionieren gut für die ausgewählten Beispiele, müssen jedoch für jedes Lichtemitter/Lichtsensor-Paar optimiert werden. - Legen Sie die Zellen nach der Transfektion in einen Inkubator, der vollständig lichtversiegelt ist (Abbildung 1).
- Je nach gewünschter Endanwendung verwenden Sie die Zellen zur Biolumineszenzstimulation am nächsten Tag in ihren ursprünglichen Wells / Schalen oder stellen Sie sie 3-4 h nach der Lipofektion neu auf. Um die Transkription eines Glühwürmchen-Luciferase-Reporter-Gens in einem Luminometer zu lesen, füllen Sie die Zellen in weißen 96-Well-Platten neu.
HINWEIS: Führen Sie alle Manipulationen in einem lichtdichten Raum in einer Laminar-Flow-Haube durch, die von rotem Licht beleuchtet wird (Abbildung 2).- Waschen Sie die transfizierten Zellen einmal mit Dulbeccos modifiziertem Eagle-Medium (DMEM) oder phosphatgepufferter Kochsalzlösung (PBS).
- Fügen Sie das Mindestvolumen eines trypsinisierenden Reagenzes zu den Vertiefungen hinzu (24-Well: 100 μL; 12-Well: 150 μL; 6-Well: 300 μL) und inkubieren Sie die Zellen für 3 min bei 37 °C.
- Fügen Sie Kulturmedium hinzu, um eine Zellkonzentration zu erreichen, die die geeignete Zelldichte für den nächsten Beschichtungsschritt ergibt (z. B. Resuspendieren von Zellen in einem 24-Well-Volumen in einem Endvolumen von 1,2 ml für die Beschichtung in 10 Wells einer 96-Well-Platte; Resuspendierungszellen in einem 12-Well-Lot in einem Endvolumen von 2,4 ml für die Beschichtung in 20 Wells einer 96-Well-Platte). Poolen Sie die transfizierten Zellen aus mehreren Vertiefungen, abhängig von der Anzahl der am Ende benötigten Bohrlöcher.
- Beschichten Sie die transfizierten Zellen in ihrem endgültigen Format und bringen Sie die Platten in den lichtgeschützten Inkubator zurück.
- Plattenzellen in Formaten und Stückzahlen entsprechend der gewünschten Endverwendung.
- Aktivierung der Biolumineszenz in vitro
- Bereiten Sie das Luciferase-Substrat (Luciferin) vor.
- Bereiten Sie 50 mM Vorräte vor, indem Sie 5 mg lyophilisiertes Coelenterazin (CTZ) in 250 μL seines spezifischen Lösungsmittels auflösen. Stellen Sie sicher, dass die gesamte CTZ entlang der Wände der Durchstechflasche durch Pipettieren oder Wirbeln aufgelöst wird. Schützen Sie die Durchstechflasche vor direktem Licht.
- Bereiten Sie 50 μL Aliquots in 0,5 mL schwarzen Mikrozentrifugenröhrchen vor und lagern Sie sie bei -80 °C für die zukünftige Verwendung.
HINWEIS: In Lösungsmittel gelöstes CTZ gefriert nicht bei -80 °C. Aliquots können mehrmals aus dem Gefrierschrank entfernt und in den Gefrierschrank zurückgebracht werden, um Arbeitslösungen herzustellen, solange die Lichteinwirkung und die Raumtemperatur auf ein Minimum reduziert werden.
- Einzelne Biolumineszenz-Lichtstimulation
HINWEIS: Alle Manipulationen werden in einem lichtdichten Raum in einer durch rotes Licht beleuchteten Laminar-Flow-Haube durchgeführt (Abbildung 2).- Bereiten Sie eine Arbeitslösung von Luciferin in Zellkulturmedium (DMEM oder NeuroBasal) vor. Stellen Sie die Konzentration des Luciferins so ein, dass die Endkonzentration 100 μM beträgt. Bereiten Sie alle Verdünnungen von CTZ in Medium kurz vor der Zugabe zu den Zellen vor, da CTZ im Laufe der Zeit oxidiert.
HINWEIS: Wenn das gesamte Volumen des Mediums ersetzt wird, beträgt die Arbeitslösung 100 μM. Wenn den Zellen Luciferin-haltiges Medium zugesetzt wird, ist die Konzentration um den Verdünnungsfaktor höher (z. B. führt die Zugabe von 50 μL Medium, das 300 μM Luciferin enthält, zu 100 μL Medium in der Vertiefung zu einer 1:3-Verdünnung und damit zu einer Endkonzentration von 100 μM Luciferin). - Fügen Sie den Zellen Luciferin-haltiges Medium hinzu und inkubieren Sie für die gewünschte Dauer der Lichtstimulation.
HINWEIS: Dies kann so kurz wie 1 min oder so lang wie 15 min sein und kann sogar kürzer oder länger sein. Die Dauer des Verlassens des Luciferin-haltigen Mediums auf den Zellen hängt von der Halbwertszeit und Kinetik der ausgewählten Luciferase-Luciferin-Kombination ab. - Überwachen Sie die Lichtemission bei 100 μM Endluciferinkonzentration durch das Auge nach dem Ausschalten des roten Lichts; Warten Sie einige Sekunden, bis sich die Augen an die völlige Dunkelheit gewöhnt haben. Dokumentieren Sie die Lichtemission durch ein Foto (auch mit einem Handy).
- Beenden Sie die Lichtstimulation, indem Sie das Luciferin-haltige Medium entfernen und durch Kulturmedium ersetzen. Je nach Empfindlichkeit der Experimente waschen Sie die Zellen ein- bis zweimal mit Kulturmedium, nachdem Sie das Luciferin enthaltende Medium entfernt haben, um alle Luciferin zu eliminieren. Wenn die Zellen nicht gut an der Kulturoberfläche haften, platten Sie sie auf PDL-beschichtetes Geschirr, um zu vermeiden, dass die Zellen während des Waschens verloren gehen.
- Bringen Sie die Zellen für 16-24 Stunden in den lichtgeschützten Inkubator zurück.
- Bereiten Sie eine Arbeitslösung von Luciferin in Zellkulturmedium (DMEM oder NeuroBasal) vor. Stellen Sie die Konzentration des Luciferins so ein, dass die Endkonzentration 100 μM beträgt. Bereiten Sie alle Verdünnungen von CTZ in Medium kurz vor der Zugabe zu den Zellen vor, da CTZ im Laufe der Zeit oxidiert.
- Wiederholte Biolumineszenz-Lichtstimulation
HINWEIS: Alle Manipulationen werden in einem Raum durchgeführt, der lichtdicht gemacht und durch rotes Licht beleuchtet werden kann.- Richten Sie die Live-Cell-Bildgebungskammer ein. Erstellen Sie ein lichtdichtes Fach um das lebendzellige Bildgebungsmikroskop mit einer Box und schwarzen Plastikfolien oder schwarzen Vorhängen (Abbildung 3). Decken Sie alle Lichtquellen ab, die im lichtdichten Fach und im Raum vorhanden sind (z. B. LED-Anzeigen am Mikroskop oder an Instrumenten).
- Richten Sie das Perfusionssystem mit der gewünschten Lösung für die Aufnahme und den Kammerauslauf ein, der zu einem Abfallbehälter führt.
HINWEIS: Die bildgebende Lösung kann beispielsweise Tyrode's Solution (Natriumchlorid (124 mM), Kaliumchlorid (3 mM), HEPES (10 mM), Calciumchloriddihydrat (2 mM), Magnesiumchloridhexahydrat (1 mM), D-Glucose (20 mM)) sein. - Bereiten Sie eine funktionierende Lösung von Luciferin in der Bildgebungslösung vor. Aliquot in so viele Mikrozentrifugenröhrchen wie die Anzahl der wiederholten Stimulationen. Stellen Sie die Konzentration des Luciferins so ein, dass die Endkonzentration in der Bildgebungskammer 100 μM beträgt.
- Legen Sie ein Deckglas mit transfizierten Zellen in die Kammer.
- Während Sie die Pumpe am Laufen halten, entfernen Sie das Einlassrohr der Pumpe aus dem Ansaugbecherglas und tauchen Sie es schnell in die Luciferin-Lösung ein, um die Übergangszeit so kurz wie möglich zu halten, um Lufthohlräume im Schlauch zu vermeiden.
- Sobald die Luciferinlösung aufgenommen wurde, legen Sie das Einlassrohr wieder in das Ansaugbecherglas. Wiederholen Sie diesen Vorgang so oft wie nötig und in Abständen von mehreren Minuten bis Stunden, abhängig von dem physiologischen Muster, dem die Zellen ausgesetzt sein sollen.
- Bringen Sie die Zellen für 16-24 h zur Transkription in den lichtgeschützten Inkubator zurück, oder für die Zeitspanne, in der die Wirkung der Lichtstimulation beurteilt werden soll.
- Bereiten Sie das Luciferase-Substrat (Luciferin) vor.
2. Biolumineszenzaktivierung photosensorischer Proteine in vivo
- Konstrukte
- Wählen Sie eine Luciferase-Sequenz oder eine Luciferase-fluoreszierende Proteinfusionssequenz, die zur Expression eines Lichtemitters führt, der Licht einer Wellenlänge erzeugt, die dem zu aktivierenden Photorezeptor entspricht.
- Verwenden Sie molekularbiologische Standardtechniken, um die DNA in ein pAAV-Plasmid zu klonen, falls dies nicht bereits von anderen Forschern oder Plasmidablagerungen verfügbar ist.
- Wählen Sie starke Promotoren für den Ausdruck der lichtemittierenden Module, wie CAG oder CMV.
- Verwenden Sie Standardansätze zur Herstellung von Virusbeständen mit hohem Titer6 oder lassen Sie virale Vektoren kommerziell vorbereiten.
- Verwenden Sie für erste Studien separate virale Vektoren für die Co-Transduktion des Lichtemitters und des Lichtsensors, um bei Bedarf eine Anpassung der Verhältnisse der verschiedenen Komponenten zu ermöglichen.
- AAV-Transduktion
- Injizieren Sie dem Zielorgan des Versuchstiers virale Vektoren des Lichtemitters, des Lichtsensors und des Reporters analog zu den Konzentrationsverhältnissen, die für die In-vitro-Transfektionen verwendet werden (Tabelle 3).
- Bringen Sie die Tiere für mindestens 2 Wochen in ihre Heimkäfige zurück, um eine maximale Expression aller Komponenten zu ermöglichen.
HINWEIS: Wenn sich das Zielorgan im Körper befindet und vor Umgebungslicht geschützt ist, können die Tiere unter normalen Lichtverhältnissen untergebracht werden.
- Biolumineszenz-Aktivierung in vivo
- Bereiten Sie das Luciferase-Substrat (Luciferin) vor.
- Nehmen Sie eine Durchstechflasche wasserlösliches CTZ aus dem -80 °C Gefrierschrank und lassen Sie es auf Raumtemperatur erwärmen. Halten Sie es vor Licht geschützt.
- Fügen Sie pro 500 μg Durchstechflasche 250 μl steriles Wasser hinzu, indem Sie entweder eine Spritze verwenden oder die Durchstechflasche öffnen und Wasser mit einer Pipette hinzufügen und dann den Gummistopfen wieder auf die Glasdurchstechflasche legen.
- Brüten Sie das rekonstituierte Glasfläschchen in einem 55 °C warmen Wasserbad für einige Minuten aus, um das Pulver vollständig aufzulösen.
- Übertragen Sie die Lösung in ein schwarzes Mikrozentrifugenröhrchen. Spülen Sie die Wände des Glasfläschchens ab, um alle CTZ zu erhalten.
- Entfernen Sie die Menge an Lösung, die für den Tag benötigt wird. Lagern Sie die restliche Lösung bei 4 °C für den nächsten Tag. Nicht einfrieren!
- Die gleichen Schritte (2.3.1.1.-2.3.1.5) sind für eine Durchstechflasche mit Fahrzeug durchzuführen.
- Biolumineszenz-Lichtstimulation
- Entfernen Sie das Volumen an Luciferin/Fahrzeug, das für die Größe des gewählten Tieres und der gewählten Ausbringungsroute benötigt wird (Tabelle 4).
- Injizieren Sie den Tieren Luciferin oder Vehikel. Wiederholen Sie die Biolumineszenz-Lichtstimulation gemäß dem experimentellen Design. Wenn beispielsweise die Aktivierung einer Rekombinase während eines bestimmten Verhaltensparadigmas gewünscht wird, injizieren Sie die Tiere kurz vor dem Verhaltenstest. Wenn die phasische Transkription eines Moleküls das Ziel ist, injizieren Sie die Tiere wiederholt über Tage.
- Sammeln Sie Daten von den biolumineszenzstimulierten Tieren wie vorgesehen.
- Bereiten Sie das Luciferase-Substrat (Luciferin) vor.
Ergebnisse
Es gibt zahlreiche intrazelluläre Ereignisse, die mit Aktuatoren, die auf Licht reagieren, manipuliert werden können und die für eine bimodale Aktivierung mit physikalischen und biologischen Lichtquellen zugänglich sind. Im Folgenden finden Sie Beispiele für die Verwendung eines photosensenden Kalzium-Integrators (Ca2+), einer lichtinduzierten Proteintranslokation, eines lichtempfindlichen Transkriptionsfaktors und einer lichtempfindlichen Rekombinase. Die Beispiele veranschaulichen die Möglichkeit, Biolumineszenz zur Aktivierung verschiedener Arten von Photorezeptoren zu verwenden. Die vorgestellten Experimente wurden nicht speziell in Bezug auf die Anwendung von Leuchtdioden (LED), die gewählte Luciferase oder in Bezug auf Konzentrationen und Zeitpunkt der Luciferin-Anwendung optimiert.
Die schnelle licht- und aktivitätsregulierte Expression (FLARE) ist ein optogenetisches System, das die Transkription eines Reportergens mit der Koinzidenz von erhöhtem intrazellulärem Ca2+ und Light23 ermöglicht (Abbildung 4A). Das Vorhandensein von Ca2+ ist erforderlich, um die Protease in die Nähe der Protease-Spaltungsstelle zu bringen, die nur mit Lichtstimulation zugänglich ist, was zur Freisetzung des Transkriptionsfaktors führt. HEK293-Zellen wurden zusammen mit den ursprünglichen FLARE-Komponenten, einem dualen Firefly (FLuc)-dTomato-Reporter-Konstrukt und einer membranverankerten Gaussia luciferase-Variante sbGLuc6 transfiziert. In Gegenwart von erhöhtem intrazellulärem Ca2+ durch die Exposition von Zellen bei 2 μM Ionomycin und 5 mM Calciumchlorid (CaCl2) führte die Anwendung von blauer LED zu einer robusten Expression des Fluoreszenzreporters im Vergleich zu Zellen, die im Dunkeln gelassen wurden, sowie zu der Expression von FLuc, die durch Messung der Lumineszenz unter Zugabe des FLuc-Substrats bestimmt wurde. D-Luciferin. Ähnliche FLuc-Expressionsniveaus wurden mit Biolumineszenz erreicht, die von sbGLuc bei der Anwendung des sbGLuc-Substrats (CTZ) zusammen mit Ionomycin und CaCl2 emittiert wurde. Beachten Sie, dass die Luciferasen, die zur Lichtaktivierung (sbGLuc) und zur Meldung der Wirkung der Lichtaktivierung (Transkription von FLuc) verwendet werden, nur Licht mit ihren jeweiligen Luciferinen (CTZ vs. D-Luciferin) erzeugen und nicht kreuzreagieren.
Verschiedene Komponenten wurden kombiniert, um ein lichtinduziertes Transkriptionssystem zu erzeugen, das auf der Heterodimerisierung von Kryptochromen basiert23,24 (Abbildung 4B). CRY2 wurde zu einer Protease verschmolzen, während das membrangebundene CIB mit der Protease-Spaltungsstelle und dem Transkriptionsfaktor verschmolzen wurde. Die lichtinduzierte Proteintranslokation setzte den Transkriptionsfaktor frei, was zur Expression von FLuc und dTomato führte, wie in Abbildung 4A gezeigt. Während das Vorhandensein der Transkriptionsfaktorkomponente allein zu einem erheblichen Hintergrundsignal führte, möglicherweise aufgrund einer spontanen Proteolyse, erhöhten sowohl das physikalische Licht (LED) als auch die Biolumineszenz (CTZ) die Expression von FLuc, gemessen in einem in vivo Bildgebungssystem (IVIS), robust.
In einer anderen Reihe von Experimenten wurde NanoLuc (Luciferin: Furimazin oder hCTZ) für die optogenetische Regulation der Transkription durch die Dimerisierung von CRY / CIB und dem photosensitiven Transkriptionsfaktor EL22225,26,27 eingesetzt. Abbildung 5A,B zeigt die Schaltpläne der verschiedenen Komponenten im dunklen und hellen Zustand und der Luziferase, die mit dem Lichtsensor co-transfiziert oder verschmolzen wird. Verschiedene Vergleiche sind in Abbildung 5C dargestellt. Biolumineszenz, induziert durch Zugabe von hCTZ zu HEK293-Zellen, die die Konstrukte exprimieren und nach 15 Minuten entfernen, war bei der Transkription von Reportern effizienter als 20 Minuten LED-Lichtexposition für CRY/CIB und EL222. Für CRY/CIB reichte eine Stunde LED-Belichtung aus, um ein Transkriptionsniveau zu erreichen, das mit 15 Minuten Biolumineszenz vergleichbar ist. Im Gegensatz dazu waren bei EL222 selbst 60 Minuten LED kaum halb so effektiv wie eine kurze Exposition gegenüber Biolumineszenz. Es gab keine signifikanten Unterschiede in der Transkriptionswirksamkeit zwischen den beiden Systemen, wenn sie co-transfiziert wurden, obwohl die Fusionsproteine von CRY/CIB effizienter waren als die von EL222. Für beide Systeme führten die Fusionsproteine zu signifikant höheren Transkriptionsraten als die co-transfizierten Komponenten. CRY/CIB zeigte im Vergleich zu EL222, das eine vernachlässigbare Hintergrundtranskription aufwies, durchweg höhere Hintergrundwerte bei der Fahrzeuganwendung. Steigende Konzentrationen von hCTZ allein hatten keinen Einfluss auf die Transkription des Reportergens.
Photoaktivierbare Rekombinasen bieten ein vielseitiges Werkzeug für optogenomische Manipulationen. Wir testeten die Biolumineszenzaktivierung einer lichtempfindlichen Split-Cre-Rekombinase basierend auf dem Vivid-LOV-Protein iCreV28. Abbildung 6A zeigt ein Schema der verschiedenen Komponenten, sbGLuc, iCreV und einen lox-stop-lox Fluoreszenzreporter (tdTomato) vor und nach der Anwendung von CTZ. Die Ergebnisse der CTZ-Anwendung in Bezug auf Steuerungen (keine CTZ oder LED) sind in Abbildung 6B dargestellt. Es gibt einige Hintergrundausdrücke auch im Dunkeln (kein CTZ); In Gegenwart von CTZ wird die Expression jedoch robust über den Hintergrund erhöht und ähnelt der mit der LED-Anwendung induzierten.

Abbildung 1: Lichtversiegelter Inkubator. Kartonklappe, die das Licht des beleuchteten Bedienfelds bedeckt (oberer Pfeil). Lichtundurchlässige Abdeckung über der Glastür des Inkubators (unterer Pfeil), um die Zellen vor Lichteinwirkung zu schützen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Laminar-Flow-Haube, die von rotem Licht beleuchtet wird. Setup, das eine Standard-Laminar-Flow-Gewebekulturhaube zeigt, die von rotem Licht beleuchtet wird. Pfeil zeigt eine Standard-Desktop-Lampe mit einer roten Glühbirne an. Alle Manipulationen unter rotem Licht werden in einem ansonsten dunklen, lichtdichten Raum durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Lichtdichte Fächer um lebendzellige Bildgebungsmikroskope. Zwei Beispiele für Live-Cell-Imaging-Mikroskop-Setups, die die Verwendung entweder einer festen Box mit Kunststoffvorhängen nur auf der Vorderseite (linke Panels: oben und unten) oder schwarzen Vorhängen rund um das Imaging-Setup (rechte Panels: oben und unten) zeigen. Die Frontseiten in beiden Beispielen bleiben offen und aufgerollt, wenn sie nicht verwendet werden (obere Panels: links und rechts). Die vorderen schwarzen Vorhänge sind nach unten gerollt, um zu verhindern, dass Licht im Raum (z. B. Computerbildschirme) in den Bildgebungsbereich gelangt, wenn eine Biolumineszenzstimulation und/oder Bildgebung mit lebenden Zellen durchgeführt wird (untere Panels: links und rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
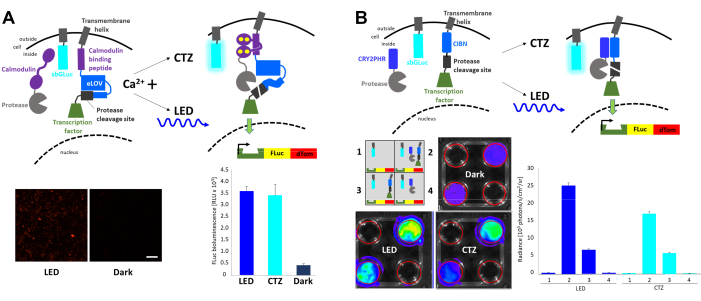
Abbildung 4: Biolumineszenz zur Integration intrazellulärer Signalereignisse. (A) Schaltpläne der mit sbGLuc ko-transfizierten FLARE-Komponenten. In Gegenwart von Ca2+ und der daraus resultierenden Nähe der Protease zur Protease-Spaltungsstelle führt entweder Biolumineszenz oder LED zur Entfaltung von LOV, zur Exposition der Spaltstelle und zur Freisetzung des Transkriptionsfaktors. Die Zellen wurden LED (Tastverhältnis 33%, 2 s ein/4 s aus für 40 min; 3,5 mW Lichtleistung, 4,72 mW/cm2 Bestrahlungsstärke ) oder Biolumineszenz (100 μM CTZ Endkonzentration für 15 min) ausgesetzt oder im Dunkeln gelassen. Mikroskopische Aufnahmen von HEK293-Zellen, die die oben genannten Komponenten nach der Behandlung exprimieren, um den Ca2+- Spiegel und die Exposition gegenüber LED zu erhöhen (links). FLuc-Lumineszenz, gemessen in einem Luminometer, das die Exposition bei LED, Biolumineszenz (CTZ) oder links im Dunkeln (rechts) vergleicht. (B) Schematische Darstellung eines nicht Ca2+-abhängigen Transkriptionssystems, das mit sbGLuc co-transfiziert wurde. HEK293-Zellen in 4-Well-Platten wurden mit vier verschiedenen Anordnungen von Komponenten transfiziert, wie im Schaltplan dargestellt. Die Platten wurden entweder LED (Tastverhältnis 33%, 2 s ein/4 s aus für 40 min; 3,5 mW Lichtleistung, 4,72 mW/cm2 Bestrahlungsstärke ) oder Biolumineszenz (100 μM CTZ Endkonzentration) durch Zugabe von CTZ und 15 min eingeschaltet; Die Steuerplatten wurden im Dunkeln gelassen. Die Transkription des FLuc-Reporters wurde in einem IVIS gemessen. IVIS-Bilder von repräsentativem Geschirr sind auf der linken Seite gezeigt; Strahlungsmessungen von mehreren Replikaten, die auf die dunklen Bedienelemente basieren, sind auf der rechten Seite dargestellt. Maßstabsleiste = 100 μm. Abkürzungen: FLARE = Fast light- and activity-regulated expression; LOV = Licht-Sauerstoff-Spannungs-Erfassung; LED = Leuchtdiode; CTZ = Coelenterazin; FLuc = Glühwürmchen-Luciferase; dTom = dTomato; CRY2 = Kryptochrom 2; CRY2PHR = CRY2-Photolyase-Homologie-Region; CIB1 = Ca2+- und Integrin-bindendes Protein 1; CIBN = N-Terminus von CIB1; IVIS = in vivo Bildgebungssystem. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
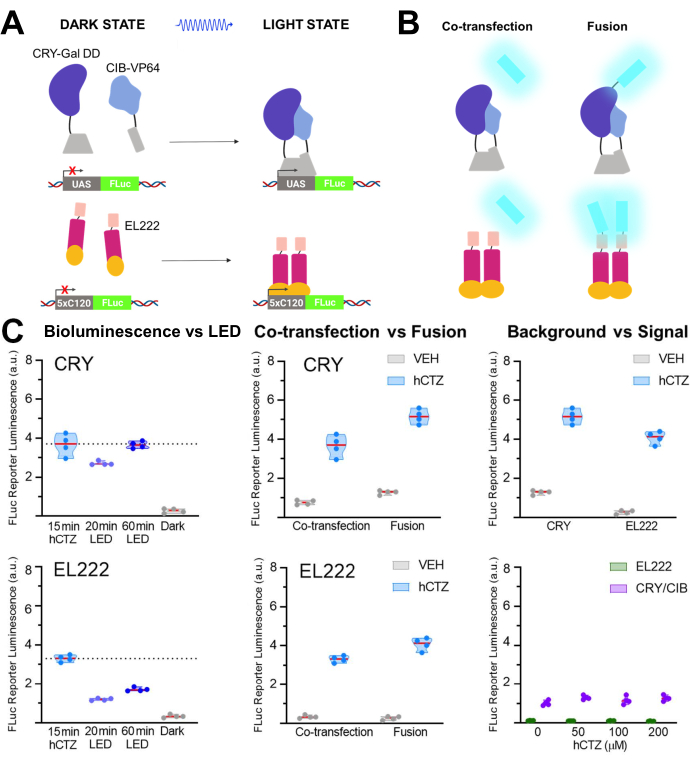
Abbildung 5: Biolumineszenz für die treibende Transkription . (A) Schematische Darstellung zweier photoaktivierbarer Transkriptionssysteme in ihrem dunklen und hellen Zustand. (B) NanoLuc wurde entweder co-transfiziert oder mit den abgebildeten lichtempfindlichen Einheiten verschmolzen (N-NanoLuc-CRY-GalDD-C; N-NanoLuc-VP16-EL222-C). (C) Vergleiche beider Systeme in Bezug auf Lichtquellen, Konstruktdesign und Signal-Rauschen. Die Zellen wurden einer LED (Tastverhältnis 33%, 2 s Ein/4 s aus für 40 min; 3,5 mW Lichtleistung, 4,72 mW/cm2 Bestrahlungsstärke) oder einer Biolumineszenz für 15 min (100 μM hCTZ Endkonzentration; außer wenn unterschiedliche Konzentrationen festgestellt werden) ausgesetzt. Dunkle Platten wurden im Inkubator zwischen der anfänglichen Umwandlung von Plasmiden und der FLuc-Messung unberührt gelassen; VEH, Kennzeichen wurden genauso behandelt wie diejenigen, die hCTZ erhielten, aber stattdessen erhielten sie Fahrzeuge. Unterschiede in den Transkriptionsniveaus: hCTZ, co-transfizierte CRY vs. EL222 - nicht signifikant; hCTZ, Luciferase - Photoproteinfusion CRY vs. EL222 - p < 0,005; hCTZ, CRY Co-Transfection vs. Fusion - p < 0,005; hCTZ, EL222 Co-Transfektion vs. Fusion - p < 0,01; Fahrzeug, CRY vs. EL222 - p < 0,05. Abkürzungen: UAS = Upstream Activating Sequence; LED = Leuchtdiode; CTZ = Coelenterazin; FLuc = Glühwürmchen-Luciferase; CRY = Kryptochrom; CIB = Ca2+- und Integrin-bindendes Protein; VEH = Fahrzeug. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
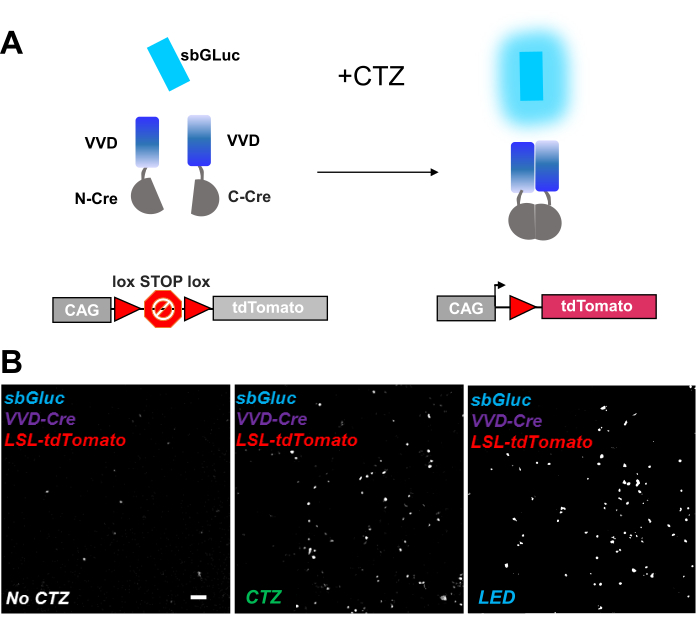
Abbildung 6: Biolumineszenz für die optogenomische Manipulation. (A) Schematische Darstellung der biolumineszenzgetriebenen optogenomischen Manipulation unter Verwendung von sbGLuc, den gespaltenen iCreV-Komponenten und einer LSL-Reporterkassette vor und nach der Anwendung von Licht. (B) HEK293-Zellen wurden mit Plasmiden lipofektiert und dann im Dunkeln gehalten. Vierundzwanzig Stunden später wurden die Zellen 30 min lang mit nur Medium (kein CTZ) oder mit CTZ (100 μM Endkonzentration) oder mit LED (Tastverhältnis 25%, 5 s on/15 s off für 5 min; 14,81 mW Lichtleistung, 20 mW/cm2 Bestrahlungsstärke) als Positivkontrolle behandelt. Mikroskopische Aufnahmen der tdTomato-Fluoreszenz unter Verwendung der angegebenen Bedingungen. Maßstabsleiste = 100 μm. Abkürzungen: LSL = lox-stop-lox; CTZ = Coelenterazin; LED = Leuchtdiode; VVD = Lebendig. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Biolumineszenzaktivierung von Photorezeptoren. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Richtlinien für die Beschichtung und Transfektion von Zellen in verschiedenen Formaten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 3: Verhältnisse verschiedener Plasmide für die Transfektion. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 4: Injektionswege, -volumina und -konzentrationen von Luciferin für In-vivo-Anwendungen (25 g Maus). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Es gibt eine Reihe von Luciferasen und Luciferinen mit Lichtemissionswellenlängen, die den Aktivierungsspektren photosensorischer Proteine von blauem bis rotem Licht entsprechen14,29. Abgesehen von der Ausrichtung der Emissions- und Anregungswellenlängen gibt es keine zuverlässige Möglichkeit, a priori zu bestimmen, welche Paarung am besten funktioniert. Daher besteht die Notwendigkeit, experimentell zu bestimmen, wie Luciferin-Luciferase-Paare in Zellen und Organismen in photosensorischen Systemen funktionieren.
Die in dieser Präsentation beschriebenen Protokolle beschreiben, wie das Luciferin vorbereitet und wie es in vitro und in vivo angewendet wird, zusammen mit Richtlinien zur Einrichtung von Räumen, Gewebekulturhauben, Inkubatoren und Mikroskopen für Experimente mit Biolumineszenz. In den repräsentativen Experimenten wurden verschiedene Luciferasen (NanoLuc, Gaussia luciferase) mit mehreren photosensorischen Proteinen (CRY/CIB, EL222, VVD, LOV) verwendet, die die Auswirkungen von Biolumineszenz gegenüber physikalischem Licht, Co-Transfektion versus Fusionsproteinen, Signal-Rausch-Vergleichen und verschiedenen Ausleseassays demonstrierten. Weitere Anwendungen der Biolumineszenzaktivierung photosensorischer Proteine werden in Publikationen aus mehreren Gruppen beschrieben, die neben der Transkription auf die Induktion des Zelltods, die cAMP-Synthese und die Proteinbewegung abzielen (Tabelle 1).
Die einfache Co-Transfektion von lichtemittierenden und lichtempfindlichen Komponenten ist ein guter Anfang. Variablen sind die molaren Verhältnisse von Emitter und Sensor; Unbekannt sind Hintergrundwerte der Sensoraktivität im Dunkeln, die Sensoraktivität in Bezug auf Lichtintensität und -dauer sowie die Effizienz der Sensoraktivierung im Vergleich von physikalischem und biologischem Licht. Während Fusionskonstrukte den Vorteil haben, das molare Verhältnis von Emitter und Sensor bei 1:1 zu halten und den Lichtemitter in die Nähe der lichtempfindlichen Domäne zu bringen, kommen andere Überlegungen ins Spiel, wie z.B. wo man sich anbinden kann (N- oder C-Terminus) und wie man verbindet (Linkerlänge und Zusammensetzung), ohne die Leistung des photosensorischen Aktuators zu beeinträchtigen.
Für Experimente sowohl in vitro als auch in vivo gibt es mehrere Möglichkeiten, die biolumineszente Lichtemission abzustimmen, entweder durch Variation der Konzentration des Luciferins und/oder durch Variation des Zeitpunkts, zu dem das Luciferin dem jeweiligen Sensor zur Verfügung gestellt wird. Die minimale Menge und Zeit wird durch das Vorhandensein oder Fehlen der bei der Lichtaktivierung erwarteten Wirkung bestimmt. Im Gegensatz dazu werden die jeweiligen Maxima hauptsächlich durch die Toleranz der Zellen gegenüber hohen Konzentrationen von Luciferin über längere Zeit bestimmt. Die in den obigen Beispielen gewählte CTZ-Konzentration von 100 μM liegt nahe an der oberen Grenze für verschiedene Zelltypen, von HEK293-Zellen bis hin zu Neuronen. Ziel ist es, eine möglichst geringe Konzentration für die kürzeste Zeit zu nutzen, um eine Aktivierung der angestrebten Photosensing-Domäne zu erreichen. Dies wird leichter mit Luciferasen mit hoher Lichtemission und Photorezeptoren mit hoher Lichtempfindlichkeit erreicht.
Biolumineszenz zum Antreiben von Photorezeptoren wurde bei Nagetieren (Mäusen, Ratten) mit photosenzierenden Proteinen verwendet, die in Leber, Muskeln, Rückenmark und Gehirn exprimiert werden, sowie über photorezeptor-exprimierende Zellen, die subkutan oder intraperitoneal transplantiert werden. Im Prinzip gibt es keine Grenzen, die verhindern, dass der Ansatz auf verschiedene Arten angewendet wird, von nichtmenschlichen Primaten bis hin zu Fischen oder Fliegen. Abhängig von der Durchlässigkeit des Organismus für das Luciferin kann die Anwendung so einfach sein wie das Auftragen des Luciferins auf das umgebende Wasser (z. B. in Fischlarven30). Vor der Verwendung von BL-OG in einem neuen Organismus müssen Pilotversuche durchgeführt werden, um sicherzustellen, dass das Luciferin seine Ziele über den gewählten Anwendungsweg erreicht.
Kritische Aspekte des Versuchsdesigns sind die verschiedenen Kontrollen, die für die Interpretation der Ergebnisse wichtig sind. Zellen, die einen Reporter exprimieren, der von einer Luciferase angetrieben wird, die auf ein photosensorisches Protein wirkt, sollten mit Zellen verglichen werden, denen die Luciferase oder das photosensorische Protein fehlt. Darüber hinaus sollten Vergleiche zwischen Zellen angestellt werden, die Luciferin oder Vehikel ausgesetzt oder im Dunkeln gehalten werden. Es ist auch wichtig, die Grenzen verschiedener Assays zur Beurteilung der Auswirkungen der biolumineszenzgetriebenen Photorezeptoraktivierung zu erkennen. Zum Beispiel kann die Wirksamkeit der biolumineszenzaktivierten Transkription auf verschiedene Arten getestet werden, je nachdem, ob es sich bei dem Reportergen um eine orthogonale Luciferase (Luminometer, IVIS) oder ein fluoreszierendes Protein (fluoreszenzaktivierte Zellsortierung, mikroskopische Bildanalyse) handelt. Während die grundlegenden Effekte über Testplattformen hinweg reproduzierbar sein sollten, können die quantitativen Aspekte der Effekte erheblich variieren.
Die Biolumineszenzaktivierung von Photorezeptoren wurde bisher für eine begrenzte Anzahl von Luciferasen bzw. photosensorischen Proteinen sowohl in vitro als auch in vivo nachgewiesen. Es kann auf die große Klasse von Photorezeptoren erweitert werden, um viele weitere biologische Prozesse zu aktivieren. Eine solche Erweiterung des Ansatzes wird durch die kontinuierliche Entwicklung neuartiger Luciferasen und Luciferase-Fluoreszenz-Proteinpaare mit viel höherer Lichtemission als natürlich vorkommende Luciferasen und mit kinetischen Merkmalen, die auf verschiedene Anwendungen abgestimmt werden können, weiter gefördert. Diese Fortschritte gehen einher mit der Erzeugung neuartiger Luciferine, die zu einer erhöhten Helligkeit und Farbpalette beitragen29. Diese Tool-Plattform bietet Anwendungen zur Manipulation und Untersuchung der intrazellulären Dynamik und Zellinteraktionen in lebenden Zellen, Geweben und Organismen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken unseren Kollegen für Konstrukte, insbesondere A. Ting für die Ca-FLARE-Protease, den Transkriptionsfaktor und den Reporter (Addgene # 92214, 92213, 92202), H. Kwon für TM-CIBN-BLITz1-TetR-VP16 und NES-CRY2PHR-TevC (Addgene # 89878, 89877), C. Tucker für CRY-GalΔDD (B1013) und CIB-VP64 (B1016) (Addgene # 92035, 92037), M. Walsh für pGL2-GAL4-UAS-Luc (Addgene #33020), K. Gardner für VP-EL222 und C120-Flac sowie A. Cetin und H. Zeng für die Bereitstellung von iCreV vor der Veröffentlichung. Diese Arbeit wurde durch Zuschüsse von NSF (NeuroNex 1707352), NIH (U01NS099709), der W.M. Keck Foundation und dem Swedish Research Council an A.B. (2016-06760) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| ABI 25W Deep Red 660 nm LED Light Bulb | Amazon | to be used with any lamp stand | |
| Black Microcentrifuge Tubes, 0.5 mL, Argos Technologies | Fisher Scientific | 03-391-166 | |
| Black Microcentrifuge Tubes, 1.5 mL, Argos Technologies | Fisher Scientific | 03-391-161 | |
| Black Nylon, Polyurethane-Coated Fabric (1.5 m x 2.7 m) x 0.12 mm (thick) | THOR LABS | BK-5 | |
| C120-Fluc | K. Gardner | ||
| CaCl2 | Sigma | C8106; CAS: 10035-04-8 | |
| Ca-FLARE protease, transcription factor and reporter | Addgene # 92214, 92213, 92202 | A. Ting | |
| CIB-VP64 (B1016) | Addgene # 92037 | C. Tucker | |
| CRY-GalΔDD (B1013) | Addgene # 92035 | C. Tucker | |
| CTZ | Prolume Inc. (NanoLight) | 303 | formulation for in vitro applications with Gaussia luciferases |
| CTZ (Water soluble native coelenterazine) | Prolume Inc. (NanoLight) | 3031 | formulation for in vivo applications with Gaussia luciferases |
| D-(+)-Glucose | Sigma | G8270; CAS: 50-99-7 | |
| D-Luciferin, Potassium Salt | Gold Biotechnology | LUCK | |
| DMEM | Thermo Fisher | 11960044 | |
| D-PBS, no calcium, no magnesium | Thermo Fisher | 14190144 | |
| hCTZ | Prolume Inc. (NanoLight) | 301 | formulation for in vitro applications with Oplophorus luciferases |
| HEK293 | ATCC | CRL-1573 | |
| HeLa | ATCC | CCL-2 | |
| HEPES | Sigma | H3375; CAS: 7365-45-9 | |
| iCreV | A. Cetin and H. Zeng | ||
| In Vivo Imaging System (IVIS) | Perkin-Elmer | Lumina LT | |
| KCl | Sigma | P5405; CAS: 7447-40-7 | |
| LED Array Driver | Amuza | LAD-1 | |
| LED Array for Multiwell Plates | Amuza | LEDA-x | |
| Lipofectamine 2000 Reagent | Invitrogen | 11668-019 | Transfection reagent |
| Luminometer | Molecular Devices | SpectraMax L | |
| MgCl2 Hexahydrate | Sigma | M2670; CAS: 7791-18-6 | |
| NaCl | Sigma | S7653; CAS: 7647-14-5 | |
| NanoFuel Solvent | Prolume Inc. (NanoLight) | 399 | for dissolving CTZ preparations for in vitro use |
| NaOH | Sigma | 221465; CAS: 1310-73-2 | |
| NES-CRY2PHR-TevC | Addgene # 89877 | H. Kwon | |
| Opti-MEM | Thermo Fisher | 11058021 | transfection medium |
| PDL coated coverslips (12 mm, 15 mm, 18 mm) | Neuvitro Corporation | GG-12-PDL, GG-15-PDL , GG-18-PDL | |
| pGL2-GAL4-UAS-Luc | Addgene #33020 | M. Walsh | |
| Prizmatix USB Pulser TTL Generator for Optogenetics | Goldstone Scientific | ||
| TM-CIBN-BLITz1-TetR-VP16 | Addgene # 89878 | H. Kwon | |
| TrypLE Express | Gibco | 12604-013 | |
| Vehicle (Water-soluble carrier without CTZ) | Prolume Inc. (NanoLight) | 3031C | control for in vivo applications with CTZ |
| VP-EL222 | K. Gardner |
Referenzen
- Johnson, H. E., et al. The spatiotemporal limits of developmental Erk signaling. Developmental Cell. 40 (2), 185-192 (2017).
- Wang, Y., et al. Photostimulation by femtosecond laser triggers restorable fragmentation in single mitochondrion. Journal of Biophotonics. 10 (2), 286-293 (2017).
- Li, T., et al. A synthetic BRET-based optogenetic device for pulsatile transgene expression enabling glucose homeostasis in mice. Nature Communications. 12 (1), 615(2021).
- Berglund, K., Birkner, E., Augustine, G. J., Hochgeschwender, U. Light-emitting channelrhodopsins for combined optogenetic and chemical-genetic control of neurons. PLoS One. 8 (3), 59759(2013).
- Tung, J. K., Gutekunst, C. -A., Gross, R. E. Inhibitory luminopsins: genetically-encoded bioluminescent opsins for versatile, scalable, and hardware-independent optogenetic inhibition. Scientific Reports. 5, 14366(2015).
- Berglund, K., et al. Luminopsins integrate opto- and chemogenetics by using physical and biological light sources for opsin activation. Proceedings of the National Academy of Sciences of the United States of America. 113 (3), 358-367 (2016).
- Gomez-Ramirez, M., More, A. I., Friedman, N. G., Hochgeschwender, U., Moore, C. I. The BioLuminescent-OptoGenetic in vivo response to coelenterazine is proportional, sensitive and specific in neocortex. Journal of Neuroscience Research. 98 (3), 471-480 (2020).
- Moore, C. I., Berglund, K. BL-OG: BioLuminescent-OptoGenetics. Journal of Neuroscience Research. 98 (3), 469-470 (2020).
- Park, S. Y., et al. Novel luciferase-opsin combinations for improved luminopsins. Journal of Neuroscience Research. 98 (3), 410-421 (2020).
- Jaiswal, P. B., Tung, J. K., Gross, R. E., English, A. W. Motoneuron activity is required for enhancements in functional recovery after peripheral nerve injury in exercised female mice. Journal of Neuroscience Research. 98 (3), 448-457 (2020).
- Zenchak, J. R., et al. Bioluminescence-driven optogenetic activation of transplanted neural precursor cells improves motor deficits in a Parkinson's disease mouse model. Journal of Neuroscience Research. 98 (3), 458-468 (2020).
- Tung, J. K., Shiu, F. H., Ding, K., Gross, R. E. Chemically activated luminopsins allow optogenetic inhibition of distributed nodes in an epileptic network for non-invasive and multi-site suppression of seizure activity. Neurobiology of Disease. 109, Pt A 1-10 (2018).
- Hegemann, P. Algal sensory photoreceptors. Annual Review of Plant Biology. 59, 167-189 (2008).
- Losi, A., Gardner, K. H., Moglich, A. Blue-light receptors for optogenetics. Chemical Reviews. 118 (21), 10659-10709 (2018).
- Proshkina, G. M., Shramova, E. I., Shilova, O. N., Ryabova, A. V., Deyev, S. M. Phototoxicity of flavoprotein miniSOG induced by bioluminescence resonance energy transfer in genetically encoded system NanoLuc-miniSOG is comparable with its LED-excited phototoxicity. Journal of Photochemistry and Photobiology B: Biology. 188, 107-115 (2018).
- Kawano, F., Okazaki, R., Yazawa, M., Sato, M. A photoactivatable Cre-loxP recombination system for optogenetic genome engineering. Nature Chemical Biology. 12 (12), 1059-1064 (2016).
- Shramova, E. I., Proshkina, G. M., Chumakov, S. P., Khodarovich, Y. M., Deyev, S. M. Flavoprotein miniSOG cytotoxisity can be induced by bioluminescence resonance energy transfer. Acta Naturae. 8 (4), 118-123 (2016).
- Naim, N., et al. Luminescence-activated nucleotide cyclase regulates spatial and temporal cAMP synthesis. Journal of Biological Chemistry. 294 (4), 1095-1103 (2019).
- Kim, C. K., Cho, K. F., Kim, M. W., Ting, A. Y. Luciferase-LOV BRET enables versatile and specific transcriptional readout of cellular protein-protein interactions. Elife. 8, 43826(2019).
- Parag-Sharma, K., et al. Engineered BRET-based biologic light sources enable spatiotemporal control over diverse optogenetic systems. ACS Synthetic Biology. 9 (1), 1-9 (2020).
- Kim, E. H., et al. Self-luminescent photodynamic therapy using breast cancer targeted proteins. Science Advances. 6 (37), (2020).
- Kim, C. K., et al. A Molecular calcium integrator reveals a striatal cell type driving aversion. Cell. 183 (7), 2003-2019 (2020).
- Wang, W., et al. A light- and calcium-gated transcription factor for imaging and manipulating activated neurons. Nature Biotechnology. 35 (9), 864-871 (2017).
- Lee, D., Hyun, J. H., Jung, K., Hannan, P., Kwon, H. -B. A calcium- and light-gated switch to induce gene expression in activated neurons. Nature Biotechnology. 35 (9), 858-863 (2017).
- Pathak, G. P., et al. Bidirectional approaches for optogenetic regulation of gene expression in mammalian cells using Arabidopsis cryptochrome 2. Nucleic Acids Research. 45 (20), 167(2017).
- Nishio, H., Walsh, M. J. CCAAT displacement protein/cut homolog recruits G9a histone lysine methyltransferase to repress transcription. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11257-11262 (2004).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nature Chemical Biology. 10 (3), 196-202 (2014).
- Yao, S., et al. RecV recombinase system for in vivo targeted optogenomic modifications of single cells or cell populations. Nature Methods. 17 (4), 422-429 (2020).
- Love, A. C., Prescher, J. A. Seeing (and using) the light: Recent developments in bioluminescence technology. Cell Chemical Biology. 27 (8), 904-920 (2020).
- Naumann, E. A., Kampff, A. R., Prober, D. A., Schier, A. F., Engert, F. Monitoring neural activity with bioluminescence during natural behavior. Nature Neuroscience. 13 (4), 513-520 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten