Method Article
מדידות כוח ישירות של מכניקה תת-תאית בכליאה באמצעות פינצטה אופטית
In This Article
Summary
כאן, אנו מציגים פרוטוקול לחקור את התכונות המכניות התאיות של תאי זברה עובריים מבודדים בכליאה תלת מימדית עם מדידת כוח ישירה על ידי מלכודת אופטית.
Abstract
במהלך התפתחותו של אורגניזם רב תאי, תא מופרית יחיד מתחלק ומוליד רקמות מרובות עם פונקציות מגוונות. מורפוגנזה רקמות הולך ביד עם שינויים מולקולריים ומבניים ברמת התא הבודד שתוצאתם וריאציות של תכונות מכניות תת תאיות. כתוצאה מכך, אפילו בתוך אותו תא, אברונים ותאים שונים להתנגד באופן שונה לחצים מכניים; ומסלולי mechanotransduction יכול לווסת באופן פעיל את המאפיינים המכניים שלהם. היכולת של תא להסתגל למיקרו-סביבה של נישה הרקמה ולכן נובעת בחלקה מהיכולת לחוש ולהגיב ללחצים מכניים. לאחרונה הצענו פרדיגמת מינוזנסציה חדשה שבה עיוות ומיקום גרעיניים מאפשרים לתא לאמוד את הסביבה התלת-ממדית הפיזית ומעניקים לתא תחושה של פרופריוספציה כדי לפענח שינויים בצורת התא. במאמר זה אנו מתארים שיטה חדשה למדידת הכוחות ומאפייני החומר המעצבים את גרעין התא בתוך תאים חיים, המודגמים על תאים דבקים ותאים מוגבלים מכנית. המדידות יכולות להתבצע באופן לא פולשני עם מלכודות אופטיות בתוך תאים, והכוחות נגישים ישירות באמצעות זיהוי ללא כיול של תנופת אור. זה מאפשר למדוד את המכניקה של הגרעין באופן עצמאי מן העיוותים פני התא ומאפשר ניתוח של נתיבי mechanotransduction exteroceptive ו interoceptive. חשוב לציין, ניתן לשלב את ניסוי ההשמנה עם מיקרוסקופיה אופטית כדי לחקור את התגובה התאית ואת הדינמיקה התת-תאית באמצעות הדמיית פלואורסצנטיות של הציטוסקלטון, יוני הסידן או המורפולוגיה הגרעינית. השיטה המוצגת היא פשוטה ליישום, תואמת פתרונות מסחריים למדידות כוח, וניתן להרחיב אותה בקלות כדי לחקור את המכניקה של תאים תת-תאיים אחרים, למשל, מיטוכונדריה, סיבי מתח ואנדוזומים.
Introduction
מורפוגנזה של רקמות הוא תהליך מורכב שבו אותות ביוכימיים וכוחות פיזיים מתואמים באופן מרחבי. בעובר המתפתח, שיפועים של גורמי איתות ביוכימיים מכתיבים את מפרט הגורל ומבטיחים דפוסי רקמות נכונים 1,2. יחד עם זאת, כוחות פנימיים וחיצוניים ממלאים תפקיד בבניית הארכיטקטורה של העובר3,4. ההשפעה של מכניקת קליפת המוח התאית בהקשר זה נחקרה בהרחבה 5,6. החיבור ההדוק בין תהליכים מכניים-כימיים במהלך מורפוגנזה מסתמך על המאפיינים של תאים בודדים לחוש ולהגיב לכוחות מכניים במיקרו-סביבה של הרקמה שלהם. תאים, ובכך לפענח אותות מכניים באמצעות נוכחות של אלמנטים תת-תאיים ומולקולריים רגישים לכוח המעבירים מידע מכני למסלולי איתות ספציפיים השולטים בהתנהגות התאים, בגורל התא ובמכניקת התאים.
סימן ההיכר של תהליכים התפתחותיים הוא שתאים מתארגנים כקבוצות לבניית מבנים רב-תאיים. ככזה, תאים בודדים לעתים רחוקות לסדר מחדש ולנוע לבד אבל קשורים סוציוטופה הדוקה שבו הם מראים התנהגות קולקטיבית כגון הגירה על-תאית7, (un)שיבוש מעברים8,9 או דחיסת blastocyst10. כוחות מכניים הנוצרים בתוך ובין התאים משמשים כרמזים חשובים להנחיית דינמיקת תאים קולקטיבית7,11. אבל גם כאשר תאים נעים לבד, כגון תאים אבהיים שסוחטים את דרכם בין יריעות רקמות או נישות רקמות צרות, הם חווים כוחות מכניים אניסוטרופיים נרחבים בעת ניווט בסביבה תלת ממדית. ללחצים מכניים אלה על תאים יש השלכות עמוקות על התנהגות התאים12,13. מספר מנגנונים נחקרו המתכנסים על הגרעין כאלמנט mechanotransduction העיקרי14,15, כאלמנט מכני פסיבי או פעיל במהלך הנדידה בתוך סביבת רקמה תלת-ממדית צפופה15,16.
לאחרונה הצענו מנגנון שמצייד תאים למדידת עיוותי צורה באמצעות הגרעין כמכנו-מד תאי אלסטי12. הגרעין, בהיותו האברונית הגדולה ביותר בתא, עובר עיוותים גדולים כאשר תאים מקוטבים, נודדים או משנים את צורתם תחת מתיחה מכנית, כליאה או מתח אוסמוטי16,17,18,19. מצאנו כי מעטפה גרעינית למתוח יחד עם המיקום התאי של הגרעין מספק תאים עם מידע על סדר הגודל וסוג של עיוות התא (כגון דחיסת תאים לעומת נפיחות תאים). מתיחה של הגרעין קשורה להתפתחות של הממברנה הגרעינית הפנימית (INM), אשר מקדם cPLA2 תלוי סידן (פוספוליפאז A2) פעילות ליפאז ב- INM ואחריו שחרור של חומצה ארכידונית (AA) והפעלה מהירה של מיוזין II בקליפת התא. זה מוביל להתכווצות תאים מוגברת ונדידת תאים אמבואואידית מעל סף של התכווצות קליפת המוח6. התגובה המכנית לעיוות התא מתרחשת תוך פחות מדקה והיא הפיכה עם שחרור הכליאה, דבר המצביע על כך שהגרעין פועל כמד מאמץ עבור פרופריוספציה תאית המסדירה את התנהגות התא האדפטיבית בתנאי לחץ מכניים. מסלול מכני זה מוצג כפעיל בתאי גזע של אבות המופקים מעוברי דגי זברה, הן בתאים פלוריפוטנטיים והן בתאים מחויבים לשושלת שושלת12 והוא נשמר במינים שונים ובקווי תאים20.
בנוסף למאפיינים הגרעיניים כמכנוזנסור תאים, ארכיטקטורה גרעינית ומכניקה מוסדרות באופן מהותי במהלך הפיתוח ובתגובה למפרט גורל התא21, ומכאן כוונון רגישות המכנית התאית22,23. התוצאה עשויה להיות שינוי בציות הגרעיני המאפשר שינויים מורפולוגיים ומעברים מקדם-כבידה למצב נודד ולהיפך8.
מספר טכניקות למדידת מכניקת גרעין התא יושמו, כגון מיקרוסקופיה של כוח אטומי24,25, שאיפה מיקרופיפט26,27, טכנולוגיה מיקרופלואידית28 ומיקרונידלס29. עם זאת, רבות מהטכניקות הללו פולשניות במובן זה שיש לעוות את התא כולו, מה שמגביל את מדידת המאפיינים המכניים ואת התגובות התלויות בכוח של הגרעין עצמו. כדי לעקוף את העיוות בו זמנית של פני השטח של התא וקליפת המוח המכנית שלו30, גרעינים מבודדים נחקרו בהקשרים שונים31,32. עם זאת, לא ניתן לשלול כי בידוד גרעיני קשור לשינוי במאפייני הגרעין המכני וברגולציה שלהם (התייחסות24 ותצפיות שלא פורסמו).
פינצטה אופטית (OTs) היא טכנולוגיה רב-תכליתית שאפשרה שפע של ניסויים במכנוביולוגיה של תאים והיוו אינסטרומנטלי בהבנתנו כיצד מכונות מולקולריות ממירות כימיקלים לאנרגיה מכנית33,34. פינצטה אופטית משתמשת בקרן לייזר ממוקדת היטב כדי להפעיל כוחות אופטיים על חלקיקים דיאלקטריים בעלי אינדקס שבירה גבוה יותר מהמדיום הסובב. כוחות כאלה יכולים להיות בסדר גודל של מאות פיקו-ניוטון ולגרום לכליאה יעילה של החלקיק בתוך מוקד מלכודת הלייזר, המאפשר מניפולציה של החלקיק הלכוד בשלושה ממדים. לשימוש באור יש יתרון חשוב בכך שניתן לבצע את המדידה באופן לא פולשני בתוך תאים חיים. מניפולציות אופטיות מוגבלות עוד יותר למיקוד המלכודת של קרן הלייזר. לפיכך, המניפולציה יכולה להתבצע מבלי לעורר את הממברנות התאיות שמסביב ואינה מטרידה את קליפת המוח האקטין או תהליכים mechanosensitive בקרום הפלזמה, כגון הפעלה תלוית כוח של תעלות יונים.
הקושי של גישת הפינצטה האופטית הוא לקבוע במדויק את הכוחות המוחלים על המיקרוספירה באמצעות גישות קלאסיות המסתמכות על כיול כוח עקיף המבוסס על משפט השווי-חלקיקים או על שימוש בכוחות סטוקס-גרירה מוגדרים כדי למדוד כוח בריחה תלוי כוח לייזר35. בעוד ששיטות אלה פשוטות ליישום בניסוי במבחנה, בדרך כלל לא ניתן לתרגם אותן לסביבה תאית. מספר אסטרטגיות הוכנסו לשטח המסתמכות על כיול כוח ישיר, הנגזר מהעקרונות הראשונים של שימור המומנטום36,37. שלא כמו גישות ספקטרוסקופיות כוח אחרות, מדידות כוח מושרות מחילופי אור מקומיים עם החלקיק הלכוד בעל הצורה השרירותית 38,39. במערך הניסיוני שלנו, שינויים בתנופת האור הנובעים מכוחות אופטיים נמדדים ישירות ללא צורך בכיול מלכודת מיקום40,41,42,42,43. לכן, המדידות הופכות לאפשריות בסביבה צמיגה כגון פנים התא או אפילו בתוך רקמה, וכוחות ניתן לכמת בקלות עד לרמת pN.
בפרוטוקול זה, אנו מתארים בדיקה לתפעל באופן מכני אברונים או מבנים תאיים ולהעריך כמותית את המאפיינים המכניים שלהם על ידי הגדרת פינצטה אופטית. הגדרה זו משולבת במיקרוסקופ פלואורסצנטי של דיסק מסתובב המאפשר הדמיה מקבילה של התנהגות תאית או דינמיקה תאית. הבדיקה מאפשרת אפיון של המאפיינים המכניים של תאים תאיים ספציפיים, כגון הגרעין, ובו זמנית ללמוד את mechanoresponse אפשרי והפעלה של מסלולי איתות מולקולרי כתוצאה מהעיוות עצמו. יתר על כן, השמנה אופטית של מיקרואורגניזמים מוזרקים בתוך התאים מאפשרת עלייה בכוח הכניסה הודות לאינדקס שבירה גבוה בהרבה של חרוז הפוליסטירן (n = 1.59) בהשוואה לשבירה הפנימית 44 של הגרעין (n ~ 1.35) לעומת ציטופלסמה (n ~ 1.38). ניתן להתאים בקלות את האסטרטגיה המוצגת לחקר מבנים ואברונים תאיים אחרים, כמו גם לגישות אחרות הכרוכות במיקרו-ולוגיה פעילה, שימוש במלכודות אופטיות מרובות כדי לחקור את אותם מבנים תת-תאיים שונים בו זמנית, ומדידות המתמקדות במכנוביולוגיה של תאים בעובר החי.
Protocol
כל הפרוטוקולים בהם נעשה שימוש אושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים ולשימוש (PRBB-IACUEC) ויושמה על פי תקנות לאומיות ואירופאיות. כל הניסויים בוצעו בהתאם לעקרונות של 3Rs. דגי זברה (דניו ריו) נשמרו כפי שתואר בעבר.
1. הכנת תאי גזע עובריים ראשוניים מבודדים של דגי זברה
- הכנת מיקרופיפט ואגרוז
הערה: לקבלת פרוטוקול מיקרו-חדירה מלא של דגי זברה, ראה הפניה45.- עם משיכת micropipette, למשוך נימי זכוכית 1.0 מ"מ כדי להשיג שתי מחטים45. אחסנו את המחטים שאינן בשימוש בצלחת פטרי בקוטר 150 מ"מ המחוברת לכרית playdough או בטבעת סרט מעבדה מבפנים החוצה כדי להגן על הקצה הדק מפני נזק במהלך ההובלה.
- ממיסים 1% אולטרה-פורה אגרוז ב-E3 (5 מ"מ NaCl, 0.17 מ"מ KCl, 0.33 מ"מ CaCl2, 0.33 מ"מ MgSO4) במיקרוגל מטבח/מעבדה סטנדרטי למשך 10 שניות. מחממים את התערובת שוב ושוב לפרקי זמן קצרים (כמה שניות) עד שהגרוז נמס.
- כאשר האגרוז נמס לחלוטין, תן לו להתקרר לזמן קצר, ולאחר מכן לשפוך אותו לתוך צלחת פטרי 10 ס"מ. הוסיפו באיטיות את תבנית המיקרו-אנז'נט המשולשת (ראו טבלת חומרים) על גבי האגרוז תוך הימנעות מהופעת בועות. אין לדחוף את התבנית, להבטיח שהוא נשאר על פני השטח agarose.
- כאשר האגוז מתמצק לחלוטין, הסר את התבנית המשולשת לאט מאוד על ידי הפעלת כוח עדין כדי למנוע כל הפסקות באגרוז. הצלחת יכולה להיות מאוחסנת הפוך ב 4 °C (65 °F) במשך 2-4 שבועות.
- 30 דקות לפני microinjection, להוציא את הצלחת מהמקרר ולהוסיף E3 מראש מחומם ל 28 °C (50 °F) כדי לתת לו להתייצב בטמפרטורת החדר.
- הכנת תערובת הזרקה
- כדי להכין את תערובת ההזרקה, לדלל 1 מיקרואורגניזמים מיקרואורסצנטיים (פוליסטירן, לא פלואורסצנטי) ביחס 1:5 במים חופשיים RNase.
- הכן mRNA לביטוי חולף של סמנים פלואורסצנטיים או ביטוי של מבני גנים רקומביננטיים ו / או הזרקה משותפת של מורפולינו בריכוז הרצוי.
הערה: תערובת הזרקה טיפוסית להזרקה משותפת של microbeads יחד עם 100 pg של mRNA לכל עובר לתייג, למשל, את הגרעין עם H2A-mCherry הוא: 1 μL של חרוזים + 1 μL של mRNA (ריכוז המלאי הוא 1 מיקרוגרם / μL) + 2.5 μL של מים חינם RNA + 0.5 μL של פנול אדום (פתרון מלאי 0.5%, אדום פנול אינו חובה; הוא משמש להדמיה טובה יותר של הטיפה המוזרקת אבל הזרקה ללא תווית טיפה גלויה גם עבור נסיין מנוסה). הזרקת RNA יכולה גם להיות שימושית כדי לבחור עוברים מוזרקים. חיידקים פלואורסצנטיים יכולים להיות מוזרקים, במקום לא פלואורסצנטיים, כדי לדמיין אותם.
- טעינה וכיול מחט מיקרו-ג'ינקציה
- הפעל את המיקרו-מקטור באמצעות האפשרות Time-Gated . הגדרה זו חשובה מאוד לכיול עוצמת ההזרקה כראוי. הגדר את זמן ההשתתפות בכ- 500 אלפיות השנייה.
- טען 3 μL של תערובת ההזרקה לתוך המחט באמצעות פיפטה מיקרו-מטעין.
- הכנס את המחט לתוך המיקרו-מניפולטור ואטם בחוזקה. בדוק אם המיקרו-מניפולטור נמצא במצב טוב ויש לו מספיק חופש לנוע בכיוון x-y על צלחת ההזרקה.
- מדוד את גודל הטיפה באמצעות שקופית מיקרומטר (5 מ"מ / 100 חטיבות) עם טיפה של שמן מינרלי על גבי 45 ופליטת טיפה של תערובת ההזרקה ישירות לתוך השמן המינרלי.
- חותכים את המחט עם מלקחיים חדים בזווית תלולה כדי ליצור קצה מחודד חד. התאם את גודל הירידה ל- 0.1 מ"מ, המתאים ל- 0.5 nL של חומר מוזרק.
הערה: אם על ידי חיתוך המחט, אמצעי אחסון זה הוא חריגה, מומלץ לבצע שוב את הליך הכיול עם מחט חדשה. ניתן לכוונן מעט את זמן ההשתתפות של המיקרו-מקטור כך שיתאים לעוצמת הירידה; עם זאת, זמני gating קצרים תואמים קוטר מחט גדול, אשר עלול לפגוע בעוברים.
- מיקרו-הזנה של עוברים דגי זברה בשלב של תא אחד
- לאסוף עוברים דגי זברה זמן קצר לאחר ההפריה עבור microinjection של תערובת חרוזים ישירות לתוך עובר שלב תא אחד (זיגוטה) לפני חלוקת התא הראשון מתרחשת.
הערה: זה מבטיח חלוקה נכונה של מיקרוספרות ותשואה גבוהה מספיק של blastomeres מבודד עם לפחות מיקרוספירה אחת לכל תא בשלבים התפתחותיים מאוחרים יותר שבהם מבוצעים ניסויים (שלב blastula-gastrula). עדיין ניתן לבצע ניסויי כניסה אם יש שתי ספירות בתוך התא, אך יש להחריג תאים שאין להם חרוזים (למרות שכניסה ללא כדורים אפשרית). זני WILDTYPE AB שימשו בפרוטוקול זה, אבל כל זן אחר, למשל, TL ניתן להשתמש. - הניחו עוברים של שלב חד-תאי (זיגוטה) בתבנית משולשת בצורת משולשת טרום-זהירה של 1% אגרווז, כפי שמוצג באיור 1A, באמצעות פיפטת פסטר מפלסטיק.
- הסר מדיום נוסף עם אותה פיפטה כדי למנוע את העוברים צפים מסביב. דוחפים בעדינות את העוברים לתוך התבנית המשולשת באמצעות מברשת. שמרו על רווח מסוים בין העוברים כדי להקל על הכיוון הנכון (איור 1B).
- יישרו בעדינות את העוברים עם מברשת כך שהעוברים יהיו מכוונים לרוחב, כאשר התא האחד של הזיגוטה יהיה גלוי בבירור, כפי שמוצג באיור 1B. אוריינטציה אידיאלית למיקרו-חדירה מגיעה כאשר התא האחד של העובר פונה לכיוון המחט (הזרקה דרך מוט החיה של העובר) או בכיוון ההפוך מול תא החלמון (הזרקה דרך הקוטב הצמחי של העובר), כפי שמוצג באיור 1C.
- החזק את המנה ביד אחת והשתמש ביד השנייה כדי למקם את קצה המחט באמצעות בקר micromanipulator. מנמיכים את קצה המחט לכיוון העוברים.
- לנקב את הכוריון ולהיכנס העובר תא אחד עם המחט תוך ניטור ההליך באמצעות סטריאומיקרוסקופ. ודאו מיקום נכון של המחט, ולאחר ההזרקה, את המיקום הנכון של הטיפה המוזרקת כפי שמוצג באיור 1C.
- חוזרים על הפעולה עבור כל העוברים: להזיז את המחט למעלה, להחליק את המנה עם העוברים עד העובר הבא מרוכז, להוריד את המחט, ולהזריק אותו.
- לאחר כל סט העוברים מוזרק, להסיר את העוברים מן עובש agarose / צלחת פטרי על ידי שטיפה כמה E3 ולשים אותם בצלחת פטרי חדשה באמצעות פיפטה פסטר פלסטיק. מומלץ להניח מדיה מספקת על צלחת ההזרקה כדי למנוע ייבוש של עוברים במהלך הליך microinjection.
- חזור על ההליך עד למספר העוברים הרצוי מוזרק. עוברים חייבים להיות בשלב אחד של התא כדי להבטיח התפשטות מקסימלית והומוגנית של החרוזים.
הערה: הליך זה מותאם לעוברי blastula מוקדמים וסביר להניח שיש למטב אותו אם יש לחקור שלבים התפתחותיים שונים. - מניחים את העוברים המוזרקים בתוך אינקובטור בטמפרטורה של 28-31 מעלות צלזיוס למשך כ-4 שעות או עד לשלב הרצוי (איור 1D) לפני שתמשיך בפרוטוקול לתרבות התא הראשית.
הערה: באופן אופציונלי, תן לעוברים להתפתח מעבר לשלב הבלסטולה (או נקודת זמן המדידה הרצויה) כדי להבטיח הישרדות ולשלול ממצאי רעילות. בשלבי זחלים, הר זחלים מרדימים עם tricaine ב 0.75% agarose ולדמיין את התפלגות של מיקרוספרות ברקמות שונות. כדי ליצור תמיסת מלאי, יש לערבב: 400 מ"ג אבקת טריקאין ב-97.9 מ"ל של מים מזוקקים, כ-2.1 מ"ל של 1 מ"ל בסיס TRIS (pH 9), ולהתאים ל-pH 7. פתרון זה ניתן לאחסן ב 4 °C (65 °F). כדי להשתמש בטריקאין כהרדמה, לדלל 4.2 מ"ל של פתרון מלאי ב 100 מ"ל של מדיום ביצה (או מדיה רצויה); במקרה זה, E3 שימש. עיין בהפניה46 לקבלת פרטים.
- לאסוף עוברים דגי זברה זמן קצר לאחר ההפריה עבור microinjection של תערובת חרוזים ישירות לתוך עובר שלב תא אחד (זיגוטה) לפני חלוקת התא הראשון מתרחשת.
2. הכנה והכתמה של תא יחיד
- מניחים את העוברים שלב הכדור (4 hpf, שעות לאחר ההפריה) בצלחת זכוכית באמצעות פיפטה פסטר פלסטיק. בחר את העוברים כי הם חיוביים עבור האות של החרוזים המוזרקים, אשר מבטאים את חלבון פלואורסצנטי במקרה של הזרקת mRNA. עוברים מסוימים עשויים להראות קיבוץ חרוזים גבוה וניתן לא לכלול אותם.
- באופן ידני dechorionate העוברים באמצעות מלקחיים. מעבירים כ-10-15 עוברים למיכלי תגובה של 1.5 מ"ל באמצעות פיפטת פסטר מזכוכית.
הערה: כאשר העוברים הם dechorionated, הם מתחברים לפלסטיק, ואת השימוש בכלי זכוכית נדרש. כחלופה לצלחת הזכוכית, ניתן להשתמש בצלחת פטרי מפלסטיק עם שכבה דקה של 1% אגורוז. dechorionation ידני צריך להיות מועדף על פני טיפול Pronase אנזימטי כדי למנוע נזק פרוטאוליטי לחלבונים פני התא ושינויים פוטנציאליים במאפייני התא והרקמות מכניים, מניעת התאוששות ממושכת פעמים 47.
- באופן ידני dechorionate העוברים באמצעות מלקחיים. מעבירים כ-10-15 עוברים למיכלי תגובה של 1.5 מ"ל באמצעות פיפטת פסטר מזכוכית.
- הסר את מדיית E3 והוסף 500 μL של מדיום תרבית רקמות עצמאית CO2 שחומם מראש (DMEM-F12; עם L-גלוטמין ו 15 מ"מ HEPES, ללא סודיום ביקרבונט ואדום פנול בתוספת 10 יחידות פניצילין ו 10 מ"ג / L סטרפטומיצין).
הערה: אין להשתמש במדיה התלויה בפחמן דו-חמצני אלא אם נעשה שימוש באינקובטור מיקרוסקופ. השימוש, למשל, ב- RPMI בתנאים חוצצי קרבונטים גורם לשינויים ב- pH של המדיה ויכול להשפיע על הישרדות התאים. היבט מרכזי נוסף הוא להימנע ממדיה תרבותית המכילה סרום. סרום עשוי להכיל חומצה ליזופוספטידית (LPA), מפעילה רבת עוצמה של מסלול Rho/ROCK, המסוגלת לשלוט בהתכווצות התאים ובתנועתיות בתאי גזע של אבות6. osmolarity של המדיום צריך להישמר ב 300 mOsm כדי למנוע אתגרים אוסמוטיים שעלולים להפריע מורפולוגיה גרעינית או מכניקה12. - נתק תאים באופן ידני על ידי ניעור עדין של הצינור. ודא כי התוכן של הצינור להיות עכור ללא נתחים גדולים גלויים על ידי העין. הימנע היווצרות של בועות כדי למזער את הנזק ואובדן של תאים.
- צנטריפוגה ב 200 x g במשך 3 דקות. הכדור חייב להיות גלוי בבירור.
- הסר את supernatant ובצע את אחד השלבים המפורטים להלן.
- אם אין צורך בהכתמה, הוסף 500 μL של DMEM. בעדינות resuspend עם פיפטה 200 μL על ידי מיקוד סילון נוזלי על הכדור. אין להפעיל כוח גזירה מוגזם על התאים. הקצפה מצביעה על נזק לתאים.
- לתיוג הגרעין עם צבעי DNA כגון Hoechst, לערבב 0.5 μL של DNA-Hoechst (מלאי 2 מ"ג / מ"ל) ב 1,000 μL של DMEM כדי להשיג 1 מיקרוגרם / מ"ל של ריכוז סופי. הוסיפו 500 μL של תמיסת כתמים זו לתאים והוסיפו מחדש בעדינות. דגירה במשך 7 דקות בחושך.
- כדי להכתים את התאים עם מחוון סידן כימי פלואורסצנטי Calbryte-520, להוסיף Calbryte-520 לריכוז 5 מיקרומטר ב- DMEM. דגירה במשך 20 דקות בחושך.
הערה: הפרוטוקולים המצוינים בשלבים 2.5.2 ו- 2.5.3 עברו אופטימיזציה עבור מוצרים ספציפיים אלה. כתמים אחרים יכולים להתבצע באמצעות הפרוטוקולים שצוינו על ידי היצרן.
- צנטריפוגה שוב משתמשת באותן הגדרות כמו בשלב 2.4; להסיר את supernatant, בעדינות resuspend התאים (כדי למנוע היווצרות של אשכולות) ב 50 μL של DMEM עבור דגימות בהשעיה או 20 μL של DMEM עבור תאים בכליאה.
3. הכנת תאי השמנה אופטיים באמצעות ריווח פולידימתילסילוקסן (PDMS)
הערה: מדידות כוח אופטיות המבוססות על זיהוי מומנטום אור דורשות לכידה של כל האור היוצא מהמלכודות האופטיות40. עבור החוסן של גורם הכיול invariant α (pN /V), התפלגות האור במישור המוקד האחורי (BFP) של חיישן הכוח האופטי חייבת לשאת התאמה מדויקת לתנופת הפוטון. זה קובע את המרחק מפני השטח של העדשה האוסף למישור הלכידה לכ -2 מ"מ, שהוא הגובה המרבי של תאי ההשמנה האופטיים.
- ציפוי ספין PDMS של מנות תחתונות זכוכית #1.5.
הערה: המתכון הבא מסופק עבור כ 40 מנות. למיקרו-צ'מבר המתקבל יהיו גבהים שונים בהתאם לשאלה אם יש לבצע ניסויים בתאים מושעים או מוגבלים (איור 1D).- יש לערבב 9 מ"ל של PDMS פולימר הבסיס ו-1 מ"ל של חומר ריפוי PDMS בצינור חרוטי של 50 מ"ל. ערבבו את שני המוצרים באופן פעיל כדי להבטיח הפצה נכונה של סוכן הריפוי.
- Degas התערובת כדי למנוע בועות באמצעות משאבת ואקום. הצג את הצינור החרוטי בבקבוק ואקום ולפנות את התא. המתן עד שלא יהיו בועות בתערובת.
הערה: פתח את הוואקום לאט כדי למנוע קצף ושפיכות של PDMS מתוך צינור הבז. - מניחים את צלחת הזכוכית התחתונה על צ'אק מעיל הספין (איור 2A). להיות עדין לא לגרד, טביעת אצבע, או ללכלך את המנה. הגן על תיבת מעיל הספין מפני דליפות PDMS עם רדיד אלומיניום.
- עבור תאי OT לניסויים על תאים בהשעיה, להוסיף כ 250 μL של תערובת PDMS במרכז המנה התחתונה לסובב אותו ב 750 סל"ד במשך 1 דקות. הגובה של שכבת PDMS יהיה 50 מיקרומטר כ 48.
- עבור תאי OT לניסויים על תאים מוגבלים, להוסיף טיפה קטנה של PDMS (כ 50 μL) ולסובב אותו ב 4,000 סל"ד במשך 5 דקות. הגובה של שכבת PDMS יהיה 10 מיקרומטר בקירוב. לקבלת פרוטוקול מפורט אודות אופן השגת עוביים שונים של PDMS, ראה reference48.
- רפא את הכלים עם תחתית הזכוכית מצופות PDMS בטמפרטורה של 70 מעלות צלזיוס למשך שעה אחת.
- חותכים ריבוע בגודל 1 x 1 ס"מ לשכבת PDMS עם אזמל ומקלפים אותו עם פינצטה (איור 2C). במקרה של תאים מוגבלים, לשטוף פסולת PDMS עם איזופרופנול.
- ציפוי תא לניסויים עם תאים מחוברים קלות בהשעיה
- הוסף 100 μL של Concanavalin A (ConA) ב 0.5 מ"ג / מ"ל כדי לכסות את כל פני השטח של החלל הריבועי ולתת לו לדגור במשך 30 דקות.
הערה: ConA הוא לציטין שנקשר לסוכרים על פני השטח של התא וזוגות תאים בודדים על פני השטח של העטיפה. - הסר את טיפת ConA ושטוף את פני השטח בזהירות עם מדיום DMEM מבלי לגרד את המשטח המטופל ConA.
- הוסף 30 μL של המדגם שהוכן בעבר (שלב 2.6) לתוך הבאר בעדינות resuspend כדי להיפטר מכל אשכולות התאים.
- סגרו את החלל על ידי הצבה עדינה של זכוכית כיסוי בגודל 22 x 22 x 22 מ"מ #1.5 על גבי חישוקי ה-PDMS (הימנעו מלתת לו ליפול בפתאומיות, השתמשו במלקחיים במידת האפשר, איור 2B,C).
הערה: כל עובי כיסוי יעבוד עבור כיסוי הזכוכית העליונה (העדשה האוסף יש מרחק עבודה של 2 מ"מ).
- הוסף 100 μL של Concanavalin A (ConA) ב 0.5 מ"ג / מ"ל כדי לכסות את כל פני השטח של החלל הריבועי ולתת לו לדגור במשך 30 דקות.
- הכנה קאמרית לניסויים בתאים בכליאה
- שים טיפה של 10 μL של פתרון המכיל תאים (שלב 2.6) לתוך החלל הריבועי (איור 2B).
- בעדינות רבה, כריך את המדגם עם זכוכית כיסוי 22 x 22 מ"מ כך טיפה מתפשטת בכל האזור ולא נצפו בועות. שוב, נוח להשתמש במלקחיים, כפי שמוצג באיור 2C, כדי למנוע מזכוכית הכיסוי ליפול בפתאומיות.
4. אפשרויות חלופיות עבור מרווח תא OT
הערה: ניתן לבצע שלבים אלה אם אין סדנת מיקרו-פבריקציה או מעיל ספין זמינים.
- הכנה קאמרית לניסויים עם תאים בהשעיה
הערה: במקרה שאין מעיל ספין זמין, spacer יכול להיעשות באמצעות סרט ויסקי רגיל, דו צדדי (כ 100 מיקרומטר גובה).- חותכים חתיכה של נייר דבק דו-צדדי עם חור מרובע בגודל של כ-10 ס"מ על 10 ס"מ במרכז (אותם ממדים כמו ב-PDMS, איור 2B).
- הסר את אחת משכבות המגן של הסרט על ידי קילוף אותו והנח את הצד החשוף של הסרט במרכז צלחת תחתית זכוכית #1.5 H. לחץ בעדינות כדי לקבל את כל פני השטח דבוקים הזכוכית תוך הימנעות בועות אוויר, ולאחר מכן להסיר את שכבת המגן הנותרת של הסרט על ידי קילוף אותו.
- בצע את ההוראות בשלב 3.2.
- הכנה קאמרית לניסויים בתאים בכליאה
הערה: כדי להגביל במדויק תאים, מיקרו-חלקיקים חד-ממדיים עם קוטר ידוע יכולים לשמש כמרווחים בין שתי כוסות הכיסוי.- הוסף 10 מיקרומטר פוליסטירן חרוזים לתאים מושעים בריכוז של 104 חרוזים / μL.
- שים טיפה 10 μL של פתרון המכיל תאים וחרוזים על זכוכית כיסוי 22 x 60 מ"מ.
- בעדינות רבה, כריך את המדגם עם עוד 22 x 60 מ"מ לכסות זכוכית, כך טיפה מתפשטת בכל האזור ולא נצפו בועות. כדי למקם את זכוכית הכיסוי העליון בעדינות (למנוע את זה נופל בפתאומיות), זה נוח להשתמש מלקחיים.
- כמו המדגם יכול להתייבש, מומלץ לבצע את ההכנה במהירות.
5. הגדרת המלכודת האופטית למדידות תאיות
הערה: השלבים הבאים ממוטבים לפלטפורמת פינצטה אופטית מסחרית הכוללת מודול מיקרו-מניפולציה אופטי המבוסס על הסטה אקוסטו-אופטית (AOD) וחיישן כוח אופטי המבוסס על זיהוי ישיר של שינויים בתנופת האור (איור 2, reference12,40,49). פרטים ורכיבים אופטיים של ההגדרה ניתן למצוא באיור 2F. כדי לבחון עיוות שנגרם על ידי כוח במהלך מניפולציות פינצטה אופטית, מיקרוסקופ קונפוקו ספינינג-דיסק Nipkow מצמיד לתוך היציאה השמאלית של מיקרוסקופ הפוך להדמיית פלואורסצנטיות צבע כפול. ללא חוסר כלליות, ניתן ליישם פרוטוקול זה עם כל מערכת OTs דינמית המצוידת במדידות כוח ישירות המבוססות על זיהוי מומנטום אור. הליכים מפורטים שלב אחר שלב זמינים לבניית השמנות הדרגתיות אופטיות ביתיות עבור יישומי vivo50. אלה המבוססים על אפנון AOD להתבלט עבור ניסויים בסופו של דבר עם מלכודות מרובות ומדידות מהירות51,52. מספר פרוטוקולים לבניית מכשיר מבוסס תנופה אור קיימים בספרות36,39,40,53, וכל שיטת הדמיה אחרת (ניגוד הפרעות דיפרנציאליות, פלואורסצנטיות רחבת שדה וכו ') יכולה להיות מועסקת.
- סטארט-אפ פינצטה אופטי
- על מנת לייעל את יציבות עוצמת היציאה, הפעל את הלייזר בהספק גבוה במידה ניכרת (למשל, 3 W) לפחות 30 דקות לפני הניסוי.
- הפעל את מודול האלקטרוניקה של יחידות המיקרו-מניפיולציה האופטיות והפעל את יחידות המדידה הכפויות.
הערה: החל את כל אמצעי הבטיחות בלייזר והשתמש רק בציוד שאושר על ידי המועצה המוסדית. לעולם אל תשתמש בעפעפיים של המיקרוסקופ האופטי כאשר הלייזר פועל. השתמש תמיד במשקפי הגנת אינפרא-אדום מאושרים (OD7 בטווח של 950-1080 ננומטר), חסום את אור הלייזר של האינפרא-אדום עם התריס ביציאת האפיפלואורסצנטית 2 ואל תבצע את תוכנת ההשמנה האופטית עד לסיום יישור חיישן הכוח האופטי לאחר שלב 5.3. באופן כללי, אין להשתמש במדגם רפלקטיבי מאוד, שכן ההשתקפות האחורית עלולה לגרום נזק ללייזר. - שלוט בעוצמת ההשמנה באמצעות HWP המסתובב (איור 2F) בכניסה למודול המיקרו-מניפולציה האופטי.
הערה: מודול המיקרו-ניהול האופטי המסחרי המשמש בפרוטוקול זה כבר משלב תכונה זו. עבור מערכות השמנה אופטיות ביתיות, שלב כלי זה לשליטה בחשמל כך שניתן יהיה להשתמש בכוחות לייזר גבוהים ויציבים יותר.
- שימוש במיקרו-צ'מבר ריק לכיול
- חותכים ריבוע בגודל 1 x 1 ס"מ על נייר דבק דו-צדדי ומצמידים אותו למגלשת מיקרוסקופ בעובי 1 מ"מ.
- מוסיפים מים לכיכר וסוגרים אותם מלמעלה עם כיסוי מס' 1.5 (22 x 22 ממ). הוספת נפח מעט גבוה יותר של מים, למשל, 30-40 μL מומלץ להימנע בועות בתוך התא המקורה. יש לנגב את תא הכיול בעדינות במקרה של מים שנשפכים ממנו.
- יישור חיישן הכוח האופטי
- שים טיפת מים על המטרה 60x / 1.2 טבילת מים. הנח את תא הכיול על הבמה עם זכוכית הכיסוי #1.5 הפונה למטרה. התמקדו על פני השטח התחתונים, שם דגימות התאים יהיו בסופו של דבר.
- הוסיפו טיפת שמן טבילה על גבי מגלשת הזכוכית העליונה המכסה את הדגימה (איור 2D). מנמיכים את עדשת האיסוף של יחידת חיישן הכוח בזהירות עד שהיא יוצרת קשר עם טיפת השמן.
הערה: הטיפה חייבת להיות גדולה מספיק כך שהיא תכסה את כל העדשה שאוספת את אור הלייזר היוצא מהמלכודות. בדרך כלל, 200 μL מספיק כדי לכסות את כל פני השטח ולספק מגע טבילה יציב. להיות שמרני ולהימנע מילוי יתר כפי שהוא עלול לדלוף לתוך המדגם. - בהתאם לפרוטוקול היצרן ליישור חיישן הכוח האופטי, עיין בתמונת המישור לדוגמה במצלמת העזר שתשמש למיקום ה- OTs (AUX, איור 2F). בעדינות רבה, הנמיכו את חיישן הכוח האופטי עד לעצירת השדה (FS, איור 2F-G) מופיעים מחוברים למישור הדגימה. זה יבטיח מדידות כוח ישירות מתאימות מזיהוי מדגם-invariant של שינויי תנופה אור40.
הערה: סגור את ה- FS מספיק כדי שהתמונה שלו תהיה קטנה יותר משדה הראייה (FOV), ומכאן, גלוי. היזהר במיוחד ואל תדחוף את העדשה האוסף של חיישן הכוח האופטי כנגד המדגם. המיקום האנכי של חיישן הכוח האופטי יכול להיקבע לחילופין מניתוח התפלגות אור הלכידה ב- BFP עבור קונוסים קלים עם צמצם מספרי מוגדר (NA). - ודא כי אין בועות אוויר בטיפת הנפט; אלה יכולים להשפיע ישירות על מדידות הכוח. כדי לבדוק אם קיימות בועות אוויר, הניחו את עדשת ברטרנד במקומה (BL, איור 2G) והתבוננו בנתיב ההדמיה דרך העינית. אם יש צורך בעפר או בבועות אוויר או שיש צורך בשמן נוסף (איור S1A), נקו את העדשה והתא ברקמת עדשה נטולת אבק וחזרו על ההליך בשלבים 5.3.2 ו-5.3.3.3. נתיב אופטי ללא הפרעה מתואר באיור S1B.
- באמצעות הברגים לרוחב המונחים על המחזיק של חיישן הכוח האופטי, מרכז את ה- FS לתוך ה- FOV. לדיוק, פתחו את ה-FS כך שהוא כמעט ימלא את ה-FOV הנראה במצלמת העזר (AUX, איור 2F).
6. אופטימיזציה פינצטה אופטית
הערה: מדידת הכוח הישיר מסתמכת אך ורק על שינוי תנופת האור הנובעת מהכוח המופעל על החלקיק הלכוד, ולכן, בניגוד לשיטות עקיפות, אין צורך לכייל נוקשות מלכודת לפני כל ניסוי. ההמרה הספציפית לכלי של גורם הסטה/כוח (α; pN/V, reference41) מכוילת על ידי היצרן ולכן היא ניסוי invariant. עם זאת, מכיוון שנקודת הלייזר עוברת מניפולציה על שטח של 70 מיקרומטר x 70 מיקרומטר, שלבים 6.2-6.5 הם קריטיים כדי להבטיח השמנה ויציבות הספק אופטימלית. השלבים הבאים מסופקים בתוכנת היצרן כך ש- OTs מקבלים מיטוב מעל אזור העבודה באופן חצי אוטומטי.
- הפעל את תוכנת ה- OTs ואת תוכנת הרכישה עבור AUX המצלמה.
- הפחת את בסיס המתח ההתחלתי על-ידי לחיצה על שלב 1: היסט אלקטרוניקה בתפריט המשנה כיול המערכת של תוכנת הנהיגה פינצטה אופטית.
- כדי לבצע שיטוח כוח השמנה על-פני אזור העבודה OT, הגדר את עוצמת ההשמנה לחצי מהמקסימום שלה על-ידי סיבוב HWP בהתאם. אל תשנה את עוצמת ההשמנה על-ידי שינוי פלט הלייזר, אלא באמצעות ה-HWP המסתובב (איור 2F). לחץ על שלב 2: כוח ליזום את השגרה האוטומטית לשיטוח כוח מלכודת.
הערה: זהו צעד קריטי לפיצוי על וריאציה של עוצמת ההשמנה באזור העבודה של ה- OTs (איור S1D). שגרה מוצלחת מורידה את וריאציית כוח המלכודת ל-2% באזור העבודה של ה-OTs ומתכנסת לאחר 2 דקות. - כדי לבצע כיול מיקום השמנה, הסר את מסנן האינפרא-אדום כך שהאור מהלייזר יהיה גלוי במצלמה. מצא את נקודת האינפרא-אדום על-ידי הגדרת מישור התמונה הממוקד על פני השטח התחתונים של המיקרו-צ'מבר. השג את נקודת האינפרא-אדום הקטנה ביותר האפשרית על-ידי כוונון מישור התמונה (מיקום אובייקטיבי) וניגודיות ההיסטוגרמה בתוכנת רכישת AUX של המצלמה. במידת הצורך, הפחיתו את עוצמת המלכודת האופטית על-ידי סיבוב ה-HWP (איור 2F). לחץ על שלב 3: מיקום כדי להתחיל את השגרה האוטומטית או כיול מיקום השמנה.
הערה: שגרה זו מאפשרת התכתבות מדויקת של קואורדינטות המיקום של ה- OT במצלמה AUX לזוויות ההיגוי של AOD. שגרה מוצלחת יוצרת את מיפוי הזווית למיקום תוך מספר שניות. - פיצוי מומנטום ראשוני
הערה: תנועת המלכודת האופטית על פני המדגם גורמת לשינויים בהתפלגות תנופת האור ב-BFP (איור S1E, F). הדבר מוביל לשינויי אותות בלתי תלויים בכוח הקשורים למיקום הלייזר מעל אזור העבודה, למרות שכוח המלכודת הושטח כמו בשלב 6.3. התוצאה היא שונות בקו הבסיס של הכוח בשל מיקום (ללא תלות בכוח בפועל הפועל על החרוז הלכוד אופטית) שיש לתקן לפני כל ניסוי.- הגדר את עוצמת המלכודת שתשמש בניסויים, על-ידי סיבוב ה-HWP (איור 2F).
- לחץ על האפשרות היסט כללי בתפריט המשנה כלים . פעולה זו תפתח את מסייע ביטול ההיסט של תוכנת הפינצטה האופטית המתקנת את בסיס המומנטום ההתחלתי.
- לחץ על היסט | מפצה על תיקון התנע ההתחלתי של משתנה המיקום.
הערה: אם שום שינוי לא ישפיע על הנתיב האופטי במהלך השבועות המתמשכים, מפות שיטוח כוח המלכודת (שלב 6.3) ומפות המיקום (שלב 6.4) יישארו בלתי-מובנות. לפיכך אנו ממליצים תמיד להשתמש באותו שילוב של אלמנטים אופטיים (מראות דיכרואיות, מסננים וכו ') שעשויים להשפיע על נתיב מלכודת הלייזר או לבצע שגרת שיטוח כוח מלכודת חדשה. לגבי פיצוי המומנטום הראשוני (שלב 6.5), היצרן של פלטפורמת ה- OTs מספק כיול תוך כדי תנועה שיש לשנות עבור כל כוח השמנה חדש והפעלה ניסיונית. שלבים 6.3 ו- 6.4 חייבים להתבצע בשקופית הכיול הריקה המתוארת בשלב 5.2. במדגם המכיל תאים או אובייקטים אחרים, שלב 6.5 צריך להתבצע ללא אובייקטים שעשויים לשנות פיזור אור באזור העבודה OTs.
- לחלופין, לכוד מיקרוספירה והזז את המלכודת במהירות ידועה בעת הקלטת אות הכוח. לדוגמה, הגדר את המלכודת לביצוע תנודה משולשת: אות הכוח המוקלט יהיה אות מרובע.
הערה: ערך הכוח צריך לגדול באופן ליניארי עם המהירות, בהתאם לכוח הגרירה הפועל על החרוז. בדיקה זו משמשת כבקרה חיובית כי מדידות כוח מתבצעות כראוי38. לחלופין, ניתן להשתמש בחיישן הכוח האופטי כדי להשיג את נוקשות ההשמנה האופטית, κ [pN/μm], ואת גורם כיול המיקום, β [μm/V], מניתוח ספקטרלי כוח35. תחת יישור נכון, גורם הכיול invariant המסופק על ידי היצרן הוא α = κ·β [pN/V].- הפעל קריאת כוח בזמן אמת על ידי לחיצה על מגרש 1 בתפריט המשנה מידות בתוכנת היצרן. זה יספק קריאה של כוח ההשמנה האופטי הנוכחי וכוח.
- פתח את תיבת הדו-שיח פרמטרי תנודה מתפריט המשנה כלים . הגדר צורת גל של רווח משולש בטבעות בורר הצורה והסוג, בהתאמה. כדוגמה, הגדר משרעת של 10 מיקרומטר ותדירות של 3 הרץ. זה יגרום כוח צמיג של כ 1 pN על חיידק עם קוטר של 1 μm38.
- בחלון AUX של המצלמה, לחץ באמצעות לחצן העכבר הימני על המיקרואורגניזם ובחר התחל תנודה. קריאת הכוח תהפוך לאות כוח מרובע עם מישורים ב-±1 pN.
- לחץ באמצעות לחצן העכבר הימני על המיקרואורגניזם ובחר הפסק תנודה.
7. ספינינג דיסק קונפוקלי מיקרוסקופיה
- הפעל את המיקרוסקופ הקונפוקלי של הדיסק המסתובב וציוד האבזור, את מנועי הלייזר המשולבים ואת מצלמות הרכישה.
- הפעל את תוכנת ההדמיה.
- הגדר ערוצי הדמיה עבור הכתמת Hoechst של הגרעין ו GFP עבור קרום פלזמה התא.
- הפעל את קווי לייזר העירור 405 ננומטר ו- 488 ננומטר.
- הוסף דיכרואי מרובה פסים כדי לשקף את העירור לדגימה וזה מאפשר לאור הנפלט לעבור למצלמות.
- לפצל את פליטת הפלואורסצנטיות עם מראה דיכרואית באורך 500 ננומטר.
- השתמש במסנני הפליטה DAPI/BFP (~ 445 ננומטר) ו- GFP (~ 521 ננומטר) מול שתי מצלמות הרכישה, בהתאמה. עיין באיור 2F, G.
- הגדר את זמן החשיפה ל- 100 אלפיות השנייה עבור כל ערוץ.
- הגדר פליטת לייזר כדי לקבל כוח של 5 mW במישור המדגם. כדי למדוד את הכוח, השתמש במד כוח מסחרי.
- הגדר את פרוטוקול ההדמיה. כדי למנוע דימום ספקטרלי מערוץ Hoechst לתוך ערוץ GFP, שני הצבעים צריכים להיות בתמונה ברצף.
הערה: אם קיים סינכרון חומרה בין ה- AODs של המלכודת האופטית לבין רכישת המצלמה, ודא שקוטביות הגורם המפעיל מוגדרת כראוי. במקרה של ספק, יש להיוועץ במנהל המתקן או עם יצרן המיקרוסקופ.
8. ביצוע ניסויי חריץ הגרעין
הערה: כבה תמיד את המלכודות האופטיות - הן באמצעות תוכנה והן סגירת התריס ביציאת epifluorescence 2 - בעת הרמת מודול חיישן הכוח ושינוי המדגם. אם לא, נזק חמור לאלמנטים אופטיים והנסיין עלול להתרחש. היזהרו עם המרחק הרוחבי בין מחזיק העדשה לקצה המנה התחתונה כשאתם מחפשים תאים כדי להימנע מהתנגשות העדשה בצלחת הבמה/התרבות (איור 2).
- מקם את הדגימה במיקרוסקופ ובצע את שלב 5.3 של פרוטוקול זה.
- באמצעות HWP המסתובב (איור 2F), הגדר את עוצמת המלכודת ל- 200 mW כערך התחלתי אם קשיחות הגרעין או המבנה התאי שנחקר אינה ידועה. תרגם את אזור העבודה OTs (באמצעות שלב המיקרוסקופ) למקום ללא תאים על מנת לפצות על בסיס המומנטום הראשוני עד שלב 6.5.
הערה: בהתאם לנוקשות של המבנה התת-תאי, יש להתאים את ערך כוח ההשמנה לערכים נמוכים או גבוהים יותר כדי לקבל עומק כניסה דומה. - באמצעות בקר התוכנה של שלב המיקרוסקופ, חפשו תא עם חרוז אחד או שניים באמצעות מיקרוסקופיה משודרת של ברייטפילד (איור 3A).
- הגדר מסלול מלכודת.
- פתח את תיבת הדו-שיח מסלול בתפריט המשנה כלים ובחר תזוזה בטבעת הבורר סוג מסלול .
- בגיליון המספרי, כתוב את ההעתקה והשעה של כל שלב מסלול עוקב. הנה שתי דוגמאות.
- לניסוי הרפיית מתחים, תכננו עומסים טרפזיים, כפי שמוצג באיור 3B. בטבלה S1, שתי חריצים טרפזיים הוחלו עם מרחק נסיעה של 5 מיקרומטר; מהירות של 5 מיקרומטר לשנייה; זמן המתנה לפני נסיגה: 10 s.
- לניסוי כניסה חוזר ונשנה במהירות קבועה כדי להשיג שגרה משולשת ללא זמן התעכבות על הגרעין, הגדר את משרעת המסלול, למשל, 5 מיקרומטר, ואת הזמן לשלב, למשל, 2 s למהירות של 2.5 מיקרומטר לשנייה. בטבלה S2, אפשרות זו מוחלת שמונה פעמים באותה מהירות.
הערה: ערכים אלה צריכים להיקבע עבור כל סוג תא וניסוי, אך הפרמטרים הבאים של שגרה טרפזית לוכדים את הדינמיקה החשובה ביותר בניסוי המוצג כאן. זמן ההמתנה צריך להספיק לגרעין כדי להראות את הרפיה הלחץ המלאה שלו לאחר הכניסה
- לכידת מיקרוספירה
- הגדר את מישור התמונה מעט מעל החרוז עם בקר התוכנה של שלב המיקרוסקופ.
- הפעל מלכודות באמצעות תוכנת OTs ולחץ על החרוז בחלון הדמיית AUX המצלמה (מכויל לאחר שלב 6.4). כליאה מוצלחת של החרוז על ידי המלכודת האופטית תפחית מאוד את תנועת החרוז.
- לחץ וגרור את החרוז על פני הציטופלסמה ומקם אותו במרחק של כ-2 מיקרומטר מהמעטפה הגרעינית (איור 3A). ודא כי המסלול מוגדר כך חריץ חרוזים מאונך לממברנה הגרעינית.
- לחלופין, במידת הצורך עבור מדידות מיקום של החרוז ביחס למלכודת, סרוק את המלכודת על פני החרוז כדי לקבוע את נוקשות ההשמנה, k [pN /μm]54, ובכך Δxbead = -F / k (ראה דיון). מודול המיקרו-מניפיול האופטי המשמש בפרוטוקול זה כולל שגרה מובנית למטרה זו.
- פתח את תיבת הדו-שיח סריקת חלקיקים בתפריט המשנה כלים .
- בחר את ההשמנה שברצונך לסרוק ותדירות גבוהה כשיטת הסריקה. בחר את הכיוון (x או y) של מסלול הכניסה עבור מדידת סריקת החרוזים.
- יופיע חלון עם מדידת נוקשות ההשמנה. בגרף, גרור את שני הסמנים כדי לבחור את אזור ההשמנה הליניארי המתאים ל- F = -kx. ההתאמה הליניארית לחלק הנתונים שנבחר תרועע באופן אוטומטי.
הערה: הגדר את המיקום ההתחלתי של החרוז הרחק מקרום התא (~ 5 מיקרומטר), כמו הסטות אור-מומנטום בממשק התא הבינוני להשפיע על ההתאמה של מדידות כוח. אם הגרעין ממוקם קרוב מדי לקרום התא, נסה להסיט פנימה את הגרעין מהאתר הנגדי. בטל את התא אם הדבר אינו אפשרי.
- התחל רכישת תמונה על ידי לחיצה על כפתור הרכישה בתוכנת ההדמיה.
- התחל מיקום השמנה וכפה שמירת נתוני מדידה על-ידי לחיצה על נתונים | שמור בחלון הקריאה בזמן אמת (נפתח כמו בשלב. 6.6.1).
הערה: המלכודת האופטית מצוידת בקלט הדק שניתן לחבר לפלט התזמון של המצלמה. לכן, נתוני תמונה וכוח מסונכרנים בחומרה והאלקטרוניקה מסוגלת למפות את מחזורי המלכודת עם מספר המסגרות של התמונות במהלך הרכישה. - הפעל את המסלול שנטען בעבר על-ידי לחיצה באמצעות לחצן העכבר הימני על החרוז ובחירה באפשרות התחל מסלול.
- חכה עד שהמסלול יסתיים והמערכת תתייצב.
- עצור שמירת נתוני מדידה של כוח השמנה. תיבת דו-שיח לשמירת נתונים תופיע.
הערה: כדי למטב את אחסון הנתונים, ניתן להשמיד נתונים על-ידי בחירת הפרמטר המשמיד בתיבת דו-שיח זו (10, 100 או 1000). - הפסק את רכישת התמונה והתווה את התוצאות בתוכנת לאחר העיבוד לפי בחירת המשתמש.
- אם המיקרוספירה אובדת במהלך השגרה ולא ניתן להסיט פנימה את הגרעין (איור S2), מחק את המדידה והגדל את העוצמה. שים לב שיש לחזור על שלב 6.5. בידינו, לפחות 95% מהשגרות הושלמו בהצלחה מבלי לאבד את החרוז מהמלכודת.
תוצאות
מיקרו-ג'ינטציה של חרוזים לוכדים:
מיקרוספרות שהוזרקו לעובר דגי הזברה של תא אחד התפשטו על כל מכסה בעלי החיים במהלך מורפוגנזה. להדמיה ברורה יותר, חזרנו על פרוטוקול ההזרקה עם מיקרואורגניזמים פלואורסצנטיים אדומים וצילמנו תמונות נפחיות עם מיקרוסקופ הקונפוקלי שלנו בשלבים התפתחותיים שונים. באיור 4A-D, חרוזים מוזרקים מתוארים בציטופלסמה של תאי גזע של אבות ב-vivo ב-5 hfp. מאוחר יותר, מיקרוספרות הופיעו פרושות על כל העובר במהירות של 24 כ"ס (איור 4E). עוברים בשני השלבים התפתחו כרגיל ושיעורי ההישרדות היו דומים לעוברים שאינם מוזרקים או מוזרקים מדומים (ראו איור S3). זה עולה בקנה אחד עם מחקרים אחרים המדווחים על הישרדות בלתי מעורערת של דגי זברה מוזרקים חרוזים עד 5 ימים לאחר ההפריה55.
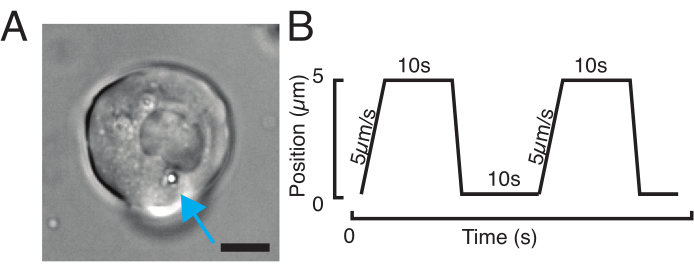
המיקרוסקופ הקונפוקלי של הדיסק המסתובב שלנו תואם למיקרוסקופיה פלואורסצנטית רב-ערוצית. באיור 5A, אנו מראים תאי גזע מבודדים עם חרוז אחד או שניים בציטופלסמה. ניתן להשתמש בתוויות פלואורסצנטיות מרובות כדי לחקור היבטים שונים של התא (איור 5B). ניתן לעקוב אחר מורפולוגיה גרעינית באמצעות צבע Hoechst או באמצעות ביטוי H2A::mCherry mRNA, בעוד קרום גרעיני פנימי ניתן לנתח עם Lap2b-eGFP12. דינמיקה של קליפת המוח actomyosin, כמו גם רמות סידן תאיים, ניתן לראות עם My12.1:::eGFP קו מהונדס56 ו Calbryte-520 דגירה, בהתאמה. הפרוטוקול שתואר כאן נועד להשוות את מכניקת גרעין התא של תאי בר משותקים על מצעים דביקים (המכונים מאוחר יותר השעיה) ובכליאה מכנית. תאי גזע מבודדים הכלואים במיקרוצ'מברים בגובה 10 מיקרומטר הציגו התפתחות חלקית של הממברנה הגרעינית הפנימית (INM) ועלייה מאוחרת יותר בהתכווצות actomyosin12. באיור 5C מוצגים תאים סגורים עם חרוז אחד או שניים בציטופלזמה. כליאה מוצלחת תהיה גלויה באמצעות תאים שטוחים ומורחבים עם חתך רחב יותר של הגרעין. הממברנה הגרעינית נפתחת עוד יותר בתאים סגורים ואמורה להיראות מוחלקת בהשוואה לתאים בהשעיה (איור 5C).
ניתוח כוח-זמן ועיוות כוח
ניתוח התוצאות שהושגו תלוי מאוד בדגימה הנחקרת ובשאלת העניין ולכן לא ניתן להכליל אותן כאן. כדוגמה, דרך נפוצה לנתח מדידת כניסה היא לחלץ מודולוס של יאנג על ידי התאמת מודל הרץ שונה לנתוני כניסת הכוח57. עם זאת, ההנחה לטיפול כזה צריכה להיות מוערכת בקפידה ולא תמיד להיות מוצדק כראוי (כגון המבנה הנחקר להיות איזוטרופי, הומוגני, עם גמישות ליניארית וכניסות להיות קטן יותר מרדיוס חרוזים). לכן אנו רואים כאן רק מדידות עצמאיות למודל המאפשרות להשוות את ההתנהגות המכנית של המבנה הנחקר בין תרחישים ניסיוניים שונים.
כנקודת התחלה, מדידת השיפוע של עקומת תזוזת הכוח בעומק כניסה מסוים מספקת מידה של קשיחות מבנית עצמאית מודל58 של הגרעין. לאחר מכן ניתן לאסוף ערך זה מדגימות מרובות ולהשוות אותו בין הגדרות ניסיוניות משתנות לבין הפרעות מדגם.
מדידת כניסה
בשורות הבאות, אנו מתמקדים בתגובה המכנית של גרעין התא במהלך עיוות התא בכליאה. ניסויים בשלב 8 של פרוטוקול זה בדרך כלל להוביל פסגות כוח של עד 200 pN עבור עומקים כניסה של כ 2-3 מיקרומטר. עם זאת, ערכים אלה יכולים להיות שונים במידה רבה, בהתאם לסוג התא ולתנאים הניסיוניים, עם גרעינים רכים יותר המובילים לכוח נמוך יותר עבור כניסה נתונה. לכן יש צורך למדוד במדויק את העיוות הגרעיני, יחד עם כוח, לאפיון מכני מדויק של גרעין התא. בחלק זה, נקבל את הנוקשות הגרעינית של התא ממדידות כניסת כוח ייצוגיות.
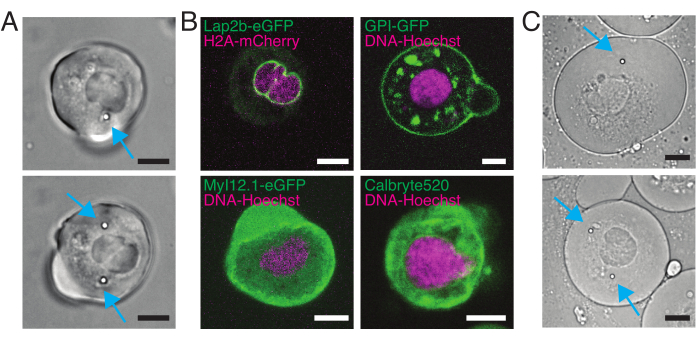
באיור 6, אנו מציגים את העיוותים של הצדדים הדיסטליים והקרובים של גרעין בתא תלוי ומרותק. ניתן לראות התנהגות מכנית עשירה. בתא מושעה טיפוסי על מצע דבק, הגרעין הוכנס בחוזקה על ידי החרוז, אך גם נעקר מעט על ידי אירועי דחיפה חוזרים ונשנים. מדדנו את כניסת החרוזים לגרעין על ידי ניתוח הקימוגרפים שהתקבלו מהדמיית פלואורסצנטיות של גרעיני תאים מוכתמים בהוכסט. הקימוגרפות חושבו בקלות באמצעות תוסף Multi Kymograph של פיג'י לאורך כיוון הכניסה (איור 6A,B) ויובאו ל- Matlab (גרסה 2021, Mathworks) לעיבוד נוסף. פונקציית שלב הותאמה לפרופיל העוצמה הגולמית במטרה לעקוב אחר הקצוות המפרידים של הגרעין לאורך המסלול של שגרת הכניסה. כפי שניתן לראות, הוא נושא מידע מדויק על השינוי הגרעיני בצורתו (איור 6 ואיור S2). השתמשנו בעקומה הכפולה-סיגמואידית הבאה כגרסה אנליטית של פונקציית שלב:
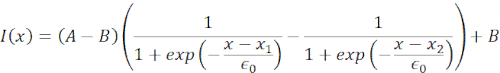 (משוואה 1)
(משוואה 1)
כאן, x1 ו- x2 מציינים את הקצוות הדיסטליים והפרקסימליים של הגרעין, בעוד ש- A ו- B הם הערכים המקסימליים והרקעיים של הערוץ הכחול (צבע הוכשט) של התמונה (איור 6B). רוחב הקצה נחשב (e0 = 0.25 מ"מ). בעוד שקצה הגרעין הפרוקסימלי (x2) בעל הסט פנימה עקב אחר המסלול המיושם על ידי שגרת המלכודת האופטית לאחר מגע המיקרוספירה-גרעין, הקצה ההפוך, הדיסטלי (x1) מציג דינמיקת הרפיה כצפוי עבור חומר ויסקולסטי כגון הציטופלסמה (איור 6D). לעומת זאת, גרעינים בתאים הסגורים במיקרו-צ'מברים בגובה 10 מיקרומטר אינם מפגינים התנהגות טרנסלוקציה כזו של הגרעין עם הכניסה לתא (איור 6B,D). כמו כן, באיור 6D, הקצוות האחוריים של הגרעינים נותרים ללא שינוי על ידי החרוז הדוחף מהצד הפרוקסימלי, ככל הנראה בשל כוחות חזקים יותר הנובעים התכווצות התא וחיכוך הפועלים נגד כוח הכניסה. כדי לקבל את עומק העיוות הנכון, ההעתק x1 הופחת מהמדד המוזרם x2: Δx = x2 - x1 (ראו גם איור 6D).
כפה ניתוח נתונים
הכוח הגורם לעיוות גרעיני נמדד מהשינוי בתנע האור שמקורו במיקרואורגניזם הלכוד אופטית (איור 7A). הכוח בעת החלת מסלולים טרפזיים (שלב 8.4.3, איור 7B) גדל בתחילה באופן ליניארי עד שהמלכודת הפסיקה לנוע, אך לאחר מכן נרגע לערך מצב יציב. התנהגות זו הצביעה על חומר ויסקולסטי המציג אובדן ומדולי אחסון. מיד לאחר אירוע הכניסה, הכוח הגיע לערך שיא, Fp, ואחריו הרפיה בלחץ (איור 7C):
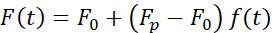 (משוואה 2)
(משוואה 2)
כאשר F0 הוא הכוח המאוחסן עבור הרכיב האלסטי ו- f(t) היא פונקציית הרפיה ללא ממדים. ניתחנו התנהגות זו בשלוש דרכים:
1. בהתחשב במוצק ליניארי סטנדרטי עם הרפיה מעריכית בלחץ, כלומר, f(t) = e-t/τ, המיוצג באופן סכמטי באיור 7C.
2. שימוש בריקבון כללי, כפול אקספוננציאלי:
F(t) = A + B1e-t/τ1 + B2e-t/τ2.
3. שימוש בחוק כוח ואחריו ריקבון מעריכי59:
f(t) = t-pe-t/τ, המצויד באיור 7C.
בעוד שההתאמה לדגם 1 יכולה להתבצע בצורה פשוטה, אנו ממליצים להעריך את הניחושים הראשוניים עבור (τ1, τ2) ו- (p, τ) עבור דגמים 2 ו -3, בהתאמה. ניתן לבצע זאת, בהתאמה, על-ידי התאמת קווים לנתונים בקנה מידה לוגריתמי-לעומת-ליניארי (איור 7D, משמאל) ולוגריתמי-לעומת-לוגריתמי (איור 7D, מימין). טבלה S3 מסכמת את התוצאות עבור הדוגמה שניתחה באיור 7. בסעיף הבא נשקול שילוב של חוק כוח וחוק אקספוננציאלי לאפיון מכניקת גרעין התא.
קשר תזוזת כוח
כמו כן, ניתן להשתמש בהגדרה הניסיונית המתוארת כדי להשיג את יחסי תזוזת הכוח של אירועי כניסה מרובים. על-ידי ביצוע שגרות משולשות (שלב 8.4.4, איור 8A), ניתן לקשר את הכוח לעיוות ולהתוות עקומת כניסת כוח. תוצאה מופתית מוצגת באיור 8B, שבו קו בסיס שטוח השתנה בצורה חלקה בשיפוע ברגע שהחרוז בא במגע עם הגרעין. זיהוי נקודת המגע האמיתית בנתונים הרועשים הוא אתגר, ויש לנקוט משנה זהירות כדי לראות אם אזור המגע מתאים לדגמים אלסטיים60. בניסוי מסוים זה, ניתן היה לראות גם כי הכניסות הבאות גורמות לעקומות עם נקודות מגע עמוקות יותר, מה שמעיד על התאוששות איטית מדי של צורה גרעינית לאחר נסיגה חרוזים ושינוי במחזור ההיסטרטי שהוגדר על ידי תכונות החומר הוויסקולסטיות של הגרעין (איור 8C). לכן, החוקר צריך להיות מודע אם זה קורה ולשלב את זה לתוך הצינור האנליטי, או להגביל את מספר המדידות הבאות, כך אפקט זה אינו משנה את המדידה.
מכניקת הגרעין בתאים בהשעיה ותחת 10 מיקרומטר כליאה
הגישה הנ"ל שימשה לניתוח הדינמיקה של הרפיה בלחץ גרעין בתאים מושעים על מצעים דביקים ותאים סגורים. התוצאות שלנו מראות שהכליאה גורמת להרחבת האזור הצפוי (איור 9A), אך שינוי לא משמעותי בנוקשות הגרעינית (איור 9B). מדדנו הרפיה דומה עם τ = 6.08 ± 1.1 s (לא מסוכם) ו τ = 4.00 ± 0.6 s (כליאה), אשר מצביע על פיזור ויסקולסטי מהיר, ואחריו ערך כוח מאוחסן התואם את מודולוס אלסטי של הגרעין. על מנת להסביר וריאציות ניסיוניות, אשר עשויות להיות מיוצרות על ידי תנאים ראשוניים שונים בשגרת הכניסה, כוחות מאוחסנים נמדדו היו מנורמלים לעומק הכניסה, כמו 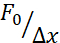 . פרמטר זה מסביר את קשיחות הגרעין ומתאר את הכוח, או את הלחץ, הנחוץ לכניסה מסוימת. השגנו קשיחות דומה תחת כליאה ובתאים לא מוגדרים:
. פרמטר זה מסביר את קשיחות הגרעין ומתאר את הכוח, או את הלחץ, הנחוץ לכניסה מסוימת. השגנו קשיחות דומה תחת כליאה ובתאים לא מוגדרים: 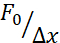 = 20.1 ± 12.6 pN / μm ו
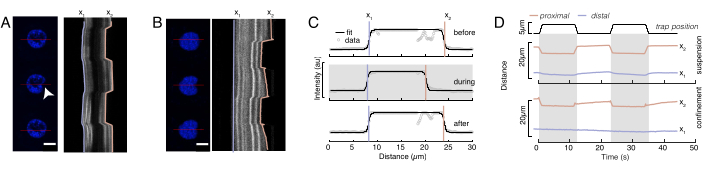
= 20.1 ± 12.6 pN / μm ו 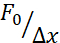 = 24.6 ± 13.6 pN / μm (ממוצע ± סטיית תקן), בהתאמה.
= 24.6 ± 13.6 pN / μm (ממוצע ± סטיית תקן), בהתאמה.

איור 1: מיקרו-הזנה של עוברים דגי זברה בשלב של תא אחד (זיגוטה). (A) צלחת הזרקה: צלחת הזרקה בצורת משולשת משמשת להזרקה. הצלחת עשויה מ-1% אגרווז אולטרה-פור ב-E3 (המדיום של הביצה). תצוגות עליונות וצדדיות מוצגות מימין. (B) מיקום העובר: כוון בעדינות את העוברים באמצעות מברשת וכוון כך שהתא הבודד נראה בבירור ונגיש בקלות עם המחט. אנו מציעים לכוון את העוברים עם התא הממוקם בצד הנגדי של המחט, כפי שמוצג בסקיצה. (ג) הליך הזרקה לתוך העובר שלב תא אחד: לנקב את הכוריון המקיף את העובר ואת התא הבודד עם המחט. ודא כי קצה המחט הוא בתוך התא ולשחרר את הלחץ להזריק. (ד) לדגור על העוברים בטמפרטורה של 28-31 מעלות צלזיוס עד שיתפתחו עד לשלב הבלסטולה (כדור) (4 כ"ס). בצע את פרוטוקול בידוד התא ואת כתמי התא (שלב 2) והכן את תא ההשמנה האופטי עם תאים מבודדים בהשעיה ו/או כליאה בשילוב עם ציפוי משטח המצע המתאים (שלב 3). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הכנת מנגנון הפינצטה האופטי. (A) שכבות ציפוי ספין של PDMS עם גובה מוגדר על כלים תחתונים מזכוכית. הירידה ב-PDMS תתפרס באופן שווה בגלל הכוח הצנטריפוגלי. (ב) הכנת תא הדגימה מתוך שכבת ה-PDMS. 1: לחתוך ריבוע עם אזמל, 2: לכסות את הבאר הפנימית עם concanavalin A (ConA), לשטוף ולזרע תאים; 3: לכסות עם שקופית זכוכית או להחליק לכסות כדי לאטום את הבאר. (ג) תמונה של חיתוך מרובע עם אזמל והסרת PDMS היטב עם מלקחיים. (D) הרכבה של עדשת האיסוף של חיישן הכוח האופטי מעל תא ההשמנה. טיפת שמן טבילה משמשת כאמצעי טבילה בין העדשה האוסף לכיסוי הזכוכית העליונה. סכמטי לא בקנה מידה. היזהר בעת הורדת העדשה האוסף כדי לא לגעת בכיסוי הזכוכית של צלחת מדגם. (ה) תמונה של יחידת איתור הכוח במגע עם המדגם. (ו) סכמטי של המערך הניסיוני. מודול המיקרו-מניפיולציה האופטי משתמש בקרן לייזר גל רציפה (5W, λ = 1064 ננומטר) עם בקרת הספק דרך צלחת חצי גל (HWP) ומפצל קרן מקוטבת (BS). לאחר מווסת עם זוג AODs, הוא מצמיד ליציאת epifluorescence העליונה של מיקרוסקופ הפוך. קרן הלייזר משתקפת לאחר מכן על ידי מראה דיכרואית קצרה של 950 ננומטר (IR-DM), המאפשרת העברה של עירור פלואורסצנטי ופליטה. לייזר ההשמנה מונחה לתוך החלק האחורי, יציאת אפיפלואורסצנטיות של המיקרוסקופ (הצריח העליון). ה- OTs נוצרים במישור המוקד של עדשה אובייקטיבית לטבילה במים (60x, NA = 1.2). חיישן הכוח האופטי נתון על ידי צריח המיקרוסקופ ולוכד את אור הלייזר היוצא מה- OTs עם עדשת טבילה גבוהה בנפט. במקביל, חיישן הכוח מאפשר תאורת שדה בהיר. יחידת הקונפוקל של הדיסק המסתובב מוצמדת ליציאה השמאלית. הוא מצויד בשני מנועי לייזר משולבים (ILE) השולטים בשבעה לייזרי עירור פלואורסצנטיים ושתי מצלמות sCMOS עם תאורה אחורית, המאפשרים הדמיית פלואורופור כפולה במקביל Abb: TI, Transilluminator; נ.ב., עצירת שדה; AOD, דפלקטור acustooptical; HWP, חצי צלחת גל; מצלמת, מצלמה (G) צילום של ציוד ההשמנה האופטי. עיגול אדום מציין את עדשת ברטרנד, שניתן להחליף לנתיב האופטי באופן ידני. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 3: בחירת הדגימות והפרמטרים הנכונים. (א) תמונה מייצגת של תא גזע מבודד של דגי זברה עם מיקרוספירה אחת הממוקמת קרוב מספיק לגרעין כדי לבצע את ניסוי הכניסה. סרגל קנה מידה = 10 מיקרומטר. (B) מסלול מלכודת למופת; עומק כניסה 5 מיקרומטר; מהירות כניסה = 5 מיקרומטר /s; זמן הרפיה 10 שניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: לוקליזציה של חיידקים בתוך עוברים של דגי זברה במהלך הפיתוח. 0.5 nL של 1 מיקרומטר חרוזים פלואורסצנטיים אדומים מוזרקים יחד עם GPI-GFP mRNA (100 pg/ עובר, קרום פלזמה) בעוברי WT כדי לדמיין לוקליזציה חרוזים. (א-ד) התפלגות של מיקרוספירה 5 h הזרקת פוסט בתוך עובר רכוב ב 0.75% agarose. (A) תמונת ברייטפילד ופלואורסצנטיות. החרוזים מפוזרים בצורה הומוגנית על פני רקמת העובר כפי שניתן לראות במיקרוגרף קונפוקלי. (B) הקרנה מקסימלית של פלואורסצנטיות קונפוקלית z-מחסנית. החרוזים מקודדים בצבע מסגול לצהוב בהתאם למיקום z שלהם בערימת התמונה. סגול/מגנטה מתאים לחרוזים/תאים החיצוניים ביותר (EVL; שכבת עוטף אפיתל; או תאי גזע של אבות הממוקמים קרוב לפני השטח של EVL), צהוב מתאים לחרוזים הפנימיים (תאים עמוקים של אבות), כפי שמוצג בסקיצה מימין. (C) גזירה והקרנה מרבית של תת-מחסנית של (B) המתאימה לאזור בתיבה הכתומה: חלק גדול מהתאים העמוקים מכילים 1-2 חרוזים. (D) גזירה והקרנה מרבית של תת-מחסנית של (B) המתאימה לתיבת מגנטה: חלק מתאי ה- EVL מכילים 1-2 חרוזים. (E) תמונת ברייטפילד והקרנה מקסימלית של מחסנית z של עובר 24 כ"ס מותקן ב 0.75% אגרווז ומורדם עם tricaine. עוברים היו דגירה מראש עם tricaine במשך 15 דקות. משמאל לימין: מיקרוספרות (קוטר 1 מיקרומטר), GPI-GFP וחפיפת תמונה. החרוזים מופצים בכל גוף העובר. ממד סרגל קנה המידה המצוין בכל חלונית. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 5: תאי גזע מבודדים של דגי זברה עם תיוג שונה. (A) תמונת מיקרוסקופיה אור שידור של תאי השעיה עם 1 (למעלה) או 2 (למטה) חרוזים מוזרקים. חיצי ציאן מצביעים על חרוזים. (B) תמונות קונפוקליות פלואורסצנטיות של תאי השעיה עם כתמים שונים. משמאל למעלה: Lap2b-eGFP (קרום גרעיני פנימי, 80 pg/עובר) ו- H2A-mCherry. מימין למעלה: GPI-GFP (קרום פלזמה, 100 pg/ עובר) ו- DNA-Hoechst (מוכתם כמתואר בסעיף 2). משמאל למטה: MyI12.1-eGFP (קו מהונדס) ו- DNA-Hoechst. מימין למטה: Calbryte488 ו- DNA-Hoechst (מוכתם כמתואר בסעיף 2). (ג) תמונת מיקרוסקופיה של אור שידור של תאים מוגבלים עם 1 (למעלה) או 2 (למטה) חרוזים מוזרקים. חיצי ציאן מצביעים על חרוזים. סרגלי קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 6: הערכת עיוות גרעיני מסרטי דיסק מסתובבים. (A,B) זמן לשגות של ניסוי חריץ של הגרעין ב(A) תא מושעה ו-(B) תא מוגבל. סרגל קנה מידה 10 מיקרומטר. תמונות מייצגות של גרעינים המסומנים על ידי Hoechst מוצגות 5 שניות לפני, במהלך, ו 5 שניות לאחר הכניסה עם מיקרוספירה לכודה אופטית (ראש חץ לבן). קימוגרפיות לאורך מקטע הכניסה (קו אדום, החלונית הימנית). x1 ו- x2 הם הגבולות הדיסטליים והפרוקסיביים (קרוב לחרוזים) של הגרעין במהלך ניסוי הכניסה שחולצו מההתאמה של פרופיל האינטנסיביות למשוואה 1. (ג) פרופילי עוצמה לאורך מקטע הכניסה עבור שלוש מסגרות שונות (לפני, במהלך ואחרי הכניסה) והותאמו למשוואה 1 כדי להעריך את המיקומים הדיסטליים, ה- x1 והקומקסימליים, x2, של קצות הגרעין. (D) מסלולים מייצגים של x1(t) בכחול ו- x2(t) בענבר במהלך ניסוי כניסה של תאים מושעים ומוגבלים (10 מיקרומטר). אזורים מוצללים מציינים את הכניסה, המרחק בין x1 ל- x2 מציין את קוטר הגרעין. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
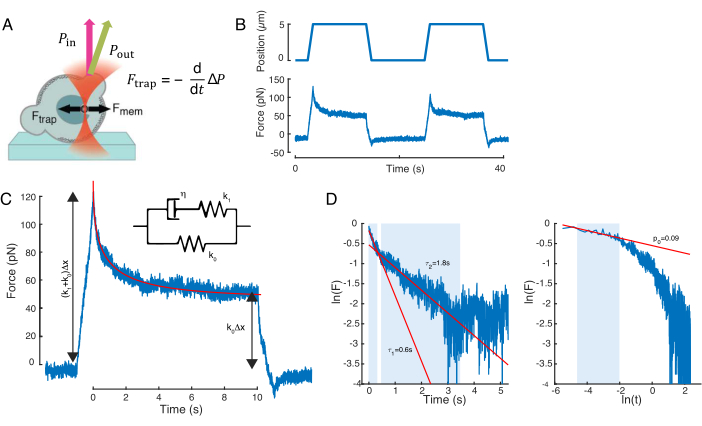
איור 7: עיבוד אותות כוח. (א) סכמטי של מיקרוספירה לכודה אופטית מעוותת את גרעין התא עם הכניסה. קרום גרעיני וכוחות אופטיים מסומנים על ידי החצים השחורים. השינוי בתנופת הקרן מסומן על ידי החץ הירוק Pout. (ב) מסלול מלכודת (למעלה) וכוח (למטה) שחווים המיקרוספירה הלכודה אופטית במהלך ניסוי חוזר ונשנה בכניסה גרעינית. (ג) כפה ריקבון הרפיה לאחר שיא הכוח בעומק הכניסה המקסימלי. Inset מציג סכמטי של מוצק ליניארי סטנדרטי שהדינמיקה שלו משוערת לתצפיות הפנומנולוגיות כאן. (ד) משמאל: לוגריתם של הכוח המנורמל לעומת הזמן. האזורים המוצללים מציינים את חלק הנתונים המשמש להתאמה לריקבון המעריכי הכפול (קווים אדומים). מימין: לוגריתם של הכוח המנורמל לעומת הלוגריתם של הזמן. האזור המוצל מציין את חלק הנתונים המשמש להתאמה לחוק החשמל. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
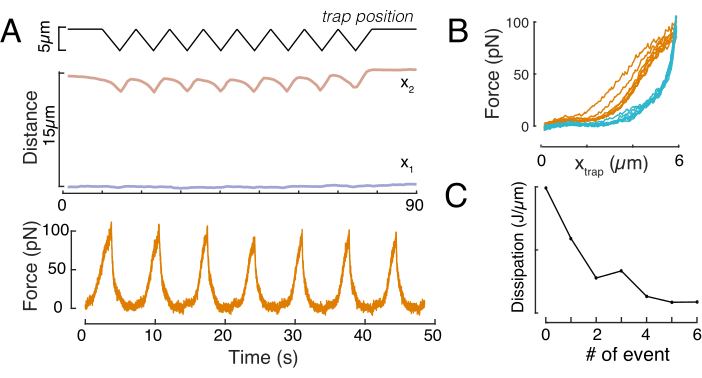
איור 8: שגרת כניסת כוח עם תזוזות מלכודת משולשות. (A) מסלול מייצג של x1(t) בכחול ו x2(t) בענבר במהלך ניסוי חריץ משולש שנערך על תא בגובה כליאה של 10 מיקרומטר. למעלה: מיקום מלכודת. אמצעי: ניתוח צורת גרעין. המרחק בין x1 ל- x2 מציין את קוטר הגרעין. למטה: אות כוח. (ב) כוח לעומת מיקום השמנה במשך שמונה חריצים רצופים. (ג) התפתחות הפיזור, הנגזרת מההיסטריה שבין חלק הגישה והנסיגה של עקומת ה- f-d, של הגרעין עבור כל אירוע כניסה עוקב. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 9. תכונות גרעיניות של תאים בהשעיה (משטח דבק) וכליאה משגרות טרפזואידיות. (A) שטח מוקרן של הגרעין מתאים בהשעיה ותחת 10 מיקרומטר כליאה. פס שחור מייצג את החציון. (ב) קשיחות גרעינית של תאים בהשעיה ותחת כליאה. פס שחור מייצג את החציון. ערכי P הנגזרים ממבחן קרוסקל-וואליס באמצעות MatLab. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה משלימה 1: מסלול טרפזי המוגדר על ידי תוכנת פינצטה אופטית. השורה הראשונה (השניה) היא המרחק x (y) שההשמנה תוסר באופן ליניארי. בשורה השלישית, משך השלב הנתון מוגדר בשניות. מסלול זה מורכב משבע נקודות ומתאים לטרפז שנטען פעמיים כנגד הגרעין באיור 7B. לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 2: מסלול משולש המוגדר על ידי תוכנת פינצטה אופטית. מקביל לטבלה 2, מסלול זה מורכב מ-16 נקודות, המתאימות לשמונה אירועי כניסה בעומק של 5 מיקרומטר ומהירות של 2.5 מיקרומטר לשנייה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 3: פרמטרים מתאימים לנתונים באיור 7. IG: ניחוש ראשוני. לחץ כאן כדי להוריד טבלה זו.
איור S1 משלים: יישור חיישן כוח אופטי ופיצוי בסיסי מומנטום. (א) עצירת שדה המצולמת במצלמת העזר (AUX, איור 2) דרך עדשת ברטרנד. בועת אוויר מופיעה בשמן הטבילה, שאינו נראה דרך העינית. (ב) נתיב אופטי נקי. ליישור מדויק, פתח את עצירת השדה והפוך אותה לחפוף עם חרוט האור NA = 1.2. (ג) תמונה של מישור הדגימה. הריבוע האדום מציין את אזור העבודה של OT. סרגל קנה מידה: 20 מיקרומטר. (D) כוח מלכודת נמדד על פני FOV, לאורך חצים כפולים לבנים המצוינים ב- C. באדום, שינוי צריכת חשמל של השמנה כאשר לא מוחל תיקון. בכחול, כוח המלכודת תוקן על כל שדה הראייה. (ה) רכיב X של בסיס המומנטום לאורך אותו טווח. במעקב אדום, לא מתוקן. בכחול, עקבות תוקנו עבור כוח מלכודת. בירוק, מעקב תוקן עבור תוכנית בסיסית של מומנטום באמצעות פיצוי היסט גלובלי בתוכנת היצרן. (ו) זהה ל- E, עבור רכיב ה- Y. שים לב שתחת פעולה רגילה, הרכיבים המוצללים משמשים למכניקה ומדידות כוח, למשל, רכיב כוח x במהלך התנועה לאורך קואורדינטת x ורכיב כוח y במהלך התנועה לאורך ציר ה- y. לאחר שכל התיקונים מיושמים, מתקבל רעש RMSD של <0.5 pN. נא לחץ כאן כדי להוריד קובץ זה.
איור S2 משלים: שגרה שנכשלה עקב מלכודות חלשות. (א) Kymograph המציג כניסת גרעין משגרה שנכשלה. רק עיוותים קצרים וחולפים נראים לעין עקב בריחה של החרוז מהמלכודת. חשוב לציין, לייזר הלכידה עדיין נע ללא חרוזים כדי להשלים את המסלול המוגדר מראש (קו מנוקד ירוק). סרגל קנה מידה = 10 מיקרומטר. (B) עליון: מיקום השמנה לעומת זמן. אמצע: תוצאת מעקב קצה של קצה הגרעין הפרוקסימלי והדיסטלי המוזרם פנימה. שים לב כי הקצה הדיסטלי אינו זז ללא הכניסה כפי שנצפה בדרך כלל עבור שגרות שהושלמו על תאים מבודדים על מצעים דביקים. למטה: כוח לעומת זמן המציג את אובדן המיקרוספירה המצוינת על ידי ירידה ברעש התרמי וירידה פתאומית לאפס כוח. נא לחץ כאן כדי להוריד קובץ זה.
איור S3 משלים: הישרדות של עוברים מוזרקים. עוברים שהוזרקו עם 1 מיקרומטר חרוזים ו 100 pg / עובר של mRNA בריכוזים המתוארים בפרוטוקול הושוו לעוברים שלא הוכנסו ואינם מראים הבדלים משמעותיים 24 שעות לאחר ההפריה. ממוצע וחריגת תקן של שלושה ניסויים עצמאיים עם N > 21 עוברים לכל תנאי לכל ניסוי. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
בפרוטוקול זה, אנו מתארים שיטה ייחודית לחקור את התכונות המכניות של גרעין התא בתוך התאים החיים. בשונה מטכניקות ספקטרוסקופיות כוח אחרות, השמנה אופטית לא פולשנית אפשרה לנו לנתק את תרומת קרום התא ואת הציטוסקלטון מהנוקשות הגרעינית של התא. חשוב לציין, מיקרו-מניפולציה אופטית תואמת למיקרוסקופיה רב-מודולרית, שתאפשר לנסיין לחקור תהליכים שונים המעורבים במכנוביולוגיה גרעינית של התא. כתוצאה מייצגת, השתמשנו בהכתמת DNA-Hoechst כדי למדוד את עיוות הגרעין על כניסה שבוצעה על ידי כוחות בסדר גודל של כמה מאות picoNewton.
יישומים פוטנציאליים של השיטה שלנו מעבר לדוגמאות המתוארות בפרוטוקול זה
האפשרות לחלץ מידע מכני כמותי ממדידות בתוך תאים חיים ללא הפרעות חיצוניות מאפשרת שפע של הזדמנויות חסרות תקדים שרק מתחילות להיחקר. לכן, הפרוטוקול המוצג של פלטפורמת המיקרו-מניפולציה האופטית שלנו יכול להיות מורחב לניסויים מורכבים יותר עם צדדיות רבה. דפלקטורים אקוסטו-אופטיים (AOD) יכולים ליצור השמנות אופטיות מרובות למדידות כוח סינכרוניות במיקומי תאים שונים, כמו גם ניתן להשתמש בהם למיקרו-התחממות פעילה בטווח תדרים רחב51,61. כפי שהוזכר, תגובת הכוח עם הכניסה יכולה להתגבר על כוח ההשמנה המרבי, מה שמוביל לבריחה של החרוז מהמלכודת האופטית. במקרה זה, ניתן להגדיר משוב כוח עם AOD על מנת להדק את הכוח האופטי. בסך הכל, גישות מיקרו-המיקרו-הסביבתיות מרובות, כגון הרפיה בלחץ המתוארת בפרוטוקול זה, אך גם מיקרו-התחממות פעילה או תאימות לזחילה, ניתן להשיג באופן ניסיוני עם פלטפורמה זו ולנתח ביסודיות על ידי חבילות תוכנה חדשניות61,62,62,63,64,65 . יתר על כן, היישום של כוחות אינו מוגבל לגרעין אבל יכול להתבצע באופן עקרוני כדי למדוד מבנים תאיים מגוונים וברקמות מורכבות כפי שהוכח ללכידת תאי דם אדומים זורמים בתוך כלי דם שלמים66,67 או לכידה ועיוות כלורופלסטים ומיטוכונדריה68 . כיול תנופת האור אינו תלוי בצורתו ובגודלו של העצם הנלכד, ולכן מאפשר מדידות כוח ישירות על כל גשושית כוח בעלת צורה שרירותית38,39. השימוש במיקרוספירות מוזרקות אפשר לנו להפעיל כוחות גבוהים על הגרעין עם כוח לייזר נמוך יחסית בהשוואה למניפולציה ישירה של מבנים תאיים69,70,71. עם זאת, בהינתן הפרש אינדקס שבירה גבוה מספיק, אין צורך בבדיקת כוח מיושמת חיצונית וניתן לתמרן אברונים תאיים ישירות ללא חרוזים מוזרקים (תצפיות שלא פורסמו והפניה70).
שינויים פוטנציאליים בשיטה שלנו להרחבת היישומים
ניתן להזריק גדלים שונים של חיידקים בהתאם לניסוי, אך יש לבצע את הבקרות היחסיות. לדוגמה, כדי ללמוד תאים בשלבים מאוחרים יותר חרוזים קטנים יותר ניתן להזריק. פעולה זו תפחית את הכוח המרבי שניתן להפעיל על ידי המלכודת האופטית (כגון מוצג בהפניה55). חרוזים גדולים יותר ניתן להזריק כדי להפעיל כוחות גבוהים יותר, אבל אלה עשויים להשפיע על התפתחות העובר בהתאם לגודלם או שלב העניין שלהם. בניסויים שבהם הזרקת חיידקים אינה אופציה, אברונים שונים המציגים הבדלי מדדי שבירה בהשוואה לזה של הציטופלסמה עדיין יכולים להיות מניפולציה אופטית, מה שמוליד כוחות אופטיים הניתנים למדידה משינויי תנופה אור42. כפי שהוזכר לעיל, שיטות אלה שימשו על ידי Bambardekar ואח 'כדי לעוות צמתים תא-תא בעובר Drosophila70. כמו כן, לגרעין התא יש אינדקס שבירה נמוך יותר מאשר ל- medium44 שמסביב, המאפשר כניסה ללא חרוזים (תצפיות שלא פורסמו והפניה72) למרות שעוצמת השמנה נמוכה יותר. לפיכך, לא ניתן ללכוד את הגרעין בקלות ונמלט מהמלכודת.
מרווח PDMS מצופה ספין מפוברק בשיטה נוחה ומהירה, אך עשוי להיות מחוץ להישג ידם של מעבדות ללא גישה למתקן מיקרו/ננו-פבריקציה או למעבדות הנדסה. לכן, spacer ניתן להרכיב בקלות מ קלטת מעבדה או parafilm (שלב 4). הפרוטוקול יכול גם להיות מותאם על ידי ייצור ערוצים microfluidic להפוך את המסירה של תאים בודדים לתוך בארות מדידה מוגדרות מראש או לתוך תא עם גובה מוגדר כדי להעריך את אפקט הכליאה בתוך אותה דגימה. עם זאת, יש לתכנן התקנים מיקרופלואידיים כאלה כך שיתאימו את הרווח בין מטרת המיקרוסקופ לעדשת האיסוף של חיישן הכוח האופטי, של כ -2 מ"מ (ראה שלב 3). שים לב כי חיישן הכוח האופטי חייב להיות ממוקם בגובה המתאים, כך שאין סטיות אופטיות מן defocusing להשפיע על מדידת מומנטום פוטון.
שינויים אחרים עשויים לכלול שינוי של כתבים ביולוגיים. מצאנו כי פלואורסצנטיות Hoechst מדממת באופן ספקטרלי לתוך ערוץ GFP ולכן אנו מעדיפים את השילוב עם histone מתויג mCherry כסמן גרעיני למדידה בו זמנית בשני ערוצים פלואורסצנטיים. לחלופין, ניתן לעקוב בקלות אחר עיוות גרעיני באמצעות תווית המיועדת לקרום הגרעיני הפנימי כגון Lap2b-GFP (איור 2).
הכניסה לגרעין התא הייתה בסדר גודל של 2-3 מיקרון, אשר אנו יכולים למדוד במדויק על ידי ניתוח תמונה של עקיפה מוגבלת ספינינג-דיסק מיקרוסקופיה קונפוקלית. במקרה של גרעינים נוקשים יותר או כוחות קטנים יותר, הכניסה תהיה בקושי ניתנת למדידה באמצעות גישה זו. עם זאת, ניתן לכייל גם את הפינצטה האופטית המכוילת בכוח המוחלטת למדידות מיקום של החרוז הלכוד במקום באמצעות אינטרפרומטריה BFP עם דיוק ננומטר51. באמצעות גישה זו, ניתן לתרגם את אות המתח ואת חיישן הכוח האופטי למיקום של הגשושית הלכודה באמצעות β פרמטר [nm/V], בעוד הפרמטר invariant α [pN/V] מניב ערכי כוח באמצעות כיול תנופת האור הנ"ל41 (ראה להלן לפרטים).
פתרון בעיות
מצאנו כי האתגרים הבאים יכולים להתרחש במהלך הניסוי:
לא נוצרת מלכודת יציבה והמיקרוספירה בורחת בקלות
כל לכלוך על מטרת המיקרוסקופ או צווארון תיקון לא מיושר עלול להוביל לכישלון של מלכודת יציבה. אם לא נמצא פתרון מיידי, מדוד את פונקציית התפשטות הנקודות של העדשה האובייקטיבית. אם דגימת העניין נמצאת עמוק בתוך רקמה צפופה אופטית, מוקד הלייזר עלול לחוות סטיות אופטיות חמורות המובילות ללכידה לא יציבה (אפקט זה הוא בדרך כלל זניח בתאים מבודדים אך הופך בולט יותר ברקמות עבות יותר). עבור קשיחות גבוהה, כוח השיקום של הגרעין יכול לחרוג מכוח המילוט של המלכודת, כך שהמיקרוספירה הולכת לאיבוד ושגרת הכניסה נכשלת. בתחילה, קצה הממברנה הגרעינית הפרוקסימלי למלכודת האופטית כמעט ולא נכנס פנימה (איור S2A). כאשר זה קורה, לייזר ההשמנה אינו מושפע עוד מכוח ומתנועה בראונית, מה שמוביל לירידה בכוח לאפס ולירידה ברעש האות (איור S2B). במקרה שזה קורה, כוח לייזר יכול להיות מוגבר יש מלכודת חזקה יותר, משרעת של המסלול הטרפזי דוחף את החרוז לתוך הגרעין ניתן להפחית, או המיקום הראשוני של המיקרואורגניזם הלכוד ניתן להגדיר רחוק יותר את הגרעין.
התא נע במהלך הגירוי
אם התאים אינם מחוברים מספיק, השמנת ההשמנה ההדרגתית האופטית תזיז את התאים בעת ביצוע שגרת הכניסה התאית, כך שהכוחות והמכניקה הבסיסית של הגרעין הם אובייקטים. כדי למנוע תזוזה של התא כולו, אנו ממליצים להגדיל את הריכוז של מולקולות הידבקות תאים על פני השטח, למשל, ConA.
פיצוי מומנטום ראשוני
אם שגרת פיצוי מומנטום ראשונית אינה זמינה בפלטפורמת ה- OTs (שלב 6.5), יש לתקן אות בסיסי מלאכותי ובלתי תלוי בכוח. זה נראה כשיפוע בעקומת הכוח גם ללא חרוז לכוד (איור S1E). כדי לבצע את התיקון, אותו מסלול צריך להתבצע ללא חרוז, מחוץ לתא בדיוק באותה תנוחה. לשם כך, הרחק את התא מההשמנה באמצעות פקד הבמה. כהפניה, היסט הכוח משתנה 5 pN על פני FOV ב 200 mW במערכת שלנו; לפיכך, הוא הופך להיות זניח עבור מסלולים קצרים. לחלופין, ניתן להשתמש בשלב סריקת פיזו כדי להזיז את התאים על המדגם, משאיר את מיקום הלייזר קבוע.
שלבים קריטיים של הפרוטוקול המוצג
יש להזריק מיקרוספירות בשלב הימני של תא אחד כדי להבטיח חלוקה מקסימלית על העובר. חרוזים לא צריכים להיות פלואורסצנטיים כך שאין דליפת אור לתוך ערוצי פלורסנט המשמשים להדמיה. לדוגמה, אפילו חרוזים אדומים-פלואורסצנטיים טיפוסיים נראים בבירור בערוץ הכחול המשמש להדמיית גרעין התא לאחר הכתמת Hoechst בשל הבהירות שלהם (עירור: 405 ננומטר; פליטה: 445 ננומטר). התקשרות יציבה של התא למצע היא קריטית כדי למנוע תזוזה לרוחב במהלך שגרת הכניסה. אם התא נע במהלך השגרה, לא מעריכים את הכוחות. במקרה שהדבר יקרה לעתים קרובות, מטב את פרוטוקול הקובץ המצורף. עבור תאי תרבית רקמות, חלבוני הידבקות תאים אחרים, כגון פיברונקטין, קולגן או פולי-L-ליזין מובילים לחיבור משביע רצון (תצפיות שלא פורסמו). במהלך הכליאה, תאים נתונים ללחץ מכני פתאומי וחמור. זה יכול לגרום נזק לתאים ולעתים קרובות הנסיין ייתקל תאים מפוצצים אם ההליך לא מתבצע בזהירות. כמו כן, אם גובה הכליאה קטן מדי, כל התאים יסבלו משבירת עוטף גרעינית או נזק בלתי הפיך. כדי למתן את אלה, הנמך את כיסוי הכיסוי העליון לאט יותר ו/או הגדל את המרווח בין כיסוי הכיסוי.
מגבלות הטכניקה והצעות להתגבר עליהם
מגבלה ברורה של הטכניקה היא חדירת אור הלייזר לחלקים עמוקים של הרקמה, מה שמוביל לסטיות וללכידה לא יציבה. לכן, גבול נמוך יותר של עומק החדירה תלוי בבהירות המדגם, תיקון הסטייה שניתן להשתמש בו73 וכוח הלייזר המיושם. יש לקחת בחשבון כי כוח לייזר גבוה יותר מוביל עירור תרמי של המדגם בקרבת המיקרוספירה. עם זאת, חימום המדגם שמקורו בנקודה לייזר באורך גל 1064 ננומטר ממוזער כדי למנוע מתח הקשור לחום מתקבל על הדעת על הדגימות הביולוגיות שלנו74.
מגבלה נוספת היא הכוח המרבי שניתן למדוד. למרות שגילוי ישיר של תנופת אור מאפשר מדידות כוח הרבה מעבר למשטר התגובה הליניארית של המלכודת האופטית40,41, הכוח המיושם המרבי הוא בסדר גודל של כמה מאות picoNewtons. זה מוגבל על ידי כוח לייזר ואת סף הנזק כתוצאה מכך של חומר ביולוגי רך ואת ההבדלים אינדקס שבירה, אשר בדרך כלל אינם גדולים יותר מ 0.1 או 0.344. מספר שיטות הוצעו כדי להגדיל את מגבלת זיהוי הכוח, למשל, באמצעות אור מובנה75, מיקרוספרות מצופות אנטי רפלקטיבי76, חלקיקי אינדקס שבירה גבוהה77 או נקודות קוונטיות מסוממות מאוד78.
OTs יכול לשמש מדידות מיקום בקנה מידה ננומטרי באמצעות אינטרפרומטריה BFP, כך המיקום של החרוז בתוך המלכודת הוא Δx = β Sx, שבו Sx הוא אות המתח של החיישן, וניתן לכייל β [μm/V] תוך כדי תנועה בעקבות פרוטוקולים שונים35,54. עבור חיישן כוח אופטי, ניתן להוכיח כי גורם ההמרה invariant מתח לכוח α [pN /V] מתייחס ישירות β ואת נוקשות המלכודת, k [pN / μm], באמצעות α = kβ 37) בניסויים עם עקירות חרוזים כי הם קטנים מדי כדי להיות מזוהה מן הדמיה אופטית, אסטרטגיה זו יכולה לשמש כדי להשלים מדידות כוח עם זיהוי מיקום קטן. דוגמה לכך היא יישום השגרה הניסיונית המוצגת כאן על גרעינים נוקשים מאוד, אשר כוחות בכוחות לייזר סבירים (200-500 mW) אינם מספיקים כדי לגרום לערכי כניסה גדולים מספיק. במקרה זה, יש להביא את החרוז במגע עם הגרעין ויש לכייל את נוקשות הלכידה לפני המדידה (שלב 8.6). הכניסה d של הגרעין כפונקציה של כוח ניתן לקבוע בעקיפין כמו:
d = xtrap - F/k
כאשר xtrap הוא מיקום המלכודת. בשונה מגורם אור-מומנטום invariant α [pN/V], גורם β [μm/V] צריך להיות מכויל לפני כל ניסוי שכן הוא תלוי משתנים מקומיים רבים הקובעים את דינמיקת ההשמנה, כגון גודל החלקיקים, גודל ספוט מלכודת אופטית, ומדדי שבירה יחסית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ח"כ מכיר בתמיכה כספית של משרד הכלכלה והתחרותיות הספרדי באמצעות התוכנית הלאומית (PGC2018-097882-A-I00), FEDER (EQC2018-005048-P), תוכנית Severo Ochoa למרכזי מצוינות במו"פ (CEX2019-000910-S; RYC-2016-21062), מ Fundació Privada Cellex, Fundació Mir-Puig, ומ Generalitat de Catalunya באמצעות CERCA ותוכנית המחקר (2017 SGR 1012), בנוסף למימון באמצעות ERC (MechanoSystems) ו- HFSP (CDA00023/2018). V.R. מכיר בתמיכת משרד המדע והחדשנות הספרדי לשותפות EMBL, סנטרו דה אקסלנסיה סוורו אוצ'ואה, תוכנית נאסיונאל של MINECO (BFU2017-86296-P, PID2020-117011GB-I00) וג'נרליטט דה קטלוניה (CERCA). V.V. מודה בתמיכתה של תוכנית הדוקטורט ICFOstepstone הממומנת על ידי תוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי תחת הסכם המענקים מארי Skłodowska-Curie 665884. אנו מודים לארנו פארה על הקריאה הביקורתית של כתב היד; מריה מרסל לעזרה עם הדמיה והרכבה של העובר 24 hpf; סנדרה חימנס-דלגאדו לתמיכה עם מיקרונג'ים של דגי זברה.
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 22 mm cover glasses | Ted Pella | 260148 | |
| #1.5 22x60 mm Coverglasses | Ted Pella | 260152 | |
| #1.5H glass bottom dishes | Willco | GWST-5040 | |
| 10-um beads | Supelco | 72986 | |
| 1-mm glass capillaries | Harvard Apparatus | 30-0020 GC100F-15 | |
| 1-um polystyrene microbeads | Sigma | 89904 | |
| 1-um red-fluorescent beads | ThermoFisher | F8816 | |
| Agar | ThermoFisher | 16500500 | |
| Aqcuisition cameras sCMOS | Andor | Sona-4BV11-UNI | |
| Auxiliary camera (Figure 3, AUX) | Blackfly, FLIR | BFS-U3-200S6M-C | |
| Calbryte 520 | AAT Bioquest | 520 AM | |
| Centrifuge | Eppendorf | 5453000011 | |
| Concanavalin A | Sigma | C5275 | |
| DMEM | Sigma | D2906 | |
| DNA-Hoechst | ThermoFisher | 33342 | |
| Double scotch tape | Biesse Adesivi | ||
| E3 | 5 mM NaCl. 0.17 mM KCl. 0.33 mM CaCl2. 0.33 mM MgSO4 | ||
| Eclipse Ti2 | Nikon | ||
| Forceps | Fine Science Tools | 11252-20 | |
| GPI-GFP | |||
| H2A-mCh | |||
| Image acquisition software | Fusion-Andor | ||
| Immersion Oil | Cargille | Type B: 16484 | |
| IR protection googles | Thorlabs | LG1 | |
| Lap2b-eGFP | |||
| Micro loader pipette | Eppendorf | GELoader | |
| Microinjector | World Precision Instruments | SYS-PV820 | |
| MicroManager 2.0 | |||
| Micromiter slide | ID5243 GXMGRAT-5 5mm/100 divisions | ||
| Mineral oil | Sigma | M3616 | |
| Motorized stage | ASI | ||
| Needle puller | Sutter instrument Co. | Model P-97 | |
| Optical tweezers platform | Impetux Optics | Sensocell | |
| OTs software (LightAce) | Impetux Optics | ||
| PDMS | Sigma | Sylgard 184 | |
| PDMS Curing agent | Sigma | Sylgard 184 | |
| Post processing software (Matlab) | Mathworks | ||
| RNAse free water | Thermofisher | AM9937 | |
| Short-pass dichroic mirror (Figure 3, IR-F) | Semrock | FF01-950/SP-25 | |
| Spin-coater | Specialty Coating Systems | Spincoat G3P-8 | |
| Spinning-disk confocal microscope | Andor | DragonFly 502 | |
| Stereomicroscope | Leica M80 | ||
| Triangular microinjection mold | Adaptive Science Tools | TU1 | |
| Universal oven | Memmert | UNB 200 | |
| Water immersion objective | Nikon | MRD07602 |
References
- Chan, C. J., Heisenberg, C. P., Hiiragi, T. Coordination of Morphogenesis and Cell-Fate Specification in Development. Current Biology. 27 (18), 1024-1035 (2017).
- Heller, E., Fuchs, E. Tissue patterning and cellular mechanics. Journal of Cell Biology. 211 (2), 219-231 (2015).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Petridou, N. I., Spiró, Z., Heisenberg, C. P. Multiscale force sensing in development. Nature Cell Biology. 19 (6), 581-588 (2017).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. 160 (4), 673-685 (2015).
- Shellard, A., Mayor, R. Supracellular migration - Beyond collective cell migration. Journal of Cell Science. 132 (8), (2019).
- Mongera, A., et al. A fluid-to-solid jamming transition underlies vertebrate body axis elongation. Nature. 561 (7723), 401-405 (2018).
- Atia, L., et al. Geometric constraints during epithelial jamming. Nature Physics. 14 (6), 613-620 (2018).
- Turlier, H., Maître, J. -. L. Mechanics of tissue compaction. Seminars in Cell & Developmental Biology. 47-48, 110-117 (2015).
- Ladoux, B., Mège, R. M. Mechanobiology of collective cell behaviours. Nature Reviews Molecular Cell Biology. 18 (12), 743-757 (2017).
- Venturini, V., et al. The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior. Science. 370 (6514), (2020).
- Charras, G., Sahai, E. Physical influences of the extracellular environment on cell migration. Nature Reviews Molecular Cell Biology. 15 (12), 813-824 (2014).
- Kirby, T. J., Lammerding, J. Emerging views of the nucleus as a cellular mechanosensor. Nature Cell Biology. 20 (4), 373-381 (2018).
- Lee, H. P., et al. The nuclear piston activates mechanosensitive ion channels to generate cell migration paths in confining microenvironments. Science Advances. 7 (2), (2021).
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Current Opinion in Cell Biology. 23 (1), 55-64 (2011).
- Versaevel, M., Riaz, M., Grevesse, T., Gabriele, S. Cell confinement: Putting the squeeze on the nucleus. Soft Matter. 9 (29), 6665-6676 (2013).
- Zuela-Sopilniak, N., et al. Measuring nucleus mechanics within a living multicellular organism: Physical decoupling and attenuated recovery rate are physiological protective mechanisms of the cell nucleus under high mechanical load. Molecular Biology of the Cell. 31 (17), 1943-1950 (2020).
- Kim, D. H., Wirtz, D. Cytoskeletal tension induces the polarized architecture of the nucleus. Biomaterials. 48, 161-172 (2015).
- Lomakin, A. J., et al. The nucleus acts as a ruler tailoring cell responses to spatial constraints. Science. 370 (6514), (2020).
- Hampoelz, B., et al. Microtubule-induced nuclear envelope fluctuations control chromatin dynamics in Drosophila embryos. Development. 138 (16), 3377-3386 (2011).
- Heo, S. J., et al. Differentiation alters stem cell nuclear architecture, mechanics, and mechano-sensitivity. eLife. 5, 1-21 (2016).
- Cosgrove, B. D., et al. Nuclear envelope wrinkling predicts mesenchymal progenitor cell mechano-response in 2D and 3D microenvironments. Biomaterials. 270, 120662 (2021).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nano. 8 (4), 3821-3828 (2014).
- Hobson, C. M., et al. Correlating nuclear morphology and external force with combined atomic force microscopy and light sheet imaging separates roles of chromatin and lamin A/C in nuclear mechanics. Molecular Biology of the Cell. 31 (16), 1788-1801 (2020).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Davidson, P. M., et al. High-throughput microfluidic micropipette aspiration device to probe time-scale dependent nuclear mechanics in intact cells. Lab on a Chip. 19 (21), 3652-3663 (2019).
- Lombardi, M., Zwerger, M., Lammerding, J. Biophysical assays to probe the mechanical properties of the interphase cell nucleus: Substrate strain application and microneedle manipulation. Journal of Visualized Experiments: JoVE. (55), (2011).
- Luo, T., Mohan, K., Iglesias, P. A., Robinson, D. N. Molecular mechanisms of cellular mechanosensing. Nature Materials. 12 (11), 1064-1071 (2013).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Bustamante, C. J., Wang, M. D. Optical tweezers in single-molecule biophysics. Nature Reviews Methods Primers. , 1-29 (2021).
- Svoboda, K., Block, S. M. Force and velocity measured for single kinesin molecules. Cell. 77 (5), 773-784 (1994).
- Berg-Sørensen, K., Flyvbjerg, H. Power spectrum analysis for optical tweezers. Review of Scientific Instruments. 75 (3), 594-612 (2004).
- Smith, S. B., Cui, Y., Bustamante, C. Optical-trap force transducer that operates by direct measurement of light momentum. Methods in Enzymology. 361 (1994), 134-162 (2003).
- Farré, A., Montes-Usategui, M. A force detection technique for single-beam optical traps based on direct measurement of light momentum changes. Optics Express. 18 (11), 11955 (2010).
- Català, F., Marsà, F., Montes-Usategui, M., Farré, A., Martín-Badosa, E. Extending calibration-free force measurements to optically-trapped rod-shaped samples. Scientific Reports. 7, 1-10 (2017).
- Bui, A. A. M., et al. Calibration of force detection for arbitrarily shaped particles in optical tweezers. Scientific Reports. 8 (1), 1-12 (2018).
- Farré, A., Marsà, F., Montes-Usategui, M. Beyond the hookean spring model: Direct measurement of optical forces through light momentum changes. Methods in Molecular Biology. 1486, (2017).
- Farré, A., Marsà, F., Montes-Usategui, M. Optimized back-focal-plane interferometry directly measures forces of optically trapped particles. Optics Express. 20 (11), 12270 (2012).
- Jun, Y., Tripathy, S. K., Narayanareddy, B. R. J., Mattson-Hoss, M. K., Gross, S. P. Calibration of optical tweezers for in vivo force measurements: How do different approaches compare. Biophysical Journal. 107 (6), 1474-1484 (2014).
- Mas, J., Farré, A., Sancho-Parramon, J., Martín-Badosa, E., Montes-Usategui, M. Force measurements with optical tweezers inside living cells. Optical Trapping and Optical Micromanipulation XI. 9164, (2014).
- Schürmann, M., Scholze, J., Müller, P., Guck, J., Chan, C. J. Cell nuclei have lower refractive index and mass density than cytoplasm. Journal of Biophotonics. 9 (10), 1068-1076 (2016).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments: JoVE. (25), (2009).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish. (Danio rerio), 5th Edition. , (2007).
- Schubert, R., et al. Assay for characterizing the recovery of vertebrate cells for adhesion measurements by single-cell force spectroscopy. FEBS Letters. 588 (19), 3639-3648 (2014).
- Koschwanez, J. H., Carlson, R. H., Meldrum, D. R. Thin PDMS films using long spin times or tert-butyl alcohol as a solvent. PLoS One. 4 (2), 2-6 (2009).
- Das, R., et al. Mechanical stretch inhibition sensitizes proprioceptors to compressive stresses. bioRxiv. , (2021).
- Chardès, C., Clement, R., Blanc, O., Lenne, P. F. Probing cell mechanics with bead-free optical tweezers in the drosophila embryo. Journal of Visualized Experiments: JoVE. (141), (2018).
- Staunton, J. R., Blehm, B., Devine, A., Tanner, K. In situ calibration of position detection in an optical trap for active microrheology in viscous materials. Optics Express. 25 (3), 1746 (2017).
- Bola, R., Treptow, D., Marzoa, A., Montes-Usategui, M., Martin-Badosa, E. Acousto-holographic optical tweezers. Optics Letters. 45 (10), 2938-2941 (2020).
- Thalhammer, G., Obmascher, L., Ritsch-Marte, M. Direct measurement of axial optical forces. Optics Express. 23 (5), 6112 (2015).
- Vermeulen, K. C., et al. Calibrating bead displacements in optical tweezers using acousto-optic deflectors. Review of Scientific Instruments. 77 (1), 1-6 (2006).
- Dzementsei, A., Barooji, Y. F., Ober, E. A., Oddershede, L. B. Foregut organ progenitors and their niche display distinct viscoelastic properties in vivo during early morphogenesis stages. bioRxiv. , 1-35 (2021).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. , (2018).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74 (3), 1564-1578 (1998).
- Khalilgharibi, N., et al. Stress relaxation in epithelial monolayers is controlled by the actomyosin cortex. Nature Physics. 15, (2019).
- Crick, S. L., Yin, F. C. Assessing micromechanical properties of cells with atomic force microscopy: importance of the contact point. Biomechanics and Modeling in Mechanobiology. 6 (3), 199-210 (2007).
- Hurst, S., Vos, B. E., Betz, T. Intracellular softening and fluidification reveals a mechanical switch of cytoskeletal material contributions during division. bioRxiv. , 425761 (2021).
- Kaplan, J. L., Bonfanti, A., Kabla, A. RHEOS.jl - A Julia package for rheology data analysis. arXiv. 4, 1-5 (2020).
- Bonfanti, A., Kaplan, J. L., Charras, G., Kabla, A. Fractional viscoelastic models for power-law materials. Soft Matter. 16 (26), 6002-6020 (2020).
- Rivas-Barbosa, R., Escobedo-Sánchez, M. A., Tassieri, M., Laurati, M. i-Rheo: determining the linear viscoelastic moduli of colloidal dispersions from step-stress measurements. Physical Chemistry Chemical Physics: PCCP. 22 (7), 3839-3848 (2020).
- Tassieri, M., et al. i-Rheo: Measuring the materials' linear viscoelastic properties "in a step". Journal of Rheology. 60 (4), 649-660 (2016).
- Zhong, M. C., Wei, X. B., Zhou, J. H., Wang, Z. Q., Li, Y. M. Trapping red blood cells in living animals using optical tweezers. Nature Communications. 4, 1767-1768 (2013).
- Harlepp, S., Thalmann, F., Follain, G., Goetz, J. G. Hemodynamic forces can be accurately measured in vivo with optical tweezers. Molecular Biology of the Cell. 28 (23), 3252-3260 (2017).
- Bayoudh, S., Mehta, M., Rubinsztein-Dunlop, H., Heckenberg, N. R., Critchley, C. Micromanipulation of chloroplasts using optical tweezers. Journal of Microscopy. 203 (2), 214-222 (2001).
- Favre-Bulle, I. A., Stilgoe, A. B., Rubinsztein-Dunlop, H., Scott, E. K. Optical trapping of otoliths drives vestibular behaviours in larval zebrafish. Nature Communications. 8 (1), 630 (2017).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. 112 (5), 1416-1421 (2015).
- Ferro, V., Chuai, M., McGloin, D., Weijer, C. J. Measurement of junctional tension in epithelial cells at the onset of primitive streak formation in the chick embryo via non-destructive optical manipulation. Development (Cambridge). 147 (3), (2020).
- Hörner, F., et al. Holographic optical tweezers-based in vivo manipulations in zebrafish embryos. Journal of Biophotonics. 10 (11), 1492-1501 (2017).
- Zhong, M. -. C., Wang, Z. -. Q., Li, Y. -. M. Aberration compensation for optical trapping of cells within living mice. Applied Optics. 56 (7), 1972 (2017).
- Català, F., Marsà, F., Montes-Usategui, M., Farré, A., Martín-Badosa, E. Influence of experimental parameters on the laser heating of an optical trap. Scientific Reports. 7 (1), 1-9 (2017).
- Taylor, M. A., Waleed, M., Stilgoe, A. B., Rubinsztein-Dunlop, H., Bowen, W. P. Enhanced optical trapping via structured scattering. Nature Photonics. 9 (10), 669-673 (2015).
- Bormuth, V., et al. Optical trapping of coated microspheres. Optics Express. 16 (18), 13831-13844 (2008).
- Sudhakar, S., et al. Germanium nanospheres for ultraresolution picotensiometry of kinesin motors. Science. 371 (6530), (2021).
- Shan, X., et al. Optical tweezers beyond refractive index mismatch using highly doped upconversion nanoparticles. Nature Nanotechnology. 16 (5), 531-537 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved