A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטה חזקה וגמישה מאוד לעיקור פני השטח של זרעי ערבידופסיס
In This Article
Summary
פרוטוקול תפוקה גבוהה לעיקור פני השטח של זרעי Arabidopsisthaliana (Arabidopsis) מסופק, אופטימיזציה של שלבי הטיפול בנוזל עם מכשיר יניקה פשוט שנבנה עם משאבת ואקום. מאות דגימות זרעים יכולות להיות מעוקרות על פני השטח ביום אחד.
Abstract
Arabidopsis הוא ללא ספק מינים מודל הצמח בשימוש הנפוץ ביותר עבור מחקרים פונקציונליים. עיקור פני השטח של זרעי Arabidopsis הוא צעד בסיסי הנדרש לקראת מטרה זו. לכן, חשוב ביותר להקים שיטות עיקור פני השטח של זרעי Arabidopsis בעלי תפוקה גבוהה כדי להתמודד עם עשרות עד מאות דגימות (למשל, קווים מהונדסים, אקולוגיים או מוטציות) בבת אחת. שיטת עיקור משטח זרע המבוססת על חיסול יעיל של נוזל בצינורות עם מכשיר יניקה תוצרת בית שנבנה ממשאבת ואקום נפוצה מוצגת במחקר זה. על ידי צמצום דרמטי של זמן מעשי אינטנסיבי בעבודה בשיטה זו טיפול בכמה מאות דגימות ביום אחד אפשרי עם מעט מאמץ. ניתוחי קורס זמן מסדרה הצביעו עוד יותר על טווח זמן גמיש מאוד של עיקור פני השטח על ידי שמירה על שיעורי נביטה גבוהים. שיטה זו יכולה להיות מותאמת בקלות לעיקור פני השטח של סוגים אחרים של זרעים קטנים עם התאמה אישית פשוטה של מכשיר היניקה בהתאם לגודל הזרע, ואת המהירות הרצויה לחסל את הנוזל.
Introduction
Arabidopsis הוא מין צמח דיפלואיד השייך למשפחת Brassicaceae. מחזור החיים הקצר יחסית שלה (חודשיים לדור בתנאי גידול ארוכים), גודל צמח קטן, והאבקה עצמית עם ייצור של מאות זרעים לצמח הפכו אותו למין הראשון של מודל הצמח הבסיסי1,2. בנוסף, הגנום שלה היהברצףמלא 3 , כלי גנטיקה הפוכה נרחבת (T-DNA רווי, טרנספוסון, ואוכלוסיות מוטגניות כימית) זמינים4,5,6, ו יעיל אגרובקטריום- טרנספורמציה מתווכת מבוססת היטב כדי להשיג קווים מהונדסים מספיק לעבודה במורד הזרם7 . לכן, במהלך שני העשורים האחרונים, התקדמות גדולה הושגה באמצעות Arabidopsis כמין מודל לנתח היבטים מגוונים של ביולוגיה צמחית ברמה המולקולרית, כולל וריאציה טבעית, גנטית ופנוטיפית8,9.
כדי לאפיין באופן פונקציונלי גנים של עניין Arabidopsis, עיקור פני זרעים כדי לחסל מזהמים פטרייתיים וחיידקיים הוא הצעד התקדים עבור פרוטוקולים רבים במורד הזרם הדורשים תרביות אקסנית. טרנספורמציה גנטית עבור ביטוי יתר10, נוק-אאוט (RNA-I11)או נוק-אאוט (עריכת גנום12,13) של תפקוד הגנים, לוקליזציה תת תאית14, פעילות מקדם15,16, חלבון חלבון17 וחלבון-DNA אינטראקציה18, כדי לצטט רק את היישומים הנפוצים ביותר, כל דורש צעד עיקור פני השטח זרע. לכן, למרות הפשטות היחסית שלה, עיקור משטח הזרע ממלא תפקיד בסיסי ניתוחים פונקציונליים רבים.
עד כה פותחו שתי קטגוריות עיקריות של שיטות עיקור פני השטח של הזרעים המבוססות על עיקור גז או על עיקור שלב נוזלי19. בעוד התפוקה של עיקור משטח זרע גז היא בינונית עד גבוהה, באמצעות גז כלור ריאגנט מסוכן כסוכן עיקור פני השטח עיכב את היישום הרחב שלה. שיטות המבוססות על עיקור שלב נוזלי, להיפך, מסתמכות על כימיקלים מתונים יותר כמו אתנול ופתרונות אקונומיקה לעיקור פני השטח, והם נמצאים בשימוש נרחב יותר למרות שיש להם תפוקה נמוכה יותר מטבעה מאשר חיטוי כלור. באופן כללי, שתי שיטות שונות המשתמשות ריאגנטים נוזליים משמשים בדרך כלל. שיטה אחת בשימוש נרחב מבוססת על כביסה עם אתנול ואקונומיקה בריכוזים שונים למשך זמן שונה20,21. שיטה נוספת מבוססת על יישום אקונומיקה רק21,22. שתי השיטות מיושמות בעיקר עבור עיקור משטח זרע בקנה מידה קטן. עם זאת, בניסויים רבים, יש צורך לסנן קווים מהונדסים Arabidopsis רבים הנגזרים טרנספורמציה אחת15,23 או מסך במקביל קווים מהונדסים רבים שנוצרו מתמורות שונות24,25. למיטב ידיעתנו, לא פורסמה שיטה מבוססת נוזל לעיקור משטח זרעים בעל תפוקה גבוהה, המהווה, אם כי לא מוכר, צוואר בקבוק חשוב לגישות גנומיקה פונקציונליות. לכן, פיתוח שיטות בטוחות, חזקות ובעלות תפוקה גבוהה לעיקור פני השטח של הזרעים הוא צעד הכרחי וקריטי לקראת הצלחת האפיון התפקודי של גנים רבים בבת אחת.
לכך, במחקר הנוכחי, מוצגת שיטה משופרת לעיקור פני השטח של זרעי Arabidopsis. שיטה זו בטוחה, בעלות נמוכה, חזקה מאוד, ותפוקה גבוהה, ומאפשרת טיפול 96 קווים עצמאיים בתוך שעה אחת מתחילת עיקור משטח הזרעים עד סוף זריעת הזרעים בצלחות פטרי. השיטה הדגימה מסתמכת על מכשור מעבדה בסיסי וזמין כמו משאבת ואקום, כלי זכוכית מתכלים וכלי פלסטיק. שיטה משופרת זו מספקת לקהילה המדעית גישה בטוחה, פשוטה ובמחיר סביר לייעול עיקור פני השטח של הזרעים עם תפוקה המתאימה לגישות גנומיקה פונקציונליות מודרניות בערבידופסיס ובמיני צמחים אחרים שאינם מודל.
Protocol
1. ריאגנטים והכנה לתקשורת
- הכן 70% תמיסה אתנול: להוסיף 737 מ"ל של 95% אתנול טכני ל 263 מ"ל של מים מזוקקים. מערבבים היטב.
הערה: הכן 70% פתרון אתנול על ספסל עבודה לא סטרילי.
אזהרה: אתנול הוא דליק מאוד ועלול לגרום לגירוי חמור בעיניים. יש להרחיק מלהבות ומקורות חום. במקרה של מגע עם העיניים, יש לשטוף במים בשפע. - הכן 5% תמיסה אקונומיקה: להוסיף 5 מ"ל של אקונומיקה ביתית (המכיל ~ 3.5% של היפוכלוריט נתרן, NaClO) כדי 95 מ"ל של מים מזוקקים סטריליים. מוסיפים כמה טיפות של חומר ניקוי לא יוני (למשל, Tween 20) ומערבבים ביסודיות.
הערה: הכן פתרון אקונומיקה 5% בתוך מכסה המנוע למינאר.
זהירות: נתרן hypochlorite, המרכיב הפעיל של אקונומיקה, הוא מאוד מעצבן. זה מאכל מאוד יכול לגרום נזקים חמורים למערכת העיכול. במקרה של מגע, יש לשטוף מיד עם מים בשפע. במקרה של בליעה, יש להתקשר למרכז לבקרת רעלים או לרופא לקבלת ייעוץ טיפולי. - הכן חצי כוח Murashige ו Skoog (1/2 MS) בינוני26.
- יש להוסיף 2.2 גרם של אבקה בינונית טראנס (כולל ויטמינים) ו-10 גרם סוכרוז ב-800 מ"ל של מים מזוקקים. התאימו את רמת ה-pH של הפתרון באמצעות 1 M KOH והבנו את עוצמת הקול עד 1 ליטר באמצעות מים מזוקקים. Aliquot 500 מ"ל לתוך בקבוק 1 L ולהוסיף 4 גרם של אגר כדי להכין מדיום מוצק. תבודד את הפתרון באופן אוטומטי.
- לאחר autoclaving, לקרר את המדיום עד 50 -53 מעלות צלזיוס באמבט מים ולשפוך אותו לתוך מנות פטרי מתחת מכסה המנוע זרימה למינאר. כדי להכין את המדיום הסלקטיבי, להוסיף 1000 μL / L של 50 מ"ג / מ"ל פתרון מלאי kanamycin (לערבב 500 מ"ג של Kanamycin סולפט מונוהידראט ב 10 מ"ל של מים מזוקקים, לחטא מסנן ולאחסן ב -20 °C (50-53 °C). מערבבים היטב על ידי מערבולת, ויוצקים לתוך מנות פטרי כאמור.
2. הגדרת שאיפה
הערה: הגדרת המכשיר מסוכמת באיור 1.
- חבר את מפרצון משאבת הוואקום לקצה אחד של צינור פוליאתילן (PE) בגודל מתאים. חבר את הקצה השני של הצינור לשקע של המכסה הדו-כיווני של בקבוק decantation. עטפו את צומת הצינורות בחוזקה בסרט איטום(שולחן החומרים)כדי להבטיח חיבור הדוק לאוויר.
- חבר צינור PE שני למפרצון (החור הבולט לחלק הפנימי של הבקבוק) של בורגק על בקבוק decantation. להתאים את הצד השני של הצינור לשקע של שסתום אקווריום. במידת הצורך, לעטוף עם סרט איטום לאורך הצומת כדי למנוע דליפת אוויר.
- רגע לפני השימוש, להתאים סטרילי 200 μL pipette קצה לפרצון של מסנן האקווריום מתחת מכסה המנוע זרימה למינאר.
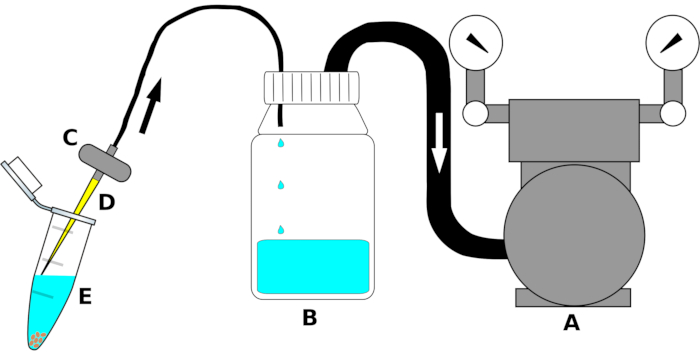
איור 1: שרטוט סכמטי של מכשיר היניקה להסרת נוזלים לעיקור בתפוקה גבוהה. לבהירות, החלקים הבודדים אינם נמשכים לקנה מידה. האות (A) מציינת את משאבת הוואקום, (B) בקבוק המאגר לאיסוף נוזלים (אתנול, אקונומיקה או מים סטריליים), (C) השסתום כדי למנוע ריפלוקס של הנוזלים, (D) קצה פיפטה סטרילי 200 μL, ו -( E) צינור microcentrifuge 1.5 מ"ל המכיל זרעים ונוזל עיקור. החצים מציינים את כיוון זרימת האוויר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. עיקור משטח נוזלי בתפוקה גבוהה של זרעים
הערה: ההליך הכולל והזמן המינימלי הנדרש לעיקור פני השטח של Arabidopsis thaliana (L.) היינה סוג בר (Col-0) (Arabidopsis) זרעים עם 96 דגימות עצמאיות מסוכמים באיור 2.
- תווית עם סמן קבוע שתי אצוות של 48 x 1.5 mL צינורות microcentrifuge עם מספרים מתקדמים.
- מוסיפים 100-200 זרעי Arabidopsis לכל אחד מצינורות מיקרוצנטריפוגה סטריליים 1.5 מ"ל סטריליים (בערך 1-2 מ"מ מעל החלק התחתון של הקצה החרוט של הצינור).
- Aliquot סביב 1000 μL של 70% אתנול לתוך כל צינור באמצעות פיפטה סרולוגית סטרילית 10 מ"ל בתוך מכסה המנוע זרימה למינאר (אצוות זרע אחד, 48 צינורות) ולסגור בזהירות את המכסים.
הערה: חלוקת הפתרונות אינה צריכה להיות מדויקת ביותר, כל עוד הנפח שניתן גבוה פי כמה מנפח הזרעים. לחלופין, בצע את השלב הזה מחוץ למכסה המנוע למינאר (מצב לא סטרילי). - לנער את הצינורות בתדר תנודה של 8.0 הרץ לפחות 3 דקות בשייקר.
- מוציאים את המתאמים מהשייק ומעבירים אותם לסל של מיקרוצנטריפוגה.
- לסובב במהירות את הזרעים באמצעות פונקציית הדופק (נוכח ברוב הצנטריפוגות ספסל) כדי להגיע 1880 x g (~ 15 s).
הערה: זמן ארוך יותר או כוחות צנטריפוגה גבוהים יותר משפיעים לרעה על נביטת הזרעים. - העבר את 48 הצינורות מהמתאמים למתלה אחד ופתח את כל הצינורות מתחת למכסה המנוע. הימנע מזיהומים על ידי לא לגעת בחלק של המכסים להתאים לתוך הצינורות. אם המכסים קרובים מדי זה לזה, חלקו את הצינורות לשני מתלים לטיפול קל יותר.
- התאימו קצה צהוב סטרילי 200 μL על פרצון שסתום האקווריום של השאיפה תוצרת בית מתחת מכסה המנוע זרימה למינאר ולהדליק את המשאבה.
- הכנס את הקצה הצהוב ממש מעל רמת הזרעים כדי למנוע נגיעה בזרעים בעת מציצת הנוזל. לחלופין, למקם במהירות את הקצה בתחתית הצינור; אם זרע חוסם את היניקה של הנוזל, לחסל את הקצה הצהוב ולהכניס אחד חדש.
- Aliquot לתוך כל צינור סביב 1000 μL של 5% אקונומיקה באמצעות 10 מ"ל סטרילי סרולוגי pipette בתוך מכסה המנוע זרימה למינאר.
- סגור בחוזקה את כל המכסים והחזיר את כל הצינורות לתאמי השייקר. לנער את הצינורות בתדר תנודה של 8.0 הרץ לפחות 3 דקות בשייקר.
- במהירות לסובב את הזרעים באמצעות פונקציית הדופק של צנטריפוגה הספסל לזמן הדרוש כדי להגיע 1880 x g (~ 15 s).
- התאימו קצה צהוב סטרילי חדש של 200 μL אל שסתום האקווריום המחובר למשאבת הוואקום מתחת למכסה המנוע של זרימת למינאר, והפעלו את המשאבה.
- הכנס את הקצה הצהוב מעל רמת הזרעים כדי למנוע נגיעה בזרעים בעת מציצת תמיסה אקונומיקה.
- Aliquot לתוך כל צינור סביב 1000 μL של H2O מעוקר באמצעות פיפטה סרולוגית סטרילית 10 מ"ל במכסה המנוע זרימה למינאר.
הערה: שלב את שתי קבוצות הזרעים כדי למזער את זמן הפעולה. - התאימו קצה צהוב סטרילי חדש של 200 μL אל שסתום האקווריום המחובר למשאבת הוואקום מתחת למכסה המנוע של זרימת למינאר והפעלו את המשאבה.
- הכנס את הקצה הצהוב ממש מעל רמת הזרעים כדי למנוע נגיעה בזרעים בעת מציצת H2O.
- Aliquot לתוך כל צינור סביב 500 μL של H2O מעוקר באמצעות פיפטה סרולוגית סטרילית 10 מ"ל ולסגור את כל המכסים במכסה המנוע זרימה למינאר. הזרעים מוכנים לזרע. במידת הצורך, לשמור על הצינורות בטמפרטורת החדר במשך כמה שעות לכל היותר או ב 4 °C (5 °F) לילה.
- מלאו את בקבוק המאגר המשמש לאיסוף נוזלים בכמות מספקת של מים ובודדו אותו אוטומטית. לאחר מכן, להשליך את הנוזל לתוך כיור רגיל.
הערה: תסובבו את הנוזל כדי להרוג את כל הזרעים בתוך המאגר.
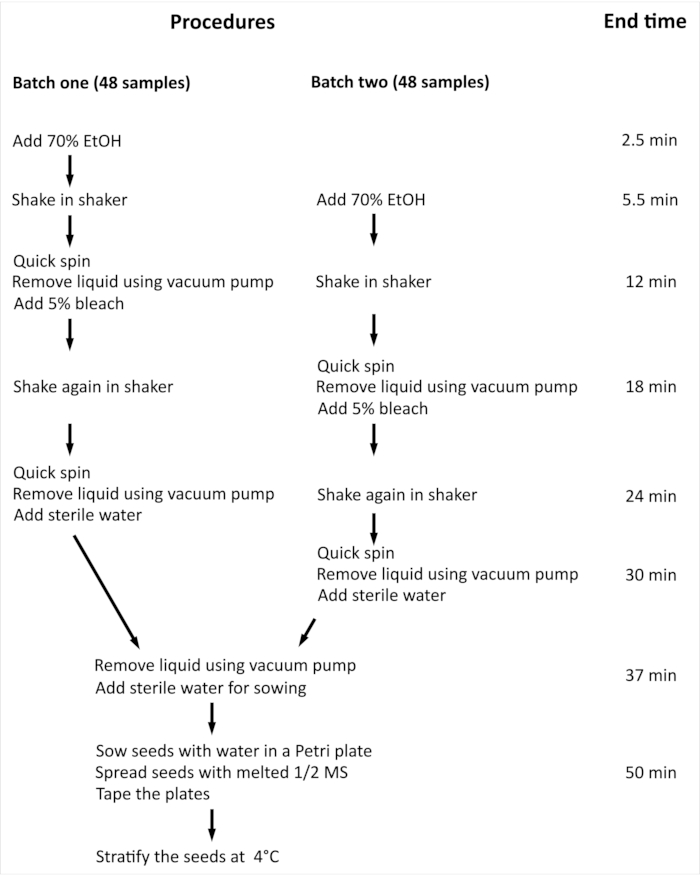
איור 2: סקירת ההליך והזמן המינימלי הנדרש לעיקור פני השטח של זרעי ערבידופסיס עם 96 דגימות עצמאיות. בניסוי שהוצג, 96 דגימות עצמאיות מטופלות בשתי קבוצות בגודל שווה. ההליך כולו זהה עבור שתי האצוות, והן מעובדות במקביל, אך אצווה 2 מעובדת עם עיכוב שלב אחד בהשוואה לאצווה אחת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. ציפוי וניקוד של Arabidopsis על 1/2 לוחות MS
- מעבירים את הזרעים ו 300-400 μL של סטרילי H2O לתוך צלחת פטרי על ידי pipetting עדין עם 1000 μL pipette.
- לאחר העברת 10 צינורות, לשפוך לתוך כל צלחת סביב 1.5-2.0 מ"ל של מומס 1/2 MS בינוני ללא אנטיביוטיקה.
הערה: להמיס מראש ולאחר מכן לשמור על 1/2 MS מומס בינוני באמבטיה תרמוסטטית להגדיר ב 50-53 °C (50 °F) כדי למנוע התגבשות. ודא כי הטמפרטורה אינה עולה על 58 °C (58 °F) כדי למנוע הפחתת הנבטות של הזרעים. - מערבבים במהירות את הצלחת כדי להפיץ את הזרעים שבתוכה. תדביק את הצלחות בצדדים מנוגדים.
- עוטפים את הצלחות בנייר פלסטיק או אלומיניום ואז מניחים אותן במקרר (4 מעלות צלזיוס) למשך 3 ימים בחושך כדי לקבל נביטה אחידה.
- מעבירים את הלוחות לתא צמיחה שנקבע על 23 °C (23 °C(16 שעות אור/8 שעות כהה) עם עוצמת אור של 100-120 מיקרומולמטר-2·s-1 ו 60% לחות יחסית.
- לאחר יומיים, להבקיע את הצמחים על ידי נוכחות של radicles. לזהות את הופעת radicle ואת היווצרות קוטילדון ירוק (פתיחה מלאה של שני cotyledons) כדי להעריך נביטת זרע.
5. ניתוחים סטטיסטיים
הערה: כאן, מבחן זוג של טוקי שימש עבור ניתוחים סטטיסטיים.
- שקול את ערכי P מתחת 0.01 כמשמעותיים סטטיסטית. בצע את כל הניסויים לפחות עם חמישה שכפולים ביולוגיים.
תוצאות
על מנת להעריך את הזמן הנדרש עבור כל הליך עיקור הזרעים, חושבו הפרשי השעות לטיפול בנוזלים ב-96 דגימות בפרוטוקול הנוכחי בהשוואה לשיטות ההצינורה המסורתיות. התוצאה מציינת כי הפרוטוקול הנוכחי חוסך זמן, וחותך את זמן הטיפול הנוזלי לרבעון מזה עם הפרוטוקולים המסורתיים (טבלה 1). הטבלה מדגישה ...
Discussion
עיקור זרעים הוא הצעד הבסיסי ללימודים פונקציונליים בערבידופסיס. למרות שזה מתבצע לעתים קרובות למטרות רבות ושונות, מחקרים מוגבלים על עיקור משטח זרעים תפוקה גבוהה Arabidopsis זמינים.
עד כה, אחת השיטות עם התפוקה הגבוהה ביותר היא באמצעות גז כלור שנוצר על ידי ערבוב אקונומיקה עם HCl מרוכ?...
Disclosures
כל המחברים מצהירים שאין ניגוד אינטרסים.
Acknowledgements
מחקר זה מומן על ידי הפרובינציה האוטונומית של טרנטו באמצעות מימון ליבה של קבוצת Ecogenomics של פונדזיון א' מאק.
Materials
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
References
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved