È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodo ad alta produttività, robusto e altamente flessibile nel tempo per la sterilizzazione superficiale dei semi di Arabidopsis
In questo articolo
Riepilogo
Viene fornito un protocollo ad alto rendimento per la sterilizzazione superficiale dei semi di Arabidopsisthaliana (Arabidopsis), ottimizzando le fasi di movimentazione del liquido con un semplice dispositivo di aspirazione costruito con una pompa per vuoto. Centinaia di campioni di semi possono essere sterilizzati in superficie in un giorno.
Abstract
Arabidopsis è di gran lunga la specie modello vegetale più utilizzata per gli studi funzionali. La sterilizzazione superficiale dei semi di Arabidopsis è un passo fondamentale in questa direzione. Pertanto, è fondamentale stabilire metodi di sterilizzazione superficiale dei semi arabidopsis ad alto rendimento per gestire da decine a centinaia di campioni (ad esempio, linee transgeniche, ecotipi o mutanti) contemporaneamente. In questo studio viene presentato un metodo di sterilizzazione della superficie dei semi basato sull'eliminazione efficiente del liquido nei tubi con un dispositivo di aspirazione fatto in casa costruito da una comune pompa per vuoto. Riducendo drasticamente il tempo di hands-on ad alta intensità di lavoro con questo metodo, è possibile gestire diverse centinaia di campioni in un giorno con poco sforzo. Le analisi del decorso temporale in serie hanno inoltre indicato un intervallo di tempo altamente flessibile di sterilizzazione superficiale mantenendo alti tassi di germinazione. Questo metodo potrebbe essere facilmente adattato per la sterilizzazione superficiale di altri tipi di piccoli semi con una semplice personalizzazione del dispositivo di aspirazione in base alle dimensioni del seme e alla velocità desiderata per eliminare il liquido.
Introduzione
Arabidopsis è una specie vegetale diploide appartenente alla famiglia delle Brassicaceae. Il suo ciclo di vita relativamente breve (due mesi per generazione in condizioni di crescita di lunga giornata), le piccole dimensioni delle piante e l'autoimpollinazione con la produzione di centinaia di semi per pianta ne hanno fatto la prima specie modello vegetale fondamentale1,2. Inoltre, il suo genoma è stato completamente sequenziato3, ampi strumenti di genetica inversa (T-DNA saturo, trasposone e popolazioni chimicamente mutagenizzate) sono disponibili4,5,6e l'efficace trasformazione mediata da Agrobacteriumè ben consolidata per ottenere linee transgeniche sufficienti per ulteriori lavori a valle7 . Così, negli ultimi due decenni, sono stati raggiunti grandi progressi utilizzando Arabidopsis come specie modello per sezionare diversi aspetti della biologia vegetale a livello molecolare, tra cui la variazione naturale, genetica e fenotipica8,9.
Per caratterizzare funzionalmente i geni di interesse in Arabidopsis, la sterilizzazione della superficie dei semi per eliminare i contaminanti fungini e batterici è il passo prerequisito per molti protocolli a valle che richiedono colture axeniche. La trasformazione genetica per la sovraespressione10,knock-down (RNA-I11)o knock-out (genome editing12,13)della funzione genica, localizzazione subcellulare14,attività promotore15,16,proteina-proteina17 e interazione proteina-DNA18,per citare solo le applicazioni più comuni, richiedono tutte una fase di sterilizzazione della superficie del seme. Pertanto, nonostante la sua relativa semplicità, la sterilizzazione della superficie dei semi svolge un ruolo fondamentale in molte analisi funzionali.
Finora, sono state sviluppate due principali categorie di metodi di sterilizzazione della superficie delle sementi basati sulla sterilizzazione in fase gassosa o liquida19. Mentre la produttività della sterilizzazione superficiale dei semi in fase gassosa è medio-alta, l'utilizzo del pericoloso gas cloro reagente come agente di sterilizzazione superficiale ha ostacolato la sua ampia applicazione. I metodi basati sulla sterilizzazione in fase liquida, al contrario, si basano su sostanze chimiche più miti come etanolo e soluzioni di candeggina per la sterilizzazione superficiale e sono più ampiamente utilizzati nonostante abbiano una produttività intrinsecamente inferiore rispetto alla fumigazione del cloro. In generale, due diversi metodi che utilizzano reagenti liquidi sono comunemente usati. Un metodo ampiamente utilizzato si basa sul lavaggio con etanolo e candeggina a diverse concentrazioni per diversa durata di tempo20,21. Un altro metodo si basa sull'applicazione di candeggina solo21,22. Entrambi i metodi sono applicati principalmente per la sterilizzazione superficiale di semi su piccola scala. Tuttavia, in molti esperimenti, è necessario vagliare molte linee transgeniche di Arabidopsis derivate da una trasformazione15,23 o schermare in parallelo molte linee transgeniche generate da diverse trasformazioni24,25. Per quanto ne sappiamo, non è stato pubblicato alcun metodo a base liquida per la sterilizzazione superficiale dei semi ad alto rendimento, che costituisce, sebbene poco riconosciuto, un importante collo di bottiglia per gli approcci di genomica funzionale. Pertanto, lo sviluppo di metodi sicuri, robusti e ad alto rendimento per la sterilizzazione della superficie dei semi è un passo necessario e critico verso il successo della caratterizzazione funzionale di molti geni contemporaneamente.
A tal fine, nel presente studio, viene presentato un metodo migliorato per la sterilizzazione superficiale dei semi di Arabidopsis. Questo metodo è sicuro, a basso costo, altamente robusto e ad alta produttività, consentendo di gestire 96 linee indipendenti entro un'ora dall'inizio della sterilizzazione della superficie del seme fino alla fine della semina in piastre di Petri. Il metodo dimostrato si basa su strumentazione di laboratorio di base ampiamente disponibile come una pompa per vuoto, vetreria consumabile e articoli in plastica. Questo metodo migliorato fornisce alla comunità scientifica un approccio sicuro, semplice e conveniente per semplificare la sterilizzazione della superficie dei semi con un throughput adeguato ai moderni approcci di genomica funzionale in Arabidopsis e altre specie vegetali non modello.
Protocollo
1. Reagenti e preparazione dei supporti
- Preparare la soluzione di etanolo al 70%: aggiungere 737 ml di etanolo tecnico al 95% a 263 ml di acqua distillata. Mescolare accuratamente.
NOTA: Preparare la soluzione di etanolo al 70% su un banco di lavoro non sterile.
ATTENZIONE: L'etanolo è altamente infiammabile e può causare gravi irritazioni agli occhi. Tenere lontano da fiamme e fonti di calore. In caso di contatto con gli occhi, risciacquare con abbondante acqua. - Preparare la soluzione di candeggina al 5%: aggiungere 5 ml di candeggina domestica (contenente ~ 3,5% di ipoclorito di sodio, NaClO) a 95 ml di acqua distillata sterile. Aggiungere qualche goccia di detergente non ionico (ad esempio, Tween 20) e mescolare accuratamente.
NOTA: Preparare la soluzione di candeggina al 5% all'interno della cappa laminare.
ATTENZIONE: L'ipoclorito di sodio, il componente attivo della candeggina, è altamente irritante. È altamente corrosivo e può causare gravi danni al tratto gastrointestinale. In caso di contatto, risciacquare immediatamente con abbondante acqua. In caso di ingestione, chiamare il centro antiveleni o un medico per un consiglio di trattamento. - Preparare Murashige e Skoog (1/2 MS) medio26.
- Aggiungere 2,2 g di MS polvere media (comprese le vitamine) e 10 g di saccarosio in 800 ml di acqua distillata. Regolare il pH della soluzione utilizzando 1 M KOH e portare il volume fino a 1 L utilizzando acqua distillata. Aliquotare 500 ml in una bottiglia da 1 L e aggiungere 4 g di agar per preparare un mezzo solido. Autoclave la soluzione.
- Dopo l'autoclave, raffreddare il mezzo a 50-53 °C a bagnomaria e versarlo in piastre di Petri sotto la cappa a flusso laminare. Per preparare il mezzo selettivo, aggiungere 1000 μL/L di soluzione madre di kanamicina da 50 mg/mL (mescolare 500 mg di Kanamicina solfato monoidrato in 10 mL di acqua distillata, filtrare sterilizzare e conservare a -20 °C) al mezzo (50-53 °C). Mescolare bene vorticando e versare nelle piastre di Petri come accennato in precedenza.
2. Configurazione dell'aspiratore
NOTA: la configurazione dello strumento è riepilogata nella Figura 1.
- Collegare l'ingresso della pompa per vuoto a un'estremità di un tubo di polietilene (PE) di dimensioni adeguate. Collegare l'altra estremità del tubo all'uscita del coperchio bidirezionale del flacone di decantazione. Avvolgere saldamente la giunzione del tubo con un film sigillante(Tabella dei materiali)per garantire una connessione ermetica.
- Collegare un secondo tubo in PE all'ingresso (il foro che sporge all'interno della bottiglia) del tappo a vite sul flacone di decantazione. Montare l'altro lato del tubo all'uscita di una valvola dell'acquario. Se necessario, avvolgere con un film sigillante lungo la giunzione per eliminare le perdite d'aria.
- Poco prima dell'uso, montare una punta di pipetta sterile da 200 μL all'ingresso del filtro dell'acquario sotto la cappa a flusso laminare.
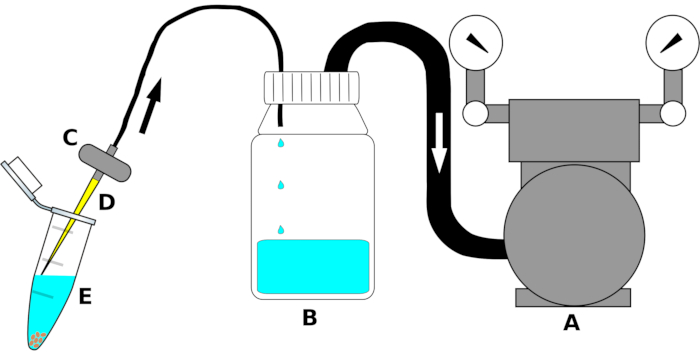
Figura 1: Disegno schematico del dispositivo di aspirazione per la rimozione ad alta produttività dei liquidi di sterilizzazione. Per chiarezza, le singole parti non sono disegnate in scala. La lettera (A) indica la pompa per vuoto, (B) la bottiglia del serbatoio per raccogliere i liquidi (etanolo, candeggina o acqua sterile), (C) la valvola per evitare il reflusso dei liquidi, (D) la punta sterile della pipetta da 200 μL e (E) il tubo microcentrifuga da 1,5 mL contenente semi e liquido di sterilizzazione. Le frecce indicano la direzione del flusso d'aria. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Sterilizzazione superficiale liquida ad alta produttività dei semi
NOTA: La procedura complessiva e il tempo minimo richiesto per la sterilizzazione superficiale dei semi di Arabidopsis thaliana (L.) Heynh wild-type (Col-0) (Arabidopsis) con 96 campioni indipendenti sono riassunti nella Figura 2.
- Etichettare con un marcatore permanente due lotti di tubi microcentrifuga da 48 x 1,5 mL con numeri progressivi.
- Aggiungere 100-200 semi di Arabidopsis a ciascuno dei 96 tubi sterili da 1,5 mL di microcentrifuga (circa 1-2 mm sopra il fondo dell'estremità conica del tubo).
- Aliquotare circa 1000 μL di etanolo al 70% in ciascun tubo utilizzando una pipetta sierologica sterile da 10 mL all'interno della cappa a flusso laminare (lotto di semi uno, 48 tubi) e chiudere accuratamente i coperchi.
NOTA: l'erogazione delle soluzioni non deve essere estremamente accurata, purché il volume erogato sia parecchie volte superiore al volume dei semi. In alternativa, eseguire questo passaggio al di fuori della cappa laminare (condizione non sterile). - Agitare i tubi ad una frequenza di oscillazione di 8,0 Hz per almeno 3 minuti in uno shaker.
- Rimuovere gli adattatori dallo shaker e trasferirli nel cestello di una microcentrifuga da banco.
- Ruotare rapidamente i semi utilizzando la funzione di impulso (presente nella maggior parte delle centrifughe da banco) per raggiungere 1880 x g (~ 15 s).
NOTA: un tempo più lungo o forze di centrifugazione più elevate influenzano negativamente la germinazione dei semi. - Trasferire i 48 tubi dagli adattatori a un rack e aprire tutti i tubi sotto la cappa a flusso laminare. Evitare contaminazioni non toccando la parte dei coperchi che si inseriscono nei tubi. Se i coperchi sono troppo vicini l'uno all'altro, dividere i tubi in due rack per una più facile manipolazione.
- Montare una punta gialla sterile da 200 μL sull'ingresso della valvola dell'acquario dell'aspiratore fatto in casa sotto la cappa a flusso laminare e accendere la pompa.
- Inserire la punta gialla appena sopra il livello dei semi per evitare di toccare i semi quando si succhia il liquido. In alternativa, posizionare rapidamente la punta nella parte inferiore del tubo; se un seme blocca l'aspirazione del liquido, eliminare la punta gialla e inserirne una nuova.
- Aliquota in ciascun tubo di circa 1000 μL di candeggina al 5% utilizzando una pipetta sierologica sterile da 10 mL all'interno della cappa a flusso laminare.
- Chiudere ermeticamente tutti i coperchi e rimettere tutti i tubi negli adattatori dello shaker. Agitare i tubi ad una frequenza di oscillazione di 8,0 Hz per almeno 3 minuti nello shaker.
- Ruotare rapidamente i semi utilizzando la funzione di impulso della centrifuga da banco per il tempo necessario a raggiungere 1880 x g (~ 15 s).
- Montare una nuova punta gialla sterile da 200 μL sulla valvola dell'acquario collegata alla pompa per vuoto sotto la cappa a flusso laminare e accendere la pompa.
- Inserire la punta gialla sopra il livello dei semi per evitare di toccare i semi quando si succhia la soluzione di candeggina.
- Aliquota in ciascun tubo di circa 1000 μL di H2O sterilizzato utilizzando una pipetta sierologica sterile da 10 mL nella cappa a flusso laminare.
NOTA: combinare i due lotti di semi per ridurre al minimo il tempo di funzionamento. - Montare una nuova punta gialla sterile da 200 μL sulla valvola dell'acquario collegata alla pompa per vuoto sotto la cappa a flusso laminare e accendere la pompa.
- Inserire la punta gialla appena sopra il livello dei semi per evitare di toccare i semi quando si succhia l'H2O.
- Aliquotare in ogni tubo circa 500 μL di H2O sterilizzato utilizzando una pipetta sierologica sterile da 10 mL e chiudere tutti i coperchi della cappa a flusso laminare. I semi sono pronti per essere seminati. Se necessario, tenere i tubi a temperatura ambiente per alcune ore al massimo o a 4 °C durante la notte.
- Riempire la bottiglia del serbatoio utilizzata per raccogliere il liquido con una quantità adeguata di acqua e autoclave. Successivamente, scartare il liquido in un lavandino normale.
NOTA: Autoclave il liquido per uccidere tutti i semi all'interno del serbatoio.
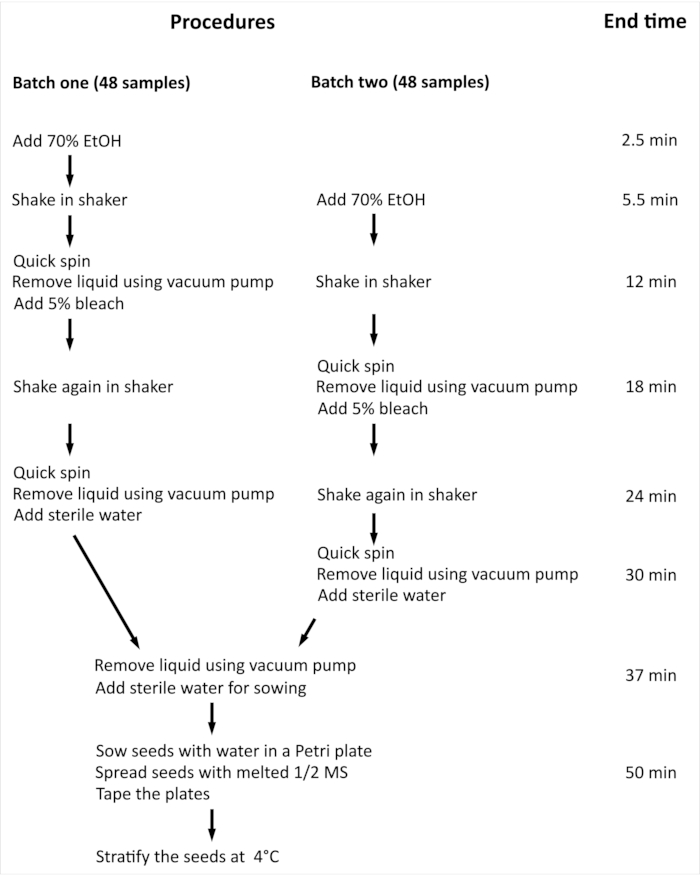
Figura 2: Panoramica della procedura e tempo minimo necessario per la sterilizzazione superficiale dei semi di Arabidopsis con 96 campioni indipendenti. Nell'esperimento presentato, 96 campioni indipendenti vengono gestiti in due lotti di uguali dimensioni. L'intera procedura è la stessa per entrambi i lotti e vengono elaborati in parallelo, ma il lotto due viene elaborato con un ritardo di un passaggio rispetto al lotto uno. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Placcatura e punteggio di Arabidopsis su piastre 1/2 MS
- Trasferire i semi e 300-400 μL di H2O sterile in una capsula di Petri mediante pipettaggio delicato con una pipetta da 1000 μL.
- Dopo aver trasferito 10 tubi, versare in ogni piastra circa 1,5-2,0 ml di terreno fuso 1/2 MS senza antibiotici.
NOTA: Sciogliere in anticipo e quindi mantenere il mezzo fuso da 1/2 MS in un bagno termostatico impostato a 50-53 °C per evitare la solidificazione. Assicurarsi che la temperatura non superi i 58 °C per evitare di diminuire la germinabilità dei semi. - Ruotare rapidamente il piatto per distribuire i semi al suo interno. Nastro adesivo le piastre su lati opposti.
- Avvolgere le piastre in un foglio di plastica o alluminio e poi metterle in frigorifero (4 °C) per 3 giorni al buio per ottenere una germinazione uniforme.
- Trasferire le piastre in una camera di crescita impostata a 23 °C in condizioni di lunga giornata (16 ore di luce/8 h di buio) con un'intensità luminosa di 100-120 μmol·m-2·s-1 e 60% di umidità relativa.
- Dopo due giorni, segna le piante in base alla presenza di radicoli. Rileva l'emergenza della radice e la formazione di cotiledoni verdi (apertura completa dei due cotiledoni) per valutare la germinazione dei semi.
5. Analisi statistiche
NOTA: Qui, il test a coppie di Tukey è stato utilizzato per analisi statistiche.
- Considera i valori P inferiori a 0,01 come statisticamente significativi. Eseguire tutti gli esperimenti almeno con cinque repliche biologiche.
Risultati
Al fine di valutare il tempo necessario per l'intera procedura di sterilizzazione delle sementi, sono state calcolate le differenze di tempo per la manipolazione dei liquidi 96 campioni nel protocollo corrente e confrontate con i metodi di pipettaggio tradizionali. Il risultato indica che il protocollo attuale consente di risparmiare tempo, riducendo il tempo di gestione dei liquidi a un quarto di quello con i protocolli tradizionali (Tabella 1). La tabella evidenzia inoltre che il tempo di rimozione del...
Discussione
La sterilizzazione dei semi è il passo fondamentale per gli studi funzionali in Arabidopsis. Sebbene sia spesso effettuato per molti scopi diversi, sono disponibili studi limitati sulla sterilizzazione superficiale dei semi ad alto rendimento in Arabidopsis.
Finora, uno dei metodi con il più alto rendimento è l'utilizzo di gas di cloro generato mescolando candeggina con HCl concentrato. Sebbene questo metodo richieda un tempo pratico limitato, utilizza un gas altamente tossico per gli esser...
Divulgazioni
Tutti gli autori dichiarano nessun conflitto di interessi.
Riconoscimenti
Questa ricerca è stata finanziata dalla Provincia Autonoma di Trento attraverso il core funding del gruppo Ecogenomics della Fondazione E. Mach.
Materiali
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
Riferimenti
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon