É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Método de alta produtividade, robusto e altamente flexível para esterilização superficial de sementes arabidopsis
Neste Artigo
Resumo
É fornecido um protocolo de alta produtividade para a esterilização superficial de sementes arabidopsisthaliana (Arabidopsis), otimizando as etapas de manuseio líquido com um simples dispositivo de sucção construído com uma bomba de vácuo. Centenas de amostras de sementes podem ser esterilizadas em um dia.
Resumo
Arabidopsis é de longe a espécie modelo vegetal mais utilizada para estudos funcionais. A esterilização superficial das sementes arabidopsis é um passo fundamental necessário para este fim. Assim, é primordial estabelecer métodos de esterilização superficial de sementes arabidopsis de alto rendimento para lidar com dezenas a centenas de amostras (por exemplo, linhas transgênicas, ecotipos ou mutantes) ao mesmo tempo. Um método de esterilização de superfície de sementes baseado na eliminação eficiente de líquido em tubos com um dispositivo de sucção caseiro construído a partir de uma bomba de vácuo comum é apresentado neste estudo. Reduzindo drasticamente o tempo prático com este método manuseando várias centenas de amostras em um dia é possível com pouco esforço. As análises do curso-período da série indicaram ainda uma faixa de tempo altamente flexível de esterilização superficial, mantendo altas taxas de germinação. Este método poderia ser facilmente adaptado para esterilização superficial de outros tipos de pequenas sementes com simples personalização do dispositivo de sucção de acordo com o tamanho da semente, e a velocidade desejada para eliminar o líquido.
Introdução
Arabidopsis é uma espécie de planta diploide pertencente à família Brassicaceae. Seu ciclo de vida relativamente curto (dois meses por geração em condições de crescimento prolongado), tamanho de plantas pequenos e auto-polinização com a produção de centenas de sementes por planta fizeram dela a primeira espécie fundamental do modelo vegetal1,2. Além disso, seu genoma foi totalmente sequenciado3, extensas ferramentas genéticas reversas (T-DNA saturado, transposon e populações quimicamente mutagenizadas) estão disponíveis4,5,6, e a transformação eficaz agrobacterium-mediada é bem estabelecida para obter linhas transgênicas suficientes para mais trabalho a jusante7 . Assim, nas últimas duas décadas, grandes avanços foram alcançados utilizando a Arabidopsis como espécie modelo para dissecar diversos aspectos da biologia vegetal no nível molecular, incluindo variação natural, genética e fenotípica8,9.
Para caracterizar funcionalmente genes de interesse na Arabidopsis, a esterilização da superfície das sementes para eliminar contaminantes fúngicos e bacterianos é o passo pré-requisito para muitos protocolos a jusante que requerem culturas axeônicas. Transformação genética para a superexpressão10, knock-down (RNA-I11) ou knock-out (edição de genoma12,13) da função genética, localização subcelular14,atividade promotora15,16, proteína-proteína17 e interação proteína-DNA18, para citar apenas as aplicações mais comuns, todas necessitam de uma etapa de esterilização superficial de sementes. Assim, apesar de sua relativa simplicidade, a esterilização da superfície das sementes desempenha um papel fundamental em muitas análises funcionais.
Até agora, duas grandes categorias de métodos de esterilização de superfície de sementes foram desenvolvidas com base no gás ou na esterilização em fase líquida19. Embora o throughput de esterilização da superfície de sementes em fase de gás seja médio a alto, o uso do gás de cloro de reagente perigoso como agente de esterilização superficial tem dificultado sua ampla aplicação. Métodos baseados na esterilização em fase líquida, pelo contrário, dependem de produtos químicos mais leves, como etanol e soluções alvejantes para esterilização superficial, e são mais amplamente utilizados, apesar de terem um rendimento inerentemente menor do que a fumigação de cloro. Em geral, dois métodos diferentes que usam reagentes líquidos são comumente utilizados. Um método amplamente utilizado é baseado na lavagem com etanol e alvejante em diferentes concentrações por diferentes períodos detempo 20,21. Outro método baseia-se na aplicação de alvejanteapenas 21,22. Ambos os métodos são aplicados principalmente para esterilização de superfície de sementes em pequena escala. No entanto, em muitos experimentos, é necessário telar muitas linhas transgênicas arabidopsis derivadas de uma transformação15,23 ou tela em paralelo muitas linhas transgênicas geradas a partir de diferentes transformações24,25. Pelo que sabemos, nenhum método baseado em líquido para esterilização de superfície de sementes de alta produtividade foi publicado, o que constitui, embora pouco reconhecido, um importante gargalo para abordagens de genômica funcional. Portanto, desenvolver métodos seguros, robustos e de alta produtividade para a esterilização da superfície de sementes é um passo necessário e crítico para o sucesso da caracterização funcional de muitos genes ao mesmo tempo.
Para isso, no presente estudo, é apresentado um método aprimorado para esterilização superficial de sementes arabidopsis. Este método é seguro, de baixo custo, altamente robusto e de alta produtividade, permitindo o manuseio de 96 linhas independentes dentro de uma hora desde o início da esterilização da superfície das sementes até o fim da semeadura em placas de Petri. O método demonstrado conta com instrumentação de laboratório amplamente disponível, como uma bomba de vácuo, vidros consumíveis e utensílios plásticos. Este método aprimorado fornece à comunidade científica uma abordagem segura, simples e acessível para simplificar a esterilização da superfície das sementes com uma throughput adequada às abordagens modernas de genômica funcional em Arabidopsis e outras espécies vegetais não modelo.
Protocolo
1. Reagentes e preparação da mídia
- Prepare 70% solução de etanol: Adicione 737 mL de 95% de etanol técnico a 263 mL de água destilada. Homogeneizar.
NOTA: Prepare a solução de 70% de etanol em um banco de trabalho não estéril.
ATENÇÃO: O etanol é altamente inflamável e pode causar séria irritação nos olhos. Mantenha-se longe de chamas e fontes de calor. Em caso de contato com os olhos, enxágue com água abundante. - Prepare 5% solução de alvejante: Adicione 5 mL de alvejante doméstico (contendo ~3,5% de hipoclorito de sódio, NaClO) a 95 mL de água destilada estéril. Adicione algumas gotas de detergente não iônico (por exemplo, Interpol 20) e misture bem.
NOTA: Prepare a solução de alvejante de 5% dentro do capô laminar.
ATENÇÃO: O hipoclorito de sódio, o componente ativo do alvejante, é altamente irritante. É altamente corrosivo e pode causar sérios danos ao trato gastrointestinal. Em caso de contato, enxágue imediatamente com água abundante. Em caso de ingestão, ligue para o centro de controle de venenos ou um médico para aconselhamento de tratamento. - Preparem-se meio-forte Murashige e Skoog (1/2 MS) médio26.
- Adicione 2,2 g de pó médio ms (incluindo vitaminas) e 10 g de sacarose em 800 mL de água destilada. Ajuste o pH da solução usando 1 M KOH e traga o volume até 1 L usando água destilada. Alíquota de 500 mL em uma garrafa de 1 L e adicione 4g de ágar para preparar um meio sólido. Autoclave a solução.
- Depois de autoclavar, esfrie o médio a 50-53 °C em um banho de água e despeje-o em pratos petri sob o capô de fluxo laminar. Para preparar o meio seletivo, adicione 1000 μL/L de 50 mg/mL solução de estoque de kanamycin (misture 500 mg de monohidrato de sulfato de kanamicina em 10 mL de água destilada, esterilize o filtro e armazene a -20 °C) ao médio (50-53 °C). Misture bem girando, e despeje em pratos de Petri como mencionado anteriormente.
2. Configuração do aspirador
NOTA: A configuração do instrumento é resumida na Figura 1.
- Conecte a entrada da bomba de vácuo a uma extremidade de um tubo de polietileno (PE) de tamanho adequado. Conecte a outra extremidade do tubo à saída da tampa bidirenal da garrafa de decantação. Enrole firmemente a junção do tubo com uma película de vedação(Tabela de Materiais)para garantir uma conexão a ar.
- Conecte um segundo tubo pe à entrada (o orifício saliente ao interior da garrafa) da tampa do parafuso na garrafa de decantação. Coloque o outro lado do tubo na saída de uma válvula de aquário. Se necessário, enrole com uma película de vedação ao longo da junção para eliminar o vazamento de ar.
- Pouco antes de usar, coloque uma ponta de pipeta estéril de 200 μL na entrada do filtro de aquário sob a capa de fluxo laminar.
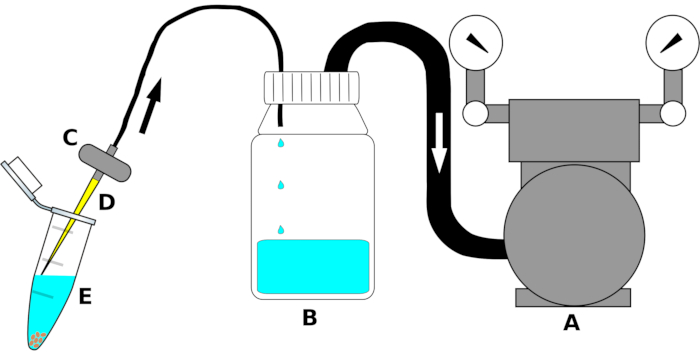
Figura 1: Desenho esquemático do dispositivo de sucção para remoção de alto rendimento de líquidos de esterilização. Para clareza, as peças únicas não são atraídas para a escala. A letra (A) indica a bomba de vácuo, (B) a garrafa do reservatório para coletar líquidos (etanol, alvejante ou água estéril), (C) a válvula para evitar o refluxo dos líquidos, (D) a ponta de pipeta estéril de 200 μL e (E) o tubo de microcentrifuagem de 1,5 mL contendo sementes e líquido de esterilização. As setas indicam a direção do fluxo de ar. Clique aqui para ver uma versão maior desta figura.
3. Esterilização de superfície líquida de alto rendimento de sementes
NOTA: O procedimento geral e o tempo mínimo necessário para a esterilização superficial de sementes arabidopsis thaliana (L.) Heynh (Col-0) (Arabidopsis) com 96 amostras independentes são resumidos na Figura 2.
- Rotule com um marcador permanente dois lotes de tubos de microcentrifus de 48 x 1,5 mL com números progressivos.
- Adicione 100-200 sementes de Arabidopsis a cada um dos tubos de microcentrifus de 1,5 mL estéreis (cerca de 1-2 mm acima da parte inferior da extremidade cônica do tubo).
- Alíquota de cerca de 1000 μL de 70% de etanol em cada tubo usando uma pipeta sorológica estéril de 10 mL dentro da capa de fluxo laminar (lote de sementes um, 48 tubos) e feche cuidadosamente as tampas.
NOTA: A dispensa das soluções não precisa ser extremamente precisa, desde que o volume dispensado seja várias vezes maior do que o volume de sementes. Alternativamente, realize esta etapa fora do capô laminar (condição não estéril). - Agite os tubos em uma frequência de oscilação de 8,0 Hz por pelo menos 3 minutos em um agitador.
- Remova os adaptadores do agitador e transfira-os para a cesta de um microcentrifuuge benchtop.
- Gire rapidamente as sementes usando a função de pulso (presente na maioria das centrífugas de bancada) para atingir 1880 x g (~15 s).
NOTA: O tempo mais longo ou maior de centrifugação afeta negativamente a germinação das sementes. - Transfira os 48 tubos dos adaptadores para um rack e abra todos os tubos sob o capô de fluxo laminar. Evite contaminações não tocando na parte das tampas que se encaixam nos tubos. Se as tampas estiverem muito próximas umas das outras, divida os tubos em dois racks para facilitar o manuseio.
- Coloque uma ponta amarela de 200 μL estéril na entrada da válvula de aquário do aspirador caseiro sob o capô de fluxo laminar e ligue a bomba.
- Insira a ponta amarela logo acima do nível das sementes para evitar tocar nas sementes ao sugar o líquido. Alternativamente, posicione rapidamente a ponta na parte inferior do tubo; se uma semente bloquear a sucção do líquido, elimine a ponta amarela e insira uma nova.
- Alíquota em cada tubo em torno de 1000 μL de alvejante de 5% usando uma pipeta sorológica estéril de 10 mL dentro da capa de fluxo laminar.
- Feche bem todas as tampas e coloque todos os tubos de volta nos adaptadores do agitador. Agite os tubos em uma frequência de oscilação de 8,0 Hz por pelo menos 3 minutos no agitador.
- Gire rapidamente as sementes usando a função de pulso da centrífuga benchtop para o tempo necessário para atingir 1880 x g (~15 s).
- Coloque uma nova ponta amarela de 200 μL estéril na válvula de aquário conectada à bomba de vácuo sob a coifa de fluxo laminar e ligue a bomba.
- Insira a ponta amarela acima do nível das sementes para evitar tocar nas sementes ao sugar a solução de alvejante.
- Alíquota em cada tubo em torno de 1000 μL de H2O esterilizado usando uma pipeta sorológica estéril de 10 mL na capa de fluxo laminar.
NOTA: Combine os dois lotes de sementes para minimizar o tempo de operação. - Coloque uma nova ponta amarela estéril de 200 μL na válvula de aquário conectada à bomba de vácuo sob o capô de fluxo laminar e ligue a bomba.
- Insira a ponta amarela logo acima do nível das sementes para evitar tocar nas sementes ao sugar o H2O.
- Alíquota em cada tubo em torno de 500 μL de H2O esterilizado usando uma pipeta sorológica estéril de 10 mL e feche todas as tampas na coifa de fluxo laminar. As sementes estão prontas para serem semeadas. Se necessário, mantenha os tubos em temperatura ambiente por algumas horas máximas ou a 4 °C durante a noite.
- Encha a garrafa do reservatório usada para coletar líquido com uma quantidade adequada de água e autoclave-o. Depois, descarte o líquido em uma pia normal.
NOTA: Autoclave o líquido para matar todas as sementes dentro do reservatório.
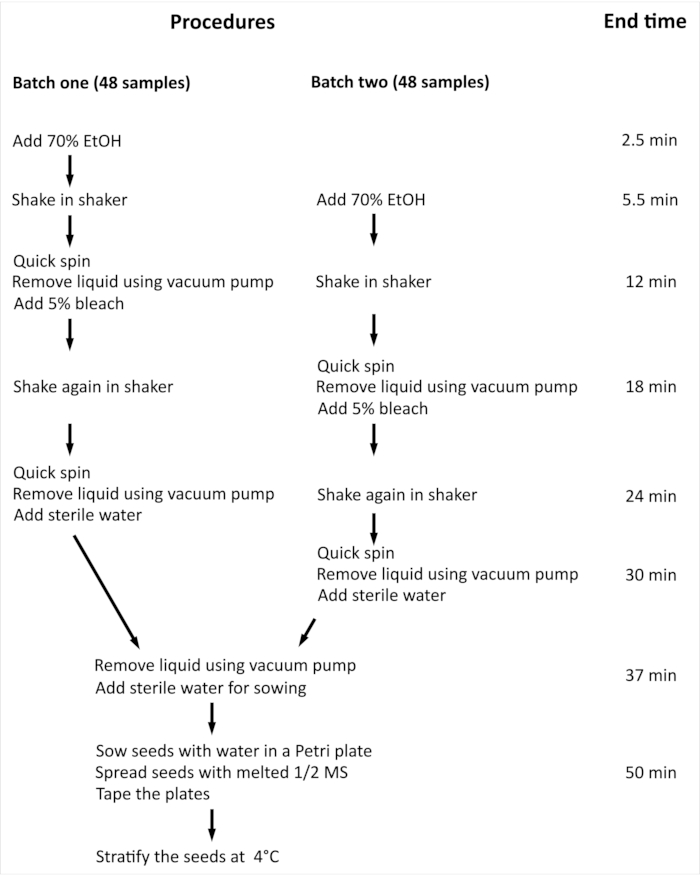
Figura 2: Visão geral do procedimento e tempo mínimo necessário para esterilização superficial de sementes arabidopsis com 96 amostras independentes. No experimento apresentado, 96 amostras independentes são manuseadas em dois lotes de tamanho igual. Todo o procedimento é o mesmo para ambos os lotes, e eles são processados em paralelo, mas o lote dois é processado com um atraso de uma etapa em comparação com o lote um. Clique aqui para ver uma versão maior desta figura.
4. Chapeamento e pontuação de Arabidopsis em placas de 1/2 MS
- Transfira as sementes e 300-400 μL de H2O estéril em uma placa de Petri por pipetação suave com uma pipeta de 1000 μL.
- Depois de transferir 10 tubos, despeje em cada placa em torno de 1,5-2,0 mL de meio derretido de 1/2 MS sem antibióticos.
NOTA: Derreta com antecedência e mantenha o meio derretido de 1/2 MS em um conjunto de banho termostático a 50-53 °C para evitar a solidificação. Certifique-se de que a temperatura não exceda 58 °C para evitar diminuir a germinabilidade das sementes. - Gire rapidamente a placa para distribuir as sementes dentro dele. Grave as placas em lados opostos.
- Enrole as placas em uma folha de plástico ou alumínio e, em seguida, coloque-as em uma geladeira (4 °C) por 3 dias no escuro para obter germinação uniforme.
- Transfira as placas para uma câmara de crescimento fixada em 23 °C em condições de longo dia (luz de 16 h/8h escuras) com uma intensidade leve de 100-120 μmol·m-2·s-1 e 60% de umidade relativa.
- Depois de dois dias, marque as plantas pela presença de radículos. Detecte o surgimento de radículos e a formação de cotyledon verde (abertura total dos dois cotilledons) para avaliar a germinação das sementes.
5. Análises estatísticas
NOTA: Aqui, o teste de tukey foi utilizado para análises estatísticas.
- Considere os valores P abaixo de 0,01 como estatisticamente significativos. Realize todos os experimentos pelo menos com cinco réplicas biológicas.
Resultados
Para avaliar o tempo necessário para todo o procedimento de esterilização de sementes, foram calculadas as diferenças de tempo para o manuseio líquido de 96 amostras no protocolo atual e comparadas com os métodos tradicionais de pipetação. O resultado indica que o protocolo atual economiza tempo, cortando o tempo de manuseio líquido para um quarto disso com os protocolos tradicionais(Tabela 1). A tabela destaca ainda que o tempo de remoção de líquidos no protocolo atual economiza mais tempo d...
Discussão
A esterilização de sementes é o passo fundamental para estudos funcionais em Arabidopsis. Embora seja frequentemente realizada para muitos propósitos diferentes, estudos limitados sobre esterilização de superfície de sementes de alta produtividade em Arabidopsis estão disponíveis.
Até agora, um dos métodos com maior rendimento é o uso de gás cloro gerado pela mistura de alvejante com HCl concentrado. Embora este método exija tempo prático limitado, ele usa um gás altamente tóx...
Divulgações
Todos os autores não declaram conflitos de interesse.
Agradecimentos
Esta pesquisa foi financiada pela Província Autônoma de Trento através do financiamento central do grupo de Ecogenômica de Fondazione E. Mach.
Materiais
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
Referências
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados