JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
애기장염 씨앗의 표면 살균을 위한 높은 처리량, 견고하고 매우 시간 유연한 방법
요약
아라비도프스탈리아나(Arabidopsis) 종자의 표면 살균을 위한 고처리량 프로토콜이 제공되어 진공 펌프로 구성된 간단한 흡입 장치로 액체 처리 단계를 최적화합니다. 수백 개의 종자 시료는 하루에 표면 살균될 수 있습니다.
초록
애기장염은 지금까지 기능 연구에 가장 널리 사용되는 식물 모델 종입니다. 아라비도시스 씨앗의 표면 살균은 이 쪽으로 요구되는 근본적인 단계입니다. 따라서, 고처리량 인 애비도시스 종자 표면 살균 방법을 한 번에 수십~수백 개의 시료(예: 트랜스제닉 라인, 에코타입 또는 돌연변이)를 처리하는 것이 가장 중요하다. 일반적인 진공 펌프로 구성된 수제 흡입 장치로 튜브에서 액체를 효율적으로 제거하는 종자 표면 살균 방법이 이 연구에서 제시된다. 하루에 수백 개의 샘플을 처리하는 이 방법으로 노동 집약적인 실습 시간을 획기적으로 줄임으로써 약간의 노력으로 가능합니다. 시리즈 타임코스 분석은 높은 발아율을 유지함으로써 표면 멸균의 매우 유연한 시간 범위를 더욱 나타내냈습니다. 이 방법은 종자 크기에 따라 흡입 장치의 간단한 사용자 정의와 작은 씨앗의 다른 종류의 표면 살균에 쉽게 적응 할 수있다, 액체를 제거하기 위해 원하는 속도.
서문
아라비도시스는 브라시카세아 족에 속하는 디플로이드 식물 종입니다. 상대적으로 짧은 수명 주기(장시간 성장 조건 하에서 세대당 2개월), 작은 식물 크기, 식물당 수백 종의 종생산과 함께 자체 수분은 최초의 기초 식물 모델 종1,2를만들었습니다. 또한, 그 게놈은완전히 서열3, 광범위한 역유전학 도구(포화 T-DNA, 트랜스포손 및 화학적으로 돌연변이된 인구)를 사용할 수 있는4,5,6,효과적인 아그로박테리움-매개변환은 추가 하류 작업을 위한 충분한 형질전환선을 확보하기 에 잘 확립되어있다7 . 따라서, 지난 2년 동안, 자연, 유전적 및 현상변이를 포함한 분자 수준에서 식물 생물학의 다양한 측면을 해부하는 모델 종으로 애기독증을 사용하여 큰 발전을 이루었다8,9.
애기장염에 대한 관심 있는 유전자를 기능적으로 특성화하기 위해, 곰팡이 및 세균 오염 물질을 제거하기 위한 종자 표면 살균은 축균 배양을 요구하는 많은 다운스트림 프로토콜을 위한 전제 조건 단계이다. 과발현(RNA-I11)또는 녹아웃(12,13)유전자 기능, 세포외 국소화14,프로모터활동(15,16,단백질-단백질17 및 단백질-DNA 상호작용18)에대한 유전적 변형은 종자 표면 멸균 단계를 모두 필요로 한다. 따라서, 상대적 단순함에도 불구하고, 종자 표면 살균은 많은 기능 적 분석에서 근본적인 역할을한다.
지금까지, 종자 표면 살균 방법의 두 가지 주요 범주는 가스 또는 액체 상멸균(19)에기초하여 개발되었다. 가스상 종자 표면 살균의 처리량은 중간에서 높지만, 유해 시약 염소 가스를 표면 살균 제로로 사용하여 광범위한 적용을 방해하고 있습니다. 반대로 액체 상 살균을 기반으로 하는 방법은 표면 살균을 위해 에탄올 및 표백제 솔루션과 같은 온화한 화학 물질에 의존하며, 염소 훈증보다 본질적으로 낮은 처리량이 있음에도 불구하고 더 널리 사용됩니다. 일반적으로 액체 시약을 사용하는 두 가지 방법이 일반적으로 사용됩니다. 크게 사용되는 방법은20,21의다른 지속 시간 동안 다른 농도에서 에탄올과 표백제로 세척을 기반으로합니다. 또 다른 방법은 표백제만21,22의적용을기반으로 한다. 두 방법 모두 주로 소규모 종자 표면 살균을 위해 적용됩니다. 그러나, 많은 실험에서, 다른변형(24, 25)으로부터생성된 많은 형질대사를 병렬로 하나의변형(15,23) 또는 스크린에서 파생된 많은 애비독시스 형질대사를 스크리징할 필요가있다. 우리의 지식에, 높은 처리량 종자 표면 살균을 위한 액체 기지를 둔 방법이 간행되지 않았습니다, 이는, 거의 인식하더라도, 기능적인 유전체학 접근을 위한 중요한 병목 현상을 구성합니다. 따라서 종자 표면 살균을 위한 안전하고 견고하며 높은 처리량 방법을 개발하는 것은 한 번에 많은 유전자의 기능적 특성화의 성공을 향한 필요하고 중요한 단계이다.
이를 위해, 현재 연구에서는, 아라비도시스 씨앗의 표면 살균을 위한 향상된 방법이 제시된다. 이 방법은 안전하고 저렴한 비용, 고도로 견고하며 처리량이 높으며, 종자 표면 살균 초기부터 페트리 접시의 종자 파종 끝까지 1시간 이내에 96개의 독립적인 라인을 처리할 수 있습니다. 입증 된 방법은 진공 펌프, 소모품 유리 제품 및 플라스틱 제품과 같은 널리 사용되는 기본 실험실 계측에 의존합니다. 이 개선된 방법은 과학 계에 아라비도시스 및 기타 비모델 식물 종의 현대 기능 적 유전체학 접근법에 적합한 처리량으로 종자 표면 살균을 간소화하는 안전하고 간단하며 저렴한 접근 방식을 제공합니다.
프로토콜
1. 시약 및 미디어 준비
- 70% 에탄올 용액 준비: 737mL95% 기술 용탄올을 증류수 263mL에 추가합니다. 완전히 섞으세요.
참고: 멸균이 아닌 작업 벤치에 70% 에탄올 용액을 준비합니다.
주의: 에탄올은 인화성이 매우 높으며 눈에 심각한 자극을 일으킬 수 있습니다. 화염과 열원을 멀리하십시오. 눈과 접촉하는 경우 풍부한 물로 헹구는 다. - 5% 표백제 용액 준비: 가정용 표백제 5mL(비염염소산나트륨 3.5%, NaClO 포함)을 멸균 증류수 95mL에 추가합니다. 이온 세제(예: 트웬 20)를 몇 방울 떨어뜨리고 완전히 섞습니다.
참고: 라미나르 후드 내부에 표백제 용액을 5% 준비합니다.
주의: 표백제의 활성 성분인 염산화나트륨은 매우 자극적입니다. 그것은 매우 부식성이 며 위 장관에 심각한 손상을 일으킬 수 있습니다. 접촉의 경우, 풍부한 물로 즉시 헹구는 다. 섭취의 경우, 치료 조언을 위해 독극물 관리 센터 또는 의료 의사에게 전화하십시오. - 반강도 무라시게와 스쿠그(1/2 MS) 중간26을준비한다.
- MS 중간 분말 2.2 g(비타민 포함)과 800mL의 증류수에 자당 10g을 넣습니다. 1M KOH를 사용하여 용액의 pH를 조정하고 증류수를 사용하여 최대 1L의 부피를 가져옵니다. Aliquot 500 mL은 1 L 병에 넣고 4g의 천지를 추가하여 단단한 매체를 준비합니다. 솔루션을 자동 복제합니다.
- 오토클레이브 후, 수조에서 중간 값을 50-53°C로 식히고 라미나르 플로우 후드 아래에 페트리 접시에 붓습니다. 선택적 매체를 제조하려면 50 mg /mL 카나마이신 재고 용액의 1000 μL /L을 추가하십시오 (10 mL의 가나마이신 황산 단수제 500 mg을 증류수 10mL에 혼합하고 필터 살균 및 저장 -20 °C)를 매체 (50-53 °C)에 넣습니다. 소용돌이에 잘 섞어서 페트리 요리에 부어 넣으세요.
2. 아스피레이터 설정
참고: 계측기 설정은 그림 1로요약되어 있습니다.
- 진공 펌프 입구를 적절한 크기의 폴리에틸렌(PE) 튜브의 한쪽 끝에 연결합니다. 튜브의 다른 쪽 끝을 디펜션 병의 양방향 뚜껑의 콘센트에 연결합니다. 튜브의 접합을 밀봉필름(재료 표)으로단단히 감싸서 밀폐 연결을 보장합니다.
- 침엽수 병의 나사캡의 입구(병 안쪽으로 돌출된 구멍)에 두 번째 PE 튜브를 연결합니다. 튜브의 다른 면을 수족관 밸브의 콘센트에 맞춥니까. 필요한 경우 접합을 따라 밀봉 필름으로 포장하여 공기 누출을 제거하십시오.
- 사용하기 직전에 멸균 200 μL 파이펫 팁을 라미나르 플로우 후드 아래 의 수족관 필터 입구에 맞춥시게 합니다.
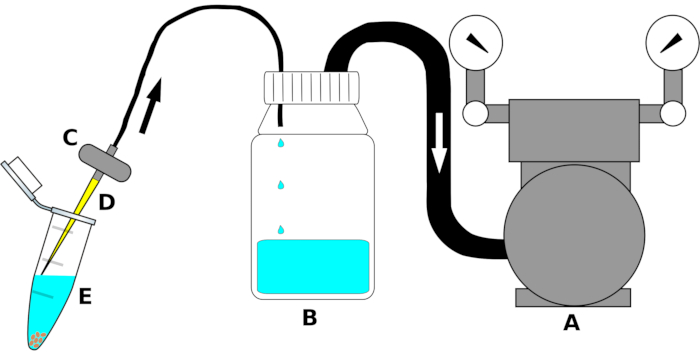
그림 1: 멸균 액체의 높은 처리량 제거를 위한 흡입 장치의 회로도. 명확성을 위해 단일 부품의 배율조정이 그려지지 않습니다. 편지(A)는진공 펌프,(B)액체(에탄올, 표백제 또는 멸균수)를 수집하는 저수지 병을 나타내며,(C)액체의 역류를 피하기 위한 밸브,(D)멸균 200 μL 파이펫 팁,(E)종자 및 멸균 액을 함유한 1.5mL 마이크로센트리슈지 튜브를 나타낸다. 화살표는 기류의 방향을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 씨앗의 높은 처리량 액체 표면 살균
참고: 96개의 독립적인 샘플을 가진 아라비도시스 탈리아나(L.) Heynh 야생형(Col-0) (아라비도시스) 종자의 표면 살균에 필요한 전체적인 절차 및 최소한의 시간은 도 2로요약된다.
- 프로그레시브 번호가 있는 48 x 1.5 mL 마이크로센심분리기 튜브의 영구 마커 2회 배치가 있는 라벨.
- 96개의 멸균 1.5mL 마이크로센심분리기 튜브(튜브의 원추형 끝의 바닥 위 약 1-2mm)에 100-200개의 아라비도시스 씨앗을 추가합니다.
- 알리코트 약 1000 μL의 70% 에탄올은 라미나르 플로우 후드(시드 배치 1, 48튜브) 내부의 10mL 멸균 서학적 파이펫을 사용하여 각 튜브에 넣고 뚜껑을 조심스럽게 닫습니다.
참고: 분배된 부피가 씨앗의 부피보다 몇 배 더 높은 한 솔루션을 분배하는 것이 매우 정확할 필요는 없습니다. 또는 라미나르 후드(비멸 상태)의 외부로 이 단계를 수행합니다. - 셰이커에서 적어도 3 분 동안 8.0 Hz의 진동 주파수에서 튜브를 흔들어주세요.
- 셰이커에서 어댑터를 제거하고 벤치탑 마이크로센심분리기 의 바구니에 옮기습니다.
- 펄스 기능(대부분의 벤치탑 원심분리기에 있음)을 사용하여 씨앗을 빠르게 회전하여 1880 x g(~15s)에 도달합니다.
참고: 더 긴 시간 또는 더 높은 원심 분리 력은 종자 발아에 부정적인 영향을 미칩니다. - 어댑터에서 하나의 랙으로 48 개의 튜브를 옮기고 라미나르 흐름 후드 아래에있는 모든 튜브를 엽니 다. 튜브에 끼어드는 뚜껑의 일부를 만지지 않음으로써 오염을 피하십시오. 뚜껑이 서로 너무 가까우면 튜브를 두 개의 랙으로 나누어 쉽게 처리하십시오.
- 멸균 200 μL 노란색 팁을 라미나르 플로우 후드 아래에 수제 흡인기의 수족관 밸브 입구에 넣고 펌프를 켭춥시다.
- 액체를 빨아 먹을 때 씨앗을 만지지 않도록 씨앗의 수준 바로 위에 노란색 팁을 삽입합니다. 또는, 신속하게 튜브의 바닥에 팁을 배치; 씨앗이 액체의 흡입을 차단하는 경우 노란색 팁을 제거하고 새 팁을 삽입합니다.
- 각 튜브에 알리쿼트는 라미나르 플로우 후드 내부의 10mL 멸균 세로지컬 파이펫을 사용하여 표백제 의 약 1000 μL에 넣습니다.
- 모든 뚜껑을 단단히 닫고 모든 튜브를 셰이커 어댑터에 다시 넣습니다. 셰이커에서 적어도 3 분 동안 8.0 Hz의 진동 주파수에서 튜브를 흔들어주세요.
- 1880 x g(~15s)에 도달하는 데 필요한 시간 동안 벤치탑 원심분리기의 펄스 기능을 사용하여 씨앗을 빠르게 회전시합니다.
- 새로운 멸균 200 μL 노란색 팁은 라미나르 유동 후드 아래의 진공 펌프에 연결된 수족관 밸브에 넣고 펌프를 켭춥시다.
- 표백제 용액을 빨아 먹을 때 씨앗을 만지지 않도록 씨앗 의 수준 위에 노란색 팁을 삽입합니다.
- 각 튜브에 알리쿼트가 10mL 멸균 혈청 을 사용하여 멸균 된 H2O의 약 1000 μL에 알리코트.
참고: 두 배치의 시드 를 결합하여 작동 시간을 최소화합니다. - 새로운 멸균 200 μL 노란색 팁을 라미나르 유동 후드 아래의 진공 펌프에 연결된 수족관 밸브에 넣고 펌프를 켭춥시다.
- H2O를 빨아 먹을 때 씨앗을 만지지 않도록 씨앗 의 수준 바로 위에 노란색 팁을 삽입합니다.
- 10mL 멸균 세로지컬 파이펫을 사용하여 멸균 된 H2O의 약 500 μL 각 튜브에 알리쿼트가 라미나르 플로우 후드의 모든 뚜껑을 닫습니다. 씨앗은 파종 될 준비가되어 있습니다. 필요한 경우 튜브를 최대 몇 시간 동안 또는 하룻밤 동안 4 °C로 유지하십시오.
- 액체를 적당량의 물로 채우고 자동 복제하는 데 사용되는 저수지 병을 채웁니다. 그 후 액체를 일반 싱크대에 버리십시오.
참고 : 저장소 내부의 모든 씨앗을 죽일 액체를 자동 클애브.
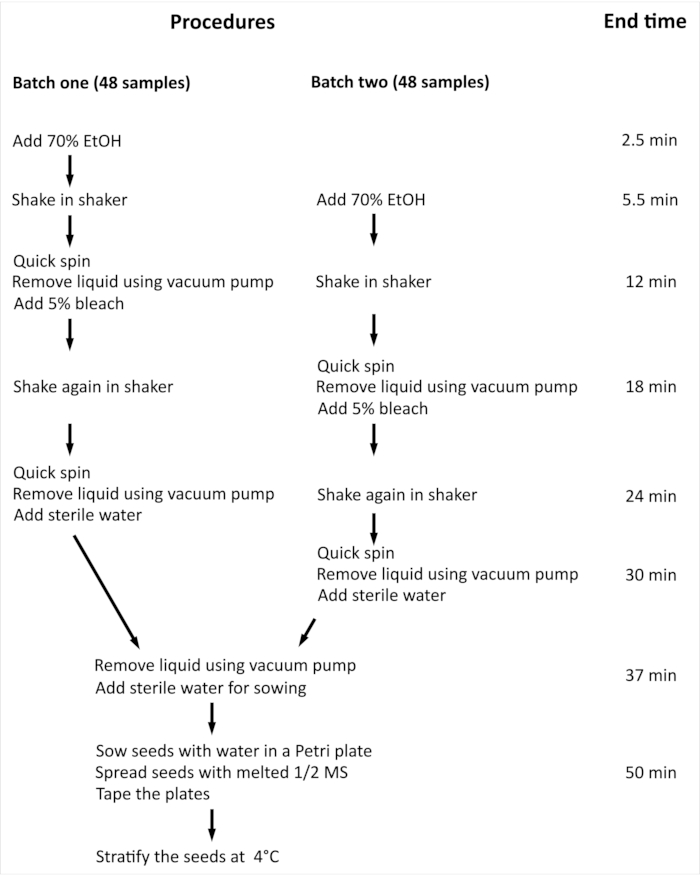
그림 2: 96 개의 독립적 인 샘플로 아라비도시스 씨앗의 표면 살균에 필요한 절차 및 최소 시간의 개요. 제시된 실험에서 96개의 독립적인 샘플은 두 개의 동일한 크기의 배치로 처리됩니다. 전체 프로시저는 두 일괄 처리모두에 대해 동일하며 병렬로 처리되지만 배치 2는 일괄 처리에 비해 한 단계 지연으로 처리됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 1/2 MS 플레이트에 아라비도시스의 도금 및 점수
- 1000 μL 파이펫으로 부드러운 파이펫을 하여 멸균 H2O의 씨앗과 300-400 μL을 페트리 접시에 옮기습니다.
- 10개의 튜브를 옮김한 후, 항생제 없이 녹은 1/2 MS 배지의 약 1.5-2.0mL 각 접시에 붓습니다.
참고: 사전에 녹인 다음 1/2 MS용 융매체를 50-53°C로 설정된 온도성 욕조에 보관하여 응고를 피하십시오. 씨앗의 발아성을 감소시키지 않도록 온도가 58 °C를 초과하지 않도록하십시오. - 접시를 빠르게 소용돌이에 넣고 씨앗을 안쪽으로 분배합니다. 플레이트를 반대편에 테이프로 고정합니다.
- 접시를 플라스틱 또는 알루미늄 호일에 싸서 냉장고(4°C)에 넣고 어둠 속에서 3일 동안 넣어 균일한 발아를 얻습니다.
- 100-120 μmol·m-2·s-1 및 60% 상대 습도의 가벼운 강도로 장일 조건(16h light/8h dark)에서 23°C로 설정된 성장 챔버로 플레이트를 옮깁니다.
- 이틀 후, 복사의 존재에 의해 식물점수를 매는다. 씨앗 발아를 평가하기 위해 방사형 출현과 녹색 코틸레돈 형성 (두 코틸레돈의 전체 개방)을 감지합니다.
5. 통계 분석
참고: 여기에서 Tukey의 쌍방향 테스트는 통계 분석에 사용되었습니다.
- 0.01 미만의 P 값을 통계적으로 유의한 것으로 간주합니다. 적어도 5개의 생물학적 복제로 모든 실험을 수행하십시오.
결과
전체 종자 살균 절차에 필요한 시간을 평가하기 위해, 현재 프로토콜에서 96개의 시료를 처리하는 액체 처리시 시간 차이를 계산하고 기존의 파이펫팅 방법과 비교하였다. 결과는 현재 프로토콜이 시간을 절약하여 기존의 프로토콜(표 1)을 사용하여 액체 처리 시간을 4분의1로줄임을 나타냅니다. 이 표는 현재 프로토콜의 액체 제거 시간이 기존 방법보다 더 많은 시간을 절약하고 전체...
토론
씨앗의 살균은 애기독증의 기능 적 연구를위한 기본 단계입니다. 그것은 자주 많은 다른 목적을 위해 수행 되지만, 애비도시스에서 높은 처리량 종자 표면 살균에 제한 된 연구를 사용할 수 있습니다.
지금까지, 가장 높은 처리량을 가진 방법 중 하나는 농축 된 HCl과 표백제혼합에 의해 생성 된 염소 가스를 사용하는 것입니다. 이 방법은 제한된 실습 시간을 필요로하지만, 그?...
공개
모든 저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 연구는 폰다지오네 E. 마하의 에코게노믹스 그룹의 핵심 자금을 통해 트렌토 자치구에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Aquarium valve | Amazon | B074CYC5SD | Kit including 2 valves and thin-walled tubings. The valve prevents the liquids to go back to the sterile tip |
| Arabidopsis Col-0 wild-type seeds | Nottingham Arabidopsis Stock Center | N1093 | Wild type seeds (sensitive to kanamycin) |
| Arabidopsis transgenic line AdoIspS-79 seeds | NA | NA | Transgenic line overexpressing an isoprene synthase gene from Arundo donax transformed in the Col-0 background, resistant to kanamycin (Li et al. (2017) Mol. Biol. Evol., 34, 2583–2599). Available on request from the authors |
| Microcentrifuge | Eppendorf | EP022628188 | Benchtop microcentrifuge used for spinning down the seeds |
| Murashige & Skoog medium including vitamins | Duchefa | M0222 | Standard medium for plant sterile culture |
| Pipette controller | Brand | 26300 | Used to operate the serological pipette |
| Polyethylene tube 1 | Roth | 9591.1 | Tube for connection from vacuum pump to decantation bottle (inner diameter: 7 mm; outer diameter: 9 mm) |
| Polyethylene tube 2 | Roth | 9587.1 | Tube for connection from decantation bottle to the aquarium valve (inner diameter: 5 mm; outer diameter: 7 mm) |
| Screw cap with connectors | Roth | PY86.1 | 2-way dispenser screw cap GL45 in polypropylene for decanting bottle |
| Serological pipette | Brand | 27823 | Graduated glass (reusable) serological pipette. Disposable pipettes can be used instead |
| Shakeret al. | Qiagen | 85300 | TissueLyser II bead mill used normally for tissue homogenization. Without the addition of beads to the tubes it works as shaker. |
| Technical ethanol | ITW Reagents (Nova Chimica Srl) | 212800 | Ethanol 96% v/v partially denatured technical grade |
| Tween 20 | Merck Millipore | 655205 | Non-ionic detergent acting as surfactant |
| Universal tubing connectors | Roth | Y523.1 | Can be used to improve/simplify tubing connections |
| Vacuum pump | Merck Millipore | WP6222050 | Used for making the suction device |
참고문헌
- Somerville, C., Koornneef, M. A fortunate choice: The history of Arabidopsis as a model plant. Nature Reviews Genetics. 3 (11), 883-889 (2002).
- Koornneef, M., Meinke, D. The development of Arabidopsis as a model plant. Plant Journal. 61 (6), 909-921 (2010).
- Initiative, T. A. G. Analysis of the genome sequence of the flowering plant Arabidopsis thaliana. Nature. 408 (6814), 796-815 (2000).
- Krysan, P. J., Young, J. C., Sussman, M. R. T-DNA as an insertional mutagen in Arabidopsis. Plant Cell. 11 (12), 2283-2290 (1999).
- Speulman, E., et al. A two-component enhancer-inhibitor transposon mutagenesis system for functional analysis of the arabidopsis genome. Plant Cell. 11 (10), 1853-1866 (1999).
- Jander, G., et al. Ethylmethanesulfonate saturation mutagenesis in Arabidopsis to determine frequency of herbicide resistance. Plant Physiology. 131 (1), 139-146 (2003).
- Zhang, X., Henriques, R., Lin, S. -. S., Niu, Q. -. W., Chua, N. -. H. Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method. Nature Protocols. 1 (2), 641-646 (2006).
- Togninalli, M., et al. AraPheno and the AraGWAS catalog 2020: A major database update including RNA-Seq and knock-out mutation data for Arabidopsis thaliana. Nucleic Acids Research. 48 (1), 1063-1068 (2020).
- Lan, Y., et al. AtMAD: Arabidopsis thaliana multi-omics association database. Nucleic Acids Research. 49 (1), 1445-1451 (2021).
- Xu, J., Trainotti, L., Li, M., Varotto, C. Overexpression of isoprene synthase affects ABA-and drought-related gene expression and enhances tolerance to abiotic stress. International Journal of Molecular Sciences. 21 (12), 1-21 (2020).
- Czarnecki, O., et al. Simultaneous knock-down of six non-family genes using a single synthetic RNAi fragment in Arabidopsis thaliana. Plant Methods. 12 (1), 1-11 (2016).
- Yan, L., et al. high-efficiency genome editing in arabidopsis using YAO promoter-driven CRISPR/Cas9 system. Molecular Plant. 8 (12), 1820-1823 (2015).
- Liu, Y., Gao, Y., Gao, Y., Zhang, Q. Targeted deletion of floral development genes in Arabidopsis with CRISPR/Cas9 using the RNA endoribonuclease Csy4 processing system. Horticulture Research. 6 (1), (2019).
- Grefen, C., et al. Subcellular localization and in vivo interactions of the Arabidopsis thaliana ethylene receptor family members. Molecular Plant. 1 (2), 308-320 (2008).
- Gazzani, S., et al. Evolution of MIR168 paralogs in Brassicaceae. BMC Evolutionary Biology. 9 (1), (2009).
- Lee, S., Korban, S. S. Transcriptional regulation of Arabidopsis thaliana phytochelatin synthase (AtPCS1) by cadmium during early stages of plant development. Planta. 215 (4), 689-693 (2002).
- Long, Y., et al. In vivo FRET-FLIM reveals cell-type-specific protein interactions in Arabidopsis roots. Nature. 548 (7665), 97-102 (2017).
- Freire-Rios, A., et al. Architecture of DNA elements mediating ARF transcription factor binding and auxin-responsive gene expression in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 117 (39), 24557-24566 (2020).
- Rivero, L., et al. Handling arabidopsis plants: Growth, preservation of seeds, transformation, and genetic crosses. Methods in Molecular Biology. 1062, 3-25 (2014).
- Chen, J. H., et al. Drought and salt stress tolerance of an arabidopsis glutathione S-transferase U17 knock-out mutant are attributed to the combined effect of glutathione and abscisic acid. Plant Physiology. 158 (1), 340-351 (2012).
- Li, D. Z., et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants. Proceedings of the National Academy of Sciences of the United States of America. 108 (49), 19641-19646 (2011).
- Mathur, J., Koncz, C. Establishment and maintenance of cell suspension cultures. Arabidopsis Protocols. Methods in Molecular Biology. 82, 27-30 (1998).
- Li, M., Cappellin, L., Xu, J., Biasioli, F., Varotto, C. High-throughput screening for in planta characterization of VOC biosynthetic genes by PTR-ToF-MS. Journal of Plant Research. 133 (1), 123-131 (2020).
- Li, M., et al. In planta recapitulation of isoprene synthase evolution from ocimene synthases. Molecular Biology and Evolution. 34 (10), 2583-2599 (2017).
- Li, M., et al. Evolution of isoprene emission in Arecaceae (palms). Evolutionary Applications. 14, 902-914 (2020).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods in Molecular Biology. 343, 87-104 (2006).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488 (7409), 86-90 (2012).
- Tkacz, A., Cheema, J., Chandra, G., Grant, A., Poole, P. S. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition. ISME Journal. 9 (11), 2349-2359 (2015).
- Singh, N., Gaddam, S. R., Singh, D., Trivedi, P. K. Regulation of arsenic stress response by ethylene biosynthesis and signaling in Arabidopsis thaliana. Environmental and Experimental Botany. 185, 104408 (2021).
- Lindsey, B. E., Rivero, L., Calhoun, C. S., Grotewold, E., Brkljacic, J. Standardized method for high-throughput sterilization of Arabidopsis seeds. Journal of Visualized Experiments: JOVE. (128), e56587 (2017).
- Acemi, A., Özen, F. Optimization of in vitro asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech Journal. 3 (3), 143-151 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유