A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקת הזנת ממברנה סטנדרטית לזיהוי זיהום פלסמודיום פלציפרום בווקטורים של יתושים אנופלס
In This Article
Summary
בדיקת הזנת הממברנה הסטנדרטית (SMFA) נחשבת לתקן הזהב להערכה וזיהוי של תרכובות פוטנציאליות נגד מלריה. מערכת האכלה מלאכותית זו משמשת להדבקת יתושים כדי להעריך עוד יותר את ההשפעות של תרכובות כאלה על העוצמה והשכיחות של טפיל פלסמודיום falciparum .
Abstract
מלריה נותרה אחת המחלות ההרסניות ביותר בעולם, ועד כה, האזור האפריקאי עדיין אחראי ל -94% מכלל המקרים ברחבי העולם. מחלה טפילית זו דורשת טפיל פרוטוזואי, וקטור יתוש אנופלס ופונדקאי בעל חוליות. הסוג אנופלס כולל יותר מ -500 מינים, מתוכם 60 ידועים כווקטורים של הטפיל. הסוג טפיל פלסמודיום מורכב מ-250 מינים, ו-48 מהם מעורבים בהעברת מחלות. יתר על כן, טפיל הפלסמודיום פלציפרום תרם בשנים האחרונות לכ-99.7% ממקרי המלריה באפריקה שמדרום לסהרה.
גמטוציטים מהווים חלק מהשלב המיני של הטפיל והם נבלעים על ידי נקבת היתוש כאשר הם ניזונים מפונדקאי אנושי נגוע. התפתחות נוספת של הטפיל בתוך היתוש משופרת על ידי תנאים סביבתיים נוחים באמצע היתוש. כאן מתרחש המיזוג של הגמטות הנקביות והזכריות, ומקורם של האוקינטים התנועתיים. האוקינטים נכנסים לאפיתל midgut של היתוש, ואוקינטים בוגרים יוצרים oocysts, אשר, בתורם, מייצרים ספורוזואיטים תנועתיים. ספורוזואיטים אלה נודדים לבלוטות הרוק של היתוש ומוזרקים כאשר יתוש לוקח ארוחת דם.
למטרות גילוי תרופות, יתושים הודבקו באופן מלאכותי בדם נגוע בגמטוציטים בבדיקת הזנת הממברנה הסטנדרטית (SMFA). כדי לזהות זיהום בתוך היתוש ו/או כדי להעריך את היעילות של תרכובות נגד מלריה, הוסרו היתושים של נקבות היתושים לאחר ההדבקה והוכתמו במרקורוכרום. שיטה זו שימשה כדי לשפר את הזיהוי החזותי של oocysts תחת מיקרוסקופ לקביעה מדויקת של שכיחות oocyst ועוצמה.
Introduction
מלריה, הידועה כאחת המחלות ההרסניות ביותר בעולם, עדיין מהווה איום גדול על מספר מדינות - במיוחד אלה באזור אפריקה - ותורמת לכ-95% מהמקרים ברחבי העולם1. מחלה זו נגרמת על ידי טפיל פרוטוזואי, יחד עם וקטור יתוש Anopheles שלה, האשמים האלה יכולים לגרום נזק רב המארח האנושי2. ליתר דיוק, המין falciparum של סוג טפיל פלסמודיום אחראי על כ 99% ממקרי המלריה באפריקה שמדרום לסהרה1. בנוסף לכך, ניתן להאשים מספר וקטורים עיקריים של יתושי אנופלס (כולל An. gambiae Giles, An. arabiensis Patton, An. coluzzii Coetzee & Wilkerson sp.n., ו- An. funestus Giles) ביותר מ-95% מהעברת הטפילים ברחבי העולם 3,4,5,6,7,8 . כדי להקים את החברות האידיאלית של טפיל-וקטור, וקטור היתוש צריך להיות רגיש לטפיל ולהיות מסוגל להעביר אותו9. יתר על כן, גם הווקטור וגם הטפיל צריכים להתגבר על מחסומים פיזיים כדי ליצור את השילוב הזיהומי המושלם - וקטור היתוש צריך להיות מסוגל לקיים את התפתחות הטפיל, והטפיל צריך להיות בעל יכולת להתגבר על מנגנוני ההגנה של הפונדקאי10,11.
גמטוציטים, השלב המיני של טפיל P. falciparum, ממלאים תפקיד מכריע בחיבור בין השותפים הווקטוריים והטפילים12. ההתפתחות המינית מתרחשת in vivo, וגמטוציטוגנזה מתארת את תהליך ההתמיינות של גמטוציטים בוגרים למיקרוגמטות זכריות תנועתיות ומקרוגמטות נקביות13. תהליך נוסף המתרחש בתוך היתוש הוא exflagellation - התהליך שבמהלכו הגמטוציט הזכרי הופך לגמטות ומגיח מתוך תאי הדם האדומים שנלקחו במהלך ארוחת דם11. תהליך ההסתגרות מוצע עוד יותר להיות משופר על ידי שינוי חיובי בסביבה של יתוש midgut14. לאחר exflagellation, זיגוטה נוצרת על ידי מיזוג של גמטות זכר ונקבה13. מן הזיגוטה, אוקינט תנועתי עולה ועובר מארוחת הדם לאפיתל של היתוש midgut13. כאן, ookinete מתבגר, ו oocyst נוצר, אשר, בתורו, מייצר sporozoites תנועתי13,15. לאחר מכן הספורוזואיטים נודדים לבלוטות הרוק של היתושים, וכאשר היתוש לוקח ארוחת דם מהפונדקאי שלו, ספורוזואיטים אלה מוזרקים לזרם הדם של הפונדקאי15.
התערבויות בקרת מלריה, המשלבות אסטרטגיות בקרת וקטורים ושימוש בתרופות יעילות נגד מלריה, הפכו חיוניות במאבק במחלה זו15. עם העלייה בעמידות בפני טפילים ויתושים, הדחיפות לזיהוי תרכובות חדשות נגד מלריה עולהב-16. לכן, הערכת in vivo של תרכובות חוסמות שידור חשובה16. לאחר פיתוח של תרופות חוסמות העברה יעילות כאלה, SMFA שימש כדי להעריך אם תרכובות אלה מעכבות את ההתפתחות המינית של P. falciparum יתוש Anopheles 17,18,19. בדיקה זו זכתה להכרה מאז שנות ה-70 וה-80 של המאה ה-20 כתקן הזהב להערכת חסימת תמסורת20,21. בדיקה זו מספקת אלטרנטיבה זולה יותר מאשר בדיקות אחרות כגון RT-qPCR, הדורשת ציוד מיוחד. יתר על כן, אין צורך בחולים כדי לבצע את הניסויים. בדיקה זו כוללת גם מתן דם המושרה על ידי גמטוציטים ליתושים נקבות, אשר מנותחים לאחר מכן כדי להעריך אם התפתחות oocyst קיים21. זה מאפשר כימות גמטוציטים וזיהוי של oocysts מעוותים בגלל תרכובות22. כדי שתרכובת תסווג כיעילה, יש להעריך את השכיחות (שיעור היתושים שיש להם לפחות אוציסט אחד באמצע המעיים) ואת מספר האוציסטים (עוצמה) במידגוט היתושים כדי להעריך את עיכוב הזיהום 17,21,22.
Access restricted. Please log in or start a trial to view this content.
Protocol
עיין באיור 1 להמחשה של הפרוטוקול. אישור אתי התקבל מוועדת האתיקה למדעי הבריאות של אוניברסיטת פרטוריה (506/2018) לנסיגה ושימוש בדם אנושי.
1. תרבות הגמטוציטים
הערה: לפני הקמת ה- SMFA, הוכנה תרבות גמטוציטים באוניברסיטת פרטוריה (ראה Reader et al.22 לפרוטוקול המלא).
- הכינו תרבית גמטוציטים המורכבת מגמטוציטים שלב V מזן הטפיל NF54.
- ודא כי gametocytemia של התרבית הוא בין 1.5% ל 2.5%, עם hematocrit 50% בסרום זכר A+, שאליו מוסיפים תאי דם אדומים טריים.
- יש להפריד את התרבית לצלוחיות שונות ולהוסיף 2 מיקרומטר מכל תרכובת לכל טיפול בהתאמה 48 שעות לפני ביצוע ה-SMFA. השאירו את קבוצת הביקורת ללא טיפול.
- הערך את תרבות הגמטוציטים זמן קצר לפני ביצוע ה- SMFA כדי להבטיח את ההצפה של גמטות זכריות, עם נוכחות של יחס נקבה:זכר 3:1.
2. זיהום מלאכותי של יתושים דרך SMFA
הערה: בטיחות ביולוגית: יתושים נגועים צריכים להיות מאוחסנים במתקן בטיחות ביולוגית ברמה 2 (BSL2) עם גישה מוגבלת.
- באמצעות שואב הפה, הכניסו 25 יתושי An. gambiae נקבות לא מזוהמות לכוס האכלה של 350 מ"ל. עשו את אותו הדבר עבור כל טיפול ותייגו את הכוסות בצורה ברורה בהתאם לשאלה אם יש להשתמש בהן כקבוצות ביקורת או טיפול. בחר את מספר הכוסות לכל טיפול בהתאם למספר המשכפלים הטכניים הכלולים.
הערה: יתושי מושבה בני 5 עד 7 ימים משמשים בהערכת תרכובת חוסמת העברה טיפוסית. הרעבת יתושים במשך 3-4 שעות או יותר לפני הזנת הדם תקל על ספיגת הדם במהלך SMFA. - חבר את מערכת הזנת הזכוכית לאמבטיית המים ושמור על הטמפרטורה ב 37 מעלות צלזיוס.
הערה: מזין הזכוכית מורכב משתי זרועות, המחוברות לצינורות הסיליקון שאליהם מחוברת אמבט המים (איור 2). המבנה החלול של המזין מאפשר למים לזרום דרך ותחזוקה של הטמפרטורה של הדם. - הכינו את המעי של הפרה (או הקרום הסינתטי) על ידי שטיפתו במי ברז וחתכו אותו לחתיכות המותאמות לכל מאכיל. מכסים כל מזין ומהדקים את הממברנה עם רצועה אלסטית.
הערה: לא היה צורך באישור אתי למעי, מכיוון שהוא נקנה מקצבייה מקומית, שם הוא נמכר לציבור להכנת מזון. - הניחו את כוסות הזיהום מתחת למאכילים, כאשר הממברנה מונחת על גבי רשת הכוס.
- הוסף 1 מ"ל של דם נגוע בגמטוציטים למזיני כוסות הבקרה ודם נגוע בגמטוציטים עם תרכובת נוספת לכל מזין תרכובת וכוס מתאימים.
- השאירו את היתושים להאכיל במשך כ 40 דקות עם המזינים חשופים.
הערה: האכלות מתבצעות בתנאי חרקים (25 מעלות צלזיוס, 80% לחות יחסית) בחושך. קוטר המזין הוא כ -13 מ"מ. - לאחר ההאכלה, להסיר את המזינים מן הכוסות, לשטוף את המאכילים, ולטפל הדם עודף עם hypochlorite.
- הסר את היתושים הלא מזוהמים מהכוס על ידי הפלת כל היתושים על הקרח (למשך 1-2 דקות) והפרדת היתושים הלא מזוהמים מאלה שלקחו ארוחת דם. חפשו בטן נפוחה ואדומה (מה שמעיד על דם) כדי להבחין בין היתושים שניזונו במלואם לבין אלה שלא ניזונים (איור 3).
- הניחו את כוסות הזיהום בתא הבטיחות הביולוגית (איור משלים S1) וספקו לכל כרית מי סוכר של 10%, תוך החלפת מי הסוכר בימים חלופיים למשך 8-10 ימים.
3. הכנת יתושים נגועים
הערה: חלק זה של הפרוטוקול מתרחש בחדר ההדבקה BSL2. רק צוות מורשה ומיומן רשאי להיכנס לחדר ההדבקה שבו שוכנים יתושים נגועים. היתושים נשמרים בכוסות מהונדסות המכילות נקודת כניסה אחת בלבד, אשר אוטמת באופן אוטומטי כאשר מסירים את שואב הפה. כוסות אלה מונחות בתוך מיכל תרמופלסטי שקוף כדי למנוע בריחה. המכולה ממוקמת בחדר ההדבקה מאחורי מערכת דלת כפולה. כל הפרוטוקולים הדרושים חייבים להיות במקום לחשיפה מקרית ליתושים נגועים (קובץ משלים S1). הפרוטוקולים הם ספציפיים למדינה ותלויים בדרישות המוסד.
- בימים 8-10 לאחר האכלת הזיהום, הפילו את היתושים הנגועים על ידי הנחתם על קרח והעברתם לצינורות מסומנים עם 70% אתנול (שמירה על היתושים של כל קבוצת ביקורת וטיפול בנפרד).
- ודא כי כל היתושים מתים לפני היציאה מחדר ההדבקה.
4. נתיחות של יתושים נגועים
הערה: חלק זה של הפרוטוקול מתבצע במעבדה.
- העבירו את היתושים לצלחות פטרי מסומנות מרופדות בנייר סינון, תוך שמירה על הפרדה בין קבוצות הביקורת והבדיקה.
- הניחו טיפה של תמיסת מלח עם אגירת פוספטים (PBS) על שקופית מיקרוסקופית (המסומנת על פי קבוצת הביקורת/בדיקה) והעבירו יתוש בודד מנייר הסינון ל-PBS.
- הסר את המותניים מהדגימה המשותקת והנגועה על ידי הצמדת בית החזה של היתוש עם מחט החיתוך תוך משיכת מקטע הבטןהשביעי עם המלקחיים.
- כאשר המעיים חשופים ונראים לעין, חפשו את הצינוריות המלפיגיאניות (איור 4A,B) כדי להבחין בין המעיים לבין השחלות. מוציאים אותו מה-PBS, מעבירים אותו לטיפה של 0.1% מרקורוכרום במגלשה חדשה במיקרוסקופ, ומשאירים את המעיים להכתים למשך 8-10 דקות.
- לאחר ההכתמה, הניחו כיסוי על המעיים המוכתמים וצפו במעיים תחת תאורת שדה בהיר בהגדלה של 20x-40x (איור 4C,D).
- רשום את הנוכחות של ומספר oocysts לכל midgut עבור כל קבוצת ביקורת וטיפול (קובץ משלים S2).
- חשב את פעילות חסימת השידור באמצעות משוואה (1):
%TBA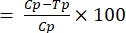 (1)
(1)
כאשר TBA = פעילות חוסמת שידור (ירידה בשכיחות oocyst); p = שכיחות oocyst; C = שליטה; ו- T = טיפול. - חשב את הפעילות המפחיתה את השידור באמצעות משוואה (2):
%TRA =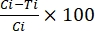 (2)
(2)
כאשר TRA = פעילות מפחיתה תמסורת (הפחתה בעוצמת oocyst); I = עוצמת אוסיסט; C = שליטה; ו- T = טיפול.
הערה: ייתכן שה-TBA לא יופחת באופן משמעותי, אך ניתן להבחין בהבדל משמעותי ב-TRA ולהיפך. זה תלוי בחומר הכימי המוערך. - בצע ניתוח סטטיסטי באמצעות מבחן t שאינו פרמטרי (Mann-Whitney).
Access restricted. Please log in or start a trial to view this content.
תוצאות
המספר הכולל של דגימות הבקרה שנותחו היה 47, עם שכיחות ממוצעת של 89% ועוצמה של 9.5 oocysts לכל midgut (טבלה 1, כפי שפורסם קודםלכן 22). עבור התרכובת MMV1581558, גודל המדגם הגיע לסך של 42 דגימות, עם שכיחות של 36% oocyst ועוצמה ממוצעת של 1.5 oocysts. זה מראה ירידה בשכיחות oocyst של 58% ו- TRA של 82% על פני כל שלושת ...
Access restricted. Please log in or start a trial to view this content.
Discussion
כדי שפרוטוקול זה יבוצע בהצלחה, יש לתת תשומת לב לכל שלב, למרות שזה עשוי להיות תהליך מייגע ומייגע. אחד הצעדים החשובים ביותר הוא להבטיח כי תרבות gametocyte הוא באיכות טובה וכי הוא מורכב gametocytes בוגרים, עם יחס זכר:נקבה הנכון, לפני תחילת SMFA23,24. במהלך ה-SMFA, חשוב גם לשמור על ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים מבקשים להודות לפרופ'. לין-מארי בירקהולץ וד"ר ג'נט רידר מהמחלקה לביוכימיה, גנטיקה ומיקרוביולוגיה, המכון לבקרת מלריה בת קיימא, באוניברסיטת פרטוריה, על גידול ואספקת תרבות הגמטוציטים. זן הטפיל התקבל מהמחלקה האחרונה (לא חלק מפרסום זה). המחלקה למדע וחדשנות (DSI) וקרן המחקר הלאומית (NRF); יוזמת כסאות מחקר בדרום אפריקה (UID 64763 ל- LK ו- UID 84627 ל- LMB); קהילות הנוהג של NRF (UID 110666 ל- LMB ו- LK); ושותפויות החדשנות האסטרטגית בתחום הבריאות של מועצת המחקר הרפואי של דרום אפריקה (SHIP) מוכרות גם הן עבור כספים מה-DSI.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine intestine/ | Butchery | ||
| Compound MMV1581558 | MMV | Pandemic response box | |
| Dissecting needles | WRIM | Custom made | |
| falcon tube | Lasec | ||
| Glass feeders | Glastechniek Peter Coelen B.V. | ||
| Graphpad Prism (8.3.0) | Graphpad | ||
| Mercurochrome | Merck (Sigma-Aldrich) | 129-16-8 | |
| Microscope slides | Merch (Sigma-Aldrich) | S8902 | |
| Parafilm | Cleansafe | ||
| PBS tablets | ThermoFisher Scientific | BP2944 | |
| Perspex biosafety cabinet | Wits University | Made by the contractors at Wits | |
| Plastic cups (350 mL) | Plastic Land |
References
- World Malaria Report. World Health Organization. , Available from: https://www.who.int/publications/i/item/9789240040496 (2021).
- Takken, W., Verhulst, N. O. Host preferences of blood feeding mosquitoes. Annual Review of Entomology. 58, 433-453 (2013).
- Gillies, M. T., Coetzee, M. Supplement to the Anophelinae of Africa south of the Sahara Afrotropical region. Publications of the South African Institute for Medical Research. 55, 1(1987).
- Gillies, M. T., De Meillon, B. The Anophelinae of Africa south of the Sahara. Publications of the South African Institute for Medical Research. 54, (1968).
- Antonio-Nkondjio, C., et al. Complexity of the malaria vectorial system in Cameroon: contribution of secondary vectors to malaria transmission. Journal of Medical Entomology. 43, 1215-1221 (2006).
- Sinka, M. E., et al. The dominant Anopheles vectors of human malaria in Africa, Europe and the Middle East: occurrence data, distribution maps and bionomic précis. Parasites and Vectors. 3, 117(2010).
- Coetzee, M., Hunt, R. H., Wilkerson, R., Della Torre, A., Coulibaly, M. B., Besansky, N. J. Anopheles coluzzii and Anopheles amharicus, new members of the Anopheles gambiae complex. Zootaxa. 3619, 246-274 (2013).
- Kyalo, D., Amratia, P., Mundia, C. W., Mbogo, C. M., Coetzee, M., Snow, R. W. A geo-coded inventory of anophelines in the Afrotropical Region south of the Sahara: 1898-2016. Wellcome Open Research. 2, 57(2017).
- Cohuet, A., Harris, C., Robert, V., Fontenille, D. Evolutionary forces on Anopheles: What makes a malaria vector. Trends in Parasitology. 309, (2009).
- Weathersby, A. B. The role of the stomach wall in the exogenous development of Plasmodium gallinaceum as studies by means of haemocoel injections of susceptible and refractory mosquitoes. The Journal of Infectious Diseases. 91, 198-205 (1952).
- Ally, A. S. I., Vaughan, A. M., Kappe, S. H. I. Malaria parasite development in the mosquito and infection of the mammalian host. The Annual Review of Microbiology. 63, 195-221 (2009).
- Delves, M. J., et al. Male and female Plasmodium falciparum mature gametocytes show different responses to antimalarial drugs. American Society for Microbiology Journal. , (2013).
- Sinden, R. E. Sexual development of malarial parasites in their mosquito vector. Transactions of the Royal Society of Tropical Medicine and Hygiene. 75, (1981).
- Garcia, G. E., Wirtz, R. A., Barr, J. R., Woolfitt, A. Xanthurenic acid induces gametogenesis in Plasmodium, the malaria parasite. Journal of Biological Chemistry. 15, 12003-12005 (1998).
- Oaks, S. C. Jr, Mitchell, V. S., Pearson, G. W., et al. Malaria: Obstacles and Opportunities. , National Academic Press. ISBN 0-309-54389-4 (1991).
- Le Manach, C., et al. Identification and profiling of a novel Diazaspirol[3.4]octane chemical series active against multiple stages of the human malaria parasite Plasmodium falciparum and optimization efforts. Journal of Medicinal Chemistry. 64, 2291-2309 (2021).
- Cibulskis, R. E., et al. Malaria: global progress 2000-2015 and future challenges. Infect Diseases of Poverty. 5, 61(2016).
- Smith, T. A., Chitnis, N., Briet, O. J., Tanner, M. Uses of mosquito-stage transmission-blocking vaccines against Plasmodium falciparum. Trends in Parasitology. 27, 190-196 (2011).
- Boyd, M. F. Epidemiology: factors related to the definitive host. Malariology. Boyd, M. F. , W.B. Saunders. Philadelphia. 608-697 (1949).
- Ponnudurai, T., van Gemert, G. J., Bensink, T., Lensen, A. H., Meuwissen, J. H. Transmission blockade of Plasmodium falciparum: its variability with gametocyte numbers and concentration of antibody. Transactions of The Royal Society of Tropical Medicine. 81, 491-493 (1987).
- Rutledge, L. C., Ward, R. A., Gould, D. J. Studies on the feeding response of mosquitoes to nutritive solutions in a new membrane feeder. Mosquito News. 24 (4), (1964).
- Reader, J., et al. Multistage and transmission-blocking targeted antimalarials discovered from the open-source MMV Pandemic Response Box. Nature Communications. 12, 269(2021).
- Bousema, T., et al. Mosquito feeding assays for natural infections. PLoS One. 7 (8), (2012).
- Churcher, T., et al. Measuring the blockade of malaria transmission - An analysis of the standard membrane feeding assay. International Journal for Parasitology. 42, 1037-1044 (2012).
- Medley, G. F., et al. Heterogeneity in patterns of malarial oocyst infections in the mosquito vector. Parasitology. 106, 441-449 (1993).
- Miura, K., et al. Transmission-blocking activity is determined by transmission reducing activity and number of control oocysts in Plasmodium falciparum standard membrane-feeding assay. Vaccine. 34, 4145-4151 (2016).
- Sattabongkot, J., Maneechai, N., Rosenberg, R. Plasmodium vivax: gametocyte infectivity of naturally infected Thai adults. Parasitology. 102 (01), 27-31 (1991).
- Vallejo, A. F., Garcia, J., Amado-Garavito, A. B., Arevalo-Herrera, M., Herrera, S. Plasmodium vivax gametocyte infectivity in sub-microscopic infections. Malaria Journal. 15 (1), 48(2016).
- Ponnudurai, T., Lensen, A. H. W., van Gemert, G. J. A., Bolmer, M. G., Meuwissen, J. H. E. Feeding behavior and sporozoite ejection by infected Anopheles stephensi. Transactions of the Royal Society of Tropical Medicine and Hygiene. 85, 175-180 (1991).
- Miura, K., et al. Qualification of standard membrane-feeding assay with Plasmodium falciparum malaria and potential improvements for future assays. PLoS One. 8, 57909(2013).
- Griffin, P., et al. Safety and reproducibility of a clinical trial system using induced blood stage Plasmodium vivax infection and its potential as a model to evaluate malaria transmission. PLoS Neglected Tropical Diseases. 10, 0005139(2016).
- Delves, M. J., Sinden, R. E. A semi-automated method for counting fluorescent malaria oocysts increases the throughput of transmission blocking studies. Malaria Journal. 9, 35(2010).
- vander Kolk, M., et al. Evaluation of the standard membrane feeding assay (SMFA) for the determination of malaria transmission-reducing activity using empirical data. Parasitology. 130, 13-22 (2005).
- van der Kolk, M., de Vlas, S. J., Sauerwein, R. W. Reduction and enhancement of Plasmodium falciparum transmission by endemic human sera. International Journal for Parasitology. 36, 1091-1095 (2006).
- Singh, M., et al. Plasmodium's journey through the Anopheles mosquito: A comprehensive review. Biochimie. 181, 176-190 (2021).
- Vos, M. W., et al. A semi-automated luminescence based standard membrane feeding assay identifies novel small molecules that inhibit transmission of malaria parasites by mosquitoes. Scientific Reports. 5, 18704(2015).
- Azevedo, R., et al. Bioluminescence method for in vitro screening of Plasmodium transmission-blocking compounds. Antimicrobial Agents and Chemotherapy. 61, (2017).
- Okell, L. C., Bousema, T., Griffin, J. T., Ouedraogo, A. L., Ghani, A. C., Drakeley, C. J. Factors determining the occurrence of submicroscopic malaria infections and their relevance for control. Nature Communications. 3, 1237(2012).
- Pasay, C. J., et al. Piperaquine monotherapy of drug-susceptible Plasmodium falciparum infection results in rapid clearance of parasitemia but is followed by the appearance of gametocytemia. The Journal of Infectious Diseases. 214, 105-113 (2016).
- Stone, W. J., et al. A scalable assessment of Plasmodium falciparum transmission in the standard membrane-feeding assay, using transgenic parasites expressing green fluorescent protein-luciferase. The Journal of Infectious Diseases. 210, 1456-1463 (2014).
- Hasan, A. U., et al. Implementation of a novel PCR based method for detecting malaria parasites from naturally infected mosquitoes in Papua New Guinea. Malaria Journal. 8, 182(2009).
- Stone, W. J., et al. The relevance and applicability of oocyst prevalence as a read-out for mosquito feeding assays. Scientific Reports. 3, 3418(2013).
- Marquart, L., Baker, M., O'Rourke, P., McCarthy, J. S. Evaluating the pharmacodynamic effect of antimalarial drugs in clinical trials by quantitative PCR. Antimicrobial Agents and Chemotherapy. 59, 4249-4259 (2015).
- McCarthy, J. S., et al. tolerability, pharmacokinetics, and activity of the novel long-acting antimalarial DSM265: a two-part first-in-human phase 1a/1b randomised study. TheLancet Infectious Diseases. 17, 626-635 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved