Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стандартный анализ мембранного питания для выявления инфекции Plasmodium falciparum у комаров-переносчиков Anopheles
В этой статье
Резюме
Стандартный анализ мембранной подачи (SMFA) считается золотым стандартом для оценки и идентификации потенциальных противомалярийных соединений. Эта система искусственного кормления используется для заражения комаров для дальнейшей оценки воздействия таких соединений на интенсивность и распространенность паразита Plasmodium falciparum .
Аннотация
Малярия остается одним из самых разрушительных заболеваний во всем мире, и на сегодняшний день африканский регион по-прежнему является причиной 94% всех случаев заболевания во всем мире. Это паразитарное заболевание требует простейшего паразита, комара-переносчика Anopheles и хозяина позвоночных. Род Anopheles включает более 500 видов, из которых 60 известны как переносчики паразита. Род паразитов Plasmodium состоит из 250 видов, и 48 из них участвуют в передаче болезни. Кроме того, паразит Plasmodium falciparum внес свой вклад в 99,7% случаев малярии в странах Африки к югу от Сахары в последние годы.
Гаметоциты являются частью половой стадии паразита и поглощаются самкой комара при питании инфицированным человеческим хозяином. Дальнейшее развитие паразита внутри комара усиливается благоприятными условиями окружающей среды в средней кишке комара. Здесь происходит слияние женских и мужских гамет, и возникают подвижные окинеты. Окинеты попадают в эпителий средней кишки комара, а зрелые окинеты образуют ооцисты, которые, в свою очередь, продуцируют подвижные спорозоиты. Эти спорозоиты мигрируют в слюнные железы комара и вводятся, когда комар принимает кровяную муку.
Для целей открытия лекарств комары были искусственно инфицированы гаметоцитарной кровью в стандартном анализе мембранного питания (SMFA). Для выявления инфекции у комара и/или для оценки эффективности противомалярийных соединений средние полоски самок комаров удаляли после заражения и окрашивали ртурохромом. Этот метод был использован для улучшения визуального обнаружения ооцист под микроскопом для точного определения распространенности и интенсивности ооцист.
Введение
Малярия, известная как одна из самых разрушительных болезней во всем мире, по-прежнему представляет большую угрозу для ряда стран, особенно для стран Африканского региона, и составляет примерно 95% случаев заболевания во всеммире1. Это заболевание вызывается простейшим паразитом и вместе со своим комаром-переносчиком Anopheles эти виновники могут нанести большой вред человеку-хозяину2. В частности, вид falciparum рода паразитов Plasmodium является причиной примерно 99% случаев малярии в странах Африки к югу от Сахары1. В дополнение к этому, несколько основных переносчиков комаров Anopheles (включая An. gambiae Giles, An. arabiensis Patton, An. coluzzii Coetzee & Wilkerson sp.n. и An. funestus Giles) могут быть обвинены в более чем 95% передачи паразитов во всем мире 3,4,5,6,7,8 . Для установления идеального общения паразита-переносчика комар-переносчик должен быть восприимчив к паразиту и быть в состоянии передать его9. Кроме того, как переносчик, так и паразит должны преодолевать физические барьеры, чтобы сформировать идеальную инфекционную комбинацию - комар-переносчик должен быть в состоянии поддерживать развитие паразита, а паразит должен иметь способность преодолевать защитные механизмы хозяина10,11.
Гаметоциты, половая стадия паразита P. falciparum, играют решающую роль в соединении вектора и паразита партнеров12. Половое развитие происходит in vivo, а гаметоцитогенез описывает процесс дифференцировки зрелых гаметоцитов в подвижные мужские микрогаметы и женские макрогаметы13. Другим процессом, который происходит внутри комара, является эксфлагелляция - процесс, во время которого мужской гаметоцит превращается в гаметы и выходит из красных кровяных клеток, захваченных во время кровяной пищи11. Далее предполагается, что процесс эксфлагелляции усиливается благоприятным изменением окружающей среды комара-midgut14. После эксфлагелляции зигота образуется путем слияния мужской и женской гамет13. Из зиготы возникает подвижная окинета и перемещается из кровяной муки в эпителий комара-мидгута13. Здесь созревает окинет, и образуется ооциста, которая, в свою очередь, вырабатывает подвижных спорозоитов13,15. Спорозоиты затем мигрируют в слюнные железы комаров, и, когда комар принимает кровяную муку от своего хозяина, эти спорозоиты вводятся в кровоток хозяина15.
Мероприятия по борьбе с малярией, сочетающие стратегии борьбы с переносчиками инфекции и использование эффективных противомалярийных препаратов, приобрели решающее значение в борьбе с этимзаболеванием15. С ростом устойчивости к паразитам и комарам срочность выявления новых противомалярийных соединений возрастаетна 16. Поэтому важна оценка in vivo соединений, блокирующих передачу16. После разработки таких эффективных препаратов, блокирующих передачу, SMFA был использован для оценки того, ингибируют ли эти соединения половое развитие P. falciparum у комара Anopheles 17,18,19. Этот анализ получил признание с 1970-1980-х годов в качестве золотого стандарта для оценки блокировки передачи20,21. Этот анализ обеспечивает более дешевую альтернативу, чем другие анализы, такие как RT-qPCR, который требует специализированного оборудования. Кроме того, для проведения экспериментов не требуется никаких пациентов. Этот анализ также включает в себя предоставление крови, индуцированной гаметоцитами, самкам комаров, которые затем рассекаются, чтобы оценить, присутствует ли развитие ооцисты21. Это позволяет количественно определять гаметоциты и обнаруживать деформированные ооцисты из-за соединений22. Чтобы соединение было классифицировано как эффективное, распространенность (доля комаров, которые содержат по крайней мере одну ооцисту в средней кишке) и количество ооцист (интенсивность) у комара-акушерки должны быть оценены для оценки ингибирования инфекции 17,21,22.
Access restricted. Please log in or start a trial to view this content.
протокол
Иллюстрация протокола приведена на рисунке 1 . Этическое разрешение было получено от Комитета по этике медицинских наук Университета Претории (506/2018) на изъятие и использование человеческой крови.
1. Культура гаметоцитов
ПРИМЕЧАНИЕ: До создания SMFA в Университете Претории была подготовлена культура гаметоцитов (см. Reader et al.22 для полного протокола).
- Подготовьте культуру гаметоцитов, состоящую из гаметоцитов стадии V из штамма паразита NF54.
- Убедитесь, что гаметоцитамия культуры составляет от 1,5% до 2,5%, с 50% гематокритом в мужской сыворотке А+, к которой добавляются свежие эритроциты.
- Разделите культуру на разные колбы и добавьте 2 мкМ каждого соединения для каждой соответствующей обработки за 48 ч до проведения SMFA. Оставьте контрольную группу без лечения.
- Оцените культуру гаметоцитов незадолго до проведения SMFA для обеспечения эксфлагелляции мужских гамет, с наличием соотношения 3:1 женщина:мужчина.
2. Искусственное заражение комаров через SMFA
ПРИМЕЧАНИЕ: Биобезопасность: инфицированные комары должны размещаться в учреждении уровня биобезопасности 2 (BSL2) с ограниченным доступом.
- Используя ротовой аспиратор, поместите 25 некормленных самок комаров An. gambiae в чашку для кормления объемом 350 мл. Сделайте то же самое для каждой чашки для лечения и четко обозначьте чашки в зависимости от того, будут ли они использоваться в качестве контрольных или лечебных групп. Выберите количество чашек на процедуру в соответствии с количеством включенных технических реплик.
ПРИМЕЧАНИЕ: Колониальные комары в возрасте от 5 до 7 дней используются в типичной оценке соединения, блокирующего передачу. Голодание комаров в течение 3-4 ч или дольше до кормления кровью облегчит поглощение крови во время SMFA. - Подключите стеклянную систему подачи к водяной бане и поддерживайте температуру на уровне 37 °C.
ПРИМЕЧАНИЕ: Стеклянный питатель состоит из двух рычагов, которые соединены с силиконовой трубкой, к которой соединена водяная баня (рисунок 2). Полая структура кормушки позволяет воде циркулировать и поддерживать температуру крови. - Подготовьте кишечник коровы (или синтетическую мембрану), промыв его в водопроводной воде и разрезав на кусочки, которые подходят для каждой кормушки. Накройте каждую подачу и закрепите мембрану эластичной лентой.
ПРИМЕЧАНИЕ: Для кишечника не требовалось никакого этического разрешения, так как он был куплен в местной мясной лавке, где он продается общественности для приготовления пищи. - Поместите чашки инфекции под кормушками, а мембрана укладывается поверх сетки чашки.
- Добавьте 1 мл гаметоцитарно-инфицированной крови к кормушкам контрольных чашек и гаметоцит-инфицированной крови с добавлением соединения к каждому соответствующему комбайну и чашке.
- Оставьте комаров кормиться примерно на 40 минут с непокрытыми кормушками.
ПРИМЕЧАНИЕ: Кормление происходит в инсектарных условиях (25 °C, относительная влажность 80%) в темное время суток. Диаметр питателя составляет приблизительно 13 мм. - После кормления выньте кормушки из чашек, промойте кормушки, обработайте лишнюю кровь гипохлоритом.
- Удалите некормленных комаров из чашки, сбив всех комаров на лед (в течение 1-2 минут) и отделив некормленных комаров от тех, кто принял кровавую муку. Ищите опухшие и красные брюшки (указывающие на кровь), чтобы отличить сытых, полностью набухших комаров от некормленных (рисунок 3).
- Поместите чашки инфекции в камеру биобезопасности (дополнительный рисунок S1) и обеспечьте каждую чашку 10% сахарной водяной прокладкой, заменяя сахарную воду в разные дни в течение 8-10 дней.
3. Подготовка инфицированных комаров
ПРИМЕЧАНИЕ: Эта часть протокола происходит в инфекционной комнате BSL2. Только уполномоченному, обученному персоналу разрешается входить в инфекционное помещение, где размещены инфицированные комары. Комары содержатся в модифицированных чашках, которые содержат только одну точку входа, которая автоматически запечатывается при удалении ротового аспиратора. Эти чашки помещаются внутрь прозрачного термопластичного контейнера для предотвращения побега. Контейнер расположен в инфекционном помещении за двухдверной системой. Все необходимые протоколы должны быть на месте случайного контакта с инфицированными комарами (Дополнительный файл S1). Протоколы зависят от конкретной страны и зависят от требований учреждения.
- На 8-10 день после кормления инфекцией сбивайте зараженных комаров, помещая их на лед и перенося их в маркированные трубки с 70% этанолом (держа комаров каждой контрольной и лечебной группы отдельно).
- Убедитесь, что все комары мертвы, прежде чем покинуть инфекционную комнату.
4. Рассечение инфицированных комаров
ПРИМЕЧАНИЕ: Эта часть протокола проводится в лаборатории.
- Перенесите комаров в маркированные чашки Петри, выстланные фильтровальной бумагой, разделив контрольную и тестовую группы.
- Поместите каплю фосфатно-буферного физиологического раствора (PBS) на предметное стекло микроскопа (помеченное в соответствии с контрольной / тестовой группой) и перенесите отдельного комара из фильтровальной бумаги в PBS.
- Удалите среднюю кишку из обездвиженного, инфицированного образца, прижав грудную клетку комара рассекающей иглой, одновременно вытягивая7-й брюшной сегмент щипцами.
- Когда кишечник открыт и виден, ищите мальпигиевы канальцы (рисунок 4A, B), чтобы отличить кишечник от яичников. Извлеките его из PBS, переложите в каплю 0,1% ртурохрома на новом слайде микроскопа и оставьте кишечник окрашиваться на 8-10 минут.
- После окрашивания поместите крышку на окрашенную кишку и просмотрите кишку при ярком освещении поля с увеличением 20x-40x (рисунок 4C, D).
- Запишите наличие и количество ооцист на среднюю кишку для каждой контрольной и лечебной группы (Дополнительный файл S2).
- Рассчитайте активность блокировки передачи с помощью уравнения (1):
%уточняется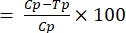 (1)
(1)
где TBA = активность блокировки передачи (снижение распространенности ооцисты); p = распространенность ооцисты; C = контроль; и Т = лечение. - Рассчитайте активность снижения передачи с помощью уравнения (2):
%ТРА =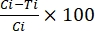 (2)
(2)
где TRA = активность, снижающая передачу (снижение интенсивности ооцисты); I = интенсивность ооцисты; C = контроль; и Т = лечение.
ПРИМЕЧАНИЕ: TBA может не быть значительно уменьшен, но в TRA может наблюдаться значительная разница и наоборот. Это зависит от оцениваемого химического материала. - Выполните статистический анализ с помощью непараметрического t-теста (Манн-Уитни).
Access restricted. Please log in or start a trial to view this content.
Результаты
Общее число рассеченных контрольных образцов составило 47, со средней распространенностью до 89% и интенсивностью 9,5 ооцист на среднюю кутку (таблица 1, опубликованная ранее22). Для соединения MMV1581558 размер выборки достиг в общей сложности 42 образцов с распространенно...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Чтобы этот протокол был успешно выполнен, следует уделять внимание каждому шагу, даже если это может быть утомительным и трудоемким процессом. Одним из наиболее важных шагов является обеспечение того, чтобы культура гаметоцитов была хорошего качества и чтобы она состояла из зрелых гам...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Авторы хотели бы отметитьProf. Лин-Мари Биркхольц и доктор Джанетт Ридер из Департамента биохимии, генетики и микробиологии Института устойчивой борьбы с малярией в Университете Претории за культивирование и снабжение культурой гаметоцитов. Штамм паразита был получен из последнего отдела (не входит в эту публикацию). Департамент науки и инноваций (DSI) и Национальный исследовательский фонд (NRF); Инициатива южноафриканских научно-исследовательских кафедр (UID 64763 для LK и UID 84627 для LMB); сообщества практиков НРФ (UID 110666 LMB и LK); и Южноафриканский совет по медицинским исследованиям Стратегические инновационные партнерства в области здравоохранения (SHIP) также признаны за средства от DSI.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine intestine/ | Butchery | ||
| Compound MMV1581558 | MMV | Pandemic response box | |
| Dissecting needles | WRIM | Custom made | |
| falcon tube | Lasec | ||
| Glass feeders | Glastechniek Peter Coelen B.V. | ||
| Graphpad Prism (8.3.0) | Graphpad | ||
| Mercurochrome | Merck (Sigma-Aldrich) | 129-16-8 | |
| Microscope slides | Merch (Sigma-Aldrich) | S8902 | |
| Parafilm | Cleansafe | ||
| PBS tablets | ThermoFisher Scientific | BP2944 | |
| Perspex biosafety cabinet | Wits University | Made by the contractors at Wits | |
| Plastic cups (350 mL) | Plastic Land |
Ссылки
- World Malaria Report. World Health Organization. , Available from: https://www.who.int/publications/i/item/9789240040496 (2021).
- Takken, W., Verhulst, N. O. Host preferences of blood feeding mosquitoes. Annual Review of Entomology. 58, 433-453 (2013).
- Gillies, M. T., Coetzee, M. Supplement to the Anophelinae of Africa south of the Sahara Afrotropical region. Publications of the South African Institute for Medical Research. 55, 1(1987).
- Gillies, M. T., De Meillon, B. The Anophelinae of Africa south of the Sahara. Publications of the South African Institute for Medical Research. 54, (1968).
- Antonio-Nkondjio, C., et al. Complexity of the malaria vectorial system in Cameroon: contribution of secondary vectors to malaria transmission. Journal of Medical Entomology. 43, 1215-1221 (2006).
- Sinka, M. E., et al. The dominant Anopheles vectors of human malaria in Africa, Europe and the Middle East: occurrence data, distribution maps and bionomic précis. Parasites and Vectors. 3, 117(2010).
- Coetzee, M., Hunt, R. H., Wilkerson, R., Della Torre, A., Coulibaly, M. B., Besansky, N. J. Anopheles coluzzii and Anopheles amharicus, new members of the Anopheles gambiae complex. Zootaxa. 3619, 246-274 (2013).
- Kyalo, D., Amratia, P., Mundia, C. W., Mbogo, C. M., Coetzee, M., Snow, R. W. A geo-coded inventory of anophelines in the Afrotropical Region south of the Sahara: 1898-2016. Wellcome Open Research. 2, 57(2017).
- Cohuet, A., Harris, C., Robert, V., Fontenille, D. Evolutionary forces on Anopheles: What makes a malaria vector. Trends in Parasitology. 309, (2009).
- Weathersby, A. B. The role of the stomach wall in the exogenous development of Plasmodium gallinaceum as studies by means of haemocoel injections of susceptible and refractory mosquitoes. The Journal of Infectious Diseases. 91, 198-205 (1952).
- Ally, A. S. I., Vaughan, A. M., Kappe, S. H. I. Malaria parasite development in the mosquito and infection of the mammalian host. The Annual Review of Microbiology. 63, 195-221 (2009).
- Delves, M. J., et al. Male and female Plasmodium falciparum mature gametocytes show different responses to antimalarial drugs. American Society for Microbiology Journal. , (2013).
- Sinden, R. E. Sexual development of malarial parasites in their mosquito vector. Transactions of the Royal Society of Tropical Medicine and Hygiene. 75, (1981).
- Garcia, G. E., Wirtz, R. A., Barr, J. R., Woolfitt, A. Xanthurenic acid induces gametogenesis in Plasmodium, the malaria parasite. Journal of Biological Chemistry. 15, 12003-12005 (1998).
- Oaks, S. C. Jr, Mitchell, V. S., Pearson, G. W., et al. Malaria: Obstacles and Opportunities. , National Academic Press. ISBN 0-309-54389-4 (1991).
- Le Manach, C., et al. Identification and profiling of a novel Diazaspirol[3.4]octane chemical series active against multiple stages of the human malaria parasite Plasmodium falciparum and optimization efforts. Journal of Medicinal Chemistry. 64, 2291-2309 (2021).
- Cibulskis, R. E., et al. Malaria: global progress 2000-2015 and future challenges. Infect Diseases of Poverty. 5, 61(2016).
- Smith, T. A., Chitnis, N., Briet, O. J., Tanner, M. Uses of mosquito-stage transmission-blocking vaccines against Plasmodium falciparum. Trends in Parasitology. 27, 190-196 (2011).
- Boyd, M. F. Epidemiology: factors related to the definitive host. Malariology. Boyd, M. F. , W.B. Saunders. Philadelphia. 608-697 (1949).
- Ponnudurai, T., van Gemert, G. J., Bensink, T., Lensen, A. H., Meuwissen, J. H. Transmission blockade of Plasmodium falciparum: its variability with gametocyte numbers and concentration of antibody. Transactions of The Royal Society of Tropical Medicine. 81, 491-493 (1987).
- Rutledge, L. C., Ward, R. A., Gould, D. J. Studies on the feeding response of mosquitoes to nutritive solutions in a new membrane feeder. Mosquito News. 24 (4), (1964).
- Reader, J., et al. Multistage and transmission-blocking targeted antimalarials discovered from the open-source MMV Pandemic Response Box. Nature Communications. 12, 269(2021).
- Bousema, T., et al. Mosquito feeding assays for natural infections. PLoS One. 7 (8), (2012).
- Churcher, T., et al. Measuring the blockade of malaria transmission - An analysis of the standard membrane feeding assay. International Journal for Parasitology. 42, 1037-1044 (2012).
- Medley, G. F., et al. Heterogeneity in patterns of malarial oocyst infections in the mosquito vector. Parasitology. 106, 441-449 (1993).
- Miura, K., et al. Transmission-blocking activity is determined by transmission reducing activity and number of control oocysts in Plasmodium falciparum standard membrane-feeding assay. Vaccine. 34, 4145-4151 (2016).
- Sattabongkot, J., Maneechai, N., Rosenberg, R. Plasmodium vivax: gametocyte infectivity of naturally infected Thai adults. Parasitology. 102 (01), 27-31 (1991).
- Vallejo, A. F., Garcia, J., Amado-Garavito, A. B., Arevalo-Herrera, M., Herrera, S. Plasmodium vivax gametocyte infectivity in sub-microscopic infections. Malaria Journal. 15 (1), 48(2016).
- Ponnudurai, T., Lensen, A. H. W., van Gemert, G. J. A., Bolmer, M. G., Meuwissen, J. H. E. Feeding behavior and sporozoite ejection by infected Anopheles stephensi. Transactions of the Royal Society of Tropical Medicine and Hygiene. 85, 175-180 (1991).
- Miura, K., et al. Qualification of standard membrane-feeding assay with Plasmodium falciparum malaria and potential improvements for future assays. PLoS One. 8, 57909(2013).
- Griffin, P., et al. Safety and reproducibility of a clinical trial system using induced blood stage Plasmodium vivax infection and its potential as a model to evaluate malaria transmission. PLoS Neglected Tropical Diseases. 10, 0005139(2016).
- Delves, M. J., Sinden, R. E. A semi-automated method for counting fluorescent malaria oocysts increases the throughput of transmission blocking studies. Malaria Journal. 9, 35(2010).
- vander Kolk, M., et al. Evaluation of the standard membrane feeding assay (SMFA) for the determination of malaria transmission-reducing activity using empirical data. Parasitology. 130, 13-22 (2005).
- van der Kolk, M., de Vlas, S. J., Sauerwein, R. W. Reduction and enhancement of Plasmodium falciparum transmission by endemic human sera. International Journal for Parasitology. 36, 1091-1095 (2006).
- Singh, M., et al. Plasmodium's journey through the Anopheles mosquito: A comprehensive review. Biochimie. 181, 176-190 (2021).
- Vos, M. W., et al. A semi-automated luminescence based standard membrane feeding assay identifies novel small molecules that inhibit transmission of malaria parasites by mosquitoes. Scientific Reports. 5, 18704(2015).
- Azevedo, R., et al. Bioluminescence method for in vitro screening of Plasmodium transmission-blocking compounds. Antimicrobial Agents and Chemotherapy. 61, (2017).
- Okell, L. C., Bousema, T., Griffin, J. T., Ouedraogo, A. L., Ghani, A. C., Drakeley, C. J. Factors determining the occurrence of submicroscopic malaria infections and their relevance for control. Nature Communications. 3, 1237(2012).
- Pasay, C. J., et al. Piperaquine monotherapy of drug-susceptible Plasmodium falciparum infection results in rapid clearance of parasitemia but is followed by the appearance of gametocytemia. The Journal of Infectious Diseases. 214, 105-113 (2016).
- Stone, W. J., et al. A scalable assessment of Plasmodium falciparum transmission in the standard membrane-feeding assay, using transgenic parasites expressing green fluorescent protein-luciferase. The Journal of Infectious Diseases. 210, 1456-1463 (2014).
- Hasan, A. U., et al. Implementation of a novel PCR based method for detecting malaria parasites from naturally infected mosquitoes in Papua New Guinea. Malaria Journal. 8, 182(2009).
- Stone, W. J., et al. The relevance and applicability of oocyst prevalence as a read-out for mosquito feeding assays. Scientific Reports. 3, 3418(2013).
- Marquart, L., Baker, M., O'Rourke, P., McCarthy, J. S. Evaluating the pharmacodynamic effect of antimalarial drugs in clinical trials by quantitative PCR. Antimicrobial Agents and Chemotherapy. 59, 4249-4259 (2015).
- McCarthy, J. S., et al. tolerability, pharmacokinetics, and activity of the novel long-acting antimalarial DSM265: a two-part first-in-human phase 1a/1b randomised study. TheLancet Infectious Diseases. 17, 626-635 (2017).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены