Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Anofellerde Plasmodium falciparum Enfeksiyonunun Tespiti için Standart Membran Besleme Testi
Bu Makalede
Özet
Standart membran besleme testi (SMFA), potansiyel sıtma önleyici bileşiklerin değerlendirilmesi ve tanımlanması için altın standart olarak kabul edilir. Bu yapay besleme sistemi, bu tür bileşiklerin Plasmodium falciparum parazitinin yoğunluğu ve prevalansı üzerindeki etkilerini daha fazla değerlendirmek için sivrisinekleri enfekte etmek için kullanılır.
Özet
Sıtma, dünya çapında en yıkıcı hastalıklardan biri olmaya devam etmektedir ve bugüne kadar, Afrika bölgesi hala dünya çapındaki tüm vakaların% 94'ünden sorumludur. Bu paraziter hastalık bir protozoan parazit, bir Anopheles sivrisinek vektörü ve bir omurgalı konakçı gerektirir. Anopheles cinsi, 60'ı parazitin vektörleri olarak bilinen 500'den fazla türden oluşur. Plasmodium parazit cinsi 250 türden oluşur ve bunların 48'i hastalık bulaşmasında rol oynar. Ayrıca, Plasmodium falciparum paraziti, son yıllarda Sahra altı Afrika'daki sıtma vakalarının tahmini% 99.7'sine katkıda bulunmuştur.
Gametositler, parazitin cinsel aşamasının bir parçasını oluşturur ve enfekte bir insan konakçısı üzerinde beslendikten sonra dişi sivrisinek tarafından yutulur. Parazitin sivrisinek içindeki daha da gelişmesi, sivrisineğin orta bağırsağındaki elverişli çevresel koşullarla arttırılır. Burada, dişi ve erkek gametlerin kaynaşması gerçekleşir ve hareketli ookinetler ortaya çıkar. Ookinetes, sivrisineğin midgut epiteline girer ve olgun ookinetes, sırayla hareketli sporozoitler üreten ookistler oluşturur. Bu sporozoitler sivrisineğin tükürük bezlerine göç eder ve bir sivrisinek kan unu alırken enjekte edilir.
İlaç keşfi amacıyla, sivrisinekler standart membran besleme testinde (SMFA) gametosit ile enfekte olmuş kan ile yapay olarak enfekte edildi. Sivrisinek içindeki enfeksiyonu tespit etmek ve / veya sıtma önleyici bileşiklerin etkinliğini değerlendirmek için, dişi sivrisineklerin orta bağırsakları enfeksiyon sonrası çıkarıldı ve merkürokrom ile boyandı. Bu yöntem, ookist prevalansının ve yoğunluğunun doğru belirlenmesi için mikroskop altında ookistlerin görsel tespitini arttırmak için kullanıldı.
Giriş
Dünya çapında en yıkıcı hastalıklardan biri olarak bilinen sıtma, birçok ülkeye, özellikle de Afrika bölgesindekilere hala büyük bir tehdit oluşturmaktadır ve dünya çapındaki vakaların yaklaşık% 95'ine katkıda bulunmaktadır1. Bu hastalığa bir protozoan parazit neden olur ve Anopheles sivrisinek vektörü ile birlikte, bu suçlular insan konakçısına büyük zarar verebilir2. Daha spesifik olarak, Plasmodium parazit cinsinin falciparum türleri, Sahra altı Afrika'daki sıtma vakalarının tahmini% 99'undan sorumludur1. Buna ek olarak, birkaç büyük Anopheles sivrisinek vektörü (An. gambiae Giles, An. arabiensis Patton, An. coluzzii Coetzee & Wilkerson sp.n. ve An. funestus Giles dahil) küresel olarak parazit iletiminin% 95'inden fazlası için suçlanabilir 3,4,5,6,7,8 . İdeal parazit-vektör arkadaşlığının kurulması için, sivrisinek vektörünün parazite duyarlı olması veonu 9 iletebilmeli olmalıdır. Ayrıca, hem vektör hem de parazit, mükemmel enfektif kombinasyonu oluşturmak için fiziksel engellerin üstesinden gelmelidir - sivrisinek vektörü parazit gelişimini sürdürebilmeli ve parazit, konağın savunma mekanizmalarının üstesinden gelme yeteneğine sahip olmalıdır10,11.
P. falciparum parazitinin cinsel aşaması olan gametositler, vektör ve parazit partnerlerinin birbirine bağlanmasında çok önemli bir rol oynar12. Cinsel gelişim in vivo olarak gerçekleşir ve gametositogenez, olgun gametositlerin hareketli erkek mikrogametlere ve dişi makrogametlere farklılaşma sürecini tanımlar13. Sivrisinek içinde gerçekleşen bir başka süreç de kamçılanmadır – erkek gametositin gametlere dönüştüğü ve bir kan yemeği sırasında alınan kırmızı kan hücrelerinden çıktığı süreç11. Eksflagellasyon sürecinin, sivrisinek midgut14'ün ortamındaki olumlu bir değişiklikle arttırılması önerilmektedir. Eksflagellasyondan sonra, erkek ve dişi gametlerin kaynaşmasıyla bir zigot oluşur13. Zigottan, hareketli bir ookinete ortaya çıkar ve kan unundan sivrisinek midgut13'ün epiteline doğru hareket eder. Burada, ookinete olgunlaşır ve sırayla hareketli sporozoitler13,15 üreten bir ookist oluşur. Sporozoitler daha sonra sivrisinek tükürük bezlerine göç eder ve sivrisinek konakçısından bir kan unu aldığından, bu sporozoitler konağın kan dolaşımına enjekte edilir15.
Vektör kontrol stratejileri ile etkili sıtma önleyici ilaçların kullanımını birleştiren sıtma kontrol müdahaleleri, bu hastalıkla mücadelede çok önemli hale gelmiştir15. Parazit ve sivrisinek direncindeki artışla birlikte, yeni sıtma önleyici bileşiklerin tanımlanması için aciliyetartmaktadır 16. Bu nedenle, iletimi bloke eden bileşiklerin in vivo değerlendirilmesi önemlidir16. Bu tür etkili bulaşmayı engelleyen ilaçların geliştirilmesinden sonra, SMFA, bu bileşiklerin Anopheles sivrisinek17,18,19'daki P. falciparum'un cinsel gelişimini inhibe edip etmediğini değerlendirmek için kullanılmıştır. Bu tahlil, 1970-1980'lerden bu yana, iletim blokajı 20,21'i değerlendirmek için altın standart olarak tanınmıştır. Bu tahlil, özel ekipman gerektiren RT-qPCR gibi diğer tahlillerden daha ucuz bir alternatif sunar. Ayrıca, deneyleri yürütmek için hiçbir hastaya gerek yoktur. Bu tahlil aynı zamanda dişi sivrisineklere gametosit kaynaklı kanın sağlanmasını da içerir, bunlar daha sonra ookist gelişiminin mevcut olup olmadığını değerlendirmek için disseke edilir21. Bu, gametosit miktarının belirlenmesine ve bileşikler22 nedeniyle deforme olmuş ookistlerin tespit edilmesine izin verir. Bir bileşiğin etkili olarak sınıflandırılması için, enfeksiyon inhibisyonunu değerlendirmek için prevalansı (midgutta en az bir ookist barındıran sivrisineklerin oranı) ve sivrisinek midgutundaki ookist sayısı (yoğunluk) değerlendirilmelidir 17,21,22.
Access restricted. Please log in or start a trial to view this content.
Protokol
Protokolün bir örneği için Şekil 1'e bakın. İnsan kanının geri çekilmesi ve kullanılması için Pretoria Üniversitesi Sağlık Bilimleri Etik Kurulu'ndan (506/2018) etik izin alınmıştır.
1. Gametosit kültürü
NOT: SMFA'yı kurmadan önce, Pretoria Üniversitesi'nde bir gametosit kültürü hazırlanmıştır (protokolün tamamı için Reader ve ark.22'ye bakınız).
- NF54 parazit suşundan evre V gametositlerden oluşan bir gametosit kültürü hazırlayın.
- Kültürün gametositemisinin% 1.5 ila% 2.5 arasında olduğundan, taze kırmızı kan hücrelerinin eklendiği A + erkek serumunda% 50 hematokrit olduğundan emin olun.
- Kültürü farklı şişelere ayırın ve SMFA'yı gerçekleştirmeden 48 saat önce her bir ilgili işlem için her bileşiğin 2 μM'sini ekleyin. Kontrol grubunu tedavi edilmeden bırakın.
- Erkek gametlerin 3: 1 dişi: erkek oranının varlığıyla kamçılanmasını sağlamak için SMFA'yı yürütmeden kısa bir süre önce gametosit kültürünü değerlendirin.
2. SMFA yoluyla sivrisineklerin yapay enfeksiyonu
NOT: Biyogüvenlik: Enfekte sivrisinekler, sınırlı erişime sahip bir biyogüvenlik seviye 2 (BSL2) tesisinde barındırılmalıdır.
- Bir ağız aspiratörü kullanarak, 25 adet beslenmemiş dişi An. gambiae sivrisineğini 350 mL'lik bir besleme kabına yerleştirin. Her tedavi kabı için aynısını yapın ve bardakları kontrol veya tedavi grubu olarak kullanılıp kullanılmadıklarına göre açıkça etiketleyin. Dahil edilen teknik kopyaların sayısına göre tedavi başına bardak sayısını seçin.
NOT: 5 ila 7 günlük koloni sivrisinekleri, tipik bir iletim engelleyici bileşik değerlendirmesinde kullanılır. Kan beslemeden önce 3-4 saat veya daha uzun süre aç kalan sivrisinekler, SMFA sırasında kan alımını kolaylaştıracaktır. - Cam besleyici sistemini su banyosuna bağlayın ve sıcaklığı 37 ° C'de tutun.
NOT: Cam besleyici, su banyosunun bağlı olduğu silikon boruya bağlı iki koldan oluşur (Şekil 2). Besleyicinin içi boş yapısı, suyun dolaşmasına ve kanın sıcaklığının korunmasına izin verir. - bağırsağını (veya sentetik membranı) musluk suyunda durulayarak hazırlayın ve her besleyici için takılı olan parçalara ayırın. Her besleyiciyi örtün ve membranı elastik bir bantla sabitleyin.
NOT: Bağırsak için etik bir izne gerek yoktu, çünkü yerel bir kasaplıktan satın alındı ve burada gıda hazırlama için halka satıldı. - Enfeksiyon kaplarını besleyicilerin altına yerleştirin, membran kabın ağının üzerine serilir.
- Kontrol kaplarının besleyicilerine 1 mL gametosit ile enfekte olmuş kan ve gametosit ile enfekte olmuş kan, karşılık gelen her bir bileşik besleyiciye ve kaba bileşik eklenmiştir.
- Sivrisinekleri, besleyiciler açıkken yaklaşık 40 dakika boyunca beslenmeye bırakın.
NOT: Beslemeler karanlıkta böcek etkisi yaratan koşullar altında (25 °C, %80 bağıl nem) gerçekleşir. Bir besleyicinin çapı yaklaşık 13 mm'dir. - Beslendikten sonra, besleyicileri bardaklardan çıkarın, besleyicileri durulayın ve fazla kanı hipoklorit ile tedavi edin.
- Tüm sivrisinekleri buzun üzerine vurarak (1-2 dakika boyunca) ve beslenmemiş sivrisinekleri kan unu almış olanlardan ayırarak beslenmemiş sivrisinekleri bardaktan çıkarın. Beslenen, tamamen engorge sivrisinekleri beslenmemiş olanlardan ayırt etmek için şişmiş ve kırmızı karınları (kanı gösteren) arayın (Şekil 3).
- Enfeksiyon bardaklarını biyogüvenlik odasına yerleştirin (Ek Şekil S1) ve her bardağa% 10'luk bir şekerli su yastığı sağlayın, şekerli suyu alternatif günlerde 8-10 gün boyunca değiştirin.
3. Enfekte sivrisineklerin hazırlanması
NOT: Protokolün bu kısmı BSL2 enfeksiyon odasında gerçekleşir. Sadece yetkili, eğitimli personelin enfekte sivrisineklerin bulunduğu enfeksiyon odasına girmesine izin verilir. Sivrisinekler, ağız aspiratörü çıkarıldığında otomatik olarak mühürlenen sadece bir giriş noktası içeren modifiye kaplarda tutulur. Bu bardaklar, kaçışı önlemek için şeffaf, termoplastik bir kabın içine yerleştirilir. Konteyner, çift kapılı bir sistemin arkasındaki enfeksiyon odasında bulunur. Enfekte sivrisineklere yanlışlıkla maruz kalmak için gerekli tüm protokoller uygulanmalıdır (Ek Dosya S1). Protokoller ülkeye özgüdür ve kurumun gereksinimlerine bağlıdır.
- Enfeksiyon beslenmesinden sonraki 8-10. günlerde, enfekte sivrisinekleri buzun üzerine yerleştirerek ve% 70 etanol içeren etiketli tüplere aktararak (her kontrol ve tedavi grubunun sivrisineklerini ayrı tutarak) yıkın.
- Enfeksiyon odasından ayrılmadan önce tüm sivrisineklerin öldüğünden emin olun.
4. Enfekte sivrisineklerin diseksiyonları
NOT: Protokolün bu bölümü laboratuvarda yürütülür.
- Sivrisinekleri, filtre kağıdı ile kaplı etiketli Petri kaplarına aktarın, kontrol ve test gruplarını ayrı tutun.
- Bir mikroskop slaytına (kontrol/test grubuna göre işaretlenmiş) bir damla fosfat tamponlu salin (PBS) yerleştirin ve tek bir sivrisineği filtre kağıdından PBS'ye aktarın.
- 7. karın segmentini forsepslerle çekerken sivrisinek toraksını diseksiyon iğnesiyle sabitleyerek midgutu hareketsizleştirilmiş, enfekte olmuş numuneden çıkarın.
- Bağırsak açıkta ve görünür olduğunda, bağırsağı yumurtalıklardan ayırt etmek için Malpighian tübüllerini (Şekil 4A, B) arayın. PBS'den çıkarın, yeni bir mikroskop slaytında% 0.1'lik bir merkürokrom damlacığına aktarın ve bağırsağı 8-10 dakika lekelenmeye bırakın.
- Boyama işleminden sonra, lekeli bağırsağın üzerine bir örtü parçası yerleştirin ve bağırsağı 20x-40x büyütmede parlak alan aydınlatması altında görüntüleyin (Şekil 4C, D).
- Her kontrol ve tedavi grubu için midgut başına ookist varlığını ve sayısını kaydedin (Ek Dosya S2).
- İletim engelleme aktivitesini Denklem (1) kullanarak hesaplayın:
%TBA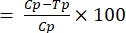 (1)
(1)
burada TBA = iletim bloke edici aktivite (ookist prevalansında azalma); p = ookist prevalansı; C = kontrol; ve T = tedavi. - İletim azaltma aktivitesini Denklem (2) kullanarak hesaplayın:
%TRA =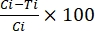 (2)
(2)
burada TRA = iletim azaltıcı aktivite (ookist yoğunluğunda azalma); I = ookist yoğunluğu; C = kontrol; ve T = tedavi.
NOT: TBA önemli ölçüde azaltılmayabilir, ancak TRA'da önemli bir fark görülebilir ve bunun tersi de geçerlidir. Bu, değerlendirilen kimyasal maddeye bağlıdır. - Parametrik olmayan t-testini ( Mann-Whitney) kullanarak istatistiksel analiz yapın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Diseke edilen toplam kontrol örneği sayısı 47 olup, ortalama %89 prevalansı ve midgut başına 9.5 ookist yoğunluğu saptanmıştır (Tablo 1, daha önce yayınlandığı gibi22). MMV1581558 bileşiği için, örneklem büyüklüğü% 36 ookist prevalansı ve ortalama 1.5 ookist yoğunluğu ile toplam 42 örneğe ulaştı. Bu, her üç biyolojik replikantta da ookist prevalansında% 58'lik bir azalma ve% 82'lik bir TRA olduğunu göstermektedir (Tablo 1).
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokolün başarılı bir şekilde yürütülebilmesi için, sıkıcı ve zahmetli bir süreç olsa bile, her adıma dikkat edilmelidir. En önemli adımlardan biri, SMFA23,24'e başlamadan önce gametosit kültürünün kaliteli olmasını ve doğru erkek:kadın oranına sahip olgun gametositlerden oluşmasını sağlamaktır. SMFA sırasında, erkek gametlerin sivrisineğe girmeden önce patlamasını önlemek için gametosit kültürünü doğru sıcaklı...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacağı bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar teşekkür ederProf. Pretoria Üniversitesi Biyokimya, Genetik ve Mikrobiyoloji Bölümü'nden Lyn-Mari Birkholtz ve Dr. Janette Reader, gametosit kültürünün kültürlenmesi ve tedarik edilmesi için Pretoria Üniversitesi Sürdürülebilir Sıtma Kontrolü Enstitüsü. Parazit suşu ikinci bölümden elde edildi (bu yayının bir parçası değil). Bilim ve İnovasyon Bölümü (DSI) ve Ulusal Araştırma Vakfı (NMG); Güney Afrika Araştırma Başkanları Girişimi (UID 64763'ten LK'ya ve UID 84627'den LMB'ye); NMG Uygulama Toplulukları (UID 110666 LMB ve LK'ya); ve Güney Afrika Tıbbi Araştırma Konseyi Stratejik Sağlık İnovasyon Ortaklıkları (SHIP) da DSI'dan gelen fonlar için kabul edilmektedir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bovine intestine/ | Butchery | ||
| Compound MMV1581558 | MMV | Pandemic response box | |
| Dissecting needles | WRIM | Custom made | |
| falcon tube | Lasec | ||
| Glass feeders | Glastechniek Peter Coelen B.V. | ||
| Graphpad Prism (8.3.0) | Graphpad | ||
| Mercurochrome | Merck (Sigma-Aldrich) | 129-16-8 | |
| Microscope slides | Merch (Sigma-Aldrich) | S8902 | |
| Parafilm | Cleansafe | ||
| PBS tablets | ThermoFisher Scientific | BP2944 | |
| Perspex biosafety cabinet | Wits University | Made by the contractors at Wits | |
| Plastic cups (350 mL) | Plastic Land |
Referanslar
- World Malaria Report. World Health Organization. , Available from: https://www.who.int/publications/i/item/9789240040496 (2021).
- Takken, W., Verhulst, N. O. Host preferences of blood feeding mosquitoes. Annual Review of Entomology. 58, 433-453 (2013).
- Gillies, M. T., Coetzee, M. Supplement to the Anophelinae of Africa south of the Sahara Afrotropical region. Publications of the South African Institute for Medical Research. 55, 1(1987).
- Gillies, M. T., De Meillon, B. The Anophelinae of Africa south of the Sahara. Publications of the South African Institute for Medical Research. 54, (1968).
- Antonio-Nkondjio, C., et al. Complexity of the malaria vectorial system in Cameroon: contribution of secondary vectors to malaria transmission. Journal of Medical Entomology. 43, 1215-1221 (2006).
- Sinka, M. E., et al. The dominant Anopheles vectors of human malaria in Africa, Europe and the Middle East: occurrence data, distribution maps and bionomic précis. Parasites and Vectors. 3, 117(2010).
- Coetzee, M., Hunt, R. H., Wilkerson, R., Della Torre, A., Coulibaly, M. B., Besansky, N. J. Anopheles coluzzii and Anopheles amharicus, new members of the Anopheles gambiae complex. Zootaxa. 3619, 246-274 (2013).
- Kyalo, D., Amratia, P., Mundia, C. W., Mbogo, C. M., Coetzee, M., Snow, R. W. A geo-coded inventory of anophelines in the Afrotropical Region south of the Sahara: 1898-2016. Wellcome Open Research. 2, 57(2017).
- Cohuet, A., Harris, C., Robert, V., Fontenille, D. Evolutionary forces on Anopheles: What makes a malaria vector. Trends in Parasitology. 309, (2009).
- Weathersby, A. B. The role of the stomach wall in the exogenous development of Plasmodium gallinaceum as studies by means of haemocoel injections of susceptible and refractory mosquitoes. The Journal of Infectious Diseases. 91, 198-205 (1952).
- Ally, A. S. I., Vaughan, A. M., Kappe, S. H. I. Malaria parasite development in the mosquito and infection of the mammalian host. The Annual Review of Microbiology. 63, 195-221 (2009).
- Delves, M. J., et al. Male and female Plasmodium falciparum mature gametocytes show different responses to antimalarial drugs. American Society for Microbiology Journal. , (2013).
- Sinden, R. E. Sexual development of malarial parasites in their mosquito vector. Transactions of the Royal Society of Tropical Medicine and Hygiene. 75, (1981).
- Garcia, G. E., Wirtz, R. A., Barr, J. R., Woolfitt, A. Xanthurenic acid induces gametogenesis in Plasmodium, the malaria parasite. Journal of Biological Chemistry. 15, 12003-12005 (1998).
- Oaks, S. C. Jr, Mitchell, V. S., Pearson, G. W., et al. Malaria: Obstacles and Opportunities. , National Academic Press. ISBN 0-309-54389-4 (1991).
- Le Manach, C., et al. Identification and profiling of a novel Diazaspirol[3.4]octane chemical series active against multiple stages of the human malaria parasite Plasmodium falciparum and optimization efforts. Journal of Medicinal Chemistry. 64, 2291-2309 (2021).
- Cibulskis, R. E., et al. Malaria: global progress 2000-2015 and future challenges. Infect Diseases of Poverty. 5, 61(2016).
- Smith, T. A., Chitnis, N., Briet, O. J., Tanner, M. Uses of mosquito-stage transmission-blocking vaccines against Plasmodium falciparum. Trends in Parasitology. 27, 190-196 (2011).
- Boyd, M. F. Epidemiology: factors related to the definitive host. Malariology. Boyd, M. F. , W.B. Saunders. Philadelphia. 608-697 (1949).
- Ponnudurai, T., van Gemert, G. J., Bensink, T., Lensen, A. H., Meuwissen, J. H. Transmission blockade of Plasmodium falciparum: its variability with gametocyte numbers and concentration of antibody. Transactions of The Royal Society of Tropical Medicine. 81, 491-493 (1987).
- Rutledge, L. C., Ward, R. A., Gould, D. J. Studies on the feeding response of mosquitoes to nutritive solutions in a new membrane feeder. Mosquito News. 24 (4), (1964).
- Reader, J., et al. Multistage and transmission-blocking targeted antimalarials discovered from the open-source MMV Pandemic Response Box. Nature Communications. 12, 269(2021).
- Bousema, T., et al. Mosquito feeding assays for natural infections. PLoS One. 7 (8), (2012).
- Churcher, T., et al. Measuring the blockade of malaria transmission - An analysis of the standard membrane feeding assay. International Journal for Parasitology. 42, 1037-1044 (2012).
- Medley, G. F., et al. Heterogeneity in patterns of malarial oocyst infections in the mosquito vector. Parasitology. 106, 441-449 (1993).
- Miura, K., et al. Transmission-blocking activity is determined by transmission reducing activity and number of control oocysts in Plasmodium falciparum standard membrane-feeding assay. Vaccine. 34, 4145-4151 (2016).
- Sattabongkot, J., Maneechai, N., Rosenberg, R. Plasmodium vivax: gametocyte infectivity of naturally infected Thai adults. Parasitology. 102 (01), 27-31 (1991).
- Vallejo, A. F., Garcia, J., Amado-Garavito, A. B., Arevalo-Herrera, M., Herrera, S. Plasmodium vivax gametocyte infectivity in sub-microscopic infections. Malaria Journal. 15 (1), 48(2016).
- Ponnudurai, T., Lensen, A. H. W., van Gemert, G. J. A., Bolmer, M. G., Meuwissen, J. H. E. Feeding behavior and sporozoite ejection by infected Anopheles stephensi. Transactions of the Royal Society of Tropical Medicine and Hygiene. 85, 175-180 (1991).
- Miura, K., et al. Qualification of standard membrane-feeding assay with Plasmodium falciparum malaria and potential improvements for future assays. PLoS One. 8, 57909(2013).
- Griffin, P., et al. Safety and reproducibility of a clinical trial system using induced blood stage Plasmodium vivax infection and its potential as a model to evaluate malaria transmission. PLoS Neglected Tropical Diseases. 10, 0005139(2016).
- Delves, M. J., Sinden, R. E. A semi-automated method for counting fluorescent malaria oocysts increases the throughput of transmission blocking studies. Malaria Journal. 9, 35(2010).
- vander Kolk, M., et al. Evaluation of the standard membrane feeding assay (SMFA) for the determination of malaria transmission-reducing activity using empirical data. Parasitology. 130, 13-22 (2005).
- van der Kolk, M., de Vlas, S. J., Sauerwein, R. W. Reduction and enhancement of Plasmodium falciparum transmission by endemic human sera. International Journal for Parasitology. 36, 1091-1095 (2006).
- Singh, M., et al. Plasmodium's journey through the Anopheles mosquito: A comprehensive review. Biochimie. 181, 176-190 (2021).
- Vos, M. W., et al. A semi-automated luminescence based standard membrane feeding assay identifies novel small molecules that inhibit transmission of malaria parasites by mosquitoes. Scientific Reports. 5, 18704(2015).
- Azevedo, R., et al. Bioluminescence method for in vitro screening of Plasmodium transmission-blocking compounds. Antimicrobial Agents and Chemotherapy. 61, (2017).
- Okell, L. C., Bousema, T., Griffin, J. T., Ouedraogo, A. L., Ghani, A. C., Drakeley, C. J. Factors determining the occurrence of submicroscopic malaria infections and their relevance for control. Nature Communications. 3, 1237(2012).
- Pasay, C. J., et al. Piperaquine monotherapy of drug-susceptible Plasmodium falciparum infection results in rapid clearance of parasitemia but is followed by the appearance of gametocytemia. The Journal of Infectious Diseases. 214, 105-113 (2016).
- Stone, W. J., et al. A scalable assessment of Plasmodium falciparum transmission in the standard membrane-feeding assay, using transgenic parasites expressing green fluorescent protein-luciferase. The Journal of Infectious Diseases. 210, 1456-1463 (2014).
- Hasan, A. U., et al. Implementation of a novel PCR based method for detecting malaria parasites from naturally infected mosquitoes in Papua New Guinea. Malaria Journal. 8, 182(2009).
- Stone, W. J., et al. The relevance and applicability of oocyst prevalence as a read-out for mosquito feeding assays. Scientific Reports. 3, 3418(2013).
- Marquart, L., Baker, M., O'Rourke, P., McCarthy, J. S. Evaluating the pharmacodynamic effect of antimalarial drugs in clinical trials by quantitative PCR. Antimicrobial Agents and Chemotherapy. 59, 4249-4259 (2015).
- McCarthy, J. S., et al. tolerability, pharmacokinetics, and activity of the novel long-acting antimalarial DSM265: a two-part first-in-human phase 1a/1b randomised study. TheLancet Infectious Diseases. 17, 626-635 (2017).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır