Method Article
אפיון שינויי RNA בתאי עצב בודדים באמצעות ספקטרומטריית מסה
In This Article
Summary
שינויים לאחר שעתוק של רנ"א מייצגים שכבה לא מבוקרת של ויסות תרגום שנקשרה לאחרונה לפלסטיות של מערכת העצבים המרכזית. כאן, הכנת דגימות וגישת ספקטרומטריית מסה כרומטוגרפית-טנדם נוזלית מתוארת לאפיון סימולטני של שינויי RNA רבים בתאי עצב בודדים.
Abstract
שינויים לאחר שעתוק (PTMs) של רנ"א מייצגים מנגנון לא מבוקר המעורב בוויסות התרגום במערכת העצבים המרכזית (CNS). עדויות עדכניות קישרו שינויים ספציפיים ברנ"א עצבי לפרדיגמות למידה וזיכרון. למרבה הצער, שיטות קונבנציונליות לזיהוי תכונות אפיטרנקטומיות אלה מסוגלות רק לאפיין שינויי RNA בשפע רב ברקמות בתפזורת, ומונעות הערכה של פרופילי PTM ייחודיים שעשויים להתקיים עבור נוירונים בודדים בתוך המעגלים ההתנהגותיים המופעלים. בפרוטוקול זה, מתוארת גישה – ניתוח שינוי RNA של נוירון יחיד על ידי ספקטרומטריית מסה (SNRMA-MS) – כדי לזהות ולכמת בו-זמנית מספר רב של ריבונוקלאוזידים שעברו שינוי בתאי עצב בודדים. הגישה מאומתת באמצעות נוירונים בודדים של הרכיכה הימית, Aplysia californica, החל מבידוד כירורגי וטיפול אנזימטי בגרעיני CNS גדולים כדי לחשוף גופים של תאי עצב, ולאחר מכן בידוד ידני של נוירון יחיד באמצעות מחטים חדות ומיקרופיפט. לאחר מכן, טיפול מכני ותרמי של הדגימה בנפח קטן של חיץ נעשה כדי לשחרר RNA מתא בודד לעיכול RNA לאחר מכן. לאחר מכן, נוקלאוזידים שעברו שינוי מזוהים ומכומתים באמצעות שיטת ספקטרומטריית מסה-כרומטוגרפיה נוזלית אופטימלית. SNRMA-MS משמש לקביעת דפוסי שינוי RNA עבור נוירונים בודדים שזוהו מ- A. californica שיש להם מורפולוגיות ותפקודים ידועים. מוצגות דוגמאות ל- SNRMA-MS איכותי וכמותי המדגישות את ההתפלגות ההטרוגנית של שינויי RNA על פני נוירונים בודדים ברשתות נוירונים.
Introduction
שינויים בנוקלאוזידים הקאנוניים של הרנ"א זכו להכרה הולכת וגוברת בשל שלל תפקידיהם בוויסות תרגום חלבונים. עד כה דווח על יותר מ-150 שינויי RNA ייחודיים, החל ממתילציה, תוספת הטרואטום, ועד הצמדה עם מטבוליטים תאיים 1,2. אלפבית RNA מורחב זה, הידוע גם בשם epitranscriptome, נוצר על ידי כותבים אנזימטיים והוא אחראי על שינוי היציבות3, קיפול4, ויעילות תרגום 5,6 של רנ"א תאיים. ניתן גם להפוך שינויי RNA נבחרים באמצעות מחקים אנזימטיים 7,8, בעוד שאחרים מצורפים ל-RNA באופן תת-סטויכיומטרי 9,10, מה שיוצר נוף מורכב של רצפי RNA שעברו שינוי וללא שינוי במערכות ביולוגיות.
החשיבות של שינויי RNA בתפקוד הביולוגי מסומנת על ידי התפלגות לא שוויונית של שינויים על פני איברים ורקמות שונים, כולל אזורי משנה של מערכת העצבים המרכזית (CNS)11. הטרוגניות כימית זו נקשרה לפיתוח CNS12, לתגובת עקה13 ולפלסטיות תלוית פעילות14. אזורי המשנה של מערכת העצבים המרכזית כוללים גם אוכלוסיות הטרוגניות של תאים שבהם תאים בודדים מציגים פרופילים כימיים מובהקיםשל 15,16,17,18. אפילו תאים בודדים מאותו סוג עשויים להציג תעתיקים ייחודיים, בין השאר בשל מיקרו-סביבהשל רקמות 19 וביטוי גניםסטוכסטיים 20. עם זאת, בעוד שאפיון השעתוק החד-תאי הוא שגרתי במידה מסוימת, אין שיטות מקבילות להקמת אפיטרנקומים חד-תאיים לשינויי RNA מרובים. גישות חדשות המסוגלות ליצור פרופיל של התפלגות שינויי הרנ"א בתאים בודדים נחוצות לניתוח מקיף של ההטרוגניות התאית וההשפעה הרגולטורית של שינויים לאחר שעתוק (PTMs) במערכת העצבים המרכזית ובמערכות ביולוגיות אחרות.
מדידה סימולטנית של שינויי RNA רבים בתאים/רקמות בתפזורת מתבצעת בקלות באמצעות טכניקות ספקטרומטריית מסה של כרומטוגרפיה נוזלית-טנדם (LC-MS/MS). עבור ניתוח LC-MS/MS של ריבונוקלאוזידים שעברו שינוי, RNA מופק מתאים (בדרך כלל 103-10 6 תאים), מטוהר על ידי משקעים והחזרות, ולאחר מכן מתעכל לנוקלאוזידים. תערובת הדגימה המורכבת מנוקלאוזידים קנוניים ומשונים מוזרקת לאחר מכן למערכת LC-MS לצורך הפרדת וזיהוי אנאליטים, מה שמוביל לקביעת המשלים המלא של שינויי RNA באורגניזם 21,22,23. LC-MS/MS שימש לאחרונה לקביעת 26 שינויי RNA במערכת העצבים המרכזית של המודל הנוירוביולוגי, Aplysia californica (A. californica). השפע של חלק מהסימנים האפיטרנסקריפטומיים הללו הפגין דינמיקה תלוית זמן ואזור, אשר תאמה עם שינויים התנהגותיים בבעל החיים24. עם זאת, ניתן היה לזהות רק שינויי RNA בדגימות בתפזורת המכילות >103 תאים בשל הרגישות המוגבלת של השיטה. דגימות גדולות אלה ככל הנראה הסתירו פרופילי שינוי RNA ייחודיים וחשובים מבחינה תפקודית של תאים בודדים עם ממוצעי אוכלוסייה. למרות שבקרה קפדנית בתנאי הכנת הדגימה שיפרה את מגבלות הגילוי לשינויי RNA בדגימות בנפח קטן 25,26,27,28, עדיין יש צורך בשיטות אנליטיות שיכולות לזהות ולכמת ריבונוקלאוזידים מרובים ששונו בתאים בודדים.
פרוטוקול זה מציג ניתוח שינוי RNA של נוירון יחיד על ידי ספקטרומטריית מסה (SNRMA-MS), המאפשרת זיהוי של יותר מתריסר שינויי RNA בתאי עצב בודדים מה- CNS של A. californica29. הגישה מורכבת מבידוד כירורגי של תאים בודדים שזוהו מגרעיני CNS גדולים ולאחר מכן בתהליך עבודה אופטימלי להכנת דגימות הכולל ליזה של תאים מכניים, דנטורציה של RNA והידרוליזה אנזימטית במאגר תואם MS. זיהוי וכימות של נוקלאוזידים שעברו שינוי לאחר שעתוק מתבצעים לאחר מכן באמצעות LC-MS/MS. SNRMA-MS ממלא צורך שלא קיבל מענה בתחום ניתוח שינוי הרנ"א על ידי הקלה על רכישת פרופילי שינוי RNA לאחר שעתוק עבור נוירונים בודדים ויש לו פוטנציאל ליישום עתידי בסוגי תאים אחרים.
Protocol
1. הכנת חומרים ופתרונות
- הכן מי ים מלאכותיים (ASW) עם 460 mM NaCl, 10 mM KCl, 10 mM CaCl2, 22 mM MgCl2, 26 mM MgSO4, ו- 10 mM HEPES במים המתקבלים ממערכת טיהור מחמירה. התאם את ה- pH ל- 7.8 באמצעות 1 M NaOH או HCl. בדרך כלל, הכן 1 ליטר של ASW ואחסן ב- 14 °C צלזיוס עד לשימוש.
- הכינו תמיסת אנטיביוטיקה ASW עם 10,000 U/mL של פניצילין G, 10 מיקרוגרם/מיקרול של סטרפטומיצין ו-10 מיקרוגרם/מיקרול של גנטמיצין ואחסנו בטמפרטורה של -20 מעלות צלזיוס. מיד לפני הניסוי, להפשיר ולדלל את תמיסת מלאי האנטיביוטיקה הקפואה 1:100 ב 20-40 מ"ל של ASW. הריכוז הסופי של אנטיביוטיקה בתמיסת ASW הפועלת הוא 100 U/mL של פניצילין G, 100 מיקרוגרם/מ"ל של סטרפטומיצין, ו-100 מיקרוגרם/מ"ל של גנטמיצין.
- הכינו מאגר עיכול RNA על ידי שילוב של 1 μL של 10 מיקרוגרם/μL אלבומין בסרום בקר, 0.5 μL של 0.5 מיקרוגרם/μL פנטוסטטין, 0.495 μL של 2 פוספטאז אלקליין אלקליין U/μL, 1 μL של 0.1 U phosphodiesterase I (ב-10 mM MgCl2), ו-0.38 μL של אנדונוקלאז מ-Serratia marcescens (25 U) לדגימה. אם אתם מנתחים מספר דגימות, הכינו תערובת מאסטר בצינור נפרד המכיל את נפחו של כל מגיב כפול מספר הדגימות שיש לנתח, ועוד אחת שתתחשב באובדן ריאגנט מקרי משלבי העברת פיפטה.
- הכינו מספר מחטים חדות (זכוכית או מתכת) לבידוד ידני של נוירונים. להכין מחטי מתכת בבית על ידי תחריט אלקטרוכימי של חוט טונגסטן כמו ב30 או לרכוש אותם. הכינו מחטי זכוכית מנימי זכוכית עבים או סטנדרטיים של בורוסיליקט (קוטר חיצוני של 1 מ"מ) באמצעות מושך מיקרופיפט. עבור השיטה הנוכחית, לשמור על קוטר קצה המחט בין 1-5 מיקרומטר, עם אורך צוואר של 100-150 מיקרומטר.
הערה: ניתן לייעל את ייצור מחטי המתכת והזכוכית כדי לייצר כלים המתאימים לצרכים האישיים של החוקר ולמודל הביולוגי הספציפי הנחקר.
2. בידוד של נוירון יחיד
- יש לקרר תמיסה של 0.33 M MgCl2 ל-14°C. באמצעות מזרק 50 מ"ל, להרדים A. californica (150-250 גרם) על ידי הזרקת תמיסת MgCl2 לתוך חלל הגוף של החיה. התוצאות הטובות ביותר מתקבלות ביחס של 1:3 בין נפח התמיסה (mL) לבין מסת גוף בעלי החיים (g). המתן כ-3 דקות עד שבעל החיים יהיה רגוע, וודא שהוא אינו מציג התכווצויות גוף בתגובה לגירוי מישושי.
- מניחים את הצד הגחוני של החיה (צד כף הרגל) למעלה במגש ניתוח. לנתח את החיה באמצעות מספריים כירורגיים עם קצה קהה אחד ממוקם לכיוון החיה, בזהירות ביצוע חתך אורכי דרך כף הרגל.
- הצמד את הצדדים הרוסטרליים, הקאודליים והלטרליים של גוף החיה כדי לחשוף את האיברים הפנימיים ואת הגרעינים של מערכת העצבים המרכזית הממוקמים בחלל הגוף. לבודד גרעיני CNS גדולים מהחיה על ידי ניתוק עצבי כירורגי וכמה חיבורים שמקורם בגרעינים.
- לטבול את הגרעינים בתמיסה של פרוטאז מסוג XIV מבית Streptomyces griseus (10 מ"ג/מ"ל בתמיסת ASW-אנטיביוטיקה) ולדגום בטמפרטורה של 34 מעלות צלזיוס למשך 30 דקות או שעה אחת (עבור גנגליון מוחי).
הערה: משך הדגירה תלוי בעונה, בגודל ובמצב בעלי החיים, כמו גם בתאי עצב ממוקדים. בידוד של נוירונים מסוימים דורש דגירה ארוכה יותר מאחרים ויש לקבוע זאת בניסוי. - שטפו את הגרעינים 6x בתמיסת אנטיביוטיקה ASW והעבירו את כל הגרעינים לתוך צלחת מצופה פולימר סיליקון מלאה בתמיסת ASW-אנטיביוטית באמצעות פיפטת העברת פוליפרופילן שנחתכה לפתח של כ-5 מ"מ. טפלו בפיפט עם 1 מ"ג/מ"ל של אלבומין בסרום בקר ב-ASW כדי למזער את ההדבקה של הגרעינים לפיפט (אופציונלי). שמור על גרעינים שקועים ב- ASW בכל עת.
הערה: טיפול אנזימטי מפחית את היציבות המכנית של נוירונים ורקמות חיבור מסביב, וכתוצאה מכך, ממברנות עצביות עלולות להיפגע עקב חשיפה לאוויר במהלך העברת גרעינים. - הצמידו את הגרעינים והשתמשו במיקרו מספריים ובמלקחיים עדינים כדי להסיר נדנים של גנגליון. עם טיפול אנזימטי חזק מספיק, השתמש במחטי זכוכית או מתכת לייבוש.
- זיהוי חזותי של A. נוירונים קליפורניקה בעלי עניין. בעבודה זו נחקרו התאים הבאים: R2 בגנגליון הבטן, LPl1 בגנגליון הפלורלי, תאים מטא-צרבראליים (MCCs) בגנגליון המוח, ותאי B2 בגנגליון הבוקאלי. צלם תמונות אופטיות של כל ההכנות העצביות והגנגליוניות באמצעות מיקרוסקופ מכויל בהגדלה כוללת של פי 20 כדי לקבוע את הגדלים והנפחים של כל סוג תא.
- באמצעות נימי זכוכית משוכים או מחטי טונגסטן חדות, בודדו בזהירות את התא שזוהה מהגנגליון הגדול.
- ציירו כמות קטנה (1 μL) של ASW למיקרופיפט פלסטיק, ולאחר מכן העבירו את התא המבודד לצינור דגימת PCR המכיל 4 μL של 0.365 M אמוניום אצטט (pH 9.2). למדידות ריקות, אספו 5 μL aliquots של תמיסת ASW-אנטיביוטיקה מהתבשיל המכיל את הגנגליון וערבבו עם מאגר עיכול (המתואר להלן).
3. תזת תאים ועיכול RNA עבור SNRMA-MS
- ליזות את הנוירונים המבודדים על ידי שאיפה חוזרת ונשנית ולוותר על מיקרופיפט (קוטר פנימי של כ-100 מיקרומטר) ב-0.365 M אמוניום אצטט. ייתכן שחלק מהתאים הקטנים יותר לא ייקרעו מיד; כדי לשקר אותם, להפעיל לחץ על פני קוטר התא עם נימי זכוכית משוכה.
- השתמש ברכיבה תרמית כדי לחמם את הדגימות עם תוכנית הטמפרטורה הבאה: 95 °C (54 °F) למשך 3 דקות, 10 °C (85 °F) למשך 3 דקות, החזק בטמפרטורה של 10 °C (74 °F). הסר את צינור הדגימה מהרוכב התרמי.
- הוסף 3.375 μL של מאגר עיכול RNA עבור כל דגימה וערבב את התמיסה באמצעות micropipette על ידי משיכה וחלוקה של התמיסה מספר פעמים. השתמש בצנטריפוגה מיניאטורית על ספסל בגודל 2700 x g במשך 30 שניות כדי לסובב מטה את כל הטיפות הנוזליות הנצמדות לדפנות צינור ה-PCR.
- דגירה של הדגימות ברכיבה התרמית בטמפרטורה של 37 מעלות צלזיוס למשך 3 שעות, ולאחר מכן החזקה בטמפרטורה של 10 מעלות צלזיוס (מכסה מחומם המוגדר ל-ON). מיד לאחר שהדגימה התקררה ל -10 מעלות צלזיוס, העבירו 7 μL של התמיסה לבקבוקון autosampler המצויד בתוספת של 250 μL, תוך הקפדה על היווצרות בועות בצינור ה-autosampler.
4. כרומטוגרפיה נוזלית-ספקטרומטריית מסה טנדם
הערה: נתחו את תקצירי הנוירונים הבודדים ואת תקני הנוקלאוזידים האותנטיים שעברו שינוי באמצעות מערכת LC-MS/MS המצוידת במקור יינון אלקטרוספריי ובשסתום מתפצה בעל שש יציאות.
- כדי להכין את מערכת ה-LC להפרדת נוקלאוזידים קנוניים ומשונים, שיווי משקל עמוד C18 (150 מ"מ x 2.1 מ"מ, גודל חלקיק של 2.2 מיקרומטר, קוטר נקבוביות 120 Å) עם 99% פאזה ניידת A (5 mM אמוניום אצטט, pH 5.6) ו-1% פאזה ניידת B (60/40 פאזה ניידת A/אצטוניטריל (ACN)) בקצב זרימה של 0.2 מ"ל לדקה למשך 12 דקות ב-36 מעלות צלזיוס. השתמש בממסים ברמת LC-MS להכנת שלבים ניידים.
- בזמן שה-LC משתווה, כייל את ספקטרומטר המסה על ידי החדרת תמיסת 1 mM של נתרן אצטט ב-50/50 ACN/water לספקטרומטר המסה באמצעות משאבת מזרקים עם קצב זרימה של 5 μL/min. לאחר הכיול, חברו מחדש את זרימת ה-LC לספקטרומטר המסה.
- תכנת את הפרמטרים הבאים של שיפוע ליניארי: 1% B למשך 0-5 דקות, 5% B ב-9 דקות, 7% B ב-11 דקות, 10% B ב-13 דקות, 15% B ב-32 דקות, 40% B ב-38 דקות, 50% B ב-43 דקות, 100% B ב-50 דקות, 100% B ב-60 דקות, 1% B ב-61 דקות, ושיווי משקל מחדש של 12 דקות ב-1% B לפני הזריקה הבאה.
- הפעל את מכשיר הטרשת הנפוצה במצב חיובי עם הפרמטרים הבאים: מתח נימי המוגדר ל-4,500 וולט, ייבוש טמפרטורה של 275 מעלות צלזיוס, גז ייבוש N2 5 ליטר לדקה וגז ערפילי 1 מוט. הגדר את שסתום הסטייה לבזבוז במשך 2 הדקות הראשונות של הניתוח ולמקור להמשך הריצה.
- אסוף ספקטרום מסה על פני טווח m/z של 110-600. בחר יונים עבור דיסוציאציה הנגרמת על ידי התנגשות ב- 35-40 eV על פני זמן מחזור של 3 שניות באמצעות רשימת מסות מועדפת שנבנתה באמצעות מסד הנתונים2 וחלון בידוד של ± 0.5. השתמש בהדרה פעילה כדי לא לכלול יונים מפיצול לאחר שלושה ספקטרום.
- הגדר רכישה דינמית של ספקטרום MS/MS עבור יונים עם עוצמות מעל ומתחת ל-50,000 ספירות ב-4 הרץ וב-1 הרץ, בהתאמה, וסף מינימלי לבחירת יונים ב-1,990 ספירות.
- עבור SNRMA-MS כמותי, בנה עקומות כיול באמצעות אזורי שיא של כרומטוגרמה יונים מופקת (EIC) המתקבלים עבור תקני נוקלאוזידים מותאמים בחמישה ריכוזים לפחות כדי לאפשר אינטרפולציה של ריכוזי אנאליטים אנדוגניים לא ידועים.
הערה: נוירונים המתקבלים מבעלי חיים עם מסות גוף של 150-250 גרם דורשים בדרך כלל עקומות כיול עבור נוקלאוזידים שעברו שינוי הנעים בין 0.02 pmol ל-2 pmol, אך ערכים אלה עשויים להשתנות בהתאם לרגישות המכשיר.
5. ניתוח נתונים
- צור EICs עבור נוקלאוזידים שהשתנו (m/z מערכי מסד נתונים2). אמת את הזהויות של נוקלאוזידים שעברו שינוי פוטטיבי על-ידי השוואת מאפייני השמירה של ספקטרום MS2 ו-LC לערכי מסד נתונים2. ראה טבלה 1 לקבלת רשימה של שינויי RNA טיפוסיים שזוהו בתאי עצב בודדים מ- A. californica.
- שלבו באופן ידני פסגות המתאימות לנוקלאוזידים שעברו שינוי וקנוניים ותעדו ערכים אלה בגיליון אלקטרוני. נרמלו את אזור השיא עבור כל נוקלאוזיד שהשתנה עם סכום אזורי השיא של ציטידין קנוני, אורידין וגואנוזין שזוהו בדגימה.
הערה: אדנוזין אינו נכלל בנורמליזציה בגלל תפקידו במערכת העצבים המרכזית כנוירומודולטור דינמי31. - בנה מטריצת נתונים המורכבת מכל דגימה של נוירון יחיד ואזורי השיא המנורמלים המתאימים עבור נוקלאוזידים שעברו שינוי שהפגינו יחסי אות לרעש >10. בצע ניתוח רכיבים עיקריים (PCA) והצג את שני המרכיבים העיקריים הראשונים בעלילת הניקוד. בנו עקומות כיול ליניאריות מאזורי השיא של EIC המתקבלות בדילול סדרתי של תקני נוקלאוזידים וחשבו את ריכוזי האנליטים שזוהו.
תוצאות
SNRMA-MS כולל בידוד ידני של תאי עצב מזוהים לנפחי דגימה קטנים לצורך תזה, עיכול וניתוח LC-MS/MS (איור 1A). זרימת עבודה זו זיהתה באופן שגרתי יותר מתריסר שינויי RNA בתאי עצב בודדים ממערכת העצבים המרכזית של A. californica (איור 1B), המייצגים כיסוי של כמעט מחצית מהאפיטרנקטום הידוע של חיה זו24 בתא בודד. לדוגמה, הכפפת הנוירון LPl1 (קוטר של כ-500 מיקרומטר) ל-SNRMA-MS הביאה לגילוי של 15 שינויי RNA ± 1 (n=3). נוקלאוזידים שהשתנו זוהו באופן חיובי על בסיס שלוש תכונות: מאפייני שמירה של LC, מסה מדויקת ופרופילי פיצול MS2 בהשוואה לערכים שסופקו במסד הנתונים2. טבלה 1 מציגה רשימה של כל שינויי הרנ"א שזוהו בתא העצב LPl1. ספקטרומטר המסה הקוודרופולי ברזולוציה גבוהה ששימש לניסויים אלה איפשר דיוק מסה של 4 ppm, כמו גם זיהוי של יון השבר MS2 האופייני ב-m/z 164 עבור הנוקלאוזיד N6,6-דימתילדנוזין שהשתנה (m66A, איור 1B). בשילוב עם נתוני ההפרדה של LC, המסכימים עם הממצאים שהופקדו במסד הנתונים (m66A elutes לאחר N6-מתיל-אדנוזין (m6A)), גישת SNRMA-MS הדגימה הקצאה נכונה של זהויות נוקלאוזידים שהשתנו.
ניתן למנף את פלטפורמת SNRMA-MS ליצירת פרופילי שינוי RNA של נוירונים בודדים ולחקירת הקשר שלהם לרקמות בתפזורת. נוירוני R2 הם תאים כולינרגיים גדולים (בקוטר של כ-500 מיקרומטר) השוכנים בגנגליון הבטן. SNRMA-MS שימש לניתוח שינויי RNA בתאי עצב מסוג R2, כמו גם בגנגליון הבטן בתפזורת שמסביב (איור 2A). אזורי שיא מנורמלים עבור שינויי RNA בכל דגימת נוירון/גנגליון (n = 7) שימשו כקלטים עבור PCA, וחשפו כי נוירוני R2 מציגים פרופילי שינוי RNA מובהקים בהשוואה לגרעינים שבהם הם שוכנים (איור 2B). עדות לכך היא נקודות נתונים עבור נוירוני R2 וגרעיני בטן התופסים אזורים שונים בעלילת הניקוד של PCA. תמיכה נוספת בדפוסי נוקלאוזידים ייחודיים ששונו התקבלה מקבוצה נפרדת של בעלי חיים (n = 7) שבה בוצעו השוואות זוגיות עבור 13 שינויי RNA שזוהו בדרך כלל הן בתאי העצב הבודדים והן ברקמה בתפזורת (איור 2C). שני נוקלאוזידים שעברו שינוי, פסאודורידין (Ψ) ו-2'-O-מתילגואנוסין (Gm), היו בשפע גבוה משמעותית בגרעיני הבטן בהשוואה לנוירונים R2. כאשר צופים בתת-קבוצה של שינויי ה-RNA עם זוגות גנגליון-נוירונים R2 שצוינו, כל גרעיני הבטן הציגו רמות גבוהות יותר של Ψ ו-Gm, ולכל תאי העצב מלבד אחד של R2 היה שפע גבוה יותר של 2'-O-methyladenosine (Am) מאשר הגנגליון המתאים להם (איור 2D). באופן כללי, תוצאות SNRMA-MS מגלות לראשונה שפרופילי שינוי RNA של תאים בודדים יכולים לסטות מתאים בתפזורת באותה רקמה.
השימוש ב-SNRMA-MS כדי לחקור את חיית המודל A. californica מספק הזדמנות ייחודית לאפיין פרופילי שינוי RNA בתאי עצב מזוהים ומובחנים מבחינה תפקודית. שינויי RNA הוערכו על ידי SNRMA-MS בארבעה תאים שזוהו: R2 ו-LPl1 (תאים הומולוגיים, כולינרגיים המעורבים בשחרור ריריות הגנתי)32, MCCs (נוירונים מווסתים סרוטונרגיים המעורבים בהאכלה)33, ותאי B2 (נוירונים פפטידיים המעורבים בתנועתיות המעיים)34. PCA של שישה שינויי RNA בתאי עצב מזוהים אלה, שבודדו מיד לאחר טיפול אנזימטי או הוכנסו לתרבית בהכנה לגנגליון במשך 48 שעות, הדגימו את היציבות והדינמיקה של אפיטרנקטום של תאים בודדים. שינויי RNA בתאים שונים מבחינה תפקודית יצרו אשכולות ייחודיים בחלקת הניקוד בעוד שתאי עצב הומולוגיים מסוג R2/LPl1 התאחדו (איור 3A). תרשים ההעמסה מראה שההבדלים הונעו בעיקר על ידי שפע האיזומרים המיקוםיים של מתיל-אדנוזין, כולל 2'-O-מתיל-אדנוזין (Am) ו-N1-מתיל-אדנוזין (m1A) (איור 3B). באותו ניתוח נערכה השוואה בין תאים מבודדים טריים ותאים בתרבית באתרם (כלומר, בגרעינים שלהם) במשך 48 שעות. כפי שמוצג במתווה הניקוד של PCA, תאים שונים מבחינה תפקודית נשארו ניתנים להבחנה על ידי פרופילי שינוי הרנ"א שלהם.
ניתן להשתמש ב- SNRMA-MS כמותי לקביעת כמויות מוחלטות של שינויי RNA נבחרים שעבורם קיימים תקנים אותנטיים. עקומות כיול חיצוניות נוצרו עבור m1A, Ψ, 2'-O-methylcytidine (Cm), Am ו-m6A, והכמות של כל נוקלאוזיד שהשתנה בזוגות התאים MCC ו-R2/LPl1 נקבעה על ידי אינטרפולציה (איור 4A-E). הכמויות התוך-תאיות של m1A ו-Ψ בשני זוגות של MCCs סימטריים נראו דומות, בעוד שהבדלים גדולים יותר בכמויות השינויים הללו נצפו בשלושה זוגות של תאי R2/LPl1. על מנת להסביר את ההבדלים הנובעים מהגודל הפיזי של התאים שנחקרו, כמויות שינוי הרנ"א נורמלו על ידי נפחי תאים שחושבו ממדידה אופטית של קוטרי התאים כדי להניב ריכוזים תוך-תאיים של נוקלאוזידים שעברו שינוי. נצפו הבדלים משמעותיים בריכוזים התוך-תאיים של Cm ו-Am בין תאי ה-MCCs לבין תאי העצב R2/LPl1. באופן כללי, SNRMA-MS מאפשרת פרופיל איכותי וכמותי של שינויי RNA בתאי עצב בודדים.
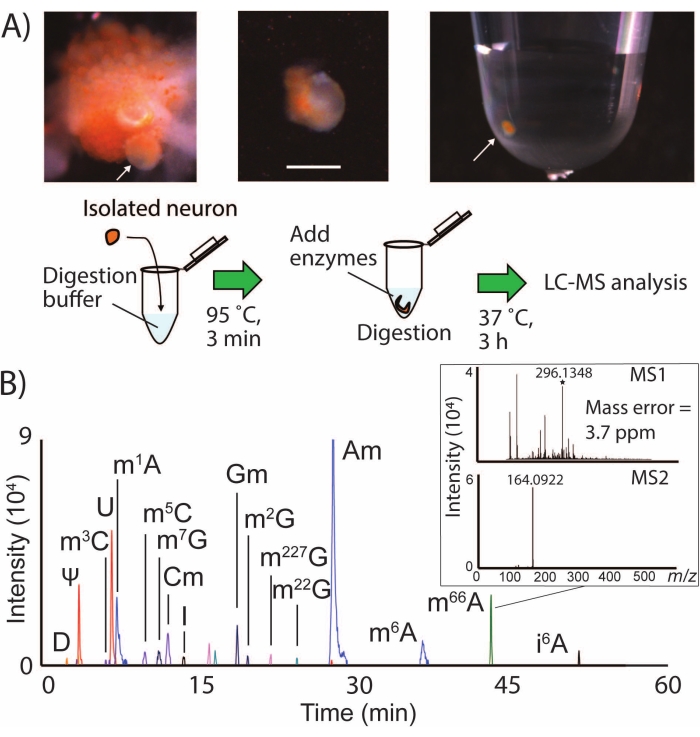
איור 1: זרימת עבודה של SNRMA-MS וזיהוי של שינויי RNA מרובים בתאי עצב בודדים על-ידי LC-MS/MS. (A) תצלומים של גנגליון בוקלי מתפרק ובידוד של תאי עצב בודדים לתוך צינור דגימה. סרגל קנה מידה = 200 מיקרומטר, חיצים מציינים תא B1 מזוהה. מוצגת גם דיאגרמה של הליך הכנת הדגימה לניתוח LC-MS/MS. (B) EICs שכבתיים עבור שינויי RNA בנוירון LPl1 יחיד, עם אינסט המציג ספקטרום MS1 ו-MS2 עבור N6, N6-דימתילדנוזין (m66A). ראה טבלה 1 עבור ערכי m/z המשמשים ליצירת EICs עבור נוקלאוזידים שהשתנו. נתון זה שונהמ-29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
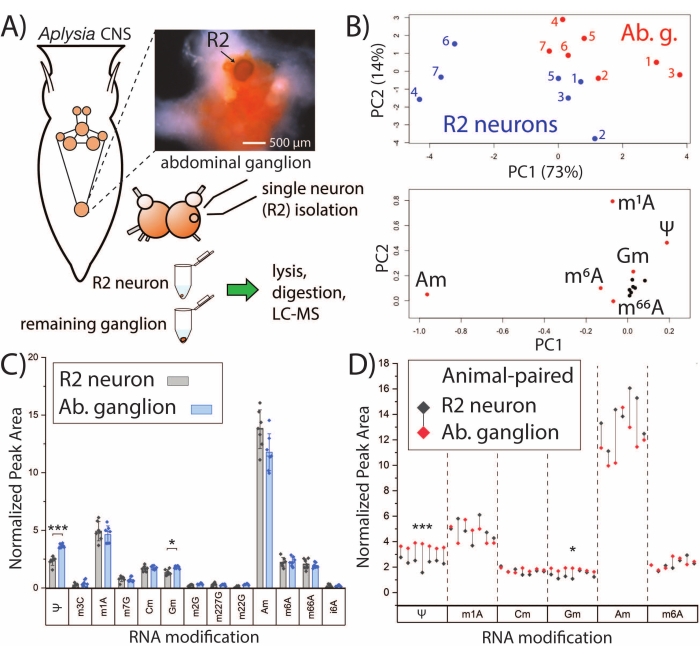
איור 2: SNRMA-MS מבחין בין פרופילי שינוי RNA של נוירונים בודדים ורקמות בתפזורת. (A) סכמטי של A. californica CNS וזרימת עבודה לניתוח נוירוני R2 וגנגליון הבטן שמסביב. התצלום מראה את גנגליון הבטן ואת נוירון R2 (מוזרק עם צבע ירוק מהיר להראות). (B) אזורי שיא יחסיים מ-13 שינויי RNA שימשו ליצירת חלקות ציון PCA (למעלה) וטעינה (למטה). (C) השוואה זוגית של שינויי RNA בגנגליון הבטן ובנוירון R2. פסי שגיאה מייצגים ±1 סטיית תקן (SD), *p < 0.05, ***p < 5 x 10−4, מבחן t משויך עם תיקון Bonferroni−Holm. (D) השוואה של שינויי RNA נבחרים מפאנל C שבו זוגות גנגליון R2-בטן עבור כל חיה מוצגים עם טיפות. נתון זה שונהמ-29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
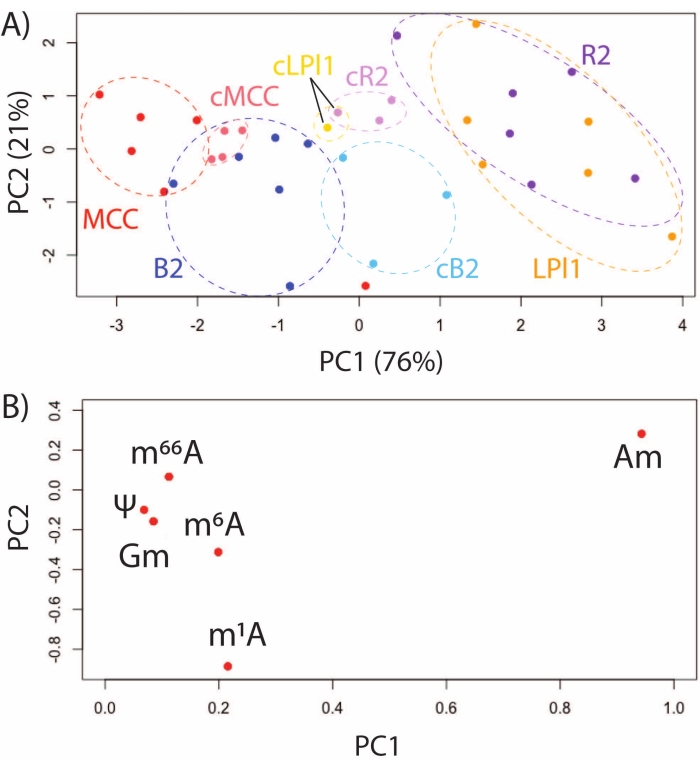
איור 3: יצירת פרופילים של שינויי RNA בתאי עצב מזוהים ושונים מבחינה תפקודית מתאי עצב מזוהים ושונים מבחינה תפקודית מ-A. californica CNS. (A) תרשים ניקוד PCA עבור MCCs, ותאי B2, R2 ו-LPl1 שהיו מבודדים טריים או מבודדים בעקבות תרבית באתרם במשך 48 שעות (מסומנת על ידי cMCC, cB2, cR2, cLPl1), ו-(B) חלקות טעינה עבור שישה שינויי RNA שזוהו בדרך כלל בתאים אלה. נתון זה שונהמ-29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
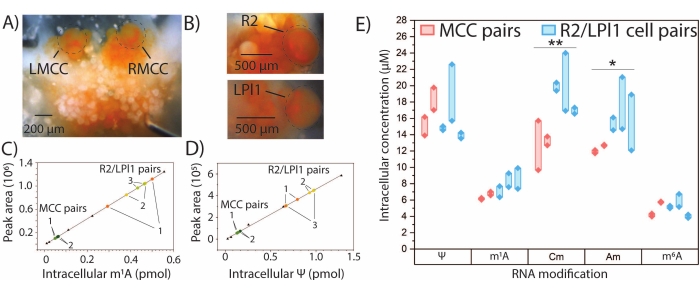
איור 4: כמותית SNRMA-MS בתאי עצב מסוג A. קליפורניקה . SNRMA-MS כמותי מספק כמויות מוחלטות וריכוזים תוך-תאיים עבור מספר נוקלאוזידים שעברו שינוי בתאי עצב בודדים שזוהו כ-A. californica . תצלומים של (A) MCCs שמאליים וימניים (LMCC ו- RMCC, בהתאמה) בגנגליון המוחי ו- (B) R2 בגנגליון הבטן ו- LPl1 בגנגליון הפלורלי. התאים מוקפים בעיגול כדי לשפר את הראות. שרטוטי כיול ליניאריים עבור (C) m1A ו-(D) Ψ (משולשים) המשמשים לאינטרפולציה של כמויות נוקלאוזידים שהשתנו בתאים בודדים (נקודות צבעוניות). זוגות תאים מכל חיה מסומנים 1-3. (E) ריכוזים תוך-תאיים של חמישה נוקלאוזידים שעברו שינוי בזוגות תאי MCC ו-R2/LPl1. קווים עבים מחברים זוגות תאים. *p < 0.05, **p < 0.005, מבחן t מזווג עם תיקון Bonferroni−Holm, n = 2 בעלי חיים (ארבעה תאים בסך הכל) עבור MCCs ו- n = 3 בעלי חיים (שישה תאים בסך הכל) עבור R2/LPl1. נתון זה שונהמ-29. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| שינוי RNA | קיצור | סדר אלוהות (C18) | m/z עבור EIC | m/z עבור MS2 |
| דיהידרורידין | D | 1 | 247.09 | 115 |
| פסאודורידין | Y | 2 | 245.08 | 209/179/155 |
| 3-מתיל-ציטידין | m3C | 3 | 258.11 | 126 |
| N1-מתיל-אדנוזין | m1A | 4 | 282.12 | 150 |
| 5-מתיל-ציטידין | m5C | 5 | 258.11 | 126 |
| N7-מתילגואנוסין | m7G | 6 | 298.12 | 166 |
| 2'-O-מתיל-ציטידין | ס מ | 7 | 258.11 | 112 |
| אינוזין | I6A | 8 | 269.09 | 137 |
| 2'-O-מתילגאנוזין | ג.מ. | 9 | 298.12 | 152 |
| N2-מתילגואנוסין | m2G | 10 | 298.12 | 166 |
| N2,N2,N7-טרימתיל-גואנוזין | m227G | 11 | 326.15 | 194 |
| N2,N2,-דימתילגואנוזין | m22G | 12 | 312.13 | 180 |
| 2'-או-מתיל-אדנוזין | עם | 13 | 282.12 | 136 |
| N6-מתילדנוזין | m6A | 14 | 282.12 | 150 |
| N6,N6-דימתיל-אדנוזין | m66A | 15 | 296.14 | 164 |
| N6-איזופנטנילאדנוזין | i6A | 16 | 336.17 | 204/136/148 |
טבלה 1: שינויי RNA שזוהו בתאי עצב בודדים מ- A. californica. תכונות לאפיון נוקלאוזידים שהשתנו מסופקות כוללות סדר שמירה של LC, m/z ליצירת EICs ושברי CID תואמים.
Discussion
SNRMA-MS ממנף את גישת הכנת הדגימה הממוטבת, וכתוצאה מכך נפח דגימה קטן התואם ל-MS שניתן להעביר לפלטפורמת LC-MS. הטיפול המקדים האנזימטי הראשוני של גרעיני CNS מכתיב הן את הקלות שבה ניתן לנטרל אותם והן את העמידות של נוירונים בודדים במהלך הבידוד. הגנגליון המוחי דורש לעתים קרובות טיפול אנזימטי ממושך בשל הנדן העבה יחסית שלו בהשוואה לגרעיני הבוקאל, הפלורלי והבטן. חוקרים בודדים המבצעים את בידודי הנוירונים הבודדים עשויים להיות בעלי העדפות שונות לגבי מידת עמידותו של הנדן בעת שימוש במיקרו-חתכים ובמלקחיים עדינים. עם זאת, חשוב שהגרעינים לא יתעכלו יתר על המידה, שכן הדבר עלול להוביל לאובדן השלמות המבנית שלהם, לאובדן מידע מיקום שהוא קריטי לזיהוי תאי מטרה, ו/או ליזה של תאים. לאחר הבידוד מהגנגליון, חשוב לוודא כי נפח מינימלי של מדיום בידוד שואף בעת העברת הנוירון לצינור הדגימה. מדיום ASW מכיל ריכוז גבוה של מלחים שעלולים להפריע לאנזימי עיכול במהלך הידרוליזה של RNA וגם ידללו את הדגימה.
במהלך שלב התזה המכנית, מקובל שתאי עצב גדולים (קוטר >250 מיקרומטר) נקרעים כאשר הם עוברים שוב ושוב דרך מיקרופיפט. נוירונים קטנים יותר עשויים לדרוש תשומת לב נוספת כדי להבטיח את התזה של התא, שבדרך כלל כוללת לחיצה על נימי זכוכית על התא. במקרה זה, ייתכן כי נפח חלקי של מאגר הדגימה יימשך לתוך הנימים בגלל כוחות נימיים. ניתן להעביר נפח זה בחזרה לצינור הדגימה על ידי הפעלת לחץ על קצה נימי הזכוכית כדי להבטיח שאף דגימה לא תאבד.
התוצאות הטובות ביותר מתקבלות על ידי הכללת שלב חימום לפני הוספת אנזימים לעיכול RNA. הסיבה לכך היא ככל הנראה שחימום בטמפרטורה של 95 מעלות צלזיוס מנטרל מבנים משניים של RNA שעלולים לעכב את פעילותם של RNases35 ולהפחית את כמות הנוקלאוזידים המשתחררים מביופולימרים של RNA. ניסויי בקרה באמצעות דגימות עם מתיונין יציב עם תווית איזוטופית בוצעו בעבר כדי לחקור אם ממצאי שינוי RNA הנגרמים על ידי חום היו הגורם לאזורי השיא המוגברים שנצפו לשינויי RNA ביחס לפרוטוקול SNRMA-MS ללא חום29. לא נצפה תיוג כזה, מה שמצביע על כך שהאותות המשופרים לשינויי RNA בשיטת SNRMA-MS הממוטבת נבעו מעיכול מעולה של RNA.
שיטות קונבנציונליות לבידוד רנ"א כוללות מיצוי נוזלי-נוזלי (LLE) עם פנול-כלורופורם ובעקבותיו משקעי RNA, שטיפה והחזרות. גישות אלה הוכיחו את עצמן כשימושיות לניסויים בתגובת שרשרת של פולימראז שעתוק הפוך, שבהם ניתן לנטר בקלות את הביטוי של גנים נבחרים בתאי עצב מזוהים מסוג A. californica 36,37. עם זאת, שיטות LLE אינן יכולות לשחזר מספיק RNA לזיהוי ריבונוקלאוזידים שעברו שינוי על ידי LC-MS, בעוד ששיטת SNRMA-MS המתוארת כאן מאפשרת זיהוי של שינויי RNA רבים29. על מנת להעריך פרופילי שינוי של סוגי RNA ספציפיים (למשל, rRNA, tRNA, mRNA) בדגימות רקמות/תאים בתפזורת, יושמו מיצוי פאזה מוצקה של חילופי אניון24, העשרה מבוססת גשושית הכלאה38 ופירוק כרומטוגרפי39, אך שיטות דומות עדיין אינן זמינות לטיהור RNA של תא יחיד. פיתוח גישות של פיצול RNA המסוגלות לבודד סוגי RNA ספציפיים מתאים בודדים יספק תובנה נוספת לגבי תפקודם של שינויי RNA.
SNRMA-MS חשף הטרוגניות לא אופיינית בעבר בנוף שינוי הרנ"א של נוירונים בודדים ב- A. californica וניתן להעלות על הדעת שפרופילי PTM מובחנים דומים קיימים על פני תאים יונקים. מכיוון שתאי יונקים הם קטנים יחסית בהשוואה לנוירונים הגדולים של A. californica שנותחו בפרוטוקול זה, יש צורך בשיפורים בטיפול בנפחי דגימות קטנים כדי להקל על מגבלות זיהוי נמוכות יותר. למרות שכרגע SNRMA-MS מוגבל לנפחים של ~ 5 μL, צפוי כי ניתן יהיה להשיג שיפורים משמעותיים על ידי שילוב התקני טיפול בנוזלים מיקרופלואידיים בזרימת העבודה. יתר על כן, יישום של בידודי תאים אוטומטיים או אוטומטיים למחצה יגדיל את תפוקת הדגימה ויאפשר ניתוח שינוי RNA של תא יחיד של אוכלוסיות תאים גדולות יותר. על ידי התממשקות עם הפרדות LC של ננו-זרימה27, האפיון של סימנים אפיטרנקטומיים בתאים קטנים עוד יותר יהיה בר השגה.
Disclosures
המחברים מצהירים על היעדר אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו מומנה על ידי המכון הלאומי לשימוש בסמים תחת פרס מספר. P30DA018310 והמכון הלאומי לחקר הגנום האנושי תחת פרס מספר. RM1HG010023. K.D.C. מודה על תמיכתה של מלגת פוסט-דוקטורט של מכון בקמן. התוכן הוא באחריותם הבלעדית של הכותבים ואינו מייצג בהכרח את הדעות הרשמיות של הסוכנויות המממנות.
Materials
| Name | Company | Catalog Number | Comments |
| Animals | |||
| Aplysia californica | National Resource for Aplysia (Miami, FL) | 150–250 g (adult) | |
| Benchtop equipment | |||
| Glass capillary puller | Sutter | P-97 | |
| Milli-Q water purification system | Millipore | ||
| Minicentrifuge for PCR tubes | LW Scientific | ZS-1 | |
| Optical Microscope | Zeiss | Stemi 2000C | |
| Thermocycler | Techne | EW-93945-01 | |
| HPLC column and consumables | |||
| Acclaim RSLC 120 C18 column | Thermo Scientific | 71399 | |
| Autosampler vials | Thermo Scientific | C4011-13 | |
| LC and MS Instrumentation and Software | |||
| DataAnalysis 4.4 software | Bruker | ||
| Dionex Ultimate 3000 nanoLC | Thermo Scientific | Equipped with online degasser, autosampler, and thermostatted column compartment | |
| Impact HD UHR QqTOF mass spectrometer | Bruker | Equipped with ESI source | |
| RStudio | RStudio | ||
| Microdissection tools | |||
| Microscissors extra fine vannas 3.5” | Roboz | RS-5640 | |
| Tungsten needles | Roboz | RS-6065 | |
| Reagents/Materials | |||
| 4-(2-hydroxyethyl)-1-piperazineethane-sulfonic acid (HEPES) | Fisher Scientific | H3375 | |
| Alkaline phosphatase | Worthington Biochemical Corp. | LS004081 | |
| Ammonium acetate | Honeywell | 17836 | |
| Benzonase (endonuclease from S. marcescens) | EMD Millipore | 70746-4 | |
| Bovine serum albumin | Sigma-Aldrich | A2153 | |
| Calcium chloride | Sigma-Aldrich | C4901 | |
| Gentamycin sulfate | Fisher Scientific | G1264 | |
| Magnesium chloride | Sigma-Aldrich | M9272 | |
| Magnesium sulfate | Sigma-Aldrich | 208094 | |
| Nucleosides test mix | Sigma-Aldrich | 47310-U | |
| Penicillin G | Sigma-Aldrich | P7794 | |
| Pentostatin | Sigma-Aldrich | SML0508 | |
| Phosphodiesterase I | Worthington Biochemical Corp. | LS003926 | |
| Protease type XIV from Streptomyces griseus | Sigma-Aldrich | P5147 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| Standard glass capillaries | A-M Systems | 626000 | 1 mm o.d., 0.5 mm i.d., 4 in |
| Streptomycin sulfate | Sigma-Aldrich | S9137 |
References
- Cantara, W. A., et al. The RNA modification database, RNAMDB: 2011 update. Nucleic Acids Research. 39, 195-201 (2011).
- Boccaletto, P., et al. MODOMICS: a database of RNA modification pathways. 2017 update. Nucleic Acids Research. 46, 303-307 (2017).
- Kimura, S., Waldor, M. K. The RNA degradosome promotes tRNA quality control through clearance of hypomodified tRNA. Proceedings of the National Academy of Sciences of the United States of America. 116 (4), 1394-1403 (2019).
- Helm, M. Post-transcriptional nucleotide modification and alternative folding of RNA. Nucleic Acids Research. 34 (2), 721-733 (2006).
- Rezgui, V. A. N., et al. tRNA tKUUU, tQUUG, and tEUUC wobble position modifications fine-tune protein translation by promoting ribosome A-site binding. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12289-12294 (2013).
- Shanmugam, R., et al. Cytosine methylation of tRNA-Asp by DNMT2 has a role in translation of proteins containing poly-Asp sequences. Cell Discovery. 1 (1), 1-10 (2015).
- Jia, G., et al. N 6-Methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO. Nature Chemical Biology. 7 (12), 885-887 (2011).
- Li, X., et al. Transcriptome-wide mapping reveals reversible and dynamic N 1 -methyladenosine methylome. Nature Chemical Biology. 12 (5), 311-316 (2016).
- Krogh, N., et al. Profiling of 2′-O-Me in human rRNA reveals a subset of fractionally modified positions and provides evidence for ribosome heterogeneity. Nucleic Acids Research. 44 (16), 7884-7895 (2016).
- Babaian, A., et al. Loss of m1acp3Ψ Ribosomal RNA Modification Is a Major Feature of Cancer. Cell Reports. 31 (5), 107611 (2020).
- Chang, M., et al. Region-specific RNA m6A methylation represents a new layer of control in the gene regulatory network in the mouse brain. Open Biology. 7 (9), 170166 (2017).
- Wang, C. -. X., et al. METTL3-mediated m6A modification is required for cerebellar development. PLOS Biology. 16 (6), 2004880 (2018).
- Engel, M., et al. The role of m6A/m-RNA methylation in stress response regulation. Neuron. 99 (2), 389-403 (2018).
- Widagdo, J., et al. Experience-dependent accumulation of N6-Methyladenosine in the prefrontal cortex is associated with memory processes in mice. Journal of Neuroscience. 36 (25), 6771-6777 (2016).
- Eberwine, J., et al. Analysis of gene expression in single live neurons. Proceedings of the National Academy of Sciences of the United States of America. 89 (7), 3010-3014 (1992).
- Cong, Y., et al. Ultrasensitive single-cell proteomics workflow identifies >1000 protein groups per mammalian cell. Chemical Science. 12 (3), 1001-1006 (2021).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nature Methods. 8 (4), 20-29 (2011).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis-electrospray ionization-mass spectrometry. Analytical Chemistry. 83 (17), 6810-6817 (2011).
- Lovatt, D., et al. Transcriptome in vivo analysis (TIVA) of spatially defined single cells in live tissue. Nature Methods. 11 (2), 190-196 (2014).
- Kærn, M., Elston, T. C., Blake, W. J., Collins, J. J. Stochasticity in gene expression: from theories to phenotypes. Nature Reviews Genetics. 6 (6), 451-464 (2005).
- Chan, C. T. Y., et al. A quantitative systems approach reveals dynamic control of tRNA modifications during cellular stress. PLOS Genetics. 6 (12), 1001247 (2010).
- Sun, C., Jora, M., Solivio, B., Limbach, P. A., Addepalli, B. The effects of ultraviolet radiation on nucleoside modifications in RNA. ACS Chemical Biology. 13 (3), 567-572 (2018).
- Heiss, M., Hagelskamp, F., Marchand, V., Motorin, Y., Kellner, S. Cell culture NAIL-MS allows insight into human tRNA and rRNA modification dynamics in vivo. Nature Communications. 12 (1), 389 (2021).
- Clark, K. D., Lee, C., Gillette, R., Sweedler, J. V. Characterization of neuronal RNA modifications during non-associative learning in aplysia reveals key roles for tRNAs in behavioral sensitization. ACS Central Science. 7 (7), 1183-1190 (2021).
- Basanta-Sanchez, M., Temple, S., Ansari, S. A., D'Amico, A., Agris, P. F. Attomole quantification and global profile of RNA modifications: Epitranscriptome of human neural stem cells. Nucleic Acids Research. 44 (3), 26 (2016).
- Huang, W., et al. Determination of DNA and RNA methylation in circulating tumor cells by mass spectrometry. Analytical Chemistry. 88 (2), 1378-1384 (2016).
- Sarin, L. P., et al. Nano LC-MS using capillary columns enables accurate quantification of modified ribonucleosides at low femtomol levels. RNA. 24 (10), 1403-1417 (2018).
- Clark, K. D., Philip, M. C., Tan, Y., Sweedler, J. V. Biphasic liquid microjunction extraction for profiling neuronal RNA modifications by liquid chromatography-tandem mass spectrometry. Analytical Chemistry. 92 (18), 12647-12655 (2020).
- Clark, K. D., Rubakhin, S. S., Sweedler, J. V. Single-neuron RNA modification analysis by mass spectrometry: Characterizing RNA modification patterns and dynamics with single-cell resolution. Analytical Chemistry. 93 (43), 14537-14544 (2021).
- Guise, O. L., Ahner, J. W., Jung, M. -. C., Goughnour, P. C., Yates, J. T. Reproducible electrochemical etching of tungsten probe tips. Nano Letters. 2 (3), 191-193 (2002).
- Peng, W., Wu, Z., Song, K., Zhang, S., Li, Y., Xu, M. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science. 369 (6508), (2020).
- Rayport, S. G., Ambron, R. T., Babiarz, J. Identified cholinergic neurons R2 and LPl1 control mucus release in Aplysia. Journal of Neurophysiology. 49 (4), 864-876 (1983).
- Rosen, S. C., Weiss, K. R., Goldstein, R. S., Kupfermann, I. The role of a modulatory neuron in feeding and satiation in Aplysia: effects of lesioning of the serotonergic metacerebral cells. Journal of Neuroscience. 9 (5), 1562-1578 (1989).
- Lloyd, P. E., Kupfermann, I., Weiss, K. R. Central peptidergic neurons regulate gut motility in Aplysia. Journal of Neurophysiology. 59 (5), 1613-1626 (1988).
- Crain, P. F. Preparation and enzymatic hydrolysis of DNA and RNA for mass spectrometry. Methods in Enzymology. 193, 782-790 (1990).
- Kadakkuzha, B. M., et al. Age-associated bidirectional modulation of gene expression in single identified R15 neuron of Aplysia. BMC Genomics. 14 (1), 880 (2013).
- Akhmedov, K., Kadakkuzha, B. M., Puthanveettil, S. V. Aplysia ganglia preparation for electrophysiological and molecular analyses of single neurons. Journal of Visualized Experiments: JoVE. (83), e51075 (2014).
- Tardu, M., Jones, J. D., Kennedy, R. T., Lin, Q., Koutmou, K. S. Identification and quantification of modified nucleosides in saccharomyces cerevisiae mRNAs. ACS Chemical Biology. 14 (7), 1403-1409 (2019).
- Heiss, M., Reichle, V. F., Kellner, S. Observing the fate of tRNA and its modifications by nucleic acid isotope labeling mass spectrometry: NAIL-MS. RNA Biology. 14 (9), 1260-1268 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved