Method Article
使用质谱法表征单个神经元中的RNA修饰
摘要
RNA的转录后修饰代表了一个未被充分研究的翻译调控层,最近与中枢神经系统可塑性有关。在这里,描述了样品制备和液相色谱 - 串联质谱方法,用于同时表征单个神经元中的许多RNA修饰。
摘要
RNA的转录后修饰(PTMs)代表了一种研究不足的机制,涉及中枢神经系统(CNS)翻译的调节。最近的证据表明,特定的神经元RNA修饰与学习和记忆范式有关。不幸的是,用于检测这些表观转录组学特征的传统方法只能表征本体组织中高度丰富的RNA修饰,从而排除了对激活的行为回路中单个神经元可能存在的独特PTM图谱的评估。在该协议中,描述了一种方法 - 通过质谱(SNRMA-MS)进行单神经元RNA修饰分析 - 以同时检测和量化单个神经元中的许多修饰的核糖核苷。该方法使用海洋软体动物 Aplysia californica的单个神经元进行验证,首先对主要的CNS神经节进行手术分离和酶处理以暴露神经元细胞体,然后使用锋利的针头和微量移液管进行手动单神经元分离。接下来,在小体积的缓冲液中对样品进行机械和热处理,以从单个细胞中释放RNA以进行随后的RNA消化。然后使用优化的液相色谱 - 质谱方法鉴定和定量修饰的核苷。SNRMA-MS用于为具有已知形态和功能的 加利福尼亚A. californica 的单个已鉴定神经元建立RNA修饰模式。提出了定性和定量SNRMA-MS的例子,突出了RNA修饰在神经元网络中单个神经元之间的异质分布。
引言
RNA规范核苷的修饰因其在蛋白质翻译调控中的无数作用而日益得到认可。迄今为止,已经报道了150多种独特的RNA修饰,其复杂性范围从甲基化,杂原子添加到与细胞代谢物1,2的偶联。这种扩展的RNA字母表,也称为表观转录组,由酶作家产生,负责改变细胞RNA的稳定性3,折叠4和翻译效率5,6 。选定的RNA修饰也可以 通过 酶解橡皮擦7,8逆转,而其他修饰则附加到RNA亚化学计量9,10,使生物系统中修饰和未修饰的RNA序列变得复杂。
RNA修饰在生物学功能中的重要性表现为修饰在不同器官和组织中的不均匀分布,包括中枢神经系统(CNS)的子区域11。这种化学非均质性与CNS发育12,应激反应13和活性依赖性可塑性14有关。中枢神经系统分区域还包括异质细胞群,其中单个细胞表现出不同的化学特征15,16,17,18。即使是相同类型的单个细胞也可能显示独特的转录组,部分原因是组织微环境19 和随机基因表达20。然而,虽然单细胞转录组的表征有些常规,但没有类似的方法可以建立用于多种RNA修饰的单细胞表观转录组。需要能够分析RNA修饰在单个细胞中的分布的新方法,以全面分析CNS和其他生物系统中转录后修饰(PTM)的细胞异质性和调节影响。
使用液相色谱-串联质谱(LC-MS/MS)技术可以很容易地同时测量大容量细胞/组织中的多种RNA修饰。对于修饰核糖核苷的LC-MS / MS分析,从细胞(通常为103-10 6个细胞)中提取RNA,通过沉淀和重悬纯化,随后消化成核苷。然后将由规范和修饰核苷组成的样品混合物注入LC-MS系统以进行分析物分离和检测,从而测定生物体21,22,23中RNA修饰的完整补体。LC-MS / MS最近用于确定神经生物学模型Aplysia californica(A. californica)的CNS中的26个RNA修饰。其中一些表转转录标记的丰度表现出与动物行为变化相关的时间和区域依赖性动态24。然而,由于该方法的灵敏度有限,只能在含有>103个细胞的本体样品中检测RNA修饰。这些较大的样品可能隐藏了具有群体平均值的单个细胞的独特且功能上重要的RNA修饰图谱。尽管对样品制备条件的仔细控制提高了小体积样品中RNA修饰的检测限25,26,27,28,但仍然需要能够检测和定量单个细胞中多个修饰核糖核苷的分析方法。
该协议通过质谱(SNRMA-MS)引入了单神经元RNA修饰分析,允许从 A. californica29的CNS中检测单个神经元中的十几个RNA修饰。该方法包括从主要的CNS神经节中手术分离单个已鉴定的细胞,然后优化样品制备工作流程,涉及机械细胞裂解,RNA变性和在MS兼容的缓冲液中酶水解。SNRMA-MS通过促进单个神经元的转录后RNA修饰谱的获取,满足了RNA修饰分析领域未满足的需求,并具有未来应用于其他细胞类型的潜力。
研究方案
1. 材料和溶液的制备
- 在从严格的净化系统获得的水中,用460 mM NaCl,10 mM KCl,10 mM CaCl2,22 mM MgCl2,26 mM MgSO4和10 mM HEPES制备人工海水(ASW)。使用1 M NaOH或HCl将pH调节至7.8,通常,准备1L反潜战并储存在14°C直至使用。
- 用10,000 U / mL青霉素G,10μg/ μL链霉素和10μg/ μL庆大霉素制备ASW抗生素溶液,并储存在-20°C。 在实验前,将冷冻的抗生素储备溶液解冻并稀释1:100在20-40 mL反潜水中。工作ASW溶液中抗生素的最终浓度为100 U / mL青霉素G,100μg/ mL链霉素和100μg/ mL庆大霉素。
- 通过组合1μL10μg/ μL牛血清白蛋白,0.5μL0.5μg/ μL戊抑素,0.495μL2 U / μL碱性磷酸酶,1μL 0.1 U磷酸二酯酶I(在10mM MgCl 2中)和来自粘质沙雷氏菌(25 U)的0.38μL内切酶来制备RNA消化缓冲液。如果分析多个样品,请在单独的试管中制备预混液,其中包含每种试剂的体积乘以要分析的样品数量,再加一个,以考虑移液器转移步骤中偶然的试剂损失。
- 准备几根锋利的针头(玻璃或金属)用于手动分离神经元。通过30 中钨丝的电化学蚀刻在内部制作金属针或购买它们。使用微量移液器从厚壁或标准壁硼硅酸盐玻璃毛细管(外径1 mm)制备玻璃针。对于本方法,保持针尖直径在1-5μm之间,颈部长度为100-150μm。
注意:可以优化金属和玻璃针的制造,以生产适合研究人员个人需求和所研究的特定生物学模型的工具。
2. 单个神经元的分离
- 将0.33M MgCl2溶液冷却至14°C。 使用50mL注射器,通过将MgCl 2溶液注射到动物的体腔中来麻醉加利福尼亚A. californica(150-250g)。溶液体积(mL)与动物体重(g)的比例为1:3,可获得最佳结果。等待大约3分钟,让动物变得放松,确保它不会在触觉刺激下表现出身体收缩。
- 将动物腹侧(脚侧)向上放在解剖盘中。使用手术剪刀切开动物,将一个钝尖朝向动物,小心地从脚上纵向切开。
- 固定动物身体的喙部,尾部和侧侧,以暴露位于体腔中的内脏和CNS神经节。通过手术切断神经和一些源自神经节的结缔剂,将主要的中枢神经系统神经节与动物分离。
- 将神经节浸入灰霉 菌 的XIV型蛋白酶溶液中(10mg / mL在ASW抗生素溶液中),并在34°C下孵育30分钟或1小时(用于脑神经节)。
注意:孵育的持续时间取决于季节,动物大小和状况,以及靶向神经元。一些神经元的分离需要比其他神经元更长的孵育时间,应通过实验确定。 - 用ASW抗生素溶液冲洗神经节6x,并使用已切至约5mm开口的聚丙烯转移移液管将所有神经节转移到装有ASW抗生素溶液的硅胶聚合物涂层皿中。用ASW中的1mg / mL牛血清白蛋白治疗移液管,以尽量减少神经节粘附在移液管上(可选)。始终将神经节浸入反潜线中。
注意:酶处理会降低神经元和周围结缔组织的机械稳定性,因此,在神经节转移过程中,神经元膜可能由于暴露于空气而受损。 - 固定神经节,用微剪刀和细镊子去除神经节鞘。经过足够强的酶处理后,使用玻璃或金属针进行脱鞘。
- 目视识别感兴趣的 加利福尼亚A. 在这项工作中,研究了以下细胞:腹部神经节中的R2,胸膜神经节中的LPl1,大脑神经节中的后脑细胞(MCCs)和颊神经节中的B2细胞。使用校准的显微镜以20倍的总放大倍率拍摄所有神经和神经节制剂的光学图像,以确定每种细胞类型的大小和体积。
- 使用拉动的玻璃毛细管或锋利的钨针,小心地将识别的细胞与块状神经节隔离开来。
- 将少量(1μL)ASW吸入塑料微量移液管中,然后将分离的细胞转移到含有4μL 0.365M乙酸铵(pH 9.2)的PCR样品管中。对于空白测量,从含有神经节的培养皿中收集5μL等分试样的ASW-抗生素溶液,并与消化缓冲液混合(如下所述)。
3. SNRMA-MS的细胞裂解和RNA消化
- 通过重复抽吸和除去0.365M乙酸铵中的微量移液管(约100μm内径)来裂解分离的神经元。一些较小的细胞可能不会立即破裂;要裂解它们,用拉动的玻璃毛细管在整个细胞的直径上施加压力。
- 使用以下温度程序使用热循环仪加热样品:95°C 3分钟,10°C3分钟,保持在10°C。 从热循环仪上取下样品管。
- 为每个样品加入3.375μLRNA消化缓冲液,并通过抽出并分配溶液几次来使用微量移液管混合溶液。使用2700× g 的微型台式离心机30秒,以旋转任何附着在PCR管壁上的液滴。
- 将样品在37°C的热循环仪中孵育3小时,然后在10°C下保持(加热的盖子设置为ON)。样品冷却至10°C后,立即将7μL溶液转移到配备250μL插入物的自动进样器小瓶中,注意避免在自动进样器管中形成气泡。
4. 液相色谱-串联质谱
注意:使用配备电喷雾电离源和六端口换向阀的LC-MS / MS系统分析单神经元消化物和真正的改良核苷标准品。
- 为了制备用于分离规范和修饰核苷的LC系统,在36°C下以0.2 mL / min的流速以99%流动相A(5mM乙酸铵,pH 5.6)和1%流动相B(60/40流动相A / 乙腈(ACN))平衡C18柱(150 mm x 2.1 mm,2.2μm粒径,120 Å孔径)12分钟。 使用LC-MS级溶剂制备流动相。
- 当LC平衡时,通过将1 mM乙酸钠溶液在50/50 ACN / 水中 通过 流速为5μL / min的注射泵引入质谱仪来校准质谱仪。校准后,将LC流重新连接到质谱仪。
- 编程以下线性梯度参数:1% B 持续 0-5 分钟,5% B 在 9 分钟,7% B 在 11 分钟,10% B 在 13 分钟,15% B 在 32 分钟,40% B 在 38 分钟,50% B 在 43 分钟,100% B 在 50 分钟,100% B 在 60 分钟,1% B 在 61 分钟, 并在下一次注射前在1%B处重新平衡12分钟。
- 在正模式下操作 MS 仪器,具有以下参数:毛细管电压设置为 4,500 V,干燥温度 275 °C,N2 干燥气体 5 L/min,雾化气体 1 bar。在分析的前2分钟内将换向阀设置为废物,并在剩余的运行中寻找源。
- 收集 m / z 范围为110-600的质谱。使用使用数据库2 构建的首选质量列表和±0.5的隔离窗口,在3 s循环时间内以35-40 eV选择碰撞诱导解离的离子。使用主动排除在三个光谱后从碎片中排除离子。
- 为强度分别在 4 Hz 和 1 Hz 下高于和低于 50,000 计数的离子设置动态 MS/MS 谱采集,在 1,990 计数下设置离子选择的最小阈值。
- 对于定量SNRMA-MS,使用为修饰的核苷标准品获得的提取离子色谱(EIC)峰区域构建校准曲线,该峰区域至少为五种浓度,以允许插值未知的内源性分析物浓度。
注意:从体量为150-250g的动物获得的神经元通常需要对修饰的核苷进行校准曲线,范围从0.02 pmol到2 pmol,但这些值可能会根据仪器的灵敏度而变化。
5. 数据分析
- 为修饰的核苷生成 EIC(从数据库值2 生成 m/z)。通过将假定的修饰核苷的 MS2 谱和 LC 保留特性与数据库值2 进行比较,验证其身份。参见表1,了解在加利福尼亚猪笼草的单个神经元中检测到的典型RNA修饰列表。
- 手动整合对应于修饰核苷和规范核苷的峰,并将这些值记录在电子表格中。使用样品中检测到的规范胞苷,尿苷和鸟苷的峰面积之和归一化每个修饰核苷的峰面积。
注意:腺苷不包括在归一化中,因为它在CNS中作为动态神经调节剂31的作用。 - 构建一个数据矩阵,该矩阵由每个单神经元样本和相应的归一化峰区域组成,用于具有>10的信噪比的修饰核苷。执行主成分分析 (PCA) 并在评分图中显示前两个主成分。从核苷标准品连续稀释获得的EIC峰区域构建线性校准曲线,并计算检测到的分析物的浓度。
结果
SNRMA-MS涉及将识别的神经元手动分离到小样本体积中,以进行裂解,消化和LC-MS / MS分析(图1A)。该工作流程常规检测来自 加利福尼亚中 枢神经系统的单个神经元中的十几个RNA修饰(图1B),代表了该动物24 在单个细胞中近一半的已知表观转录组的覆盖率。例如,将LPl1神经元(直径约500μm)置于SNRMA-MS下,检测到15±1个RNA修饰(n = 3)。根据三个属性肯定地鉴定了修饰的核苷:LC保留特性,精确质量和MS2片段化曲线与数据库中提供的值相比2。 表1 显示了在LPl1神经元中检测到的所有RNA修饰的列表。用于这些实验的高分辨率四极杆飞行时间质谱仪能够实现4 ppm的质量精度以及m / z 164处的MS2片段离子的特征检测改性核苷N6,6-二甲基腺苷(m66A, 图1B)。结合LC分离数据,其与数据库中沉积的结果一致(m66 A在N6-甲基腺苷(m6A)之后洗脱),SNRMA-MS方法证明了修饰的核苷身份的正确分配。
SNRMA-MS平台可用于建立单个神经元的RNA修饰谱并研究它们与本体组织的关系。R2神经元是位于腹部神经节中的大(直径约500μm)胆碱能细胞。SNRMA-MS用于分析R2神经元以及周围大块腹神经节的RNA修饰(图2A)。每个神经元/神经节样本中RNA修饰的归一化峰区域(n = 7)被用作PCA的输入,表明R2神经元与它们所在的神经节相比表现出不同的RNA修饰谱(图2B)。R2神经元和腹部神经节的数据点占据了PCA评分图的不同区域,证明了这一点。从单独的动物队列(n = 7)获得了对独特修饰核苷模式的进一步支持,其中对13种RNA修饰进行了成对比较,这些修饰通常在单个神经元和本体组织中检测到(图2C)。与R2神经元相比,两种修饰的核苷,假尿苷(Ψ)和2'-O-甲基鸟苷(Gm),在腹部神经节中的丰度显着更高。当观察具有R2神经元 - 神经节对的RNA修饰的子集时,所有腹部神经节都表现出更高水平的Ψ和Gm,并且除一个神经元外,所有R2神经元的2'-O-甲基腺苷(Am)丰度高于其相应的神经节(图2D)。总体而言,SNRMA-MS结果首次揭示了单细胞的RNA修饰谱可以与同一组织中的大细胞分化。
使用SNRMA-MS研究模型动物 A. californica 提供了一个独特的机会来表征已鉴定的,功能不同的神经元中的RNA修饰谱。SNRMA-MS在四种已鉴定的细胞中评估RNA修饰:R2和LPl1(同源胆碱能细胞参与防御性粘液释放)32,MCCs(参与喂养的5-羟色胺能调节神经元)33和B2细胞(参与肠道运动的肽类神经元)34。这些已鉴定神经元中六种RNA修饰的PCA,要么在酶处理后立即分离,要么在神经节制剂中培养48小时,证明了单细胞表观转录组的稳定性和动力学。功能不同细胞中的RNA修饰在评分图中形成独特的簇,而同源R2 / LPl1神经元共聚(图3A)。加载图显示,差异主要是由甲基腺苷的位置异构体的丰度驱动的,包括2'-O-甲基腺苷(Am)和N1-甲基腺苷(m1A)(图3B)。在同一分析中,对新鲜分离的细胞和 原位 (即在其各自的神经节中)培养48小时的细胞进行比较。如PCA评分图所示,功能不同的细胞通过其RNA修饰谱保持可区分。
定量SNRMA-MS可用于确定具有真实标准品的精选RNA修饰的绝对量。生成m1A,Ψ,2'-O-甲基胞苷(Cm),Am和m6A的外部校准曲线,并通过插值确定MCC和R2 / LPl1细胞对中每个修饰核苷的量(图4A-E)。两对对称MCC中m1A和Ψ的细胞内量似乎相似,而在三对R2 / LPl1细胞中观察到这些修饰量的较大差异。为了解释由于所研究细胞的物理尺寸引起的差异,通过光学测量细胞直径计算的细胞体积对RNA修饰量进行归一化,以产生修饰核苷的细胞内浓度。在MCC和R2 / LPl1神经元之间观察到Cm和Am的细胞内浓度的显着差异。总体而言,SNRMA-MS能够对单个神经元中的RNA修饰进行定性和定量分析。
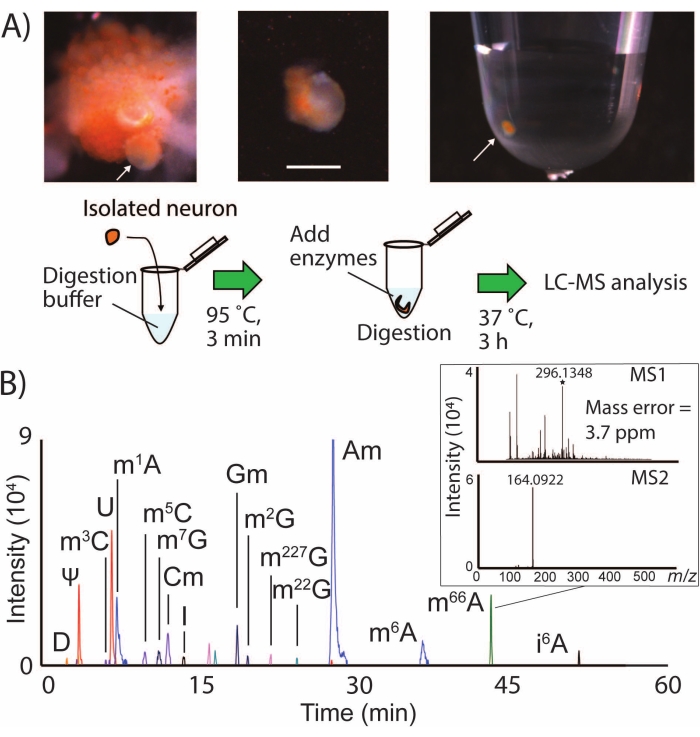
图1:SNRMA-MS工作流程和通过LC-MS / MS检测单个神经元中的多个RNA修饰 (A)脱皮的颊神经节和单个神经元分离到样品管中的照片。比例尺 = 200 μm,箭头表示已识别的 B1 细胞。还显示了用于LC-MS / MS分析的样品制备程序图。(B) 覆盖在单个 LPl1 神经元中进行 RNA 修饰的 EIC,插图显示 N6、N6-二甲基腺苷 (m66A) 的 MS1 和 MS2 光谱。参见 表1 ,了解用于生成修饰核苷EIC的 m/z 值。此数字已从29 修改。 请点击此处查看此图的大图。
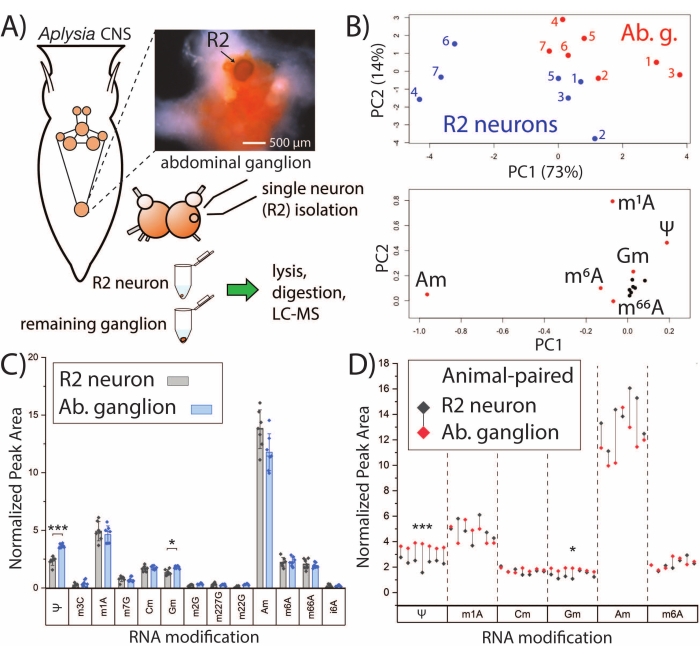
图2:SNRMA-MS区分了单个神经元和本体组织的RNA修饰谱。 (A) 加利福尼亚猪笼草 CNS的示意图以及用于分析R2神经元和周围腹部神经节的工作流程。照片显示了腹部神经节和R2神经元(注射快速绿色染料以提高可见度)。(B)使用来自13个RNA修饰的相对峰区域来生成PCA评分(顶部)和负载(底部)图。(C)腹部神经节和R2神经元中RNA修饰的成对比较。误差线表示 ±1 标准差 (SD),*p < 0.05,***p < 5 x 10−4,与 Bonferroni−Holm 校正配对 的 t 检验。(D)从图C中选择的RNA修饰的比较,其中每个动物的R2-腹部神经节对用滴线显示。此数字已从29 修改。 请点击此处查看此图的大图。
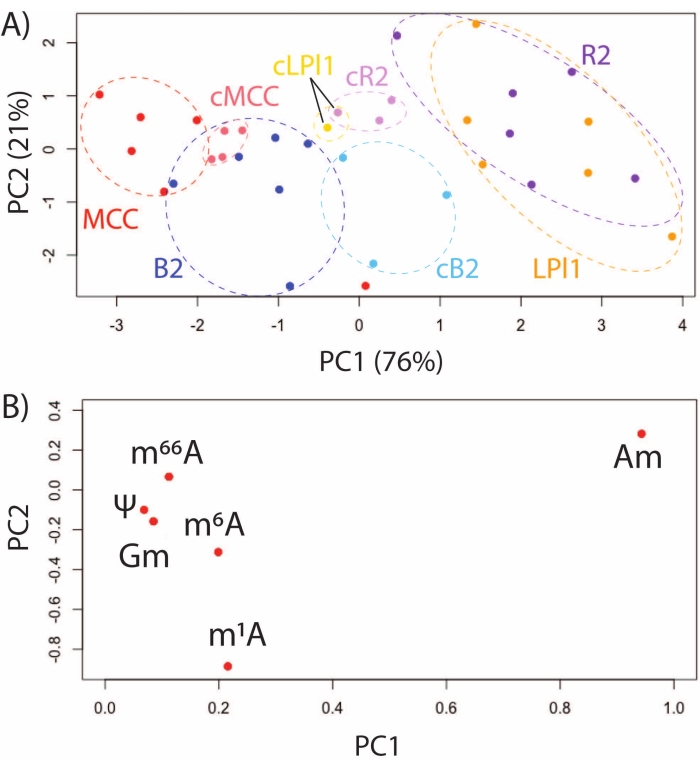
图3:分析来自 加利福尼亚猪笼草 CNS的已鉴定,功能不同的神经元的RNA修饰 (A)MCC的PCA评分图,以及B2,R2和LPl1细胞,这些细胞 在原位 培养48小时后新鲜分离或分离(由cMCC,cB2,cR2,cLPl1表示),以及(B)在这些细胞中通常检测到的六种RNA修饰的加载图。此数字已从29 修改。 请点击此处查看此图的大图。
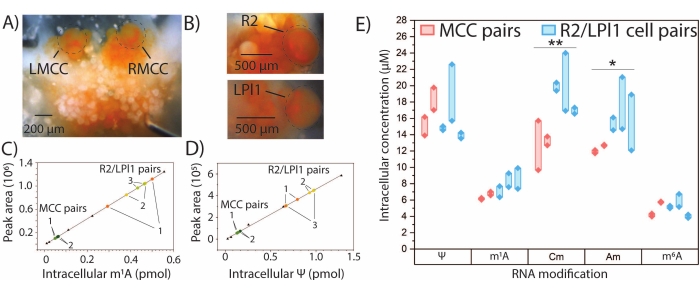
图4: 加州锥虫 神经元中的定量SNRMA-MS。 定量SNRMA-MS为单个已鉴定的 加利福尼亚锥虫 神经元中的几种修饰核苷提供绝对量和细胞内浓度。脑神经节中(A)左右MCC(分别为LMCC和RMCC)和(B)腹部神经节中的R2和胸膜神经节中的LPl1的照片。单元格被圈出以增强可见性。(C)m1A和(D)Ψ(三角形)的线性校准图,用于插值单个细胞(彩色点)中修饰的核苷量。来自每只动物的细胞对被标记为1-3。(E)MCC和R2 / LPl1细胞对中五种修饰核苷的细胞内浓度。粗线连接细胞对。*p < 0.05,**p < 0.005,与 Bonferroni−Holm 校正配对 t 检验,mccc 为 n = 2 只动物(共 4 个细胞),R2/LPl1 为 n = 3 只动物(共 6 个细胞)。此数字已从29 修改。 请点击此处查看此图的大图。
| 核糖核酸修饰 | 缩写 | 洗脱顺序 (C18) | m/z 代表 EIC | m/z for MS2 |
| 二氢尿苷 | D | 1 | 247.09 | 115 |
| 假尿苷 | Y | 2 | 245.08 | 209/179/155 |
| 3-甲基胞苷 | m3C | 3 | 258.11 | 126 |
| N1-甲基腺苷 | 毫1安 | 4 | 282.12 | 150 |
| 5-甲基胞苷 | m5C | 5 | 258.11 | 126 |
| N7-甲基鸟苷 | m7G | 6 | 298.12 | 166 |
| 2'-O-甲基胞苷 | 厘米 | 7 | 258.11 | 112 |
| 肌苷 | I6A 系列 | 8 | 269.09 | 137 |
| 2'-O-甲基鸟苷 | 通用 汽车 | 9 | 298.12 | 152 |
| N2-甲基鸟苷 | m2G | 10 | 298.12 | 166 |
| N2,N2,N7-三甲基鸟苷 | m227G | 11 | 326.15 | 194 |
| N2,N2,-二甲基鸟苷 | m22G | 12 | 312.13 | 180 |
| 2'-O-甲基腺苷 | 是 | 13 | 282.12 | 136 |
| N6-甲基腺苷 | 毫6A | 14 | 282.12 | 150 |
| N6,N6-二甲基腺苷 | m66A | 15 | 296.14 | 164 |
| N6-异戊烯基二氢呋喃 | i6A | 16 | 336.17 | 204/136/148 |
表1:在 加利福尼亚猪笼草的单个神经元中检测到RNA修饰。 提供了用于表征修饰核苷的属性,包括LC保留顺序,用于生成EIC的 m / z 以及相应的CID片段。
讨论
SNRMA-MS利用优化的样品制备方法,从而产生小的,与MS兼容的样品体积,可以输送到LC-MS平台。中枢神经系统神经节的初始酶预处理决定了它们脱鞘的难易程度和分离期间单个神经元的耐久性。脑神经节通常需要延长酶治疗,因为与颊神经节、胸膜和腹部神经节相比,其鞘相对较厚。执行单个神经元分离的个体研究人员可能对使用微剪刀和细镊子时鞘的耐用性有不同的偏好。然而,重要的是神经节不要过度消化,因为这可能导致其结构完整性的丧失,对识别靶细胞至关重要的位置信息的丧失和/或细胞裂解。从神经节分离后,重要的是要确保在将神经元转移到样品管时吸出最小体积的分离培养基。ASW培养基含有高浓度的盐,在RNA水解过程中可能会干扰消化酶,并且还会稀释样品。
在机械裂解步骤中,大神经元(直径>250μm)在反复通过微量移液管时破裂是很常见的。较小的神经元可能需要额外的注意来确保细胞裂解,这通常涉及在细胞上按压玻璃毛细管。在这种情况下,由于毛细管力,样品缓冲液的部分体积可能会被吸入毛细管中。通过对玻璃毛细管末端施加压力,该体积可以输送回样品管中,以确保不会丢失样品。
通过在添加用于RNA消化的酶之前包括加热步骤,可以获得最佳结果。这可能是因为在95°C下加热会使RNA二级结构变性,这可能会阻碍RNases35 的活性并减少RNA生物聚合物释放的核苷量。先前使用用稳定同位素标记的蛋氨酸加标的样品进行对照实验,以研究热诱导的RNA修饰伪影是否是相对于无热SNRMA-MS方案29观察到的RNA修饰峰面积增加的原因。没有观察到这样的标记,表明使用优化的SNRMA-MS方法进行RNA修饰的改善信号是由于RNA的优越消化。
从细胞中分离总RNA的传统方法包括使用苯酚 - 氯仿进行液-液萃取(LLE)以及随后的RNA沉淀,洗涤和重悬。这些方法已被证明可用于逆转录聚合酶链反应实验,其中选择基因的表达可以很容易地监测已鉴定的 A. californica 神经元36,37。然而,LLE方法不能回收足够的RNA用于通过LC-MS检测修饰的核糖核苷,而本文描述的SNRMA-MS方法能够检测许多RNA修饰29。为了评估本体组织/细胞样品中特定RNA类型(例如,rRNA,tRNA,mRNA)的修饰谱,阴离子交换固相提取24,基于杂交探针的富集38和色谱分离39 方法已被应用,但尚未使用类似的方法用于单细胞RNA纯化。能够从单细胞中分离特定RNA类型的RNA分馏方法的发展将为RNA修饰的功能提供额外的见解。
SNRMA-MS揭示了以前在 加利福尼亚猪笼草 中单个神经元的RNA修饰景观中未表征的异质性,并且可以想象哺乳动物细胞中存在类似不同的PTM图谱。由于与在该协议中分析的大型 A. californica 神经元相比,哺乳动物细胞相对较小,因此需要改进小样本量的处理以促进较低的检测限。虽然目前SNRMA-MS的体积限制为~5μL,但通过将微流体液体处理设备纳入工作流程,可以实现实质性的改进。此外,实施自动或半自动细胞分离将提高样品通量,并允许对较大的细胞群进行单细胞RNA修饰分析。通过与纳米流LC分离27接口,可以实现在更小的细胞中表征表转转录标记。
披露声明
作者声明没有相互竞争的经济利益。
致谢
这项工作由国家药物滥用研究所资助,奖号为。P30DA018310和国家人类基因组研究所的奖励号为。RM1HG010023.K.D.C.感谢贝克曼研究所博士后奖学金的支持。内容完全由作者负责,并不一定代表资助机构的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| Animals | |||
| Aplysia californica | National Resource for Aplysia (Miami, FL) | 150–250 g (adult) | |
| Benchtop equipment | |||
| Glass capillary puller | Sutter | P-97 | |
| Milli-Q water purification system | Millipore | ||
| Minicentrifuge for PCR tubes | LW Scientific | ZS-1 | |
| Optical Microscope | Zeiss | Stemi 2000C | |
| Thermocycler | Techne | EW-93945-01 | |
| HPLC column and consumables | |||
| Acclaim RSLC 120 C18 column | Thermo Scientific | 71399 | |
| Autosampler vials | Thermo Scientific | C4011-13 | |
| LC and MS Instrumentation and Software | |||
| DataAnalysis 4.4 software | Bruker | ||
| Dionex Ultimate 3000 nanoLC | Thermo Scientific | Equipped with online degasser, autosampler, and thermostatted column compartment | |
| Impact HD UHR QqTOF mass spectrometer | Bruker | Equipped with ESI source | |
| RStudio | RStudio | ||
| Microdissection tools | |||
| Microscissors extra fine vannas 3.5” | Roboz | RS-5640 | |
| Tungsten needles | Roboz | RS-6065 | |
| Reagents/Materials | |||
| 4-(2-hydroxyethyl)-1-piperazineethane-sulfonic acid (HEPES) | Fisher Scientific | H3375 | |
| Alkaline phosphatase | Worthington Biochemical Corp. | LS004081 | |
| Ammonium acetate | Honeywell | 17836 | |
| Benzonase (endonuclease from S. marcescens) | EMD Millipore | 70746-4 | |
| Bovine serum albumin | Sigma-Aldrich | A2153 | |
| Calcium chloride | Sigma-Aldrich | C4901 | |
| Gentamycin sulfate | Fisher Scientific | G1264 | |
| Magnesium chloride | Sigma-Aldrich | M9272 | |
| Magnesium sulfate | Sigma-Aldrich | 208094 | |
| Nucleosides test mix | Sigma-Aldrich | 47310-U | |
| Penicillin G | Sigma-Aldrich | P7794 | |
| Pentostatin | Sigma-Aldrich | SML0508 | |
| Phosphodiesterase I | Worthington Biochemical Corp. | LS003926 | |
| Protease type XIV from Streptomyces griseus | Sigma-Aldrich | P5147 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| Standard glass capillaries | A-M Systems | 626000 | 1 mm o.d., 0.5 mm i.d., 4 in |
| Streptomycin sulfate | Sigma-Aldrich | S9137 |
参考文献
- Cantara, W. A., et al. The RNA modification database, RNAMDB: 2011 update. Nucleic Acids Research. 39, 195-201 (2011).
- Boccaletto, P., et al. MODOMICS: a database of RNA modification pathways. 2017 update. Nucleic Acids Research. 46, 303-307 (2017).
- Kimura, S., Waldor, M. K. The RNA degradosome promotes tRNA quality control through clearance of hypomodified tRNA. Proceedings of the National Academy of Sciences of the United States of America. 116 (4), 1394-1403 (2019).
- Helm, M. Post-transcriptional nucleotide modification and alternative folding of RNA. Nucleic Acids Research. 34 (2), 721-733 (2006).
- Rezgui, V. A. N., et al. tRNA tKUUU, tQUUG, and tEUUC wobble position modifications fine-tune protein translation by promoting ribosome A-site binding. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12289-12294 (2013).
- Shanmugam, R., et al. Cytosine methylation of tRNA-Asp by DNMT2 has a role in translation of proteins containing poly-Asp sequences. Cell Discovery. 1 (1), 1-10 (2015).
- Jia, G., et al. N 6-Methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO. Nature Chemical Biology. 7 (12), 885-887 (2011).
- Li, X., et al. Transcriptome-wide mapping reveals reversible and dynamic N 1 -methyladenosine methylome. Nature Chemical Biology. 12 (5), 311-316 (2016).
- Krogh, N., et al. Profiling of 2′-O-Me in human rRNA reveals a subset of fractionally modified positions and provides evidence for ribosome heterogeneity. Nucleic Acids Research. 44 (16), 7884-7895 (2016).
- Babaian, A., et al. Loss of m1acp3Ψ Ribosomal RNA Modification Is a Major Feature of Cancer. Cell Reports. 31 (5), 107611 (2020).
- Chang, M., et al. Region-specific RNA m6A methylation represents a new layer of control in the gene regulatory network in the mouse brain. Open Biology. 7 (9), 170166 (2017).
- Wang, C. -. X., et al. METTL3-mediated m6A modification is required for cerebellar development. PLOS Biology. 16 (6), 2004880 (2018).
- Engel, M., et al. The role of m6A/m-RNA methylation in stress response regulation. Neuron. 99 (2), 389-403 (2018).
- Widagdo, J., et al. Experience-dependent accumulation of N6-Methyladenosine in the prefrontal cortex is associated with memory processes in mice. Journal of Neuroscience. 36 (25), 6771-6777 (2016).
- Eberwine, J., et al. Analysis of gene expression in single live neurons. Proceedings of the National Academy of Sciences of the United States of America. 89 (7), 3010-3014 (1992).
- Cong, Y., et al. Ultrasensitive single-cell proteomics workflow identifies >1000 protein groups per mammalian cell. Chemical Science. 12 (3), 1001-1006 (2021).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nature Methods. 8 (4), 20-29 (2011).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis-electrospray ionization-mass spectrometry. Analytical Chemistry. 83 (17), 6810-6817 (2011).
- Lovatt, D., et al. Transcriptome in vivo analysis (TIVA) of spatially defined single cells in live tissue. Nature Methods. 11 (2), 190-196 (2014).
- Kærn, M., Elston, T. C., Blake, W. J., Collins, J. J. Stochasticity in gene expression: from theories to phenotypes. Nature Reviews Genetics. 6 (6), 451-464 (2005).
- Chan, C. T. Y., et al. A quantitative systems approach reveals dynamic control of tRNA modifications during cellular stress. PLOS Genetics. 6 (12), 1001247 (2010).
- Sun, C., Jora, M., Solivio, B., Limbach, P. A., Addepalli, B. The effects of ultraviolet radiation on nucleoside modifications in RNA. ACS Chemical Biology. 13 (3), 567-572 (2018).
- Heiss, M., Hagelskamp, F., Marchand, V., Motorin, Y., Kellner, S. Cell culture NAIL-MS allows insight into human tRNA and rRNA modification dynamics in vivo. Nature Communications. 12 (1), 389 (2021).
- Clark, K. D., Lee, C., Gillette, R., Sweedler, J. V. Characterization of neuronal RNA modifications during non-associative learning in aplysia reveals key roles for tRNAs in behavioral sensitization. ACS Central Science. 7 (7), 1183-1190 (2021).
- Basanta-Sanchez, M., Temple, S., Ansari, S. A., D'Amico, A., Agris, P. F. Attomole quantification and global profile of RNA modifications: Epitranscriptome of human neural stem cells. Nucleic Acids Research. 44 (3), 26 (2016).
- Huang, W., et al. Determination of DNA and RNA methylation in circulating tumor cells by mass spectrometry. Analytical Chemistry. 88 (2), 1378-1384 (2016).
- Sarin, L. P., et al. Nano LC-MS using capillary columns enables accurate quantification of modified ribonucleosides at low femtomol levels. RNA. 24 (10), 1403-1417 (2018).
- Clark, K. D., Philip, M. C., Tan, Y., Sweedler, J. V. Biphasic liquid microjunction extraction for profiling neuronal RNA modifications by liquid chromatography-tandem mass spectrometry. Analytical Chemistry. 92 (18), 12647-12655 (2020).
- Clark, K. D., Rubakhin, S. S., Sweedler, J. V. Single-neuron RNA modification analysis by mass spectrometry: Characterizing RNA modification patterns and dynamics with single-cell resolution. Analytical Chemistry. 93 (43), 14537-14544 (2021).
- Guise, O. L., Ahner, J. W., Jung, M. -. C., Goughnour, P. C., Yates, J. T. Reproducible electrochemical etching of tungsten probe tips. Nano Letters. 2 (3), 191-193 (2002).
- Peng, W., Wu, Z., Song, K., Zhang, S., Li, Y., Xu, M. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science. 369 (6508), (2020).
- Rayport, S. G., Ambron, R. T., Babiarz, J. Identified cholinergic neurons R2 and LPl1 control mucus release in Aplysia. Journal of Neurophysiology. 49 (4), 864-876 (1983).
- Rosen, S. C., Weiss, K. R., Goldstein, R. S., Kupfermann, I. The role of a modulatory neuron in feeding and satiation in Aplysia: effects of lesioning of the serotonergic metacerebral cells. Journal of Neuroscience. 9 (5), 1562-1578 (1989).
- Lloyd, P. E., Kupfermann, I., Weiss, K. R. Central peptidergic neurons regulate gut motility in Aplysia. Journal of Neurophysiology. 59 (5), 1613-1626 (1988).
- Crain, P. F. Preparation and enzymatic hydrolysis of DNA and RNA for mass spectrometry. Methods in Enzymology. 193, 782-790 (1990).
- Kadakkuzha, B. M., et al. Age-associated bidirectional modulation of gene expression in single identified R15 neuron of Aplysia. BMC Genomics. 14 (1), 880 (2013).
- Akhmedov, K., Kadakkuzha, B. M., Puthanveettil, S. V. Aplysia ganglia preparation for electrophysiological and molecular analyses of single neurons. Journal of Visualized Experiments: JoVE. (83), e51075 (2014).
- Tardu, M., Jones, J. D., Kennedy, R. T., Lin, Q., Koutmou, K. S. Identification and quantification of modified nucleosides in saccharomyces cerevisiae mRNAs. ACS Chemical Biology. 14 (7), 1403-1409 (2019).
- Heiss, M., Reichle, V. F., Kellner, S. Observing the fate of tRNA and its modifications by nucleic acid isotope labeling mass spectrometry: NAIL-MS. RNA Biology. 14 (9), 1260-1268 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。