Method Article
질량 분광법을 사용하여 단일 뉴런의 RNA 변형 특성화
요약
RNA의 전사 후 변형은 최근에 중추 신경계 가소성과 관련이있는 번역 조절의 과소 연구 된 층을 나타냅니다. 여기에서, 샘플 준비 및 액체 크로마토그래피-탠덤 질량 분광법 접근법은 단일 뉴런에서 수많은 RNA 변형의 동시 특성화를 위해 기술된다.
초록
RNA의 전사 후 변형 (PTMs)은 중추 신경계 (CNS)에서 번역의 조절에 관여하는 미연구 메커니즘을 나타낸다. 최근의 증거는 특정 뉴런 RNA 변형을 학습 및 기억 패러다임과 연결시켰다. 불행하게도, 이러한 에피전사체 특징의 검출을 위한 종래의 방법들은 단지 벌크 조직에서 고도로 풍부한 RNA 변형을 특성화할 수 있을 뿐이며, 활성화된 행동 회로 내의 개별 뉴런에 대해 존재할 수 있는 독특한 PTM 프로파일의 평가를 배제한다. 이 프로토콜에서는 단일 뉴런에서 수많은 변형된 리보뉴클레오시드를 동시에 검출하고 정량화하는 접근법(질량 분광법(SNRMA-MS)에 의한 단일 뉴런 RNA 변형 분석에 대해 설명합니다. 이 접근법은 해양 연체 동물의 개별 뉴런 인 Aplysia californica를 사용하여 검증되며, 뉴런 세포 몸체를 노출시키는 주요 CNS 신경절의 외과 적 분리 및 효소 치료로 시작하여 날카로운 바늘과 마이크로 피펫을 사용하여 수동 단일 뉴런 분리가 수행됩니다. 다음으로, 소량의 완충액에서 샘플의 기계적 및 열적 처리는 후속 RNA 소화를 위해 개별 세포로부터 RNA를 해방시키기 위해 수행된다. 이어서, 변형된 뉴클레오시드는 최적화된 액체 크로마토그래피-질량 분광법을 사용하여 동정되고 정량화된다. SNRMA-MS는 형태학 및 기능을 알고 있는 A. californica 로부터 확인된 단일 뉴런에 대한 RNA 변형 패턴을 확립하는데 사용된다. 정성적 및 정량적 SNRMA-MS의 예가 뉴런 네트워크에서 개별 뉴런에 걸친 RNA 변형의 이질적 분포를 강조하는 것으로 제시된다.
서문
RNA의 정준 뉴클레오시드에서의 변형은 단백질 번역의 조절에서 그들의 무수한 역할에 대해 점점 더 인식되고 있다. 현재까지 150개 이상의 독특한 RNA 변형이 메틸화, 헤테로원자 첨가, 세포 대사산물 1,2와의 접합에 이르기까지 복잡성의 범위가 보고되었다. epitranscriptome으로도 알려진이 확장 RNA 알파벳은 효소 작성자에 의해 생성되며 세포 RNA의 안정성3, 폴딩4 및 번역 효율 5,6을 변경하는 역할을합니다. 선택된 RNA 변형은 또한 효소적 지우개(7,8)를 통해 역전될 수 있는 반면, 다른 것들은 RNAs에 치환량론적으로9,10으로 부가되어, 생물학적 시스템에서 변형된 RNA 서열과 변형되지 않은 RNA 서열의 복잡한 풍경을 렌더링한다.
생물학적 기능에서 RNA 변형의 중요성은 중추 신경계 (CNS)의 하위 영역을 포함한 다른 기관 및 조직에 걸친 변형의 불평등 한 분포에 의해 나타납니다 11. 이러한 화학적 이질성은 CNS 개발(12), 스트레스 반응(13), 및 활성-의존적 가소성(14)과 연결되었다. CNS 서브영역은 개별 세포가 별개의 화학적 프로파일15,16,17,18을 나타내는 이종 세포 집단을 추가로 포함한다. 동일한 유형의 단일 세포조차도 조직 미세 환경(19) 및 확률적 유전자 발현(20)으로 인해 부분적으로 독특한 전사체를 표시할 수 있다. 그러나, 단일 세포 전사체의 특성화는 다소 일상적이지만, 다중 RNA 변형을 위한 단일 세포 에피텍토롬을 확립하기 위한 유사한 방법은 없다. 개별 세포에서 RNA 변형의 분포를 프로파일링할 수 있는 새로운 접근법은 CNS 및 다른 생물학적 시스템에서 전사 후 변형(PTM)의 세포 이질성 및 조절 영향에 대한 포괄적인 분석을 위해 필요하다.
벌크 세포/조직에서 수많은 RNA 변형의 동시 측정은 액체 크로마토그래피-탠덤 질량 분광분석법(LC-MS/MS) 기술을 사용하여 쉽게 수행할 수 있습니다. 변형된 리보뉴클레오시드의 LC-MS/MS 분석을 위해, RNA는 세포(전형적으로 10개의3-10 6개의 세포)로부터 추출되고, 침전 및 재현탁에 의해 정제되고, 이어서 뉴클레오시드로 소화된다. 정준 및 변형된 뉴클레오시드로 구성된 샘플 혼합물은 분석물 분리 및 검출을 위해 LC-MS 시스템에 주입된 후, 유기체21,22,23에서 RNA 변형의 완전한 보체의 결정으로 이어진다. LC-MS/MS는 최근 신경생물학적 모델인 Aplysia californica (A. californica)의 CNS에서 26개의 RNA 변형을 결정하는 데 사용되었습니다. 이들 후성전사학적 표식들 중 일부의 풍부함은 동물(24)의 행동 변화와 상관관계가 있는 시간-및 영역-의존적 역학을 나타내었다. 그러나, 상기 방법의 제한된 민감도로 인해 >103 세포를 함유하는 벌크 샘플에서만 RNA 변형을 검출할 수 있었다. 이 더 큰 샘플은 집단 평균을 가진 개별 세포의 독특하고 기능적으로 중요한 RNA 변형 프로파일을 숨길 가능성이 큽니다. 시료 준비 조건을 신중하게 조절하여 소량 샘플25,26,27,28에서 RNA 변형에 대한 검출 한계가 개선되었지만, 단일 세포에서 다중 변형된 리보뉴클레오시드를 검출하고 정량화할 수 있는 분석 방법에 대한 필요성이 여전히 남아 있다.
이 프로토콜은 질량 분광법 (SNRMA-MS)에 의한 단일 뉴런 RNA 변형 분석을 도입하여 A. californica29의 CNS에서 단일 뉴런에서 수십 개 이상의 RNA 변형을 검출 할 수 있습니다. 이 접근법은 주요 CNS 신경절에서 확인 된 단일 세포를 외과 적으로 분리 한 다음 MS 호환 버퍼에서 기계적 세포 용해, RNA 변성 및 효소 가수분해와 관련된 최적화 된 샘플 준비 워크 플로우로 구성됩니다. 전사 후 변형된 뉴클레오시드의 확인 및 정량화는 LC-MS/MS. SNRMA-MS를 사용하여 수행됩니다. SNRMA-MS는 단일 뉴런에 대한 전사 후 RNA 변형 프로파일의 획득을 용이하게 함으로써 RNA 변형 분석 분야에서 충족되지 않은 요구를 충족시키며 향후 다른 세포 유형에 적용할 가능성이 있습니다.
프로토콜
1. 재료 및 솔루션의 제조
- 엄격한 정제 시스템으로부터 얻은 물에서 460 mM NaCl, 10 mM KCl, 10 mM CaCl2, 22 mMMgCl2, 26 mM MgSO4 및 10 mM HEPES로 인공 해수 (ASW)를 준비하십시오. 1 M NaOH 또는 HCl을 사용하여 pH를 7.8로 조정하십시오. 일반적으로 1 L의 ASW를 준비하고 사용 전까지 14°C에서 보관하십시오.
- 10,000 U/mL의 페니실린 G, 10 μg/μL의 스트렙토마이신 및 10 μg/μL의 젠타마이신으로 ASW-항생제 용액을 준비하고 -20°C에서 보관하십시오. 실험 직전에, 동결된 항생제 원액을 ASW 20-40 mL에 1:100으로 녹이고 희석한다. 작동하는 ASW 용액에서 항생제의 최종 농도는 페니실린 G 100 U / mL, 스트렙토 마이신 100 μg / mL 및 겐타마이신 100 μg / mL입니다.
- 10 μg/μL 소 혈청 알부민 1 μL, 0.5 μg/μL 펜토스타틴 0.5 μL, 2 U/μL 알칼리성 포스파타제 0.495 μL, 0.1 U 포스포디에스테라제 I (10 mM MgCl2 중) 1 μL 및 혈청 마르세센스 (25 U)의 엔도뉴클레아제 0.38 μL를 시료당 조합하여 RNA 소화 완충액을 제조하였다. 여러 샘플을 분석하는 경우, 각 시약의 부피에 분석할 샘플 수를 곱한 값과 피펫 이송 단계로부터의 부수적인 시약 손실을 설명하기 위해 하나 더 포함하는 별도의 튜브에 마스터 믹스를 준비하십시오.
- 뉴런의 수동 분리를 위해 여러 개의 날카로운 바늘 (유리 또는 금속)을 준비하십시오. 30 에서와 같이 텅스텐 와이어의 전기 화학 에칭으로 집에서 금속 바늘을 만들거나 구입하십시오. 마이크로 피펫 풀러를 사용하여 두껍거나 표준 벽 붕규산염 유리 모세 혈관 (1mm 외경)에서 유리 바늘을 준비하십시오. 본 방법의 경우, 바늘 끝 직경을 1-5 μm 사이, 목 길이 100-150 μm로 유지하십시오.
참고 : 금속 및 유리 바늘의 제작은 연구자의 개별 요구와 조사중인 특정 생물학적 모델에 맞는 도구를 생산하도록 최적화 될 수 있습니다.
2. 단일 뉴런의 분리
- 0.33 MMgCl2 용액을 14°C로 냉각시킨다. 50 mL 주사기를 사용하여, MgCl2 용액을 동물의 체강에 주입하여 A. californica (150-250 g)를 마취한다. 최상의 결과는 동물 체질량 (g)에 대한 용액 부피 (mL)의 1:3 비율로 얻어진다. 동물이 이완 될 때까지 약 3 분 정도 기다렸다가 촉각 자극에 반응하여 신체 수축을 나타내지 않도록하십시오.
- 동물 복부 측면 (발 측면)을 해부 트레이에 올려 놓습니다. 동물 쪽으로 한 개의 무딘 팁이 놓인 외과 용 가위를 사용하여 동물을 해부하고 조심스럽게 발을 통해 세로 절단을합니다.
- 동물 신체의 로스트랄, 코달 및 측면 측면을 고정시켜 체강에 위치한 내부 장기와 CNS 신경절을 노출시킵니다. 신경절에서 유래 한 신경과 일부 연결을 외과 적으로 절단하여 동물로부터 주요 CNS 신경절을 분리하십시오.
- 신경절을 스트렙토마이세스 그리세우스 (ASW-항생제 용액 중 10mg/mL)의 프로테아제 유형 XIV 용액에 담그고 34°C에서 30분 또는 1시간 동안 배양한다(대뇌 신경절의 경우).
참고 : 배양 기간은 계절, 동물의 크기 및 상태뿐만 아니라 표적 뉴런에 따라 다릅니다. 일부 뉴런의 분리는 다른 뉴런보다 더 긴 배양을 필요로하며 실험적으로 결정되어야합니다. - ASW 항생제 용액으로 신경절 6x를 헹구고 ~ 5mm의 개구부로 절단 된 폴리 프로필렌 전달 피펫을 사용하여 ASW 항생제 용액으로 채워진 실리콘 폴리머 코팅 접시에 모든 신경절을 옮깁니다. ASW에서 1 mg / mL의 소 혈청 알부민으로 피펫을 처리하여 신경절이 피펫에 달라 붙는 것을 최소화하십시오 (선택 사항). 신경절은 항상 ASW에 잠겨 있어야합니다.
참고: 효소 치료는 뉴런 및 주변 결합 조직의 기계적 안정성을 감소시키고, 결과적으로 신경절 전달 중 공기에 노출되어 신경세포막이 손상될 수 있습니다. - 신경절을 고정하고 미세 가위와 미세 포셉을 사용하여 신경절 외피를 제거하십시오. 충분히 강한 효소 처리로 유리 또는 금속 바늘을 사용하여 탈피하십시오.
- 관심있는 A. californica 뉴런을 시각적으로 식별하십시오. 이 연구에서는 복부 신경절의 R2, 흉막 신경절의 LPl1, 뇌 신경절의 메타 뇌 세포 (MCCs) 및 구강 신경절의 B2 세포가 연구되었습니다. 20x 총 배율에서 보정 된 현미경을 사용하여 모든 신경 및 신경절 이온 제제의 광학 이미지를 촬영하여 각 세포 유형의 크기와 부피를 결정하십시오.
- 당겨진 유리 모세관 또는 날카로운 텅스텐 바늘을 사용하여 확인 된 세포를 벌크 신경절에서 조심스럽게 분리하십시오.
- 소량 (1 μL)의 ASW를 플라스틱 마이크로피펫에 그린 다음, 단리된 세포를 0.365 M 아세트산암모늄 (pH 9.2) 4 μL를 함유하는 PCR 샘플 튜브 내로 옮긴다. 블랭크 측정을 위해, 신경절이 들어있는 접시에서 ASW-항생제 용액의 5 μL 분취량을 수집하고 소화 완충액 (아래 설명)과 혼합하십시오.
3. SNRMA-MS에 대한 세포 용해 및 RNA 소화
- 반복적인 흡인에 의해 분리된 뉴런을 용해시키고, 0.365 M 암모늄 아세테이트에 마이크로피펫(∼100 μm 내경)을 분주한다. 일부 작은 세포는 즉시 파열되지 않을 수 있습니다. 그들을 용해시키기 위해, 당겨진 유리 모세관으로 세포의 직경에 압력을 가하십시오.
- 열 사이클러를 사용하여 다음 온도 프로그램으로 샘플을 가열하십시오 : 3 분 동안 95 °C, 3 분 동안 10 °C, 10 °C에서 유지하십시오. 열 순환기에서 샘플 튜브를 제거하십시오.
- 각 샘플에 3.375 μL의 RNA 소화 완충액을 첨가하고 용액을 여러 번 회수 및 분주하여 마이크로피펫을 사용하여 용액을 혼합한다. 2700 x g 의 소형 벤치탑 원심분리기를 30초 동안 사용하여 PCR 튜브의 벽에 달라붙는 액체 방울을 스핀다운합니다.
- 샘플을 3시간 동안 37°C에서 열 사이클러에서 인큐베이션하고, 이어서 10°C에서 홀드하였다(가열된 뚜껑을 ON으로 설정). 샘플이 10°C로 냉각된 직후에, 용액 7 μL를 250 μL 인서트가 장착된 자동 샘플러 바이알로 옮기고, 자동 샘플러 튜브 내의 기포 형성을 피하기 위해 주의를 기울인다.
4. 액체 크로마토그래피 - 탠덤 질량 분광법
참고: 전기 분무 이온화 소스와 여섯 포트 전환기 밸브가 장착된 LC-MS/MS 시스템을 사용하여 단일 뉴런 다이제스트 및 본격적인 변형된 뉴클레오시드 표준을 분석하십시오.
- 정준 및 개질된 뉴클레오시드의 분리를 위한 LC 시스템을 제조하기 위해, C18 컬럼(150 mm x 2.1 mm, 2.2 μm 입자 크기, 120 Å 기공 직경)을 99% 이동상 A(5 mM 아세트산암모늄, pH 5.6) 및 1% 이동상 B(60/40 이동상 A/아세토니트릴(ACN))의 유속으로 36°C에서 12분 동안 0.2 mL/min의 유속으로 평형화시킨다. 이동상 제조를 위해 LC-MS 등급 용매를 사용하십시오.
- LC가 평형을 이루는 동안, 50/50 ACN/물 중의 1 mM 아세트산나트륨 용액을 5 μL/min의 유량으로 주사기 펌프를 통해 질량 분광계에 도입하여 질량 분광계를 교정하십시오. 교정 후 LC 흐름을 질량 분석기에 다시 연결합니다.
- 다음과 같은 선형 구배 파라미터를 프로그래밍한다: 0-5분 동안 1% B, 9분에 5% B, 11분에 7% B, 13분에 10% B, 32분에 15% B, 38분에 40% B, 43분에 50% B, 50분에 100% B, 60분에 100% B, 61분에 1% B, 및 다음 주사 전에 1% B에서 12분 재평형화한다.
- MS 기기를 포지티브 모드에서 작동하려면 모세관 전압 4,500V로 설정, 건조 온도 275°C,N2 건조 가스 5L/min, 분무 가스 1bar로 설정합니다. 전환기 밸브를 분석의 처음 2 분 동안 낭비하고 나머지 실행 동안 소스로 설정하십시오.
- 110-600의 m/z 범위에서 질량 스펙트럼을 수집합니다. 3s 사이클 시간에 걸쳐 35-40 eV에서 충돌 유도된 해리를 위해 선택된 이온은 데이터베이스2 및 ± 0.5의 격리 윈도우를 사용하여 구성된 바람직한 질량 리스트를 사용한다. 활성 제외를 사용하여 세 스펙트럼 후에 단편화에서 이온을 제외합니다.
- 4Hz 및 1Hz에서 각각 50,000카운트 이상 및 그 미만의 강도를 갖는 이온에 대해 동적 MS/MS 스펙트럼 수집을 설정하고 이온 선택을 위한 최소 임계값을 1,990카운트로 설정합니다.
- 정량적 SNRMA-MS의 경우, 알려지지 않은 내인성 분석물 농도의 보간을 허용하기 위해 최소 다섯 가지 농도에서 변형된 뉴클레오시드 표준에 대해 수득된 추출된 이온 크로마토그램(EIC) 피크 영역을 사용하여 보정 곡선을 구축한다.
참고: 체질량이 150-250g인 동물로부터 얻은 뉴런은 일반적으로 0.02pmol에서 2pmol 범위의 변형된 뉴클레오시드에 대한 보정 곡선이 필요하지만, 이러한 값은 기기의 민감도에 따라 달라질 수 있습니다.
5. 데이터 분석
- 수정된 뉴클레오시드에 대한 EIC를 생성합니다(데이터베이스 값2의 m/z). 그들의 MS2 스펙트럼 및 LC 보유 특성을 데이터베이스 값2와 비교함으로써 추정적 변형된 뉴클레오시드의 동일성을 검증한다. A. californica로부터의 단일 뉴런에서 검출된 전형적인 RNA 변형의 리스트는 표 1을 참조한다.
- 수정 및 정식 뉴클레오시드에 해당하는 피크를 수동으로 통합하고 이러한 값을 스프레드시트에 기록합니다. 각 변형된 뉴클레오시드에 대한 피크 면적을 샘플에서 검출된 정준 시티딘, 우리딘 및 구아노신에 대한 피크 면적의 합으로 정규화한다.
참고: 아데노신은 동적 신경 조절제(31)로서 CNS에서의 그의 역할 때문에 정상화에 포함되지 않는다. - 신호 대 잡음비를 나타내는 각각의 단일 뉴런 샘플 및 상응하는 정규화된 피크 영역과 변형된 뉴클레오시드에 대한 >10으로 구성된 데이터 매트릭스를 구성한다. 주성분 분석(PCA)을 수행하고 점수 그림에 처음 두 주성분을 표시합니다. 뉴클레오시드 표준물질의 연속 희석으로부터 수득된 EIC 피크 영역으로부터 선형 보정 곡선을 구성하고 검출된 분석물의 농도를 계산한다.
결과
SNRMA-MS는 용해, 소화 및 LC-MS/MS 분석을 위해 식별된 뉴런을 작은 샘플 부피로 수동으로 분리하는 것을 포함합니다(그림 1A). 이 워크플로우는 A. californica의 CNS로부터 단일 뉴런에서 십여 개의 RNA 변형을 통해 일상적으로 검출되며(도 1B), 이는 단일 세포에서 이 동물(24)의 알려진 에피전사체의 거의 절반의 커버리지를 나타낸다. 예를 들어, LPl1 뉴런 (직경∼500 μm)을 SNRMA-MS에 투여하면 15 ± 1 RNA 변형의 검출이 초래되었다 (n = 3). 변형된 뉴클레오시드는 세 가지 속성에 기초하여 긍정적으로 확인되었다: LC 보유 특성, 정확한 질량, 및 MS2 단편화 프로파일은 데이터베이스2에 제공된 값과 비교하였다. 표 1은 LPl1 뉴런에서 검출된 모든 RNA 변형의 리스트를 나타낸다. 이러한 실험에 사용된 고분해능 사중극자 비행 시간 질량 분광계는 4ppm의 질량 정확도뿐만 아니라 변형된 뉴클레오시드 N6,6-디메틸아데노신(m66A, 그림 1B)에 대해 m/z 164에서 특징적인 MS2 단편 이온의 검출을 가능하게 했습니다. 데이터베이스에 침착된 발견(N6-메틸아데노신(m6A) 후 m66A에루트)에 동의하는 LC 분리 데이터와 결합하여, SNRMA-MS 접근법은 변형된 뉴클레오시드 동일성의 정확한 할당을 입증하였다.
SNRMA-MS 플랫폼은 단일 뉴런의 RNA 변형 프로파일을 확립하고 벌크 조직과의 관계를 조사하는 데 활용할 수 있습니다. R2 뉴런은 복부 신경절에 상주하는 큰 (직경 ~ 500 μm) 콜린성 세포입니다. SNRMA-MS는 R2 뉴런뿐만 아니라 주변 벌크 복부 신경절에서의 RNA 변형을 분석하는데 사용되었다 (도 2A). 각 뉴런/신경절 샘플에서 RNA 변형을 위한 정규화된 피크 영역(n=7)이 PCA의 입력으로 사용되었으며, R2 뉴런은 그들이 상주하는 신경절과 비교하여 뚜렷한 RNA 변형 프로파일을 나타낸다는 것을 밝혀냈다(그림 2B). 이것은 PCA 점수 플롯의 다른 영역을 차지하는 R2 뉴런 및 복부 신경절에 대한 데이터 포인트에 의해 입증됩니다. 독특한 변형된 뉴클레오시드 패턴에 대한 추가 지지체는 동물의 별개의 코호트(n=7)로부터 얻어졌으며, 여기서 쌍 비교는 단일 뉴런 및 벌크 조직 둘 다에서 공통적으로 검출된 13개의 RNA 변형에 대해 수행되었다(도 2C). 2개의 변형된 뉴클레오시드인 슈도우리딘(Ψ)과 2'-O-메틸구아노신(Gm)은 R2 뉴런에 비해 복부 신경절에서 유의하게 더 높은 풍부도를 보였다. R2 뉴런-신경절 쌍을 갖는 RNA 변형의 서브세트를 볼 때, 모든 복부 신경절은 Ψ 및 Gm의 더 높은 수준을 나타내었고, R2 뉴런 중 하나를 제외한 모든 뉴런은 상응하는 신경절보다 2'-O-메틸아데노신(Am)의 풍부도가 더 높았다(도 2D). 전반적으로, SNRMA-MS 결과는 단일 세포의 RNA 변형 프로파일이 동일한 조직의 벌크 세포로부터 발산할 수 있다는 것을 처음으로 밝혀냈다.
SNRMA-MS를 사용하여 모델 동물 A. californica를 조사하면 확인되고 기능적으로 구별되는 뉴런에서 RNA 변형 프로파일을 특성화 할 수있는 독특한 기회를 제공합니다. RNA 변형은 4개의 확인된 세포에서 SNRMA-MS에 의해 평가되었다: R2 및 LPl1 (상동성, 방어성 점액 방출에 관여하는 콜린성 세포)32, MCCs (세로토닌성 조절 뉴런 공급에 관여함)33, 및 B2 세포 (장 운동성에 관여하는 펩티드성 뉴런)34. 이들 확인된 뉴런에서 6개의 RNA 변형의 PCA는, 효소 처리 직후에 단리되거나 48시간 동안 신경절 제제에서 배양되어, 단일 세포 에피전사체의 안정성 및 역동성을 입증하였다. 기능적으로 상이한 세포에서의 RNA 변형은 상동성 R2/LPl1 뉴런이 공동-클러스터링되는 동안 스코어 플롯에서 독특한 클러스터를 형성하였다(도 3A). 로딩 플롯은 차이가 주로 2'-O-메틸아데노신(Am) 및 N1-메틸아데노신(m1A)을 포함한 메틸아데노신의 위치 이성질체의 풍부함에 의해 주도되었음을 보여준다(도 3B). 동일한 분석에서, 갓 분리된 세포와 48 h 동안 계내(즉, 각각의 신경절에서)에서 배양된 세포의 비교가 수행되었다. PCA 점수 플롯에 나타난 바와 같이, 기능적으로 상이한 세포는 그들의 RNA 변형 프로파일에 의해 구별가능한 채로 남아있었다.
정량적 SNRMA-MS는 진정한 표준이 이용 가능한 선택된 RNA 변형의 절대량을 결정하는 데 사용될 수 있다. 외부 보정 곡선은m1A, Ψ, 2'-O-메틸시티딘 (Cm), Am, 및m6A에 대해 생성되었고, MCC 및 R2/LPl1 세포 쌍에서 각각 변형된 뉴클레오시드의 양은 보간법에 의해 결정되었다 (도 4A-E). 두 쌍의 대칭 MCC에서m1A및 Ψ의 세포 내 수량은 유사한 것으로 보인 반면, 이러한 변형의 양에서 더 큰 차이는 R2/LPl1 세포의 세 쌍에서 관찰되었다. 연구된 세포의 물리적 크기에 의한 차이를 설명하기 위해, RNA 변형량은 변형된 뉴클레오시드의 세포내 농도를 산출하기 위해 세포 직경의 광학 측정으로부터 계산된 세포 부피에 의해 정규화되었다. Cm 및 Am의 세포내 농도에서 유의한 차이가 MCCs와 R2/LPl1 뉴런 사이에서 관찰되었다. 전반적으로, SNRMA-MS는 단일 뉴런에서 RNA 변형의 정성적 및 양적 프로파일링을 모두 가능하게 한다.
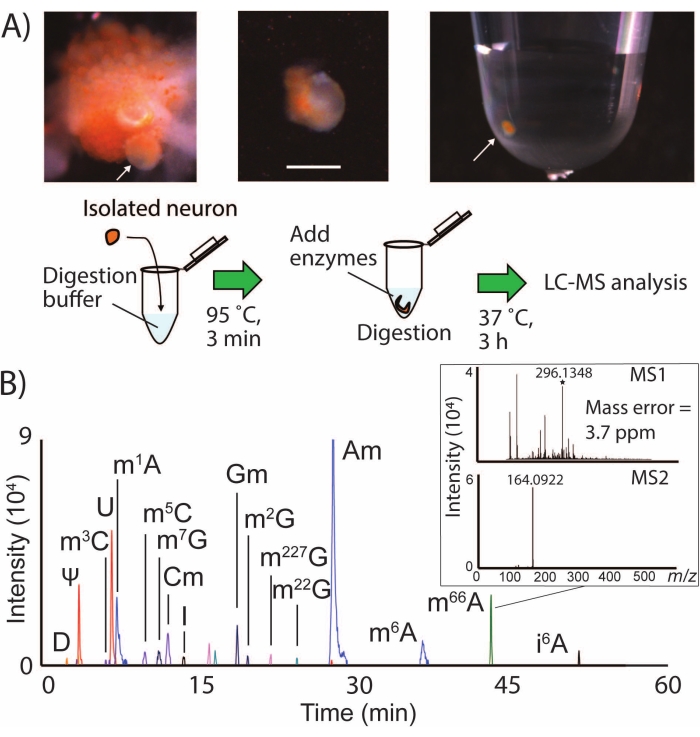
그림 1: SNRMA-MS 워크플로우 및 LC-MS/MS에 의한 단일 뉴런의 다중 RNA 변형 검출 (A) 샘플 튜브로의 데스피싱된 협측 신경절 및 단일 뉴런 분리의 사진. 스케일 바 = 200 μm, 화살표는 식별된 B1 세포를 나타낸다. LC-MS/MS 분석을 위한 샘플 준비 절차의 다이어그램도 표시됩니다. (b) 단일 LPl1 뉴런에서 RNA 변형을 위한 EIC를 오버레이하고, N6, N6-디메틸아데노신(m66A)에 대한 MS1 및 MS2 스펙트럼을 나타내는 인셋. 변형된 뉴클레오시드에 대한 EIC를 생성하는데 사용되는 m/z 값에 대해서는 표 1을 참조한다. 이 수치는29에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
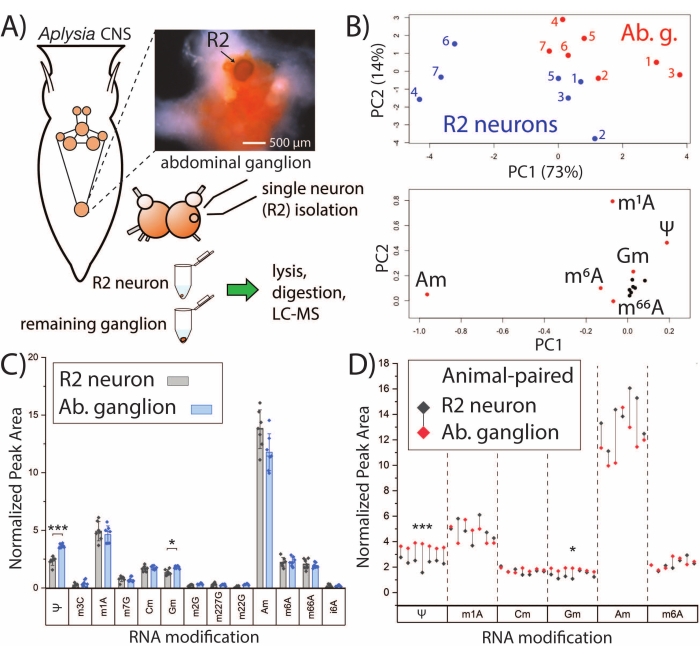
그림 2: SNRMA-MS는 단일 뉴런과 벌크 조직의 RNA 변형 프로파일을 구별합니다. (A) R2 뉴런과 주변 복부 신경절을 분석하기 위한 A. californica CNS 및 워크플로우의 도식. 사진은 복부 신경절과 R2 뉴런 (가시성을 위해 Fast Green 염료를 주입)을 보여줍니다. (b) 13개의 RNA 변형으로부터의 상대적 피크 영역은 PCA 스코어(상단) 및 로딩(하위) 플롯을 생성하는데 사용되었다. (c) 복부 신경절과 R2 뉴런에서의 RNA 변형의 쌍 비교. 오차 막대는 ±1 표준 편차 (SD), *p < 0.05, ***p < 5 x 10-4, Bonferroni-Holm 보정과 쌍을 이룬 t-검정을 나타냅니다. (d) 각 동물에 대한 R2-복부 신경절 쌍이 드롭라인으로 표시되는 패널 C로부터의 선택된 RNA 변형의 비교. 이 수치는29에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
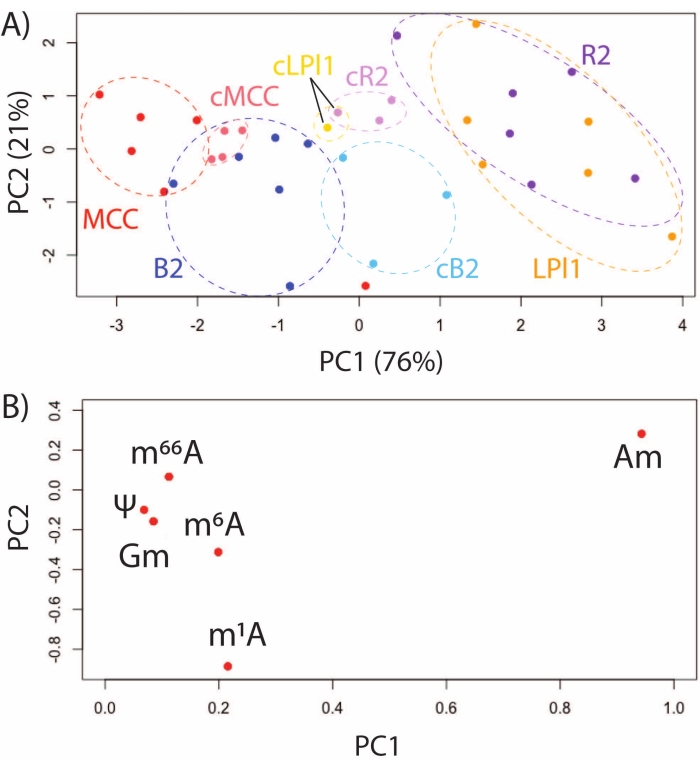
도 3: A. californica CNS로부터 확인된, 기능적으로 상이한 뉴런에서의 RNA 변형 프로파일링. (A) MCCs에 대한 PCA 스코어 플롯, 및 B2, R2, 및 LPl1 세포에 대한 PCA 스코어 플롯은 48시간 동안 계내 배양 후 갓 단리되거나 단리되었다(cMCC, cB2, cR2, cLPl1로 표시됨) 및 (B) 이들 세포에서 일반적으로 검출되는 6개의 RNA 변형에 대한 로딩 플롯. 이 수치는29에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
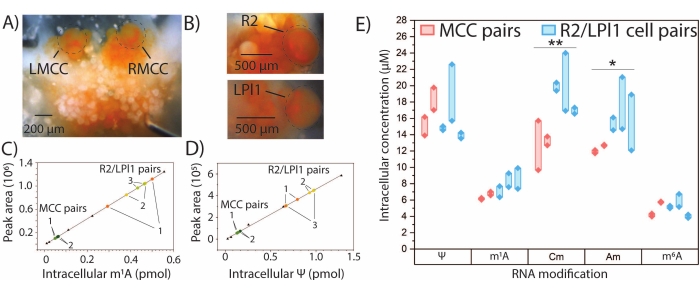
그림 4: A. 칼리포니카 뉴런에서의 정량적 SNRMA-MS. 정량적 SNRMA-MS는 단일, 확인된 A. 칼리포니카 뉴런에서 몇몇 변형된 뉴클레오시드에 대한 절대량 및 세포내 농도를 제공한다. (A) 대뇌 신경절의 좌우 MCC(LMCC 및 RMCC)와 복부 신경절의 R2 및 흉막 신경절의 LPl1의 사진. 세포는 가시성을 향상시키기 위해 원으로 표시됩니다. 단일 세포 (착색 된 점)에서 변형 된 뉴클레오시드 양의 보간을 위해 사용되는 (C)m1A 및 (D) Ψ (삼각형)에 대한 선형 보정 플롯. 각 동물로부터의 세포 쌍은 1-3으로 표지된다. (e) MCC 및 R2/LPl1 세포쌍에서 다섯 개의 변형된 뉴클레오시드의 세포내 농도. 굵은 선은 셀 쌍을 연결합니다. *p < 0.05, **p<는 0.005, 본페로니-홀름 보정과 짝을 이룬 t-검정, MCC의 경우 n=2마리(총 네 세포), R2/LPl1의 경우 n=3마리(총 6세포)입니다. 이 수치는29에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| RNA 변형 | 약어 | 용출 순서(C18) | EIC를 위한 m/z | MS2를 위한 m/z |
| 디하이드로우리딘 | D | 1 | 247.09 | 115 |
| 슈도우리딘 | Y | 2 | 245.08 | 209/179/155 |
| 3-메틸시티딘 | m3C | 3 | 258.11 | 126 |
| N1-메틸아데노신 | m1A | 4 | 282.12 | 150 |
| 5-메틸시티딘 | m5C | 5 | 258.11 | 126 |
| N7-메틸구아노신 | m7G | 6 | 298.12 | 166 |
| 2'-O-메틸시티딘 | 센티미터 | 7 | 258.11 | 112 |
| 이노신 | I6A | 8 | 269.09 | 137 |
| 2'-O-메틸구아노신 | 증권 시세 표시기 | 9 | 298.12 | 152 |
| N2-메틸구아노신 | m2G | 10 | 298.12 | 166 |
| N2,N2,N7-트리메틸구아노신 | m227G | 11 | 326.15 | 194 |
| N2, N2, 디메틸 구아노신 | m22G | 12 | 312.13 | 180 |
| 2'-O-메틸아데노신 | 오전 | 13 | 282.12 | 136 |
| N6-메틸아데노신 | m6A | 14 | 282.12 | 150 |
| N6,N6-디메틸아데노신 | m66A | 15 | 296.14 | 164 |
| N6-이소펜테닐아데노신 | i6A | 16 | 336.17 | 204/136/148 |
표 1: A. 칼리포르니카로부터의 단일 뉴런에서 검출된 RNA 변형. 변형된 뉴클레오시드의 특성화를 위한 속성은 LC 보유 차수, EIC를 생성하기 위한 m/z , 및 상응하는 CID 단편을 포함하여 제공된다.
토론
SNRMA-MS는 최적화된 샘플 준비 접근 방식을 활용하여 LC-MS 플랫폼으로 전달할 수 있는 작은 MS 호환 샘플 볼륨을 제공합니다. CNS 신경절의 초기 효소 전처리는 격리 될 수있는 용이성과 격리 중 단일 뉴런의 내구성을 모두 지시합니다. 대뇌 신경절은 종종 협측, 흉막 및 복부 신경절에 비해 상대적으로 두꺼운 외피가 있기 때문에 연장 된 효소 치료가 필요합니다. 단일 뉴런 분리를 수행하는 개별 연구원은 미세 가위와 미세 포셉을 사용할 때 칼집이 얼마나 내구성이 있어야하는지에 대한 선호도가 다를 수 있습니다. 그러나 신경절이 과도하게 소화되지 않는 것이 중요한데, 이는 구조적 완전성의 상실, 표적 세포를 식별하는 데 중요한 위치 정보의 손실 및/또는 세포 용해로 이어질 수 있기 때문이다. 신경절로부터의 분리 후, 뉴런을 샘플 튜브로 옮길 때 최소한의 양의 분리 매질이 흡인되도록 하는 것이 중요하다. ASW 배지에는 RNA 가수분해 중에 소화 효소를 방해 할 수있는 고농도의 염이 포함되어 있으며 샘플을 희석합니다.
기계적 용해 단계 동안, 큰 뉴런 (>250 μm 직경)이 마이크로 피펫을 반복적으로 통과 할 때 파열되는 것이 일반적입니다. 더 작은 뉴런은 세포 용해를 보장하기 위해 추가적인주의가 필요할 수 있으며, 이는 일반적으로 세포의 유리 모세관을 누르는 것을 포함합니다. 이 예에서, 샘플 버퍼의 부분 부피가 모세관 힘 때문에 모세관 내로 인입될 수 있다. 이 부피는 샘플이 손실되지 않도록 유리 모세관 끝에 압력을 가하여 샘플 튜브 내로 다시 전달될 수 있습니다.
가장 좋은 결과는 RNA 소화를 위한 효소를 첨가하기 전에 가열 단계를 포함함으로써 얻어진다. 이는 95°C에서 가열하면 RNases35 의 활성을 방해하고 RNA 바이오폴리머로부터 방출되는 뉴클레오시드의 양을 감소시킬 수 있는 RNA 이차 구조를 변성시키기 때문일 가능성이 높다. 안정한 동위원소 표지된 메티오닌으로 스파이크된 샘플을 사용한 대조군 실험은 열-유도된 RNA 변형 아티팩트가 무열 SNRMA-MS 프로토콜29에 비해 RNA 변형에 대해 관찰된 증가된 피크 영역의 원인인지 여부를 조사하기 위해 이전에 수행되었다. 이러한 표지는 관찰되지 않았으며, 이는 최적화된 SNRMA-MS 방법을 사용한 RNA 변형에 대한 개선된 신호가 RNA의 우수한 소화 때문임을 나타낸다.
세포로부터 총 RNA를 분리하기 위한 종래의 방법은 페놀-클로로포름을 이용한 액체-액체 추출(LLE) 및 후속 RNA 침전, 세척 및 재현탁을 포함한다. 이러한 접근법은 선별된 유전자의 발현이 확인된 A. californica 뉴런36,37에서 용이하게 모니터링될 수 있는 역전사 중합효소 연쇄 반응 실험에 유용한 것으로 입증되었다. 그러나, LLE 방법은 LC-MS에 의한 변형된 리보뉴클레오시드의 검출을 위해 충분한 RNA를 회수할 수 없는 반면, 본원에 기재된 SNRMA-MS 방법은 수많은 RNA 변형(29)의 검출을 가능하게 한다. 벌크 조직/세포 샘플에서 특정 RNA 유형(예를 들어, rRNA, tRNA, mRNA)의 변형 프로파일을 평가하기 위해, 음이온-교환 고체상 추출(24), 혼성화 프로브-기반 농축물(38), 및 크로마토그래피 분획화(39) 접근법이 적용되었지만, 단일 세포 RNA 정제를 위해 유사한 방법이 아직 이용가능하지 않다. 단일 세포로부터 특정 RNA 유형을 분리할 수 있는 RNA 분획화 접근법의 개발은 RNA 변형의 기능에 대한 추가적인 통찰력을 제공할 것이다.
SNRMA-MS는 A. californica 에서 단일 뉴런의 RNA 변형 풍경에서 이전에 특성화되지 않은 이질성을 밝혀 냈으며 포유류 세포에 걸쳐 유사하게 별개의 PTM 프로파일이 존재한다고 생각할 수 있습니다. 포유동물 세포는 이 프로토콜에서 분석된 큰 A. californica 뉴런에 비해 상대적으로 작기 때문에, 더 낮은 검출 한계를 용이하게 하기 위해 작은 샘플 부피의 취급에 있어서의 개선이 필요하다. 현재 SNRMA-MS는 ~5μL의 부피로 제한되어 있지만, 미세유체 액체 처리 장치를 워크플로우에 통합함으로써 상당한 개선이 이루어질 것으로 기대된다. 또한, 자동화 또는 반자동화된 세포 분리의 구현은 샘플 처리량을 증가시키고 더 큰 세포 집단의 단일 세포 RNA 변형 분석을 허용한다. 나노플로우 LC 분리(27)와 인터페이싱함으로써, 더 작은 세포에서도 에피전사체 마크의 특성화가 달성될 수 있을 것이다.
공개
저자들은 경쟁하는 재정적 이익이 없다고 선언합니다.
감사의 말
이 작품은 국립 약물 남용 연구소 (National Institute on Drug Abuse)가 상을 수상했습니다. P30DA018310 및 국립 인간 게놈 연구소 상 번호 아래에. RM1HG010023. K.D.C.는 Beckman Institute 박사후 펠로우십의 지원을 인정합니다. 내용은 전적으로 저자의 책임이며 반드시 자금 조달 기관의 공식 견해를 나타내는 것은 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| Animals | |||
| Aplysia californica | National Resource for Aplysia (Miami, FL) | 150–250 g (adult) | |
| Benchtop equipment | |||
| Glass capillary puller | Sutter | P-97 | |
| Milli-Q water purification system | Millipore | ||
| Minicentrifuge for PCR tubes | LW Scientific | ZS-1 | |
| Optical Microscope | Zeiss | Stemi 2000C | |
| Thermocycler | Techne | EW-93945-01 | |
| HPLC column and consumables | |||
| Acclaim RSLC 120 C18 column | Thermo Scientific | 71399 | |
| Autosampler vials | Thermo Scientific | C4011-13 | |
| LC and MS Instrumentation and Software | |||
| DataAnalysis 4.4 software | Bruker | ||
| Dionex Ultimate 3000 nanoLC | Thermo Scientific | Equipped with online degasser, autosampler, and thermostatted column compartment | |
| Impact HD UHR QqTOF mass spectrometer | Bruker | Equipped with ESI source | |
| RStudio | RStudio | ||
| Microdissection tools | |||
| Microscissors extra fine vannas 3.5” | Roboz | RS-5640 | |
| Tungsten needles | Roboz | RS-6065 | |
| Reagents/Materials | |||
| 4-(2-hydroxyethyl)-1-piperazineethane-sulfonic acid (HEPES) | Fisher Scientific | H3375 | |
| Alkaline phosphatase | Worthington Biochemical Corp. | LS004081 | |
| Ammonium acetate | Honeywell | 17836 | |
| Benzonase (endonuclease from S. marcescens) | EMD Millipore | 70746-4 | |
| Bovine serum albumin | Sigma-Aldrich | A2153 | |
| Calcium chloride | Sigma-Aldrich | C4901 | |
| Gentamycin sulfate | Fisher Scientific | G1264 | |
| Magnesium chloride | Sigma-Aldrich | M9272 | |
| Magnesium sulfate | Sigma-Aldrich | 208094 | |
| Nucleosides test mix | Sigma-Aldrich | 47310-U | |
| Penicillin G | Sigma-Aldrich | P7794 | |
| Pentostatin | Sigma-Aldrich | SML0508 | |
| Phosphodiesterase I | Worthington Biochemical Corp. | LS003926 | |
| Protease type XIV from Streptomyces griseus | Sigma-Aldrich | P5147 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| Standard glass capillaries | A-M Systems | 626000 | 1 mm o.d., 0.5 mm i.d., 4 in |
| Streptomycin sulfate | Sigma-Aldrich | S9137 |
참고문헌
- Cantara, W. A., et al. The RNA modification database, RNAMDB: 2011 update. Nucleic Acids Research. 39, 195-201 (2011).
- Boccaletto, P., et al. MODOMICS: a database of RNA modification pathways. 2017 update. Nucleic Acids Research. 46, 303-307 (2017).
- Kimura, S., Waldor, M. K. The RNA degradosome promotes tRNA quality control through clearance of hypomodified tRNA. Proceedings of the National Academy of Sciences of the United States of America. 116 (4), 1394-1403 (2019).
- Helm, M. Post-transcriptional nucleotide modification and alternative folding of RNA. Nucleic Acids Research. 34 (2), 721-733 (2006).
- Rezgui, V. A. N., et al. tRNA tKUUU, tQUUG, and tEUUC wobble position modifications fine-tune protein translation by promoting ribosome A-site binding. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12289-12294 (2013).
- Shanmugam, R., et al. Cytosine methylation of tRNA-Asp by DNMT2 has a role in translation of proteins containing poly-Asp sequences. Cell Discovery. 1 (1), 1-10 (2015).
- Jia, G., et al. N 6-Methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO. Nature Chemical Biology. 7 (12), 885-887 (2011).
- Li, X., et al. Transcriptome-wide mapping reveals reversible and dynamic N 1 -methyladenosine methylome. Nature Chemical Biology. 12 (5), 311-316 (2016).
- Krogh, N., et al. Profiling of 2′-O-Me in human rRNA reveals a subset of fractionally modified positions and provides evidence for ribosome heterogeneity. Nucleic Acids Research. 44 (16), 7884-7895 (2016).
- Babaian, A., et al. Loss of m1acp3Ψ Ribosomal RNA Modification Is a Major Feature of Cancer. Cell Reports. 31 (5), 107611 (2020).
- Chang, M., et al. Region-specific RNA m6A methylation represents a new layer of control in the gene regulatory network in the mouse brain. Open Biology. 7 (9), 170166 (2017).
- Wang, C. -. X., et al. METTL3-mediated m6A modification is required for cerebellar development. PLOS Biology. 16 (6), 2004880 (2018).
- Engel, M., et al. The role of m6A/m-RNA methylation in stress response regulation. Neuron. 99 (2), 389-403 (2018).
- Widagdo, J., et al. Experience-dependent accumulation of N6-Methyladenosine in the prefrontal cortex is associated with memory processes in mice. Journal of Neuroscience. 36 (25), 6771-6777 (2016).
- Eberwine, J., et al. Analysis of gene expression in single live neurons. Proceedings of the National Academy of Sciences of the United States of America. 89 (7), 3010-3014 (1992).
- Cong, Y., et al. Ultrasensitive single-cell proteomics workflow identifies >1000 protein groups per mammalian cell. Chemical Science. 12 (3), 1001-1006 (2021).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nature Methods. 8 (4), 20-29 (2011).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis-electrospray ionization-mass spectrometry. Analytical Chemistry. 83 (17), 6810-6817 (2011).
- Lovatt, D., et al. Transcriptome in vivo analysis (TIVA) of spatially defined single cells in live tissue. Nature Methods. 11 (2), 190-196 (2014).
- Kærn, M., Elston, T. C., Blake, W. J., Collins, J. J. Stochasticity in gene expression: from theories to phenotypes. Nature Reviews Genetics. 6 (6), 451-464 (2005).
- Chan, C. T. Y., et al. A quantitative systems approach reveals dynamic control of tRNA modifications during cellular stress. PLOS Genetics. 6 (12), 1001247 (2010).
- Sun, C., Jora, M., Solivio, B., Limbach, P. A., Addepalli, B. The effects of ultraviolet radiation on nucleoside modifications in RNA. ACS Chemical Biology. 13 (3), 567-572 (2018).
- Heiss, M., Hagelskamp, F., Marchand, V., Motorin, Y., Kellner, S. Cell culture NAIL-MS allows insight into human tRNA and rRNA modification dynamics in vivo. Nature Communications. 12 (1), 389 (2021).
- Clark, K. D., Lee, C., Gillette, R., Sweedler, J. V. Characterization of neuronal RNA modifications during non-associative learning in aplysia reveals key roles for tRNAs in behavioral sensitization. ACS Central Science. 7 (7), 1183-1190 (2021).
- Basanta-Sanchez, M., Temple, S., Ansari, S. A., D'Amico, A., Agris, P. F. Attomole quantification and global profile of RNA modifications: Epitranscriptome of human neural stem cells. Nucleic Acids Research. 44 (3), 26 (2016).
- Huang, W., et al. Determination of DNA and RNA methylation in circulating tumor cells by mass spectrometry. Analytical Chemistry. 88 (2), 1378-1384 (2016).
- Sarin, L. P., et al. Nano LC-MS using capillary columns enables accurate quantification of modified ribonucleosides at low femtomol levels. RNA. 24 (10), 1403-1417 (2018).
- Clark, K. D., Philip, M. C., Tan, Y., Sweedler, J. V. Biphasic liquid microjunction extraction for profiling neuronal RNA modifications by liquid chromatography-tandem mass spectrometry. Analytical Chemistry. 92 (18), 12647-12655 (2020).
- Clark, K. D., Rubakhin, S. S., Sweedler, J. V. Single-neuron RNA modification analysis by mass spectrometry: Characterizing RNA modification patterns and dynamics with single-cell resolution. Analytical Chemistry. 93 (43), 14537-14544 (2021).
- Guise, O. L., Ahner, J. W., Jung, M. -. C., Goughnour, P. C., Yates, J. T. Reproducible electrochemical etching of tungsten probe tips. Nano Letters. 2 (3), 191-193 (2002).
- Peng, W., Wu, Z., Song, K., Zhang, S., Li, Y., Xu, M. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science. 369 (6508), (2020).
- Rayport, S. G., Ambron, R. T., Babiarz, J. Identified cholinergic neurons R2 and LPl1 control mucus release in Aplysia. Journal of Neurophysiology. 49 (4), 864-876 (1983).
- Rosen, S. C., Weiss, K. R., Goldstein, R. S., Kupfermann, I. The role of a modulatory neuron in feeding and satiation in Aplysia: effects of lesioning of the serotonergic metacerebral cells. Journal of Neuroscience. 9 (5), 1562-1578 (1989).
- Lloyd, P. E., Kupfermann, I., Weiss, K. R. Central peptidergic neurons regulate gut motility in Aplysia. Journal of Neurophysiology. 59 (5), 1613-1626 (1988).
- Crain, P. F. Preparation and enzymatic hydrolysis of DNA and RNA for mass spectrometry. Methods in Enzymology. 193, 782-790 (1990).
- Kadakkuzha, B. M., et al. Age-associated bidirectional modulation of gene expression in single identified R15 neuron of Aplysia. BMC Genomics. 14 (1), 880 (2013).
- Akhmedov, K., Kadakkuzha, B. M., Puthanveettil, S. V. Aplysia ganglia preparation for electrophysiological and molecular analyses of single neurons. Journal of Visualized Experiments: JoVE. (83), e51075 (2014).
- Tardu, M., Jones, J. D., Kennedy, R. T., Lin, Q., Koutmou, K. S. Identification and quantification of modified nucleosides in saccharomyces cerevisiae mRNAs. ACS Chemical Biology. 14 (7), 1403-1409 (2019).
- Heiss, M., Reichle, V. F., Kellner, S. Observing the fate of tRNA and its modifications by nucleic acid isotope labeling mass spectrometry: NAIL-MS. RNA Biology. 14 (9), 1260-1268 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유