Method Article
質量分析法を用いた単一ニューロンにおけるRNA修飾の特性評価
要約
RNAの転写後修飾は、最近中枢神経系の可塑性に関連している翻訳調節の未研究の層を表す。ここで、試料調製および液体クロマトグラフィータンデム質量分析アプローチは、単一のニューロンにおける多数のRNA修飾の同時特性評価のために説明される。
要約
RNAの転写後修飾(PTM)は、中枢神経系(CNS)における翻訳の調節に関与する研究されていないメカニズムを表す。最近の証拠は、特定のニューロンRNA修飾を学習および記憶パラダイムに結びつけている。残念なことに、これらのエピトランスクリプトーム的特徴を検出するための従来の方法は、バルク組織における非常に豊富なRNA修飾を特徴付けることしかできず、活性化された行動回路内の個々のニューロンに対して存在し得るユニークなPTMプロファイルの評価を排除する。このプロトコルでは、単一ニューロン中の多数の修飾リボヌクレオシドを同時に検出および定量するためのアプローチ(質量分析(SNRMA-MS)による単一ニューロンRNA修飾分析)が説明されています。このアプローチは、海洋軟体動物 Aplysia californicaの個々のニューロンを用いて検証され、外科的単離およびニューロン細胞体を露出させるための主要なCNS神経節の酵素的処置から始まり、続いて鋭利な針およびマイクロピペットを用いた手動単一ニューロン単離が行われる。次に、少量の緩衝液中でのサンプルの機械的および熱処理が行われ、その後のRNA消化のために個々の細胞からRNAが遊離する。修飾ヌクレオシドは、次いで、最適化された液体クロマトグラフィー質量分析法を用いて同定および定量される。SNRMA-MSは、既知の形態および機能を有する A. californica から同定された単一のニューロンのRNA修飾パターンを確立するために使用される。定性的および定量的SNRMA−MSの例が提示され、ニューロンネットワークにおける個々のニューロンにわたるRNA修飾の不均一な分布を強調する。
概要
RNAの正準ヌクレオシドの修飾は、タンパク質翻訳の調節における無数の役割のためにますます認識されている。メチル化、ヘテロ原子付加から細胞代謝産物とのコンジュゲーションまで、複雑性の範囲の150以上のユニークなRNA修飾が現在までに報告されている1,2。エピトランスクリプトームとしても知られるこの拡張RNAアルファベットは、酵素ライターによって生成され、細胞RNAの安定性3、フォールディング4、および翻訳効率5,6を変化させる責任があります。選択されたRNA修飾はまた、酵素消しゴム7,8を介して逆転され得るが、他のものは、化学量論的にRNAに付加され9,10、生物学的系における修飾および非修飾RNA配列の複雑なランドスケープをレンダリングする。
生物学的機能におけるRNA修飾の重要性は、中枢神経系(CNS)のサブ領域を含む異なる器官および組織にわたる修飾の不均等な分布によって示される11。この化学的不均一性は、CNS発生12、応力応答13、および活性依存性可塑性14に関連している。CNSサブ領域はさらに、個々の細胞が別個の化学的プロファイルを示す細胞の不均一な集団を含む15、16、17、18。同じタイプの単一細胞であっても、部分的には組織微小環境19および確率的遺伝子発現20に起因する、ユニークなトランスクリプトームを示し得る。しかしながら、単一細胞トランスクリプトームの特性評価は幾分日常的であるが、複数のRNA修飾のために単一細胞エピトランスクリプトームを樹立するための類似の方法は存在しない。個々の細胞におけるRNA修飾の分布をプロファイリングすることができる新しいアプローチは、CNSおよび他の生物学的系における転写後修飾(PTM)の細胞不均一性および調節的影響の包括的な分析のために必要とされる。
バルク細胞/組織における多数のRNA修飾の同時測定は、液体クロマトグラフィータンデム質量分析(LC-MS/MS)技術を使用して容易に達成されます。修飾リボヌクレオシドのLC-MS/MS分析では、RNAを細胞(典型的には103~106細胞)から抽出し、沈殿および再懸濁によって精製し、続いてヌクレオシドに消化する。次いで、正準ヌクレオシドおよび修飾ヌクレオシドからなるサンプル混合物をLC−MSシステムに注入して分析物の分離および検出を行い、生物におけるRNA修飾の完全な補体の決定をもたらす21、22、23。LC-MS/MSは最近、神経生物学的モデルであるAplysia californica(A. californica)のCNSにおける26のRNA修飾を決定するために使用された。これらのエピトランスクリプトームマークのいくつかの豊富さは、動物における行動変化と相関する時間的および地域依存的なダイナミクスを示した24。しかしながら、この方法の感度が限られているため、>103細胞を含むバルクサンプルにおいてRNA修飾を検出することしかできなかった。これらのより大きなサンプルは、集団平均を持つ個々の細胞のユニークで機能的に重要なRNA修飾プロファイルを隠していた可能性が高い。サンプル調製条件の慎重な制御により、少量サンプル25、26、27、28におけるRNA修飾の検出限界が向上しましたが、単一細胞中の複数の修飾リボヌクレオシドを検出および定量できる分析方法の必要性が残っています。
このプロトコルは、質量分析(SNRMA-MS)による単一ニューロンRNA修飾分析を導入し、 A. californica29のCNSからの単一ニューロンにおける1ダース以上のRNA修飾の検出を可能にする。このアプローチは、主要なCNS神経節から同定された単一の細胞の外科的単離と、その後、機械的細胞溶解、RNA変性、およびMS適合性緩衝液中での酵素加水分解を含む最適化されたサンプル調製ワークフローからなる。SNRMA-MSは、単一ニューロンの転写後RNA修飾プロファイルの取得を容易にすることにより、RNA修飾分析の分野における満たされていないニーズを満たし、他の細胞型への将来の応用の可能性を秘めています。
プロトコル
1. 材料および溶液の調製
- 厳格な精製システムから得られた水中に、460 mM NaCl、10 mM KCl、10 mM CaCl2、22 mM MgCl2、26 mM MgSO4、および 10 mM HEPESを含む人工海水(ASW)を調製する。1 M NaOH または HCl を使用して pH を 7.8 に調整します。通常、1 L の ASW を準備し、使用時まで 14 °C で保存します。
- 10,000 U/mLのペニシリンG、10 μg/μLのストレプトマイシン、および10 μg/μLのゲンタマイシンを含むASW抗生物質溶液を調製し、-20°Cで保存する。 実験の直前に、凍結抗生物質原液を20〜40mLのASW中で1:100に解凍および希釈する。作動ASW溶液中の抗生物質の最終濃度は、100U/mLのペニシリンG、100μg/mLのストレプトマイシン、および100μg/mLのゲンタマイシンである。
- 1 サンプルあたり 10 μg/μL のウシ血清アルブミン、0.5 μL の 0.5 μg/μL のペントスタチン、0.495 μL の 2 U/μL アルカリホスファターゼ、1 μL の 0.1 U ホスホジエステラーゼ I (10 mM MgCl 2 中)、およびセラチア マルセッセンス (25 U) 由来のエンドヌクレアーゼ 0.38 μL を組み合わせて RNA 消化バッファーを調製します。複数のサンプルを分析する場合は、各試薬の体積に分析するサンプル数を掛け、ピペット移送ステップからの付随的な試薬損失を考慮して、さらに1つを加えた別のチューブにマスターミックスを準備します。
- ニューロンを手動で分離するために、いくつかの鋭い針(ガラスまたは金属のいずれか)を準備します。30 のようにタングステン線の電気化学的エッチングによって社内で金属針を作るか、それらを購入してください。マイクロピペットプーラーを使用して、厚い壁または標準的な壁のホウケイ酸ガラス毛細血管(外径1mm)からガラス針を調製する。本方法では、針先の直径を1~5μm、ネック長を100~150μmに保ちます。
注:金属針とガラス針の両方の製造は、研究者の個々のニーズと調査中の特定の生物学的モデルに合ったツールを製造するように最適化することができます。
2. 単一ニューロンの単離
- 0.33 M MgCl2溶液 を14°Cに冷却する。 50mLシリンジを用いて、MgCl2溶液を動物の体腔に注入することによって A. californica (150〜250g )を麻酔する。最良の結果は、溶液容量(mL)対動物の体重(g)の1:3の比で得られる。動物がリラックスするまで約3分間待って、触覚刺激に反応して身体の収縮が現れないようにします。
- 動物の腹側(足側)を解剖トレイの上に置きます。1つの鈍い先端を動物に向けて配置した外科用はさみを使用して動物を解剖し、慎重に足を縦方向に切り込みます。
- 動物の体の吻側、尾側、および側方をピン留めして、体腔内にある内臓およびCNS神経節を露出させる。神経および神経節に由来するいくつかの結合器を外科的に切断することによって、動物から主要なCNS神経節を単離する。
- 神経節を ストレプトマイセス・グリセウス 由来のプロテアーゼXIV型溶液(ASW抗生物質溶液で10mg/mL)に浸漬し、34°Cで30分または1時間(大脳神経節の場合)インキュベートする。
注:孵卵の期間は、季節、動物の大きさおよび状態、ならびに標的ニューロンに依存する。一部のニューロンの単離は、他のニューロンよりも長いインキュベーションを必要とし、実験的に決定されるべきである。 - ASW抗生物質溶液で神経節6xをすすぎ、約5mmの開口部に切断されたポリプロピレン転写ピペットを使用して、ASW抗生物質溶液で満たされたシリコーンポリマーコーティング皿にすべての神経節を移す。ASW中の1mg/mLのウシ血清アルブミンでピペットを処理し、ピペットへの神経節の固着を最小限に抑えます(オプション)。神経節は常にASWに沈めてください。
注:酵素処理は、ニューロンおよび周囲の結合組織の機械的安定性を低下させ、その結果、神経節転移中の空気への曝露によりニューロン膜が損傷する可能性がある。 - 神経節をピン留めし、マイクロハサミと細かい鉗子を使って神経節の鞘を取り除きます。十分に強い酵素処理で、脱剥離のためにガラスまたは金属針を使用してください。
- 目的の A.カリフォルニカ ニューロンを視覚的に識別する。この研究では、腹部神経節のR2、胸膜神経節のLPl1、大脳神経節の中大脳細胞(MCC)、頬神経節のB2細胞の細胞を調べた。校正された顕微鏡を用いて、すべての神経および神経節調製物の光学画像を20倍の全倍率で撮影し、各細胞型のサイズおよび体積を決定する。
- 引っ張られたガラス毛細血管または鋭いタングステン針を使用して、同定された細胞をバルク神経節から慎重に隔離する。
- プラスチックマイクロピペットに少量(1 μL)のASWを引き出し、単離した細胞を4 μLの0.365 M酢酸アンモニウム(pH 9.2)を含むPCRサンプルチューブに移します。ブランク測定の場合は、神経節を含むディッシュからASW抗生物質溶液の5μLアリコートを収集し、消化バッファー(後述)と混合します。
3. SNRMA-MSのための細胞溶解とRNA消化
- 吸引を繰り返し、0.365 M酢酸アンモニウム中のマイクロピペット(〜100 μm内径)で分配することによって、単離されたニューロンを溶解する。いくつかの小さな細胞はすぐに破裂しないかもしれません。それらを溶解するには、引っ張ったガラス毛細管でセルの直径全体に圧力をかけます。
- サーマルサイクラーを使用して、次の温度プログラムでサンプルを加熱します:95°Cで3分間、10°Cで3分間保持します。 サンプルチューブをサーマルサイクラーから取り外します。
- 各サンプルに3.375 μLのRNA消化バッファーを加え、溶液を数回抜き取って分注することによって、マイクロピペットを使用して溶液を混合する。2700 x g のミニチュアベンチトップ遠心分離機を 30 秒間使用して、PCR チューブの壁に付着している液滴をスピンダウンします。
- サンプルをサーマルサイクラーで37°Cで3時間インキュベートし、続いて10°Cで保持した(加熱蓋をONに設定)。サンプルを 10 °C に冷却した直後に、オートサンプラーチューブ内の気泡形成を避けるように注意しながら、7 μL の溶液を 250 μL のインサートを備えたオートサンプラーバイアルに移します。
4. 液体クロマトグラフィー-タンデム質量分析
メモ:エレクトロスプレーイオン化源と6ポートダイバータバルブを備えたLC-MS/MSシステムを使用して、シングルニューロンダイジェストと本物の修正ヌクレオシド規格を分析します。
- 正準ヌクレオシドと修飾ヌクレオシドを分離するための LC システムを調製するには、C18 カラム (150 mm x 2.1 mm、粒子径 2.2 μm、細孔径 120 Å) を 99% 移動相 A (5 mM 酢酸アンモニウム、pH 5.6) および 1% 移動相 B (60/40 移動相 A/アセトニトリル (ACN)) で 0.2 mL/分の流速で 36 °C で 12 分間平衡化します。 移動相の調製にはLC-MSグレードの溶媒を使用してください。
- LCが平衡化している間に、50/50 ACN/水中の酢酸ナトリウム1 mM溶液を5 μL/minの流量のシリンジポンプ を介して 質量分析計に導入して質量分析計を校正する。校正後、LCフローを質量分析計に再接続します。
- 次の線形勾配パラメータをプログラムする:0〜5分間の1%B、9分間の5%B、11分間の7%B、13分間の10%B、32分間の15%B、38分間の40%B、43分間の50%B、50分間の100%B、60分間の100%B、61分間の1%B、 次の注射の前に1%Bで12分間再平衡化した。
- キャピラリー電圧を4,500 V、乾燥温度275 °C、N2 乾燥ガス5 L/min、噴霧ガス1バールのパラメータでMS機器をポジティブモードで操作します。ダイバータバルブを解析の最初の 2 分間は廃棄し、残りの実行はソースに設定します。
- 110-600の m / z 範囲にわたって質量スペクトルを収集します。データベース2 を使用して構築された好ましい質量リストと±0.5の単離ウィンドウを使用して、3秒のサイクルタイムにわたって35〜40eVで衝突誘発解離するイオンを選択する。アクティブ排除を使用して、3 つのスペクトル後のフラグメンテーションからイオンを除外します。
- ダイナミックMS/MSスペクトル取得は、それぞれ4 Hzおよび1 Hzで50,000カウント以上および50,000カウント未満の強度を持つイオンについて、イオン選択の最小しきい値を1,990カウントに設定します。
- 定量的SNRMA-MSの場合、未知の内因性分析物濃度の補間を可能にするために、最小5濃度の修飾ヌクレオシド標準について得られた抽出イオンクロマトグラム(EIC)ピーク面積を使用して検量線を構築する。
注:体重が150〜250gの動物から得られたニューロンは、通常、0.02pmol〜2pmolの範囲の修飾ヌクレオシドの検量線を必要としますが、これらの値は機器の感度によって異なる場合があります。
5. データ解析
- 修飾ヌクレオシドのEIC(データベース値2からm / z)を生成します。推定修飾ヌクレオシドの同一性を検証するには、MS2スペクトルおよびLC保持特性をデータベース値2と比較します。A. californicaの単一ニューロンで検出された典型的なRNA修飾のリストについては、表1を参照されたい。
- 修飾ヌクレオシドと正準ヌクレオシドに対応するピークを手動で統合し、これらの値をスプレッドシートに記録します。各修飾ヌクレオシドのピーク面積を、サンプルで検出された正準シチジン、ウリジン、およびグアノシンのピーク面積の合計で正規化します。
注:アデノシンは、動的神経調節因子31としてのCNSにおけるその役割のために正規化には含まれない。 - 各単一ニューロンサンプルと、信号対雑音比>10を示した修飾ヌクレオシドの対応する正規化ピーク面積からなるデータ行列を構築する。主成分分析(PCA)を実行し、スコアプロットに最初の2つの主成分を表示します。ヌクレオシド標準物質の段階希釈から得られたEICピーク面積から線形検量線を作成し、検出された分析物の濃度を計算する。
結果
SNRMA-MSでは、同定されたニューロンを、溶解、消化、およびLC-MS/MS分析のために少量のサンプルに手動で単離します(図1A)。このワークフローは、A. californicaのCNSからの単一ニューロンにおける1ダース以上のRNA修飾を日常的に検出し(図1B)、単一細胞におけるこの動物の既知のエピトランスクリプトーム24のほぼ半分のカバレッジを表す。例えば、LPl1ニューロン(直径約500μm)をSNRMA−MSに供すると、15個の±1個のRNA修飾(n=3)が検出された。修飾ヌクレオシドは、データベース2に提供された値と比較したLC保持特性、正確な質量、およびMS2フラグメンテーションプロファイルの3つの属性に基づいて積極的に同定された。表1は、LPl1ニューロンにおいて検出された全てのRNA修飾のリストを示す。これらの実験に使用した高分解能四重極飛行時間型質量分析計は、4ppmの質量精度と、修飾ヌクレオシドN6,6-ジメチルアデノシンのm/z 164での特徴的なMS2フラグメントイオンの検出を可能にしました(m66A、図1B)。データベースに寄託された所見(m66AはN6-メチルアデノシン(m6A)の後に溶出する)と一致するLC分離データと組み合わせると、SNRMA−MSアプローチは修飾ヌクレオシド同一性の正しい割り当てを実証した。
SNRMA-MSプラットフォームは、単一ニューロンのRNA修飾プロファイルを確立し、バルク組織との関係を調査するために活用することができます。R2ニューロンは、腹部神経節に存在する大きな(直径約500μmの)コリン作動性細胞である。SNRMA-MSを用いて、R2ニューロンおよび周囲のバルク腹部神経節におけるRNA修飾を分析した(図2A)。各ニューロン/神経節サンプル(n = 7)におけるRNA修飾の正規化されたピーク面積をPCAの入力として使用し、R2ニューロンがそれらが存在する神経節と比較して明確なRNA修飾プロファイルを示すことを明らかにした(図2B)。これは、PCAスコアプロットの異なる領域を占めるR2ニューロンおよび腹部神経節のデータポイントによって証明される。さらに、ユニークな改変ヌクレオシドパターンの支持が、単一ニューロンおよびバルク組織の両方で一般的に検出された13個のRNA修飾についてペアワイズ比較が行われた動物の別個のコホート(n = 7)から得られた(図2C)。2つの修飾ヌクレオシド、プソイドウリジン(Ψ)および2'-O-メチルグアノシン(Gm)は、R2ニューロンと比較して腹部神経節において有意に高い存在量であった。示されたR2ニューロン-神経節対を有するRNA修飾のサブセットを見るとき、すべての腹部神経節はより高いレベルのΨおよびGmを示し、R2ニューロンの1つを除くすべては、対応する神経節よりも2'-O-メチルアデノシン(Am)の存在量が高かった(図2D)。全体として、SNRMA-MSの結果は、単一細胞のRNA修飾プロファイルが同じ組織内のバルク細胞から発散し得ることを初めて明らかにした。
SNRMA-MSを使用してモデル動物 A. californica を調査することは、同定された機能的に異なるニューロンにおけるRNA修飾プロファイルを特徴付けるユニークな機会を提供する。RNA修飾は、R2およびLPl1(相同で、防御的粘液放出に関与するコリン作動性細胞)32、MCC(摂食に関与するセロトニン作動性調節ニューロン)33、およびB2細胞(腸運動性に関与するペプチド作動性ニューロン)34の4つの同定された細胞においてSNRMA-MSによって評価された。これらの同定されたニューロンにおける6つのRNA修飾のPCAは、酵素処理の直後に単離されるか、または神経節調製物中で48時間培養され、単一細胞エピトランスクリプトームの安定性および動態を実証した。機能的に異なる細胞におけるRNA修飾は、相同なR2/LPl1ニューロンが共クラスター化している間に、スコアプロットにおいて固有のクラスターを形成した(図3A)。負荷プロットは、差異が主に2'-O-メチルアデノシン(Am)およびN1-メチルアデノシン(m1A)を含むメチルアデノシンの位置異性体の存在によって駆動されたことを示している(図3B)。同じ分析において、新たに単離された細胞と、その場で(すなわち 、 それらのそれぞれの神経節において)48時間培養された細胞との比較が行われた。PCAスコアプロットに示されているように、機能的に異なる細胞は、それらのRNA修飾プロファイルによって区別可能なままであった。
定量的SNRMA-MSは、真正な標準物質が利用可能な選択されたRNA修飾の絶対量を決定するために使用することができる。m1A、Ψ、2'-O-メチルシチジン(Cm)、Am、およびm6Aについて外部検量線を作成し、MCCおよびR2/LPl1細胞対における各修飾ヌクレオシドの量を補間によって決定した(図4A-E)。2対の対称MCCにおけるm1AおよびΨの細胞内量は類似しているように見えたが、これらの修飾量のより大きな差異は3対のR2/LPl1細胞で観察された。研究した細胞の物理的サイズによる違いを説明するために、RNA修飾量は、細胞直径の光学的測定から計算された細胞体積によって標準化され、修飾ヌクレオシドの細胞内濃度を得た。CmおよびAmの細胞内濃度に有意差がMCCとR2/LPl1ニューロンの間で観察された。全体として、SNRMA-MSは、単一ニューロンにおけるRNA修飾の定性的および定量的プロファイリングの両方を可能にする。
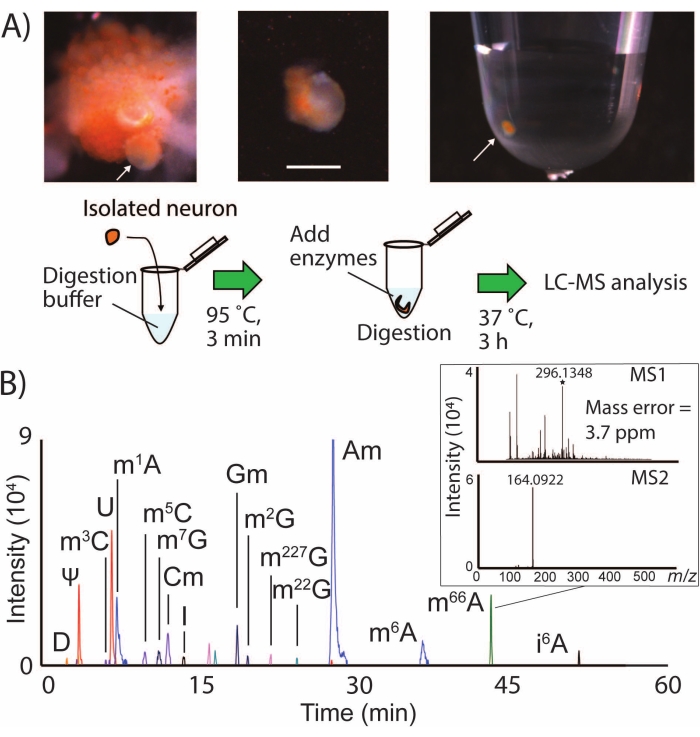
図1:SNRMA-MSワークフローとLC-MS/MSによる単一ニューロンにおける複数のRNA修飾の検出(A)サンプル管への脱鞘結膜頬神経節および単一ニューロン単離の写真。スケールバー=200μm、矢印は同定されたB1細胞を示す。LC-MS/MS分析のためのサンプル調製手順の図も示されています。(b)単一のLPl1ニューロンにおけるRNA修飾のための重ね合わせたEICsを、N6、N6−ジメチルアデノシン(m66A)についてのMS1およびMS2スペクトルを示す挿入図と共に示す。修飾ヌクレオシドのEICを生成するために使用されるm/z値については、表1を参照してください。この数値は29から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
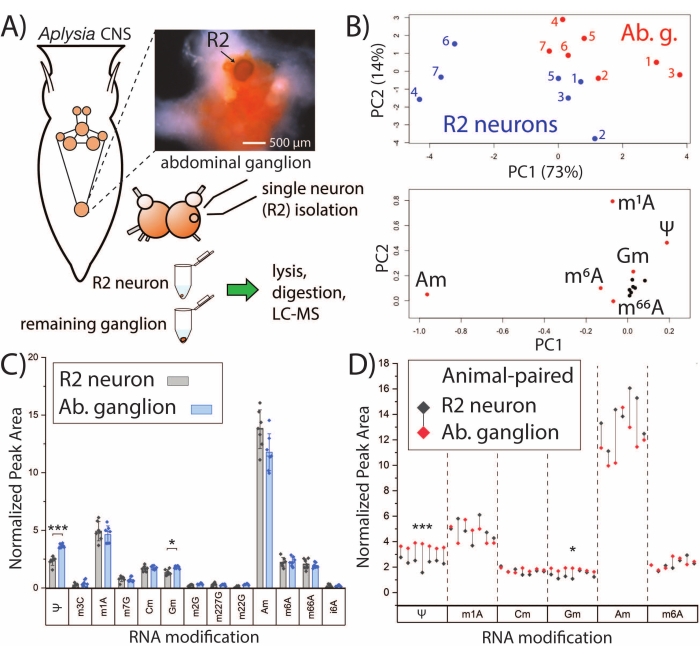
図2:SNRMA-MSは、単一ニューロンおよびバルク組織のRNA修飾プロファイルを区別する。 (A) A. californica CNSの概略図およびR2ニューロンおよび周囲の腹部神経節を分析するためのワークフロー。写真は腹部神経節とR2ニューロン(視認性のためにファストグリーン染料を注入)を示しています。(B)13個のRNA修飾からの相対ピーク面積を使用して、PCAスコア(上)およびローディング(下)プロットを生成した。(c)腹部神経節およびR2ニューロンにおけるRNA修飾のペアワイズ比較。エラーバーは、±1標準偏差(SD)、*p<0.05、***p<5 x 10−4、ボンフェローニ−ホルム補正による対応のあるt検定を表します。(d)パネルCから選択されたRNA修飾の比較で、各動物のR2-腹部神経節対をドロップラインで示す。この数値は29から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
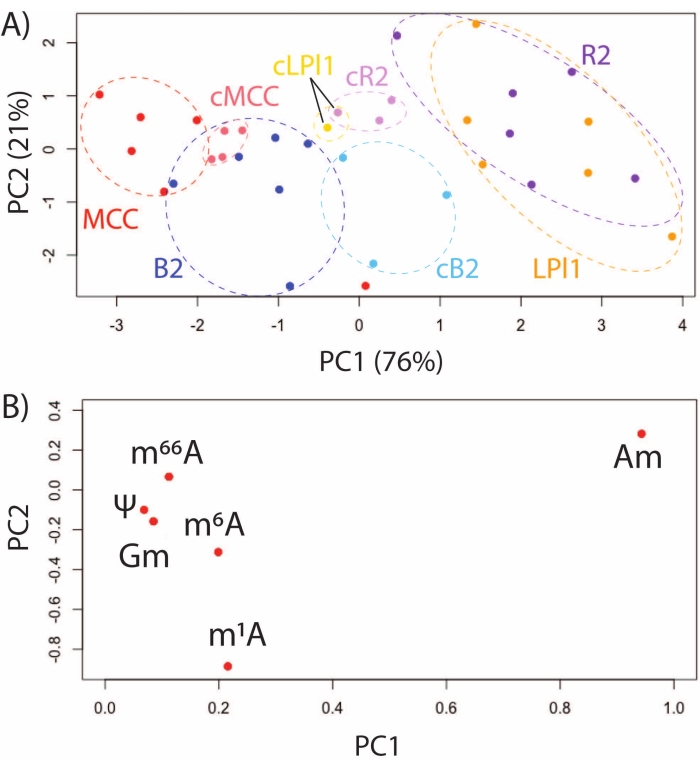
(A)MCCのPCAスコアプロット、および新たに単離または単離されたB2、R2、およびLPl1細胞の48時間のin situ培養(cMCC、cB2、cR2、cLPl1と表記される)、および(B)これらの細胞で一般的に検出される6つのRNA修飾についてのローディングプロット。この数値は29から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
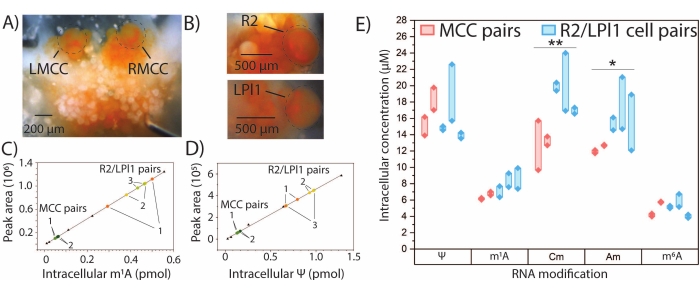
図4:A.カリフォルニカニューロンにおける定量的SNRMA-MS。定量的SNRMA-MSは、単一の同定されたA.カリフォルニカニューロンにおけるいくつかの修飾ヌクレオシドの絶対量および細胞内濃度を提供する。(A)大脳神経節の左右のMCC(それぞれLMCCとRMCC)、腹部神経節のR2、胸膜神経節のLPl1の写真。セルは、視認性を高めるために丸で囲まれています。単一細胞(色付きドット)における修飾ヌクレオシド量の補間に使用される(C)m1Aおよび(D)Ψ(三角形)の線形較正プロット。各動物由来の細胞対は、1〜3と標識される。(E)MCCおよびR2/LPl1細胞対における5つの修飾ヌクレオシドの細胞内濃度。太い線はセルのペアを接続します。*p < 0.05、**p < 0.005、ボンフェローニ−ホルム補正による対応のあるt検定、MCCについてはn = 2匹(合計4細胞)、R2/LPl1についてはn = 3匹(合計6細胞)。この数値は29から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
| RNA修飾 | 略称 | 溶出順序 (C18) | EICのm/z | MS2 の m/z |
| ジヒドロウリジン | D | 1 | 247.09 | 115 |
| プソイドウリジン | Y | 2 | 245.08 | 209/179/155 |
| 3-メチルシチジン | m3C | 3 | 258.11 | 126 |
| N1-メチルアデノシン | m1A | 4 | 282.12 | 150 |
| 5-メチルシチジン | m5C | 5 | 258.11 | 126 |
| N7-メチルグアノシン | m7G | 6 | 298.12 | 166 |
| 2'-O-メチルシチジン | センチメートル | 7 | 258.11 | 112 |
| イノシン | I6A | 8 | 269.09 | 137 |
| 2'-O-メチルグアノシン | ティッカー | 9 | 298.12 | 152 |
| N2-メチルグアノシン | m2G | 10 | 298.12 | 166 |
| N2,N2,N7-トリメチルグアノシン | m227G | 11 | 326.15 | 194 |
| N2,N2,-ジメチルグアノシン | m22G | 12 | 312.13 | 180 |
| 2'-O-メチルアデノシン | 午前 | 13 | 282.12 | 136 |
| N6-メチルアデノシン | m6A | 14 | 282.12 | 150 |
| N6,N6-ジメチルアデノシン | m66A | 15 | 296.14 | 164 |
| N6-イソペンテニルアデノシン | i6A | 16 | 336.17 | 204/136/148 |
表1: A. californica由来の単一ニューロンで検出されたRNA修飾。 修飾ヌクレオシドの特性評価のための属性は、LC保持順序、EICを生成するための m / z 、および対応するCID断片を含む提供される。
ディスカッション
SNRMA-MSは、最適化されたサンプル調製アプローチを活用し、LC-MSプラットフォームに送達できるMS互換の小さなサンプル量をもたらします。CNS神経節の初期酵素的前処理は、それらが脱鞘され得る容易さと単離中の単一ニューロンの耐久性の両方を決定する。大脳神経節は、頬側、胸膜、および腹側神経節と比較して比較的厚い鞘のために、しばしば延長酵素処理を必要とする。単一のニューロン単離を行う個々の研究者は、マイクロハサミおよび微細な鉗子を使用する場合のシースの耐久性について異なる好みを有する可能性がある。しかし、神経節が過剰消化されないことは、その構造的完全性の喪失、標的細胞の同定に重要な位置情報の喪失、および/または細胞溶解につながる可能性があるためである。神経節からの単離に続いて、ニューロンをサンプル管に移す際に、最小量の単離媒体が吸引されるようにすることが重要です。ASW培地には、RNA加水分解中に消化酵素を妨害する可能性のある高濃度の塩が含まれており、サンプルも希釈されます。
機械的溶解工程では、大きなニューロン(直径>250μm)がマイクロピペットを繰り返し通過すると破裂するのが一般的です。より小さなニューロンは、細胞溶解を確実にするためにさらなる注意を必要とする場合があり、これは典型的には、ガラス毛細血管を細胞に押し付けることを含む。この場合、毛細管力のためにサンプルバッファーの部分的な体積がキャピラリーに引き込まれる可能性があります。この体積は、ガラスキャピラリーの端部に圧力を加えることによってサンプルチューブに戻して、サンプルが失われないようにすることができます。
最良の結果は、RNA消化のために酵素を添加する前に加熱工程を含むことによって得られる。これは、95°Cでの加熱がRNA二次構造を変性させ、RNases35 の活性を妨げ、RNA生体高分子から放出されるヌクレオシドの量を減少させるためである可能性が高い。安定同位体標識メチオニンでスパイクされたサンプルを用いた対照実験は、熱誘発性RNA修飾アーチファクトが、非熱SNRMA-MSプロトコル29と比較してRNA修飾について観察されるピーク面積の増加の原因であるかどうかを調査するために以前に実施された。このような標識は観察されず、最適化されたSNRMA-MS法を用いたRNA修飾のシグナルの改善は、RNAの優れた消化によるものであったことが示された。
細胞から全RNAを単離するための従来の方法は、フェノール - クロロホルムによる液液抽出(LLE)およびその後のRNA沈殿、洗浄、および再懸濁を含む。これらのアプローチは、同定されたA. californicaニューロン36,37において選択された遺伝子の発現を容易にモニターすることができる逆転写ポリメラーゼ連鎖反応実験に有用であることが証明されている。しかしながら、LLE法は、LC−MSによる修飾リボヌクレオシドの検出に十分なRNAを回収することができないが、本明細書に記載のSNRMA−MS法は、多数のRNA修飾の検出を可能にする29。バルク組織/細胞サンプル中の特定のRNAタイプ(例えば、rRNA、tRNA、mRNA)の修飾プロファイルを評価するために、陰イオン交換固相抽出24、ハイブリダイゼーションプローブベースの濃縮38、およびクロマトグラフィー分画39のアプローチが適用されているが、単一細胞RNA精製にはまだ同様の方法が利用できない。単一細胞から特定のRNAタイプを単離することができるRNA分画アプローチの開発は、RNA修飾の機能に関するさらなる洞察を提供するであろう。
SNRMA-MSは 、A. californica の単一ニューロンのRNA修飾ランドスケープにおける以前は特徴づけられていなかった不均一性を明らかにし、哺乳動物細胞全体にも同様に異なるPTMプロファイルが存在することが考えられる。哺乳類細胞は、このプロトコールで分析された大きな A. californica ニューロンと比較して比較的小さいため、検出限界を下げるためには、少量のサンプルの取り扱いの改善が必要です。現在、SNRMA-MSは5μL程度にとどまっていますが、マイクロ流体液体処理装置をワークフローに組み込むことで大幅な改善が期待できます。さらに、自動または半自動の細胞単離を実装することで、サンプルスループットが向上し、より大きな細胞集団の単一細胞RNA修飾解析が可能になります。ナノフローLC分離27とインターフェースすることにより、さらに小さな細胞におけるエピトランスクリプトームマークの特性評価が達成可能であろう。
開示事項
著者らは、競合する金銭的利益はないと宣言している。
謝辞
この研究は、国立薬物乱用研究所から賞番号の下で資金提供されました。P30DA018310および国立ヒトゲノム研究所は、受賞番号RM1HG010023。K.D.C.は、ベックマン研究所のポスドクフェローシップからの支援を認めています。コンテンツは著者の責任であり、必ずしも資金提供機関の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Animals | |||
| Aplysia californica | National Resource for Aplysia (Miami, FL) | 150–250 g (adult) | |
| Benchtop equipment | |||
| Glass capillary puller | Sutter | P-97 | |
| Milli-Q water purification system | Millipore | ||
| Minicentrifuge for PCR tubes | LW Scientific | ZS-1 | |
| Optical Microscope | Zeiss | Stemi 2000C | |
| Thermocycler | Techne | EW-93945-01 | |
| HPLC column and consumables | |||
| Acclaim RSLC 120 C18 column | Thermo Scientific | 71399 | |
| Autosampler vials | Thermo Scientific | C4011-13 | |
| LC and MS Instrumentation and Software | |||
| DataAnalysis 4.4 software | Bruker | ||
| Dionex Ultimate 3000 nanoLC | Thermo Scientific | Equipped with online degasser, autosampler, and thermostatted column compartment | |
| Impact HD UHR QqTOF mass spectrometer | Bruker | Equipped with ESI source | |
| RStudio | RStudio | ||
| Microdissection tools | |||
| Microscissors extra fine vannas 3.5” | Roboz | RS-5640 | |
| Tungsten needles | Roboz | RS-6065 | |
| Reagents/Materials | |||
| 4-(2-hydroxyethyl)-1-piperazineethane-sulfonic acid (HEPES) | Fisher Scientific | H3375 | |
| Alkaline phosphatase | Worthington Biochemical Corp. | LS004081 | |
| Ammonium acetate | Honeywell | 17836 | |
| Benzonase (endonuclease from S. marcescens) | EMD Millipore | 70746-4 | |
| Bovine serum albumin | Sigma-Aldrich | A2153 | |
| Calcium chloride | Sigma-Aldrich | C4901 | |
| Gentamycin sulfate | Fisher Scientific | G1264 | |
| Magnesium chloride | Sigma-Aldrich | M9272 | |
| Magnesium sulfate | Sigma-Aldrich | 208094 | |
| Nucleosides test mix | Sigma-Aldrich | 47310-U | |
| Penicillin G | Sigma-Aldrich | P7794 | |
| Pentostatin | Sigma-Aldrich | SML0508 | |
| Phosphodiesterase I | Worthington Biochemical Corp. | LS003926 | |
| Protease type XIV from Streptomyces griseus | Sigma-Aldrich | P5147 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| Standard glass capillaries | A-M Systems | 626000 | 1 mm o.d., 0.5 mm i.d., 4 in |
| Streptomycin sulfate | Sigma-Aldrich | S9137 |
参考文献
- Cantara, W. A., et al. The RNA modification database, RNAMDB: 2011 update. Nucleic Acids Research. 39, 195-201 (2011).
- Boccaletto, P., et al. MODOMICS: a database of RNA modification pathways. 2017 update. Nucleic Acids Research. 46, 303-307 (2017).
- Kimura, S., Waldor, M. K. The RNA degradosome promotes tRNA quality control through clearance of hypomodified tRNA. Proceedings of the National Academy of Sciences of the United States of America. 116 (4), 1394-1403 (2019).
- Helm, M. Post-transcriptional nucleotide modification and alternative folding of RNA. Nucleic Acids Research. 34 (2), 721-733 (2006).
- Rezgui, V. A. N., et al. tRNA tKUUU, tQUUG, and tEUUC wobble position modifications fine-tune protein translation by promoting ribosome A-site binding. Proceedings of the National Academy of Sciences of the United States of America. 110 (30), 12289-12294 (2013).
- Shanmugam, R., et al. Cytosine methylation of tRNA-Asp by DNMT2 has a role in translation of proteins containing poly-Asp sequences. Cell Discovery. 1 (1), 1-10 (2015).
- Jia, G., et al. N 6-Methyladenosine in nuclear RNA is a major substrate of the obesity-associated FTO. Nature Chemical Biology. 7 (12), 885-887 (2011).
- Li, X., et al. Transcriptome-wide mapping reveals reversible and dynamic N 1 -methyladenosine methylome. Nature Chemical Biology. 12 (5), 311-316 (2016).
- Krogh, N., et al. Profiling of 2′-O-Me in human rRNA reveals a subset of fractionally modified positions and provides evidence for ribosome heterogeneity. Nucleic Acids Research. 44 (16), 7884-7895 (2016).
- Babaian, A., et al. Loss of m1acp3Ψ Ribosomal RNA Modification Is a Major Feature of Cancer. Cell Reports. 31 (5), 107611 (2020).
- Chang, M., et al. Region-specific RNA m6A methylation represents a new layer of control in the gene regulatory network in the mouse brain. Open Biology. 7 (9), 170166 (2017).
- Wang, C. -. X., et al. METTL3-mediated m6A modification is required for cerebellar development. PLOS Biology. 16 (6), 2004880 (2018).
- Engel, M., et al. The role of m6A/m-RNA methylation in stress response regulation. Neuron. 99 (2), 389-403 (2018).
- Widagdo, J., et al. Experience-dependent accumulation of N6-Methyladenosine in the prefrontal cortex is associated with memory processes in mice. Journal of Neuroscience. 36 (25), 6771-6777 (2016).
- Eberwine, J., et al. Analysis of gene expression in single live neurons. Proceedings of the National Academy of Sciences of the United States of America. 89 (7), 3010-3014 (1992).
- Cong, Y., et al. Ultrasensitive single-cell proteomics workflow identifies >1000 protein groups per mammalian cell. Chemical Science. 12 (3), 1001-1006 (2021).
- Rubakhin, S. S., Romanova, E. V., Nemes, P., Sweedler, J. V. Profiling metabolites and peptides in single cells. Nature Methods. 8 (4), 20-29 (2011).
- Nemes, P., Knolhoff, A. M., Rubakhin, S. S., Sweedler, J. V. Metabolic differentiation of neuronal phenotypes by single-cell capillary electrophoresis-electrospray ionization-mass spectrometry. Analytical Chemistry. 83 (17), 6810-6817 (2011).
- Lovatt, D., et al. Transcriptome in vivo analysis (TIVA) of spatially defined single cells in live tissue. Nature Methods. 11 (2), 190-196 (2014).
- Kærn, M., Elston, T. C., Blake, W. J., Collins, J. J. Stochasticity in gene expression: from theories to phenotypes. Nature Reviews Genetics. 6 (6), 451-464 (2005).
- Chan, C. T. Y., et al. A quantitative systems approach reveals dynamic control of tRNA modifications during cellular stress. PLOS Genetics. 6 (12), 1001247 (2010).
- Sun, C., Jora, M., Solivio, B., Limbach, P. A., Addepalli, B. The effects of ultraviolet radiation on nucleoside modifications in RNA. ACS Chemical Biology. 13 (3), 567-572 (2018).
- Heiss, M., Hagelskamp, F., Marchand, V., Motorin, Y., Kellner, S. Cell culture NAIL-MS allows insight into human tRNA and rRNA modification dynamics in vivo. Nature Communications. 12 (1), 389 (2021).
- Clark, K. D., Lee, C., Gillette, R., Sweedler, J. V. Characterization of neuronal RNA modifications during non-associative learning in aplysia reveals key roles for tRNAs in behavioral sensitization. ACS Central Science. 7 (7), 1183-1190 (2021).
- Basanta-Sanchez, M., Temple, S., Ansari, S. A., D'Amico, A., Agris, P. F. Attomole quantification and global profile of RNA modifications: Epitranscriptome of human neural stem cells. Nucleic Acids Research. 44 (3), 26 (2016).
- Huang, W., et al. Determination of DNA and RNA methylation in circulating tumor cells by mass spectrometry. Analytical Chemistry. 88 (2), 1378-1384 (2016).
- Sarin, L. P., et al. Nano LC-MS using capillary columns enables accurate quantification of modified ribonucleosides at low femtomol levels. RNA. 24 (10), 1403-1417 (2018).
- Clark, K. D., Philip, M. C., Tan, Y., Sweedler, J. V. Biphasic liquid microjunction extraction for profiling neuronal RNA modifications by liquid chromatography-tandem mass spectrometry. Analytical Chemistry. 92 (18), 12647-12655 (2020).
- Clark, K. D., Rubakhin, S. S., Sweedler, J. V. Single-neuron RNA modification analysis by mass spectrometry: Characterizing RNA modification patterns and dynamics with single-cell resolution. Analytical Chemistry. 93 (43), 14537-14544 (2021).
- Guise, O. L., Ahner, J. W., Jung, M. -. C., Goughnour, P. C., Yates, J. T. Reproducible electrochemical etching of tungsten probe tips. Nano Letters. 2 (3), 191-193 (2002).
- Peng, W., Wu, Z., Song, K., Zhang, S., Li, Y., Xu, M. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science. 369 (6508), (2020).
- Rayport, S. G., Ambron, R. T., Babiarz, J. Identified cholinergic neurons R2 and LPl1 control mucus release in Aplysia. Journal of Neurophysiology. 49 (4), 864-876 (1983).
- Rosen, S. C., Weiss, K. R., Goldstein, R. S., Kupfermann, I. The role of a modulatory neuron in feeding and satiation in Aplysia: effects of lesioning of the serotonergic metacerebral cells. Journal of Neuroscience. 9 (5), 1562-1578 (1989).
- Lloyd, P. E., Kupfermann, I., Weiss, K. R. Central peptidergic neurons regulate gut motility in Aplysia. Journal of Neurophysiology. 59 (5), 1613-1626 (1988).
- Crain, P. F. Preparation and enzymatic hydrolysis of DNA and RNA for mass spectrometry. Methods in Enzymology. 193, 782-790 (1990).
- Kadakkuzha, B. M., et al. Age-associated bidirectional modulation of gene expression in single identified R15 neuron of Aplysia. BMC Genomics. 14 (1), 880 (2013).
- Akhmedov, K., Kadakkuzha, B. M., Puthanveettil, S. V. Aplysia ganglia preparation for electrophysiological and molecular analyses of single neurons. Journal of Visualized Experiments: JoVE. (83), e51075 (2014).
- Tardu, M., Jones, J. D., Kennedy, R. T., Lin, Q., Koutmou, K. S. Identification and quantification of modified nucleosides in saccharomyces cerevisiae mRNAs. ACS Chemical Biology. 14 (7), 1403-1409 (2019).
- Heiss, M., Reichle, V. F., Kellner, S. Observing the fate of tRNA and its modifications by nucleic acid isotope labeling mass spectrometry: NAIL-MS. RNA Biology. 14 (9), 1260-1268 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved