Method Article
ריצוף גנום שלם לאפיון מהיר של נגיף הכלבת בטכנולוגיית ננופור
In This Article
Summary
כאן, אנו מציגים זרימת עבודה מהירה וחסכונית לאפיון גנומים של נגיף הכלבת (RABV) באמצעות טכנולוגיית ננו-נקבוביות. זרימת העבודה נועדה לתמוך במעקב מבוסס גנומיקה ברמה המקומית, לספק מידע על שושלות RABV מסתובבות ומיקומם בתוך פילוגניות אזוריות כדי להנחות אמצעים להדברת כלבת.
Abstract
ניתן להשתמש בנתונים גנומיים כדי לעקוב אחר העברה והתפשטות גיאוגרפית של מחלות זיהומיות. עם זאת, יכולת הריצוף הנדרשת למעקב גנומי נותרה מוגבלת במדינות רבות בעלות הכנסה נמוכה ובינונית (LMICs), שבהן כלבת בתיווך כלבים ו / או כלבת המועברות על ידי חיות בר כגון עטלפי ערפדים מציבות חששות גדולים לבריאות הציבור ולכלכלה. אנו מציגים כאן תהליך עבודה מהיר ומשתלם של דגימה לרצף לפרשנות באמצעות טכנולוגיית ננו-נקבוביות. פרוטוקולים לאיסוף דגימות ואבחון כלבת מתוארים בקצרה, ולאחר מכן פרטים על זרימת העבודה הממוטבת של ריצוף גנום שלם, כולל תכנון פריימר ואופטימיזציה עבור תגובת שרשרת פולימראז מרובת (PCR), הכנת ספריית ריצוף שונה בעלות נמוכה, ריצוף עם קריאות בסיס חיות ולא מקוונות, ייעוד שושלת גנטית וניתוח פילוגנטי. יישום זרימת העבודה מודגם, ושלבים קריטיים מודגשים לפריסה מקומית, כגון אימות צינורות, אופטימיזציה של פריימר, הכללת בקרות שליליות ושימוש בנתונים ובכלים גנומיים הזמינים לציבור (GLUE, MADDOG) לסיווג ומיקום בתוך פילוגניות אזוריות וגלובליות. זמן האספקה עבור זרימת העבודה הוא 2-3 ימים, והעלות נעה בין $25 לדגימה עבור הפעלת מדגם 96 ל- $80 לדגימה עבור ריצה של 12 מדגם. אנו מסיקים כי הגדרת מעקב גנומי אחר נגיף הכלבת ב- LMICs היא אפשרית ויכולה לתמוך בהתקדמות לקראת היעד העולמי של אפס מקרי מוות של כלבת אנושית בתיווך כלבים עד 2030, כמו גם ניטור משופר של התפשטות כלבת חיות בר. יתר על כן, ניתן להתאים את הפלטפורמה לפתוגנים אחרים, ולסייע בבניית יכולת גנומית רב-תכליתית התורמת להיערכות למגיפות ולמגפות.
Introduction
נגיף הכלבת (RABV) הוא וירוס ליסה ממשפחת Rhabdoviridae הגורם למחלה נוירולוגית קטלנית ביונקים1. למרות שכלבת ניתנת למניעה ב -100% על ידי חיסון, היא נותרה דאגה בריאותית וכלכלית מרכזית במדינות אנדמיות. מתוך 60,000 מקרי מוות מכלבת אנושית המתרחשים מדי שנה, יותר מ-95% הם באפריקה ובאסיה, שם כלבים הם המאגר העיקרי2. לעומת זאת, חיסון כלבים הוביל לחיסול הכלבת בתיווך כלבים ברחבי מערב אירופה, צפון אמריקה ורוב אמריקה הלטינית. באזורים אלה, מאגרים של כלבת מוגבלים כעת לחיות בר, כגון עטלפים, דביבונים, בואשים, וקנידים פראיים3. ברחבי אמריקה הלטינית, עטלף הערפד המצוי הוא מקור בעייתי לכלבת בשל העברה קבועה של עטלפים הן לבני אדם והן לבעלי חיים במהלך האכלת הדם הלילית4. ההשפעה הכלכלית העולמית השנתית של הכלבת מוערכת ב-8.6 מיליארד דולר, כאשר הפסדי בעלי חיים מהווים 6%5.
נתוני רצף מפתוגנים נגיפיים בשילוב עם מטא נתונים על העיתוי והמקור של זיהומים יכולים לספק תובנות אפידמיולוגיות חזקות6. עבור RABV, ריצוף שימש כדי לחקור את מקור ההתפרצויות7,8, לזהות קשרים מארחים עם חיות בר או כלבי בית 8,9,10,11,12, ולהתחקות אחר מקורות של מקרים אנושיים 13,14. חקירות התפרצות באמצעות ניתוח פילוגנטי הצביעו על כך שכלבת הופיעה במחוז נקי מכלבת לשעבר של באלי, אינדונזיה, באמצעות הקדמה אחת מהאזורים האנדמיים הסמוכים של קלימנטן או סולאווסי15. בינתיים, בפיליפינים התגלתה התפרצות באי טבלאס שבמחוז רומבלון מהאי המרכזי לוזון16. נתונים גנומיים נגיפיים שימשו גם להבנה טובה יותר של דינמיקת העברת פתוגנים הנדרשת למיקוד אמצעי בקרה גיאוגרפיים. לדוגמה, אפיון גנומי של RABV ממחיש את ההתקבצות הגיאוגרפית של קלאדים 17,18,19, תפוצה משותפת של שושלות 20,21,22, תנועה נגיפית בתיווך אנושי 17,23,24, ודינמיקה של מטא-אוכלוסייה 25,26.
ניטור מחלות הוא פונקציה חשובה אחת של מעקב גנומי ששופר עם הגידול העולמי ביכולת הריצוף בתגובה למגיפת SARS-CoV-2. מעקב גנומי תמך במעקב בזמן אמת אחר וריאנטים מדאיגים של SARS-COV-227,28 ואמצעי נגדקשורים 6. ההתקדמות בטכנולוגיית ריצוף נגישה, כגון טכנולוגיית ננו-נקבוביות, הובילה לפרוטוקולים משופרים וזולים יותר לריצוף מהיר של פתוגנים אנושיים 29,30,31,32 ובעלי חיים33,34,35. עם זאת, במדינות אנדמיות רבות לכלבת, עדיין קיימים חסמים להפעלת מעקב גנומי פתוגן, כפי שמוצג על ידי פערים גלובליים ביכולת ריצוף SARS-CoV-236. מגבלות בתשתית המעבדות, שרשראות האספקה והידע הטכני הופכות את ההקמה והרוטיניזציה של מעקב גנומי למאתגרת. במאמר זה, אנו מדגימים כיצד ניתן לפרוס זרימת עבודה אופטימלית, מהירה ומשתלמת של ריצוף גנום שלם עבור מעקב RABV בסביבות מוגבלות במשאבים.
Protocol
המחקר אושר על ידי הוועדה המתאמת למחקר רפואי של המכון הלאומי למחקר רפואי (NIMR/HQ/R.8a/vol. IX/2788), המשרד למינהל אזורי ושלטון מקומי (AB.81/288/01), ומועצת הביקורת המוסדית של מכון הבריאות Ifakara (IHI/IRB/No:22-2014) בטנזניה; המכון למחלות טרופיות ומדבקות באוניברסיטת ניירובי (P947/11/2019) ומכון המחקר הרפואי של קניה (KEMRI-SERU; פרוטוקול מס' 3268) בקניה; ומכון המחקר לרפואה טרופית (RITM), משרד הבריאות (2019-023) בפיליפינים. ריצוף דגימות שמקורן בניגריה נעשה על גבי חומר אבחון ארכיוני שנאסף כחלק ממעקב לאומי.
הערה: סעיפים 1-4 הם תנאים מוקדמים. סעיפים 5-16 מתארים את תהליך העבודה של דגימה לרצף לפרשנות עבור ריצוף ננו-נקבוביות RABV (איור 1). לשלבים הבאים בפרוטוקול הזקוקים לצנטריפוגה דופקת, צנטריפוגה ב 10-15,000 x גרם במשך 5-15 שניות.
1. הגדרת סביבה חישובית לרצף וניתוח נתונים
- פתח את אתר האינטרנט Oxford Nanopore Technology (ONT)37 וצור חשבון כדי לגשת למשאבים ספציפיים לננו-נקבוביות.
- היכנס והתקן את תוכנת רצף ONT ושיחות בסיס38.
- פתח את GitHub39 וצור חשבון.
- עבור אל המאגרים artic-rabv40 ו- MADDOG41 ופעל לפי הוראות ההתקנה.
2. עצב או עדכן את ערכת הפריימר המרובבת
הערה: סכימות RABV קיימות זמינות במאגר artic-rabv40. כאשר מתמקדים באזור גיאוגרפי חדש, יש לתכנן תוכנית חדשה, או לשנות תוכנית קיימת כדי לשלב מגוון נוסף.
- בחר קבוצת ייחוס גנומית שתייצג את המגוון באזור המחקר; זוהי בדרך כלל קבוצה של רצפים זמינים לציבור (למשל, מ- NCBI GenBank) או נתונים ראשוניים פנימיים. בצע את שלב 2.1.1 כדי להשתמש ב- RABV-GLUE42, משאב נתונים של רצף RABV, כדי לסנן ולהוריד רצפי NCBI ומטה-נתונים משויכים.
הערה: בחר רצפי ייחוס עם גנומים שלמים (כלומר, ללא רווחים ובסיסים מוסווים). מומלץ לבחור עד 10 רצפים כערכת התייחסות לעיצוב פריימר. אם נתוני הרצף הזמינים אינם שלמים או אינם מייצגים את אזור המחקר, עיין בעצה43,44,45 בקובץ משלים 1.- נווט אל הדף NCBI RABV Sequences by Clade מהתפריט הנפתח נתוני רצף ב- RABV-GLUE. לחץ על הקישור וירוס הכלבת (RABV) כדי לגשת לכל הנתונים הזמינים או לבחור קבוצה מסוימת של עניין. השתמש באפשרות המסנן כדי להוסיף מסננים המתאימים לקריטריונים הרצויים (לדוגמה, ארץ מוצא, אורך רצף). הורד רצפים ומטה-נתונים.
- צור סכימת פריימר עבור תגובת שרשרת פולימראז מרובה (PCR) בהתאם להוראות שסופקו על-ידי Primal Scheme46. ערכת 400 bp עם חפיפה של 50 bp מומלצת לרצף דגימות באיכות נמוכה. הורד ושמור את כל היציאות (אל תערוך את שמות הקבצים או הפריימרים).
הערה: הסכימה תימדד לרצף הראשון בצוואת הקלט, שתיקרא מעתה 'ייחוס המדד' (איור 2). ראה קובץ משלים 1 לקבלת אפשרויות למיטוב ביצועי פריימר.
3. הגדר צינורות RAMPART וביואינפורמטיקה ARTIC
- עיין בקובץ משלים 2 כדי להגדיר מבנה ספריות לניהול קבצי הקלט/פלט עבור RAMPART וצינור הביואינפורמטיקה של ARTIC.
4. בטיחות ביולוגית ומערך מעבדה
- טפל בדגימות שעשויות להיות חיוביות לכלבת במצבים של רמת בטיחות ביולוגית (BSL) 2 או 3.
- יש לוודא שצוות המעבדה השלים חיסון נגד כלבת לפני החשיפה ועבר מעקב אחר החסינות בהתאם להמלצות ארגון הבריאות העולמי (WHO)3.
- ודא כי נהלי הפעלה סטנדרטיים ייעודיים והערכות סיכונים, בהתאם להנחיות לאומיות או בינלאומיות, קיימים עבור המעבדה.
- הגדרת מעבדה נדרשת: מזעור הזיהום על ידי שמירה על הפרדה פיזית בין אזורים לפני ואחרי PCR. במעבדות עם שטח מוגבל או בתנאי מעבדה בשטח, השתמשו בתאי כפפות ניידים או בתחנות מעבדה מאולתרות כדי למזער את הזיהום.
- בפרוטוקול זה, הקפד לייעד אזורים נפרדים עבור:
- מיצוי דגימה: הגדר ארון BSL2/3 / תא כפפות לטיפול בחומר ביולוגי וביצוע אינאשפעציה ומיצוי RNA.
- אזור תבנית: הגדר ארון/קופסת כפפות BSL1 להוספת תבנית (RNA/cDNA) לתערובת האב לתגובה שהוכנה מראש.
- אזור מאסטר מיקס: הגדר אזור נקי ייעודי (ארון BSL1/קופסת כפפות) להכנת תערובות מאסטר ריאגנטיות. לא אמורה להיות תבנית באזור זה.
- אזור פוסט-PCR: הגדר אזור נפרד לעבודה על אמפליקונים והכנת ספריית ריצוף.
הערה: יש לנקות את כל האזורים עם מזהם פני השטח ולעקר אולטרה סגול (UV) לפני ואחרי השימוש.
5. איסוף דגימות שדה ואבחון
הערה: הדגימות חייבות להיאסף על ידי אנשי צוות מיומנים ומחוסנים הלובשים ציוד מגן אישי ופועלים בהתאם לנהלים הסטנדרטיים 47,48,49 שהוזכרו לעיל.
- לאסוף את הדגימה באמצעות foramen magnum (כלומר, המסלול העורפי), כפי שמתואר בפירוט Mauti et al.50.
- לאבחן כלבת בשטח באמצעות בדיקות אבחון מהירות ולאשר במעבדה באמצעות הליכים מומלצים47, כגון בדיקת נוגדנים פלואורסצנטיים ישירה (DFA), בדיקה אימונוהיסטוכימית מהירה ישירה (DRIT)51,52, או שעתוק לאחור בזמן אמת (RT)-PCR 53.
- השתמש בדגימות מוח חיוביות מאושרות למיצוי RNA או אחסן במקפיא ב -20 ° C למשך 2-3 חודשים או -80 ° C לתקופות ארוכות יותר. שימור RNA לאחסון ושינוע באמצעות מדיום ייצוב DNA/RNA מתאים.
6. הכנת דגימה ומיצוי RNA (3 שעות)
הערה: השתמש בערכת מיצוי RNA נגיפי מבוססת עמודת ספין המתאימה לסוג הדגימה.
- הכינו שני צינורות חרוזים קרמיים על ידי מילוי צינור PCR 2 מ"ל עם צינור כ 200 μL מלא חרוזים קרמיים 1.4 מ"מ ותייגו את הצינור.
- הוסף את הנפח המומלץ של חיץ ליזיס המסופק בערכת מיצוי ה- RNA לצינור ה- PCR המסומן.
- קבל בערך קובייה של 3 מ"מ מדגימת המוח שאושרה עם זיהום כלבת באמצעות אפליקטור עץ והכנס לצינור מסומן עם מזהה דגימה ו -100 μL של מים ללא נוקלאז לתוך הצינור המסומן בקרה שלילית.
הערה: השתמש בהומוגניזציה מבוססת חרוזים בצינור סגור כדי להגביל את החשיפה לדגימה. אם הדבר אינו אפשרי, השתמש במשבשים מכניים מתאימים אחרים (למשל, מבוססי רוטור) או במיקרו-פשט ידני. עם זאת, אלה עשויים להיות פחות יעילים מאשר מכות חרוזים על משטח קשה כדי לשבש רקמות (דגימות רקמה עשויות להתקשות באמצעי אחסון מסוימים). - לשבש את רקמת המוח באופן ידני באמצעות מקל אפליקטור עץ ולאחר מכן מערבלים במהירות מקסימלית עד הומוגניזציה מלאה של הרקמה מושגת.
- צנטריפוגו את הליזט בהתאם להוראות היצרן והשתמשו בפיפט כדי להעביר את הסופרנאטנט לצינור מיקרוצנטריפוגה חדש שכותרתו. השתמש בסופרנאטנט זה רק בשלבים הבאים.
- עקוב אחר הוראות עמודת הספין של ערכת מיצוי ה- RNA כדי לקבל RNA מטוהר.
- כלול כאן בקרת מיצוי שלילית (NEC) וקח את כל הדרך עד לשלב הריצוף.
7. הכנת cDNA (20 דקות)
- באזור תערובת האב, הכינו תערובת אב לסינתזה cDNA של גדיל ראשון בהתאם למספר הדגימות והבקרות שיש לעבד (עם נפח עודף של 10% כדי להבטיח מגיב הולם; טבלה 1). יש לכלול פקד ללא תבנית (NTC) בשלב זה.
- תווית 0.2 מ"ל PCR רצועת צינורות aliquot 5 μL של תערובת מאסטר לתוך צינורות.
- קח את הצינורות המוכנים לאזור התבנית. הוסף 5 μL של RNA לכל צינור מסומן, כולל NEC. הוסף 5 μL של מים ללא נוקלאז (NFW) ל- NTC.
- יש לדגור במחזור תרמי בהתאם לתנאים המוזכרים בטבלה 1.
הערה: נקודת השהיה אופציונלית: cDNA יכול להיות מאוחסן ב -20 ° C עד חודש אחד במידת הצורך, אבל להמשיך PCR עדיף.
8. הכנת מלאי פריימר למאגר (1 שעות)
הערה: שלב זה נחוץ רק אם מייצרים מניות חדשות מפריימרים בודדים, ולאחר מכן ניתן להשתמש בפתרונות מלאי מוכנים מראש.
- הכינו מאגר פריימר של 100 מיקרומטר באזור תערובת האב.
- השהה מחדש את הפריימרים הליופיליים במאגר 1x tris-EDTA (TE) או NFW בריכוז של 100 מיקרומטר כל אחד. מערבלים ביסודיות ומסתחררים.
הערה: בשלבים הבאים, פריימרים נפרדים מופרדים לשני מאגרי פריימרים - אי-זוגיים ממוספרים (בשם בריכה A) וזוגיים (בשם בריכה B) - כדי למנוע אינטראקציות בין פריימרים החופפים לאמפליקון. מאגרים אלה של פריימרים יוצרים אמפליקונים חופפים של 400 bp המשתרעים על פני גנום המטרה. - סדרו את כל הפריימרים הממוספרים האי-זוגיים במדף צינורות. צור מאגר פריימר על ידי הוספת 5 μL מכל פריימר לצינור מיקרוצנטריפוגה של 1.5 מ"ל שכותרתו "שם ערכת פריימר - בריכה A (100 מיקרומטר)".
- חזור על התהליך עבור כל הפריימרים הממוספרים הזוגיים ותייג כ"שם סכימת פריימר - בריכה B (100 מיקרומטר)".
- יש לדלל כל מאגר פריימר ביחס של 1:10 במים באיכות מולקולרית כדי ליצור מלאי פריימר של 10 מיקרומטר.
הערה: הכינו אליציטוטים מרובים של דילולי פריימר של 10 מיקרומטר והקפיאו אותם במקרה של השפלה או זיהום.
9. PCR מולטיפלקס (5 שעות)
- הכינו שתי תערובות מאסטר PCR, אחת לכל מאגר פריימר באזור המאסטר מיקס.
- יש להשתמש בריכוז סופי של 0.015 מיקרומטר לפריימר. חשב את נפח מאגר הפריימר הנדרש עבור תגובת PCR (טבלה 2) באמצעות הנוסחה הבאה:
נפח מאגר פריימר = מספר פריימרים x נפח תגובה x 0.015/ריכוז (μM) של מלאי פריימר
- יש להשתמש בריכוז סופי של 0.015 מיקרומטר לפריימר. חשב את נפח מאגר הפריימר הנדרש עבור תגובת PCR (טבלה 2) באמצעות הנוסחה הבאה:
- Aliquot 10 μL כל אחד של תערובת מאסטר בריכה A ותערובת מאסטר בריכה B לצינורות רצועת PCR מסומנים באזור התבנית. עבור כל דגימה, הוסף 2.5 μL של cDNA (משלב 3) לכל אחת מתגובות הפריימר המתאימות למאגר A ו- B. עודף cDNA יכול להיות מאוחסן ב -20 ° C.
- מערבבים על ידי תנועה עדינה וצנטריפוגה דופקת.
- לדגור על הדגימות בתנאים המוזכרים בטבלה 2 במכשיר PCR.
הערה: התוכנית אינה כוללת שלב הארכה ספציפי בשל זמן החישול הארוך של 5 דקות (נדרש בשל מספר הפריימרים הגבוה) והאורך הקצר של האמפליקונים (400 bp) המספיק להארכה.
10. ניקוי וכימות PCR (3.5 שעות)
- בצע את כל העבודה מנקודה זו ואילך באזור הפוסט-PCR.
- Aliquot שלב מוצק הפיך immobilization (SPRI) חרוזים לתוך צינורות microcentrifuge מן הבקבוק הראשי. יש לאחסן בטמפרטורה של 4°C.
- מחממים אליציטוט חרוזי SPRI לטמפרטורת החדר (RT; ~ 20 מעלות צלזיוס) ומערבלים היטב עד שהחרוזים מרחפים מחדש לחלוטין בתמיסה.
- בצינורות של 1.5 מ"ל, שלבו את מוצרי הפריימר Pool A והפריימר Pool B PCR עבור כל דגימה. במידת הצורך, מוסיפים מים כדי להביא את הנפח ל 25 μL.
- הוסף 25 μL של חרוזי SPRI לכל דגימה (יחס חרוז 1:1:מדגם). מערבבים על ידי פיפטציה למעלה ולמטה או הקשה עדינה על הצינור.
- יש לדגור ב-RT במשך 10 דקות, ומדי פעם להפוך או להעיף את הצינורות.
- מניחים על מדף מגנטי עד שהחרוזים והתמיסה נפרדים לחלוטין. הסר והשליך את supernatant, נזהר לא להפריע גלולת החרוז.
- יש לשטוף פעמיים עם 80% אתנול (מחומם ל-RT).
- הוסף 200 μL אתנול לכדור. המתן 30 שניות כדי לוודא שהחרוזים נשטפים כראוי.
- בזהירות להסיר ולהשליך את supernatant, מנסה לא לגעת גלולת החרוז.
- חזור על שלבים 10.8.1-10.8.2 כדי לשטוף את הגלולה פעם נוספת.
- הסר את כל עקבות האתנול באמצעות קצה 10 μL. יבש באוויר עד שעקבות אתנול התאדו (עם חרוזים קטנים זה קורה במהירות, ~ 30 שניות); כאשר זה קורה, הגלולה צריכה לעבור מבריק למאט. היזהר לא להתייבש יתר על המידה (אם הגלולה נסדקת, היא יבשה מדי), שכן זה ישפיע על התאוששות ה- DNA.
- יש להשהות מחדש את החרוזים ב-15 מיקרוליטר של NFW ולדגור ב-RT (כבוי מדף מגנטי) למשך 10 דקות.
- חזרו למדף המגנטי והעבירו את הסופרנאטנט (מוצר מנוקה) לצינור טרי בנפח 1.5 מ"ל.
- הכינו דילול של 1:10 של כל דגימה בשפופרת נפרדת (2 מיקרוליטר של מוצר + 18 מיקרוליטר של NFW).
הערה: היזהר מאוד בשלב זה כדי למנוע זיהום צולב. יש רק צינור אמפליקון אחד פתוח בכל פעם. Aliquot 18 μL של מים לתוך צינורות הראשון (באזור תערובת מאסטר נקי). - למדוד את ריכוז הדנ"א של כל דגימה מדוללת באמצעות פלואורומטר רגיש וספציפי ביותר, כמתואר protocols.io54,55.
11. נורמליזציה (30 דקות)
- השתמש בתבנית הנורמליזציה (קובץ משלים 3) ובריכוז ה- DNA (ng/μL) של כל דגימה כדי לחשב את נפח הדגימה המדוללת (או המסודרת) הנדרשת עבור 200 fmol של כל דגימה בנפח כולל של 5 μL.
- תייג צינורות PCR חדשים והוסף נפחים מחושבים של NFW ודגימה כדי לקבל DNA מנורמל.
- השתמש בנפח המחושב עבור דגימות לא מדוללות (מסודרות) אם נדרש מעל 5 μL של הדגימה המדוללת כדי לקבל 200 fmol.
הערה: נקודת השהיה אופציונלית: בשלב זה, ניתן לאחסן את מוצר ה-PCR המנקה ב-4°C למשך עד שבוע אחד או להציב אותו ב-20°C לאחסון לטווח ארוך יותר במידת הצורך.
12. הכנת קצה וברקוד (1.5 שעות)
הערה: השלבים הבאים מניחים שימוש בריאגנטים ספציפיים מערכות ברקוד וריצוף קשירה ספציפיות לננו-נקבוביות (ראה טבלת חומרים לקבלת פרטים). הפרוטוקול ניתן להעברה בין גרסאות כימיה שונות, אך על המשתמשים להקפיד להשתמש בערכות תואמות, בהתאם להוראות היצרן.
- תיקון קצה וזנב dA
- הגדר את תגובת ההכנה הסופית עבור כל מדגם המוזכר בטבלה 3. הכינו תערובת אב בהתאם למספר הדגימות (בתוספת 10% עודף). היזהר כאשר pipetting כמו ריאגנטים הם צמיגים.
- הוסף 5 μL של תערובת מאסטר לכל צינור של DNA מנורמל (5 μL). תמהיל התגובה הכולל צריך להיות 10 μL. שנה את הקצוות בכל פעם ורק צינור אחד פתוח בכל פעם.
- דגירה במחזור תרמי בתנאים הנזכרים בטבלה 3.
- ברקוד
- Aliquot את הברקודים מערכת ברקוד לצינורות רצועת PCR ב 1.25 μL / צינור, ולהקליט ברקוד שהוקצה לכל דגימה.
- הוסף 0.75 μL של הדגימה שהוכנה בסוף ל- aliquot הברקוד שהוקצה לה.
- הכינו תערובת מאסטר קשירה לפי מספר הדגימות (בתוספת 10% עודף) (טבלה 4).
- הוסף 8 μL של תערובת מאסטר קשירה למדגם הסופי + ברקודים, נותן תגובה כוללת של 10 μL.
- דגירה במחזור תרמי באמצעות התנאים המוזכרים בטבלה 4.
- ניקוי חרוזי SPRI וכימות DNA
- הפשירו חיץ שבר קצר (SFB) ב-RT, ערבבו על ידי מערבולת, צנטריפוגת פולס והניחו על קרח.
- אסוף את כל דגימות הברקוד יחד בצינור מיקרוצנטריפוגה של 1.5 מ"ל לובניד. כדי לא להפוך את נפח הניקוי לגדול מדי לשימוש, אגרו 12-24 דגימות (10 מיקרוליטר לדגימה), עד 48 דגימות (5 מיקרוליטר לדגימה), או עד 96 דגימות (2.5 מיקרוליטר לדגימה) מכל תגובת ברקוד מקורית.
- הוסף נפח של 0.4x של חרוזי SPRI למאגר הברקוד. מערבבים בעדינות (פליק או פיפט) ודגורים על RT במשך 5 דקות.
- מניחים את הדגימות על מגנט עד שהחרוזים נפלטים והסופרנאטנט צלול לחלוטין (~ 2 דקות). הסר והשליך את הסופר-נטנט. היזהרו לא להפריע לחרוזים.
- יש לשטוף פעמיים עם 250 מיקרוליטר של SFB.
- הסר את הצינור מהמגנט והשהה לחלוטין את הגלולה ב 250 μL של SFB. דוגרים 30 שניות, דופקים צנטריפוגה וחוזרים למגנט.
- מוציאים את הסופרנאטנט ומשליכים.
- חזור על שלב 12.3.5 כדי לבצע שטיפת SFB שנייה.
- פולס צנטריפוגה ולהסיר כל SFB שיורית.
- הוסף 200 μL של אתנול 80% (RT) כדי לרחוץ את הכדור. הסר והשליך את האתנול, נזהר לא להפריע את גלולת החרוז. יש לייבש באוויר במשך 30 שניות או עד שהגלולה איבדה את הברק שלה.
- יש להשהות מחדש ב-22 μL של NFW ב-RT למשך 10 דקות.
- מניחים על המגנט, מניחים להסתפק ~ 2 דקות, ואז מסירים בזהירות את התמיסה ומעבירים לצינור מיקרוצנטריפוגה נקי של 1.5 מ"ל.
- השתמש ב- 1 μL כדי להשיג את ריכוז ה- DNA, כפי שתואר קודם לכן (שלב 10.13).
הערה: נקודת השהיה אופציונלית: בשלב זה, ניתן לאחסן את הספרייה ב- 4 ° C למשך עד שבוע אחד או - 20 ° C לאחסון לטווח ארוך יותר, אך עדיף להמשיך עם קשירת מתאם ורצף.
13. רצף (48 שעות לכל היותר)
- הכן את המחשב (עיין גם בדרישות מוקדמות סעיפים 1-4).
- בדוק שיש מספיק מקום לאחסון נתונים חדשים (מינימום 150 GB), נתונים מריצות ישנות מגובים/מועברים לשרת לפני המחיקה, והגרסה העדכנית ביותר של MinKNOW מותקנת.
- הוציאו את תא הזרימה המאוחסן מהמקרר ואפשרו לו להגיע ל-RT.
- קשירת מתאם (1 שעות)
- צנטריפוגות פולס, המתאם, מערבבים וליגאז ומניחים על קרח.
- חיץ הפשרה (EB), SFB וחיץ קשירה ב- RT. מערבבים על ידי מערבולת, צנטריפוגת פולס, ומניחים על קרח.
- הכן את תערובת האב לקשירת מתאם (טבלה 5), המשלבת ריאגנטים בסדר שצוין בצינור קישור נמוך.
הערה: ניתן להשתמש בחלופות לריאגנטים של תערובת מאסטר קשירת מתאמים (טבלה 5) בהתאם לזמינות במעבדה. ראו קובץ משלים 3 וטבלת חומרים לרשימת חלופות. השתמש בחישוב בגליון העבודה של קובץ משלים 3 כדי לקבל את נפח ספריית ה- DNA שווה ערך ל- 200 fmol. אם פחות מ-20 μL מחושב, הוסף NFW כדי ליצור עד 20 μL. - מערבבים בתנועות עדינות וצנטריפוגות דופקות. יש לדגור ב-RT במשך 20 דקות.
הערה: במהלך הדגירה, התחל להכין את תא הזרימה (סעיף 13.5).
- נקו באמצעות חרוזי SPRI (אין להשתמש באתנול כמו בניקיונות קודמים).
- הוסף נפח של 0.4x של חרוזי SPRI (RT) לדגימות. דוגרים ב-RT במשך 10 דקות, ומעבירים בעדינות לסירוגין כדי לסייע בערבוב.
- מניחים על המגנט עד שהחרוזים והתמיסה נפרדים לחלוטין (~ 5 דקות). להסיר ולהשליך את supernatant; יש להיזהר שלא להפריע לגלולת החרוזים.
- יש לשטוף פעמיים עם 125 μL של SFB.
- להשעות את הגלולה לחלוטין עם 125 μL של SFB על ידי ערבוב עם פיפטה. השאירו לדגור במשך 30 שניות.
- צנטריפוגת פולסים לאיסוף נוזלים בבסיס הצינור ומניחים על המגנט. מוציאים את הסופרנאטנט ומשליכים.
- חזור על שלבים 13.4.4-13.4.5 כדי לשטוף את הגלולה פעם נוספת.
- דופק צנטריפוגה ולהסיר SFB עודף.
- יש להשהות מחדש ב-15 μL של EB ולדגור למשך 10 דקות ב-RT.
- חזור למגנט למשך ~2 דקות ולאחר מכן העבר בזהירות את התמיסה לצינור מיקרוצנטריפוגה נקי של 1.5 מ"ל.
- כמת 1 μL של הספרייה המדוללת, כפי שתואר קודם לכן בשלב 10.13
הערה: לקבלת התוצאות הטובות ביותר, המשך ישירות לריצוף MinION; עם זאת, ניתן לאחסן את הספרייה הסופית ב- EB ב- 4 ° C למשך עד שבוע במידת הצורך.
- הפעל בדיקת איכות תא זרימה.
- חבר את התקן הרצף למחשב נייד ופתח את תוכנת הרצף.
- בחר סוג תא זרימה ולאחר מכן לחץ על בדוק תא זרימה והתחל בדיקה.
- לאחר השלמתה, יוצג המספר הכולל של נקבוביות פעילות (כלומר, בנות קיימא). תא זרימה חדש צריך להיות >800 נקבוביות פעילות; אם לא, פנה ליצרן לקבלת החלפה.
- פרימה וטעינה של תא הזרימה (20 דקות)
- הפשיר את הריאגנטים הבאים ב- RT ולאחר מכן מקם מאגר ריצוף, קשירה סומקת, מאגר הדחה וטעינת חרוזים על קרח.
- מערבלים את חיץ הרצף ואת חיץ ההדחה, דופקים צנטריפוגה ומניחים על קרח.
- צנטריפוגות פולס את קשירת ההדחה ומערבבים על ידי פיפטציה; ואז מניחים על קרח.
- הכינו את תערובת הפריימינג של תאי הזרימה על ידי הוספת 30 μL של קשירת סומק ישירות לצינור של חיץ ההדחה מערכת הכנה של תאי זרימה וערבבו באמצעות פיפט.
- ערבבו את חרוזי ההעמסה על ידי פיפטינג מיד לפני השימוש מכיוון שהם שוקעים במהירות.
- בשפופרת טרייה מכינים את דילול הספרייה הסופי לריצוף, כמפורט בטבלה 5.
הערה: השתמש בחישוב בגליון העבודה של קובץ משלים 3 כדי לקבל את אמצעי האחסון של ספריית DNA שווה ערך ל- 50 fmol. אם פחות מ- 12 μL מחושב, הוסף EB כדי ליצור עד 12 μL. - הפוך לאחור את מכסה התקן הריצוף והחלק את מכסה יציאת הפריימינג בכיוון השעון כך שיציאת הפריימינג תהיה גלויה (איור 3)
- הסר בועות אוויר בזהירות על ידי הגדרת פיפטה P1000 ל 200 μL, הכנס את הקצה ליציאת הפריימינג, וסובב את הגלגל עד שנראה נפח קטן הנכנס לקצה פיפטה (מקסימום סיבוב ל 230 μL).
- טען 800 μL של תערובת פריימינג של תאי זרימה לתוך תא הזרימה דרך יציאת הפריימינג, תוך הקפדה על מניעת בועות.
- להשאיר למשך 5 דקות.
- הרימו בעדינות את מכסה יציאת הדגימה וטענו 200 מיקרוליטר של תערובת פריימינג לתוך תא הזרימה דרך יציאת הפרימינג באמצעות פיפטה P1000.
- פיפטה מערבבת את הספרייה למעלה ולמטה לפני הטעינה, ומבטיחה שטעינת חרוזים בתערובת האב תושהה מחדש לפני הטעינה.
- טען 75 μL של תערובת ספרייה לתא הזרימה דרך יציאת הדגימה בצורה טיפתית. ודא שכל טפטוף זורם לתוך היציאה לפני הוספת הטפטוף הבא.
- החלף את מכסה יציאת הדגימה בעדינות, וודא שהבאנג נכנס ליציאת הדגימה.
- סגור את יציאת הפריימינג והחלף את מכסה התקן הריצוף.
- ריצת רצף (48 שעות לכל היותר)
- חבר את התקן הרצף למחשב הנייד ופתח את תוכנת הרצף.
- לחץ על התחל ולאחר מכן לחץ על התחל רצף.
- לחץ על ניסוי חדש ופעל בהתאם לזרימת העבודה של ממשק המשתמש הגרפי (GUI) של תוכנת הרצף כדי להגדיר את הפרמטרים עבור ההפעלה.
- הקלד את שם הניסוי ואת מזהה הדגימה (לדוגמה, rabv_run1), ובחר באפשרות Flow Cell Type מהתפריט הנפתח.
- המשך לבחירת הערכה ובחר את ערכת ריצוף הקשירה הרלוונטית ואת ערכות הברקוד המקוריות שבהן נעשה שימוש.
- המשך להפעיל אפשרויות . שמור על ברירות המחדל, אלא אם כן רצוי שהריצה תיפסק באופן אוטומטי לאחר מספר מסוים של שעות (ניתן להפסיק ריצות באופן ידני בכל עת).
- המשך אל Basecalling. בחר להפעיל או לבטל את Basecalling בהתאם למשאבי המחשוב (ראה הגדרת מחשב). בחרו 'אפשרויות עריכה' תחת ברקוד וודאו שהאפשרות 'ברקוד בשני הקצוות' מופעלת. שמור והמשך לקטע הפלט.
- קבל את ברירות המחדל והמשך לסקירה הסופית, בדוק את ההגדרות ורשום את הפרטים בגליון העבודה (קובץ משלים 3). לחץ על התחל.
הערה: אם נעשה שימוש חוזר בתא הזרימה, התאם את מתח ההתחלה (בחלק המתקדם של אפשרויות ההפעלה), כפי שמצוין על-ידי התוכנית בקובץ משלים 3. - הקלט את הערוצים הפעילים הראשוניים - אם זה נמוך משמעותית מבדיקת בקרת האיכות (QC), הפעל מחדש את תוכנת הרצף. אם עדיין נמוך יותר, אתחל מחדש את המחשב.
- הקלט את התעלות הראשוניות בגדיל לעומת נקבובית בודדת כדי לתת תפוסה משוערת של הנקבוביות. מספר זה ישתנה, אז תן קירוב.
- עקוב אחר הריצה תוך כדי התקדמותה.
14. שיחות בסיס חיות ולא מקוונות
הערה: הוראות אלה מניחות כי מבנה הספריות הקיים מראש שסופק במאגר artic-rabv וכי התנאים המוקדמים סעיפים 1 ו- 3 של הפרוטוקול מולאו.
- במערכת הקבצים המקומית שלך, צור ספרייה חדשה בשם ניתוח, שבה תאחסן את כל פלטי הניתוח שלך. כדי להתארגן עוד: צור ספריית משנה עם שם הפרויקט שלך ובתוכה ספריה חדשה עבור הריצה, באמצעות מזהה לדוגמה שסופק ל- MinKNOW כ- run_name. בצע פעולה זו בפקודה אחת באופן הבא:
MKDIR -P
ניתוח/project_name/run_name
לאחר מכן נווט אל מיקומו:
תקליטור
נתיב/ניתוח/project_name/run_name - שיחות בסיס חיות
הערה: כדי לבצע שיחות בסיס ננו-נקבוביות בזמן אמת, מחשבים ניידים דורשים יחידת עיבוד גרפי (GPU) תואמת NVIDIA CUDA. ודא שההוראות להגדרת הקריאה הבסיסית של המעבד הגרפי בוצעו באמצעות פרוטוקול guppy56.- במהלך הגדרת ההפעלה, הפעל שיחות בסיס חיות.
- השתמש ב- RAMPART כדי לפקח על כיסוי הרצף בזמן אמת, בהתאם להוראות להלן.
- במסוף המחשב, הפעל את סביבת artic-rabv conda:
Conda activate artic-rabv - צור ספרייה חדשה עבור פלט הסוללה בתוך ספריית run_name ונווט לתוכה:
תקליטור /נתיב/ניתוח/project_name/run_name
MKDIR rampart_output
CD rampart_output - צור קובץ .csv ברקודים כדי להתאים את הברקודים ואת השמות לדוגמה. עליו לכלול שורה אחת לכל ברקוד ולציין רק ברקודים הנמצאים בספרייה, עם הכותרות "ברקוד" ו"מדגם". עקוב אחר הדוגמה בספריית artic-rabv:
ניתוח/example_project/example_run/rampart_output/ברקודים.csv - הפעל את RAMPART על-ידי אספקת תיקיית הפרוטוקול הרלוונטית והנתיב לתיקיית fastq_pass בפלט MinKNOW עבור ההפעלה:
rampart --protocol /path/rampart/scheme_name_V1_protocol - basecalledPath - פתח חלון דפדפן ונווט אל localhost:3000 בתיבה URL. המתן לבסיס נתונים מספיקים לפני שהתוצאות יופיעו על המסך.
- שיחות בסיס לא מקוונות (מבוצעות לאחר הפעלה)
- אם לא הוגדרה קריאה בסיסית חיה, הפלט מ- MinKNOW יהיה נתוני אות גולמיים (קבצי fast5). אחד לא יוכל להשתמש RAMPART במהלך הריצה. המר את קבצי fast5 לנתונים בסיסיים (קובצי fastq) לאחר ההפעלה באמצעות guppy (ראה הגדרה בתנאים מוקדמים שלב 1.1.1.). הפעל RAMPART לאחר הוק על הנתונים הבסיסיים.
- הפעל את מתקשר הבסיס הגורפי:
guppy_basecaller -c dna_r9.4.1_450bps_fast.cfg -i /path/to/reads/fast5_* -s /path/analysis/project_name/run_name -x auto -r
-c הוא קובץ התצורה כדי לציין את מודל קריאת הבסיס, -i הוא נתיב הקלט, -s הוא נתיב השמירה, -x מציין קריאת בסיס על ידי התקן GPU (אל תכלול אם אתה משתמש בגרסת המחשב של GUPPY), ו-r מציין לחפש קבצי קלט באופן רקורסיבי.
הערה: ניתן לשנות את קובץ התצורה (.cfg) ל- basecaller ברמת דיוק גבוהה על-ידי החלפת _fast ב- _hac, אם כי פעולה זו תימשך זמן רב יותר באופן משמעותי.
15. שטיפת תאי הזרימה
- ניתן לשטוף את תאי הזרימה ולעשות בהם שימוש חוזר כדי לרצף ספריות חדשות אם הנקבוביות עדיין קיימות. ראה הוראות לשטיפה בפרוטוקול שטיפת תאי זרימה ONT57.
16. ניתוח ופרשנות
- יצירת רצף קונצנזוס עם צינור ביואינפורמטיקה של ARTIC
- בצע את ההוראות המפורטות במאגר GitHub40 של artic-rabv בתיקייה rabv_protocols כדי ליצור רצפי קונצנזוס מקבצי fastq גולמיים5 או מבוססי fastq.
הערה: עיין ב- Artic pipeline - Corepipeline 58 לקבלת הדרכה נוספת.
- בצע את ההוראות המפורטות במאגר GitHub40 של artic-rabv בתיקייה rabv_protocols כדי ליצור רצפי קונצנזוס מקבצי fastq גולמיים5 או מבוססי fastq.
- אופציונלי: נתח את עומק הקריאה הממוצע לכל אמפליקון.
- התאם את הסקריפטים הזמינים ממאגר artic-rabv, תוך התייחסות לקובץ משלים 1. נתונים סטטיסטיים קצרים ומעמיקים מופקים באמצעות SAMtools59 וכיסוי לכל נוקלאוטיד המסומן ב-R.
- ניתוח פילוגנטי באמצעות GLUE
- מ-RABV_GLUE 42, בחר בכרטיסייה Analysis > Genotyping and Interpretation > Add Files, ובחר בקובץ fasta של רצפי קונצנזוס.
- לחץ על שלח והמתן. לאחר השלמת הניתוחים, הלחצן Show Analysis יהיה זמין ללחיצה, ויציג הקצאות clade ו- subclade, כיסוי לכל גן, שונות מרצפי ייחוס וקרוב משפחה קרוב.
- ניתן לזהות רצפים הקשריים רלוונטיים גם בסעיף נתוני רצף > רצפי NCBI לפי Clade .
- בחר את הקלייד שזוהה או לחץ על וירוס הכלבת (RABV) כדי לראות את כל הרצפים הזמינים.
- סנן רצפים רלוונטיים (לדוגמה, ארץ מוצא).
- הורד רצפים אלה ומטה-נתונים מתאימים לצורך ניתוח והשוואה.
- הקצאת שושלת באמצעות MADDOG41
- משוך את מאגר MADDOG מ- GitHub כדי לוודא שאתה עובד עם הגרסה העדכנית ביותר.
- צור תיקיית משימה בתוך מאגר MADDOG המקומי (שנוצר בעבר במקטע תנאים מוקדמים) בשם שם ההפעלה.
- בתוך התיקייה, הוסף את קובץ fasta המכיל את רצפי הקונצנזוס.
- הוסף קובץ מטא-נתונים לתיקיה.
הערה: קובץ זה חייב להיות קובץ csv עם 4 עמודות הנקראות 'מזהה', 'מדינה', 'שנה' ו'הקצאה', המפרטות את מזהי הרצף, ארץ הדגימה ושנת איסוף הדגימה, בעוד שהעמודה 'הקצאה' צריכה להיות ריקה. - בממשק שורת הפקודה, הפעל את סביבת קונדה: קונדה הפעל את MADDOG.
- בממשק שורת הפקודה, נווט אל תיקיית מאגר MADDOG.
- בתחילה, בצע הקצאת שושלת על רצפים כדי לבדוק אם יש חריגות פוטנציאליות ולזהות אם הפעלת שלב ייעוד השושלת הארוך יותר תהיה מתאימה. לשם כך, הקלד זאת בשורת הפקודה: sh assignment.sh.
- כשתתבקש, הזן Y כדי לציין שמשכת את המאגר ואתה עובד עם הגרסה העדכנית ביותר של MADDOG.
- כשתתבקש, הזן את שם התיקיה בתיקיית מאגר MADDOG המכילה את קובץ fasta.
- לאחר השלמת הקצאת השושלת, בדוק את קובץ הפלט בתיקיה שלך. אם הפלט הוא כצפוי ויש רצפים מרובים שהוקצו לאותה שושלת, הפעל את ייעוד השושלת.
- אם פועל ייעוד שושלת, מחק את קובץ פלט המשימה שזה עתה נוצר.
- בטרמינל, בתוך תיקיית מאגר MADDOG, הפעל את הפקודה sh designation.sh.
- כשתתבקש, הזן Y כדי לציין שמשכת את המאגר ואתה עובד עם הגרסה העדכנית ביותר של MADDOG.
- כשתתבקשו, הזינו את שם התיקייה בתיקייה MADDOG repository המכילה את קובץ fasta ומטא-נתונים. זה מפיק מידע שושלת על כל רצף, פילוגנזה של הרצפים הקודמים החדשים והרלוונטיים (מ-16.3.6), מידע היררכי על השושלות, ופרטים על שושלות פוטנציאליות מתפתחות ואזורים של תת-דגימה.
הערה: פרטים מלאים על הפרוטוקול, השימוש והפלטים ניתן למצוא ב- Campbell et al.60. - לאחר השלמת הניתוח הראשוני, אם תתבקש לבדוק גם שושלות מתפתחות ותת-דגימה, הזן Y, אם הדבר נדרש. אחרת, הזן N.
- אם תתבקש לאשר שושלות חדשות שנמצאו, הזן Y ופעל לפי ההוראות בקובץ NEXT_STEPS.eml המתקבל. אחרת, הזן N.
תוצאות
תהליך העבודה של דגימה לרצף לפענוח עבור RABV המתואר בפרוטוקול זה שימש בהצלחה בתנאי מעבדה שונים במדינות אנדמיות, כגון טנזניה, קניה, ניגריה והפיליפינים (איור 4). הפרוטוקול שימש על סוגים ותנאים שונים של דגימות (טבלה 6): רקמת מוח טרייה וקפואה, תמציות cDNA ו-RNA מרקמת מוח המועברות תחת שרשרת קרה לפרקי זמן ממושכים, וכרטיסי FTA עם מריחות רקמת מוח.
שיחות בסיס חיות באמצעות RAMPART (איור 5) מראות את היצירה כמעט בזמן אמת של קריאות ואת אחוז הכיסוי לדגימה. הדבר שימושי במיוחד בהחלטה מתי להפסיק את הריצה ולשמור את תא הזרימה לשימוש חוזר. נצפתה שונות בזמן הריצה, כאשר חלקם סיימו תוך שעתיים, בעוד שאחרים יכלו לקחת יותר מ -12 שעות כדי להגיע לעומק כיסוי מספיק (x100). אנו יכולים גם להציג אזורים עם הגברה גרועה; לדוגמה, איור 6 מציג תמונה של ריצת רצף אחת שבה פרופילי כיסוי מראים כמה אמפליקונים עם הגברה נמוכה מאוד, מה שמצביע על פריימרים שעלולים להיות בעייתיים. על-ידי חקירה יסודית יותר של אזורי ההגברה הגרועים האלה, הצלחנו לזהות אי-התאמות בפריימר, מה שיאפשר לנו לעצב מחדש ולשפר פריימרים בודדים. חלק מתוכניות הפריימר הראו יותר אי-התאמות מאחרות. זה נצפה בתוכנית הפריימר של מזרח אפריקה, בהשוואה לפיליפינים, בהתאם למגוון הממוקד, שכן תוכנית מזרח אפריקה שואפת ללכוד מגוון רחב הרבה יותר.
RABV-GLUE42, משאב כללי לניהול נתוני גנום RABV, ו-MADDOG60, מערכת סיווג שושלות ומינוח, שימשו לקומפילציה ופירוש רצפי RABV שנוצרו. טבלה 7 מציגה את הקלאדים העיקריים והקטנים המסתובבים בכל מדינה שהוקצתה באמצעות RABV-GLUE. כמו כן מוצג סיווג ברזולוציה גבוהה יותר של שושלות מקומיות לאחר הקצאת MADDOG.
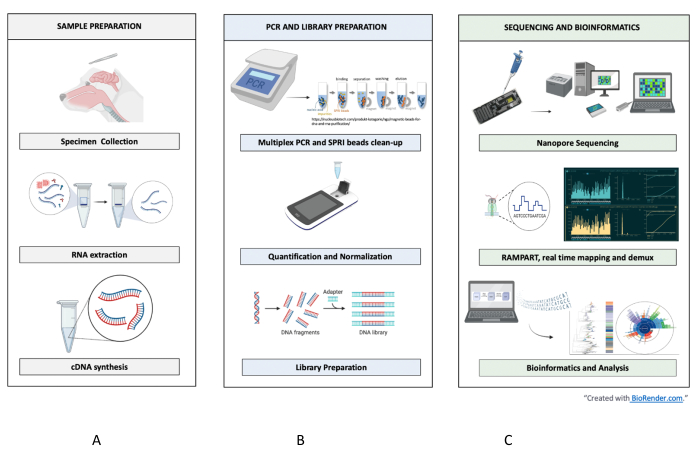
איור 1: זרימת עבודה של דגימה לרצף לפרשנות עבור RABV. שלבים מסוכמים מוצגים עבור (A) הכנת דגימה, (B) PCR והכנת ספריות, ו-(C) ריצוף וביואינפורמטיקה עד ניתוח ופענוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
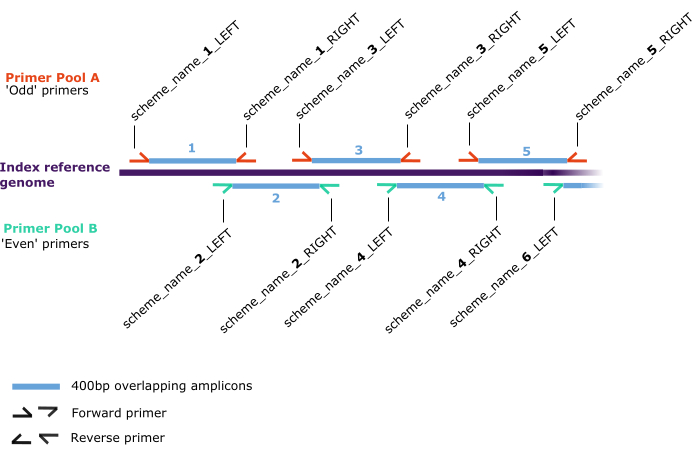
איור 2: סכימת פריימר. מיקום חישול לאורך "גנום הייחוס האינדקסי" (סגול כהה) לזוגות פריימרים קדימה ואחורה (חצאי חצים), המוקצים בשני מאגרים נפרדים: A (אדום) ו-B (ירוק). זוגות פריימרים יוצרים אמפליקונים חופפים של 400 bp (כחול) הממוספרים ברצף לאורך גנום הייחוס האינדקסי בפורמט 'scheme_name_X_DIRECTION', כאשר 'X' הוא מספר המתייחס לאמפליקון שנוצר על ידי הפריימר ו- 'DIRECTION' הוא 'שמאל' או 'ימין', המתאר את הקדימה או ההפוך בהתאמה. ערכים אי-זוגיים או זוגיים של 'X' קובעים את המאגר (A או B, בהתאמה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
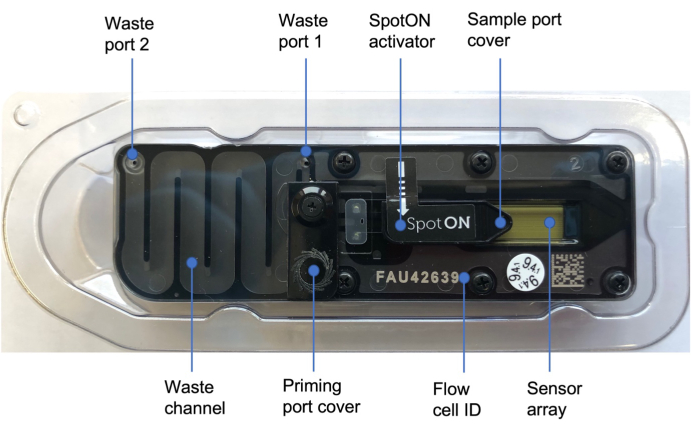
איור 3: תא זרימהננופור 48. תוויות כחולות ממחישות את החלקים השונים של תא הזרימה, כולל כיסוי יציאת הפריימינג המכסה את יציאת הפריימינג שבה מתווספת תמיסת הפרימינג, כיסוי יציאת הדגימה SpotON המכסה את יציאת הדגימה שבה הדגימה מתווספת בצורה טיפתית, יציאות הפסולת 1 ו- 2 ומזהה תא הזרימה. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
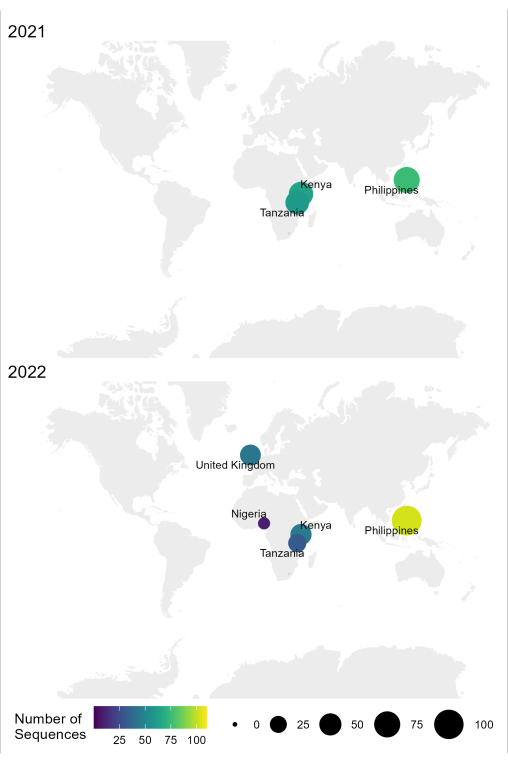
איור 4: מפה המציגה את המיקום שבו בוצע ריצוף RABV באמצעות זרימת העבודה הממוטבת בשנים 2021 ו-2022. גודל וצבע הבועות תואמים למספר הרצפים בכל מיקום, כאשר קטן יותר וכהה יותר הוא קטן יותר, בעוד גדול ובהיר יותר הוא יותר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
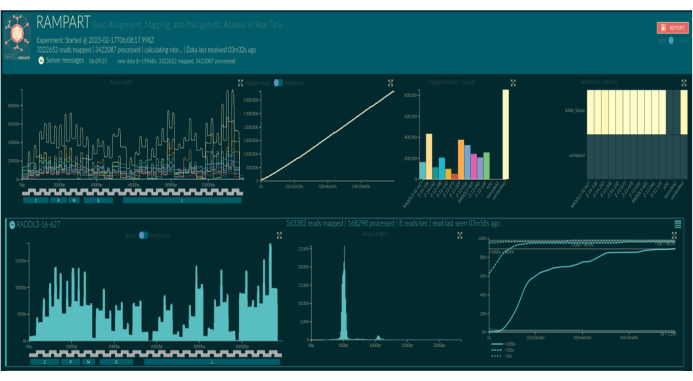
איור 5: צילום מסך של תצוגה חזותית של RAMPART בדפדפן אינטרנט. שמות ברקוד מוחלפים בשמות לדוגמה בהתאם להגדרה הביואינפורמטית. שלושת הלוחות העליונים מציגים תרשימי סיכום לכל הריצה: עומק הכיסוי של קריאות ממופות עבור כל ברקוד לכל מיקום נוקלאוטידים בגנום הייחוס של האינדקס (למעלה משמאל, צבוע בברקוד), סיכום קריאות ממופות מכל הברקודים לאורך זמן (אמצע עליון), וקריאות ממופות לכל ברקוד (למעלה מימין, צבוע בברקוד). לוחות תחתונים מציגים שורות של תרשימים לכל ברקוד. משמאל לימין: עומק הכיסוי של קריאות ממופות לכל מיקום נוקלאוטידים בגנום הייחוס האינדקסי (משמאל), התפלגות האורך של קריאות ממופות (באמצע), ושיעור מיקומי הנוקלאוטידים בגנום הייחוס האינדקסי שקיבלו כיסוי של פי 10, 100x ו-1,000x של קריאות ממופות לאורך זמן (מימין). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
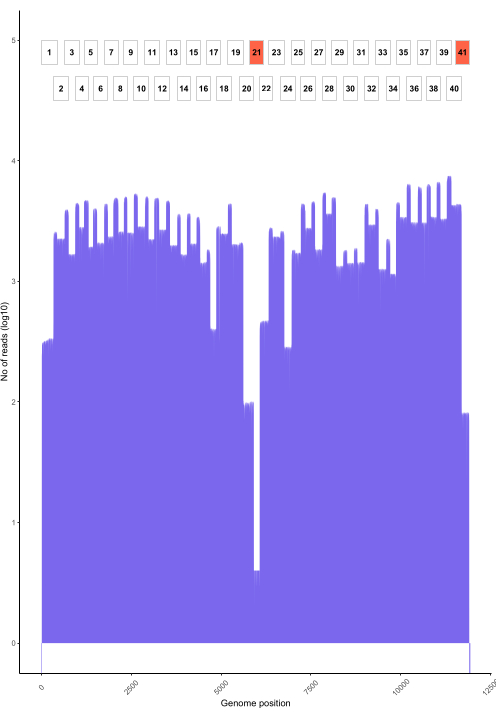
איור 6: דוגמה לקריאת כיסוי לאורך הגנום עבור דגימת נגיף כלבת מהפיליפינים שרוצפה באמצעות הפרוטוקול. כיסוי קריאה בכל מיקום נוקלאוטיד בגנום מוצג, לצד מיקום האמפליקונים החופפים (1-41) המשמשים ליצירת הספרייה. קוצים בעומק הכיסוי מתאימים לאזורים של חפיפה אמפליקון. אמפליקונים עם עומק כיסוי נמוך מתאימים לאזורים של חפיפת אמפליקון. אמפליקונים עם עומק כיסוי נמוך מסומנים באדום ומציינים אזורים בעייתיים שעשויים לדרוש אופטימיזציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: תערובת אב ותנאי מחזור תרמי להכנת cDNA. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: מיקס מאסטר ותנאי מחזור תרמי עבור PCR מרובה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: תערובת מאסטר ותנאי מחזור תרמי לתגובת הכנה סופית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: תערובת מאסטר ותנאי מחזור תרמי לברקוד. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: תערובת אב לקשירת מתאמים ודילול ספרייה סופית לריצוף. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 6: מספר רצפי הגנום השלם של נגיף הכלבת שנוצרו וסוג הדגימות שנעשה בהן שימוש במדינות שונות באמצעות תהליך העבודה של דגימה לרצף לפענוח. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 7: הקצאות קלאדה גדולות ומשניות מ- RABV-GLUE והקצאות שושלת מ- MADDOG עבור רצפים שנוצרו באמצעות זרימת העבודה. אנא לחץ כאן כדי להוריד טבלה זו.
קובץ משלים 1: תכנון ואופטימיזציה של סכימת פריימר וניתוח עומק קריאה של אמפליקון. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: הגדרה חישובית לחץ כאן להורדת קובץ זה.
קובץ משלים 3: גליון עבודה של פרוטוקול RABV WGS אנא לחץ כאן להורדת קובץ זה.
Discussion
תהליך עבודה נגיש של ריצוף גנום שלם מבוסס ננו-נקבוביות פותח על ידי Brunker et al.61, תוך שימוש במשאבים מרשת ARTIC46. כאן, אנו מציגים זרימת עבודה מעודכנת, עם שלבים מלאים מדגם לרצף לפרשנות. תהליך העבודה מפרט את הכנת דגימות רקמת המוח לריצוף גנום שלם, מציג צינור ביואינפורמטיקה לעיבוד קריאות ויצירת רצפי קונצנזוס, ומדגיש שני כלים ספציפיים לכלבת כדי להפוך את הקצאת השושלת לאוטומטית ולקבוע הקשר פילוגנטי. זרימת העבודה המעודכנת מספקת גם הוראות מקיפות להגדרת סביבות עבודה חישוביות ומעבדתיות מתאימות, עם שיקולים ליישום בהקשרים שונים (כולל הגדרות דלות משאבים). הדגמנו את היישום המוצלח של זרימת העבודה הן במסגרות אקדמיות והן במכוני מחקר בארבעה LMICs אנדמיים של RABV ללא יכולת מעקב גנומי או מוגבלת. זרימת העבודה הוכיחה עמידות ליישומים בהגדרות מגוונות, ומובנת למשתמשים בעלי מומחיות משתנה.
זרימת עבודה זו עבור ריצוף RABV היא הפרוטוקול המקיף ביותר הזמין לציבור (המכסה שלבי דגימה לרצף לפענוח) ומותאם במיוחד כדי להפחית הן את עלויות ההפעלה והן את עלויות התפעול. הזמן והעלות הנדרשים להכנת הספרייה ולריצוף בטכנולוגיית ננו-נקבוביות מצטמצמים מאוד ביחס לפלטפורמות אחרות, כגון Illumina61, ופיתוחים טכנולוגיים מתמשכים משפרים את איכות הרצף ואת דיוקו כדי להיות דומים ל- Illumina62.
פרוטוקול זה נועד להיות עמיד בהקשרים מגוונים דלי משאבים. על-ידי התייחסות להנחיות לפתרון בעיות ושינויים המסופקות לצד פרוטוקול הליבה, משתמשים נתמכים כדי להתאים את זרימת העבודה לצרכיהם. הוספת כלים ביואינפורמטיים ידידותיים למשתמש לזרימת העבודה מהווה התפתחות משמעותית לפרוטוקול המקורי, המספק שיטות מהירות וסטנדרטיות שניתן ליישם על ידי משתמשים עם ניסיון ביואינפורמטי קודם מינימלי כדי לפרש נתוני רצף בהקשרים מקומיים. היכולת לעשות זאת באתרו מוגבלת לעתים קרובות על ידי הצורך בתכנות ספציפי ומיומנויות פילוגנטיות, הדורשות השקעה אינטנסיבית וארוכת טווח בהכשרת מיומנויות. בעוד שמיומנות זו חשובה לפירוש יסודי של נתוני רצף, כלי פרשנות בסיסיים ונגישים רצויים באותה מידה על מנת לקלוט "אלופי ריצוף" מקומיים, שמומחיות הליבה שלהם עשויה להיות מבוססת מעבדה רטובה, מה שיאפשר להם לפרש ולקחת בעלות על הנתונים שלהם.
מכיוון שהפרוטוקול בוצע במשך מספר שנים במספר מדינות, כעת אנו יכולים לספק הדרכה כיצד לייעל תוכניות פריימר מולטיפלקס כדי לשפר את הכיסוי ולהתמודד עם המגוון המצטבר. נעשו גם מאמצים לסייע למשתמשים לשפר את העלות-תועלת או לאפשר קלות רכש באזור נתון, דבר המהווה בדרך כלל אתגר לקיימות של גישות מולקולריות63. לדוגמה, באפריקה (טנזניה, קניה וניגריה), בחרנו בתערובת מאסטר ליגאז קהה / TA בשלב קשירת המתאם, שהיה זמין יותר מספקים מקומיים וחלופה זולה יותר לריאגנטים אחרים של קשירה.
מניסיון, ישנן מספר דרכים להפחית את העלות למדגם ולריצה. הפחתת מספר הדגימות לריצה (למשל, מ-24 ל-12 דגימות) יכולה להאריך את חיי תאי הזרימה על פני מספר ריצות, בעוד שהגדלת מספר הדגימות לריצה ממקסמת את הזמן והריאגנטים. בידינו הצלחנו לשטוף תאי זרימה ולעשות בהם שימוש חוזר באחד מכל שלושה רצפי ריצוף, מה שאפשר לרצף 55 דגימות נוספות. שטיפת תא הזרימה מיד לאחר השימוש, או אם הדבר אינו אפשרי, סילוק נוזל הפסולת מתעלת הפסולת לאחר כל ריצה, נראה כמשמר את מספר הנקבוביות הזמינות לריצה שנייה. אם ניקח בחשבון את המספר הראשוני של נקבוביות זמינות בתא זרימה, ריצה אחת יכולה גם להיות ממוטבת כדי לתכנן כמה דגימות לרוץ בתא זרימה מסוים.
למרות שזרימת העבודה שואפת להיות מקיפה ככל האפשר, עם תוספת של הדרכה מפורטת ומשאבים מסומנים, ההליך עדיין מורכב ויכול להיות מרתיע עבור משתמש חדש. אנו מעודדים את המשתמש לחפש הדרכה ותמיכה אישית, באופן אידיאלי מקומי, או לחילופין באמצעות משתפי פעולה חיצוניים. בפיליפינים למשל, פרויקט על בניית יכולות במעבדות אזוריות למעקב גנומי של SARS-CoV-2 באמצעות ONT פיתח יכולות ליבה בקרב מאבחנים בתחום הבריאות הניתנות להעברה בקלות לריצוף RABV. שלבים חשובים, כגון ניקוי חרוזי SPRI, יכולים להיות קשים לשליטה ללא אימון מעשי, וניקוי לא יעיל עלול לפגוע בתא הזרימה ולסכן את הריצה. זיהום דגימות הוא תמיד דאגה מרכזית כאשר אמפליקונים מעובדים במעבדה ויכול להיות קשה לסלק. בפרט, קשה מאוד לזהות זיהום צולב בין דגימות במהלך ביואינפורמטיקה שלאחר ריצה. טכניקות מעבדה טובות ושיטות עבודה, כגון שמירה על משטחי עבודה נקיים, הפרדת אזורים לפני ואחרי PCR ושילוב בקרות שליליות, הן הכרחיות כדי להבטיח בקרת איכות. הקצב המהיר של פיתוחי ריצוף ננו-נקבוביות הוא גם יתרון וגם חיסרון למעקב גנומי שגרתי של RABV. שיפורים מתמשכים בדיוק, בנגישות וברפרטואר הפרוטוקולים של ננו-נקבוביות מרחיבים ומשפרים את טווח היישום שלה. עם זאת, אותם פיתוחים מקשים על שמירה על נהלי תפעול סטנדרטיים וצינורות ביואינפורמטיקה. בפרוטוקול זה, אנו מספקים מסמך המסייע במעבר מערכות הכנה ישנות יותר לקיימות של ספריית ננו-נקבוביות (Table of Materials).
מחסום נפוץ לריצוף ב- LMICs הוא נגישות, הכוללת לא רק את העלות אלא גם את היכולת לרכוש חומרים מתכלים בזמן (במיוחד ריאגנטים רצף, שהם חדשים יחסית לצוותי רכש וספקים) ומשאבים חישוביים, כמו גם פשוט גישה לחשמל יציב ולאינטרנט. שימוש בטכנולוגיית ריצוף ננו-נקבוביות ניידת כבסיס לזרימת עבודה זו מסייע ברבות מבעיות נגישות אלה, והדגמנו את השימוש בפרוטוקול שלנו במגוון הגדרות, תוך ביצוע הפרוטוקול המלא והניתוח במדינה. אמנם, רכישת ציוד וריצוף חומרים מתכלים בזמן נותרה אתגר, ובמקרים רבים, נאלצנו לשאת או לשלוח ריאגנטים מבריטניה. עם זאת, באזורים מסוימים, הצלחנו להסתמך לחלוטין על נתיבי אספקה מקומיים עבור ריאגנטים, ונהנינו מהשקעה בריצוף SARS-CoV-2 (למשל, הפיליפינים) שייעל את תהליכי הרכש והחל לנרמל את היישום של גנומיקה פתוגנית.
הצורך בחיבור אינטרנט יציב ממוזער על ידי התקנות חד פעמיות בלבד; לדוגמה, מאגרי GitHub, הורדת תוכנה וריצוף ננו-נקבוביות עצמו דורשים רק גישה לאינטרנט כדי להתחיל את הריצה (לא לאורך כל הדרך) או שניתן לבצע אותם באופן לא מקוון לחלוטין בהסכמת החברה. אם נתונים סלולריים זמינים, טלפון יכול לשמש כנקודה חמה למחשב הנייד כדי להתחיל את ריצת הרצף, לפני התנתקות למשך הריצה. בעת עיבוד שגרתי של דגימות, דרישות אחסון הנתונים יכולות לגדול במהירות, ובאופן אידיאלי הנתונים יאוחסנו בשרת. אחרת, כוננים קשיחים מסוג Solid State Drive (SSD) זולים יחסית למקור.
בעוד שאנו מכירים בכך שעדיין קיימים חסמים למעקב גנומי ב-LMICs, הגדלת ההשקעה בבניית נגישות ומומחיות גנומיות (למשל, Africa Pathogen Genomics Initiative [Africa PGI])64 מצביעה על כך שמצב זה ישתפר. מעקב גנומי הוא קריטי להיערכות למגיפה6, וניתן לבסס יכולת באמצעות רוטיניזציה של המעקב הגנומי אחר פתוגנים אנדמיים כגון RABV. פערים גלובליים ביכולות הריצוף שהודגשו במהלך מגיפת SARS-CoV-2 צריכים להיות מניע לשינוי קטליטי כדי לטפל באי-שוויון מבני זה.
תהליך עבודה זה של דגימה לרצף לפענוח עבור RABV, כולל כלים ביואינפורמטיים נגישים, הוא בעל פוטנציאל לשמש להנחיית אמצעי בקרה המכוונים ליעד של אפס מקרי מוות אנושיים מכלבת בתיווך כלבים עד 2030, ובסופו של דבר לחיסול וריאנטים של RABV. בשילוב עם מטא נתונים רלוונטיים, נתונים גנומיים המופקים מפרוטוקול זה מאפשרים אפיון RABV מהיר במהלך חקירות התפרצות ובזיהוי שושלות מסתובבות במדינה או באזור60,61,65. אנו ממחישים את הצינור שלנו בעיקר באמצעות דוגמאות מכלבת בתיווך כלבים; עם זאת, זרימת העבודה חלה ישירות על כלבת חיות בר. יכולת העברה זו ועלות נמוכה אלה ממזערות את האתגרים בהפיכת ריצוף שגרתי לזמין בקלות, לא רק עבור כלבת אלא גם עבור פתוגנים אחרים46,66,67, כדי לשפר את ניהול המחלה ובקרתה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי Wellcome [207569/Z/17/Z, 224670/Z/21/Z], מימון ניוטון מהמועצה למחקר רפואי [MR/R025649/1] ומחלקת המדע והטכנולוגיה של הפיליפינים (DOST), המאמץ הגלובלי למחקר וחדשנות בבריטניה בנושא COVID-19 [MR/V035444/1], קרן התמיכה האסטרטגית המוסדית של אוניברסיטת גלזגו [204820], פרס החוקר החדש של המועצה למחקר רפואי (KB) [MR/X002047/1], והקרן לפיתוח שותפות בינלאומית, מלגת DOST של המועצה הבריטית-פיליפינים (CB), מלגת GemVi של המכון הלאומי לחקר הבריאות [17/63/82] (GJ), ומלגות אוניברסיטת גלזגו מה- MVLS DTP (KC) [125638-06], EPSRC DTP (RD) [EP/T517896/1], וה- Wellcome IIB DTP (HF) [218518/Z/19/Z]. אנו אסירי תודה לעמיתים ולמשתפי פעולה שתמכו בעבודה זו: דניאל סטרייקר, אליס ברוס, אליזבת מירנדה, DVM, דריה מנלו, DVM, Thumbi Mwangi, קנדי לושאסי, צ'ארלס קאיוקי, ג'וד קרלו בוליבר, ג'רומיר בונדוק, אסטבן בלבין, רונל טונגוהן, אגתה אוקאנדה, דייוויס קוצ'אקה, מומבואה מוטונגה, לוויטיקו סיקנה ואנה צ'ופרינה.
Materials
| Name | Company | Catalog Number | Comments |
| Brand name | |||
| Software | |||
| Sequencing software (MinKnow) | Oxford Nanopore Technologies | https://community.nanoporetech.com/downloads | |
| Bioinformatics tool kit (Guppy) | Oxford Nanopore Technologies | https://community.nanoporetech.com/docs/prepare/library_prep_protocols/Guppy-protocol/v/gpb_2003_v1_revao_14dec2018 | |
| Equipment | |||
| Thermal cycler (miniPCR™ mini16 thermal cycler) | Cambio | MP-QP-1016-01 | |
| Homogenizer (Precellys Evolution Touch Homogenizer) | Bertin Instruments | EQ02520-300 | |
| Cold Racks (0.2-0.5mL) (PCR Mini-cooler with transparent lid) | BRAND | 781260 | |
| Pipettor | |||
| (Pipetman L Fixed F1000L, 1000 uL) | Gilson | SKU: FA10030 | |
| (Pipetman L Fixed F100L, 100 uL) | Gilson | SKU: FA10024 | |
| (Pipetman L Fixed F10L, 10 uL) | Gilson | SKU: FA10020 | |
| (Pipetman L Fixed F1L, 1 uL) | Gilson | SKU: FA10025 | |
| (Pipetman L Fixed F20L, 20 uL) | Gilson | SKU: FA10021 | |
| (Pipetman L Fixed F250L, 250 uL) | Gilson | SKU: FA10026 | |
| Fluorometer (Qubit 4 Fluorometer) | Thermofisher scientific/Fisher scientific | Q33238 | |
| Laptop (Any brand with ~2 GB of drive space, minimum of 512 GB storage space, msi installer [GPU]) | |||
| Microcentrifuge (Refrigerated centrifuge) | Thermofisher scientific/Fisher scientific | 75004081 | |
| Vortex mixer (Basic vortex mixer) | Thermofisher scientific/Fisher scientific | 88882011 | |
| Magnetic rack (DynaMag -2 Magnet) | Thermofisher scientific/Fisher scientific | 12321D | |
| Sequencing device (MinION) | Oxford Nanopore Technologies | MinION Mk1B | |
| RNA Extraction | |||
| RNA extraction kit (Qiagen RNEasy Mini Kit 250) | Qiagen | 74106 | |
| RNA stabilizing reagents | |||
| (RNA later) | Invitrogen | AM7020 | |
| (DNA/RNA Shield) | Zymo Research | R1100-50 | |
| PCR | |||
| Nuclease-free Water (Nuclease-free Water [not DEPC-treated]) | Thermofisher scientific/Fisher scientific | AM9937 | |
| Master mix for first strand cDNA synthesis (LunaScript RT SuperMix Kit) | New England Biolabs | E3010S | |
| DNA amplification master mix (Q5® Hot Start High-Fidelity 2X Master Mix [NEB]) | New England Biolabs | M0494L | |
| Primer (Scheme) (Custom DNA oligos) | Invitrogen | ||
| SPRI Bead Clean-up | |||
| SPRI beads (Aline Biosciences PCR Clean DX ) | Cambio | AL-AC1003-50 | |
| Ethanol, Pure Absolute, >99.8% (GC) [Riedel-De Haen] | Merck | 818760 | |
| Short Fragment buffer (SFB expansion pack) | Oxford Nanopore Technologies | EXP-SFB001 | |
| DNA Quantification | |||
| DNA quantification kit (Qubit® dsDNA HS Assay Kit) | Thermofisher scientific/Fisher scientific | Q32854 | |
| DNA quantification assay tubes (Qubit™ Assay Tubes) | Thermofisher scientific/Fisher scientific | Q32856 | |
| End Prep and barcoding (Qubit™ Assay Tubes) | |||
| End Prep master mix (NEBNext Ultra End Repair/dA-Tailing Module) | New England Biolabs | E7546L | |
| Barcoding kit | |||
| *Chemistry 9 | Oxford Nanopore Technologies | *Chemistry 9 | |
| (Native Barcoding Expansion 1-12) | EXP-NBD104 | ||
| (Native Barcoding Expansion 13-24) | EXP-NBD114 | ||
| (Native Barcoding Expansion 96) | EXP-NBD196 | ||
| *Chemistry 14 | Oxford Nanopore Technologies | *Chemistry 14 | |
| (not compatible) | (not compatible) | ||
| (Native Barcoding Kit 24 V14) | SQK-NBD114.24 | ||
| (Native Barcoding Kit 96 V14) | SQK-NBD114.96 | ||
| Ligation mastermix (Blunt/TA Ligase Master Mix) | New England Biolabs | M0367S | |
| Adapter Ligation | |||
| Adapter ligation master mix | |||
| (NEBNext Quick Ligation Module) | New England Biolabs | E6056S | |
| (NEBNext Ultra II Ligation Module) | New England Biolabs | E7595S | |
| (Blunt/TA Ligase Master Mix) | New England Biolabs | M0367S | |
| Adapter mix | |||
| *Chemistry 9 | Oxford Nanopore Technologies | *Chemistry 9 EXP-AMII001 | |
| (Adapter Mix II [AMII]) | |||
| *Chemistry 14 | Oxford Nanopore Technologies | *Chemistry 14 EXP-NBA114 | |
| (Native adapter [NA]) | |||
| Sequencing | |||
| Flowcell priming kit | |||
| *Chemistry 9 | Oxford Nanopore Technologies | *Chemistry 9 EXP-FLP002 | |
| (Flush Buffer [FB]) | |||
| (Flush Tether [FT]) | |||
| *Chemistry 14 | Oxford Nanopore Technologies | *Chemistry 14 EXP-FLP004 | |
| (Flow Cell Flush [FCF]) | |||
| (Flow Cell Tether [FCT]) | |||
| Ligation Sequencing Kit | |||
| *Chemistry 9 | Oxford Nanopore Technologies | *Chemistry 9 SQK-LSK109 | |
| Adapter Mix (Adapter Mix [AMX]) | |||
| Ligation Buffer (Ligation buffer [LNB]) | |||
| Short Fragment Buffer (Short Fragment buffer [SFB]) | |||
| Sequencing Buffer (Sequencing Buffer [SQB]) | |||
| Elution Buffer (Elution buffer [EB]) | |||
| Loading Beads (Loading Beads [LB]) | |||
| Sequencing Tether (Sequencing Tether [SQT]) | |||
| *Chemistry 14 | Oxford Nanopore Technologies | *Chemistry 14 SQK-LSK114 | |
| Adapter Mix (Ligation Adapter [LA]) | |||
| Ligation Buffer (Ligation buffer [LNB]) | |||
| Short Fragment Buffer (Short Fragment buffer [SFB]) | |||
| Sequencing Buffer (Sequencing Buffer [SB]) | |||
| Elution Buffer (Elution buffer [EB]) | |||
| Loading Beads (Loading Beads [LIB]) | |||
| Sequencing Tether (Flow Cell Tether [FCT]) | |||
| Library solution (Library solution [LIS]) | |||
| Flush buffer (Flow Cell Flush [FCF]) | |||
| Flow Cell | |||
| *Chemistry 9 | Oxford Nanopore Technologies | *Chemistry 9 FLO-MIN106D | |
| (Flow Cell [R9.4.1]) | |||
| *Chemistry 14 | Oxford Nanopore Technologies | *Chemistry 14 FLO-MIN114 | |
| (Flow Cell [R10.4.1]) | |||
| Flow Cell wash | |||
| Flowcell wash kit (Flow cell wash kit) | Oxford Nanopore Technologies | EXP-WSH004 | |
| Consummables | |||
| Surface decontaminant | |||
| (DNA Away Surface Decontaminant, Squeeze Bottle [Molecular Bio]) | Thermofisher scientific/Fisher scientific | 7010PK | |
| (RNase Away Surface Decontaminant, Bottle [Molecular Bio]) | Thermofisher scientific/Fisher scientific | 7002PK | |
| PCR 8-Tube Strip 0.2ml, individual cap (PCR 8-Tube Strip 0.2ml, with Individual attached Flat Caps, Sterile, DNAse/RNAse, Pyrogen Free,Natural [Greiner]) | Greiner | 608281 | |
| PCR Tube 0.2ml (PCR Tube 0.2ml, Natural [Domed Cap] Bagged in 500s, Non-Sterile [Greiner]) | Greiner | 671201 | |
| 1000µL Filter Tips (500) (Stacked 1000µL Filter Tips [500]) | Thermofisher scientific/Fisher scientific | 11977724 | |
| 100µL Filter Tips (1000) | Thermofisher scientific/Fisher scientific | 11947724 | |
| 10µL Filter Tips (1000) (Stacked 100µL Filter Tips [1000]) | Thermofisher scientific/Fisher scientific | 11907724 | |
| Reinforced tubes tubes (2ml) with screw caps and o-rings (Fisherbrand™ Bulk tubes) | Thermofisher scientific/Fisher scientific | 15545809 | |
| Microcentrifuge tube (1.5ml) (1.5 ml Eppendorf Tubes [500]) | Eppendorf | 1229888 | |
| DNA LoBind Tubes (1.5ml) (DNA LoBind Tubes) | Thermofisher scientific/Fisher scientific | 10051232 | |
| Cryobabies labels | |||
| Gloves (S/M/L) | |||
| Paper towel |
References
- Rupprecht, C. E. Rhabdoviruses: rabies virus. Medical Microbiology. , University of Texas Medical Branch. Galveston, TX. (1996).
- Rabies. World Health Organization. , Available from: https://www.who.int/news-room/fact-sheets/detail/rabies (2023).
- Health Organization, W. orld WHO Expert Consultation on Rabies: WHO TRS N°1012. World Health Organization. , Available from: https://www.who.int/publications-detail-redirect/WHO-TRS-1012 (2018).
- Benavides, J. A., et al. Defining new pathways to manage the ongoing emergence of bat rabies in Latin America. Viruses. 12 (9), 1002(2020).
- Hampson, K. Estimating the global burden of endemic canine rabies. PLoS Neglected Tropical Diseases. 9 (4), e0003709(2015).
- Global genomic surveillance strategy for pathogens with pandemic and epidemic potential, 2022-2032. World Health Organization. , Available from: https://www.who.int/publications-detail-redirect/978924004679 (2022).
- Tsai, K. J., et al. Emergence of a sylvatic enzootic formosan ferret badger-associated rabies in Taiwan and the geographical separation of two phylogenetic groups of rabies viruses. Veterinary Microbiology. 182, 28-34 (2016).
- Chiou, H. -Y., et al. Molecular characterization of cryptically circulating rabies virus from ferret badgers, Taiwan. Emerging Infectious Diseases. 20 (5), 790-798 (2014).
- Sabeta, C. T., Mansfield, K. L., McElhinney, L. M., Fooks, A. R., Nel, L. H. Molecular epidemiology of rabies in bat-eared foxes (Otocyon megalotis) in South Africa. Virus Research. 129 (1), 1-10 (2007).
- Scott, T. P. Complete genome and molecular epidemiological data infer the maintenance of rabies among kudu (Tragelaphus strepsiceros) in Namibia. PLoS One. 8 (3), e58739(2013).
- Lembo, T., et al. Exploring reservoir dynamics: a case study of rabies in the Serengeti ecosystem. The Journal of Applied Ecology. 45 (4), 1246-1257 (2008).
- Coetzee, P., Nel, L. H. Emerging epidemic dog rabies in coastal South Africa: a molecular epidemiological analysis. Virus Research. 126 (1-2), 186-195 (2007).
- Ou de Munnink, B. B. First molecular analysis of rabies virus in Qatar and clinical cases imported into Qatar, a case report. International Journal of Infectious Diseases. 96, 323-326 (2020).
- Smith, J., et al. Case report: Rapid ante-mortem diagnosis of a human case of rabies imported into the UK from the Philippines. Journal of Medical Virology. 69, 150-155 (2003).
- Mahardika, G. N. K., et al. Phylogenetic analysis and victim contact tracing of rabies virus from humans and dogs in Bali, Indonesia. Epidemiology and Infection. 142 (6), 1146-1154 (2014).
- Tohma, K., et al. Molecular and mathematical modeling analyses of inter-island transmission of rabies into a previously rabies-free island in the Philippines. Infection, Genetics and Evolution. 38, 22-28 (2016).
- Tohma, K., et al. Phylogeographic analysis of rabies viruses in the Philippines. Infection, Genetics and Evolution. 23, 86-94 (2014).
- Saito, M., et al. Genetic diversity and geographic distribution of genetically distinct rabies viruses in the Philippines. PLoS Neglected Tropical Diseases. 7 (4), e2144(2013).
- Biek, R., Henderson, J. C., Waller, L. A., Rupprecht, C. E., Real, L. A. A high-resolution genetic signature of demographic and spatial expansion in epizootic rabies virus. Proceedings of the National Academy of Sciences. 104 (19), 7993-7998 (2007).
- Reddy, G. B., et al. Molecular characterization of Indian rabies virus isolates by partial sequencing of nucleoprotein (N) and phosphoprotein (P) genes. Virus Genes. 43, 13-17 (2011).
- David, D., Dveres, N., Yakobson, B. A., Davidson, I. Emergence of dog rabies in the northern region of Israel. Epidemiology and Infection. 137 (4), 544-548 (2009).
- Benjathummarak, S. Molecular genetic characterization of rabies virus glycoprotein gene sequences from rabid dogs in Bangkok and neighboring provinces in Thailand, 2013-2014. Archives of Virology. 161 (5), 1261-1271 (2016).
- Denduangboripant, J., et al. Transmission dynamics of rabies virus in Thailand: implications for disease control. BMC Infectious Diseases. 5, 52(2005).
- Talbi, C., et al. Phylodynamics and human-mediated dispersal of a zoonotic virus. PLoS Pathogens. 6 (10), e1001166(2010).
- Bourhy, H., et al. Revealing the micro-scale signature of endemic zoonotic disease transmission in an African urban setting. PLoS Pathogens. 12 (4), e1005525(2016).
- Zinsstag, J., et al. Vaccination of dogs in an African city interrupts rabies transmission and reduces human exposure. Science Translational Medicine. 9 (421), (2017).
- Yakovleva, A., et al. Tracking SARS-COV-2 variants using Nanopore sequencing in Ukraine in 2021. Scientific Reports. 12, 15749(2022).
- Mannsverk, S., et al. SARS-CoV-2 variants of concern and spike protein mutational dynamics in a Swedish cohort during 2021, studied by Nanopore sequencing. Virology Journal. 19, 164(2022).
- Soufi, M., et al. Fast and easy nanopore sequencing workflow for rapid genetic testing of familial Hypercholesterolemia. Frontiers in Genetics. 13, 836231(2022).
- Cabibbe, A. M. Application of targeted next-generation sequencing assay on a portable sequencing platform for culture-free detection of drug-resistant tuberculosis from clinical samples. Journal of Clinical Microbiology. 58 (10), 00632(2020).
- Xu, Y., et al. Nanopore metagenomic sequencing of influenza virus directly from respiratory samples: diagnosis, drug resistance and nosocomial transmission, United Kingdom, 2018/19 influenza season. Euro Surveillance. 26 (27), 2000004(2021).
- Stubbs, S. C. B., et al. Assessment of a multiplex PCR and Nanopore-based method for dengue virus sequencing in Indonesia. Virology Journal. 17, 24(2020).
- Croville, G., et al. Rapid whole-genome based typing and surveillance of avipoxviruses using nanopore sequencing. Journal of Virological Methods. 261, 34-39 (2018).
- Theuns, S., et al. Nanopore sequencing as a revolutionary diagnostic tool for porcine viral enteric disease complexes identifies porcine kobuvirus as an important enteric virus. Scientific Reports. 8, 9830(2018).
- O'Donnell, V. K., et al. Rapid sequence-based characterization of African swine fever virus by use of the Oxford Nanopore MinION sequence sensing device and a companion analysis software tool. Journal of Clinical Microbiology. 58, 01104-01119 (2019).
- Brito, A. F. Global disparities in SARS-CoV-2 genomic surveillance. Nature Communications. 13, 7003(2022).
- ONT login/register. Oxford Nanopore Technology. , Available from: https://nanoporetech.com/login-register (2023).
- Software Downloads. Oxford Nanopore Technology. , Available from: https://community.nanoporetech.com/downloads (2023).
- GitHub. , Available from: https://github.com/ (2023).
- Brunker, K. Artic-rabv. , Available from: https://github.com/kirstyn/artic-rabv (2022).
- Campbell, K. MADDOG: Method for Assignment, Definition and Designation of Global Lineages. , Available from: https://github.com/KathrynCampbell/MADDOG (2022).
- Campbell, K. RABV-GLUE. Centre for Virus Research. , Available from: https://github.com/KathrynCampbell/MADDOG (2022).
- Itokawa, K., Sekizuka, T., Hashino, M., Tanaka, R., Kuroda, M. Disentangling primer interactions improves SARS-CoV-2 genome sequencing by multiplex tiling PCR. PLoS ONE. 15 (9), e0239403(2020).
- Davis, M. W., Jorgensen, E. M. ApE, A plasmid editor: A freely available DNA manipulation and visualization program. Frontiers in Bioinformatics. 2, 818619(2022).
- Döring, M., Pfeifer, N. openPrimeR: Multiplex PCR primer design and analysis. , (2023).
- Quick, J. Multiplex PCR method for MiniON and Illumina sequencing of Zika and other virus genomes directly from clinical samples. Nature Protocols. 12 (6), 1261-1276 (2017).
- Laboratory Techniques in Rabies. World Health Organization. 1, Available from: https://apps.who.int/iris/bitstream/handle/10665/310836/9789241515153-eng.pdf (2018).
- Lembo, T. Partners for Rabies Prevention. The blueprint for rabies prevention and control: a novel operational toolkit for rabies elimination. PLoS Neglected Tropical Diseases. 6 (2), e1388(2012).
- Terrestrial Manual Online Access. World Organization for Animal Health. , Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2023).
- Mauti, S. Field postmortem rabies rapid immunochromatographic diagnostic test for resource-limited settings with further molecular applications. Journal of Visualized Experiments. (160), e60008(2020).
- Patrick, E., et al. Enhanced rabies surveillance using a direct rapid immunohistochemical test. Journal of Visualized Experiments. (146), e59416(2019).
- Lembo, T., et al. Evaluation of a direct, rapid immunohistochemical test for rabies diagnosis. Emerging Infectious Diseases. 12 (2), 310-313 (2006).
- Marston, D. A., et al. Pan-lyssavirus real time RT-PCR for rabies diagnosis. Journal of Visualized Experiments. (149), e59709(2019).
- Brunker, K. DNA quantification using the Qubit fluorometer. , Available from: https://www.protocols.io/view/dna-quantification-using-the-qubit-fluorometer-bc6vize6 (2020).
- Quick, J. DNA quantification using the Quantus fluorometer. , Available from: https://www.protocols.io/view/dna-quantification-using-the-quantus-fluorometer-7pzhmp6 (2020).
- Guppy protocol. Nanopore Community. , Available from: https://community.nanoporetech.com/protocols/Guppy-protocol/v/gpb_2003_v1_revaq_14dec2018 (2023).
- Flow Cell Wash Kit (EXP-WSH004). Nanopore Community. , Available from: https://community.nanoporetech.com/protocols/flow-cell-wash-kit-exp-wsh004/v/wfc_9120_v1_revh_08dec2020 (2023).
- Core Pipeline - arctic pipeline. , Available from: https://artic.readthedocs.io/en/latest/minion/ (2023).
- Samtools. , Available from: https://www.htslib.org (2023).
- Campbell, K., et al. Making genomic surveillance deliver: A lineage classification and nomenclature system to inform rabies elimination. PLoS Pathogens. 18 (5), e1010023(2022).
- Brunker, K., et al. Rapid in-country sequencing of whole virus genomes to inform rabies elimination programmes. Wellcome Open Research. 5, 3(2020).
- Bull, R. A., et al. Analytical validity of nanopore sequencing for rapid SARS-CoV-2 genome analysis. Nature Communications. 11, 6272(2020).
- Okeke, I. N., Ihekweazu, C. The importance of molecular diagnostics for infectious diseases in low-resource settings. Nature Reviews. Microbiology. 19 (9), 547-548 (2021).
- Inzaule, S. C., Tessema, S. K., Kebede, Y., Ouma, A. E. O., Nkengasong, J. N. Genomic-informed pathogen surveillance in Africa: opportunities and challenges. The Lancet Infectious Diseases. 21 (9), 281-289 (2021).
- Kennedy, L. Integrating contact tracing and whole-genome sequencing to track the elimination of dog-mediated rabies: an observational and genomic study. eLife. , (2023).
- Pallerla, S. R. Diagnosis of pathogens causing bacterial meningitis using Nanopore sequencing in a resource-limited setting. Annals of Clinical Microbiology and Antimicrobials. 21, 39(2022).
- Quick, J. Real-time, portable genome sequencing for Ebola surveillance. Nature. 530 (7589), 228-232 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved