Method Article
הקלטה וניתוח של דינמיקה של אנסמבל עצבי רב-מודאלי בקנה מידה גדול במערך מיקרואלקטרודות בצפיפות גבוהה משולב CMOS
In This Article
Summary
כאן, אנו משתמשים ב- HD-MEA כדי להתעמק בדינמיקה חישובית של הרכבים עצביים בקנה מידה גדול, במיוחד בהיפוקמפוס, מעגלי פקעות ריח ורשתות נוירונים אנושיות. לכידת פעילות מרחבית-זמנית, בשילוב עם כלים חישוביים, מספקת תובנות לגבי מורכבות ההרכב העצבי. השיטה משפרת את ההבנה של תפקודי המוח, ועשויה לזהות סמנים ביולוגיים וטיפולים להפרעות נוירולוגיות.
Abstract
רשתות עצביות בקנה מידה גדול והמיקרו-מעגלים המבוזרים המורכבים שלהן חיוניים ליצירת תפיסה, קוגניציה והתנהגות הנובעות מדפוסים של פעילות עצבית מרחבית-זמנית. דפוסים דינמיים אלה הנובעים מקבוצות תפקודיות של הרכבים עצביים מקושרים מאפשרים חישובים מדויקים לעיבוד וקידוד מידע עצבי בקנה מידה רב, ובכך מניעים תפקודי מוח גבוהים יותר. כדי לחקור את העקרונות החישוביים של דינמיקה עצבית העומדת בבסיס מורכבות זו ולחקור את ההשפעה הרב-ממדית של תהליכים ביולוגיים בבריאות ובמחלות, הקלטות סימולטניות בקנה מידה גדול הפכו לאינסטרומנטליות. כאן, מערך מיקרואלקטרודות בצפיפות גבוהה (HD-MEA) משמש לחקר שתי שיטות של דינמיקה עצבית - מעגלי פקעות ההיפוקמפוס וחוש הריח מפרוסות מוח של עכבר ex-vivo ורשתות עצביות מתרביות תאים במבחנה של תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (iPSCs). פלטפורמת HD-MEA, עם 4096 מיקרואלקטרודות, מאפשרת הקלטות לא פולשניות, מרובות אתרים, נטולות תוויות של דפוסי ירי חוץ-תאיים מאלפי הרכבים עצביים בו זמנית ברזולוציה מרחבית-זמנית גבוהה. גישה זו מאפשרת אפיון של מספר תכונות אלקטרופיזיולוגיות ברחבי הרשת, כולל דפוסי פעילות דוקרנים יחידים/מרובי יחידות ותנודות פוטנציאליות בשדה המקומי. כדי לבחון נתונים עצביים רב-ממדיים אלה, פיתחנו מספר כלים חישוביים המשלבים אלגוריתמים של למידת מכונה, זיהוי וסיווג אירועים אוטומטיים, תורת הגרפים וניתוחים מתקדמים אחרים. על ידי השלמת צינורות חישוביים אלה עם פלטפורמה זו, אנו מספקים מתודולוגיה לחקר הדינמיקה הגדולה, הרב-ממדית והרב-מודאלית ממכלולי תאים לרשתות. זה עשוי לקדם את ההבנה שלנו של תפקודי מוח מורכבים ותהליכים קוגניטיביים בבריאות ובחולי. מחויבות למדע פתוח ותובנות לגבי דינמיקה עצבית חישובית בקנה מידה גדול יכולה לשפר מודלים בהשראת המוח, מחשוב נוירומורפי ואלגוריתמים של למידה עצבית. יתר על כן, הבנת המנגנונים הבסיסיים של חישובים עצביים לקויים בקנה מידה גדול ודינמיקת המיקרו-מעגלים המקושרים ביניהם עשויה להוביל לזיהוי סמנים ביולוגיים ספציפיים, ולסלול את הדרך לכלי אבחון מדויקים יותר ולטיפולים ממוקדים להפרעות נוירולוגיות.
Introduction
הרכבים עצביים, המכונים לעתים קרובות מכלולי תאים, הם מרכזיים בקידוד עצבי, ומאפשרים חישובים מורכבים לעיבודמידע עצבי בקנה מידה 1,2,3. הרכבים אלה עומדים בבסיס היווצרותן של רשתות נוירונים נרחבות והמיקרו-מעגלים הניואנסיים שלהן4. רשתות כאלה ודפוסי התנודה שלהן מניעים תפקודי מוח מתקדמים, כולל תפיסה וקוגניציה. בעוד מחקר מקיף בחן סוגים עצביים ספציפיים ומסלולים סינפטיים, הבנה עמוקה יותר של האופן שבו נוירונים יוצרים בשיתוף פעולה הרכבות תאים ומשפיעים על עיבוד מידע מרחבי-זמני בין מעגלים ורשתות נותרה חמקמקה5.
פרוסות מוח חריפות ואקס-ויו הן כלים אלקטרופיזיולוגיים מרכזיים לחקר מעגלים עצביים שלמים, המציעות סביבה מבוקרת לבדיקת דפוסי פעילות תנודתית של תפקוד עצבי, שידור סינפטי וקישוריות, עם השלכות בבדיקות פרמקולוגיות ובמודלים של מחלות 6,7,8. פרוטוקול מחקר זה מדגיש שני מעגלים מרכזיים במוח - ההיפוקמפוס-קליפת המוח (HC) המעורבת בתהליכי למידה וזיכרון 9,10, ופקעת הריח (OB) האחראית להבחנה בריח 11,12,13. בשני האזורים האלה, נוירונים תפקודיים חדשים נוצרים ברציפות על-ידי נוירוגנזה בוגרת לאורך כל החיים במוחות של יונקים14. שני המעגלים מדגימים דפוסי פעילות עצבית דינמית רב-ממדית ופלסטיות מובנית המשתתפים בחיווט מחדש של הרשת העצבית הקיימת ומאפשרים אסטרטגיות עיבוד מידע חלופיות בעת הצורך15,16.
מודלים חריפים של פרוסות מוח ex-vivo הם הכרחיים להתעמקות בתפקוד המוח ולהבנת מנגנוני מחלה ברמת המיקרו-מעגל. עם זאת, תרביות תאים חוץ-גופיות שמקורן ברשתות עצביות של תאי גזע פלוריפוטנטיים מושרים אנושיים (iPSCs) מציעות אפיק מבטיח של מחקר תרגומי, המקשר בצורה חלקה בין ממצאים מניסויים בבעלי חיים לטיפול קליני פוטנציאלי בבני אדם17,18. בדיקות מבחנה אלה הממוקדות בבני אדם משמשות פלטפורמה אמינה להערכת רעילות פרמקולוגית, מאפשרות סינון תרופות מדויק, ומקדמת מחקר באסטרטגיות טיפוליות חדשניות מבוססות תאים19,20. מתוך הכרה בתפקיד המרכזי של המודל העצבי iPSC, הקדשנו את המודול השלישי של מחקר פרוטוקול זה כדי לחקור ביסודיות את המאפיינים הפונקציונליים של הרשתות הנגזרות ממנו ולכוונן את פרוטוקולי תרביות התאים הקשורים.
מודולים עצביים אלקטרוגניים אלה נחקרו בדרך כלל באמצעות טכניקות כמו סידן (הדמיית Ca2+), רישומי מהדק טלאי ומערכי מיקרואלקטרודות בצפיפות נמוכה (LD-MEA). בעוד שהדמיית Ca2+ מציעה מיפוי פעילות של תא יחיד, זוהי שיטה מבוססת תיוג תאים המעוכבת על ידי הרזולוציה הטמפורלית הנמוכה שלה והאתגרים בהקלטות ארוכות טווח. LD-MEAs חסרים דיוק מרחבי, בעוד שמהדק טלאי, בהיותה טכניקה פולשנית באתר יחיד ומייגעת, מניבה לעתים קרובות שיעור הצלחה נמוך 21,22,23. כדי להתמודד עם אתגרים אלה ולחקור ביעילות פעילות ברחבי הרשת, הקלטות עצביות סימולטניות בקנה מידה גדול התפתחו כגישה מרכזית להבנת העקרונות החישוביים של דינמיקה עצבית העומדת בבסיס מורכבות המוח והשלכותיהם על בריאות ומחלות24,25.
בפרוטוקול JoVE זה, אנו מדגימים שיטת הקלטה עצבית בקנה מידה גדול המבוססת על MEA (HD-MEA) בצפיפות גבוהה ללכידת פעילות עצבית מרחבית-טמפורלית בשיטות מוח שונות, כולל מעגלי פקעות בהיפוקמפוס ובפקעות הריח מפרוסות חדות במוח עכבר ex-vivo (איורים 1A-C) ורשתות נוירונים אנושיות שמקורן במבחנה iPSC (איורים 1D-E), שדווחו בעבר על-ידי הקבוצה שלנו ועמיתים אחרים26,27,28,29,30,31,32,33,34,35. ה-HD-MEA, הבנוי על טכנולוגיית מוליכים למחצה (CMOS) משלימים של מתכת-תחמוצת-תחמוצת, מתגאה במעגלים חשמליים על שבב ובהגברה, המאפשרים הקלטות של תת-אלפיות השנייה על פני מערךשל 7 מ"מ בגודל2 בגודל 36. גישה לא פולשנית זו לוכדת דפוסי ירי חוץ-תאיים מרובי אתרים, נטולי תוויות, מאלפי הרכבים עצביים בו זמנית באמצעות 4096 מיקרואלקטרודות ברזולוציה מרחבית-טמפורלית גבוהה, וחושפת את הדינמיקה המורכבת של פוטנציאלי שדה מקומיים (LFPs) ופעילות דוקרנים רב-יחידתיים (MUA)26,29.
בהתחשב בהיקף הנתונים העצום שנוצר על ידי מתודולוגיה זו, מסגרת אנליטית מתוחכמת היא חיונית, אך מציבה אתגרים37. פיתחנו כלים חישוביים הכוללים זיהוי אירועים אוטומטי, סיווג, תורת הגרפים, למידת מכונה וטכניקות מתקדמות אחרות (איור 1F)26,29,38,39. בשילוב HD-MEA עם כלים אנליטיים אלה, פותחה גישה הוליסטית כדי לחקור את הדינמיקה המורכבת ממכלולי תאים בודדים לרשתות עצביות רחבות יותר על פני שיטות עצביות מגוונות. גישה משולבת זו מעמיקה את אחיזתנו בדינמיקה החישובית בתפקודי מוח נורמליים ומציעה תובנות לגבי אנומליות הקיימות בתנאים פתולוגיים28. יתר על כן, תובנות מגישה זו יכולות להניע התקדמות במודלים בהשראת המוח, מחשוב נוירומורפי ואלגוריתמים של למידה עצבית. בסופו של דבר, שיטה זו טומנת בחובה הבטחה בחשיפת מנגנוני הליבה מאחורי שיבושים ברשת העצבית, זיהוי פוטנציאלי של סמנים ביולוגיים, והנחיית יצירת כלי אבחון מדויקים וטיפולים ממוקדים למצבים נוירולוגיים.
Protocol
כל הניסויים בוצעו בהתאם לתקנות האירופיות והלאומיות הרלוונטיות (Tierschutzgesetz) ואושרו על ידי הרשות המקומית (Landesdirektion Sachsen; 25-5131/476/14).
1. פרוסות מוח Ex-vivo ממעגלי פקעות ההיפוקמפוס-קליפת המוח וחוש הריח ב-HD-MEA
- הכנת פתרונות חיתוך והקלטה ניסיוניים (איור 2A)
- ביום הניסוי, הכינו 0.5 ליטר של תמיסת חיתוך עתירת סוכרוז ו-1 ליטר של תמיסת רישום נוזל מוחי מלאכותי (aCSF) (טבלה 1A,B).
- הוסיפו את כל הכימיקלים המוצקים לצלוחית נפחית יבשה, ומלאו חלק מהדרך במים מזוקקים פעמיים (dd).
- הוסף MgCl2 ו- CaCl2 מתמיסות מלאי של 1 M, ולאחר מכן מלא את השאר במי DD. התחל לערבב ללא הרף עם מערבל מגנטי עד שהמוצקים הנראים לעין התמוססו ~ 5 דקות.
- השתמש באוסמומטר נקודת הקפאה כדי לאמת את האוסמולריות בין 350-360 mOsm עבור תמיסת חיתוך עתירת סוכרוז ו- 315-325 mOsm עבור פתרון ההקלטה aCSF.
- השתמש במד pH כדי לאמת את ה- pH בין 7.3-7.4 עבור תמיסת חיתוך סוכרוז גבוהה ו- 7.25-7.35 עבור פתרון ההקלטה aCSF. התחילו לבעבע ללא הרף עם 95% O2 ו-5% CO2.
- הניחו את תמיסת החיתוך עתירת הסוכרוז על קרח למשך 30 דקות לפחות לפני החיתוך והתחילו לבעבע ברציפות עם 95% O2 ו-5% CO2.
- לאחר 10 דקות של קרבוגנציה, ממלאים 50 מ"ל בתמיסת חיתוך 30 מ"ל ואחסנו אותה במקפיא (-20 מעלות צלזיוס) למשך 20-30 דקות או עד להקפאה חלקית.
הערה: יש להכין את כל הפתרונות טריים לכל ניסוי. מי dd המשמשים כאן הם מים אולטרה-טהורים אוטומטיים המאוחסנים בטמפרטורת החדר (RT). כמות הפתרון המוכן צריכה להיות מותאמת לשאלת המחקר הספציפית.
- ביום הניסוי, הכינו 0.5 ליטר של תמיסת חיתוך עתירת סוכרוז ו-1 ליטר של תמיסת רישום נוזל מוחי מלאכותי (aCSF) (טבלה 1A,B).
- הכנת אזורי עבודה של פרוסות מוח (איור 2A)
- הכניסו את החיה לחדר הניסויים.
הערה: בפרוטוקול זה, נקבות עכברים C57BL/J6 בגילאי 8-16 שבועות שימשו כמתואר קודם 26,29,32. יש לאפשר לבעל החיים להתאקלם לפחות 30 דקות לאחר ההובלה. יש להימנע מהעברות למרחקים ארוכים (כלומר, בין מכונים) באותו יום של הניסוי. הגיל, המין והזן של בעל החיים צריכים להיקבע על סמך שאלת המחקר הספציפית. - בזמן שבעל החיים מתאקלם והתמיסה עתירת הסוכרוז מתקררת, הניחו את הכלים הדרושים בכל סביבת עבודה ייעודית (ראו טבלת חומרים).
- הכינו סביבת עבודה לשחזור ותחזוקת פרוסות המוח. מלאו את תא השחזור של הפרוסה בתמיסת הקלטה קרבוגנית של aCSF והניחו את התא באמבט המים המוגדר לטמפרטורה של 32°C. שמור על קרבוגציה מתמשכת לאורך כל הניסוי.
- הכינו את סביבת העבודה להכנת פרוסת המוח. הגדרת הוויברטום - מקם את הלהב במחזיק להב הוויברטום וכייל את הוויברטום להגדרות הנכונות (מהירות תנועת להב: 0.20 מ"מ לשנייה, משרעת גובה: 95 מיקרומטר, זווית להב: 45°). מלאו את מגש הקרח של הוויברטום בקרח ואת מגש החיץ בתמיסת חיתוך עתירת סוכרוז והתחילו לקרבוגני את התמיסה במגש החיץ.
- הכינו את סביבת העבודה להכנת המוח. ממלאים את צלחת הפטרי מזכוכית 150 מ"מ בקרח ומניחים צלחת תרבית פלסטיק 90 מ"מ עם נייר פילטר בתוכה. מלאו את צלחת תרבית הפלסטיק בתמיסת חיתוך עתירת סוכרוז והתחילו בייצור קרבוגני. מוסיפים טיפת דבק סופר לצלחת הדגימה המצוננת ומחברים את תבנית האגרוז.
הערה: עובש אגרוז מוכן לפחות יום קודם עם 3% אגרוז במים בתבנית מוח עכבר בהתאמה אישית. - לבסוף, הכינו את סביבת העבודה של מיצוי המוח. כסו את רדיד האלומיניום בנייר טישו, שלפו בנפח 50 מ"ל המכילה תמיסת חיתוך עתירת סוכרוז והוסיפו איזופלורן לתא ההרדמה.
הערה: חומר הרדמה יתווסף לתא ההרדמה ~ דקה אחת לפני הנחת בעלי החיים. 50 מ"ל עם 30 מ"ל של סומק תמיסת חיתוך עתירת סוכרוז יוסר מהמקפיא של -20 מעלות צלזיוס ~ 2 דקות לפני עריפת הראש.
- הכניסו את החיה לחדר הניסויים.
- חילוץ וחיתוך מוח העכבר
הערה: יש לבצע את כל ההליך הזה מהר ככל האפשר כדי למנוע חוסר חמצון למוח. הסרת המוח צריכה לקחת רק 1-2 דקות מעריפת ראשים ועד טבילה בתמיסת חיתוך עתירת סוכרוז.- להרדים את בעל החיים עם המינון המתאים של isoflurane (0.5 מ"ל / 1 L תא הרדמה). לקבוע את עומק ההרדמה באמצעות צביטת כפה; אשר את היעדר רפלקס הנסיגה של כפות הרגליים לפני שתמשיך.
- העבירו את בעל החיים לנייר הטישו בסביבת העבודה של מיצוי המוח וערפו את ראשו בעזרת מספריים כירורגיים.
- הכניסו מספריים של הקשתית לגזע המוח ושמרו על המספריים התחתונים צמודים לקלווריה. חותכים לאורך תפר הקשת עד שמגיעים לתפר העטרה. מניחים את מספריים הקשתית בארובות העיניים וחותכים דרך התפר המטופי. השתמש במלקחיים מעוקלים כדי להזיז את הצדדים של calvaria למטה, לחשוף את המוח כולו.
הערה: היזהר הן עם המספריים הקשתית והן עם המלקחיים לא לנקב את המוח בעת חיתוך התפרים. - החלק את המוח עם הקצה הקהה של המלקחיים המעוקלים לתוך 50 מ"ל עם 30 מ"ל של תמיסת חיתוך סוכרוז גבוהה. תן לזה להישאר במשך 1 דקה.
- העבירו את המוח לצלחת תרבית פלסטיק בקוטר 90 מ"מ עם תמיסת חיתוך קרבוגנית מצוננת בסביבת העבודה להכנת המוח. לכוון את המוח למיקום בתבנית האגרוז.
- מוסיפים נקודה קטנה של דבק סופר לקצה הרוסטרלי של תבנית האגרוז. מניחים את המוח בתבנית עם המרית. ודא שהמוח ממוקם עם הצד הגבי כלפי מטה לחיתוך אופקי.
הערה: מיקום הדבק בתבנית ישתנה בהתאם לאזור העניין (ROI). עבור פרוסות היפוקמפוס-קליפת המוח (HC) ופקעת הריח (OB), ודא כי OB מיוצב ואת הצדדים של המוח להישאר ללא דבק. יותר מדי דבק ישפיע על איכות החיתוך ויגרום לקרעים במהלך חיתוך הוויברטום. - העבירו את לוחית הדגימה למגש החיץ, הזיזו את הלהב למקומו בזווית הנכונה והגדילו את גובה מגש החיץ כדי לקרב את הלהב ככל האפשר למוח.
- פורסים במהירות 0.20 מ"מ לשנייה 300 מיקרומטר מרווחים של רקמות HC ו-OB, ואז אוספים אותם לאחר כל חיתוך עגול עם פיפטה פסטר מזכוכית.
- השאירו את הפרוסות בתא ההתאוששות המלא ב-aCSF באמבט מים בטמפרטורה של 32°C למשך 45 דקות, ולאחר מכן שעה אחת ב-RT. ודאו שהפרוסות אינן חופפות וחשופות לחלוטין לתמיסה הקרבוגנית.
הערה: הקפד לשמור על קרבוגנציה רציפה של כל התמיסות וכל החדרים שהוזכרו המכילים את התמיסה. ניתן להשתמש בווסת לחץ כדי לשמור על קרבוגציה עקבית.
2. רשת עצבית אנושית מבוססת iPSC במבחנה על HD-MEA
הערה: כל תאי העצב iPSC ששימשו במחקר זה מתקבלים באופן מסחרי (ראה טבלת חומרים). תאים אנושיים אלה התמינו משורות תאי iPS יציבים שמקורם בדם היקפי אנושי או בפיברובלסטים.
- ציפוי של שבבי HD-MEA עבור תרביות תאי iPSC אנושיים במבחנה (איור 2B)
- הניחו את שבב ה-HD-MEA על פלטפורמת הקלטת הרכישה, מלאו את המאגר ב-PBS ובדקו את השבב לפני הציפוי. הפעל את תוכנת Brainwave. בחר קובץ > הפעלת הקלטה חדשה. הגדר את פרמטרי ההקלטה כך שיהיו בעלי תדר הקלטה של 50 הרץ ותדר דגימה של 18 קילוהרץ / אלקטרודה. שנה את הסטת המגבר כדי לכייל את השבב. עיין בטבלה 2 לקבלת עצות לפתרון בעיות.
הערה: הפרמטרים של תדירות ההקלטה ותדירות הדגימה תלויים בסוג הנתונים ובדרישות המערכת הבודדות. - עיקור ותנאי מראש HD-MEAs.
- מתחת למכסה המנוע, נגבו את השבב ואת טבעת הזכוכית עם טישו רטוב באתנול 96% (EtOH), ואז הכניסו כל מכשיר לצלחת פטרי סטרילית בגודל 100 מ"מ x 20 מ"מ ומלאו את מאגר MEA ב-70% EtOH למשך 20 דקות.
- שאפו את ה-EtOH ושטפו את המאגר במי dd סטריליים ומסוננים 3 פעמים. יש להוסיף 1 מ"ל של חומר למיזוג מקדים ולדגור למשך הלילה בטמפרטורה של 37°C ו-5% CO2.
הערה: אמצעי מיזוג מראש צריכים להיות תמיסה מבוססת מלח כדי להפוך את משטח HD-MEA להידרופילי יותר. זה יכול לכלול מדיה מלאה של BrainPhys (BP) שהוכנה בעבר (לא בת > 3 חודשים) (טבלאות 1C).
- מעיל HD-MEAs. למחרת, שאפו מדיה טרום התניה. יש להוסיף 1 מ"ל של 0.1 מ"ג/מ"ל פולי-DL-אורניתין (PDLO) כדי לצפות את כל האזור הפעיל. יש לדגור ב-37 מעלות צלזיוס למשך הלילה באינקובטור.
- הכן וחמם מדיה ל- RT. הפרוטוקולים כאן מנצלים תאי עצב iPSC אנושיים פונקציונליים משני מקורות מסחריים; לפיכך, רכיבי המדיה משתנים עבור כל ספק. פרוטוקול אחד מתואר ב (טבלאות 1C, D) .
- שאפו PDLO, שטפו 3 פעמים עם מי dd ותנו לשבבים להתייבש מתחת למכסה המנוע במשך 10 דקות.
- מלאו צלחת פטרי בגודל 35 מ"מ x 10 מ"מ במי dd סטריליים ומסוננים והניחו אותה לצד השבב כדי לשמור על לחות נאותה ולמנוע אידוי של תאי הזרעים בשלבים הבאים.
- הניחו את שבב ה-HD-MEA על פלטפורמת הקלטת הרכישה, מלאו את המאגר ב-PBS ובדקו את השבב לפני הציפוי. הפעל את תוכנת Brainwave. בחר קובץ > הפעלת הקלטה חדשה. הגדר את פרמטרי ההקלטה כך שיהיו בעלי תדר הקלטה של 50 הרץ ותדר דגימה של 18 קילוהרץ / אלקטרודה. שנה את הסטת המגבר כדי לכייל את השבב. עיין בטבלה 2 לקבלת עצות לפתרון בעיות.
- ציפוי ותחזוקה של תאי עצב iPSC אנושיים ב-HD-MEAs (איור 2B)
- הפשירו ודללו תאים לתאים הרצויים לריכוז מיקרוליטר (כלומר, 1000 תאים/מיקרוליטר כדי להשיג צפיפות תאים של 50,000 בירידה של 50 מיקרוליטר ב-HD-MEA) (טבלה 1C).
- פיפטה את תרחיף התא על פני השטח של האזור הפעיל של השבב באמצעות מדיה מנוקדת למינין גבוהה (טבלה 1D).
- יש לדגור בטמפרטורה של 37°C עם 5% CO2 למשך 45-60 דקות.
- מלא בעדינות 2 מ"ל של מדיה במאגר HD-MEA (טבלה 1C).
- בצע שינוי מדיה של 100% ביום הראשון (DIV1) לאחר הזריעה באמצעות מדיית RT (טבלה 1C). שנה 50% מהמדיה כל 3-4 ימים. שמור על HD-MEAs מודגרים ב 37 ° C עם 5% CO2 לאורך כל הניסוי.
הערה: פיפטה בעדינות כדי למנוע עקירה של התאים. בדוק את צבע המדיה עבור כל זיהום. המרווח והכמות של שינוי המדיה יכולים להיקבע על ידי שאלות מחקר בודדות או צרכים/מפרטים של התא. - אופציונלי: בדוק את התקדמות צמיחת תרבית התאים בין DIV4-DIV8 תחת מיקרוסקופ ניגודיות דיפרנציאלית זקופה (DIC) לאחר ניקוי השלב עם >70% EtOH.
3. הקלטות עצביות בקנה מידה גדול Ex-vivo ו - in-vitro עם HD-MEAs
- הכנת סביבת עבודה להקלטת פרוסות מוח (איור 2A)
- בזמן שפרוסות המוח מתאוששות, מקמו את הכלים הדרושים בכל סביבת עבודה ייעודית (ראו טבלת חומרים).
הערה: הגדרת המערכת הראשית חייבת להיות ממוטבת ונבדקת הרבה לפני יום הניסוי של פרוסת המוח. מערכת הזילוח (קווי כניסה, קווי יציאת משאבה, צינורות והארקה) צריכה להיבדק עם PBS או aCSF ו- HD-MEA בפלטפורמת ההקלטה כדי להבטיח אות נקי, יחס אות רעש מוגבר והיעדר רעש זילוח. - צפה את שבב HD-MEA ב-0.1 מ"ג/מ"ל PDLO כדי לשפר את צימוד רקמות-שבב ולדגור ב-37°C למשך 20 דקות.
- במהלך הדגירה של השבב, מלא את מערכת הזילוח מבוססת הכבידה ואת הקווים עם הקלטת aCSF. להבטיח קרבוגנציה מתמשכת של מערכת הזלוף. הגדר קצב זרימה של 4.5 מ"ל/דקה וטמפרטורה של 37°C.
- מקם את שבב HD-MEA בפלטפורמת הקלטת הרכישה, מלא את המאגר ב- aCSF, בדוק את מערכת הזילוח ופתור כל רעשי המערכת שנותרו.
- הפעל את תוכנת Brainwave. בחר קובץ > הפעלת הקלטה חדשה. הגדר את פרמטרי ההקלטה לתדר הקלטה של 1 הרץ ותדר דגימה של 14 קילוהרץ / אלקטרודה. שנה את הסטת המגבר כדי לכייל את השבב. עיין בטבלה 2 לקבלת עצות לפתרון בעיות.
הערה: הפרמטרים של תדירות ההקלטה ותדירות הדגימה תלויים בסוג הנתונים ובדרישות המערכת הבודדות.
- הפעל את תוכנת Brainwave. בחר קובץ > הפעלת הקלטה חדשה. הגדר את פרמטרי ההקלטה לתדר הקלטה של 1 הרץ ותדר דגימה של 14 קילוהרץ / אלקטרודה. שנה את הסטת המגבר כדי לכייל את השבב. עיין בטבלה 2 לקבלת עצות לפתרון בעיות.
- ודאו שאזור ההקלטה חשוך באמצעות מערכת תאורה בחדר או כלוב מוצל על השולחן האופטי.
- יישר את המיקרוסקופ הסטריאוסקופי עם מאגר שבבי HD-MEA והאזור הפעיל לרכישת תמונה.
- מקם את העוגן במאגר השבבים כדי לאזן.
הערה: Anchor הוא נבל פלטינה בהתאמה אישית עם חוטים מינימליים לקידום חמצון; עם זאת, כמה מסחריים זמינים. - הוסף תרכובות פרמקולוגיות לצינורות הזילוח המתאימים.
הערה: בפרוטוקול זה, הן הקלטות ספונטניות והן 100 μM 4-aminopyridine (4-AP) המושרה פרמקולוגית התקבלו כפי שתואר קודם לכן. ניתן להתאים תרכובות פרמקולוגיות לשאלת המחקר הספציפית. - בסביבת העבודה להכנת פרוסת המוח, מניחים צלחת תרבית פלסטיק חדשה בקוטר 90 מ"מ בתוך צלחת פטרי מזכוכית בקוטר 150 מ"מ. הוסף aCSF והתחל carbogenating.
- בזמן שפרוסות המוח מתאוששות, מקמו את הכלים הדרושים בכל סביבת עבודה ייעודית (ראו טבלת חומרים).
- הקלטות מעגליות מפרוסות HC ו-OB באמצעות HD-MEAs
הערה: יש לבצע צימוד פרוסות במהירות האפשרית כדי למנוע חוסר חמצון לפרוסה. הצימוד צריך לקחת רק ~ 1 דקות מהמיקום הראשוני של פרוסת microdissected על האזור הפעיל שבב לאתחול מערכת זילוח הסופי.- מוציאים את הפרוסה מתא השחזור של פרוסת המוח בעזרת פיפטה מזכוכית ומניחים אותה בכלי תרבית פלסטיק 90 מ"מ עם קרבוגנציה מתמשכת. באמצעות כלי microdissection, לבודד את HC או OB מרקמת פרוסת המוח שמסביב.
- העבר את פרוסות HC או OB חריפות מבודדות עם פיפטה זכוכית לתוך מאגר HD-MEA. יישרו בעדינות את הפרוסה על האזור הפעיל באזור MEA בעזרת מברשת עדינה. למצוץ את כל הפתרונות משבב HD-MEA היטב עם מערכת שאיפה.
- מניחים את העוגן בעדינות על גבי הפרוסה בעזרת מלקחיים.
הערה: יש למקם את העוגן ללא תנועת פרוסה כדי למנוע אובדן צימוד. - הוסף בעדינות פתרון למאגר השבבים והפעל את מערכת הזילוח.
הערה: ודא זרימה למינרית מכניסת הזילוח ומשקע המשאבה לקבלת פרמטרי הקלטה מיטביים. - ודא שאזור ההקלטה מעומעם כראוי דרך מערכת התאורה בחדר או עם כלוב מוצל על שולחן אופטי.
- תנו לפרוסה להתאקלם במשך 10 דקות לפני תחילת ההקלטות או אפנון פרמקולוגי נוסף.
- הפעל את תוכנת Brainwave. בחר קובץ > הפעלת הקלטה חדשה. הגדר את פרמטרי ההקלטה לתדר הקלטה של 1 הרץ ותדר דגימה של 14 קילוהרץ / אלקטרודה. שנה את הסטת המגבר כדי לכייל את השבב.
הערה: כפי שצוין קודם לכן בסעיף 3.1.4.1, בעת ביצוע בדיקות מערכת, הקפד להחיל את אותם פרמטרי הקלטה. - הקש Record כדי להתחיל את הרכישה עם תנאי הניסוי שנקבעו מראש.
- מיד לאחר ההקלטה הסופית, צלם הדמיית אור של פרוסת המוח החריפה. החזירו את הפרוסה לתא שחזור הפרוסה, הסירו את כל החומר האורגני שהוצמד לשבב בעזרת מברשת והמשיכו לפרוסה הבאה. נקה את מכשירי HD-MEA כמתואר בסעיף 3.4.
- הכנת סביבת עבודה של הקלטת iPSC אנושית והקלטות ברחבי הרשת ב-HD-MEA (איור 2B)
הערה: שנה מדיה יום לפני ההקלטה או מיד לאחר הקלטת iPSC אנושית (טבלה 1C). במחקרים שהשתמשו בנוירונים פונקציונליים, המדיה השתנתה כל 4 ימים, וב-4, 8, 16 ו-24 DIV המדיה משתנה מיד לאחר הקלטות iPSC.- הבטח סביבת עבודה סטרילית על ידי ניקוי פלטפורמת הרכישה HD-MEA עם >70% EtOH.
- הניחו בעדינות מכסה בסיס פולידימתילסילוקסאן (PDMS) עם התייחסות לטבעת HD-MEA מתחת למכסה המנוע. העבר את שבב ה- HD-MEA לסביבת העבודה של הקלטת iPSC וחבר את שבב ה- HD-MEA לפלטפורמת הרכישה.
- ודא שאזור ההקלטה מעומעם כראוי באמצעות מערכת תאורה בחדר או כלוב מוצל על שולחן אופטי.
- אפשר לשבב HD-MEA להתאזן למשך 10 דקות לפני תחילת ההקלטות או אפנון פרמקולוגי נוסף.
- הפעל את תוכנת Brainwave. בחר קובץ > הפעלת הקלטה חדשה. הגדר את פרמטרי ההקלטה כך שיהיו בעלי תדר הקלטה של 50 הרץ ותדר דגימה של 18 קילוהרץ / אלקטרודה. שנה את הסטת המגבר כדי לכייל את השבב.
הערה: כפי שצוין קודם לכן בסעיף 2.1.1, בעת ביצוע בדיקת מערכת לפני ציפוי וציפוי, הקפד ליישם את אותם פרמטרי הקלטה. - תעד את פעילות הירי הספונטנית או את התגובות המושרות פרמקולוגית מרשת iPSC האנושית בכל יום של תוכנית הניסוי (כלומר, 4, 8, 16, 24 DIVs).
הערה: אין לאפשר לשבב להישאר מחוץ לאינקובטור למשך >30 דקות כדי לשמור על טמפרטורה ולחות יציבות ולמנוע זעזוע טמפרטורה לתאים. - דגרו על HD-MEAs בטמפרטורה של 37°C עם 5%CO2 במהלך הניסוי.
- לאחר השלמת הניסוי, תקן את הרשת העצבית על שבבים וכתם לצורך הדמיה אופטית נוספת או נקה את HD-MEAs ישירות, כמתואר בשלב 3.4.
- ניקוי שבבי HD-MEA
- לאחר הניסוי, יש להשליך את התמיסה בהתאם לסילוק פסולת נכון ולשטוף במי dd.
- מוסיפים את חומר הניקוי הנבחר, מנקים את האזור הפעיל ואת כל המיכל בעזרת Q-tip ומשליכים את חומר הניקוי. מלאו בחומר ניקוי, דגרו במשך 20 דקות ולאחר מכן השליכו את חומר הניקוי.
- יש לשטוף היטב במים באיכות מעבדה. לאחר מכן, שטפו 3-4 פעמים עם מים DD.
- השתמש בלחץ אוויר כדי לייבש היטב את שבב HD-MEA.
4. ניתוח הקלטות עצביות בקנה מידה גדול מ- HD-MEAs
הערה: בעוד שלב 4.1 הוא ספציפי לתוכנת Brainwave, ניתן לשנות את שלב 4.2 בהתבסס על סוג התקן HD-MEA הזמין מסחרית של כל משתמש.
- עיבוד מקדים של נתונים גולמיים וזיהוי אירועים
- פתח קובץ נתונים גולמיים מוקלטים ( .brw) בתוכנת Brainwave. בחר ניתוח > זיהוי LFP או זיהוי ספייק.
הערה: LFP Detection משתמש בסינון IIR עם מסנן Butterworthמסדר 4 במעבר נמוך (1-100 הרץ). אלגוריתמי סף קשיחים כוללים סף גבוה של 150 μV, סף נמוך של -150 μV, חלון אנרגיה בין 70-120 מילישניות, תקופה עקשנית של 10 מילישניות, ומשך אירוע מקסימלי של 1 שניות. Single and MUA Spike Detection משתמש בסינון IIR עם מסנן Butterworthמסדר 4 בעל מעבר גבוה (300-3500 הרץ). אלגוריתם PTSD מוחל עם מקדם סטיית תקן של 8, תקופת חיי שיא של 2 אלפיות השנייה, ותקופה עקשנית של 1 אלפיות השנייה. - עבור הקלטות מעגלים HC ו- OB, הוסף את האפשרות Advanced Workspace בקובץ האירועים שזוהה ( .bxr) כדי לייבא את תמונת האור המבני שצולמה מהסטריאומיקרוסקופ. בעת בחינת מעגלי HC בקנה מידה גדול, צור שכבות מבניות המכילות את הבליטה המשוננת (DG), הילוס, Cornu Ammonis 1 (CA1), Cornu Ammonis 3 (CA3), קליפת המוח האנטורינלית (EC) וקליפת המוח הפרירינלית (PC). בעת בחינת מעגלי OB בקנה מידה גדול, צור שכבות מבניות המכילות את שכבת עצב הריח (ONL), שכבה גלומרולרית (GL), שכבת פרספקס חיצונית (EPL), שכבת תאים מיטרליים (MCL) ושכבת תאי גרגיר (GCL). חשבו על EPL ו-MCL כשכבת הקרנה (PL), כולל קליפת הריח (OCx).
- פתח קובץ נתונים גולמיים מוקלטים ( .brw) בתוכנת Brainwave. בחר ניתוח > זיהוי LFP או זיהוי ספייק.
- עיבוד נתונים עם צינור חישובי מותאם אישית של Python
- Denoising
- קרא קובץ .bxr באמצעות סקריפט Python מותאם אישית 26,29,32 וחבילת python h5py 3.6.0.
- חלץ רכבות ספייק הנוגעות להקלטות רשת iPSC ורכבות אירועי LFP הנוגעות להקלטות מעגלי פרוסת המוח HC ו- OB.
- לאפיין אירועים עם מספר כולל של אלקטרודות פעילות פחות מ-0.1% או 10% מהאלקטרודות הפעילות הממוצעות לאירוע ממוצע או אירועים שזוהו מחוץ לטווח קצב ירי סביר סטטיסטית כאירועים אקראיים ולהסיר אותם. בנוסף, החל ערכי סף של משרעת ומשך אירוע.
הערה: עבור טווח קצב הירי, 0.1-15 קוצים לשנייה ו- 0.1-60 אירועי LFP לדקה נחשבים. אלה הם ערכי סף קצב לדוגמה המשמשים עבור ערכות הנתונים שנותחו. ספי הקצב, המשרעת ומשך הזמן יהיו תלויים בנתונים בודדים. - שמור את נתוני רכבת האירועים המתקבלים עם המידע המרחבי-זמני הנלווה בתבנית הקובץ .npy.
- רסטרגרם
- קרא קבצי .npy ו- .bxr של אירועים מסוננים וצור תרשים רסטר באמצעות הפונקציה Matplotlib pyplot (https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html).
- בנוסף, עבור הקלטות של פרוסות מוח עם ספציפיות שכבות, מיין וקבץ את מזהי האלקטרודות בהתבסס על השכבות שהופקו בשלב 4.1.2.
- ממוצע פעילות ירי
- עבד את נתוני סדרות הזמן מקובץ .bxr, תוך חישוב קצב הירי הממוצע של כל אלקטרודה (מספר אירועים/זמן הקלטה).
- בנה מטריצת נתונים שבה השורות והעמודות מייצגות את הקואורדינטות של אלקטרודות במערך HD-MEA 64 x 64, כאשר כל ערך מטריצה מציין את קצב הירי הממוצע.
- השתמש בספריית תכנון כגון imshow של Matplotlib או פונקציות מפת חום של Seaborn בפייתון.
- השתמש במפת הצבעים 'חמה' כאן, וצור מפת חום אינפורמטיבית המתמצתת חזותית את ההתפלגות המרחבית של קצבי ירי ממוצעים על פני מערך האלקטרודות.
- עקבות צורת גל מייצגות
- קרא נתוני סידרת זמן מקובץ .brw וצור מעקב אחר צורת גל באמצעות הפונקציה Matplotlib pyplot. (https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html).
- הזן את מזהה האלקטרודה הרצוי, סל הזמן ופס התדרים הרצוי לקבלת מעקב צורת גל מייצגת. תחומי התדרים שהוגדרו בניתוחים אלה כוללים תנודות LFP בתדר נמוך (1-100 הרץ) עם פסי תדרים מסוננים δ, θ, β ו-γ פסי פסים; אדוות גל חד (SWR) (140-220 הרץ); וסינגל בתדר גבוה ו- MUA (300-3500 הרץ). תחומי התדרים δ, θ, β ו-γ הם 1-4 הרץ, 5-12 הרץ, 13-35 הרץ ו-35-100 הרץ בהתאמה.
- צפיפות ספקטרלית של הספק
- קרא את נתוני סדרות הזמן מקובץ .brw וחשב את הפריודוגרמות כדי להבחין בתדרים הדומיננטיים העומדים בבסיס הפעילות התנודתית בתוך כל סדרת זמן.
- בניית ספקטוגרמות פסאודו-צבעים של דינמיקת תדר-זמן.
הערה: ספקטרום מחושב בשיטה של וולש על ידי שימוש בהתמרת פורייה מהירה של LFPs מוקלטים כדי להעריך צפיפות הספק ספקטרלית41. - הזן את מזהה האלקטרודה הרצוי, סל הזמן ופס התדרים הרצוי לקבלת מפת צפיפות ספקטרלית. פסי התדרים שהוגדרו בניתוחים אלה כוללים את אלה המתוארים בשלב 4.2.4.
- קישוריות פונקציונלית
- עבור הקלטות של מעגלי פרוסות מוח, בצע את השלבים 4.2.6.2-4.2.6.4.
- קרא נתוני סדרות זמן מקובץ .brw וחשב את השונות הצולבת בין זוגות אלקטרודות פעילות במערך 64 x 64 תוך שימוש במקדם המתאם של פירסון (PCC)42.
- התאמת מודל אוטורגרסיבי וקטורי לסדרת הזמן באמצעות סיבתיות גריינג'ר רב-משתנית כדי לכמת את ההשפעה של סדרת זמן אחת על אחרת.
- החל פונקציית העברה מכוונת (DTF) כדי להעריך זרימת מידע כיוונית בתוך הקישורים המתואמים.
הערה: קישוריות פונקציונלית ברשת הרב-שכבתית נוצרת על-ידי קביעת סף ערך מתאם המבוסס על ערכי מעל הממוצע ושתי סטיות תקן של כל ערכי השונות הצולבת43,44. - להקלטת iPSC, בצע את השלבים 4.2.6.6-4.2.6.8.
- קרא נתוני spiketrains מקובץ .bxr וחשב מטריצה של 64x64 של מקדמי מתאם PCC בין כל הצירופים של רכבות ספייק קשורות באמצעות פונקציות spike_train_correlation (https://elephant.readthedocs.io/en/v0.7.0/reference/spike_train_correlation.html).
הערה: קישוריות פונקציונלית ברשת הרב-שכבתית נוצרת על-ידי קביעת סף ערך מתאם המבוסס על ערכי מעל הממוצע ושתי סטיות תקן של כל ערכי השונות הצולבת. - יתר על כן, יישום הליכי סינון מסננים מרחביים-זמניים (STF) וספי השהיה תלויי מרחק (DdLT) במטריצת הקישוריות כדי למנוע חיבורים זוגיים פוטנציאליים החורגים ממהירות ההתפשטות המרבית (המוגדרת ל- 400 מ"מ לשנייה)45.
- חלץ שיאים שליליים ממטריצות מתאמים צולבים שנוצרו כתוצאה מכך באמצעות פעולות סינון וסף כדי לזהות את הקשרים המעכבים באמצעות אלגוריתם היסטוגרמה מסונן ומנורמל של מתאם צולב (FNCCH)45.
- המר כל מטריצת קישוריות לקובץ גרף דינמי ( .gexf).
- מפות קישוריות רשת
- מעבדת נתונים פתוחה בתוכנית Gephi גרסה 9.2 (https://gephi.org) עבור הגרף הדינמי להתוות סלי זמן ספציפיים.
- החל פריסה גיאוגרפית בחלון הפריסה למיפוי מרחבי.
- מקם אילוצי פרמטרים על טווח מעלות ומשקל קצה לצורך השוואה.
- הקצה צבע נודאלי, גודל קצה וגודל תואר לתצוגה חזותית טובה יותר.
- Denoising
תוצאות
מיפוי מרחבי-זמני רב-מודלי וחילוץ של תכונות ירי מתנודדות
כדי לכמת אירועי LFP וספייק ברחבי הרשת שהופיעו מהרכבים עצביים דינמיים, חקרנו דפוסי ירי סינכרוניים בקנה מידה גדול במעגלי HC ו-OB וברשתות iPSC אנושיות. מעגלי פרוסת מוח מוקלטים משלב 3.2 ורשתות iPSC מוקלטות משלב 3.3 נותחו בהתאם לשלבים 4.1-4.2 של הפרוטוקול. ראשית, זיהוי אירועים וזיהוי בוצעו עבור כל מערכי הנתונים המוקלטים ונפתרו באופן אזורי בהתאם למפרטי המעגלים. לאחר מכן, שורטטו מיפוי מרחבי פסאודו-צבעוני טופוגרפי של תבניות ירי LFP וספייק בקנה מידה גדול, רסטרגרמות של אירועים שזוהו ועקבות מייצגות של 5-s של צורות גל מסוננות (איורים 3 A-I). מיפוי פסאודו-צבעוני טופוגרפי של תבניות LFP בקנה מידה גדול וקצב ירי ספייק הונחו על התמונות האופטיות שצולמו במיקרוסקופ בהתאמה של HC (איור 3A), OB (איור 3B) ורשת תאי עצב iPSC אנושית (איור 3C). זה מאפשר חקירה של מעגלים בודדים ודפוסי תנודה מבוססי רשת ותגובות. רסטרגרמות HC ו-OB מכילות ספירות אירועי LFP שזוהו ממוינות על פני שכבות DG, Hilus, CA3, CA1, EC ו-PC של מעגל HC ושכבות ONL, OCx, GL, PL ו-GCL של רשת OB על פני סל זמן של 60 שניות (איורים 3D,E). רסטרגרם iPSC אנושי מציג אירועי ספייק סינכרוניים שזוהו ברשת התרבית המחוברת על פני סל זמן של 20 שניות (איור 3G). לאחר מכן, עקבות אירועים מייצגים של 5s מאתרי הקלטה בקנה מידה גדול של HD-MEA מראים טווח של תדרי תנודה מוקלטים במעגלים HC (כלומר, אלקטרודה נבחרת ב-CA3) (איור 3G) ו-OB (כלומר, אלקטרודה נבחרת ב-GL) (איור 3H) ופעילות מתפרצת ספייק רב-יחידתית ברשת iPSC האנושית מארבע אלקטרודות פעילות נבחרות במערך (איור 3I)). אותות מופתיים אלה מראים חתימות של אותות ביולוגיים, כולל תנודות LFP בתדר נמוך (1-100 הרץ) עם פסי פסים מסוננים δ, θ, β ו-γ תדרים; אדוות גל חד (SWR) (140-220 הרץ); וסינגל בתדר גבוה ו- MUA (300-3500 הרץ). לבסוף, נעשה שימוש בניתוח צפיפות ספקטרלית של הספק (PSD) כדי לכמת בו-זמנית את עוצמת העוצמה של פס תנודה מסוים במעגל HC ו-OB המחוברים זה לזה שנרשם מ-HD-MEA (איורים 3J,K).
קונקטום פונקציונלי רב-מודאלי ברחבי הרשת
כדי להסיק את הקישוריות בקנה מידה גדול של רשתות עצביות רב-שכבתיות מדפוסי ירי בו זמנית של הרכבים עצביים פעילים בו-זמנית, השונות הצולבת בין זוגות אלקטרודות פעילות באירועים שזוהו חושבה על פי שלב 4.2.6 של הפרוטוקול. כאן, מקדם המתאם מוין על בסיס שכבות במעגל HC ו- OB או לא ממוין ברשת iPSC ולאחר מכן מאוחסן במטריצה סימטרית. קונקטומים פונקציונליים של מעגלי HC ו-OB נוצרו על ידי יישום סיבתיות גריינג'ר רב-משתנית ופונקציית העברה מכוונת (DTF) כדי לכמת את ההשפעה של סדרת זמן אחת על אחרת ולהעריך את זרימת המידע הכיוונית בתוך הקשרים המתואמים ברשתות הנפרדות. מיפוי קונקטום של HC (איור 4A) ו-OB (איור 4B) והדמיית רשת בוצעו באמצעות תוכנת Gephi גרסה 9.2 (https://gephi.org). אילוצי פרמטרים דומים הוטלו על הקישורים הפונקציונליים כדי להשוות את מעגלי פרוסת המוח HC ו- OB והמחישו 100 שניות של הקישוריות התפקודית של אירועי LFP שזוהו. גודל הצמתים משתנה בהתאם לחוזק הדרגה, כאשר צבע הקשרית מציין צבע שכבה וקישור המזהה את הקשרים התוך-שכבתיים והבין-שכבתיים. קונקטום פונקציונלי של רשתות iPSC אנושיות נוצר על ידי החלת מסננים מרחביים-זמניים (STF) וספי השהיה תלויי מרחק (DdLT) כדי לשפר את הבחירה של קישורים משמעותיים ולחדד את הזיהוי של קשרים משמעותיים על ידי יישום ניתוח היסטוגרמה מסוננת ומנורמלת של מתאם צולב (FNCCH). מיפוי קונקטום של רשתות iPSC אנושיות על כל התצוגה החזותית של שבב HD-MEA (איור 4C) שבוצעה באמצעות Gephi. צבע נודאלי מציין קלט מעורר או מעכב, וצבע קישור מזהה קשרים.
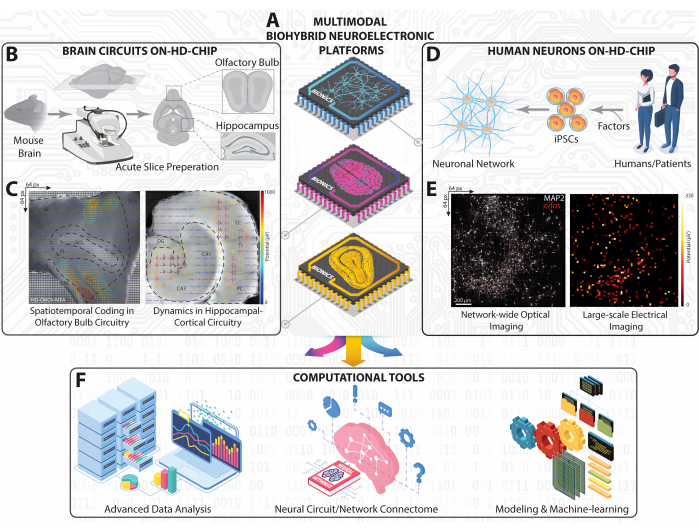
איור 1: סקירה כללית של הפלטפורמה הניסויית והחישובית ב-HD-MEA בקנה מידה גדול. (A) ייצוג סכמטי איזומטרי של הפלטפורמות הנוירו-אלקטרוניות הביו-היברידיות הרב-מודאליות שלנו, שמומשו באמצעות HD-MEA מבוסס CMOS, כדי ללכוד דינמיקה עצבית ממעגלים עצביים ורשתות של HC, OB ו-iPSC אנושיים. (B) זרימת עבודה סכמטית עבור חיתוך מוח עכבר ונוף העבודה שלו להשגת פרוסות HC ו- OB. (C) ייצוגים טופוגרפיים של תבניות הירי בקנה מידה גדול שתועדו בו זמנית מכל פרוסות HC ו-OB המונחות על גבי צורות הגל החוץ-תאיות שחולצו לתמונות האופטיות של הפרוסה. (D) ייצוג סכמטי של רשת עצבית iPSC המתקבלת מבני אדם. (E) מיקרוגרפים פלואורסצנטיים המראים c-fos תאי ו-MAP-2 סומטי/דנדריטי של כל הרשת העצבית האנושית על שבב HD-MEA (משמאל) תואמים לכל מפת פעילות הירי הממוצעת (מימין). (F) מסגרת חישובית הכוללת ניתוח נתונים מתקדם, מיפוי קישוריות וכלי AI-Machine Learning לניתוח נתונים עצביים רב-ממדיים המתקבלים מהקלטות בקנה מידה גדול ב-HD-MEAs. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: פריסות עבור פרוסות מוח ex-vivo וסביבות עבודה של תרבית iPSC אנושית במבחנה . (A) זרימת עבודה סכמטית הממחישה את ההתקנה להכנת פרוסות HC ו- OB, הכוללת את הכלים והציוד הדרושים בכל סביבת עבודה. (B) ייצוג סכמטי להכנת תרבית iPSC אנושית, כולל הכלים והמכשירים הדרושים. רשימה מלאה של חומרים כלולה בשלבים 1.2.2, 2.1, 2.2, 3.1.1, 3.3 ובטבלת החומרים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
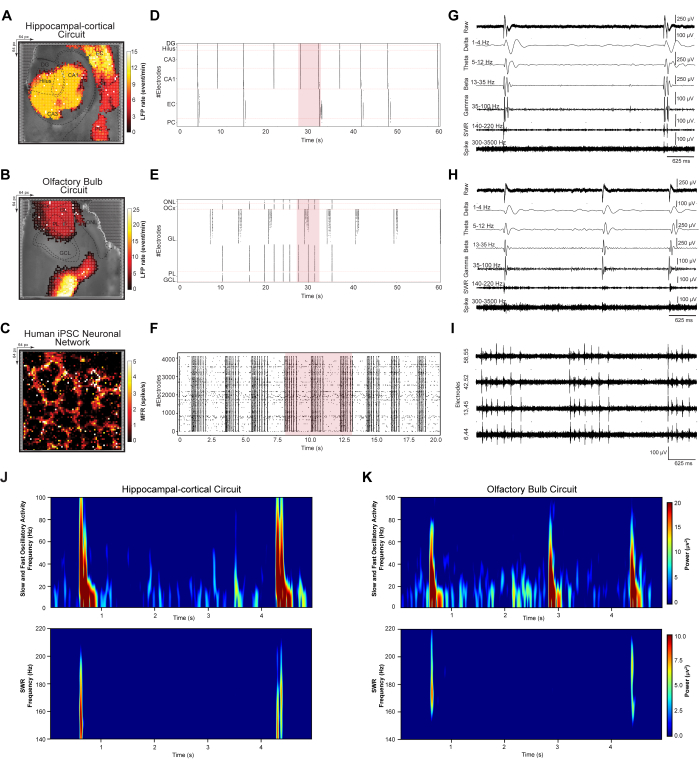
איור 3: מיפוי וחילוץ דפוסים מרחביים-זמניים של דינמיקת רשת. (A-C) מפות מרחביות LFP וקצב ספייק ממוצע, מחושבות על פני הקלטות של חמש דקות, על גבי תמונת האור במיקרוסקופ. (ד-ו) תרשימי רסטר המתארים אירועי LFP מזוהים ונקובים בתת-דגימת נתונים של 60 שניות וזינוקים בתת-דגימת נתונים של 20 שניות. (ז-י) חילוץ עקבות מייצג של צורת גל מקטע בן 5 שניות של תת-דגימת נתוני תרשים הרסטר (מסומן באדום בתרשים הרסטר), המוצג כפסי תנודות LFP גולמיים (1-100 הרץ); δ (1-4 הרץ), θ (5-12 הרץ), β (13-35 הרץ) ו-γ (35-100 הרץ); SWR (140-220 הרץ); וספייקינג יחיד ו-MUA בתדר גבוה (300-3500 הרץ). (י,ק) מפות צפיפות ספקטרלית של LFPs מתנדנדים מהירים ואיטיים (1-100 הרץ) ו- SWR (140-220 הרץ). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
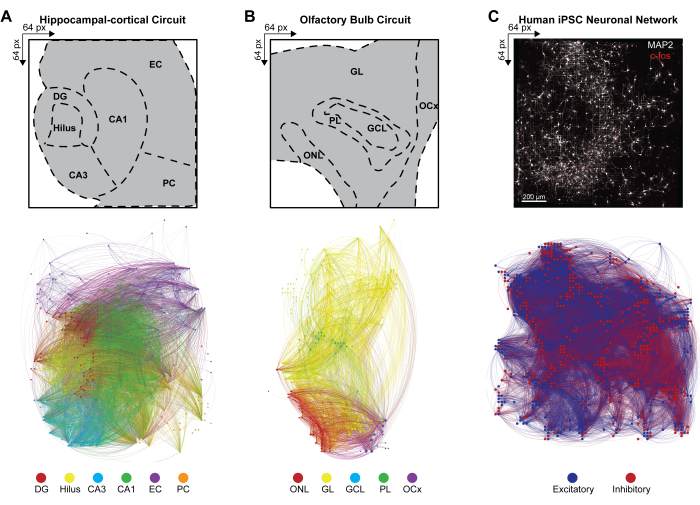
איור 4: ארגון של קונקטומים פונקציונליים רב-מודאליים ברחבי הרשת. (א-ג) מפות Gephi המדגימות קישוריות פונקציונלית של צמתים, כאשר הצמתים תואמים לאחת ממקרא סרגל הצבע לדוגמה (להלן), בעוד שהקישורים (או הקצוות) מוצללים כך שיתאימו לצמתים המחברים. מקרא לדוגמה עבור שכבות (A) HC, (B) OB ו- (C) iPSC מוצגות במערך של 64 x 64. שכבות HC ו- OB משורטטות על פני סל זמן של 100 שניות כדי להפחית ביעילות את מספר הצמתים והקישורים הגלויים למטרות הדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פתרונות להכנת פרוסות מוח ומדיה עבור תרביות נוירונים iPSC. (A) תמיסת חיתוך עתירת סוכרוז להכנת פרוסת מוח ex-vivo. (B) פתרון הקלטה aCSF להכנה והקלטה של פרוסות מוח ex-vivo. (ג-ד) פרוטוקול המדיה iPSC העצבי האנושי, כאשר (C) הוא המדיה המלאה של BrainPhys המשמשת להפשרת תאים, ציפוי שבב HD-MEA ותחזוקת HD-MEA בתרבית, ו-(D) מדיית הניקוד המשמשת לציפוי תאי HD-MEA. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: פתרון בעיות נפוצות ברכישת הקלטות HD-MEA. רשימה של בעיות נפוצות, הגורמים האפשריים שלהן ופתרונות פתרון בעיות הקשורים לשבבי HD-MEA, פלטפורמת הקלטה, רעשי מערכת ותוכנה. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
הדינמיקה המורכבת של הפעילות העצבית המרחבית-זמנית, הנובעת מהרכבים עצביים מקושרים, הייתה מזה זמן רב נושא לתככים במדעי המוח. מתודולוגיות מסורתיות, כגון מהדק טלאים, MEA סטנדרטי והדמיית Ca2+, סיפקו תובנות חשובות לגבי מורכבות המוח. עם זאת, לעתים קרובות הם נכשלים בלכידת הדינמיקה החישובית המקיפה ברחבי הרשת 21,22,23. הפרוטוקול הטכני של פלטפורמת HD-MEA, כפי שמפורט במחקר JoVE זה, מייצג קפיצת מדרגה משמעותית, ומציע מבט פנורמי על דינמיקה עצבית בשיטות מגוונות, החל ממכלולי תאים ועד רשתות נרחבות (כלומר, פרוסות מוח חריפות של עכברי ex-vivo ורשתות iPSC אנושיות במבחנה)26,29,30,32.
פרוסות מוח חריפות של עכברי ex-vivo היו כלי בסיסי במחקר עצבי, וסייעו לחקירות מולקולריות ומעגליות 6,7. עם זאת, האתגר של שמירה על כדאיות הרקמה היה צוואר בקבוק מתמשך. הפרוטוקול המתואר במחקר זה מציג שינויים קריטיים כדי למטב את האיכות ואת תוחלת החיים של פרוסות אלה כדי לנצל את היתרונות שלהם על פלטפורמת HD-MEA. פרוטוקול זה מדגיש את החשיבות של - i) השגת אחידות פרוסות, שעבורה השימוש בויברטומה מועדף על פני מסוק רקמות בשל דיוקו ומזעור הנזק לרקמות, למרות הפשרה של זמני חיתוך ארוכים יותר. ii) הבטחת קרבוגניזציה מתמדת לאורך כל התהליך, מהמיצוי ועד ההקלטה, כדי לשמור על כדאיות הרקמות. iii) ויסות הטמפרטורה ומתן זמן התאוששות הולם לפני ההקלטה. 4) שימוש בגוש אגרוז או עובש לייצוב המוח, למניעת קריעה ולמזעור מגע דבק. v) שמירה על קצבי זרימה אופטימליים של aCSF קרבוגני בתוך מאגר HD-MEA כדי להבטיח את בריאות הפרוסה תוך הימנעות מבעיות כמו ניתוק, רעש וסחף (טבלה 2).
הן עבור פרוסות מוח של עכבר והן עבור תכשירי iPSC אנושיים, שיפור צימוד ממשק אלקטרודה-רקמה הוא בעל חשיבות עליונהשל 30,46,47. הפרוטוקול שלנו מדגיש את החשיבות של שימוש במולקולה מעודדת הדבקה Poly-dl-ornithine (PDLO). מולקולה זו לא רק מגדילה את שטח הפנים לגילוי אותות חשמליים, אלא גם מגבירה את המוליכות החשמלית46. בכך הוא מקדם היצמדות תאית, גדילה ופיתוח תכונות רשת פונקציונליות. אופטימיזציה כזו ממלאת תפקיד מרכזי בשיפור היעילות של פלטפורמת HD-MEA. זה, בתורו, מבטיח ניתוח מדויק ועקבי של קונקטום ex-vivo ו- in-vitro בקנה מידה מיקרוסקולרי ורצפי הירי המרחבי-זמני שלהם. יש לציין כי PDLO הוכח כבעל ביצועים טובים יותר ממצעים אחרים כמו פוליאתילניאמין (PEI) ופולי-ל-אורניתין (אש"ף) בקידום פעילות ירי ספונטנית והיענות לגירויים חשמליים בתרביות עצביות. בנוסף, PDLO שימש לפונקציונליות פני השטח ב- HD-MEA והוכח כמשפר את ממשק הצימוד של פרוסת אלקטרודה ומגביר את יחס האות לרעש הן בפרוסות OB והן בפרוסות HC26,29. התוספת של עוגן פלטינה שנבנה בהתאמה אישית מגדילה עוד יותר את צימוד ממשק פרוסת האלקטרודה, מה שמוביל להקלטות עם יחס אות לרעש גבוה יותר.
השימוש ב-HD-MEA הן עבור פרוסות מוח של עכברי ex-vivo והן עבור רשתות iPSC אנושיות במבחנה מציג שיטה המיומנת בחקר דינמיקה נרחבת, רב-ממדית ורב-מודאלית. גישה חדשנית זו, עם זאת, מביאה אתגרים משמעותיים, במיוחד בניהול נתונים 48,49,50,51. הקלטת HD-MEA אחת הנרכשת בתדר דגימה של 18 קילוהרץ/אלקטרודה מפיקה כמות מדהימה של נתונים בנפח 155 מגה-בתים לשנייה. נפח הנתונים עולה במהירות כאשר משקללים פרוסות מרובות, מצבים פרמקולוגיים מגוונים או תקופות הקלטה ממושכות. זרם כזה של מידע דורש תשתיות אחסון איתנות וכלי חישוב מתקדמים לייעול העיבוד. היכולת של פלטפורמת HD-MEA לאסוף בו זמנית נתונים מאלפי הרכבים עצביים היא גם ברכה וגם משוכה. הוא מספק תובנות עילאיות על הדינמיקה החישובית של תפקודי המוח, אך הוא גם דורש מסגרת אנליטית מעודנת. בפרוטוקול JoVE זה, סיפקנו דוגמאות לאסטרטגיות חישוביות, כולל זיהוי אירועים בקנה מידה גדול, סיווג, תורת הגרפים, ניתוח תדרים ולמידת מכונה. שיטות אלה מדגישות את המאמצים האינטנסיביים שנעשו כדי להתמודד עם האתגרים של ניתוח נתונים עצביים מורכבים. עם זאת, עדיין יש מקום רב לפיתוח כלים חישוביים מתקדמים יותר לניתוח מערכי נתונים עצביים רב-ממדיים אלה. חמושה בכלים ובמתודולוגיות המתאימים, הפוטנציאל של פלטפורמת HD-MEA גדל, ומציעה תובנות מעמיקות על המורכבות של תפקודי המוח במצבים בריאים ופתולוגיים כאחד.
בעיקרו של דבר, פלטפורמת HD-MEA, כאשר היא משולבת עם הפרוטוקולים המפורטים והכלים החישוביים שנדונו, מציעה גישה טרנספורמטיבית להבנת פעולתו המורכבת של המוח. על-ידי לכידת דינמיקות בקנה מידה גדול, רב-ממדי ורב-מודאלי, הוא מספק תובנות יקרות ערך לגבי תהליכים כגון למידה, זיכרון ועיבוד מידע. יתר על כן, היישום שלה ברשתות iPSC אנושיות במבחנה יש פוטנציאל לחולל מהפכה בסינון תרופות וברפואה מותאמת אישית. עם זאת, בעוד פלטפורמה זו מייצגת התקדמות משמעותית במחקר מדעי המוח, חיוני להכיר ולטפל באתגרים הטכניים הטבועים. עם שכלול מתמשך ושילוב של כלים חישוביים מתקדמים, פלטפורמת HD-MEA עומדת לפתוח עידן חדש של כלי אבחון מדויקים, זיהוי סמנים ביולוגיים ספציפיים וטיפולים ממוקדים להפרעות נוירולוגיות.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים או כלכליים.
Acknowledgements
מחקר זה נתמך על ידי קרנות מוסדיות (DZNE), אגודת הלמהולץ במסגרת קרן התיקוף של הלמהולץ (HVF-0102), ובית הספר הבינלאומי למוסמכים בדרזדן לביו-רפואה וביו-הנדסה (DIGS-BB). ברצוננו גם להודות לפלטפורמה לניסויים התנהגותיים בבעלי חיים ב- DZNE-Dresden (אלכסנדר גארת, אן קרסינסקי, סנדרה גינתר וינס ברגמן) על תמיכתם. ברצוננו להכיר בכך שחלק מאיור 1 נוצר באמצעות BioRender.com הפלטפורמה.
Materials
| Name | Company | Catalog Number | Comments |
| 150 mm Glass Petri Dish | generic | generic | Brain Preparation Workspace, Brain Slice Recording Workspace |
| 0.22 μm Sterile Filter Unit | Assorted | Assorted | Assorted |
| 90 mm Plastic Culture Dish | TPP | 93100 | Brain Preparation Workspace, Brain Slice Recording Workspace |
| Agarose | Roth | 6351.5 | Brain Preparation Workspace |
| Agarose Mold | CUSTOM | CUSTOM | Brain Preparation Workspace; Custom designed 3D Printer Design, available upon request |
| Aluminum Foil | generic | generic | Brain Extraction Workspace |
| Anesthesia chamber | generic | generic | Brain Extraction Workspace; Assorted Beaker, Bedding etc |
| Ascorbic Acid | Sigma Aldrich | A4544-25G | Solution Preparation Workspace |
| Assorted Beakers | generic | generic | Solution Preparation Workspace; 50 mL |
| Assorted Luers | Cole Parmer | 45511-00 | Brain Slice Recording Workspace |
| Assorted Volumetric flasks | generic | generic | Solution Preparation Workspace; 500 mL, 1 L |
| B27 Supplement | Life Technologies | 17504-044 | BrainXell Commercial Supplier Protocol |
| BDNF | Peprotech | 450-02 | BrainXell Commercial Supplier Protocol |
| Biological Safety Cabinet with UV Lamp | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| BrainPhys Neuronal Medium | STEMCELL Technologies | 05790 | CDI, and BrainXell Commerical Supplier Protocol |
| Brainwave Software | 3Brain AG | Version 4 | Brain Slice and Human iPSC Recording Workspace |
| BrainXell Glutamatergic Neuron Assay | BrainXell | BX-0300 | BrainXell Commercial Supplier Protocol |
| CaCl2 | Sigma Aldrich | 21115-100ML | Solution Preparation Workspace |
| Carbogen | generic | generic | All Workspaces; 95%/5% O2 and CO2 mixture |
| Cell Culture Incubator | Assorted | Assorted | Assorted |
| CMOS-based HD-MEA chip | 3Brain AG | CUSTOM | Brain Slice and Human iPSC Recording Workspace |
| Conical Tubes, 50 mL, Falcon (Centrifuge Tubes) | STEMCELL Technologies | 38010 | CDI Commerical Supplier Protocol |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | Brain Slice Recording Workspace |
| Curved Forceps | FST | 11052-10 | Brain Extraction Workspace |
| DMEM/F12 Medium | Life Technologies | 11330-032 | BrainXell Commercial Supplier Protocol |
| Dulbecco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | STEMCELL Technologies | 37350 | CDI Commerical Supplier Protocol |
| Filter Paper | Macherey-Nagel | 531 011 | Brain Preparation Workspace |
| Fine Brush | Leonhardy | 773 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Forceps | VITLAB | 67895 | Brain Slice Recording Workspace |
| GDNF | Peprotech | 450-10 | BrainXell Commercial Supplier Protocol |
| Geltrex | Life Technologies | A1413201 | BrainXell Commercial Supplier Protocol |
| Glass pasteur pipette | Roth | 4518 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Glucose | Sigma Aldrich | G7021-1KG | Solution Preparation Workspace |
| GlutaMAX | Life Technologies | 35050-061 | BrainXell Commercial Supplier Protocol |
| Gravity-based Perfusion System | ALA | VC3-8xG | Brain Slice Recording Workspace |
| HD-MEA Recording platform | 3Brain AG | CUSTOM | Brain Slice and Human iPSC Recording Workspace |
| Heater | Warner Instruments | TC-324C | Brain Slice Recording Workspace |
| Hemocytometer or Automated Cell Counter | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| Hypo Needles | Warner Instruments | 641489 | Brain Slice Recording Workspace |
| iCell GlutaNeurons Kit, 01279 | CDI | R1061 | CDI Commerical Supplier Protocol |
| Iris Scissors | Vantage | V95-304 | Brain Extraction Workspace |
| Isoflurane | Baxter | HDG9623 | Brain Extraction Workspace |
| KCl | Sigma Aldrich | P5405-250G | Solution Preparation Workspace |
| Laminin | Sigma-Aldrich | L2020 | CDI Commerical Supplier Protocol |
| Liquid Nitrogen Storage Unit | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| Magnetic Stirrer | generic | generic | Solution Preparation Workspace |
| Metal Screws | Thorlabs | HW-KIT2/M | Brain Slice Recording Workspace |
| MgCl2 | Sigma Aldrich | M1028-100ML | Solution Preparation Workspace |
| MgSO4 | Sigma Aldrich | 63138-250G | Solution Preparation Workspace |
| Microdissection Tool Holder | Braun | 4606108V | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Microdissection Tool Needle | Braun | 9186166 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Modular Stereomicroscope | Leica | CUSTOM | Brain Slice Recording Workspace; custom specifications and modifications |
| N2 Supplement | Life Technologies | 17502-048 | CDI, and BrainXell Commercial Supplier Protocol |
| NaCl | Sigma Aldrich | S3014-1KG | Solution Preparation Workspace |
| NaH2PO4 | Sigma Aldrich | S0751-100G | Solution Preparation Workspace |
| NaHCO3 | Sigma Aldrich | S5761-500G | Solution Preparation Workspace |
| Neurobasal Medium | Life Technologies | 21103-049 | BrainXell Commercial Supplier Protocol |
| Optical Cage System | Thorlabs | Assorted | Brain Slice Recording Workspace |
| Optical Table w/Breadboard | Thorlabs | SDA7590 | Brain Slice Recording Workspace |
| PDLO | Sigma Aldrich | P0671 | HD-MEA Coating, Brain Slice Recording Workspace |
| Penicillin-streptomycin, 100x | Thermo Fisher Scientific | 15140-122 | CDI Commerical Supplier Protocol |
| Pipette tips | TipONE | S1120-8810 | Brain Slice Recording Workspace |
| Pipettors | Assorted | Assorted | Assorted |
| Platinum Anchor | CUSTOM | CUSTOM | Brain Slice Recording Workspace |
| Polyethylene Tubing | Assorted | Assorted | Brain Slice Recording Workspace |
| Pump | MasterFlex | 78018-22 | Brain Slice Recording Workspace |
| Razor Blade | Apollo | 10179960 | Brain Preparation Workspace |
| Reference Electrode Cell Culture Cap | CUSTOM | CUSTOM | Human iPSC Recording Workspace; Custom designed 3D Printer Design, available upon request |
| Rubber Pipette Bulb | Duran Wheaton Kimble | 292000205 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Serological Pipettes, 1 mL, 2 mL, 5 mL, 10 mL, 25 mL | Assorted | Assorted | Assorted |
| Slice Recovery Chamber | CUSTOM | CUSTOM | Brain Slice Recovery Workspace; Custom designed 3D Printer Design, available upon request |
| Spatula | ISOLAB | 047.06.150 | Brain Preparation Workspace |
| Sucrose | Sigma Aldrich | 84100-1KG | Solution Preparation Workspace |
| Super Glue | UHU | 358221 | Brain Slice Preparation Workspace |
| Surgical Scissors | Peters Instruments | BC 344 | Brain Extraction Workspace |
| Tabletop Centrifuge | Assorted | Assorted | Assorted |
| TGF-β1 | Peprotech | 100-21C | BrainXell Commercial Supplier Protocol |
| Tissue Paper | generic | generic | Brain Extraction Workspace |
| Trypan Blue | STEMCELL Technologies | 07050 | CDI Commerical Supplier Protocol |
| Upright Microscope | Olympus | CUSTOM | Imaging Workspace; Custom specifications and modifications |
| Vacusip | Integra | 159010 | Brain Slice Recording Workspace |
| Vibratome | Leica | VT1200s | Brain Slice Preparation Workspace; Includes: Specimen plate, buffer tray, ice tray, specimen plate holding tool, vibratome blade adjusting tool |
| Vibratome Blade | Personna | N/A | Brain Slice Preparation Workspace |
| Water Bath | Lauda | L000595 | Brain Slice Recovery Workspace |
References
- Hebb, D. O. . The Organization of Behavior; A Neuropsychological Theory. , (1949).
- Cossart, R., Garel, S. Step by step: cells with multiple functions in cortical circuit assembly. Nat Rev Neurosci. 23, 395-410 (2022).
- Carrillo-Reid, L., Yuste, R. Playing the piano with the cortex: role of neuronal ensembles and pattern completion in perception and behavior. Curr Opin Neurobiol. 64, 89-95 (2020).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Neural Syntax: Cell assemblies, synapsembles, and readers. Neuron. 68 (3), 362-385 (2010).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Cho, S., Wood, A., Bowlby, M. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Curr Neuropharmacol. 5 (1), 19-33 (2007).
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Anderson, P., Morris, R., Amaral, D., Bliss, T., O'Keefe, L. . The Hippocampus Book. , (2006).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nat Neurosci. 20, 1434-1447 (2017).
- Mori, K., Nagao, H., Yoshihara, Y. The olfactory bulb: Coding and processing of odor molecule information. Science. 286 (5440), 711-715 (1999).
- Buck, L., Axel, R. A novel multigene family may encode odorant receptors: A molecular basis for odor recognition. Cell. 65 (1), 175-187 (1991).
- Bushdid, C., Magnasco, M. O., Vosshall, L. B., Keller, A. Humans can discriminate more than 1 trillion olfactory stimuli. Science. 343 (6177), 1370-1372 (2014).
- Kempermann, G. Why new neurons? Possible functions for adult hippocampal neurogenesis. J Neurosci. 23 (3), 635-638 (2003).
- Aimone, J. B., Wiles, J., Gage, F. H. Computational influence of adult neurogenesis on memory encoding. Neuron. 61 (2), 187-202 (2009).
- Nithianantharajah, J., Hannan, A. J. Enriched environments, experience-dependent plasticity and disorders of the nervous system. Nat Rev Neurosci. 7, 697-709 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Rajamohan, D., et al. Current status of drug screening and disease modelling in human pluripotent stem cells. Bioessays. 35 (3), 281-298 (2013).
- Heilker, R., Traub, S., Reinhardt, P., Schöler, H. R., Sterneckert, J. iPS cell derived neuronal cells for drug discovery. Trends Pharmacol Sci. 35 (10), 510-519 (2014).
- Zhao, S. R., Mondéjar-Parreño, G., Li, D., Shen, M., Wu, J. C. Technical applications of microelectrode array and patch clamp recordings on human induced pluripotent stem cell-derived cardiomyocytes. J Vis Exp. (186), e64265 (2022).
- Hamill, O. P., McBride, D. W. Induced membrane hypo/hyper-mechanosensitivity: A limitation of patch-clamp recording. Annu Rev Physiol. 59, 621-631 (1997).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protoc. 2 (2), 100442 (2021).
- Lee, C. H., Park, Y. K., Lee, K. Recent strategies for neural dynamics observation at a larger scale and wider scope. Biosens Bioelectron. 240, 115638 (2023).
- Urai, A. E., Doiron, B., Leifer, A. M., Churchland, A. K. Large-scale neural recordings call for new insights to link brain and behavior. Nat Neurosci. 25 (1), 11-19 (2022).
- Hu, X., Khanzada, S., Klütsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834 (2022).
- Amin, H., Marinaro, F., Tonelli, D. D. P., Berdondini, L. Developmental excitatory-to-inhibitory GABA-polarity switch is disrupted in 22q11.2 deletion syndrome: A potential target for clinical therapeutics. Sci Rep. 7 (1), 15752 (2017).
- Amin, H., Nieus, T., Lonardoni, D., Maccione, A., Berdondini, L. High-resolution bioelectrical imaging of Aβ-induced network dysfunction on CMOS-MEAs for neurotoxicity and rescue studies. Sci Rep. 7 (1), 2460 (2017).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471 (2023).
- Amin, H., et al. Electrical responses and spontaneous activity of human iPS-derived neuronal networks characterized for 3-month culture with 4096-electrode arrays. Front Neurosci. 10, 121 (2016).
- Lonardoni, D., et al. Recurrently connected and localized neuronal communities initiate coordinated spontaneous activity in neuronal networks. PLoS Comput Biol. 13 (7), e1005672 (2017).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. 2022 44th Annual International Conference of the IEEE Engineering in Medicine & Biology Society (EMBC). , 3111-3114 (2022).
- Rossi, L., Emery, B. A., Khanzada, S., Hu, X., Amin, H. Pharmacologically and electrically-induced network-wide activation of olfactory bulb with large-scale biosensor. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Emery, B. A., et al. Recording network-based synaptic transmission and LTP in the hippocampal network on a large-scale biosensor. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays). Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Berdondini, L., et al. Active pixel sensor array for high spatio-temporal resolution electrophysiological recordings from single cell to large scale neuronal networks. Lab Chip. 9, 2644-2651 (2009).
- Siegle, J. H., Hale, G. J., Newman, J. P., Voigts, J. Neural ensemble communities: open-source approaches to hardware for large-scale electrophysiology. Curr Opin Neurobiol. 32, 53-59 (2015).
- Amin, H., Maccione, A., Zordan, S., Nieus, T., Berdondini, L. High-density MEAs reveal lognormal firing patterns in neuronal networks for short and long term recordings. 2015 7th International IEEE/EMBS Conference on Neural Engineering (NER). , 1000-1003 (2015).
- Altuntac, E., et al. Bottom-up neurogenic-inspired computational model. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Maccione, A., et al. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. J Neurosci Methods. 177 (1), 241-249 (2009).
- Welch, P. D. The use of fast Fourier transform for the estimation of power spectra: A method based on time averaging over short, modified periodograms. IEEE Transactions on Audio and Electroacoustics. 15 (2), 70-73 (1967).
- Eggermont, J. J., Munguia, R., Pienkowski, M., Shaw, G. Comparison of LFP-based and spike-based spectro-temporal receptive fields and cross-correlation in cat primary auditory cortex. PLoS One. 6 (5), e20046 (2011).
- Damos, P. Using multivariate cross correlations, Granger causality and graphical models to quantify spatiotemporal synchronization and causality between pest populations. BMC Ecol. 16, 33 (2016).
- Kaminski, M. J., Blinowska, K. J. A new method of the description of the information flow in the brain structures. Biol Cybern. 65, 203-210 (1991).
- Pastore, V. P., Massobrio, P., Godjoski, A., Martinoia, S. Identification of excitatory-inhibitory links and network topology in large-scale neuronal assemblies from multi-electrode recordings. PLoS Comput Biol. 14 (8), e1006381 (2018).
- Amin, H., Dipalo, M., De Angelis, F., Berdondini, L. Biofunctionalized 3D nanopillar arrays fostering cell guidance and promoting synapse stability and neuronal activity in networks. ACS Appl Mater Interfaces. 10 (17), 15207-15215 (2018).
- Woeppel, K., Yang, Q., Cui, X. T. Recent advances in neural electrode-tissue interfaces. Curr Opin Biomed Eng. 4, 21-31 (2017).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Curr Opin Neurobiol. 50, 92-100 (2018).
- Siegle, J. H., Hale, G. J., Newman, J. P., Voigts, J. Neural ensemble communities: open-source approaches to hardware for large-scale electrophysiology. Curr Opin Neurobiol. 32, 53-59 (2015).
- Freeman, J. Open source tools for large-scale neuroscience. Curr Opin Neurobiol. 32, 156-163 (2015).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nat Neurosci. 14 (2), 139-142 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved