Method Article
CMOS集積高密度微小電極アレイにおけるマルチモーダル大規模神経集団ダイナミクスの記録と解析
要約
本研究では、HD-MEAを用いて、特に海馬、嗅球回路、ヒト神経回路における大規模な神経集団の計算ダイナミクスを掘り下げます。時空間活動を捉え、計算ツールと組み合わせることで、ニューロンのアンサンブルの複雑さに関する洞察を得ることができます。この手法は、脳機能の理解を深め、神経疾患のバイオマーカーや治療法を特定できる可能性がある。
要約
大規模な神経回路網とその複雑な分布微小回路は、時空間的な神経活動のパターンから出現する知覚、認知、行動を生み出すために不可欠です。相互接続されたニューロンアンサンブルの機能群から出現するこれらの動的パターンは、マルチスケールの神経情報を処理および符号化するための正確な計算を容易にし、それによって高次脳機能を促進します。この複雑さの根底にある神経ダイナミクスの計算原理を探り、健康と病気における生物学的プロセスのマルチスケールの影響を調査するために、大規模な同時記録が役立つようになりました。ここでは、高密度微小電極アレイ(HD-MEA)を用いて、生体 外 マウスの脳切片由来の海馬および嗅球回路と、ヒト人工多能性幹細胞(iPS細胞)の in vitro 細胞培養由来の神経回路という2つの神経動態を研究しています。4096個の微小電極を備えたHD-MEAプラットフォームは、数千のニューロン集団からの細胞外発火パターンを高い時空間分解能で同時に非侵襲的、マルチサイト、ラベルフリーで記録することができます。このアプローチにより、単一/複数ユニットのスパイク活動パターンや局所電界電位振動など、いくつかの電気生理学的ネットワーク全体の特徴を特徴付けることができます。これらの多次元ニューラルデータを精査するために、機械学習アルゴリズム、自動イベント検出・分類、グラフ理論などの高度な解析を組み込んだ計算ツールをいくつか開発しました。これらの計算パイプラインをこのプラットフォームで補完することにより、細胞集合体からネットワークまでの大規模、マルチスケール、マルチモーダルダイナミクスを研究するための方法論を提供します。これにより、健康と病気における複雑な脳機能と認知プロセスの理解が進む可能性があります。オープンサイエンスへの取り組みと大規模な計算ニューラルダイナミクスへの洞察は、脳に着想を得たモデリング、ニューロモルフィックコンピューティング、およびニューラル学習アルゴリズムを強化する可能性があります。さらに、大規模神経計算障害の根底にあるメカニズムとそれらが相互に関連したマイクロ回路ダイナミクスを理解することは、特定のバイオマーカーの同定につながり、神経疾患のより正確な診断ツールと標的療法への道を開く可能性があります。
概要
ニューロンの集合体は、しばしば細胞集合体と呼ばれ、ニューロンコーディングにおいて極めて重要であり、マルチスケールのニューラル情報を処理するための複雑な計算を容易にします1,2,3。これらのアンサンブルは、広大なニューロンネットワークとその微妙な微小回路の形成を支えています4。このようなネットワークとその振動パターンは、知覚や認知などの高度な脳機能を促進します。特定のニューロンの種類とシナプス経路を探求する広範な研究が行われていますが、ニューロンが協調して細胞集合体を形成し、回路やネットワーク全体で時空間情報処理に影響を与える方法についてのより深い理解は、依然としてとらえどころのないままです5。
急性期のex-vivo脳スライスは、無傷の神経回路を研究するための極めて重要な電気生理学的ツールであり、神経機能、シナプス伝達、および接続性の振動活動パターンを調査するための制御された設定を提供し、薬理学的検査と疾患モデリングに影響を及ぼします6,7,8。この研究プロトコルは、2つの重要な脳回路を強調しています-学習と記憶プロセスに関与する海馬皮質(HC)9,10、および匂いの識別に関与する嗅球(OB)11,12,13。これら2つの領域では、哺乳類の脳では、成体の神経新生によって生涯を通じて新しい機能的ニューロンが連続的に生成される14。どちらの回路も、既存のニューラルネットワークの再配線に関与し、必要に応じて代替情報処理戦略を容易にする多次元の動的神経活動パターンと固有の可塑性を示しています15,16。
急性期の生体外脳スライスモデルは、脳の機能を掘り下げ、微小回路レベルで病気のメカニズムを理解するために不可欠です。しかし、ヒト人工多能性幹細胞(iPS細胞)のニューロンネットワークに由来する体外細胞培養は、動物実験の知見を潜在的なヒトの臨床治療にシームレスに結びつける、トランスレーショナルリサーチの有望な手段を提供します17,18。これらのヒト中心のin vitroアッセイは、薬理学的毒性を評価し、正確な薬物スクリーニングを可能にし、革新的な細胞ベースの治療戦略の研究を促進するための信頼できるプラットフォームとして機能します19,20。iPS細胞ニューロンモデルの極めて重要な役割を認識し、このプロトコル研究の第3モジュールでは、iPS細胞由来のネットワークの機能特性を徹底的に調査し、関連する細胞培養プロトコルを微調整しました。
これらの電磁形成神経モジュールは、カルシウム(Ca2+イメージング)、パッチクランプ記録、低密度微小電極アレイ(LD-MEA)などの技術を用いて一般的に研究されてきました。Ca2+イメージングは単一細胞活性マッピングを提供しますが、細胞標識ベースの方法であり、時間分解能が低く、長期記録が困難であるという課題があります。LD-MEAは空間精度に欠けており、パッチクランプは侵襲的な単一部位技術であり、手間がかかるため、成功率が低いことがよくあります21,22,23。これらの課題に対処し、ネットワーク全体の活動を効果的に調査するために、脳の複雑さの根底にある神経ダイナミクスの計算原理と、健康と病気への影響を理解するための極めて重要なアプローチとして、大規模な同時神経記録が登場しました24,25。
このJoVEプロトコルでは、高密度MEA(HD-MEA)に基づく大規模な神経記録法を実証し、ex-vivoマウス脳急性切片(図1A-C)やin vitroヒトiPS細胞由来神経回路(図1D-E)など、さまざまな脳モダリティにわたる時空間神経活動を捕捉します26、27、28、29、30、31、32、33、34、35。相補型金属酸化膜半導体(CMOS)技術で構築されたHD-MEAは、オンチップ回路と増幅機能を誇り、7mm2のアレイサイズ36でミリ秒未満の記録が可能です。この非侵襲的アプローチは、4096個の微小電極を高い時空間分解能で同時に使用し、数千のニューロンアンサンブルからマルチサイト、ラベルフリーの細胞外発火パターンを捕捉し、局所電界電位(LFP)とマルチユニットスパイク活性(MUA)の複雑なダイナミクスを明らかにします26,29。
この方法論によって生成されるデータの膨大さを考えると、洗練された分析フレームワークが不可欠ですが、課題があります37。私たちは、自動イベント検出、分類、グラフ理論、機械学習、およびその他の高度な技術を網羅する計算ツールを開発しました(図1F)26,29,38,39。HD-MEAをこれらの分析ツールと統合することで、個々の細胞集合体から多様な神経モダリティにわたるより広範なニューラルネットワークまでの複雑なダイナミクスを調査するための包括的なアプローチが考案されています。この複合的なアプローチは、正常な脳機能における計算ダイナミクスの理解を深め、病理学的状態に存在する異常への洞察を提供します28。さらに、このアプローチから得られた知見は、脳型モデリング、ニューロモルフィックコンピューティング、ニューラル学習アルゴリズムの進歩を促進する可能性があります。最終的に、この方法は、ニューラルネットワークの破壊の背後にあるコアメカニズムを明らかにし、バイオマーカーを特定し、神経疾患の正確な診断ツールと標的治療の作成を導く上で有望です。
プロトコル
すべての実験は、該当するヨーロッパおよび国内の規制(Tierschutzgesetz)に従って実施され、地方自治体(Landesdirektion Sachsen、25-5131/476/14)によって承認されました。
1. HD-MEA上の海馬-皮質および嗅球回路からの Ex-vivo 脳スライス
- 実験用切断および記録溶液の調製(図2A)
- 実験当日は、高ショ糖切削液0.5Lと人工脳脊髄液(aCSF)記録液1Lを調製する(表1A、B)。
- すべての固体化学物質を乾いたメスフラスコに入れ、途中に二重蒸留水(dd)を入れます。
- 1 M ストック溶液から MgCl2 と CaCl2 を添加し、残りを dd 水で満たします。目に見える固形物が溶解~5分になるまで、マグネチックスターラーで絶えず攪拌を開始します。
- 凝固点浸透圧計を使用して、高スクロース切断溶液の場合は350〜360 mOsm、aCSF記録溶液の場合は315〜325 mOsmの浸透圧を検証します。
- pHメーターを使用して、高スクロース切断溶液のpHを7.3〜7.4、aCSF記録溶液のpHを7.25〜7.35の間で検証します。95%のO2 と5%のCO2で連続的にバブリングを開始します。
- スライスする前に、高スクロース切断溶液を少なくとも30分間氷上に置き、95%O2 および5%CO2で連続的にバブリングを開始します。
- 10分間のカルボゲン化後、50 mLビーカーに30 mLの切断液を入れ、冷凍庫(-20°C)で20〜30分間、または部分的に凍結するまで保存します。
注:すべての溶液は、実験ごとに新たに調製する必要があります。ここで用いるdd水は、常温(RT)で保存したオートクレーブ滅菌した超純水です。準備される溶液の量は、特定の研究課題に合わせて調整する必要があります。
- 実験当日は、高ショ糖切削液0.5Lと人工脳脊髄液(aCSF)記録液1Lを調製する(表1A、B)。
- ブレインスライスワークスペース領域の準備(図2A)
- 動物を実験室に連れて行きます。
注:このプロトコルでは、8〜16週齢のC57BL / J6雌マウスが、前述のように使用されました26,29,32。動物は輸送後少なくとも30分間順応させる必要があります。長距離移動(施設間)は、実験当日は避けるべきです。動物の年齢、性別、および系統は、特定の研究質問に基づいて決定する必要があります。 - 動物が順応し、高ショ糖溶液が冷えている間に、必要な道具を指定された各作業スペースに置きます( 材料表を参照)。
- ブレインスライスの回復とメンテナンスのワークスペースを準備します。スライス回収チャンバーに炭化aCSF記録溶液を充填し、チャンバーを32°Cに設定したウォーターバスに入れます。 実験全体を通して継続的なカルボゲン化を維持します。
- ブレインスライス準備ワークスペースを準備します。ビブラトームのセットアップ - ブレードをビブラトームブレードホルダーに置き、ビブラトームを正しい設定(ブレード移動速度:0.20 mm / s、高さ振幅:95 μm、ブレード角度:45°)に校正します。ビブラトーム製氷トレイに氷を入れ、バッファートレイに高ショ糖切断溶液を入れ、バッファートレイで溶液のカーボゲン化を開始します。
- 脳の準備ワークスペースを準備します。150mmのガラスペトリ皿に氷を入れ、ろ紙を入れた90mmのプラスチック培養皿を置きます。プラスチック培養皿に高ショ糖切断液を入れ、カルボゲン化を開始します。冷やした試料プレートに瞬間接着剤を一滴加え、アガロース型を取り付けます。
注:アガロースモールドは、少なくとも前日に、カスタムマウスの脳モールドで3%アガロースを水中に溶かして調製します。 - 最後に、 脳抽出ワークスペースを準備します。アルミホイルをティッシュペーパーで覆い、高ショ糖切削液スラッシュを含む50 mLビーカーを取り出し、麻酔チャンバーにイソフルランを追加します。
注:麻酔は、動物を配置する~1分前に麻酔チャンバーに追加されます。30 mL の高スクロース切断溶液スラッシュを含む 50 mL ビーカーを、斬首の ~2 分前に -20 °C の冷凍庫から取り出します。
- 動物を実験室に連れて行きます。
- マウス脳の抽出とスライス
注意: この手順全体は、脳への酸素供給の不足を避けるために、できるだけ早く実行する必要があります。脳の除去は、斬首から高ショ糖切断溶液スラッシュへの浸漬まで1〜2分しかかかりません。- 適切な用量のイソフルラン(0.5 mL / 1 L麻酔チャンバー)で動物を麻酔します。.肉球をつまんで麻酔の深さを決定します。先に進む前に、足の引き抜き反射がないことを確認してください。
- 動物を脳抽出作業場のティッシュペーパーに移し、手術用ハサミで首を切り落とします。
- 虹彩のはさみを脳幹に挿入し、下のはさみをふくらはみと同じ高さに保ちます。冠状縫合糸に達するまで矢状縫合糸に沿って切断します。虹彩はさみを眼窩に入れ、メトピア縫合糸を切開します。湾曲した鉗子を使用して、ふくらはぎの側面を下に動かし、脳全体を露出させます。
注:虹彩はさみと鉗子の両方で、縫合糸を切断するときに脳に穴を開けないように注意してください。 - 湾曲した鉗子の鈍い端で脳を、30 mLの高ショ糖切削液スラッシュが入った50 mLビーカーにスライドさせます。1分間そのままにします。
- 脳を、脳の準備作業スペースで冷やしたカルボゲン化切断液を入れた90mmのプラスチック培養皿に移します。アガロースモールドにポジショニングするために脳を向けます。
- アガロース型の吻側端に瞬間接着剤の小さな点を追加します。へらで型に脳を入れます。水平スライスのために、脳が背側を下にして配置されていることを確認してください。
注意: 金型内の接着剤の位置は、関心領域(ROI)によって異なります。海馬皮質(HC)と嗅球(OB)のスライスの場合、OBが安定し、脳の側面に接着剤が付着していないことを確認してください。接着剤が多すぎるとスライス品質に影響し、ビブラトームスライス中に裂け目が発生します。 - 標本プレートをバッファートレイに移動し、ブレードを正しい角度で所定の位置に移動し、バッファートレイの高さを上げてブレードを脳にできるだけ近づけます。
- HC組織とOB組織を0.20 mm/sの速度で300 μm間隔でスライスし、スライスするたびにガラス製のパスツールピペットで回収します。
- スライスをaCSFで充填した回収チャンバー内の32°Cのウォーターバスで45分間放置した後、室温で1時間放置します。 スライスが重ならないようにし、カルボゲン溶液に完全に曝露してください。
注:すべての溶液および溶液を含む言及されたチャンバーの継続的なカルボゲン化を必ず維持してください。圧力調整器は、一貫したカルボゲン化を維持するために使用できます。
2. HD-MEAにおける in vitro ヒトiPS細胞による神経回路網
注:この研究で使用されたすべてのiPS細胞ニューロンは市販のものです( 材料表を参照)。これらのヒト細胞は、ヒト末梢血や線維芽細胞由来の安定なiPS細胞株から分化しました。
- in vitroヒトiPS細胞培養用のHD-MEAチップのコーティング(図2B)
- HD-MEAチップをアクイジション記録プラットフォームに置き、リザーバーにPBSを充填し、コーティング前にチップをテストします。Brainwave ソフトウェアを起動します。[ ファイル] > [新しい記録セッション] を選択します。録音パラメータを、 記録周波数 を50Hz、 サンプリング周波数 を18kHz/電極に設定します。 Amplifier Offset を変更して、チップをキャリブレーションします。トラブルシューティングのヒントについては、 表 2 を参照してください。
メモ: 記録周波数とサンプリング周波数のパラメータは、データタイプと個々のシステム要件によって異なります。 - HD-MEAの滅菌とプレコンディショニング。
- フードの下で、チップとガラスリングを96%エタノール(EtOH)で湿らせた組織で拭き取り、各デバイスを滅菌済みの100 mm x 20 mmペトリ皿に入れ、MEAリザーバーに70%EtOHを20分間充填します。
- EtOHを吸引し、リザーバーを滅菌されたろ過されたdd水で3回洗浄します。1 mLのプレコンディショニング培地を加え、37°C、5%CO2で一晩インキュベートします。
注:プレコンディショニング培地は、HD-MEA表面の親水性を高めるために塩ベースの溶液である必要があります。これには、以前に調製されたBrainPhys(BP)完全な培地(>3ヶ月経過していないもの)が含まれる(表1C)。
- HD-MEAをコーティングします。翌日、プレコンディショニング培地を吸引します。0.1 mg/mLのポリ-dl-オルニチン(PDLO)を1 mL添加して、活性領域全体をコーティングします。インキュベーターで37°Cで一晩インキュベートします。
- 培地を準備し、RTに温めます。ここでのプロトコルは、2つの市販のソースからの機能的なヒトiPS細胞ニューロンを利用します。したがって、メディアコンポーネントはサプライヤーごとに異なります。1つのプロトコルが(表1C、D)に記載されている。
- PDLOを吸引し、dd水で3回洗浄し、チップをフードの下で10分間乾燥させます。
- 35 mm x 10 mmのシャーレに滅菌済みのろ過dd水を入れ、チップの横に置いて適切な湿度を維持し、次のステップで播種した細胞の蒸発を防ぎます。
- HD-MEAチップをアクイジション記録プラットフォームに置き、リザーバーにPBSを充填し、コーティング前にチップをテストします。Brainwave ソフトウェアを起動します。[ ファイル] > [新しい記録セッション] を選択します。録音パラメータを、 記録周波数 を50Hz、 サンプリング周波数 を18kHz/電極に設定します。 Amplifier Offset を変更して、チップをキャリブレーションします。トラブルシューティングのヒントについては、 表 2 を参照してください。
- HD-MEAにおけるヒトiPS細胞ニューロンのプレーティングと維持(図2B)
- 細胞を凍結し、マイクロリットルあたりの濃度あたりの所望の細胞数に希釈します(すなわち、1000細胞/μLで、HD-MEA上で50 μLの滴下で50,000細胞密度を得る)(表1C)。
- 高ラミニンドット培地(表1D)を用いて、チップ活性領域の表面に細胞懸濁液をピペットで移します。
- 37°C、5%CO2で45〜60分間インキュベートします。
- HD-MEAリザーバーに2 mLの培地を静かに充填します(表1C)。
- RT培地を使用して、播種後の1日目(DIV1)に100%培地交換を行います(表1C)。3〜4日ごとにメディアの50%を交換します。実験中、HD-MEAを5%CO2 で37°Cでインキュベートしてください。
注:細胞が外れないように、ピペットで静かに回してください。メディアの色に汚れがないか確認します。培地交換の間隔と量は、個々の研究の質問または細胞のニーズ/仕様によって決定できます。 - オプション:>70% EtOHでステージを洗浄した後、直立した微分干渉コントラスト(DIC)顕微鏡下でDIV4-DIV8間の細胞培養増殖の進行状況を確認します。
3. HD-MEAを用いた Ex-vivo および in vitro 大規模神経記録
- ブレインスライス記録ワークスペースの準備(図2A)
- 脳のスライスが回復している間に、必要なツールを指定された各ワークスペースに配置します( 材料表を参照)。
注:メインシステムのセットアップは、ブレインスライス実験日のかなり前に最適化およびテストする必要があります。灌流システム(入口ライン、ポンプ出口ライン、チューブ、および接地)は、記録プラットフォーム上でPBSまたはaCSFとHD-MEAを使用してテストし、クリーンな信号、S/N比の増加、および灌流ノイズの欠如を確認する必要があります。 - HD-MEAチップを0.1 mg/mLのPDLOでコーティングして組織チップの結合を強化し、37°Cで20分間インキュベートします。
- チップインキュベーション中に、重力ベースの灌流システムとラインに記録aCSFを充填します。灌流システムの継続的なカルボゲン化を確保します。流速を4.5mL/min、温度を37°Cに設定してください。
- HD-MEAチップをアクイジション記録プラットフォームに置き、リザーバーにaCSFを充填し、灌流システムをテストして、残りのシステムノイズのトラブルシューティングを行います。
- Brainwave ソフトウェアを起動します。[ ファイル] > [新しい記録セッション] を選択します。記録パラメータを、 記録周波数 を1 Hz、 サンプリング周波数 を14 kHz/電極に設定します。 Amplifier Offset を変更して、チップをキャリブレーションします。トラブルシューティングのヒントについては、 表 2 を参照してください。
メモ: 記録周波数とサンプリング周波数のパラメータは、データタイプと個々のシステム要件によって異なります。
- Brainwave ソフトウェアを起動します。[ ファイル] > [新しい記録セッション] を選択します。記録パラメータを、 記録周波数 を1 Hz、 サンプリング周波数 を14 kHz/電極に設定します。 Amplifier Offset を変更して、チップをキャリブレーションします。トラブルシューティングのヒントについては、 表 2 を参照してください。
- 部屋の照明システムまたは光学テーブルの日陰のケージを通して、記録エリアが暗いことを確認してください。
- 実体顕微鏡をHD-MEAチップリザーバーおよび画像取得用のアクティブエリアに合わせます。
- アンカーをチップリザーバーに配置して平衡化します。
注:アンカーは、酸素化を促進するためのワイヤーを最小限に抑えたカスタムメイドのプラチナハープです。ただし、一部の商用のものが利用可能です。 - 薬理学的化合物を適切な灌流チューブに添加します。
注:このプロトコルでは、前述のように、自発的および100μMの4-アミノピリジン(4-AP)薬理学的に誘発された記録の両方が得られました。薬理学的化合物は、特定の研究課題に合わせて調整できます。 - 脳スライス調製ワークスペースで、新しい90 mmのプラスチック培養皿を150 mmガラスのペトリ皿に入れます。aCSFを添加し、カルボゲン化を開始します。
- 脳のスライスが回復している間に、必要なツールを指定された各ワークスペースに配置します( 材料表を参照)。
- HD-MEAを使用したHCおよびOBスライスからの回路全体の記録
注意: スライスカップリングは、スライスへの酸素供給が不足しないように、できるだけ早く実行する必要があります。カップリングは、チップのアクティブ領域に微小解剖されたスライスを最初に配置してから、最終的な灌流システムの起動まで~1分しかかかりません。- ガラスピペットで脳スライス回収チャンバーからスライスを取り出し、連続カルボゲン化で90mmのプラスチック培養皿に入れます。マイクロダイセクションツールを使用して、HCまたはOBを周囲の脳スライス組織から分離します。
- 単離したHCまたはOB急性切片をガラスピペットでHD-MEAリザーバーに移します。MEAアクティブエリアのスライスを細いブラシでそっと位置合わせします。吸引システムでHD-MEAチップからすべての溶液をよく吸い込みます。
- 鉗子を使用して、アンカーをスライスの上にそっと置きます。
注意: アンカーは、カップリングの損失を避けるために、スライスを動かさずに配置する必要があります。 - チップリザーバーに溶液を静かに添加し、灌流システムを開始します。
注意: 最適な記録パラメータのために、灌流入口とポンプ出口からの層流を確保してください。 - 記録エリアが、部屋の照明システムを通して、または光学テーブルセットアップの日陰のケージで適切に暗くなっていることを確認してください。
- スライスを10分間順応させてから、記録または追加の薬理学的変調を開始します。
- Brainwave ソフトウェアを起動します。[ ファイル] > [新しい記録セッション] を選択します。記録パラメータを、 記録周波数 を1 Hz、 サンプリング周波数 を14 kHz/電極に設定します。 Amplifier Offset を変更して、チップをキャリブレーションします。
メモ: セクション 3.1.4.1 で前述したように、システム テストを実行するときは、必ず同じ記録パラメータを適用してください。 - Record(記録)を押して、あらかじめ設定された実験条件で取り込みを開始します。
- 最終記録の直後に、急性脳スライスの光イメージングをキャプチャします。スライスをスライス回収チャンバーに戻し、チップに付着した有機材料をブラシで取り除き、次のスライスに進みます。セクション3.4の説明に従ってHD-MEAをクリーニングします。
- ヒトiPS細胞の記録ワークスペースの準備とHD-MEAでのネットワーク全体の記録(図2B)
注:記録の前日またはヒトiPS細胞記録の直後に培地を交換してください(表1C)。機能的ニューロンを用いた研究では、培地を4日ごとに交換し、4、8、16、24のDIVでは、iPS細胞の記録直後に培地を交換しました。- HD-MEA取得プラットフォームを>70% EtOHで洗浄することにより、無菌作業環境を確保します。
- ポリジメチルシロキサン(PDMS)ベースキャップを基準として、フードの下のHD-MEAリングにそっと置きます。HD-MEAチップをiPS細胞記録ワークスペースに移動し、HD-MEAチップをデータ取得プラットフォームに取り付けます。
- 部屋の照明システムまたは光学テーブルの日陰のケージを通して、記録領域が適切に暗くなっていることを確認してください。
- HD-MEAチップを10分間平衡化させてから、記録または追加の薬理学的変調を開始します。
- Brainwave ソフトウェアを起動します。[ ファイル] > [新しい記録セッション] を選択します。録音パラメータを、 記録周波数 を50Hz、 サンプリング周波数 を18kHz/電極に設定します。 Amplifier Offset を変更して、チップをキャリブレーションします。
注意: セクション2.1.1で前述したように、コーティングとメッキの前にシステムテストを実行するときは、必ず同じ記録パラメータを適用してください。 - 実験計画の各日(すなわち、4、8、16、24 DIVs)におけるヒトiPS細胞ネットワークからの自然発火活性または薬理学的に誘発された反応を記録します。
注意: 安定した温度と湿度を維持し、細胞への温度ショックを防ぐために、チップを>30分間インキュベーターの外に放置しないでください。 - 実験中にHD-MEAを37°Cで5%CO2でインキュベートします。
- 実験終了後、ステップ3.4で説明したように、チップ上のニューロンネットワークを固定し、さらなる光学イメージングのために染色するか、HD-MEAを直接洗浄します。
- HD-MEAチップの洗浄
- 実験後、適切な廃棄物処理に従って溶液を廃棄し、dd-waterですすいでください。
- 選択した洗剤を追加し、Qチップでアクティブエリアとリザーバー全体を清掃し、洗剤を廃棄します。洗剤を補充し、20分間インキュベートしてから、洗剤を廃棄します。
- 実験室グレードの水で十分にすすいでください。次に、dd水で3〜4回すすぎます。
- 空気圧を使用して、HD-MEAチップを完全に乾燥させます。
4. HD-MEAからの大規模神経記録の解析
注:ステップ4.1はBrainwaveソフトウェア固有ですが、ステップ4.2は各ユーザーの市販のHD-MEAデバイスタイプに基づいて変更できます。
- 生データの前処理とイベント検出
- 記録された生データファイル(.brw)をBrainwaveソフトウェアで開きます。[ LFP 検出(LFP Detection)] または [ スパイク検出(Spike Detection)] > [分析(Analysis)] を選択します。
注:LFP検出は、ローパス4次 バターワースフィルター(1-100 Hz)によるIIRフィルタリングを採用しています。ハード閾値アルゴリズムには、150μVの高閾値、-150μVの下限閾値、70〜120msのエネルギーウィンドウ、10msの耐火期間、および1秒の最大イベント期間が含まれます。シングルおよびMUAスパイク検出は、ハイパス4次 バターワースフィルタ(300-3500Hz)によるIIRフィルタリングを採用しています。PTSDアルゴリズムは、標準偏差係数8、ピーク寿命期間2ms、耐火期間1msで適用されます。 - HCおよびOB回路の記録では、検出されたイベントファイル(.bxr)に [詳細ワークスペース ]オプションを追加して、実体顕微鏡からキャプチャされた構造光画像をインポートします。大規模なHC回路を調べる場合は、歯状回(DG)、肺門、角膜アンモニス1(CA1)、角膜アンモニス3(CA3)、嗅内皮質(EC)、鼻周囲皮質(PC)を含む構造層を作成します。大規模なOB回路を調べる場合は、嗅神経層(ONL)、糸球体層(GL)、外網状層(EPL)、僧帽弁細胞層(MCL)、顆粒細胞層(GCL)を含む構造層を作成します。EPLとMCLは、嗅覚皮質(OCx)を含む投影層(PL)と考えてください。
- 記録された生データファイル(.brw)をBrainwaveソフトウェアで開きます。[ LFP 検出(LFP Detection)] または [ スパイク検出(Spike Detection)] > [分析(Analysis)] を選択します。
- カスタム Python 計算パイプラインを使用したデータ処理
- ノイズ除去
- カスタム記述のPythonスクリプト26,29,32とh5py 3.6.0 pythonパッケージを使用して.bxrファイルを読み取ります。
- iPS細胞ネットワークの記録に関連するスパイク列と、HCおよびOBの脳スライス回路の記録に関連するLFPイベント列を抽出します。
- アクティブ電極の総数が平均イベントあたりの平均アクティブ電極の0.1%または10%未満のイベント、または統計的に妥当な発火率の範囲外にある検出されたイベントをランダムイベントとして特徴付け、それらを除去します。さらに、振幅とイベント期間のしきい値を適用します。
注:発火率の範囲では、0.1〜15スパイク/秒および0.1〜60LFPイベント/分が考慮されます。これらは、分析されたデータセットに使用されるレートしきい値の例です。レート、振幅、および期間のしきい値は、個々のデータによって異なります。 - 結果のイベント トレイン データを、付随する時空間情報とともに .npy ファイル形式で保存します。
- ラスターグラム
- フィルター処理されたイベントの .npy ファイルと .bxr ファイルを読み取り、Matplotlib pyplot 関数 (https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html) を使用してラスター プロットを生成します。
- さらに、層特異性を持つ脳スライス記録の場合は、ステップ4.1.2で生成した層に基づいて電極IDをソートおよびグループ化します。
- 平均発火活動
- .bxr ファイルの時系列データを処理し、各電極の平均発火率 (イベント数/記録時間) を計算します。
- 行と列が HD-MEA 64 x 64 配列の電極の座標を表し、各行列値が平均発火率を示すデータ行列を作成します。
- Python では、Matplotlib の imshow や Seaborn のヒートマップ関数などのプロット ライブラリを使用します。
- ここで「ホット」カラーマップを使用して、電極アレイ全体の平均発火率の空間分布を視覚的にカプセル化する有益なヒートマップを作成します。
- 代表的な波形トレース
- .brw ファイルから時系列データを読み取り、Matplotlib pyplot 関数を使用して波形トレースを生成します。(https://matplotlib.org/3.5.3/api/_as_gen/matplotlib.pyplot.html)。
- 必要な電極ID、タイムビン、および代表的な波形トレースの周波数帯域を入力します。これらの分析で定義される周波数帯域には、バンドパスフィルタリングされたδ、θ、β、およびγ周波数帯域を持つ低周波LFP振動(1〜100 Hz)が含まれます。鋭い波紋(SWR)(140-220 Hz);高周波シングルおよびMUA(300-3500 Hz)。周波数帯域δ、θ、β、およびγは、それぞれ1〜4Hz、5〜12Hz、13〜35Hz、および35〜100Hzです。
- パワースペクトル密度
- *.brw ファイルから時系列データを読み取り、ピリオドグラムを計算して、各時系列内の振動活動の根底にある支配的な周波数を識別します。
- 周波数-時間ダイナミクスの疑似カラー スペクトログラムを作成します。
注:スペクトルは、記録されたLFPの高速フーリエ変換を利用してスペクトルパワー密度を推定することにより、ウェルチ法を使用して計算されます41。 - 必要な電極ID、タイムビン、およびスペクトル密度マップの周波数帯域を入力します。これらの分析で定義される周波数帯域には、手順4.2.4で説明した周波数帯域が含まれます。
- 機能的なコネクティビティ
- ブレインスライス回路の記録については、手順4.2.6.2-4.2.6.4に従います。
- brw ファイルから時系列データを読み取り、ピアソンの相関係数 (PCC)42 を使用して、64 x 64 アレイ内のアクティブ電極のペア間の相互共分散を計算します。
- 多変量グレンジャー因果関係を使用してベクトル自己回帰モデルを時系列に当てはめ、ある時系列が別の時系列に与える影響を定量化します。
- 有向伝達関数 (DTF) を適用して、相関リンク内の方向情報フローを評価します。
注:多層ネットワークにおける機能的接続性は、すべての相互共分散値の平均と2つの標準偏差43,44を超える相関値のしきい値を設定することによって確立されます。 - iPS細胞の記録は、4.2.6.6-4.2.6.8の手順で行います。
- .bxr ファイルからスパイクトレイン データを読み取り、spike_train_correlation関数 (https://elephant.readthedocs.io/en/v0.7.0/reference/spike_train_correlation.html) を使用して、ビン化されたスパイク列のすべての組み合わせ間の PCC 相関係数の 64 行 64 列の行列を計算します。
注: 多層ネットワークにおける機能的な接続性は、すべての相互共分散値の平均と 2 つの標準偏差を超える相関値のしきい値を設定することによって確立されます。 - さらに、コネクティビティ・マトリクスに時空間フィルタ(STF)と距離依存遅延閾値(DdLT)のフィルタリング手順を実装して、最大伝搬速度(400 mm/sに設定)を超える可能性のあるペア接続を排除します45。
- フィルタリングおよび閾値演算を用いて結果の相互相関行列から負のピークを抽出し、フィルタリングおよび正規化相互相関ヒストグラム(FNCCH)アルゴリズム45を用いて抑制性接続を同定する。
- 各接続性マトリックスを動的グラフ (*.gexf) ファイルに変換します。
- ネットワーク接続マップ
- Gephiプログラム9.2バージョン(https://gephi.org)で データラボ を開き、動的グラフで特定の時間ビンをプロットします。
- 空間マッピングのレイアウト ウィンドウで [地理レイアウト (Geo Layout )] を適用します。
- 比較のために、 次数範囲(Degree Range )と エッジ ウェイト(Edge Weight )にパラメータ コンストレイントを設定します。
- 節点カラー(Nodal Color)、エッジ サイズ(Edge Size)、次数サイズ(Degree Size)を割り当てて、見やすくします。
- ノイズ除去
結果
マルチモデル時空間マッピングと振動発火特徴量の抽出
動的神経集団から生じるネットワーク全体のLFPとスパイクイベントを定量化するために、HC回路とOB回路、およびヒトiPS細胞ネットワークにおける同期大規模発火パターンを調べました。ステップ3.2で記録された脳スライス回路とステップ3.3で記録されたiPS細胞ネットワークを、プロトコルのステップ4.1-4.2に従って分析しました。まず、記録されたすべてのデータセットに対してイベント検出とノイズ除去を実行し、回路仕様に従って局所的に解決しました。次に、平均大規模LFPとスパイク発火パターンの地形疑似カラー空間マッピング、検出されたイベントのラスタグラム、およびフィルタリングされた波形の代表的な5秒トレースをプロットしました(図3A-I)。HC(図3A)、OB(図3B)、ヒトiPS細胞神経ネットワーク(図3C)のそれぞれの顕微鏡で撮影した光学画像に、大規模なLFPとスパイク発火率パターンのトポグラフィー擬似カラーマッピングを重ね合わせました。これにより、個々の回路やネットワークベースの発振パターンと応答を調べることができます。HCおよびOBラスタグラムには、HC回路のDG、Hilus、CA3、CA1、EC、およびPC層と、60秒の時間ビンでOBネットワークのONL、OCx、GL、PL、およびGCL層でソートされた検出されたLFPイベントカウントが含まれています(図3D、E)。ヒトiPS細胞ラスタグラムは、20秒の時間ビンで相互接続された培養ネットワークの同期検出スパイクイベントを表示します(図3G)。次に、大規模なHD-MEA記録サイトからの5s代表的なイベントトレースは、HC(すなわち、CA3の選択された電極)(図3G)およびOB(すなわち、GLの選択された電極)(図3H)回路で記録された振動周波数の範囲と、アレイ内の選択された4つのアクティブ電極からのヒトiPS細胞ネットワークにおけるマルチユニットスパイクバースト活性を示しています(図3I)).これらの例示的な信号は、バンドパスフィルタされたδ、θ、β、およびγ周波数帯域を有する低周波LFP振動(1〜100Hz)を含む生体信号シグネチャーを示す。鋭い波紋(SWR)(140-220 Hz);高周波シングルおよびMUA(300-3500 Hz)。最後に、パワースペクトル密度(PSD)分析を使用して、HD-MEAから記録された相互接続されたHCおよびOB回路の特定の振動帯域の電力の大きさを同時に定量化しました(図3J、K)。
マルチモーダルネットワークワイド機能コネクトーム
同時にアクティブなニューロンアンサンブルの同時発火パターンから多層ニューラルネットワークの大規模な接続性を推測するために、検出されたイベント内のアクティブ電極のペア間の相互共分散をプロトコルのステップ4.2.6に従って計算しました。ここでは、相関係数をHC回路とOB回路の層に基づいてソートするか、iPS細胞ネットワークでソートせず、対称マトリックスに格納しました。HC回路とOB回路の機能的コネクトームは、多変量グレンジャー因果関係と有向伝達関数(DTF)を適用して生成し、ある時系列が別の時系列に与える影響を定量化し、異なるネットワーク内の相関リンク内の方向情報の流れを評価しました。HC(図4A)とOB(図4B)のコネクトームマッピングとネットワークの可視化は、Gephiプログラム9.2バージョン(https://gephi.org)を使用して実行しました。HCとOBの脳スライス回路を比較するために、機能リンクに同様のパラメータ制約を設定し、検出されたLFPイベントの機能的接続性を100秒示しました。節点は強度の度合いに応じてスケーリングされ、節点の色は層を示し、リンクの色は層内および層間の接続を識別します。ヒトiPS細胞ネットワークの機能的コネクトームは、時空間フィルター(STF)と距離依存潜時閾値(DdLT)を適用し、有意なリンクの選択を強化し、意味のあるつながりの同定を精緻化することで、フィルタリングおよび正規化相互相関ヒストグラム(FNCCH)解析を適用することで生成されました。HD-MEAチップ全体におけるヒトiPS細胞ネットワークのコネクトームマッピング(図4C)をGephiを用いて可視化しました。節点の色は興奮性または抑制性の入力を示し、リンクの色は接続を示します。
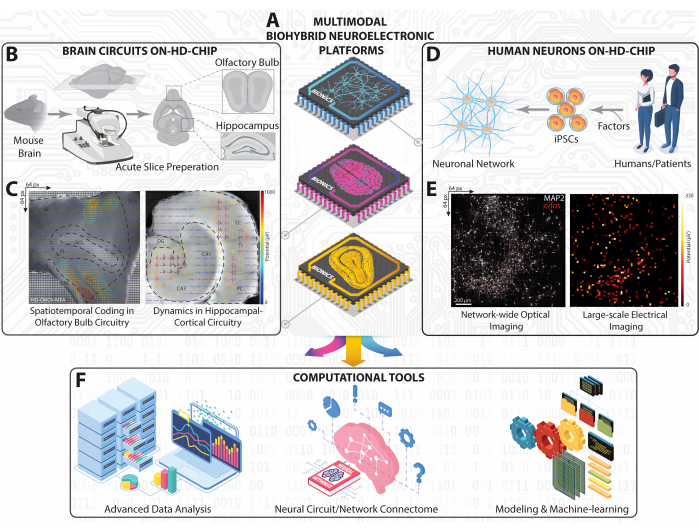
図1:大規模HD-MEAの実験・計算プラットフォームの概要 (A)HC、OB、ヒトiPS細胞の神経回路やネットワークから神経動態を捉えるために、CMOSベースのHD-MEAで実現したマルチモーダルバイオハイブリッド神経電子プラットフォームの等尺性模式図。(B)マウスの脳スライスの概略的ワークフローと、HCおよびOBスライスを得るためのワークスケープ。(C)HCスライスとOBスライス全体から同時に記録された大規模発火パターンの地形表現と、抽出した細胞外波形をスライス光学画像に重ね合わせたもの。(D)ヒトから得られたiPS細胞の神経回路網の模式図。(E)HD-MEAチップ上のヒト神経ネットワーク全体の細胞c-fosおよび体細胞/樹状突起MAP-2を示す蛍光顕微鏡写真(左)と平均発火活動マップ全体(右)。(F)HD-MEAでの大規模記録から得られた多次元ニューラルデータを解析するための高度なデータ解析、コネクティビティマッピング、AI機械学習ツールなどの計算フレームワーク。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2: ex-vivo 脳スライスおよび in vitro ヒトiPS細胞培養の準備と記録のワークスペースのレイアウト。 (A)HCおよびOBスライスを調製するためのセットアップを示す概略的なワークフローで、各ワークスペースに必要なツールと機器を備えています。(B)ヒトiPS細胞培養準備のための概略図(必要なツールとデバイスを含む)。材料の完全なリストは、手順1.2.2、2.1、2.2、3.1.1、3.3、および 材料表に含まれています。 この図の拡大版をご覧になるには、ここをクリックしてください。
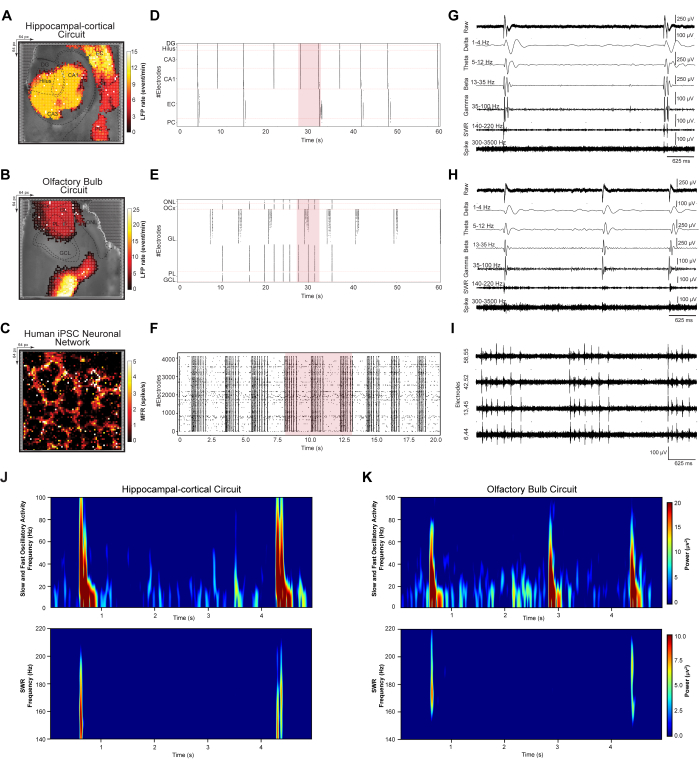
図3:ネットワークダイナミクスの時空間パターンのマッピングと抽出。 (A-C)顕微鏡の光画像に重ね合わせた5分間の記録で計算された平均LFPおよびスパイクレート空間マップ。(D-F)検出され、ノイズ除去された LFP イベントを 60 秒のデータ サブサンプルで、スパイクを 20 秒のデータ サブサンプルで示すラスター プロット。(ジーアイ)ラスタープロットデータサブサンプルの5秒間のセグメント(ラスタープロットで赤く強調表示)からの代表的な波形トレースの抽出、生のLFP振動バンド(1-100 Hz)として表示。δ(1-4 Hz)、θ(5-12 Hz)、β(13-35 Hz)、およびγ(35-100 Hz)周波数帯域。SWR(140-220 Hz);高周波シングルおよびMUAスパイク(300-3500 Hz)。(J、K)高速および低速振動LFP(1-100 Hz)およびSWR(140-220 Hz)のパワースペクトル密度マップ。この図の拡大版をご覧になるには、ここをクリックしてください。
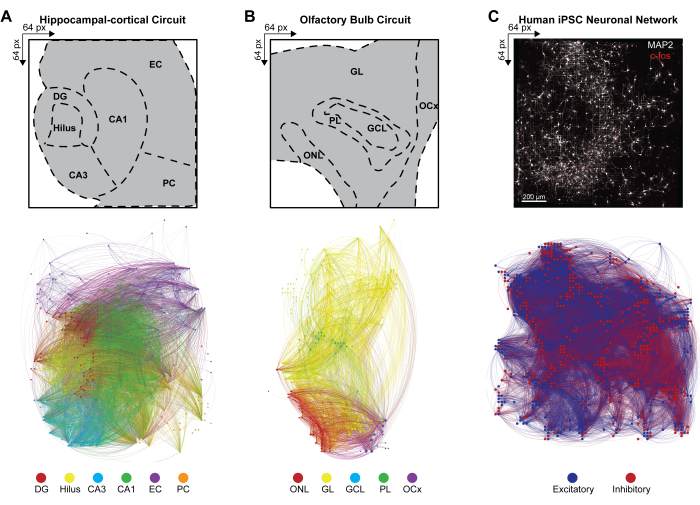
図4:マルチモーダルネットワーク全体の機能的コネクトームの組織化。(A-C) ノードがカラーバーの凡例(下図)の1つに対応し、リンク(またはエッジ)は接続ノードと一致するようにシェーディングされているノード機能接続を示すGephiマップ。(A)HC、(B)OB、(C)iPS細胞層の凡例を64×64のアレイで表示します。HC レイヤーと OB レイヤーは 100 秒のタイム ビンにプロットされ、視覚化のために表示されるノードとリンクの数を効果的に減らします。 この図の拡大版をご覧になるには、ここをクリックしてください。
表1:iPS細胞神経細胞培養用の脳スライス調製および培地の溶液。 (A)ex-vivo脳スライス調製用の高スクロース切断液。(B)ex-vivo脳スライスの調製および記録のためのaCSF記録溶液。(C-D)ヒト神経細胞iPS細胞培地プロトコル(C)は細胞融解、HD-MEAチップコーティング、培養HD-MEA維持に使用されるBrainPhys完全培地、(D)HD-MEA細胞プレーティングに使用されるドット培地。この表をダウンロードするには、ここをクリックしてください。
表2:HD-MEA記録取得に関する一般的な問題のトラブルシューティング。 HD-MEAチップ、記録プラットフォーム、システムノイズ、およびソフトウェアに関連する一般的な問題、その潜在的な原因、およびトラブルシューティングソリューションのリスト。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
相互に結びついたニューロンのアンサンブルから生まれる時空間ニューロン活動の複雑なダイナミクスは、神経科学において長い間興味をそそられてきました。パッチクランプ、標準MEA、Ca2+イメージングなどの従来の方法論は、脳の複雑さに関する貴重な洞察を提供してきました。しかし、ネットワーク全体の包括的な計算ダイナミクスを捉えるには不十分な場合が多い21,22,23。このJoVE研究で詳述されているように、HD-MEAプラットフォームの技術プロトコルは、細胞集合体から拡張ネットワーク(すなわち、急性、ex-vivoマウス脳スライス、in vitroヒトiPS細胞ネットワーク)まで、多様なモダリティにわたる神経ダイナミクスのパノラマビューを提供し、大きな飛躍を表しています26,29,30,32。
急性期のex-vivoマウス脳切片は、神経細胞研究の基礎となるツールであり、分子レベルおよび回路レベルの調査を容易にしています6,7。しかし、組織の生存率を維持するという課題は、根強いボトルネックとなっていました。この研究で説明したプロトコルでは、これらのスライスの品質と寿命を最適化して、HD-MEAプラットフォームでの利点を活用するための重要な変更を導入しています。このプロトコルは、スライスの均一性を達成することの重要性を強調しており、スライス時間の延長というトレードオフにもかかわらず、ビブラトームの使用は、その精度と組織の損傷の最小化により、組織チョッパーよりも好まれます。ii)組織の生存率を維持するために、抽出から記録までのプロセス全体で一定のカルボゲン化を確保します。iii)温度を調節し、記録前に十分な回復時間を確保します。iv)アガロースブロックまたはカビを利用して、脳を安定させ、裂け目を防ぎ、接着剤の接触を最小限に抑えます。v)HD-MEAリザーバー内のカルボゲン化aCSFの最適な流速を維持して、デカップリング、ノイズ、ドリフトなどの問題を回避しながらスライスの健全性を確保します(表2)。
マウスの脳切片とヒトiPS細胞の調製物の両方において、電極と組織界面の結合を増強することが最も重要である30,46,47。私たちのプロトコルは、接着促進分子ポリ-dl-オルニチン(PDLO)を利用することの重要性を強調しています。この分子は、電気信号を検出するための表面積を増大させるだけでなく、電気伝導率も高める46。そうすることで、細胞の接着、成長、および機能的なネットワーク特性の発達を促進します。このような最適化は、HD-MEAプラットフォームの有効性を高める上で極めて重要な役割を果たします。これにより、マイクロスケールのex-vivoおよびin vitroコネクトームとその時空間発火シーケンスの正確で一貫性のある分析が保証されます。特に、PDLOは、ニューロン培養における自然発火活性と電気刺激に対する応答性を促進するという点で、ポリエチレンイミン(PEI)やポリ-l-オルニチン(PLO)などの他の基質よりも優れていることが示されています。さらに、PDLOはHD-MEAの表面官能基化に使用されており、電極スライス結合界面を強化し、OBスライスとHCスライスの両方でS/N比を増加させることが示されています26,29。特注のプラチナアンカーを追加することで、電極スライス界面の結合がさらに強化され、より高いS/N比での録音が可能になります。
HD-MEAをex-vivoマウスの脳スライスとin vitroヒトiPS細胞ネットワークの両方に利用することで、広範でマルチスケール、マルチモーダルなダイナミクスを探索することに長けた方法が導入されます。しかし、この革新的なアプローチは、特にデータ管理において大きな課題をもたらします48,49,50,51。18 kHz/電極のサンプリング周波数で取得した1回のHD-MEA記録では、155 MB/秒という驚異的なデータが生成されます。データ量は、複数のスライス、多様な薬理学的条件、または長期間の記録を考慮に入れると、急速に増加します。このような情報の流入には、堅牢なストレージインフラストラクチャと、処理を合理化するための高度な計算ツールが必要です。HD-MEAプラットフォームが何千ものニューロンアンサンブルから同時にデータを収集できることは、恩恵であると同時にハードルでもあります。脳機能の計算ダイナミクスに関する最高の洞察を提供しますが、洗練された分析フレームワークも必要です。このJoVEプロトコルでは、大規模なイベント検出、分類、グラフ理論、頻度分析、機械学習などの計算戦略の例を提供しています。これらの手法は、複雑なニューラルデータの解析という課題に取り組むためになされた集中的な努力を強調しています。それにもかかわらず、これらの多次元ニューラルデータセットを分析するためのより高度な計算ツールの開発の余地はまだかなりあります。適切なツールと方法論を武器に、HD-MEAプラットフォームの可能性は拡大し、健康な状態と病理学的状態の両方における脳機能の複雑さに関する深い洞察を提供します。
要するに、HD-MEAプラットフォームは、ここで説明した詳細なプロトコルや計算ツールと統合することで、脳の複雑な働きを理解するための革新的なアプローチを提供するのです。大規模、マルチスケール、マルチモーダルのダイナミクスを捉えることで、学習、記憶、情報処理などのプロセスに関する貴重な洞察を提供します。さらに、体外ヒトiPS細胞ネットワークへの応用は、薬物スクリーニングや個別化医療に革命をもたらす可能性を秘めています。しかし、このプラットフォームは神経科学研究における重要な進歩を表していますが、固有の技術的課題を認識して対処することが重要です。HD-MEAプラットフォームは、継続的な改良と高度な計算ツールの統合により、正確な診断ツール、特定のバイオマーカーの特定、神経疾患の標的療法の新時代の到来を告げる態勢を整えています。
開示事項
著者は、競合または金銭的利益がないことを宣言します。
謝辞
この研究は、機関投資家基金(DZNE)、ヘルムホルツ検証基金内のヘルムホルツ協会(HVF-0102)、およびドレスデン国際生物医学・生物工学大学院(DIGS-BB)の支援を受けました。また、DZNE-Dresdenの行動動物実験プラットフォーム(Alexander Garthe、Anne Karasinsky、Sandra Günther、Jens Bergmann)の支援にも感謝します。図1の一部は、プラットフォーム BioRender.com を使用して作成されたものであることを認識したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 150 mm Glass Petri Dish | generic | generic | Brain Preparation Workspace, Brain Slice Recording Workspace |
| 0.22 μm Sterile Filter Unit | Assorted | Assorted | Assorted |
| 90 mm Plastic Culture Dish | TPP | 93100 | Brain Preparation Workspace, Brain Slice Recording Workspace |
| Agarose | Roth | 6351.5 | Brain Preparation Workspace |
| Agarose Mold | CUSTOM | CUSTOM | Brain Preparation Workspace; Custom designed 3D Printer Design, available upon request |
| Aluminum Foil | generic | generic | Brain Extraction Workspace |
| Anesthesia chamber | generic | generic | Brain Extraction Workspace; Assorted Beaker, Bedding etc |
| Ascorbic Acid | Sigma Aldrich | A4544-25G | Solution Preparation Workspace |
| Assorted Beakers | generic | generic | Solution Preparation Workspace; 50 mL |
| Assorted Luers | Cole Parmer | 45511-00 | Brain Slice Recording Workspace |
| Assorted Volumetric flasks | generic | generic | Solution Preparation Workspace; 500 mL, 1 L |
| B27 Supplement | Life Technologies | 17504-044 | BrainXell Commercial Supplier Protocol |
| BDNF | Peprotech | 450-02 | BrainXell Commercial Supplier Protocol |
| Biological Safety Cabinet with UV Lamp | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| BrainPhys Neuronal Medium | STEMCELL Technologies | 05790 | CDI, and BrainXell Commerical Supplier Protocol |
| Brainwave Software | 3Brain AG | Version 4 | Brain Slice and Human iPSC Recording Workspace |
| BrainXell Glutamatergic Neuron Assay | BrainXell | BX-0300 | BrainXell Commercial Supplier Protocol |
| CaCl2 | Sigma Aldrich | 21115-100ML | Solution Preparation Workspace |
| Carbogen | generic | generic | All Workspaces; 95%/5% O2 and CO2 mixture |
| Cell Culture Incubator | Assorted | Assorted | Assorted |
| CMOS-based HD-MEA chip | 3Brain AG | CUSTOM | Brain Slice and Human iPSC Recording Workspace |
| Conical Tubes, 50 mL, Falcon (Centrifuge Tubes) | STEMCELL Technologies | 38010 | CDI Commerical Supplier Protocol |
| Crocodile Clip Grounding Cables | JWQIDI | B06WGZG17W | Brain Slice Recording Workspace |
| Curved Forceps | FST | 11052-10 | Brain Extraction Workspace |
| DMEM/F12 Medium | Life Technologies | 11330-032 | BrainXell Commercial Supplier Protocol |
| Dulbecco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | STEMCELL Technologies | 37350 | CDI Commerical Supplier Protocol |
| Filter Paper | Macherey-Nagel | 531 011 | Brain Preparation Workspace |
| Fine Brush | Leonhardy | 773 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Forceps | VITLAB | 67895 | Brain Slice Recording Workspace |
| GDNF | Peprotech | 450-10 | BrainXell Commercial Supplier Protocol |
| Geltrex | Life Technologies | A1413201 | BrainXell Commercial Supplier Protocol |
| Glass pasteur pipette | Roth | 4518 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Glucose | Sigma Aldrich | G7021-1KG | Solution Preparation Workspace |
| GlutaMAX | Life Technologies | 35050-061 | BrainXell Commercial Supplier Protocol |
| Gravity-based Perfusion System | ALA | VC3-8xG | Brain Slice Recording Workspace |
| HD-MEA Recording platform | 3Brain AG | CUSTOM | Brain Slice and Human iPSC Recording Workspace |
| Heater | Warner Instruments | TC-324C | Brain Slice Recording Workspace |
| Hemocytometer or Automated Cell Counter | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| Hypo Needles | Warner Instruments | 641489 | Brain Slice Recording Workspace |
| iCell GlutaNeurons Kit, 01279 | CDI | R1061 | CDI Commerical Supplier Protocol |
| Iris Scissors | Vantage | V95-304 | Brain Extraction Workspace |
| Isoflurane | Baxter | HDG9623 | Brain Extraction Workspace |
| KCl | Sigma Aldrich | P5405-250G | Solution Preparation Workspace |
| Laminin | Sigma-Aldrich | L2020 | CDI Commerical Supplier Protocol |
| Liquid Nitrogen Storage Unit | Assorted | Assorted | HD-MEA Coating, Plating, Mainainance Workspace |
| Magnetic Stirrer | generic | generic | Solution Preparation Workspace |
| Metal Screws | Thorlabs | HW-KIT2/M | Brain Slice Recording Workspace |
| MgCl2 | Sigma Aldrich | M1028-100ML | Solution Preparation Workspace |
| MgSO4 | Sigma Aldrich | 63138-250G | Solution Preparation Workspace |
| Microdissection Tool Holder | Braun | 4606108V | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Microdissection Tool Needle | Braun | 9186166 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Modular Stereomicroscope | Leica | CUSTOM | Brain Slice Recording Workspace; custom specifications and modifications |
| N2 Supplement | Life Technologies | 17502-048 | CDI, and BrainXell Commercial Supplier Protocol |
| NaCl | Sigma Aldrich | S3014-1KG | Solution Preparation Workspace |
| NaH2PO4 | Sigma Aldrich | S0751-100G | Solution Preparation Workspace |
| NaHCO3 | Sigma Aldrich | S5761-500G | Solution Preparation Workspace |
| Neurobasal Medium | Life Technologies | 21103-049 | BrainXell Commercial Supplier Protocol |
| Optical Cage System | Thorlabs | Assorted | Brain Slice Recording Workspace |
| Optical Table w/Breadboard | Thorlabs | SDA7590 | Brain Slice Recording Workspace |
| PDLO | Sigma Aldrich | P0671 | HD-MEA Coating, Brain Slice Recording Workspace |
| Penicillin-streptomycin, 100x | Thermo Fisher Scientific | 15140-122 | CDI Commerical Supplier Protocol |
| Pipette tips | TipONE | S1120-8810 | Brain Slice Recording Workspace |
| Pipettors | Assorted | Assorted | Assorted |
| Platinum Anchor | CUSTOM | CUSTOM | Brain Slice Recording Workspace |
| Polyethylene Tubing | Assorted | Assorted | Brain Slice Recording Workspace |
| Pump | MasterFlex | 78018-22 | Brain Slice Recording Workspace |
| Razor Blade | Apollo | 10179960 | Brain Preparation Workspace |
| Reference Electrode Cell Culture Cap | CUSTOM | CUSTOM | Human iPSC Recording Workspace; Custom designed 3D Printer Design, available upon request |
| Rubber Pipette Bulb | Duran Wheaton Kimble | 292000205 | Brain Slice Preparation Workspace, Brain Slice Recording Workspace |
| Serological Pipettes, 1 mL, 2 mL, 5 mL, 10 mL, 25 mL | Assorted | Assorted | Assorted |
| Slice Recovery Chamber | CUSTOM | CUSTOM | Brain Slice Recovery Workspace; Custom designed 3D Printer Design, available upon request |
| Spatula | ISOLAB | 047.06.150 | Brain Preparation Workspace |
| Sucrose | Sigma Aldrich | 84100-1KG | Solution Preparation Workspace |
| Super Glue | UHU | 358221 | Brain Slice Preparation Workspace |
| Surgical Scissors | Peters Instruments | BC 344 | Brain Extraction Workspace |
| Tabletop Centrifuge | Assorted | Assorted | Assorted |
| TGF-β1 | Peprotech | 100-21C | BrainXell Commercial Supplier Protocol |
| Tissue Paper | generic | generic | Brain Extraction Workspace |
| Trypan Blue | STEMCELL Technologies | 07050 | CDI Commerical Supplier Protocol |
| Upright Microscope | Olympus | CUSTOM | Imaging Workspace; Custom specifications and modifications |
| Vacusip | Integra | 159010 | Brain Slice Recording Workspace |
| Vibratome | Leica | VT1200s | Brain Slice Preparation Workspace; Includes: Specimen plate, buffer tray, ice tray, specimen plate holding tool, vibratome blade adjusting tool |
| Vibratome Blade | Personna | N/A | Brain Slice Preparation Workspace |
| Water Bath | Lauda | L000595 | Brain Slice Recovery Workspace |
参考文献
- Hebb, D. O. . The Organization of Behavior; A Neuropsychological Theory. , (1949).
- Cossart, R., Garel, S. Step by step: cells with multiple functions in cortical circuit assembly. Nat Rev Neurosci. 23, 395-410 (2022).
- Carrillo-Reid, L., Yuste, R. Playing the piano with the cortex: role of neuronal ensembles and pattern completion in perception and behavior. Curr Opin Neurobiol. 64, 89-95 (2020).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nat Neurosci. 7, 446-451 (2004).
- Buzsáki, G. Neural Syntax: Cell assemblies, synapsembles, and readers. Neuron. 68 (3), 362-385 (2010).
- Huang, Y., Williams, J. C., Johnson, S. M. Brain slice on a chip: opportunities and challenges of applying microfluidic technology to intact tissues. Lab Chip. 12 (12), 2103-2117 (2012).
- Cho, S., Wood, A., Bowlby, M. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Curr Neuropharmacol. 5 (1), 19-33 (2007).
- Bliss, T. V. P., Collingridge, G. L. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39 (1993).
- Anderson, P., Morris, R., Amaral, D., Bliss, T., O'Keefe, L. . The Hippocampus Book. , (2006).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nat Neurosci. 20, 1434-1447 (2017).
- Mori, K., Nagao, H., Yoshihara, Y. The olfactory bulb: Coding and processing of odor molecule information. Science. 286 (5440), 711-715 (1999).
- Buck, L., Axel, R. A novel multigene family may encode odorant receptors: A molecular basis for odor recognition. Cell. 65 (1), 175-187 (1991).
- Bushdid, C., Magnasco, M. O., Vosshall, L. B., Keller, A. Humans can discriminate more than 1 trillion olfactory stimuli. Science. 343 (6177), 1370-1372 (2014).
- Kempermann, G. Why new neurons? Possible functions for adult hippocampal neurogenesis. J Neurosci. 23 (3), 635-638 (2003).
- Aimone, J. B., Wiles, J., Gage, F. H. Computational influence of adult neurogenesis on memory encoding. Neuron. 61 (2), 187-202 (2009).
- Nithianantharajah, J., Hannan, A. J. Enriched environments, experience-dependent plasticity and disorders of the nervous system. Nat Rev Neurosci. 7, 697-709 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Espuny-Camacho, I., et al. Pyramidal neurons derived from human pluripotent stem cells integrate efficiently into mouse brain circuits in vivo. Neuron. 77 (3), 440-456 (2013).
- Rajamohan, D., et al. Current status of drug screening and disease modelling in human pluripotent stem cells. Bioessays. 35 (3), 281-298 (2013).
- Heilker, R., Traub, S., Reinhardt, P., Schöler, H. R., Sterneckert, J. iPS cell derived neuronal cells for drug discovery. Trends Pharmacol Sci. 35 (10), 510-519 (2014).
- Zhao, S. R., Mondéjar-Parreño, G., Li, D., Shen, M., Wu, J. C. Technical applications of microelectrode array and patch clamp recordings on human induced pluripotent stem cell-derived cardiomyocytes. J Vis Exp. (186), e64265 (2022).
- Hamill, O. P., McBride, D. W. Induced membrane hypo/hyper-mechanosensitivity: A limitation of patch-clamp recording. Annu Rev Physiol. 59, 621-631 (1997).
- Manz, K. M., Siemann, J. K., McMahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protoc. 2 (2), 100442 (2021).
- Lee, C. H., Park, Y. K., Lee, K. Recent strategies for neural dynamics observation at a larger scale and wider scope. Biosens Bioelectron. 240, 115638 (2023).
- Urai, A. E., Doiron, B., Leifer, A. M., Churchland, A. K. Large-scale neural recordings call for new insights to link brain and behavior. Nat Neurosci. 25 (1), 11-19 (2022).
- Hu, X., Khanzada, S., Klütsch, D., Calegari, F., Amin, H. Implementation of biohybrid olfactory bulb on a high-density CMOS-chip to reveal large-scale spatiotemporal circuit information. Biosens Bioelectron. 198, 113834 (2022).
- Amin, H., Marinaro, F., Tonelli, D. D. P., Berdondini, L. Developmental excitatory-to-inhibitory GABA-polarity switch is disrupted in 22q11.2 deletion syndrome: A potential target for clinical therapeutics. Sci Rep. 7 (1), 15752 (2017).
- Amin, H., Nieus, T., Lonardoni, D., Maccione, A., Berdondini, L. High-resolution bioelectrical imaging of Aβ-induced network dysfunction on CMOS-MEAs for neurotoxicity and rescue studies. Sci Rep. 7 (1), 2460 (2017).
- Emery, B. A., Hu, X., Khanzada, S., Kempermann, G., Amin, H. High-resolution CMOS-based biosensor for assessing hippocampal circuit dynamics in experience-dependent plasticity. Biosens Bioelectron. 237, 115471 (2023).
- Amin, H., et al. Electrical responses and spontaneous activity of human iPS-derived neuronal networks characterized for 3-month culture with 4096-electrode arrays. Front Neurosci. 10, 121 (2016).
- Lonardoni, D., et al. Recurrently connected and localized neuronal communities initiate coordinated spontaneous activity in neuronal networks. PLoS Comput Biol. 13 (7), e1005672 (2017).
- Emery, B. A., et al. Large-scale multimodal recordings on a high-density neurochip: Olfactory bulb and hippocampal networks. 2022 44th Annual International Conference of the IEEE Engineering in Medicine & Biology Society (EMBC). , 3111-3114 (2022).
- Rossi, L., Emery, B. A., Khanzada, S., Hu, X., Amin, H. Pharmacologically and electrically-induced network-wide activation of olfactory bulb with large-scale biosensor. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Emery, B. A., et al. Recording network-based synaptic transmission and LTP in the hippocampal network on a large-scale biosensor. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Hierlemann, A., Frey, U., Hafizovic, S., Heer, F. Growing cells atop microelectronic chips: Interfacing electrogenic cells in vitro with CMOS-based microelectrode arrays). Proceedings of the IEEE. 99 (2), 252-284 (2011).
- Berdondini, L., et al. Active pixel sensor array for high spatio-temporal resolution electrophysiological recordings from single cell to large scale neuronal networks. Lab Chip. 9, 2644-2651 (2009).
- Siegle, J. H., Hale, G. J., Newman, J. P., Voigts, J. Neural ensemble communities: open-source approaches to hardware for large-scale electrophysiology. Curr Opin Neurobiol. 32, 53-59 (2015).
- Amin, H., Maccione, A., Zordan, S., Nieus, T., Berdondini, L. High-density MEAs reveal lognormal firing patterns in neuronal networks for short and long term recordings. 2015 7th International IEEE/EMBS Conference on Neural Engineering (NER). , 1000-1003 (2015).
- Altuntac, E., et al. Bottom-up neurogenic-inspired computational model. 2023 IEEE BioSensors Conference (BioSensors). , 1-4 (2023).
- Maccione, A., et al. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. J Neurosci Methods. 177 (1), 241-249 (2009).
- Welch, P. D. The use of fast Fourier transform for the estimation of power spectra: A method based on time averaging over short, modified periodograms. IEEE Transactions on Audio and Electroacoustics. 15 (2), 70-73 (1967).
- Eggermont, J. J., Munguia, R., Pienkowski, M., Shaw, G. Comparison of LFP-based and spike-based spectro-temporal receptive fields and cross-correlation in cat primary auditory cortex. PLoS One. 6 (5), e20046 (2011).
- Damos, P. Using multivariate cross correlations, Granger causality and graphical models to quantify spatiotemporal synchronization and causality between pest populations. BMC Ecol. 16, 33 (2016).
- Kaminski, M. J., Blinowska, K. J. A new method of the description of the information flow in the brain structures. Biol Cybern. 65, 203-210 (1991).
- Pastore, V. P., Massobrio, P., Godjoski, A., Martinoia, S. Identification of excitatory-inhibitory links and network topology in large-scale neuronal assemblies from multi-electrode recordings. PLoS Comput Biol. 14 (8), e1006381 (2018).
- Amin, H., Dipalo, M., De Angelis, F., Berdondini, L. Biofunctionalized 3D nanopillar arrays fostering cell guidance and promoting synapse stability and neuronal activity in networks. ACS Appl Mater Interfaces. 10 (17), 15207-15215 (2018).
- Woeppel, K., Yang, Q., Cui, X. T. Recent advances in neural electrode-tissue interfaces. Curr Opin Biomed Eng. 4, 21-31 (2017).
- Steinmetz, N. A., Koch, C., Harris, K. D., Carandini, M. Challenges and opportunities for large-scale electrophysiology with Neuropixels probes. Curr Opin Neurobiol. 50, 92-100 (2018).
- Siegle, J. H., Hale, G. J., Newman, J. P., Voigts, J. Neural ensemble communities: open-source approaches to hardware for large-scale electrophysiology. Curr Opin Neurobiol. 32, 53-59 (2015).
- Freeman, J. Open source tools for large-scale neuroscience. Curr Opin Neurobiol. 32, 156-163 (2015).
- Stevenson, I. H., Kording, K. P. How advances in neural recording affect data analysis. Nat Neurosci. 14 (2), 139-142 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved