Method Article
הדמיית מיקרוסקופ אפיפלואורסצנטי בהילוך מהיר של Pseudomonas aeruginosa ו - Staphylococcus aureus פנוטיפים הטרוגניים
* These authors contributed equally
In This Article
Summary
בכתב יד זה, אנו מספקים פרוטוקול מקיף להערכת הישרדות אנטיביוטיקה עבור Pseudomonas aeruginosa ו - Staphylococcus aureus, הפיכת פלסמידים ל - P. aeruginosa ו- S. aureus כדי ליצור זני כתב ולדמיין וריאנטים פנוטיפיים, כגון מתמידים, על ידי מיקרוסקופ אפיפלואורסצנטי בהילוך מהיר.
Abstract
התמדה אנטיביוטית היא תופעה שבה מספר קטן של תאי חיידקים באוכלוסייה רגישה גנטית שורדים טיפול אנטיביוטי שהורג את התאים הזהים האחרים מבחינה גנטית. חיידקים מתמידים יכולים לחדש את השכפול ברגע שהטיפול האנטיביוטי מסתיים, ומקובל לחשוב שהם עומדים בבסיס כישלון הטיפול הקליני. עבודה שנעשתה לאחרונה תוך רתימת כוחה של מיקרוסקופ פלואורסצנטי בהילוך מהיר, שבו חיידקים מסומנים בכתבי תמלול פלואורסצנטיים, כתבים תרגומיים ו/או צבעים למגוון תכונות תאיות, קידמה את הבנתנו לגבי מתמידי Escherichia coli מעבר למה שניתן ללמוד ממבחני הישרדות אנטיביוטיים ברמת האוכלוסייה. גישות חד-תאיות כאלה, ולא מבחני אוכלוסייה בתפזורת, חיוניות לשרטוט המנגנונים של היווצרות מתמשכת, תגובת נזק והישרדות. עם זאת, שיטות לחקר מתמידים במינים פתוגניים חשובים אחרים ברמת פירוט זו נותרו מוגבלות.
מחקר זה מספק גישה ניתנת להתאמה להדמיית הילוך מהיר של Pseudomonas aeruginosa (מוט גראם-שלילי) וסטפילוקוקוס אאורוס (קוקוס גראם-חיובי) במהלך טיפול אנטיביוטי והתאוששות. אנו דנים בגישות גנטיות מולקולריות להחדרת כתבים פלואורסצנטיים לחיידקים אלה. באמצעות כתבים אלה, כמו גם צבעים, אנו יכולים לעקוב אחר השינויים הפנוטיפיים, התכונות המורפולוגיות והגורלות של תאים בודדים בתגובה לטיפול אנטיביוטי. בנוסף, אנו מסוגלים לצפות בפנוטיפים של מתמידים בודדים בזמן שהם מבצעים החייאה לאחר הטיפול. בסך הכל, עבודה זו משמשת משאב עבור אלה המעוניינים לעקוב אחר הישרדות וביטוי גנים של תאים בודדים שטופלו באנטיביוטיקה, כולל מתמידים, הן במהלך הטיפול והן לאחריו, בפתוגנים חשובים מבחינה קלינית.
Introduction
פתוגנים חיידקיים יכולים להתחמק מהשפעות האנטיביוטיקה באמצעות שני מנגנונים עיקריים: עמידות לאנטיביוטיקה, הכוללת שינויים גנטיים, וסבילות פנוטיפית, הכוללת שינויים שאינם גנטיים. עמידות לאנטיביוטיקה היא תופעה מקודדת גנטית המקנה את היכולת של תא חיידק נתון לא רק לשרוד אלא גם להשתכפל בנוכחות אנטיביוטיקה1. סבילות פנוטיפית, אשר יכולה להקיף חיידקים עמידים לאנטיביוטיקה או מתמידים לאנטיביוטיקה, מתרחשת כאשר תאים עומדים בטיפול אנטיביוטי קוטל חיידקים מבלי להשיג את היכולת להשתכפל בנוכחות ריכוז מעכב של אנטיביוטיקה 1,2. מה שמבדיל בין סבילות להתמדה הוא שסובלנות מתייחסת ליכולת של כלל האוכלוסייה לשרוד טיפול, בעוד שהתמדה מתייחסת לתת-קבוצה של אוכלוסייה איזוגנית אך הטרוגנית פנוטיפית ששורדת טיפול אנטיביוטי. כאשר תרבית משובטים מטופלת באנטיביוטיקה קוטלת חיידקים וניצולים שנותרו בתרבית משורטטים כנגד הזמן בקנה מידה לוג-ליניארי, עקומה ביפאזית מזוהה בדרך כלל כאשר מתמידים נוכחים. בעקומות אלה, השלב הראשון מראה שרוב האוכלוסייה מומתת מהר יחסית, והשלב השני מצביע על כך שחלק עיקש אנטיביוטי נהרג בקצב איטי יותר או בכלל לא 1,2.
התמדה אנטיביוטית מהווה נטל גדול על מערכות הבריאות העולמיות. לדוגמה, Staphylococcus aureus ו- Pseudomonas aeruginosa persisters, שהם מוקד מאמר זה, נחשבים כגורמים לזיהומים סרבניים אנטיביוטיים, כולל זיהומים חוזרים בדרכי הנשימה בחולים עם סיסטיק פיברוזיס וזיהומים כרונייםבפצעים 3,4. לכן, הבהרה נוספת של ביולוגיה תאית מתמשכת ותוכניות פנוטיפיות היא קריטית. בעוד שהושגה התקדמות בהבנת האופן שבו מתמידים נוצרים ומבצעים החייאה, פערי ידע קריטיים הנוגעים לתיאום של תכנות מחדש מטבולי ואירועים מולקולריים בתאים בודדים העומדים בבסיס ההתמדה נותרו 5,6,7,8.
לימוד יעיל של התמדה הוכח כאתגר טכני. מאחר שהתמדה נצפית רק בתת-קבוצה קטנה של אוכלוסיית חיידקים, טכניקות שדוגמות אוכלוסיות חיידקים בתפזורת לעתים קרובות אינן מצליחות ללכוד מידע ביולוגי רלוונטי 1,2,8,9,10. יתר על כן, מאחר ששינויים פנוטיפיים העומדים בבסיס ההתמדה הם חולפים ואינם תורשתיים, מעקב אחר גורלם של תאים מתמידים יכול להיות מורכב 1,8,9,10,11. ברגע שהחיידקים המתמידים חוזרים לצמוח, הם יכולים להתחלק ולהוליד גם מתמידים וגם לא מתמידים, מה שלא מאפשר להעשיר אוכלוסיות מתמידות טהורות על ידי תרבית. אתגרים אלה מדגישים את הצורך בטכניקות שיכולות למלא את הקריטריונים הבאים: 1) היכולת ללכוד מידע ביולוגי של תאים חיים ובודדים 2) היכולת לשמש יחד עם צבעים פלואורסצנטיים, גשושיות, חיישנים וכתבים המאפשרים לחקור פנוטיפים של תאים בודדים באוכלוסיות הטרוגניות לאורך זמן.
ההתקדמות האחרונה בטכנולוגיות של תא בודד סיפקה דרך לחקור ביעילות הטרוגניות חיידקית ולהתגבר על מכשולים אלה בחקר התמדה12,13. חלק מטכניקות אלה כוללות מיקרוסקופ פלואורסצנטי, ציטומטריית זרימה / מיון תאים המופעלים על ידי פלואורסצנציה, מיקרופלואידיקה, וריצוף RNA של תא בודד12,13. במאמר זה אנו מתארים פרוטוקולים להבהרת הפיזיולוגיה של התא הבודד באמצעות מיקרוסקופ אפיפלואורסצנטי בהילוך מהיר של זני כתב שעתוק או תרגום. מיקרוסקופ פלואורסצנטי הוא טכניקה רבת עוצמה הממלאת את הקריטריונים לחקר פנוטיפים מתמידים, כלומר, היכולת לזהות אילו תאים בודדים באוכלוסייה גדולה מתרבים לאחר הסרת אנטיביוטיקה ולכן ניתן להגדירם כמתמידים. עם כניסתן של טכנולוגיות מצלמה אוטומטיות ותאי דגירה, לכידת תאי חיידקים חיים נגישה באופן נרחב ברחבי תחום המיקרוביולוגיה. באופן מכריע, מיקרוסקופ בהילוך מהיר מציע את היכולת לדמיין תאים בודדים בזמן אמת, במשך שעות ואפילו ימים, מה שמאפשר לעקוב אחר חיידקים לפני, במהלך ואחרי טיפול אנטיביוטי 14,15,16. לתובנות מחקירות אלה, הרותמות את המיקרוסקופ בהילוך מהיר, יש פוטנציאל עצום ליצור תובנה לגבי המנגנונים המורכבים של ביולוגיה מתמשכת.
Protocol
1. יצירת זני כתב פלואורסצנטיים של S. aureus על ידי טרנספורמציה והתמרה
הערה: זני כתב מכילים חלבון פלואורסצנטי כדי להצביע על ביטוי של גן או חלבון מעניין. כתבי תמלול מציגים עותק משוכפל של רצף המקדם המקורי עבור גן בעל עניין במעלה הזרם של חלבון פלואורסצנטי, כך שהפלואורסצנטיות גדלה ככל שהביטוי של גן מעניין עולה. כתבים תרגומיים מקשרים את מסגרות הקריאה הפתוחות של חלבון פלואורסצנטי וחלבון מעניין עם מחבר פפטידי גמיש. הדמיה של זני כתבים באמצעות מיקרוסקופ של תאים חיים יכולה לגלות אם גן/חלבון נתון שמעניין קשור למורפולוגיה מסוימת של תאים או לגורלות תאים מסוימים (איור 1, וידאו משלים 1 ווידאו משלים 2). בחרו חלבון פלואורסצנטי הממוטב לקודון עבור S. aureus. בעוד מחקר זה משתמש sGFP מ pCM29 מחונן על ידי ד"ר אלכסנדר Horswill, נברסקה Transposon מוטאנט הספרייה הגנטית ערכת כלים מכילים פלסמידים הנושאים sGFP אופטימיזציה קודון, eYFP, eCFP, DsRed.T3, ו eqFP65017,18.
- הפוך פלסמידים כתב לתוך S. aureus RN4220.
הערה: סעיף הפרוטוקול הבא הותאם מסדנת יסודות הגנטיקה הסטפילוקוקלית וחילוף החומרים במרכז הרפואי של אוניברסיטת נברסקה19,20.- ראשית, להכין electrocompetent S. aureus RN4220. להכין 200 מ"ל של מרק B2 על ידי שילוב של 2 גרם של חומצות קמינו, 5 גרם של תמצית שמרים, 2 מ"ל של 10% K2HPO4, pH 7.5, 2 מ"ל של 50% תמיסת גלוקוז, ו 5 גרם של NaCl. הביאו את הנפח ל -100 מ"ל עם מים סטריליים טהורים במיוחד. יש לערבב לזמן קצר בטמפרטורה של 37°C כדי להמיס רכיבים ולעקר באמצעות מסנן עליון מבקבוק (גודל נקבוביות של 0.22 מיקרומטר).
- חסן את S. aureus RN4220 ממלאי קפוא המאוחסן ב -80 ° C ב 25% גליצרול לתוך 30 מ"ל של מרק B2 בבקבוק 250 מ"ל מבולבל לדגור במשך 18 שעות ב 30 ° C, רועד ב 125 סל"ד.
- לדגור על שתי צלוחיות מבולבלות של 250 מ"ל עם 50 מ"ל של ציר B2 כל אחת בטמפרטורה של 37 מעלות צלזיוס למשך הלילה, כדי לחמם מראש את המדיה ליום המחרת.
- למחרת, מדדו את OD600 של תרבות הלילה. הוסיפו מספיק תרבית לילה לכל בקבוק המכיל 50 מ"ל מרק B2 כדי לקבל OD600 סופי של 0.25.
- דוגרים ב-37°C, רועדים ב-250 סל"ד, עד שה-OD600 מגיע ל-0.35-0.4.
הערה: בדוק את OD600 כ- 30 דקות לאחר תרבית משנה כדי לוודא שהתרבות אינה גדלה מעבר ל- 0.35-0.4. אם OD600 אינו מגיע 0.35-0.4 בתוך 1 שעה של subculturing, לנטוש את ההליך ולנסות שוב למחרת. סביר להניח שהחיידקים גדלו יותר מדי בן לילה והיו עמוק מדי בשלב הנייח. - ברגע שהתרבית מגיעה לשלב אמצע הלוג, יוצקים את התרבית מכל בקבוק לתוך צינור חרוטי סטרילי של 50 מ"ל ותאי גלולה בצנטריפוגה של 4,000 x גרם למשך 10 דקות.
- דקרו את הסופרנאטנט והשהו מחדש את הגלולה ב-1 מ"ל מים סטריליים בטמפרטורת החדר (RT). מעבירים את התאים לצינור מיקרוצנטריפוגה.
- צנטריפוגו את התאים שוב ב 21,000 x גרם במשך 30 שניות, להסיר את supernatant, ו resuspend ב 1 מ"ל של מים RT סטרילי. חזור על הצנטריפוגה, הסרת הסופרנטנט והתרחיף ב 1 מ"ל של מדרגות מים פעמיים נוספות בסך הכל שלוש שטיפות.
- צנטריפוגה את התאים, להסיר את המים, ולאחר מכן להשעות מחדש את התאים ב 1 מ"ל של RT סטרילי 10% גליצרול (במים, סטרילי-מסונן) ולהשאיר ב RT במשך 15 דקות.
- משחררים את התאים באמצעות צנטריפוגה במהירות של 21,000 x גרם למשך 30 שניות, מסירים את הסופרנטנט ומרחפים מחדש את התאים בעוד 1 מ"ל גליצרול סטרילי, RT 10%. תאים אלה הם כעת electrocompetent.
- Aliquot 70 μL של תאים electrocompetent לתוך צינורות microcentrifuge snap-cap ולאחסן ב -80 °C לשימוש עתידי.
- כדי להפוך את S. aureus RN4220 electrocompetent, להפשיר aliquot של תאים על קרח. הוסיפו 1 מיקרוגרם של דנ"א פלסמיד לתאים, העבירו את הדגימה לערבוב ודגרו על קרח במשך 5 דקות. לאחר מכן, אלקטרופורציה של התאים ולאפשר להם להתאושש ב 390 μL של מדיה B2 במשך 1-2 שעות ב 37 ° C, רועד ב 225 סל"ד, ואת צלחת transformants על אגר סויה טריפטי סלקטיבי.
הערה: רוב וקטורי המעבורת ששימשו במחקר זה כוללים קסטת עמידות לאמפיצילין לבחירה ב- E. coli (100 מיקרוגרם / מ"ל) וקסטת התנגדות כלוראמפניקול (10 מיקרוגרם / מ"ל) או אריתרומיצין - (Erm, 10 מיקרוגרם / מ"ל) לבחירה ב- S. aureus. זנים רבים של S. aureus הנמצאים בשימוש שגרתי במעבדה עמידים בפני Erm. ודא שזן מעניין תואם לאנטיביוטיקה הסלקטיבית לפני השימוש בווקטור מעבורת נתון. חשוב למזער את נפח הדנ"א שנוסף לתאים (כלומר, <5 μL) כדי למנוע קשת, המתרחשת כאשר הדגימה מוליכה מדי במהלך אלקטרופורציה. טיהור ריכוזים גבוהים (≥300 ng/μL) של DNA פלסמיד מ E. coli יעזור לשמור על נפחים נמוכים.
- להפיץ בקטריופאג' על טרנספורמציה S. aureus RN4220.
הערה: קטע הפרוטוקול הבא הותאם משיטות של קראוס ובוז21ואולסון22. שניים מהבקטריופאג'ים הנפוצים ביותר עבור S. aureus התמרה היא φ11 ו 80α. הליך הקציר של שני אלה זהה, אלא שאנו מקבלים φ11 מ S. aureus RN451 ו 80α מ S. aureus RN10359. φ11 שימש בהצלחה עם זנים נפוצים JE2 ו- HG003, בין היתר, והוא משמש בפרוטוקול זה23,24. עם זאת, ייתכן שהפאגים האלה לא יתמירו ביעילות מבודדים קליניים שיש להם עמידות שונה לפאגים. עיין בפרסומים של קראוס ובוז21 ואולסון22 לשיטה להכנת Φ11 ולקביעת טיטר פאגים.- כדי להמיר את פלסמיד הכתב, הכינו שש צלחות אגר סויה טריפטי (TSA) עם 5 mM CaCl2 ואת הריכוז הנכון של אנטיביוטיקה סלקטיבית. Streak S. aureus RN4220 הפך עם פלסמיד הכתב על צלחת TSA המכילה את האנטיביוטיקה הסלקטיבית ולא CaCl2 ודגר בן לילה.
- למחרת, הפעל אינקובטור או אמבט מים ל 56 °C (76 °F). יש לתייג שישה צינורות 5 מ"ל של כובע הצמדה 1 x 104 עד 1 x 109, ו-aliquot 40 μL של 500 mM CaCl2 לתוך כל צינור כובע הצמדה.
- יש להמיס TSA רך (0.5% אגר) במיקרוגל כשהפקק משוחרר כדי למנוע הצטברות לחץ תוך שמירה על סטריליות. לאחר מכן, aliquot 4 מ"ל לתוך כל אחד צינורות כובע הצמדה. הפכו את הצינורות כדי לערבב, ואז הכניסו אותם לאינקובטור של 56 מעלות צלזיוס כדי למנוע מהאגר הרך להתמצק.
- יש לדלל את ציר הפאג'ים ל-1 x10 10 PFU/mL בציר סויה טריפטי (TSB) + 5 mM CaCl2. הוסף 100 μL של 1 x10 10 PFU/mL פאג לצינור מיקרוצנטריפוגה המכיל 900 μL של TSB + 5 mM CaCl2 לריכוז סופי של 1 x109 PFU/mL. לאחר מכן, לדלל סדרתית לתוך צינורות microcentrifuge נוספים המכילים 900 μL של TSB + 5 mM CaCl2 עד ריכוז של 1 x 104 PFU/mL. תייגו כל אחד מששת צלחות האגר האנטיביוטיות TSA + 5 mM CaCl2 + עם דילול סדרתי: 1 x104 עד 1 x 109 PFU/mL.
- להשעות את הלילה S. aureus RN4220 המכיל את פלסמיד ב 1 מ"ל של TSB + 5 mM CaCl2. הסר את צינור 109 כובע הצמד מהאינקובטור והוסף במהירות 10 μL של RN4220 מושעה מחדש המכיל את הפלסמיד ו 100 μL של 1 x 109 PFU/mL דילול פאגים, הפוך לערבוב, ושפך את התוכן על TSA המתאים + 5 mM CaCl2 + צלחת אגר אנטיביוטית סלקטיבית.
- בצע הליך זה עבור דילולי הפאגים הנותרים והלוחות המתאימים להם. הניחו לאגר הרך להתמצק על הצלחות, ואז דגרו כשהאגר הרך פונה כלפי מעלה למשך הלילה בטמפרטורה של 37°C.
- למחרת, ודאו שרבדים (אזורי פינוי על מדשאות החיידקים) נראים על הצלחות (איור 2A). פלאקים מייצגים אזורים בליזה שבהם פאגים הדביקו בהצלחה את RN4220, וכמה פאגים תפסו את הפלסמיד המעניין. בחר את הצלחת עם מלאי הפאגים הכי פחות מדולל שיש לו ליזה כמעט מתמזגת (לדוגמה: 1 x 109 PFU/mL פאג') וכן את הלוחות שקיבלו את שני הדילולים שמתחתיו (במקרה זה, 1 x 108 PFU/mL ו- 1 x 107 PFU/mL, שלשניהם צריכה להיות ליזה כמעט מתמזגת).
- הוסף 3 מ"ל של TSB + 5 mM CaCl2 לפחות מדולל של לוחות אלה (1 x 109 PFU/mL, עבור דוגמה זו). השתמשו במפזר תאים סטרילי בצורת L כדי לגרד בעדינות את שכבת האגר הרך מהאגר הרגיל (איור 2B). השתמש במפזר התאים כדי לשבש את האגר ככל האפשר כדי להקל על שחרור הפאגים מהאגר הרך.
- לאחר שהאגר הרך בצלחת הראשונה שובש לחלוטין, שפכו בעדינות את האגר הרך ואת תמיסת המרק על הצלחת הבאה (במקרה זה, 1 x 108 PFU/mL). מגרדים ומשבשים את האגר הרך בצלחת זו, ולאחר מכן יוצקים את התרחיף שהתקבל על הצלחת הסופית וחוזר חלילה.
- לאחר הכנת תרחיף האגר הרך מכל שלוש הצלחות, יוצקים בעדינות את הסלארי לתוך צינור חרוטי של 50 מ"ל. פיפטה בעדינות כדי לשבש עוד יותר את האגר הרך, אך הימנעו מיצירת בועות. אל תתערבלו, מכיוון שזה עלול לפגוע בפאגים ולהקטין את הטיטר.
- צנטריפוגו את תרחיף האגר הרך במהירות 4,000 x גרם למשך 10 דקות ב-RT. מזגו בעדינות את הסופרנאטנט לתוך מזרק המחובר לפילטר של 0.45 מיקרומטר.
הערה: חשוב לשפוך בעדינות ולהימנע מהכנסת חתיכות אגר לפילטר. חלקים אלה יסתמו את הפילטר וימנעו סינון של הטיטר הסופר-נטנטי שנותר ויקטינו אותו. - קבע את הטיטר של הפאג ליזט שנוצר באמצעות סוג פראי RN422021.
- הכניסו פלסמידים כתבים לזני S. aureus של עניין על ידי טרנסדוקציה.
- הכינו שמונה צלחות TSA המכילות 500 מיקרוגרם/מ"ל נתרן ציטראט ואת הריכוז המתאים של אנטיביוטיקה סלקטיבית. פזרו בצפיפות את זן S. aureus הנמען הרצוי על TSA רגיל ודגרו למשך הלילה בטמפרטורה של 37°C.
- למחרת, ספוג את הצלחת והשהה מחדש את זן הנמען ב 1 מ"ל של TSB + 5 mM CaCl2.
- לדלל את מלאי הפאגים הנושא את פלסמיד הכתב הרצוי ל 1 x1010 PFU/mL.
- מערבבים 1.5 מ"ל של TSB + 5 mM CaCl2, 0.5 מ"ל של זן מקבל מושעה מחדש, ו 0.5 מ"ל של מלאי פאגים מדולל בצינור חרוטי 50 מ"ל. דוגרים ב-37°C, רועדים ב-225 סל"ד, למשך 20 דקות.
הערה: זמני דגירה ארוכים יותר אינם מומלצים מכיוון שהם ככל הנראה יפחיתו את יעילות ההולכה כאשר הפאג מתחיל ליזה תאים מקבלים. - מיד לאחר מכן, הוסף 1 מ"ל של נתרן ציטראט סטרילי מסונן כקרח 0.02 M (במים) לצינור החרוטי ולצנטריפוגה ב 4,000 x גרם למשך 10 דקות ב 4 ° C. לאחר מכן, להשעות מחדש את הגלולה ב 1 מ"ל של קר כקרח 0.02 M ציטראט נתרן.
- יש למרוח 100 μL aliquots על כל אחת משש צלחות TSA המכילות 500 מיקרוגרם/מ"ל נתרן ציטראט ואת הריכוז המתאים של אנטיביוטיקה סלקטיבית לבחירת טרנסדנטים. לדגור לילה ב 37 °C (77 °F).
- למחרת, פזרו מושבות בודדות מלוחות הטרנסדוקציה אל שני לוחות TSA הנותרים המכילים 500 מיקרוגרם/מ"ל נתרן ציטראט ואת הריכוז המתאים של אנטיביוטיקה סלקטיבית. לדגור לילה ב 37 °C (77 °F).
הערה: שלב עובר זה על לוחות נתרן ציטראט נוספים מסייע להפחית את titer של פאג סביב התאים המותמרים, מניעת ליזה22. - בחר מושבות בודדות מצלחת הפסים, גדל את התאים לשלב מעריכי ב- TSB המכיל את האנטיביוטיקה הסלקטיבית, ואחסן ב -25% גליצרול ב -80 ° C לשימוש עתידי.
2. יצירת זני כתב פלואורסצנטיים של P. aeruginosa על ידי הצמדה
הערה: העברת פלסמיד כתב לתוך P. aeruginosa מזן שיבוט E. coli יכולה להיעשות על ידי הזדווגות תלת-הורית25. זן תורם של E. coli הנושא את פלסמיד העניין (אשר אמור להכיל oriT להעברה זוגית), E. coli HB101 + pRK2013 - זן עוזר כדי להקל על הצמידות (להשתמש 50 מיקרוגרם / מ"ל kanamycin עבור תחזוקת פלסמיד pRK2013), ואת זן מקבל P. aeruginosa כי יקבל את פלסמיד נדרשים נדרשים. עבור דוגמה זו, לפלסמיד המעניין יש סמן התנגדות טטרציקלין (Tet), כך שכל תרבית E. coli עם הפלסמיד תזדקק ל- 10 מיקרוגרם/מ"ל טט, ו - P. aeruginosa עם הפלסמיד תזדקק ל- 75 מיקרוגרם/מ"ל טט לבחירה26.
- חסן חיידקים ממלאי קפוא המאוחסן ב -80 ° C ב 25% גליצרול לתוך מרק ליזוגני (LB) עם אנטיביוטיקה מתאימה לצמיחה לילה, רועד ב 225 סל"ד ב 37 ° C.
- למחרת, מרחו 200 מיקרוליטר מכל תרבית לילה נוזלית על צלחת אגר LB עם אנטיביוטיקה סלקטיבית מתאימה. תלוי כמה הזדווגויות טרנספורמציה יש לעשות, לפזר יותר צלחות עבור זנים עוזר ותורם. צלחת אחת של עוזר/תורם לכל טרנספורמציה מומלצת. לדגור על הצלחות במשך הלילה ב 37 מעלות צלזיוס כדי לקבל מדשאות צפופות של כל זן.
- למחרת, אספו את מדשאות הצמיחה על ידי ניקוי כל משטח צלחת עם צמר גפן סטרילי וניגוב לאורך החלק הפנימי של צינור מיקרוצנטריפוגה. צנטריפוגה כל צינור לזמן קצר (פולס במשך 5 שניות) כדי לאסוף את התאים לתחתית הצינור. להשהות מחדש כל גלולה התא ב 200 μL של LB.
הערה: המתלים צריכים להיראות עבים מאוד, אטומים וללא גושים. - בצינורות מיקרוצנטריפוגות חדשים עבור כל הזדווגות, לשלב 5 μL של זן P. aeruginosa הנמען, 160 μL של זן E. coli תורם הנושא את פלסמיד עניין, ו 160 μL של עוזר E. coli HB101 + pRK2013. מערבבים בעדינות, תוך פיטום מעלה ומטה, ואז ממקמים 50 מיקרוליטר מהתערובת על צלחת אגר LB מיובשת מראש. כמו כן, נקוב 20 μL של כל זן בודד לאגר LB לבקרות. תן כתמים להתייבש לתוך הצלחת לחלוטין, ולאחר מכן לדגור ב 37 ° C במשך 3-6 שעות.
הערה: ייבוש מראש של אגר LB מונע מהכתם של 50 μL להתפשט על פני השטח ובכך מאלץ את התאים לקיים אינטראקציה בתוך שטח קטן יותר. - לאחר הדגירה, החליקו בעדינות קצה פיפטה על פני נקודת ההזדווגות כדי להעביר חלק מהתאים לצינור מיקרוצנטריפוגה חדש. צנטריפוגה קצרה כדי לאסוף את התאים בתחתית הצינור. יש להשהות מחדש ב-200 מיקרוליטר של LB ולחבר את כל המתלה לצלחת אגר LB + Irgasan (Igr; 25 מיקרוגרם/מ"ל) + Tet (75 מיקרוגרם/מ"ל).
הערה: P. aeruginosa עמיד באופן מהותי לאיגראסן, והפלסמיד המעניין מכיל את סמן ההתנגדות Tet, כך שרק P. aeruginosa שעבר טרנספורמציה מוצלחת אמור להיות מסוגל לגדול על לוחות LB + Irgasan + Tet. בהתאם ליעילות הטרנספורמציה, השהיה מחדש וציפוי של כל מקום ההזדווגות עשויים לגרום למדשאה של שנאים למחרת. כדי להשיג מושבות בודדות, (i) להשהות מחדש את כל נקודת ההזדווגות בנפח גדול יותר של LB ואז צלחת 200 μL ממנו או (ii) להעביר חלק קטן של נקודת ההזדווגות לצינור מיקרוצנטריפוגה ולאחר מכן להשהות מחדש ב 200 μL וצלחת. - בעזרת נקודות הבקרה של כל זן בנפרד, החליקו בעדינות חלק מכתם התא הצפוף על קצה פיפטה, העבירו לצינור מיקרוצנטריפוגה חדש, השהו מחדש ב-200 מיקרו-ליטר של LB, ואז נקוב 50 μL על צלחת אגר LB + Irgasan + Tet (ניתן להניח נקודות בקרה מרובות על אותה צלחת אגר). הניחו לכתמים להתייבש לחלוטין. לדגור על כל הצלחות במשך 16-20 שעות לילה ב 37 מעלות צלזיוס.
הערה: עבור נקודות הביקורת, המטרה היא לוודא כי צלחת האנטיביוטיקה היא סלקטיבית עבור טרנספורמנטים P. aeruginosa . אם כתמי הבקרה מרוכזים מדי כאשר הם מזוהים על לוחות אגר LB + Irgasan + Tet, אז יהיה קשה לקבוע אם הבחירה עבדה למחרת כי תהיה הילה של תאים מתים שעלולים להיות מוטעים לצמיחה. - למחרת, אשר את הסלקטיביות האנטיביוטית של לוחות LB + Irgasan + Tet על ידי ציון חוסר צמיחת תאים עבור נקודות בקרת הזן הבודד.
הערה: מושבות המופיעות על צלחת ההזדווגות התלת-הורית LB + Igrasan + Tet הן טרנספורמנטים P. aeruginosa הנושאים את הפלסמיד המעניין. - אופציונלי לקטוף ולפסוח מושבות על LB + Irgasan + Tet אגר ולגדול במשך הלילה כדי להיפטר מעודפי E. coli מת מתערובת ההזדווגות.
- בחרו מושבות בודדות, גדלו במשך 3-6 שעות ב-LB נוזלי + Tet (75 מיקרוגרם/מ"ל) עד לעכירות נראית לעין, ואז אחזו במלאי קפוא ב-25% גליצרול (תרבית תאים 500 מיקרוליטר + 500 מיקרוליטר 50% גליצרול במים). ודא כי השיבוטים עוברים טרנספורמציה בהצלחה על ידי PCR מושבה ואחריו Sanger או ריצוף פלסמיד שלם.
3. קביעת מינונים אנטיביוטיים לבדיקות מתמידות
הערה: כדי לבחור מינון של אנטיביוטיקה נתונה לטיפול באוכלוסיית החיידקים לצורך ניסויים מתמידים, מדדו תחילה את הריכוז המעכב המינימלי (MIC) של האנטיביוטיקה כנגד זן החיידקים המעניין. ניתן להשיג זאת באמצעות שיטת מיקרודילוציה של מרק – גישה שמכון התקנים הקליני והמעבדה (CLSI) תומך בה – או באמצעות בדיקת אפסילומטר (E-test), הנעשית באמצעות רצועות בדיקה עם מגוון מנות אנטיביוטיות27. לאחר קביעת ה- MIC, בחר לפחות חמישה ריכוזים של אנטיביוטיקה הנעים בין פי 1 עד פי 100 מיקרופון לטיפול תאי.
- חסן חיידקים ממלאי קפוא המאוחסן ב -80 ° C ב -25% גליצרול לתוך 2 מ"ל של MHB (CA-MHB) מותאם קטיון או מדיה עשירה בחומרים מזינים אחרים. גדל את התאים במשך כ 4 שעות ב 37 ° C עם רעד ב 250 סל"ד לפני העברת 125 μL של התרבית ל 25 מ"ל של מדיה טרייה מוגדרת כימית בבקבוק Erlenmeyer מבולבל 250 מ"ל. לגדל את החיידקים במשך 16 שעות (לשלב נייח) ב 37 ° C, רועד ב 250 סל"ד.
הערה: חומר מלח בזאלי (BSM) עם סוקצינאט כמקור הפחמן היחיד משמש בדרך כלל לניסויים של P. aeruginosa ומדיה עשירה המוגדרת כימית משמשת בדרך כלל לניסויי S. aureus 28,29,30,31. - למחרת בבוקר, הכינו מלאי אנטיביוטיקה 100x (בממסים המתאימים) לטווח הרצוי של ריכוזי סופרה-מיקרופון. הוסף 10 μL מכל דילול למבחנות בודדות.
- מדוד את OD600 של תרבית הלילה כדי לאשר עכירות בשלב נייח. יש לדלל באופן סדרתי 10 מיקרוליטר של תרבית ולצלחת את הדילול על צלחות אגר מזינות - כגון אגר LB, אגר CA-MHB או TSA - כדי לקבוע את יחידות יצירת המושבה (CFUs) לפני הטיפול האנטיביוטי.
- לטיפול אנטיביוטי, יש לפזר 1 מ"ל אליציטוטים של התרבית למבחנות המכילות 10 מיקרוליטר של 100x ריכוזי אנטיביוטיקה. דוגרים על הדגימות בטמפרטורה של 37 מעלות צלזיוס, רועדות ב-250 סל"ד, למשך זמן שמספיק כדי להרוג את הלא-מתמידים באוכלוסייה, ומשאירים את המתמידים כתאים יוצרי המושבה היחידים.
הערה: משך הטיפול יכול להשתנות בהתאם לניסוי ולזן החיידקי הנבדק. בדרך כלל S. aureus מטופל במשך 5 שעות או 7 שעות ו P. aeruginosa במשך 7 שעות או 24 שעות. באופן כללי, ניתן להשתמש בכל נקודת זמן בשלב השני של בדיקת ההישרדות תלוית הזמן מכיוון שהתאים שנותרו בשלב השני צפויים להיות מתמידים. - לאחר טיפול אנטיביוטי, להעביר 100 μL של תאים מהמבחנות למבחנות מיקרוצנטריפוגות המכילות 900 μL של מלח סטרילי פוספט חוצץ (PBS). גלול את התאים על ידי צנטריפוגה ב RT ב 21,000 x גרם במשך 3 דקות. הסר 900 μL של supernatant והשהה מחדש את הגלולה ב 900 μL של PBS סטרילי. חזור על שלב השטיפה לפחות פעם נוספת כדי להפחית את שאריות האנטיביוטיקה לרמות תת-מיקרופוניות.
- מדללים באופן סדרתי את התרבית פי 10 (שש פעמים) ואת הצלחת 10 מיקרוליטר מכל דילול על צלחות אגר מזינות. לדגור את הצלחות ב 37 ° C במשך הלילה.
הערה: השתמש בצלחות לא מטופלות, בעלות תחתית עגולה של 96 בארות לדילול סדרתי ובתאי צלחת על לוחות אגר מרובעים באמצעות פיפטה רב ערוצית. - למחרת, ספרו את המושבות בכל ריכוז אנטיביוטי. מקטע הישרדות העלילה (CFU בסוף הטיפול/CFU לפני הטיפול) כנגד ריכוז בקנה מידה לוג-ליניארי. כדי לבחור ריכוז תרופה לבדיקות עתידיות של מתמידים, בחרו ריכוז בשלב השני של העקומה הדו-פאזית (איור 3).
4. הדמיה של תאים במהלך טיפול אנטיביוטי או התאוששות
- הכינו רפידות אגרוז ודגימות תאים להדמיית קיטועי זמן
הערה: פרוטוקול הכנת הדגימות הבא פותח כחלופה ידידותית למשתמש וחסכונית לשיטות "כריך" אגרוז מסורתיות14,16. השימוש בכלי כיסוי להחלפה מונע את הצורך בשומן מלכלך או בלק כדי לאטום את הדגימה, מה שעלול להגביל עוד יותר את אוורור הדגימה. האגרוז מונח בצלחת הכיסוי הניתנת להחלפה כאשר הכיסוי כבר במקומו, מה שיוצר משטחי אגרוז מישוריים אמינים בהשוואה לתכשירי כרית אגרוז ביד חופשית. בסך הכל, שיטה זו אפשרה דגימות הדמיה עם מיקוד משופר על פני שדה הראייה לפרקי זמן ארוכים יותר בשל לחות יציבה. השיטה המתוארת כאן משמשת לדמיון חיידקים במהלך טיפול אנטיביוטי (תרשים 4, סרטון משלים 3ו סרטון משלים 4). לדמיין מתמידים בזמן שהם מבצעים החייאה ומתעוררים מחדש לאחר טיפול אנטיביוטי (תרשים 5, סרטון משלים 5ו סרטון משלים 6), הכינו את רפידות האגרוז עם מצע תרבית טרי במקום מדיה משומשת ואל תוסיפו אנטיביוטיקה לפדים (למעט אלה שנוספו לתחזוקת פלסמיד/בחירת אנטיביוטיקה).- הניחו מכסה סטרילי בקוטר 30 מ"מ (עובי #1.5) בתחתית בסיס הנירוסטה של צלחת כיסוי הניתנת להחלפה ("חדר"). השחילו בעדינות את כניסת הפוליקרבונט לבסיס כך שהכיסוי בקוטר 30 מ"מ יהווה את בסיס התא, ואטמו אותו במקומו על ידי דחיסת טבעת ה-O מסיליקון המצורפת. חזור על שלב זה כדי להכין תא כפול.
הערה: מומלץ להכין כפילויות לכל ניסוי במקרה שההכנה של אחד התאים אינה אופטימלית. מחיצה מותאמת אישית המודפסת בתלת-ממד ממוקמת כנגד מכסה 30 מ"מ כדי למנוע תאים נעים כמו P. aeruginosa מזיהום צולב ולספק ציוני דרך למיקומי דגימה. קובץ STL להדפסה תלת-ממדית זמין בקובץ משלים 1. - מכינים 1.5% אגרוז בצינור חרוטי 50 מ"ל באמצעות המדיה הנבחרת. מערבלים בעדינות כדי לערבב.
הערה: לצורך הדמיה של תאים בשלב נייח במהלך הטיפול, מדיה ללא תאים מתרבית לילה בשלב נייח משמשת כמצע הבסיס. בדרך כלל, agarose מדיה מוכן כמו 0.105 גרם של agarose ב 7 מ"ל של מדיה להכנת שני תאים; כל תא דורש 2 מ"ל של מדיה אגרוז, ואת עודף מועיל למניעת בועות אוויר בעת pipetting. - הניחו את החרוט בנפח 50 מ"ל בתוך זכוכית או מחזיק כספת למיקרוגל (ודאו שהמכסה רופף). יש לחמם במיקרוגל על עוצמה גבוהה, ולעצור כל 3-4 שניות כדי לערבל ולערבב. עצרו וערבבו לעתים קרובות כדי למנוע מתערובת האגרוז לבעבע.
- לאחר ~ 1 דקות זמן חימום כולל, לבדוק אם יש אגרוז גלוי שלא נמס נשאר בתערובת. אם התערובת ברורה באופן אחיד, יש לאפשר למצע האגרוז להתקרר ל~60 מעלות צלזיוס לזמן קצר לפני הוספת תרופות או צבעים נוספים. מערבלים בעדינות כדי לערבב ולמנוע היווצרות בועות אוויר.
הערה: ניתן להוסיף יודיד פרופידיום (16 מיקרומטר עבור P. aeruginosa או 1.6 מיקרומטר עבור S. aureus) כדי להמחיש מתי תאים מאבדים את יכולת הכדאיות.
- לאחר ~ 1 דקות זמן חימום כולל, לבדוק אם יש אגרוז גלוי שלא נמס נשאר בתערובת. אם התערובת ברורה באופן אחיד, יש לאפשר למצע האגרוז להתקרר ל~60 מעלות צלזיוס לזמן קצר לפני הוספת תרופות או צבעים נוספים. מערבלים בעדינות כדי לערבב ולמנוע היווצרות בועות אוויר.
- נע במהירות כדי למנוע את מדיית האגרוז מלהתמצק, פיפטה 2 מ"ל של מדיית האגרוז לתוך התא עם כיסוי 30 מ"מ. הניחו בעדינות כיסוי סטרילי של 25 מ"מ (עובי #1.5) מעל מדיית האגרוז בפתח החדר העליון; זה עוזר למנוע התייבשות של כרית האגרוז ומבטיח משטח עליון שטוח של האגרוז להדמיית ניגודיות פאזה אופטימלית. הניחו לפד להתמצק למשך 1-2 שעות.
- לאחר שהפד התמצק, הכינו את התאים להדמיה על ידי דילולם לצפיפות דלילה מתאימה ב-PBS לצורך הדמיה של תאים בודדים. כאן, התאים מדוללים ל- OD600 0.01-0.05.
- בכיסוי בקוטר 25 מ"מ, השתמשו בטוש קבוע בעל קצה דק כדי לסמן את המיקומים/הזהויות של כל דגימה שנזרעה על הפד. הפוך את התא כך שטבעת הבסיס מפלדת אל-חלד פונה כלפי מעלה והחזק בזהירות את תוספת הפוליקרבונט שמתחתיה תוך ביטול השחלת הבסיס. הניחו את בסיס הנירוסטה בצד. החליקו בזהירות את מכסה ה-30 מ"מ מהפד והשליכו אותו.
הערה: הסר את משטח הכיסוי בקוטר 30 מ"מ על-ידי החלקה אופקית, והיזהר שלא להסיט פנימה את משטח האגרוז. כמו כן, הימנעו מעבודה על משטח האגרוז החשוף: כל אבק שייפול עליו ישפיע על איכות התמונה ועלול לזהם את הפד. - באמצעות הסימנים על הכיסוי בקוטר 25 מ"מ לצורך הנחיה, נקוב 5 μL של התאים המדוללים למיקומים המתאימים על כרית האגרוז. הוסף שלושה כתמים של 5 μL (התאם זאת לפי הצורך, למשל, 4 x 4 μL כתמים וכו '). לאחר שהכתמים התייבשו לחלוטין, הניחו בעדינות כיסוי חדש וסטרילי בקוטר 30 מ"מ במרכזו הפד.
- החזיקו את תוסף הפוליקרבונט ביד אחת, וביד השנייה, השחילו מחדש באיטיות את בסיס הנירוסטה מעל הכיסוי החדש. די בדק עד לחוזק האצבע כדי לדחוס את טבעת ה-O מסיליקון ולאטום את התא.
הערה: היזהר לא להדק יתר על המידה - אם הכיסוי בקוטר 30 מ"מ כנגד משטח הדגימה נדחס על ידי בסיס הנירוסטה ומסובב שוב ושוב, התאים יכולים להתפשט בתבנית רדיאלית, מה שעלול לגרום לזיהום צולב של הדגימה. - לאחר האטימה של החדר, שימו לב אם האגרוז יוצר קשר עם פני השטח של הכיסוי בקוטר 30 מ"מ; בשלב זה, יש בדרך כלל מגע כלשהו, אך לא מלא, על פני השטח. השתמש בקצה הקהה של זוג פינצטה או מכשיר דומה כדי ללחוץ בעדינות על החלקה של כיסוי 25 מ"מ עד שהאגרוז נוגע בכיסוי 30 מ"מ באופן שווה על פני כל המשטח.
התראה: שלב זה עלול לגרום לשבירת הכיסוי בקוטר 25 מ"מ אם נעשה שימוש בכוח עודף. - ברגע שהאגרוז נלחץ היטב כנגד הכיסוי בקוטר 30 מ"מ כך שלא נותרו בועות אוויר גדולות, הפד מוכן לצילום.
- הניחו מכסה סטרילי בקוטר 30 מ"מ (עובי #1.5) בתחתית בסיס הנירוסטה של צלחת כיסוי הניתנת להחלפה ("חדר"). השחילו בעדינות את כניסת הפוליקרבונט לבסיס כך שהכיסוי בקוטר 30 מ"מ יהווה את בסיס התא, ואטמו אותו במקומו על ידי דחיסת טבעת ה-O מסיליקון המצורפת. חזור על שלב זה כדי להכין תא כפול.
- הגדר את המיקרוסקופ ואת התמונה.
- הכינו את המיקרוסקופ ואת תא ההדמיה בקרות סביבתיות. הגדר את האינקובטור העליון ואת טמפרטורת האינקובטור התא הגדול ל -37 מעלות צלזיוס והפעל את מכשיר האדים. הכניסו את אחד מתכשירי כרית האגרוז לאינקובטור שעל הבמה וסגרו את תא הדגירה כדי לאפשר לדגימה להתאזן. מכסה האינקובטור העליון נשאר פתוח בשלב זה כדי למנוע עיבוי על מכסה 25 מ"מ של החדר.
הערה: התכווצות/התרחבות הפד עקב שינויי טמפרטורה עלולה לגרום לסחף בין נקודות זמן החורגות מטווח הסריקה של אלגוריתם המיקוד האוטומטי. חשוב מאוד לאזן את כרית האגרוז לטמפרטורה יציבה לפני ההדמיה, שבדרך כלל אורכת לפחות 15 דקות. חימום מספק גם מונע עיבוי על המכסה העליון כאשר מכס הלחות מונח במקומו. רכיבי החומרה של מערכת ההדמיה היו (טבלה של חומרים): תא דגירה של תאים חיים, מיקרוסקופ הפוך עם מטרה Plan-Apochromat 63x/1.40 Oil Ph3 M27, מנוע תאורת LED ספקטרה 7 ומצלמת sCMOS (גודל פיקסל 6.5 מיקרומטר). השליטה ברכיבים הממונעים של המיקרוסקופ ורכישת התמונה נעשית באמצעות יישום תוכנה לניתוח מיקרוסקופיה. - הכן את התוכנה לרכישת תמונה. הגדר את אלגוריתם המיקוד האוטומטי המובנה של MetaMorph (תוכנת ניתוח מיקרוסקופיה) לשימוש בערוץ הפאזה במהלך רכישה רב-ממדית.
- בכרטיסייה 'שלב' , קבעו מיקומי שלבים מרובים לכל דגימה, תוך הכוונה לשדות ראייה שבהם צפיפות התא מפוזרת באופן אחיד. בכרטיסייה Timelapse , הגדר את משך הזמן והתדירות הרצויים (מרווח זמן) של תמונות לצילום. בכרטיסיות אורכי גל , הגדר את הערוצים הרצויים לרכישה והתאם את זמני החשיפה לעוצמות האות של הדגימות.
הערה: תמונות של כל מיקום מצולמות כל 10 דקות למשך עד 24 שעות. לצורך הדמיה פלואורסצנטית של הצבעים/פלואורופורים המוזכרים במאמר זה, נעשה שימוש בהגדרות העירור הבאות של מנוע האור: פרופידיום יודיד (Cy3; 555/15 ננומטר) ו-GFP (GFP/FITC; 470/24 ננומטר). זמן החשיפה האופייני לעירור פלואורסצנטי המשמש הוא 100 אלפיות השנייה. נעשה שימוש בערכת מסננים 15 (Beamsplitter FT580, Emission LP590) עבור יודיד פרופידיום וערכת מסנן 44 (Beamsplitter FT500, Emission BP 530/50) עבור GFP.
- בכרטיסייה 'שלב' , קבעו מיקומי שלבים מרובים לכל דגימה, תוך הכוונה לשדות ראייה שבהם צפיפות התא מפוזרת באופן אחיד. בכרטיסייה Timelapse , הגדר את משך הזמן והתדירות הרצויים (מרווח זמן) של תמונות לצילום. בכרטיסיות אורכי גל , הגדר את הערוצים הרצויים לרכישה והתאם את זמני החשיפה לעוצמות האות של הדגימות.
- לאחר שכרית האגרוז התחממה בחדר, הוסיפו את מכסה הלחות לאינקובטור שבראש הבמה. זה יעזור למנוע מהפד להתייבש ולזוז במהלך ההדמיה.
- עם מכסה הלחות, יש לעבור משלב לניגודיות הפרעה דיפרנציאלית (DIC) ולהתאים את המעבה ודיאפרגמת הצמצם של המיקרוסקופ להארה נכונה של קוהלר.
- לאחר ההתאמה, חזור לפאזה. נווט לכל מיקום במה, התאם את המיקוד ואפס את מיקום הבמה למישור המוקד החדש. ההגדרות נמצאות כעת במקום כדי להתחיל בהדמיה.
הערה: חשוב לחזור על כל מיקום שלב לפני תחילת הרכישה כדי לוודא שהפד לא זז. אם התאים אינם ממוקדים כאשר מבקרים אותם מחדש בתנוחת שלב נתונה, התמקדו בהם מחדש ועקפו את מיקום השלב הקודם. הגדרת אלגוריתם המיקוד האוטומטי משתמשת במיקום z מוקד מנקודת הזמן האחרונה ± 3 מיקרומטר כטווח חיפוש, כך שאם המשטח יזוז יותר מ- 3 מיקרומטר, האלגוריתם לא יצליח להתמקד כראוי. - התחל את הרכישה הרב-ממדית על ידי לחיצה על כפתור הרכישה .
- לאחר השלמת הניסוי, קבצו את התמונות הבודדות מכל ערוץ לערימה לצפייה כסרטון וידאו או לניתוח אחר. עשו זאת באמצעות MetaMorph או ImageJ.
- כדי לקמפל תמונות ב- MetaMorph (מועדף), ביישום Review Multi Dimensional Data , בחר את הערוצים/אורכי הגל המעניינים ובחר נקודות זמן של כל הזמנים עבור מיקום במה נתון. לחצו על 'טען תמונות'. Windows יופיע עבור כל ערוץ/אורך גל. שמור כל אוסף עם שם הערוץ המתאים לו כקובץ .tiff.
- כדי לבצע הידור ב- ImageJ, פתח את הקבצים עבור כל נקודות הזמן עבור מיקום שלב אחד וערוץ אחד. הידור באמצעות תמונות לערימה.
- הכינו את המיקרוסקופ ואת תא ההדמיה בקרות סביבתיות. הגדר את האינקובטור העליון ואת טמפרטורת האינקובטור התא הגדול ל -37 מעלות צלזיוס והפעל את מכשיר האדים. הכניסו את אחד מתכשירי כרית האגרוז לאינקובטור שעל הבמה וסגרו את תא הדגירה כדי לאפשר לדגימה להתאזן. מכסה האינקובטור העליון נשאר פתוח בשלב זה כדי למנוע עיבוי על מכסה 25 מ"מ של החדר.
5. יצירת סרטוני קיטועי זמן באמצעות פיג'י / ImageJ
הערה: פיג'י (פיג'י היא רק ImageJ) היא תוכנה זמינה באופן חופשי לעיבוד וניתוח תמונה שניתן להוריד כאן: "https://imagej.net/software/fiji/downloads32"32. פיג'י/ImageJ2 1.54f שימש לשיטות עיבוד התמונה המתוארות להלן.
- תקן את ערימת התמונות של ערוץ הפאזה באמצעות BaSiC33. פתח את ערימת תמונות הפאזה הרצויה בפיג'י ולאחר מכן בחר BaSiC מ הכרטיסייה תוספים . הערימה המתוקנת בהצללה תופיע בחלון נפרד שכותרתו Corrected:ImageName.
הערה: ניתן להוריד BaSiC.jar כאן: "https://github.com/marrlab/BaSiC33"33. עקוב אחר הוראות היזם להתקנה נכונה של BaSiC בפיג'י. - מזג את אוסף ערוצי הפאזה המתוקן בגוון עם ערוצים/אורכי גל אחרים בעזרת Image > Color > Merge Channels. התאם את עוצמות הרקע והאות באמצעות > תמונה התאם > בהירות/ניגודיות עבור כל ערוץ. שמור את הקובץ הממוזג כקובץ .tiff.
- לאחר מכן, ייצב את התמונות באמצעות Correct 3D Drift. לאחר בחירת הערימה המתוקנת בצל, עבור אל Plugins > Registrations > Correct 3D Drift. בחלון הדו-שיח שנפתח, הגדר את ערוץ הרישום למספר הערוץ המתאים לאוסף השלבים. המחסנית המתקבלת לאחר התיקון תיקרא נקודות זמן רשומות. חתוך לשדה הראייה הרצוי ולאחר מכן שמור את הקובץ המתוקן כקובץ .tiff.
הערה: אם MetaMorph שימש ליצירת אוסף התמונות שעבר הידור, יש שלב עיבוד נוסף: עבור אל Image > Properties והחלף את המספרים בשדות Slices (z) ו- Frames (t). תיקון הסחף יכול כעת לפרש כראוי כל מסגרת כנקודת זמן ולא כפרוסה של ערימת z. ניתן להשתמש בקובץ .tiff מתוקן הצל ותיקון סחף בניתוחי תמונות עוקבים. קיימות חבילות תוכנה רבות למדידת עוצמות אות פלואורסצנטיות, לכימות מאפיינים מורפולוגיים, למעקב אחר גורלם של תאים בודדים ועוד. שתי תוכנות נפוצות הן תוסף MicrobeJ עבור פיג'י ו- Oufti34,35. - הוסף חותמות זמן ותוויות טקסט לערימה באמצעות Image > Stacks > Label.
- כדי להוסיף סרגל קנה מידה, ראשית, דע את גודל הפיקסלים של המצלמה ואת ההגדלה האובייקטיבית של המיקרוסקופ. חשב את יחס הפיקסלים:מיקרון כגודל פיקסלים חלקי הגדלה. בתיבת הדו-שיח Analyze > Set Scale , הזן את יחס הפיקסל:מיקרון בשדה המרחק הידוע . לאחר מכן, הוסף סרגל קנה מידה לערימה באמצעות Analyze > Tools > Scale Bar.
הערה: קנה המידה המדויק של מיקרוסקופ צריך להיות מכויל באמצעות מיקרומטר שלב. עם זאת, עדשת המיקרוסקופ האובייקטיבית והמצלמה שבה נעשה שימוש יכולים לספק הערכה גסה של קנה המידה. לדוגמה, למצלמת PCO sCMOS המשמשת כאן יש גודל פיקסל של 6.5 x 6.5 מיקרומטר2, והמטרה 63x שימשה להדמיה, כך שגודל הפיקסל חלקי הגדלה הוא 6.5/63 = 0.1032 מיקרומטר לפיקסל. הזן 0.1032 בשדה המרחק הידוע עבור תיבת הדו-שיח הגדרת קנה מידה . - כדי לייצא את ערימת התמונות המוגמרת כסרטון שניתן להפעיל בנגן QuickTime, Microsoft PowerPoint וכו ', שמור כקובץ .avi.
תוצאות
החדרה מוצלחת של פלסמידים כתבים לתוך P. aeruginosa ו- S. aureus מסומנת על ידי צמיחה על אנטיביוטיקה סלקטיבית נכונה וניתן לאשר על ידי PCR מושבה ו / או ריצוף. יש לאמת את הזנים שעברו שינוי ככתבים פנוטיפיים על-ידי חשיפתם לתנאים שבהם ידוע שהגן המעניין מושרה, וניתן למדוד את הפלואורסצנטיות המתקבלת באמצעות ציטומטריית זרימה, ספקטרופוטומטריה או מיקרוסקופ אפיפלואורסצנטי (איור 1).
כדי להקל על הבחירה של מינון אנטיביוטיקה (ים) שישמשו לניסויים הבאים, לבצע בדיקות אנטיביוטיות תלויות ריכוז מתמיד עבור P . aeruginosa או S. aureus זנים של עניין. בדיקות תלויות ריכוז גורמות בדרך כלל לעקומה דו-פאזית עם שיפוע התחלתי תלול בריכוזי אנטיביוטיקה נמוכים יותר ומישור או שיפוע תלול פחות בריכוזים גבוהים יותר. עם זאת, עבור זוגות מסוימים של מינים אנטיביוטיים, ייתכן שלא תיווצר עקומה ביפאזית ברורה. לדוגמה, העקומה עבור עקומת S. aureus delafloxacin היא בבירור דו-פאזית (איור 3A), אולם עקומת P. aeruginosa levofloxacin אינה (איור 3B)15. בתרחיש זה, אנו בוחרים ריכוז שהוא לפחות פי 10 מהמיקרופון (למשל, 5 מיקרוגרם/מ"ל, שהוא בערך פי 15 מהמיקרופון עבור P. aeruginosa)15. עם זאת, מכיוון ש-15x levofloxacin MIC מביא רק ~0.001% ניצולי P. aeruginosa , אנו משתמשים בטיפול 1 מיקרוגרם / מ"ל levofloxacin אם אנו רוצים לראות מתמידים כאשר תאי הדמיה כפי שהם מתאוששים על רפידות אגרוז ללא אנטיביוטיקה (וידאו משלים 6); אחרת, מספר שדות הראייה הדרושים לתמונה של מתמידים מרובים הופך לבלתי אפשרי.
בתחילת ההדמיה, הדגימה האידיאלית והכנת כרית האגרוז צריכים להיראות מישוריים בכל שדה הראייה, ללא פסולת גדולה, קמטים או בועות אוויר, ועם תאים בודדים המפוזרים באופן שווה. השגת תאים בודדים מבוזרים היטב עשויה לדרוש אופטימיזציה של דילול הדגימה או השעיה. עבור S. aureus, תאים נוטים ליצור צבירים קטנים ויש צורך לערבל אותם ביסודיות לפני הזריעה לכרית האגרוז (איור 4 ואיור 5). עבור P. aeruginosa, תאים עשויים ליצור אגרגטים עטופים במטריצה חוץ-תאית דביקה בתרחיף; יש צורך לקלוט דגימות אלה ביסודיות ולשבש את הצברים עבור הדמיה של תאים בודדים.
לאחר סיום ניסוי ההדמיה, יופיע קיטוע זמן מוצלח של תמונות בפוקוס, מואר ביציבות ועם סטייה מינימלית במישור x-y לאורך כל הניסוי. וידאו משלים 7 מייצג רכישת תמונה אופטימלית: t הוא ערוץ הפאזה של וידאו משלים 4 לפני תיקון צל או סחף. אובדן מיקוד יכול להתרחש אם עיבוי (כתוצאה מלחות יתר או התחממות דגימה לא מספקת) גורם להיווצרות טיפות מים על הכיסוי העליון בקוטר 25 מ"מ, מעוות את האור ודוחף את מישור המוקד אל מחוץ לטווח החיפוש המקסימלי של אלגוריתם המיקוד האוטומטי (סרטון משלים 8). שינויים בתאורה מעידים בדרך כלל על שמן טבילה לא מספיק בזמן ההדמיה. אם הבמה נעה מהר מדי, השמן על המטרה עלול להיגרר מאחור ועדיין להדביק את הפער כאשר התמונות נרכשות. ניתן למתן זאת על ידי התאמת פקדי הרכישה כדי להאט את מהירות התנועה או הוספת הפסקה בין התנועה למיקום הבא לבין רכישת התמונה. סחף דגימה גדול ייראה כמו תאים רבים הנעים על פני שדה הראייה, בעוד שחלקם נשארים במקומם (סרטון משלים 9). זה קורה בדרך כלל מאוחר יותר בניסויים מכיוון שכרית האגרוז התייבשה עקב בקרת לחות לא מספקת. הכנת כרית האגרוז המוצגת במאמר זה נועדה להקל על יציבות הדגימה, אך חימום/לחות נכונה של הדגימה וסביבתה נחוצים לרכישת תמונה אופטימלית.
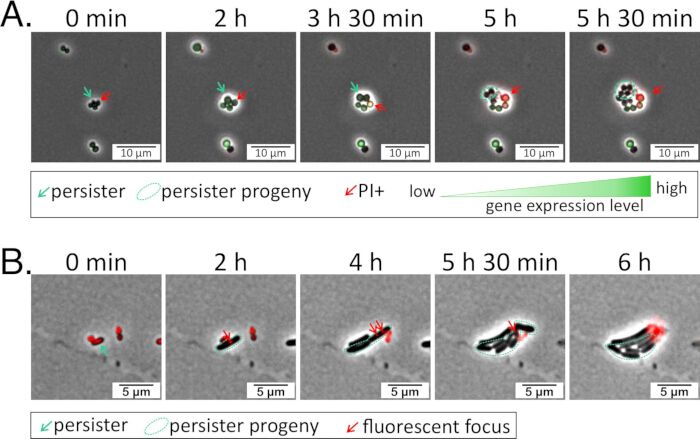
איור 1: זני כתב פלואורסצנטיים מאירים את הביטוי של גן מעניין. (A) S. aureus הומר עם כתב תעתיק GFP עבור גן מעניין לפי פרוטוקול 1. זן הכתב טופל במשך 24 שעות באנטיביוטיקה, נשטף עם PBS, ולאחר מכן נזרע על פד אגרוז עשוי CA-MHB בתוספת יודיד פרופידיום (1.6 מיקרומטר) וכלוראמפניקול (10 מיקרוגרם / מ"ל לתחזוקת פלסמיד כתב) להדמיה במהלך ההתאוששות (סרטון משלים 1). (B) P. aeruginosa הומר עם פלסמיד הנושא כתב תרגום מקושר סקרלט עבור חלבון של עניין26. זן הכתב טופל במשך 5 שעות באנטיביוטיקה, נשטף עם PBS, ולאחר מכן נזרע על פד אגרוז עשוי BSM בתוספת טט (75 מיקרוגרם / מ"ל; לתחזוקת פלסמיד כתב) להדמיה במהלך ההתאוששות (וידאו משלים 2). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
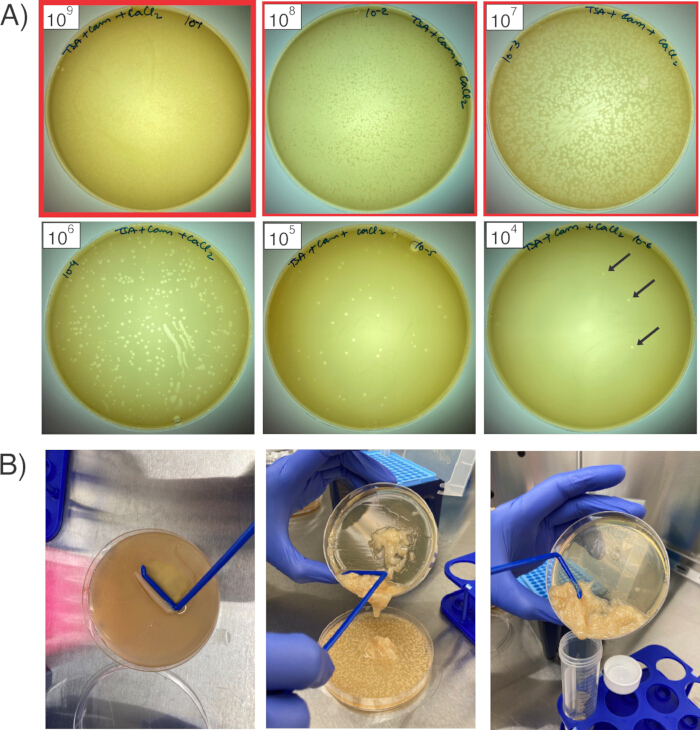
איור 2: הפצה וקצירת בקטריופאג'ים. (A) ששת הלוחות מראים שש כמויות שונות של מלאי פאגים מדולל על המדשאות של S. aureus RN4220. קווי המתאר האדומים מציינים את שלוש הצלחות שייקצרו, מהצלחת עם הניקוי הרב ביותר (קו מתאר אדום מודגש; 1 x109 PFU/mL) ועד לשני הדילולים הבאים (1 x 108 ו- 1 x 107 PFU/mL). החיצים השחורים מצביעים על לוחות בודדים. (B) כדי לקצור פאגים מהצלחות, מגרדים את שכבת האגר הרך (משמאל), מעבירים את הבוצה לצלחת הדילול הבאה (במרכז), ולאחר איגום האגר הרך מכל שלוש הצלחות יחד, מחברים לצינור חרוטי לצנטריפוגה (מימין). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
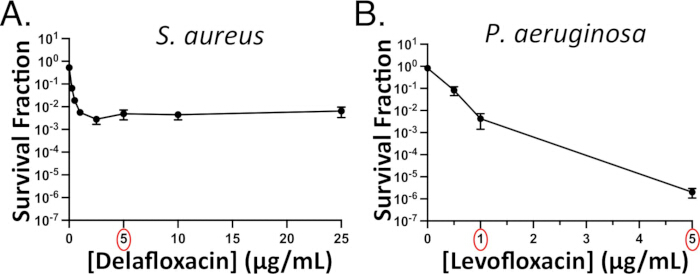
איור 3: מבחני התמדה תלויי ריכוז מייצגים. התמדה פלואורוקינולון תלוית ריכוז הוערכה בפאזה נייחת (A) S. aureus (נגד delafloxacin) ו-(B) P. aeruginosa (נגד levofloxacin). ניסויים מאוחרים יותר משתמשים ב-5 מיקרוגרם/מ"ל delafloxacin (עיגול אדום) מכיוון שהרג S. aureus הגיע לריכוז זה. מינון של לפחות 1 מיקרוגרם/מ"ל levofloxacin (עיגול אדום) ישמש לניסויים הבאים עם P. aeruginosa. שימו לב שהרג החיידקים אינו מישורי עבור P. aeruginosa, אך עדיין קיים "שלב שני" פחות תלול של העקומה הדו-פאזית המצביע על תת-אוכלוסייה מתמשכת. לוח 3B הותאם באישור Hare et al.15. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
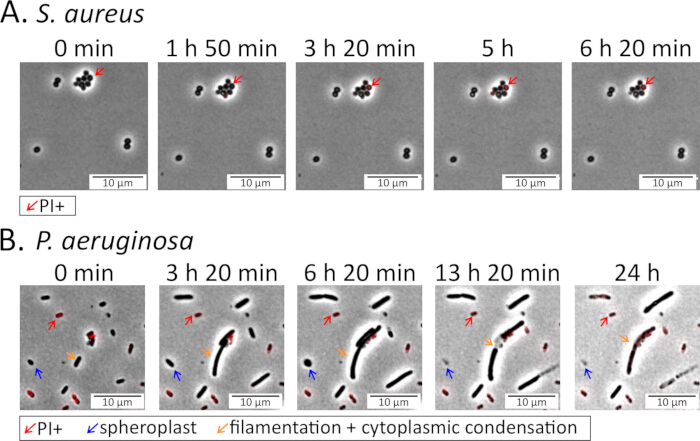
איור 4: הדמיה של פנוטיפים חיידקיים במהלך טיפול אנטיביוטי. תאי פאזה נייחים (A) S. aureus ו-(B) P. aeruginosa נזרעו על רפידות אגרוז המכילות אנטיביוטיקה פלואורוקינולון ונוטרו במהלך הטיפול: 5 מיקרוגרם/מ"ל delafloxacin עבור S. aureus (וידאו משלים 3) ו-5 מיקרוגרם/מ"ל levofloxacin עבור P. aeruginosa (וידאו משלים 4)15. פרופידיום יודיד (PI; 16 מיקרומטר עבור P. aeruginosa, 1.6 מיקרומטר עבור S. aureus) נוסף לפדים כדי לסמן תאים מתים או גוססים. תאי S. aureus נשארים ברובם שלמים וחיים בנוכחות FQ, בעוד שרוב תאי P. aeruginosa עוברים שינויים מורפולוגיים דרסטיים, כולל יצירת ספרופלסטים עגולים, לפני שהם שוכבים ומתים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
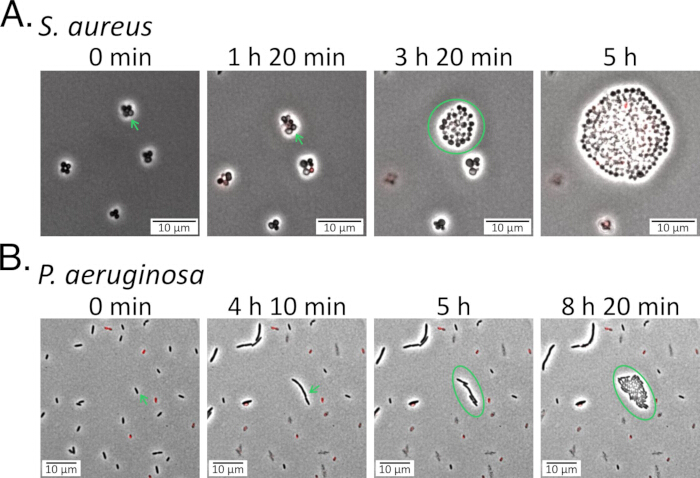
איור 5: מעקב אחר מתמידים במהלך התאוששות. (A) אוכלוסיות S. aureus ו-(B) P. aeruginosa נזרעו על רפידות אגרוז שהכילו מדיה טרייה לאחר שטופלו בפלואורוקינולונים (5 מיקרוגרם/מ"ל דלאפלוקסצין עבור S. aureus ו-1 מיקרוגרם/מ"ל לבופלוקסצין עבור P. aeruginosa) ונוטרו במהלך החלמתם לאחר הטיפול (וידאו משלים 5 ווידאו משלים 6). הפריסיסטרים שנצפו מסומנים בחצים ירוקים בשתי המסגרות הראשונות בכל לוח, והם נותרו שלמים וברי קיימא במהלך הטיפול האנטיביוטי. לאחר תקופת פיגור ראשונית, המתמידים החלו להתחלק והולידו צאצאים חדשים (מסומנים בעיגולים ירוקים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
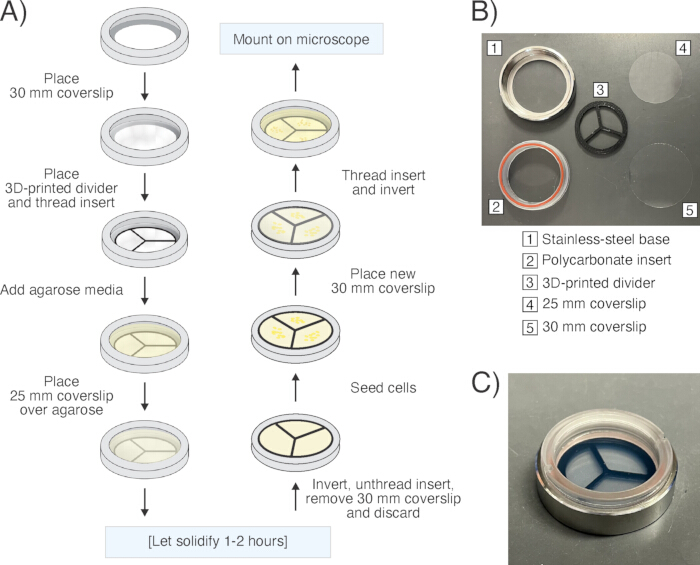
איור 6: הכנת דגימות במיקרוסקופ. (A) סכמה של תהליך הכנת הדגימה באמצעות צלחת כיסוי הניתנת להחלפה ("חדר"). (B) תמונה של החדר המפורק ומרכיביו הבודדים. (C) תמונה של החדר שהורכב במלואו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
סרטון משלים 1: S. aureus persister. קובץ וידאו המכיל את התמונות באיור 1A. בקצרה, S. aureus הנושא כתב שעתוק GFP לגן מעניין טופל במשך 24 שעות באנטיביוטיקה, נשטף עם PBS, ואז נזרע על פד אגרוז עשוי CA-MHB בתוספת יודיד פרופידיום (1.6 מיקרומטר) וכלוראמפניקול (10 מיקרוגרם / מ"ל) להדמיה במהלך ההתאוששות. אנא לחץ כאן להורדת סרטון זה.
וידאו משלים 2: P. aeruginosa persister. קובץ וידאו המכיל תמונות באיור 1B. בקצרה, P. aeruginosa הנושא כתב תרגום מקושר mScarlet עבור חלבון של עניין טופל במשך 5 שעות עם אנטיביוטיקה, נשטף עם PBS, ולאחר מכן זרע על כרית agarose עשה עם BSM בתוספת טט (75 מיקרוגרם / מ"ל) עבור הדמיה במהלך התאוששות26. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 3: S. aureus במהלך טיפול אנטיביוטי. תרבית פאזה נייחת של S. aureus שגודלה במדיה עשירה ומוגדרת כימית נזרעה לפדים אגרוזים שיוצרו מהמדיה הממוזגת נטולת התאים של התרבית עם פרופידיום יודיד (1.6 מיקרומטר) ודלפלוקסצין (5 מיקרוגרם/מ"ל). אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 4: P. aeruginosa במהלך טיפול אנטיביוטי. תרבית פאזה נייחת של P. aeruginosa שגדלה ב-BSM נזרעה לפדים של אגרוז העשויים ממדיה מותנית נטולת תאים מתרבית של P. aeruginosa שגדלה ב-BSM במקביל; כרית האגרוז הכילה גם פרופידיום יודיד (16 מיקרומטר) ולבופלוקסצין (5 מיקרוגרם/מ"ל). סרטון זה עובד באישור Hare et al.15. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 5: S. aureus במהלך התאוששות לאחר אנטיביוטיקה. S. aureus גדל לשלב נייח במדיה עשירה בהגדרה כימית. התרביות בשלב הנייח טופלו ב-5 מיקרוגרם/מ"ל דלאפלוקסצין במבחנות במשך 24 שעות, נשטפו עם PBS, ולאחר מכן נזרעו לפדים נטולי אנטיביוטיקה CA-MHB agarose המכילים פרופידיום יודיד (1.6 מיקרומטר) לצורך הדמיה. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 6: P. aeruginosa במהלך התאוששות לאחר אנטיביוטיקה. תרבית פאזה נייחת של P. aeruginosa שגדלה ב-BSM טופלה ב-1 מיקרוגרם/מ"ל לבופלוקסצין במבחנות במשך 7 שעות, נשטפה עם PBS, ואז נזרעה לפדים BSM אגרוז נטולי אנטיביוטיקה המכילים פרופידיום יודיד (16 מיקרומטר) להדמיה. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 7: דוגמה לרכישת תמונה אופטימלית. סרטון זה הוא ערוץ הפאזה של וידאו משלים 4 לפני עיבוד תמונה כדוגמה לרכישה אופטימלית של קיטועי זמן. שימו לב להיסחפות מינימלית, תאורה יציבה ושמירה על מיקוד לאורך כל הניסוי. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 8: דוגמה לרכישת תמונה לא אופטימלית עקב עיבוי. סרטון זה מציג חלק מניסוי כאשר רכישת התמונה הושפעה ממיקוד לקוי, ככל הנראה עקב עיבוי על התא עקב חימום לא נכון של הדגימה ו / או לחות יתר של סביבת ההדמיה. הדגימה המצולמת הייתה P. aeruginosa שטופלה בלבופלוקסצין במהלך התאוששות פוסט-אנטיביוטית על פד אגרוז BSM. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים 9: דוגמה לרכישת תמונה לא אופטימלית עקב סחף. סרטון זה מציג חלק מניסוי כאשר רכישת התמונה הושפעה מסחיפת דגימה, ככל הנראה עקב התייבשות והתכווצות/הרמה של כרית האגרוז מהחלקה. הדגימה המצולמת הייתה P. aeruginosa על פד אגרוז המכיל levofloxacin ו-propidium iodide. אנא לחץ כאן להורדת סרטון זה.
קובץ משלים 1: 25mm-3D-divider-for-35mmBioptechs.stl אנא לחץ כאן להורדת קובץ זה.
Discussion
מצאנו כי הצלחתו של ניסוי במיקרוסקופ בהילוך מהיר תלויה באיכות רפידות האגרוז וביציבותן במהלך ההדמיה. רפידות האגרוז הסגורות בתא הנירוסטה קלות יחסית להכנה, והתוצאה היא דגימות מישוריות עקביות שניתן לצלם ביציבות במשך עשרות שעות. זה מאפשר הדמיה של עשרות אלפי תאים בניסוי אחד ומגדיל את הסבירות לגילוי וריאנטים פנוטיפיים נדירים, כמו תאים מתמידים, באוכלוסייה.
שיטת הכנת כרית אגרוז זו מציגה חלופה קלה ליישום לשיטות שפורסמו בעבר. הפרוטוקול שלנו אינו דורש את הדיוק הטכני של ייצור התקנים מיקרופלואידים או את המניפולציות המיומנות של שיטות "סנדוויץ'" אגרוז, מה שמקל על השגת הכנות עקביות מריצה לריצה 14,16,36. יתר על כן, המערכת חסכונית. תא הנירוסטה ניתן לחיטוי ולשימוש חוזר (בניגוד לתאי פלסטיק חד פעמיים) וההתקנה אינה דורשת ציוד מיוחד16,37. התא מותאם בקלות למערכות מיקרוסקופיה שונות באמצעות תוספות במה זמינות מסחרית. נוסף על כך, מאחר שחיידקים משותקים בממשק זכוכית מכוסה אגרוז, נחלנו הצלחה במעקב אחר חיידקים בעלי תנועה גבוהה כמו P. aeruginosa, ועדיין לאפשר שינויים מורפולוגיים (איור 4, סרטון משלים 4). שיטות הדמיה חד-תאיות אחרות, כגון "מכונת האם", מגבילות תאים לתעלות המונעות תצפית על שינויים מורפולוגיים שאינם נימה36.
להצלחה עם פרוטוקול זה, ישנם כמה שלבים ופרמטרים קריטיים שיש לזכור. להכנת פד, חשוב לחמם ולהמיס היטב את האגרוז, שכן כל גבישי האגרוז שנותרו יגרמו לעקיפה של האור וישפיעו על איכות התמונה. כמו כן, יש להקפיד להכניס את האגרוז לתא מבלי להכניס בועות אוויר. כדי להבטיח שעובי רפידות האגרוז יישאר עקבי ולהגביל את סחף הדגימה, חשוב לאפשר לרפיד להתאזן – בדרך כלל למשך 15 דקות – במתחם הלח ומבוקר הטמפרטורה לפני תחילת ההדמיה. גורם נוסף שיכול לגרום לאיכות תמונה ירודה הוא בקרת לחות: לחות נמוכה תגרום לכרית האגרוז להתייבש ולהתכווץ, בעוד שלחות גבוהה (או התחממות דגימה לא נכונה בתא) עלולה לגרום לאוויר החם להתעבות על הדגימה ולעוות את ההדמיה. דוגמה להדמיית קיטועי זמן תת-אופטימלית עקב עיבוי ניתן למצוא וידאו משלים 8.
מגבלה של המערך הנוכחי היא שלא ניתן להחליף את אמצעי התרבית, מה שמונע מעקב רציף אחר חיידקים בודדים לפני, במהלך ואחרי טיפול אנטיביוטי. אנו צופים כי צימוד כרית האגרוז עם תאי זרימה או התקנים מיקרופלואידים המאפשרים חילופי מדיה בתרבית יוכל לאפשר מעקב אחר אוכלוסיות במהלך שינויים תזונתיים או סביבתיים. פרמטר נוסף של העיצוב הנוכחי שניתן לשפר הוא אוורור דגימה. אטם טבעת O, עיצוב הברגה של צלחת הכיסוי הניתנת להחלפה מאפשר אוורור דגימה טוב יותר בהשוואה למערכות הדורשות שימוש בשעווה או בחומר איטום על בסיס שומן כדי לאטום את הרפידות16. עם זאת, אוורור בתא האטום עדיין עשוי להיות מוגבל ועשוי שלא לתמוך בצמיחה של אירובים מחייבים, אם כי זה עדיין לבדיקה.
פרוטוקול הכנת דגימות ההדמיה בהילוך מהיר שאנו מציגים במאמר זה מאפשר לעקוב אחר אלפי חיידקים בזמן שהם מגיבים לטיפול אנטיביוטי או מחלימים ממנו. שיטה זו גם ניתנת להכללה רבה ויש לה מגוון יישומים פוטנציאליים מעבר לביולוגיה מתמשכת. לדוגמה, כרית האגרוז ומערך החוצצים מאפשרים זריעה של דגימות תאים מופרדות מרחבית אך מאפשרים תקשורת בין תאים באמצעות דיפוזיה דרך כרית האגרוז. אנו בוחנים כעת את הפוטנציאל של מערך זה לבחון כיצד חילופי מוצרים מופרשים משפיעים על גדילת תאים בקהילות מרובות מינים. אנו צופים כי פרוטוקול זה יספק מחסום כניסה נמוך למיקרוסקופ בהילוך מהיר עבור החוקר החדש ווריאציות בלתי מוגבלות עבור המיקרוביולוג המנוסה לחקור.
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
אנו מודים לגב' סוזן סטורובסקי במרכז הבריאות UConn לניתוח תאים ומידול מיקרוסקופיה על סיועה בניסויים במיקרוסקופיה. אנו מודים לד"ר מונה וו אור ולסדנת יסודות הגנטיקה הסטפילוקוקלית והמטבוליזם על הפרוטוקולים והעצות שלהם לגבי שיבוט ב- P. aeruginosa ו- S. aureus, בהתאמה. עבודה זו נתמכה על ידי מימון מהמכונים הלאומיים לבריאות (NIH; DP2GM146456-01 ו- 1R01AI167886-01A1 ל- W.W.K.M., 1F30DE032598-01A1 ל- P.J.H. ו- 1F31DK136259-01A1 ל- T.J.L.). למממנים לא היה כל תפקיד בעיצוב הניסויים שלנו או בהכנת כתב היד הזה.
Materials
| Name | Company | Catalog Number | Comments |
| BaSiC | GitHub | https://github.com/marrlab/BaSiC | |
| Certified Molecular Biology Agarose | Biorad | 1613101 | |
| Fiji-ImageJ | NIH | https://imagej.net/software/fiji/downloads | |
| Interchangeable Coverglass Dish | Bioptechs | 190310-35 | 35 mm ICD for preparing agarose pads; comes with 30 mm (#1.5) coverslips |
| Lumencor Spectra 7 LED light engine | Lumencor | https://lumencor.com/products/spectra-light-engine | Spectra 7 LED light engine |
| MetaMorph | Molecular Devices | Premier version 7.10.5 | |
| pco.edge 4.2 bi sCMOS camera | Excelitas | https://www.excelitas.com/product/pcoedge-42-bi-usb-scmos-camera | sCMOS camera |
| PeCon live cell incubation chamber | peCon | https://www.pecon.biz/ | |
| Thomas Scientific Round cover glass, #1.5 thickness, 25 mm, 100 pack | Fisher Scientific | NC1272770 | 25 mm (#1.5) coverslips |
| Zeiss Axiovert 200M microscope | Zeiss | https://www.zeiss.com/microscopy/en/products/light-microscopes/widefield-microscopes/axiovert-for-materials.html | Inverted microscope with Plan-Apochromat 63x/1.40 Oil Ph3 M27 objective, Lumencor Spectra 7 LED light engine, and pco.edge 4.2 bi sCMOS camera (6.5 mm pixel size) |
References
- Brauner, A., Fridman, O., Gefen, O., Balaban, N. Q. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nat Rev Microbiol. 14, 320-330 (2016).
- Balaban, N. Q., et al. Definitions and guidelines for research on antibiotic persistence. Nat Rev Microbiol. 17 (7), 441-448 (2019).
- Conlon, B. P. Staphylococcus aureus chronic and relapsing infections: evidence of a role for persister cells. Bioessays. 36 (10), 991-996 (2014).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. J Bacteriol. 192 (23), 6191-6199 (2010).
- Verstraete, L., Van den Bergh, B., Verstraeten, N., Michiels, J. Ecology and evolution of antibiotic persistence. Trends Microbiol. 30 (5), 466-479 (2021).
- Sett, A., Dubey, V., Bhowmik, S., Pathania, R. Decoding bacterial persistence: Mechanisms and strategies for effective eradication. ACS Infect Dis. 10 (8), 2525-2539 (2024).
- Mempin, R., et al. Release of extracellular ATP by bacteria during growth. BMC Microbiol. 13, 301 (2013).
- Lewis, K. Persister cells, dormancy and infectious disease. Nat Rev Microbiol. 5 (1), 48-56 (2006).
- Fauvart, M., De Groote, V. N., Michiels, J. Role of persister cells in chronic infections: clinical relevance and perspectives on anti-persister therapies. J Med Microbiol. 60 (pt 6), 699-709 (2011).
- Van den Bergh, B., Fauvart, M., Michiels, J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters. FEMS Microbiol Rev. 41, 219-251 (2017).
- Levin, B. R., Rozen, D. E. Non-inherited antibiotic resistance. Nat Rev Microbiol. 4 (7), 556-562 (2006).
- Davis, K. M., Isberg, R. R. Defining heterogeneity within bacterial populations via single cell approaches. Bioessays. 38 (8), 782-790 (2016).
- Hare, P. J., LaGree, T. J., Byrd, B. A., DeMarco, A. M., Mok, W. W. K. Single-cell technologies to study phenotypic heterogeneity and bacterial persisters. Microorganisms. 9 (11), 2277 (2021).
- de Jong, I. G., Beilharz, K., Kuipers, O. P., Veening, J. W. Live cell imaging of Bacillus subtilis and Streptococcus pneumoniae using automated time-lapse microscopy. J Vis Exp. 53, e3145 (2011).
- Hare, P. J., Gonzalez, J. R., Quelle, R. M., Wu, Y. I., Mok, W. W. K. Metabolic and transcriptional activities underlie stationary-phase Pseudomonas aeruginosa sensitivity to levofloxacin. Microbiol Spectr. 12 (1), e0356723 (2024).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat Protoc. 7 (1), 80-88 (2011).
- Pang, Y. Y., et al. agr-Dependent interactions of Staphylococcus aureus USA300 with human polymorphonuclear neutrophils. J Innate Immun. 2 (6), 546-559 (2010).
- Bose, J. L., Fey, P. D., Bayles, K. W. Genetic tools to enhance the study of gene function and regulation in Staphylococcus aureus. Appl Environ Microbiol. 79 (7), 2218 (2013).
- Schenk, S., Laddaga, R. A. Improved method for electroporation of Staphylococcus aureus. FEMS Microbiol Lett. 73, 133-138 (1992).
- Grosser, M. R., Richardson, A. R. Method for Preparation and Electroporation of S. aureus and S. epidermidis. The Genetic Manipulation of Staphylococci. Methods Molecular Biology. , (2016).
- Krausz, K. L., Bose, J. L. Bacteriophage Transduction in Staphylococcus aureus: Broth-Based Method. The Genetic Manipulation of Staphylococci. Methods Molecular Biology. , (2016).
- Olson, M. E. Bacteriophage Transduction in Staphylococcus aureus. The Genetic Manipulation of Staphylococci. Methods Molecular Biology. , (2016).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), e00537-e00612 (2013).
- Coe, K. A., et al. Multi-strain Tn-Seq reveals common daptomycin resistance determinants in Staphylococcus aureus. PLoS Pathog. 15 (11), e1007862 (2019).
- Figurski, D. H., Helinski, D. R. Replication of an origin-containing derivative of plasmid RK2 dependent on a plasmid function provided in trans. Proc Natl Acad Sci U S A. 76 (4), 1648 (1979).
- Shee, C., et al. Engineered proteins detect spontaneous DNA breakage in human and bacterial cells. eLife. 2, e01222 (2013).
- Kowalska-Krochmal, B., Dudek-Wicher, R. The minimum inhibitory concentration of antibiotics: methods, interpretation, clinical relevance. Pathogens. 10 (2), 165 (2021).
- Robinson, J. L., Jaslove, J. M., Murawski, A. M., Fazen, C. H., Brynildsen, M. P. An integrated network analysis reveals that nitric oxide reductase prevents metabolic cycling of nitric oxide by Pseudomonas aeruginosa. Metab Eng. 41, 67-81 (2017).
- Wolff, J. A., MacGregor, C. H., Eisenberg, R. C., Phibbs, P. V. Isolation and characterization of catabolite repression control mutants of Pseudomonas aeruginosa PAO. J Bacteriol. 173 (15), 4700-4706 (1991).
- Batchelder, J. I., Taylor, A. J., Mok, W. W. K. Metabolites augment oxidative stress to sensitize antibiotic-tolerant Staphylococcus aureus to fluoroquinolones. mBio. , e0271424 (2024).
- Power, A. D., Mok, W. W. K. Agar and agarose used for Staphylococcus aureus biofilm cultivation impact fluoroquinolone tolerance. J Appl Microbiol. 135 (8), lxae191 (2024).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Peng, T., et al. A BaSiC tool for background and shading correction of optical microscopy images. Nat Commun. 8, 14836 (2017).
- Ducret, A., Quardokus, E., Brun, Y. V. MicrobeJ, a tool for high throughput bacterial cell detection and quantitative analysis. Nat Microbiol. 1 (7), 16077 (2016).
- Paintdakhi, A., et al. Oufti: an integrated software package for high-accuracy, high-throughput quantitative microscopy analysis. Mol Microbiol. 99 (4), 767-777 (2016).
- Wang, P., et al. Robust growth of Escherichia coli. Curr Biol. 20 (12), 1099-1103 (2010).
- Moffitt, J. R., Lee, J. B., Cluzel, P. The single-cell chemostat: an agarose-based, microfluidic device for high-throughput, single-cell studies of bacteria and bacterial communities. Lab Chip. 12 (8), 1487-1494 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved