Method Article
Pseudomonas aeruginosa ve Staphylococcus aureus Heterojen Fenotiplerinin Hızlandırılmış Epifloresan Mikroskobu Görüntülemesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu yazıda, Pseudomonas aeruginosa ve Staphylococcus aureus için antibiyotik sağkalımını değerlendirmek için kapsamlı bir protokol sunuyoruz, plazmitleri P. aeruginosa ve S. aureus'a dönüştürerek raportör suşlar oluşturmak ve persistanlar gibi fenotipik varyantları hızlandırılmış epifloresan mikroskobu ile görselleştirmek için.
Özet
Antibiyotik kalıcılığı, genetik olarak duyarlı bir popülasyondaki az sayıda bakteri hücresinin, diğer genetik olarak özdeş hücreleri öldüren antibiyotik tedavisinden sağ çıktığı bir olgudur. Bakteriyel kalıcılar, antibiyotik tedavisi sona erdiğinde replikasyona devam edebilir ve genellikle klinik tedavi başarısızlığının altında yattığı düşünülmektedir. Bakterilerin çeşitli hücresel özellikler için floresan transkripsiyonel raportörler, translasyonel raportörler ve / veya boyalarla etiketlendiği hızlandırılmış floresan mikroskobunun gücünden yararlanan son çalışmalar, Escherichia coli kalıcıları hakkındaki anlayışımızı, popülasyon düzeyinde antibiyotik sağkalım testlerinden öğrenilebileceklerin ötesine taşımıştır. Toplu popülasyon tahlillerinden ziyade bu tür tek hücreli yaklaşımlar, kalıcı oluşum, hasar tepkisi ve hayatta kalma mekanizmalarını tanımlamak için gereklidir. Bununla birlikte, bu ayrıntı düzeyinde diğer önemli patojenik türlerdeki kalıcıları incelemek için yöntemler sınırlı kalmaktadır.
Bu çalışma, antibiyotik tedavisi ve iyileşme sırasında Pseudomonas aeruginosa (gram negatif bir çubuk) ve Staphylococcus aureus'un (gram pozitif bir kok) hızlandırılmış görüntülemesi için uyarlanabilir bir yaklaşım sunmaktadır. Floresan raportörleri bu bakterilere dahil etmek için moleküler genetik yaklaşımları tartışıyoruz. Bu raportörleri ve boyaları kullanarak, antibiyotik tedavisine yanıt olarak tek tek hücrelerin fenotipik değişikliklerini, morfolojik özelliklerini ve kaderlerini izleyebiliriz. Ek olarak, tedaviyi takiben yeniden canlandırılırken bireysel ısrarcıların fenotiplerini gözlemleyebiliyoruz. Toplamda, bu çalışma, klinik olarak önemli patojenlerde hem tedavi sırasında hem de sonrasında kalıcılar da dahil olmak üzere, bireysel antibiyotikle tedavi edilen hücrelerin sağkalımını ve gen ekspresyonunu izlemekle ilgilenenler için bir kaynak görevi görmektedir.
Giriş
Bakteriyel patojenler, antibiyotiklerin etkilerinden iki ana mekanizma yoluyla kaçabilir: genetik değişiklikleri içeren antibiyotik direnci ve genetik olmayan değişiklikleri içeren fenotipik tolerans. Antibiyotik direnci, belirli bir bakteri hücresinin sadece hayatta kalmakla kalmayıp aynı zamanda bir antibiyotikvarlığında çoğalma yeteneğini de veren genetik olarak kodlanmış bir olgudur 1. Antibiyotiğe toleranslı veya antibiyotiğe dayanıklı bakterileri kapsayabilen fenotipik tolerans, hücreler antibiyotiğin inhibitör bir konsantrasyonunun varlığında çoğalma yeteneği kazanmadan bakterisidal antibiyotik tedavisine dayandığında ortaya çıkar 1,2. Toleransı kalıcılıktan ayıran şey, toleransın tüm popülasyonun tedaviden sağ çıkma yeteneğini ifade etmesidir, oysa kalıcılık, antibiyotik tedavisinden kurtulan izojenik ancak fenotipik olarak heterojen bir popülasyonun bir alt kümesini ifade eder. Bir klonal kültür bakterisidal antibiyotiklerle tedavi edildiğinde ve kültürde kalan hayatta kalanlar log-doğrusal bir ölçekte zamana karşı çizildiğinde, ısrarcılar mevcut olduğunda genellikle bifazik bir eğri tespit edilir. Bu eğrilerde, ilk aşama popülasyonun çoğunluğunun nispeten hızlı bir şekilde öldürüldüğünü gösterir ve ikinci aşama, bir antibiyotik kalıcı fraksiyonunun daha yavaş bir oranda öldürüldüğünü veya hiç öldürülmediğini gösterir 1,2.
Antibiyotik kalıcılığı, küresel sağlık sistemleri üzerinde büyük bir yük oluşturmaktadır. Örneğin, bu makalenin odak noktası olan Staphylococcus aureus ve Pseudomonas aeruginosa persisterlerinin, kistik fibrozisli hastalarda tekrarlayan hava yolu enfeksiyonları ve kronik yara enfeksiyonları da dahil olmak üzere antibiyotik dirençli inatçı enfeksiyonlara neden olduğu düşünülmektedir 3,4. Bu nedenle, kalıcı hücre biyolojisi ve fenotipik programların daha fazla aydınlatılması kritik öneme sahiptir. Kalıcıların nasıl oluştuğunu ve yeniden canlandırıldığını anlamada ilerleme kaydedilmiş olsa da, kalıcılığın altında yatan bireysel hücrelerde metabolik yeniden programlama ve moleküler olayların koordinasyonu ile ilgili kritik bilgi boşlukları 5,6,7,8 olarak kalmaktadır.
Kalıcılığı etkili bir şekilde incelemenin teknik bir zorluk olduğu kanıtlanmıştır. Kalıcılık yalnızca bir bakteri popülasyonunun küçük bir alt kümesinde gözlemlenebildiğinden, toplu bakteri popülasyonlarını örnekleyen teknikler genellikle ilgili biyolojik bilgileri yakalayamaz 1,2,8,9,10. Ayrıca, kalıcılığın altında yatan fenotipik değişiklikler geçici olduğundan ve kalıtsal olmadığından, kalıcı hücrelerin kaderini izlemek karmaşık olabilir 1,8,9,10,11. Bakteriyel kalıcılar büyümeye devam ettiklerinde, bölünebilir ve hem kalıcı hem de kalıcı olmayanlara yol açabilirler, bu da kültürleme yoluyla saf kalıcı popülasyonlar için zenginleştirmeyi imkansız hale getirir. Bu zorluklar, aşağıdaki kriterleri yerine getirebilecek tekniklere olan ihtiyacı vurgulamaktadır: 1) canlı, tek hücrelerin biyolojik bilgilerini yakalama yeteneği ve 2) floresan boyalar, problar, sensörler ve heterojen popülasyonlardaki bireysel hücrelerin fenotiplerinin zaman içinde sorgulanmasına izin veren raportörlerle birlikte kullanılma yeteneği.
Tek hücre teknolojilerindeki son gelişmeler, bakteriyel heterojenliği etkili bir şekilde araştırmak ve kalıcılık çalışmasındaki bu engellerin üstesinden gelmek için bir yol sağlamıştır12,13. Bu tekniklerden bazıları floresan mikroskobu, akış sitometrisi/floresanla aktive edilen hücre sıralaması, mikroakışkanlar ve tek hücreli RNA diziliminiiçerir 12,13. Burada, transkripsiyonel veya translasyonel raportör suşlarının epifloresan hızlandırılmış mikroskobunu kullanarak tek hücreli persister fizyolojisini aydınlatmak için protokolleri açıklıyoruz. Floresan mikroskobu, kalıcı fenotipleri inceleme kriterlerini, yani büyük bir popülasyondaki hangi bireysel hücrelerin antibiyotik çıkarıldıktan sonra çoğaldığını belirleme yeteneğini karşılayan güçlü bir tekniktir ve bu nedenle kalıcı olarak tanımlanabilir. Otomatik kamera teknolojilerinin ve kuluçka odalarının tanıtılmasıyla, canlı bakteri hücrelerini yakalamak, mikrobiyoloji alanında yaygın olarak erişilebilir hale geldi. En önemlisi, hızlandırılmış mikroskopi, tek hücreleri saatler ve hatta günler boyunca gerçek zamanlı olarak görselleştirme yeteneği sunar, bu da antibiyotik tedavisi öncesinde, sırasında ve sonrasında bakterilerin izlenmesini mümkün kılar 14,15,16. Hızlandırılmış mikroskopiden yararlanan bu araştırmalardan elde edilen içgörüler, kalıcı biyolojinin karmaşık mekanizmaları hakkında bilgi oluşturmak için muazzam bir potansiyele sahiptir.
Protokol
1.Transformasyon ve transdüksiyon yoluylaS. aureus'un floresan raportör suşlarının üretilmesi
NOT: Raportör suşları, ilgilenilen bir genin veya proteinin ekspresyonunu belirtmek için bir floresan proteini barındırır. Transkripsiyonel raportörler, bir floresan proteinin yukarı akışında ilgilenilen bir gen için doğal promotör dizisinin bir kopyasını içerir, böylece ilgilenilen bir genin ekspresyonu arttıkça floresan artar. Translasyonel muhabirler, bir floresan proteinin ve ilgilenilen bir proteinin açık okuma çerçevelerini esnek bir peptit konektörü ile birbirine bağlar. Raportör suşlarının canlı hücre mikroskobu ile görselleştirilmesi, ilgilenilen belirli bir gen/proteinin belirli hücre morfolojileri veya hücre kaderleri ile ilişkili olup olmadığını ortaya çıkarabilir (Şekil 1, Ek Video 1 ve Ek Video 2). S. aureus için kodon için optimize edilmiş bir floresan proteini seçin.Bu çalışma, Dr. Alexander Horswill tarafından hediye edilen pCM29'dan sGFP'yi kullanırken, Nebraska Transpozon Mutant Kütüphanesi Genetik Araç Seti, kodon için optimize edilmiş sGFP, eYFP, eCFP, DsRed.T3 ve eqFP65017,18 taşıyan plazmitleri içerir.
- Raportör plazmitlerini S. aureus RN4220'ye dönüştürün.
NOT: Aşağıdaki protokol bölümü, Nebraska Üniversitesi Tıp Merkezi 19,20'deki Staphylococcal Genetics and Metabolism'in Temelleri Çalıştayı'ndan uyarlanmıştır.- İlk olarak, elektroyetkin S. aureus RN4220'yi hazırlayın. 2 g kasamino asit, 5 g maya özütü, 2 mL %10K2HPO4, pH 7.5, 2 mL %50 glikoz çözeltisi ve 5 g NaCl'yi birleştirerek 200 mL B2 suyu hazırlayın. Steril ultra saf su ile hacmi 100 mL'ye getirin. Bileşenleri çözmek için 37 °C'de kısa bir süre karıştırın ve bir şişe üstü filtre (0,22 μm gözenek boyutu) kullanarak sterilize edin.
- S. aureus RN4220'yi -80 ° C'de% 25 gliserol içinde saklanan donmuş bir stoktan 250 mL'lik şaşkın bir şişede 30 mL B2 suyuna aşılayın ve 125 rpm'de çalkalayarak 30 ° C'de 18 saat inkübe edin.
- Ortamı ertesi gün için önceden ısıtmak için her biri 50 mL B2 suyu ile iki adet 37 mL şaşkın şişeyi gece boyunca 37 mL inkübe edin.
- Ertesi gün, gece kültürünün OD600'ünü ölçün. 50 mL B2 suyu içeren her şişeye 0.25'lik son bir OD600 elde etmek için yeterli gece kültürü ekleyin.
- OD600 0.35-0.4'e ulaşana kadar 37 ° C'de 250 rpm'de çalkalayarak inkübe edin.
NOT: Kültürün0.35-0.4'ün üzerine çıkmadığından emin olmak için alt kültürlemeden yaklaşık 30 dakika sonra OD 600'ü kontrol edin. OD600 , alt kültürlemeden sonraki 1 saat içinde 0.35-0.4'e ulaşmazsa, prosedürü terk edin ve ertesi gün tekrar deneyin. Bakteriler büyük olasılıkla bir gecede çok fazla büyüdü ve durağan fazın çok derinlerindeydi. - Kültür, orta log fazına ulaştığında, her bir şişeden kültürü steril 50 mL'lik bir konik tüpe ve 10 dakika boyunca 4.000 x g'da santrifüjleme yoluyla pelet hücrelerine dökün.
- Süpernatanı boşaltın ve peleti 1 mL steril, oda sıcaklığında (RT) suda yeniden süspanse edin. Hücreleri bir mikrosantrifüj tüpüne aktarın.
- Hücreleri 30 saniye boyunca 21.000 x g'da tekrar santrifüjleyin, süpernatanı çıkarın ve 1 mL steril RT suyunda yeniden süspanse edin. Santrifüjlemeyi, süpernatantın uzaklaştırılmasını ve yeniden süspansiyonu 1 mL su adımlarında toplam üç yıkama için iki kez daha tekrarlayın.
- Hücreleri santrifüjleyin, suyu çıkarın, daha sonra hücreleri 1 mL steril RT% 10 gliserol (suda, steril filtrelenmiş) içinde yeniden süspanse edin ve 15 dakika RT'de bırakın.
- Hücreleri 30 saniye boyunca 21.000 x g'da santrifüjleme ile peletleyin, süpernatanı çıkarın ve hücreleri 1 mL başka bir steril, RT% 10 gliserol içinde yeniden süspanse edin. Bu hücreler artık elektroyettir.
- 70 μL elektroyetkin hücreleri geçmeli kapaklı mikrosantrifüj tüplerine alın ve ileride kullanmak üzere -80 °C'de saklayın.
- Elektroyetkin S. aureus RN4220'yi dönüştürmek için, bir dizi hücreyi buz üzerinde çözün. Hücrelere 1 μg plazmit DNA ekleyin, karıştırmak için numuneyi hafifçe vurun ve 5 dakika buz üzerinde inkübe edin. Daha sonra, hücreleri elektropore edin ve 37 ° C'de 1-2 saat boyunca 390 μL B2 ortamında iyileşmelerine izin verin, 225 rpm'de çalkalayın ve seçici triptik soya agar üzerinde plaka dönüştürücüler.
NOT: Bu çalışmada kullanılan mekik vektörlerinin çoğu, E. coli'de seçim için bir ampisilin direnç kaseti (100 μg/mL) ve S. aureus'ta seçim için bir kloramfenikol- (10 μg/mL) veya eritromisin- (Erm, 10 μg/mL) direnç kaseti içerir.Laboratuvarda rutin olarak kullanılan birçok S. aureus suşu Erm'ye dirençlidir. Belirli bir mekik vektörünü kullanmadan önce ilgilenilen bir suşun seçici antibiyotikle uyumlu olduğundan emin olun. Elektroporasyon sırasında numune çok iletken olduğunda meydana gelen ark oluşumunu önlemek için hücrelere eklenen DNA hacminin en aza indirilmesi (yani <5 μL) önemlidir. Plazmit DNA'nın yüksek konsantrasyonlarının (≥300 ng/μL) E. coli'den saflaştırılması, hacimlerin düşük tutulmasına yardımcı olacaktır.
- Transforme edilmiş bakteriyofajı çoğaltın S. aureus RN4220 olarak adlandırılır.
NOT: Aşağıdaki protokol bölümü Krausz ve Bose'un yöntemlerinden uyarlanmıştır.21ve Olson22. En sık kullanılan bakteriyofajlardan ikisi S. aureus transdüksiyon vardır φ11 ve 80α. Bunların her ikisini de hasat etme prosedürü aynıdır, ancak φ11'i elde etmemiz dışında S. aureus RN451 ve 80α'dan itibaren S. aureus RN10359. φ11, diğerlerinin yanı sıra yaygın suşlar JE2 ve HG003 ile başarıyla kullanılmıştır ve bu protokolde kullanılmaktadır23,24. Bununla birlikte, bu fajlar, değişen faj dirençlerine sahip klinik izolatları verimli bir şekilde dönüştüremeyebilir. Krausz ve Bose'un yayınlarına bakın21 ve Olson22 φ11 hazırlamak ve faj titresini belirlemek için bir yöntem için.- Raportör plazmidi transdüksiyona uğratmak için, 5 mMCaCl2 ve seçici antibiyotiğin uygun konsantrasyonuna sahip altı triptik soya agar (TSA) plakası hazırlayın. Streak S. aureus RN4220, raportör plazmidi ile seçici antibiyotik içeren ve CaCl2 içermeyen bir TSA plakasına dönüştürülür ve gece boyunca inkübe edilir.
- Ertesi gün, 56 ° C'ye kadar bir inkübatör veya su banyosu yapın. Altı adet 5 mL'lik geçmeli kapak tüpünü 1 x 104 ila 1 x 109 arasında etiketleyin ve her bir geçmeli kapaklı tüpe 40 μL 500 mM CaCl2 ekleyin.
- Steriliteyi korurken basınç oluşumunu önlemek için yumuşak TSA'yı (%0,5 agar) kapağı gevşetilmiş bir mikrodalgada eritin. Ardından, geçmeli kapaklı tüplerin her birine 4 mL alikot edin. Karıştırmak için tüpleri ters çevirin, ardından yumuşak agarın katılaşmasını önlemek için 56 °C inkübatöre yerleştirin.
- Faj stoğunu triptik soya suyu (TSB) + 5 mM CaCl2'de 1 x10 10 PFU/mL'ye seyreltin. 1 x109 PFU/mL'lik bir nihai konsantrasyon için 900 μL TSB + 5 mM CaCl2 içeren bir mikrosantrifüj tüpüne 100 μL 1 x10 10 PFU/mL faj ekleyin. Daha sonra, 1 x 104 PFU / mL'lik bir konsantrasyona kadar 900 μL TSB + 5 mM CaCl2 içeren ek mikrosantrifüj tüplerine seri olarak seyreltin. Altı TSA + 5 mM CaCl2 + seçici antibiyotik agar plakasının her birini seri seyreltme ile etiketleyin: 1 x104 ila 1 x 109 PFU/mL.
- Gece boyunca yeniden süspanse et S. aureus RN4220 1 mL TSB + 5 mM CaCl2 içinde plazmit içerir. 109 geçmeli kapak tüpünü inkübatörden çıkarın ve hızlı bir şekilde plazmid ve 100 μL 1 x 109 PFU / mL faj seyreltmesi içeren 10 μL yeniden askıya alınmış RN4220 ekleyin, karıştırmak için ters çevirin ve içeriği karşılık gelen TSA + 5 mM CaCl2 + seçici antibiyotik agar plakasına dökün.
- Kalan faj seyreltmeleri ve ilgili plakaları için bu prosedürü gerçekleştirin. Yumuşak agarın plakalar üzerinde katılaşmasına izin verin, ardından yumuşak agar gece boyunca 37 °C'de yukarı bakacak şekilde inkübe edin.
- Ertesi gün, plakaların (bakteri çimi üzerindeki boşluk alanları) plakalar üzerinde görünür olduğundan emin olun (Şekil 2A). Plaklar, fajın RN4220'yi başarılı bir şekilde enfekte ettiği lizis alanlarını temsil eder ve bazı fajlar ilgilenilen plazmidi almış olacaktır. Neredeyse birleşik lizise sahip en az seyreltilmiş faj stoğuna sahip plakayı seçin (örnek: 1 x 109 PFU/mL faj) ve bunun altındaki iki seyreltmeyi alan plakaları (bu durumda, 1 x 108 PFU/mL ve 1 x 107 PFU/mL, her ikisi de birleşime yakın lizise sahip olmalıdır).
- Bu plakaların en az seyreltilmiş olanına 3 mL TSB + 5 mM CaCl2 ekleyin (bu örnek için 1 x 109 PFU / mL). Yumuşak agar tabakasını normal agardan nazikçe sıyırmak için steril L şeklinde bir hücre yayıcı kullanın (Şekil 2B). Yumuşak agardan faj salınımını kolaylaştırmak için agarı mümkün olduğunca bozmak için hücre yayıcıyı kullanın.
- İlk plakadaki yumuşak agar tamamen bozulduktan sonra, yumuşak agar ve et suyu bulamacını bir sonraki plakaya yavaşça dökün (bu durumda, 1 x 108 PFU/mL). Bu plakadaki yumuşak agarı kazıyın ve parçalayın, ardından elde edilen bulamacı son plakaya dökün ve tekrarlayın.
- Yumuşak agar bulamacını her üç plakadan da hazırladıktan sonra, bulamacı yavaşça 50 mL'lik konik bir tüpe dökün. Yumuşak agarı daha da bozmak için nazikçe pipetleyin, ancak kabarcık oluşturmaktan kaçının. Fajlara zarar verebileceği ve titreyi azaltabileceği için girdap yapmayın.
- Yumuşak agar bulamacını RT'de 10 dakika boyunca 4.000 x g'da santrifüjleyin. Süpernatanı yavaşça 0.45 μm'lik bir filtreye bağlı bir şırıngaya dökün.
NOT: Nazikçe dökmek ve filtreye agar parçaları girmekten kaçınmak önemlidir. Bu parçalar filtreyi tıkayacak ve kalan süpernatantın filtrelenmesini önleyerek titreyi azaltacaktır. - Vahşi tip RN422021 kullanarak elde edilen faj lizatının titresini belirleyin.
- Muhabir plazmitleri transdüksiyon yoluyla ilgilenilen S. aureus suşlarına sokun.
- 500 μg/mL sodyum sitrat ve uygun konsantrasyonda seçici antibiyotik içeren sekiz TSA plakası hazırlayın. İstenen alıcı S. aureus suşunu düz TSA'ya yoğun bir şekilde çizin ve gece boyunca 37 ° C'de inkübe edin.
- Ertesi gün, plakayı sürüntü ve alıcı suşunu 1 mL TSB + 5 mM CaCl2 içinde yeniden süspanse edin.
- İstenen raportör plazmidi taşıyan faj stoğunu 1 x1010 PFU/mL'ye seyreltin.
- 50 mL'lik konik bir tüpte 1.5 mL TSB + 5 mM CaCl2, 0.5 mL yeniden askıya alınmış alıcı suşu ve 0.5 mL seyreltilmiş faj stoğunu karıştırın. 37 °C'de, 225 rpm'de çalkalayarak 20 dakika inkübe edin.
NOT: Daha uzun inkübasyon süreleri önerilmez, çünkü faj alıcı hücreleri parçalamaya başladığında muhtemelen transdüksiyon verimliliğini azaltacaktır. - Hemen ardından, konik tüpe 1 mL steril filtrelenmiş buz gibi 0.02 M sodyum sitrat (suda) ekleyin ve 4 ° C'de 10 dakika boyunca 4.000 x g'da santrifüjleyin. Ardından, peleti 1 mL buz gibi soğuk 0.02 M sodyum sitrat içinde yeniden süspanse edin.
- 500 μg/mL sodyum sitrat içeren altı TSA plakasının her birine 100 μL'lik alikot ve transdüktanları seçmek için uygun seçici antibiyotik konsantrasyonu yayın. Gece boyunca 37 °C'de inkübe edin.
- Ertesi gün, transdüksiyon plakalarından 500 μg / mL sodyum sitrat ve uygun konsantrasyonda seçici antibiyotik içeren kalan iki TSA plakasına tek tek koloniler çizin. Gece boyunca 37 °C'de inkübe edin.
NOT: Ek sodyum sitrat plakaları üzerindeki bu geçiş adımı, transdüksiyon hücrelerinin etrafındaki faj titresini azaltmaya yardımcı olarak lizis22'yi önler. - Çizgi plakasından tek tek kolonileri seçin, seçici antibiyotik içeren TSB'de hücreleri üstel faza büyütün ve ileride kullanmak üzere -80 ° C'de% 25 gliserol içinde saklayın.
2. Konjugasyon yoluyla P. aeruginosa'nın floresan raportör suşlarının üretilmesi
NOT: Bir raportör plazmitin bir E. coli klonlama suşundan P. aeruginosa'ya taşınması, üç ebeveynli çiftleşme25 ile yapılabilir. İlgilenilen plazmidi taşıyan bir donör E. coli suşu (evlilik transferi için bir oriT içermesi gereken), E. coli HB101 + pRK2013 - konjugasyonu kolaylaştırmak için bir yardımcı suş (pRK2013 plazmit bakımı için 50 μg/mL kanamisin kullanın) ve plazmidi alacak P. aeruginosa alıcı suşu gereklidir. Bu örnek için, ilgilenilen plazmidin bir tetrasiklin (Tet) direnç markörü vardır, bu nedenle plazmidli herhangi bir E. coli kültürü 10 μg/mL Tet'e ihtiyaç duyacaktır ve P. aeruginosa plazmidli seçim26 için 75 μg/mL Tet'e ihtiyaç duyacaktır.
- %25 gliserol içinde -80 °C'de depolanan donmuş stoklardan bakterileri, gece boyunca büyüme için uygun antibiyotikle, 37 °C'de 225 rpm'de çalkalayarak lizojeni et suyuna (LB) aşılayın.
- Ertesi gün, her sıvı gece kültüründen 200 μL'yi uygun seçici antibiyotik ile LB agar plakasına yayın. Kaç tane dönüşüm çiftleşmesinin yapılacağına bağlı olarak, yardımcı ve donör suşları için daha fazla plaka yayın. Dönüşüm başına bir plaka yardımcı/donör önerilir. Her suştan yoğun çimler elde etmek için plakaları gece boyunca 37 °C'de inkübe edin.
- Ertesi gün, her bir plaka yüzeyini steril bir pamuklu çubukla temizleyerek ve bir mikrosantrifüj tüpünün içi boyunca silerek büyüme çimlerini toplayın. Hücreleri tüpün dibine toplamak için her tüpü kısaca santrifüjleyin (5 saniye boyunca darbe). Her hücre peletini 200 μL LB içinde yeniden süspanse edin.
NOT: Süspansiyonlar çok kalın, opak görünmeli ve topaklardan arındırılmış olmalıdır. - Her çiftleşme için yeni mikrosantrifüj tüplerinde, 5 μL alıcı P. aeruginosa suşu, ilgilenilen plazmidi taşıyan 160 μL donör E. coli suşu ve 160 μL yardımcı E. coli HB101 + pRK2013'ü birleştirin. Hafifçe karıştırın, yukarı ve aşağı pipetleyin, ardından karışımın 50 μL'sini önceden kurutulmuş bir LB agar plakasına yerleştirin. Ayrıca, kontroller için her bir suşun 20 μL'sini LB agar'a tespit edin. Lekelerin plakada tamamen kurumasını bekleyin, ardından 37 ° C'de 3-6 saat inkübe edin.
NOT: LB agarın önceden kurutulması, 50 μL'lik noktanın yüzeye yayılmasını önler ve böylece hücreleri daha küçük bir alanda etkileşime girmeye zorlar. - İnkübasyondan sonra, bazı hücreleri yeni bir mikrosantrifüj tüpüne aktarmak için bir pipet ucunu çiftleşme noktası boyunca hafifçe kaydırın. Tüpün altındaki hücreleri toplamak için kısa bir süre santrifüjleyin. 200 μL LB'de yeniden süspansiyon yapın ve tüm yeniden süspansiyonu bir LB + Irgasan (Igr; 25 μg/mL) + Tet (75 μg/mL) agar plakasına yerleştirin.
NOT: P. aeruginosa , Igrasan'a karşı doğal olarak dirençlidir ve ilgilenilen plazmid, Tet direnç belirtecini içerir, bu nedenle yalnızca başarılı bir şekilde dönüştürülmüş P. aeruginosa , LB + Irgasan + Tet plakaları üzerinde büyüyebilmelidir. Dönüşüm verimliliğine bağlı olarak, tüm eşleşme noktasının yeniden askıya alınması ve kaplanması, ertesi gün bir dönüştürücü çimi ile sonuçlanabilir. Bireysel koloniler elde etmek için, (i) tüm çiftleşme noktasını daha büyük bir LB hacminde yeniden süspanse edin ve daha sonra 200 μL'sini plakalayın veya (ii) çiftleşme noktasının küçük bir kısmını bir mikrosantrifüj tüpüne aktarın ve ardından 200 μL ve plakada yeniden süspanse edin. - Her bir suşun kontrol noktaları ile, yoğun hücre noktasının bir kısmını bir pipet ucuna nazikçe kaydırın, yeni bir mikrosantrifüj tüpüne aktarın, 200 μL LB'de yeniden süspanse edin, ardından 50 μL'yi bir LB + Irgasan + Tet agar plakasına yerleştirin (aynı agar plakasına birden fazla kontrol noktası yerleştirilebilir). Lekelerin tamamen kurumasını bekleyin. Tüm plakaları gece boyunca 37 °C'de 16-20 saat inkübe edin.
NOT: Kontrol noktaları için amaç, antibiyotik plakasının P. aeruginosa transformantları için seçici olduğunu doğrulamaktır. LB + Irgasan + Tet agar plakalarında tespit edildiğinde kontrol noktaları çok konsantre ise, seçimin ertesi gün işe yarayıp yaramadığını belirlemek zor olacaktır, çünkü büyüme ile karıştırılabilecek bir ölü hücre halesi olacaktır. - Ertesi gün, LB + Irgasan + Tet plakalarının antibiyotik seçiciliğini, bireysel suş kontrol noktaları için hücre büyümesi eksikliğine dikkat çekerek onaylayın.
NOT: Üç ebeveynli çiftleşme LB + Igrasan + Tet plakasında görünen koloniler, ilgilenilen plazmidi taşıyan P. aeruginosa dönüştürücüleridir. - Kolonileri LB + Irgasan + Tet agar üzerine toplamak ve çizmek ve çiftleşme karışımından fazla ölü E. coli'den kurtulmak için gece boyunca büyütmek isteğe bağlıdır.
- Tek tek kolonileri toplayın, sıvı LB + Tet (75 μg/mL) içinde gözle görülür şekilde bulanıklaşana kadar 3-6 saat büyütün, ardından donmuş stokları %25 gliserol (500 μL hücre kültürü + 500 μL suda %50 gliserol) içinde saklayın. Klonların koloni PCR ve ardından Sanger veya tam plazmit dizilimi ile başarılı bir şekilde dönüştürüldüğünü doğrulayın.
3. Persistan tahliller için antibiyotik dozlarının belirlenmesi
NOT: Kalıcı deneyler için bakteri popülasyonunu tedavi etmek için belirli bir antibiyotiğin bir dozunu seçmek için, önce ilgilenilen bakteri suşuna karşı antibiyotiğin minimum inhibitör konsantrasyonunu (MIC) ölçün. Bu, Klinik ve Laboratuvar Standartları Enstitüsü'nün (CLSI) onayladığı bir yaklaşım olan et suyu mikrodilüsyon yöntemi veya bir dizi antibiyotik dozu27 içeren test şeritleri kullanılarak yapılan Epsilometre testi (E-testi) kullanılarak elde edilebilir. MIC belirlendikten sonra, hücre tedavisi için 1 ila 100 kat MIC arasında değişen en az beş antibiyotik konsantrasyonu seçin.
- -80 °C'de %25 gliserol içinde saklanan donmuş stoklardan bakterileri 2 mL katyon ayarlı MHB (CA-MHB) veya besin açısından zengin başka bir ortama aşılayın. 125 μL kültürü 250 mL şaşkın bir Erlenmeyer şişesinde 25 mL taze, kimyasal olarak tanımlanmış ortama aktarmadan önce hücreleri 37 ° C'de yaklaşık 4 saat boyunca 250 rpm'de çalkalayarak büyütün. Bakterileri 37 ° C'de 16 saat (sabit faza kadar) büyütün, 250 rpm'de çalkalayın.
NOT: Tek karbon kaynağı olarak süksinat içeren Bazal Tuz Ortamı (BSM) tipik olarak P. aeruginosa deneyleri için kullanılır ve kimyasal olarak tanımlanmış zengin ortam tipik olarak S. aureus deneyleri için kullanılır 28,29,30,31. - Ertesi sabah, istenen supra-MIC konsantrasyon aralığı için 100x antibiyotik stoğu (ilgili çözücülerde) hazırlayın. Ayrı ayrı test tüplerine her seyreltmeden 10 μL ekleyin.
- Sabit faz bulanıklığını doğrulamak için gece boyunca kültürün OD600'ünü ölçün. Antibiyotik tedavisinden önce koloni oluşturan birimleri (CFU'lar) belirlemek için 10 μL kültürü seri olarak seyreltin ve seyreltmeleri LB agar, CA-MHB agar veya TSA gibi besleyici agar plakalarına yerleştirin.
- Antibiyotik tedavisi için, kültürün 1 mL alikotunu 10 μL 100x antibiyotik konsantrasyonu içeren test tüplerine dağıtın. Numuneleri 37 ° C'de, 250 rpm'de çalkalayarak, popülasyondaki kalıcı olmayanları öldürmek için yeterli bir süre boyunca inkübe edin ve kalıcı olanları tek koloni oluşturan hücreler olarak bırakın.
NOT: Tedavi süresi, deneye ve test edilen bakteri suşuna bağlı olarak değişebilir. Tipik olarak S. aureus 5 saat veya 7 saat ve P. aeruginosa 7 saat veya 24 saat boyunca tedavi edilir. Genel olarak, zamana bağlı sağkalım testinin ikinci aşamasındaki herhangi bir zaman noktası kullanılabilir, çünkü ikinci aşamada kalan hücrelerin kalıcı olması beklenir. - Antibiyotik tedavisinden sonra, test tüplerinden 100 μL hücreyi 900 μL steril fosfat tamponlu salin (PBS) içeren mikrosantrifüj tüplerine aktarın. Hücreleri 3 dakika boyunca 21.000 x g'da RT'de santrifüjleme ile peletleyin. 900 μL süpernatanı çıkarın ve peleti 900 μL steril PBS'de yeniden süspanse edin. Artık antibiyotikleri alt MIC seviyelerine düşürmek için yıkama adımını en az bir kez daha tekrarlayın.
- Kültürü 10 kat (altı kez) seri olarak seyreltin ve her seyreltmeden 10 μL'yi besleyici agar plakaları üzerine plakalayın. Plakaları gece boyunca 37 °C'de inkübe edin.
NOT: Seri seyreltme için işlenmemiş, yuvarlak tabanlı 96 oyuklu plakalar ve çok kanallı bir pipet kullanarak kare agar plakaları üzerinde plaka hücreleri kullanın. - Ertesi gün, her antibiyotik konsantrasyonunda kolonileri sayın. Log-doğrusal ölçekte konsantrasyona karşı hayatta kalma fraksiyonunu (tedavinin sonunda CFU / tedaviden önce CFU) çizin. Gelecekteki kalıcı testler için bir ilaç konsantrasyonu seçmek için, bifazik eğrinin ikinci aşamasında bir konsantrasyon seçin (Şekil 3).
4. Antibiyotik tedavisi veya iyileşme sırasında hücrelerin görüntülenmesi
- Hızlandırılmış görüntüleme için agaroz pedleri ve hücre örnekleri hazırlayın
NOT: Aşağıdaki numune hazırlama protokolü, geleneksel agaroz "sandviç" yöntemlerine kullanıcı dostu, uygun maliyetli bir alternatif olarak geliştirilmiştir14,16. Değiştirilebilir bir lamel kabının kullanılması, numuneyi kapatmak için dağınık yağ veya oje ihtiyacını ortadan kaldırır ve bu da numunenin havalandırılmasını daha da sınırlayabilir. Agaroz, lamel zaten yerinde olacak şekilde değiştirilebilir lamel kabına yerleştirilir ve serbest el agaroz ped preparatlarına kıyasla güvenilir bir şekilde düzlemsel agaroz yüzeyler oluşturur. Genel olarak, bu yöntem, stabil nemlendirme nedeniyle görüş alanı boyunca daha iyi odaklanarak ve daha uzun süreler boyunca numunelerin görüntülenmesine izin vermiştir. Burada açıklanan yöntem, antibiyotik tedavisi sırasında bakterileri görselleştirmek için kullanılır (Şekil 4, Ek Video 3ve Ek Video 4). Antibiyotik tedavisinden sonra inatçıları yeniden canlanırken ve yeniden uyanırken görselleştirmek için (Şekil 5, Ek Video 5ve Ek Video 6), agaroz pedlerini kullanılmış besiyeri yerine taze kültür besiyeri ile hazırlayın ve pedlere antibiyotik eklemeyin (plazmit idamesi/antibiyotik seçimi için eklenenler hariç).- Değiştirilebilir bir lamel kabının ("hazne") paslanmaz çelik tabanının altına 30 mm'lik steril bir lamel (#1.5 kalınlık) yerleştirin. Polikarbonat eki, 30 mm'lik lamel haznenin tabanını oluşturacak şekilde yavaşça tabana geçirin ve takılı silikon O-ringi sıkıştırarak yerine kapatın. Yinelenen bir oda hazırlamak için bu adımı tekrarlayın.
NOT: Odalardan birinin hazırlanmasının yetersiz olması durumunda, her deney için kopyaların hazırlanması önerilir. P. aeruginosa gibi hareketli hücrelerin çapraz kontaminasyonunu önlemek ve numune konumları için yer işaretleri sağlamak için 30 mm'lik lamel üzerine özel bir 3D baskılı bölücü yerleştirilmiştir. 3D baskı için STL dosyası Ek Dosya 1'de mevcuttur. - Tercih edilen ortamı kullanarak 50 mL'lik konik bir tüpte% 1.5 agaroz hazırlayın. Karıştırmak için hafifçe döndürün.
NOT: Tedavi sırasında durağan faz hücrelerinin görüntülenmesi için, baz ortam olarak durağan faz gece kültüründen hücresiz harcanan ortam kullanılır. Tipik olarak, agaroz ortamı, iki odacıkın hazırlanması için 7 mL ortamında 0.105 g agaroz olarak hazırlanır; her hazne 2 mL agaroz ortamı gerektirir ve fazlalık, pipetleme sırasında hava kabarcıklarını önlemek için yararlıdır. - 50 mL konikliği bir cam kabın veya mikrodalgaya dayanıklı bir tutucunun içine yerleştirin (kapağın gevşek olduğundan emin olun). Mikrodalga yüksekte, her 3-4 saniyede bir döndürmek ve karıştırmak için durun. Agaroz karışımının köpürmesini önlemek için sık sık duraklayın ve karıştırın.
- ~1 dk toplam ısıtma süresinden sonra, karışımda erimemiş görünür bir agaroz olup olmadığını kontrol edin. Karışım eşit derecede berraksa, herhangi bir ek ilaç veya boya eklemeden önce agaroz ortamının kısa bir süre ~ 60 ° C'ye soğumasını bekleyin. Karıştırmak ve hava kabarcıklarının oluşumunu önlemek için hafifçe döndürün.
NOT: Hücrelerin canlılığını kaybettiğini görselleştirmek için propidyum iyodür ( P. aeruginosa için 16 μM veya S. aureus için 1.6 μM) eklenebilir.
- ~1 dk toplam ısıtma süresinden sonra, karışımda erimemiş görünür bir agaroz olup olmadığını kontrol edin. Karışım eşit derecede berraksa, herhangi bir ek ilaç veya boya eklemeden önce agaroz ortamının kısa bir süre ~ 60 ° C'ye soğumasını bekleyin. Karıştırmak ve hava kabarcıklarının oluşumunu önlemek için hafifçe döndürün.
- Agaroz ortamının katılaşmasını önlemek için hızlı bir şekilde hareket ederek, 2 mL agaroz ortamını 30 mm'lik lamel ile hazneye pipetleyin. Üst hazne açıklığındaki agaroz ortamının üzerine nazikçe 25 mm'lik steril bir lamel (#1.5 kalınlık) yerleştirin; Bu, agaroz pedinin dehidrasyonunu önlemeye yardımcı olur ve optimum faz kontrastlı görüntüleme için agarozun düz bir üst yüzeyini sağlar. Pedin 1-2 saat katılaşmasına izin verin.
- Ped katılaştıktan sonra, tek hücreleri görselleştirmek için PBS'de uygun şekilde seyrek bir yoğunluğa seyrelterek görüntülenecek hücreleri hazırlayın. Burada hücreler OD600 0.01-0.05'e seyreltilir.
- 25 mm'lik lamel üzerinde, ped üzerine ekilen her numunenin konumlarını/kimliklerini işaretlemek için ince uçlu bir kalıcı işaretleyici kullanın. Hazneyi, paslanmaz çelik taban halkası yukarı bakacak şekilde ters çevirin ve tabanı açarken polikarbonat eki dikkatlice altında tutun. Paslanmaz çelik tabanı yana yerleştirin. 30 mm'lik lamel pedden dikkatlice kaydırın ve atın.
NOT: 30 mm'lik lamel yatay olarak kaydırarak çıkarın ve agaroz yüzeyini girintili hale getirmemeye dikkat edin. Ayrıca, açıkta kalan agaroz yüzeyi üzerinde çalışmaktan kaçının: üzerine düşen herhangi bir toz görüntü kalitesini etkiler ve potansiyel olarak pedi kirletebilir. - Yönlendirme için 25 mm'lik lamel üzerindeki işaretleri kullanarak, seyreltilmiş hücrelerin 5 μL'sini agaroz pedi üzerindeki ilgili yerlere yerleştirin. Üç adet 5 μL'lik nokta ekleyin (bunu gerektiği gibi ayarlayın, örneğin 4 x 4 μL'lik nokta vb.). Lekeler tamamen kuruduktan sonra, pedin ortasına yeni, steril 30 mm'lik bir lamel yerleştirin.
- Polikarbonat eki bir elinizle tutun ve diğer elinizle paslanmaz çelik tabanı yeni lamel üzerine yavaşça yeniden geçirin. Silikon O-ringi sıkıştırmak ve hazneyi kapatmak için sadece parmak sıkılığına kadar diş açmak yeterlidir.
NOT: Aşırı sıkmamaya dikkat edin - numune yüzeyine karşı 30 mm'lik lamel paslanmaz çelik taban tarafından sıkıştırılır ve tekrar tekrar bükülürse, hücreler radyal bir düzende yayılabilir ve potansiyel olarak numune çapraz kontaminasyonuna neden olabilir. - Hazne kapatıldıktan sonra, agarozun 30 mm'lik lamel yüzeyine temas edip etmediğini gözlemleyin; Bu noktada, genellikle bir miktar yüzey teması vardır, ancak tam değildir. Bir cımbızın veya benzer bir aletin kör ucunu kullanarak, agaroz 30 mm'lik lamel tüm yüzey boyunca eşit şekilde temas edene kadar 25 mm'lik lamele hafifçe bastırın.
DİKKAT: Bu adım, aşırı kuvvet kullanılırsa 25 mm lamel kırılmasına neden olabilir. - Agaroz, büyük hava kabarcıkları kalmayacak şekilde 30 mm'lik lamel üzerine iyice bastırıldıktan sonra, ped görüntülenmeye hazırdır.
- Değiştirilebilir bir lamel kabının ("hazne") paslanmaz çelik tabanının altına 30 mm'lik steril bir lamel (#1.5 kalınlık) yerleştirin. Polikarbonat eki, 30 mm'lik lamel haznenin tabanını oluşturacak şekilde yavaşça tabana geçirin ve takılı silikon O-ringi sıkıştırarak yerine kapatın. Yinelenen bir oda hazırlamak için bu adımı tekrarlayın.
- Mikroskobu ve görüntüyü ayarlayın.
- Mikroskop ve görüntüleme odası çevre kontrollerini hazırlayın. Sahne üstü inkübatörü ve büyük hazneli inkübatörü sıcaklıklarını 37 °C'ye ayarlayın ve hazneli nemlendiriciyi açın. Agaroz ped preparatlarından birini sahne üstü inkübatöre yerleştirin ve numunenin dengelenmesine izin vermek için inkübasyon odasını kapatın. Haznenin 25 mm'lik lamel üzerinde yoğuşmayı önlemek için sahne üstü inkübatör nemlendirme kapağı bu noktada açık bırakılır.
NOT: Sıcaklık değişikliklerinden kaynaklanan balata büzülmesi/genişlemesi, otomatik odaklama algoritmasının tarama aralığının ötesine geçen zaman noktaları arasında kaymaya neden olabilir. Görüntülemeden önce agaroz pedini sabit bir sıcaklığa dengelemek çok önemlidir, bu genellikle en az 15 dakika sürer. Yeterli ısınma, nemlendirme kapağı yerine yerleştirildiğinde üst lamel üzerinde yoğuşmayı da önler. Görüntüleme sisteminin donanım bileşenleri şunlardı (Malzeme Tablosu): canlı hücre inkübasyon odası, Plan-Apochromat 63x/1.40 Oil Ph3 M27 objektifli ters mikroskop, Spectra 7 LED ışık motoru ve sCMOS kamera (6.5 μm piksel boyutu). Mikroskobun motorlu bileşenlerinin kontrolü ve görüntü elde edilmesi, bir mikroskopi analiz yazılımı uygulaması kullanılarak yapılır. - Yazılımı görüntü alımı için hazırlayın. MetaMorph'un (mikroskopi analiz yazılımı) yerleşik otomatik odaklama algoritmasını, çok boyutlu edinim sırasında faz kanalını kullanacak şekilde ayarlayın.
- Sahne Alanı sekmesinde, hücre yoğunluğunun eşit olarak dağıtıldığı görüş alanlarını hedefleyerek her örnek için birden fazla sahne alanı konumu ayarlayın. Timelapse sekmesinde, çekilecek görüntülerin istenen süresini ve sıklığını (zaman aralığı) ayarlayın. Dalga Boyları sekmelerinde, alım için istenen kanalları ayarlayın ve örneklerin sinyal yoğunlukları için maruz kalma sürelerini ayarlayın.
NOT: Her konumun görüntüleri 24 saate kadar her 10 dakikada bir çekilir. Bu makalede bahsedilen boyaların/floroforların floresan görüntülemesi için aşağıdaki ışık motoru uyarma ayarları kullanılmıştır: propidyum iyodür (Cy3; 555/15 nm) ve GFP (GFP/FITC; 470/24 nm). Kullanılan tipik floresan uyarma maruz kalma süresi 100 ms'dir. Promidyum iyodür için filtre seti 15 (Beamsplitter FT580, Emisyon LP590) ve GFP için filtre seti 44 (Beamsplitter FT500, Emisyon BP 530/50) kullanılır.
- Sahne Alanı sekmesinde, hücre yoğunluğunun eşit olarak dağıtıldığı görüş alanlarını hedefleyerek her örnek için birden fazla sahne alanı konumu ayarlayın. Timelapse sekmesinde, çekilecek görüntülerin istenen süresini ve sıklığını (zaman aralığı) ayarlayın. Dalga Boyları sekmelerinde, alım için istenen kanalları ayarlayın ve örneklerin sinyal yoğunlukları için maruz kalma sürelerini ayarlayın.
- Agaroz pedi haznede ısındıktan sonra, nemlendirme kapağını sahne üstü inkübatöre ekleyin. Bu, görüntüleme sırasında pedin kurumasını ve kaymasını önlemeye yardımcı olacaktır.
- Nemlendirme kapağı açıkken, fazdan diferansiyel girişim kontrastına (DIC) geçin ve uygun Köhler aydınlatması için mikroskobun kondansatörünü ve diyafram diyaframını ayarlayın.
- Ayarladıktan sonra faza geri dönün. Her aşama konumuna gidin, odağı ayarlayın ve sahne alanı konumunu yeni odak düzlemine sıfırlayın. Görüntülemeye başlamak için ayarlar artık yerinde.
NOT: Pedin kaymadığından emin olmak için edinime başlamadan önce her bir aşama konumunu tekrar ziyaret etmek önemlidir. Hücreler belirli bir aşama konumunda yeniden ziyaret edildiğinde odak dışındaysa, hücrelere yeniden odaklanın ve önceki aşama konumunu geçersiz kılın. Otomatik odaklama algoritması ayarı, arama aralığı olarak 3 μm'± son zaman noktasından odak z konumunu kullanır, bu nedenle ped 3 μm'den fazla kayarsa, algoritma düzgün odaklama yapamaz. - Al düğmesine tıklayarak çok boyutlu alımı başlatın.
- Deneme tamamlandıktan sonra, video olarak görüntülemek veya başka bir analiz için her kanaldan ayrı ayrı görüntüleri bir yığın halinde derleyin. Bunu MetaMorph veya ImageJ kullanarak yapın.
- MetaMorph'ta (tercih edilen) görüntüleri derlemek için, Çok Boyutlu Verileri İncele uygulamasında, ilgilenilen kanalları/dalga boylarını seçin ve belirli bir aşama konumu için tüm zaman noktalarını seçin. Resimleri Yükle'yi tıklayın. Her kanal/dalga boyu için pencereler görünecektir. Her derlemeyi ilgili kanal adıyla bir .tiff dosyası olarak kaydedin.
- ImageJ'de derlemek için, bir aşama konumu ve bir kanal için tüm zaman noktalarının dosyalarını açın. Yığınlanacak Görüntüleri kullanarak derleyin.
- Mikroskop ve görüntüleme odası çevre kontrollerini hazırlayın. Sahne üstü inkübatörü ve büyük hazneli inkübatörü sıcaklıklarını 37 °C'ye ayarlayın ve hazneli nemlendiriciyi açın. Agaroz ped preparatlarından birini sahne üstü inkübatöre yerleştirin ve numunenin dengelenmesine izin vermek için inkübasyon odasını kapatın. Haznenin 25 mm'lik lamel üzerinde yoğuşmayı önlemek için sahne üstü inkübatör nemlendirme kapağı bu noktada açık bırakılır.
5. Fiji/ImageJ kullanarak hızlandırılmış videolar oluşturma
NOT: Fiji (Fiji sadece ImageJ'dir), görüntü işleme ve analiz için buradan indirilebilen ücretsiz olarak kullanılabilen bir yazılımdır: "https://imagej.net/software/fiji/downloads32"32. Aşağıda açıklanan görüntü işleme yöntemleri için Fiji/ImageJ2 1.54f kullanılmıştır.
- BaSiC33 kullanarak faz kanalı görüntü yığınını gölge düzeltin. Fiji'de istenen faz görüntü yığınını açın ve ardından Eklentiler sekmesinden BaSiC'yi seçin. Gölge düzeltmeli yığın, Corrected:ImageName başlıklı ayrı bir pencerede görünecektir.
NOT: BaSiC.jar buradan indirilebilir: "https://github.com/marrlab/BaSiC33"33. BaSiC'yi Fiji'ye doğru şekilde kurmak için geliştiricinin talimatlarını izleyin. - Görüntü > Renk > Kanalları Birleştir'i kullanarak gölge düzeltmeli faz kanalı yığınını diğer kanallarla/dalga boylarıyla birleştirin. Görüntü ile arka planı ve sinyal yoğunluklarını ayarlayın > Her kanal için > Parlaklığı/Kontrastı Ayarlayın. Birleştirilmiş dosyayı .tiff olarak kaydedin.
- Ardından, Doğru 3D Kaymayı kullanarak görüntüleri sabitleyin. Gölge düzeltmeli yığın seçiliyken, Eklentiler > Kayıtlar > Doğru 3D Kayması'na gidin. Açılan iletişim penceresinde, kayıt için kanalı, faz yığınına karşılık gelen kanal numarasına ayarlayın. Düzeltmeden sonra ortaya çıkan yığın, kayıtlı zaman noktaları olarak adlandırılacaktır. İstediğiniz görüş alanına kırpın, ardından düzeltilen dosyayı .tiff olarak kaydedin.
NOT: Derlenmiş görüntü yığınını oluşturmak için MetaMorph kullanılmışsa, fazladan bir işlem adımı vardır: Görüntü > Özellikleri'ne gidin ve Dilimler (z) ve Çerçeveler (t) alanlarındaki sayıları değiştirin. Sapma düzeltmesi artık her kareyi bir z yığınının bir dilimi olarak değil, bir zaman noktası olarak düzgün bir şekilde yorumlayabilir. Gölge düzeltmeli ve sapma düzeltmeli .tiff dosyası, sonraki görüntü analizlerinde kullanılabilir. Floresan sinyal yoğunluklarını ölçmek, morfolojik özellikleri ölçmek, tek tek hücrelerin kaderini izlemek ve daha fazlası için birçok yazılım paketi mevcuttur. Yaygın olarak kullanılan iki program, Fiji için MicrobeJ eklentisi ve Oufti 34,35'tir. - Görüntü > Yığınları ve Etiket'i kullanarak yığına zaman damgaları > metin etiketleri ekleyin.
- Bir ölçek çubuğu eklemek için önce kameranın piksel boyutunu ve mikroskop objektif büyütmesini öğrenin. Piksel:mikron oranını, piksel boyutunun büyütmeye bölünmesiyle hesaplayın. Analiz Et > Ölçeği Ayarla iletişim kutusunda, bilinen uzaklık alanına piksel:mikron oranını girin. Ardından, Analiz > Araçları > Ölçek Çubuğu ile yığına bir ölçek çubuğu ekleyin.
NOT: Bir mikroskobun hassas ölçeği, bir sahne mikrometresi kullanılarak kalibre edilmelidir. Bununla birlikte, kullanılan mikroskop objektif lensi ve kamera, ölçeğin kabaca bir tahminini sağlayabilir. Örneğin, burada kullanılan PCO sCMOS kameranın piksel boyutu 6,5 x 6,5μm2'dir ve görüntüleme için 63x objektif kullanılmıştır, bu nedenle piksel boyutunun büyütmeye bölünmesi piksel başına 6,5/63 = 0,1032 μm'dir. Ölçeği Ayarla iletişim kutusu için bilinen uzaklık alanına 0.1032 girin. - Bitmiş görüntü yığınını QuickTime Player, Microsoft PowerPoint vb.'de oynatılabilecek bir video olarak dışa aktarmak için .avi dosyası olarak kaydedin.
Sonuçlar
Raportör plazmitlerin P. aeruginosa ve S. aureus'a başarılı bir şekilde dahil edilmesi, doğru seçici antibiyotiklerde büyüme ile gösterilir ve koloni PCR ve/veya dizileme ile doğrulanabilir. Modifiye edilmiş suşlar, ilgilenilen genin indüklendiğinin bilindiği koşullara tabi tutularak fenotipik raportörler olarak doğrulanmalıdır ve ortaya çıkan floresan, akış sitometrisi, spektrofotometri veya epifloresan mikroskobu ile ölçülebilir (Şekil 1).
Sonraki deneyler için kullanılacak bir antibiyotik dozunun (dozlarının) seçimini kolaylaştırmak için, ilgilenilen P. aeruginosa veya S. aureus suşları için konsantrasyona bağlı antibiyotik kalıcı testler yapın. Konsantrasyona bağlı tahliller tipik olarak, daha düşük antibiyotik konsantrasyonlarında dik bir başlangıç eğimi ve daha yüksek konsantrasyonlarda bir plato veya daha az dik eğim ile iki fazlı bir eğri ile sonuçlanır. Bununla birlikte, bazı antibiyotik-tür çiftleri için, belirgin bir bifazik eğri ortaya çıkmayabilir. Örneğin, S. aureus delafloxacin eğrisi için eğri açıkça iki fazlıdır (Şekil 3A), ancak P. aeruginosa levofloksasin eğrisi değildir (Şekil 3B)15. Bu senaryoda, MIC'nin en az 10 katı olan bir konsantrasyon seçeriz (örneğin, 5 μg / mL, bu da P. aeruginosa için MIC'nin yaklaşık 15 katıdır)15. Bununla birlikte, 15x levofloksasin MİK sadece ~% 0.001 P. aeruginosa ile sonuçlandığından, hücreleri antibiyotik içermeyen agaroz pedlerinde iyileşirken görüntülerken kalıcıları görmek istiyorsak 1 μg / mL levofloksasin tedavisi kullanıyoruz (Ek Video 6); Aksi takdirde, birden çok kalıcıyı görüntülemek için gereken görüş alanı sayısı engelleyici hale gelir.
Görüntülemenin başlangıcında, ideal numune ve agaroz ped hazırlığı, görüş alanı boyunca düzlemsel görünmeli, büyük döküntüler, kırışıklıklar veya hava kabarcıkları içermemeli ve eşit olarak dağılmış tek hücrelerle görünmelidir. İyi dağılmış tek hücrelerin elde edilmesi, numune seyreltmesinin veya yeniden süspansiyonunun optimizasyonunu gerektirebilir. S. aureus için, hücreler küçük kümeler oluşturma eğilimindedir ve agaroz pedine tohumlanmadan önce iyice girdaplanmaları gerekir (Şekil 4 ve Şekil 5). P. aeruginosa için hücreler, süspansiyon halinde yapışkan bir hücre dışı matris ile kaplanmış agregalar oluşturabilir; Tek hücreleri görüntülemek için bu numuneleri iyice pipetlemek ve agregaları parçalamak gerekir.
Bir görüntüleme deneyinin sona ermesinden sonra, görüntülerin başarılı bir zaman atlamalı görüntüsü odakta, sabit bir şekilde aydınlatılmış ve deney boyunca xy düzleminde minimum sapma ile görünecektir. Ek Video 7 , optimum bir görüntü alımını temsil eder: t, Ek Video 4'ün gölge veya sapma düzeltmesinden önceki faz kanalıdır. Yoğuşma (aşırı nemlendirme veya yetersiz numune ısınmasından kaynaklanan) üst 25 mm'lik lamel üzerinde su damlacıklarının oluşmasına neden olarak ışığı bozar ve odak düzlemini otomatik odaklama algoritmasının maksimum arama aralığının dışına iterse odak kaybı meydana gelebilir (Ek Video 8). Aydınlatmadaki değişiklik genellikle görüntüleme sırasında yetersiz daldırma yağını gösterir. Sahne alanı çok hızlı hareket ederse, objektif üzerindeki yağ geriye doğru sürüklenebilir ve görüntüler elde edildiğinde hala yetişiyor olabilir. Bu, hareket hızını yavaşlatmak için alım kontrollerini ayarlayarak veya bir sonraki konuma hareket ile görüntü alımı arasında bir duraklama ekleyerek azaltılabilir. Büyük örnek kayması, bazıları yerinde kalırken görüş alanı boyunca çizgi çizen birçok hücre gibi görünecektir (Ek Video 9). Bu tipik olarak deneylerde daha sonra ortaya çıkar, çünkü agaroz ped yetersiz nem kontrolü nedeniyle susuz kalmıştır. Bu belgede sunulan agaroz ped hazırlığı, numune stabilitesini kolaylaştırmak için tasarlanmıştır, ancak optimum görüntü elde etmek için numunenin ve çevresindeki ortamın uygun şekilde ısıtılması/nemlendirilmesi gereklidir.
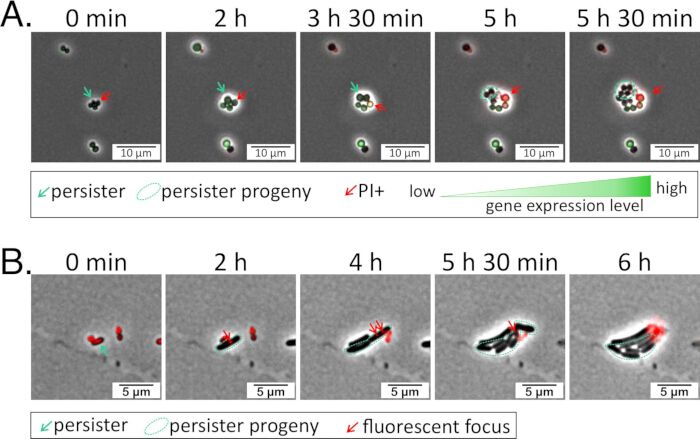
Şekil 1: Floresan raportör suşları, ilgilenilen bir genin ifadesini aydınlatır. (A) S. aureus , Protokol 1'e göre ilgilenilen bir gen için bir GFP transkripsiyonel raportörü ile transdüksiyona tabi tutuldu. Raportör suşu 24 saat boyunca antibiyotikle muamele edildi, PBS ile yıkandı ve daha sonra iyileşme sırasında görüntüleme için CA-MHB artı propidyum iyodür (1.6 μM) ve kloramfenikolden (raportör plazmid bakımı için 10 μg / mL) yapılmış bir agaroz ped üzerine ekildi (Ek Video 1). (B) P. aeruginosa , ilgilenilen bir protein için mScarlet'e bağlı bir translasyonel raportör taşıyan bir plazmit ile dönüştürüldü26. Raportör suşu 5 saat boyunca antibiyotikle muamele edildi, PBS ile yıkandı ve daha sonra iyileşme sırasında görüntüleme için BSM artı Tet'ten (75 μg / mL; muhabir plazmid bakımı için) yapılmış bir agaroz ped üzerine ekildi (Ek Video 2). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
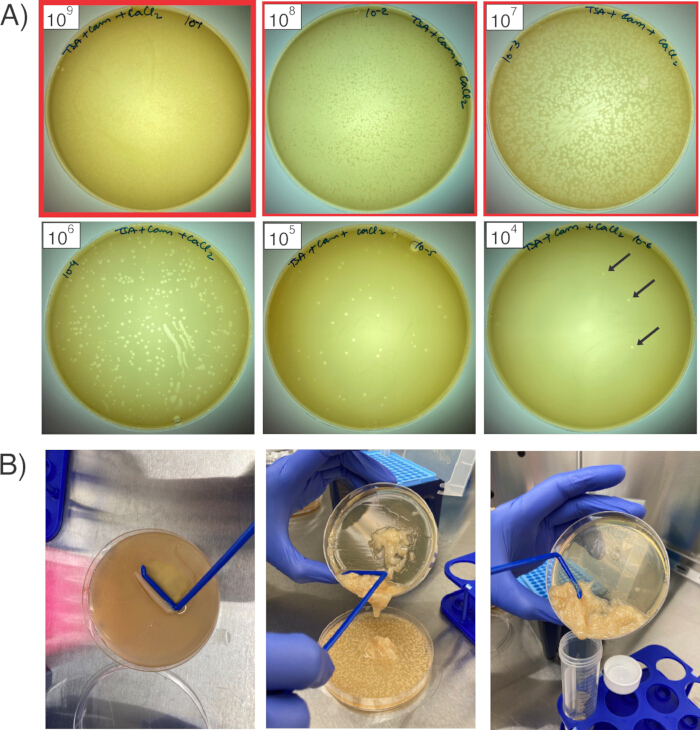
Şekil 2: Bakteriyofajın çoğaltılması ve hasat edilmesi. (A) Altı plaka, S. aureus RN4220'nin çimleri üzerinde altı farklı miktarda seyreltilmiş faj stoğunu göstermektedir. Kırmızı ana hatlar, en açık olan plakadan (koyu kırmızı anahat; 1 x109 PFU/mL) sonraki iki seyreltmeye (1 x108 ve 1 x 107 PFU/mL) kadar hasat edilecek üç plakayı gösterir. Siyah oklar tek tek plaklara işaret ediyor. (B) Plakalardan faj elde etmek için, yumuşak agar tabakasını kazıyın (solda), bulamacı bir sonraki seyreltme plakasına (ortada) aktarın ve her üç plakadan yumuşak agarı bir araya getirdikten sonra, santrifüjleme için konik bir tüpte birleştirin (sağda). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
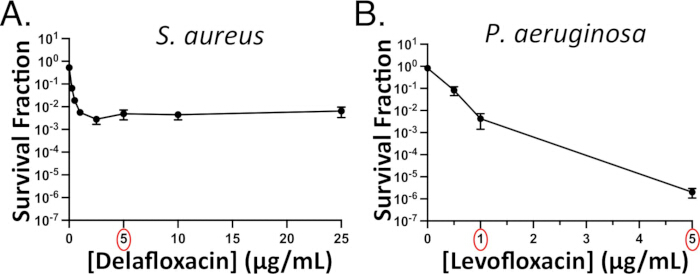
Şekil 3: Temsili konsantrasyona bağlı kalıcı deneyler. Konsantrasyona bağlı florokinolon kalıcılığı durağan fazda değerlendirildi (A) S. aureus (delafloksasine karşı) ve (B) P. aeruginosa (levofloksasine karşı). Daha sonraki deneylerde 5 μg/mL delafloksasin (kırmızı daire) kullanılır, çünkü S. aureus öldürme bu konsantrasyonda plato haline gelmiştir. P. aeruginosa ile sonraki deneyler için en az 1 μg / mL levofloksasin (kırmızı daire) bir dozaj kullanılacaktır. Bakteri öldürmenin P. aeruginosa için plato yapmadığını, ancak kalıcı bir alt popülasyonu gösteren bifazik eğrinin daha az dik bir "ikinci aşaması" olduğunu unutmayın. Panel 3B, Hare ve ark.15'in izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
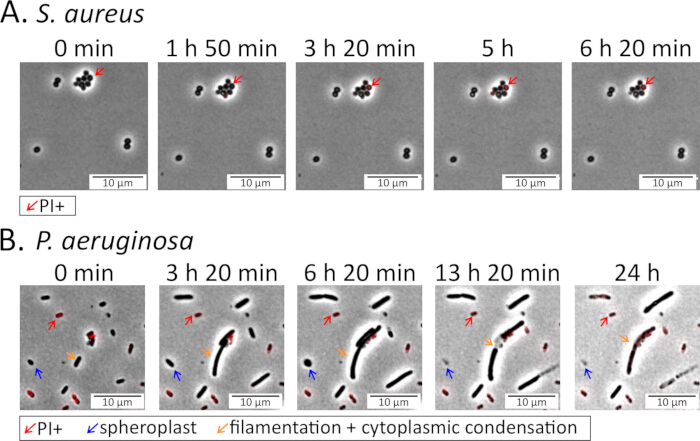
Şekil 4: Antibiyotik tedavisi sırasında bakteri fenotiplerinin görüntülenmesi. Sabit faz (A) S. aureus ve (B) P. aeruginosa hücreleri, florokinolon antibiyotikler içeren agaroz pedlerine ekildi ve tedavi sırasında izlendi: S. aureus için 5 μg / mL delafloksasin (Ek Video 3) ve P. aeruginosa için 5 μg / mL levofloksasin (Ek Video 4) 15. Propidium iyodür (PI; P. aeruginosa için 16 μM, S. aureus için 1.6 μM) ölü veya ölmekte olan hücreleri işaretlemek için pedlere eklendi. S. aureus hücreleri, FQ varlığında büyük ölçüde sağlam ve canlı kalırken, çoğu P. aeruginosa hücresi, parçalanmadan ve ölmeden önce yuvarlak sferoplast oluşturmak da dahil olmak üzere ciddi morfolojik değişikliklere uğrar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
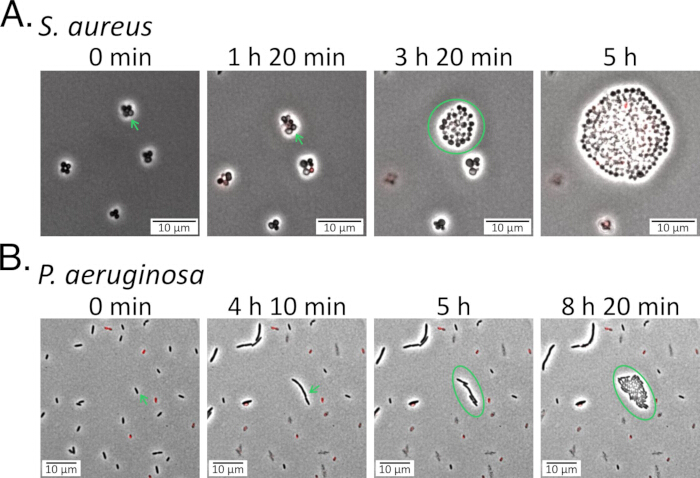
Şekil 5: Kurtarma sırasında kalıcıların izlenmesi. (A) S. aureus ve (B) P. aeruginosa popülasyonları, florokinolonlarla ( S. aureus için 5 μg/mL delafloksasin ve P. aeruginosa için 1 μg/mL levofloksasin) muamele edildikten sonra taze ortam içeren agaroz pedlerine ekildi ve tedavi sonrası iyileşmeleri sırasında izlendi (Ek Video 5 ve Ek Video 6). Görülen perisisterlar her panelde ilk iki karede yeşil oklarla belirtilmiş ve antibiyotik tedavisi sırasında sağlam ve canlı kalmıştır. İlk gecikme döneminden sonra, ısrarcılar bölünmeye başladı ve yeni döllere yol açtı (yeşil dairelerle gösterilir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
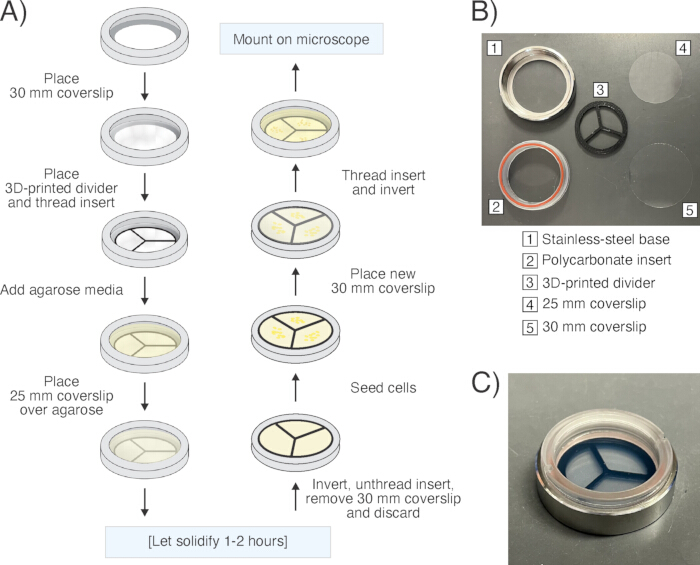
Şekil 6: Mikroskop numunesi hazırlama. (A) Değiştirilebilir bir lamel kabı ("hazne") kullanılarak numune hazırlama iş akışının şeması. (B) Demonte edilen haznenin ve tek tek bileşenlerinin resmi. (C) Tamamen monte edilmiş odanın resmi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video 1: S. aureus persister. Şekil 1A'daki görüntüleri içeren video dosyası. Kısaca, ilgilenilen bir gen için GFP transkripsiyonel raportörü taşıyan S. aureus , 24 saat boyunca antibiyotik ile tedavi edildi, PBS ile yıkandı, daha sonra iyileşme sırasında görüntüleme için CA-MHB artı propidyum iyodür (1.6 μM) ve kloramfenikol (10 μg/mL) ile yapılan bir agaroz ped üzerine tohumlandı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 2: P. aeruginosa kalıcı. Şekil 1B'deki görüntüleri içeren video dosyası. Kısaca, ilgilenilen bir protein için mScarlet'e bağlı bir translasyonel raportör taşıyan P. aeruginosa, 5 saat boyunca antibiyotikle muamele edildi, PBS ile yıkandı, daha sonra iyileşme sırasında görüntüleme için BSM artı Tet (75 μg/mL) ile yapılan bir agaroz pedine ekildi26. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 3: Antibiyotik tedavisi sırasında S. aureus. Kimyasal olarak tanımlanmış zengin ortamlarda yetiştirilen durağan fazlı bir S. aureus kültürü, kültürün hücresiz şartlandırılmış ortamından propidyum iyodür (1.6 μM) ve delafloksasin (5 μg/mL) ile yapılan agaroz pedlerine tohumlandı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 4: Antibiyotik tedavisi sırasında P. aeruginosa. BSM'de yetiştirilen durağan fazlı bir P. aeruginosa kültürü, paralel olarak BSM'de yetiştirilen bir P. aeruginosa kültüründen hücresiz şartlandırılmış ortamdan yapılan agaroz pedlerine tohumlandı; agaroz pedi ayrıca propidyum iyodür (16 μM) ve levofloksasin (5 μg/mL) içeriyordu. Bu video Hare ve ark.15'in izniyle uyarlanmıştır. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 5: S. aureus antibiyotik sonrası iyileşme sırasında. S. aureus , kimyasal olarak tanımlanmış zengin besiyerlerinde durağan faza büyütüldü. Sabit faz kültürleri, 24 saat boyunca test tüplerinde 5 μg / mL delafloksasin ile muamele edildi, PBS ile yıkandı ve daha sonra görüntüleme için propidyum iyodür (1.6 μM) içeren antibiyotik içermeyen CA-MHB agaroz pedlerine tohumlandı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 6: P. aeruginosa antibiyotik sonrası iyileşme sırasında. BSM'de yetiştirilen durağan fazlı bir P. aeruginosa kültürü, 7 saat boyunca test tüplerinde 1 μg / mL levofloksasin ile muamele edildi, PBS ile yıkandı, daha sonra görüntüleme için propidyum iyodür (16 μM) içeren antibiyotik içermeyen BSM agaroz pedlerine tohumlandı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 7: Optimum görüntü elde etme örneği. Bu video, optimum zaman atlamalı çekimin bir örneği olarak görüntü işlemeden önceki Ek Video 4'ün faz kanalıdır. Deney boyunca minimum kaymaya, sabit aydınlatmaya ve odak bakımına dikkat edin. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 8: Yoğuşma nedeniyle optimal olmayan görüntü elde etme örneği. Bu video, büyük olasılıkla numunenin yanlış ısıtılması ve/veya görüntüleme ortamının aşırı nemlendirilmesi nedeniyle hazne üzerindeki yoğuşma nedeniyle, görüntü alımının zayıf odaktan etkilendiği bir deneyin bir bölümünü göstermektedir. Görüntülenen örnek, bir BSM agaroz pedi üzerinde antibiyotik sonrası geri kazanım sırasında levofloksasin ile muamele edilen P. aeruginosa idi. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video 9: Sapma nedeniyle optimal olmayan görüntü elde etme örneği. Bu video, muhtemelen dehidrasyon ve agaroz pedin lamel üzerinden büzülmesi/kaldırılması nedeniyle, görüntü elde etmenin numune kaymasından etkilendiği bir deneyin bir bölümünü göstermektedir. Görüntülenen örnek, levofloksasin ve propidyum iyodür içeren bir agaroz ped üzerinde P. aeruginosa idi. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Dosya 1: 25mm-3D-divider-for-35mmBioptechs.stl Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Hızlandırılmış bir mikroskopi deneyinin başarısının, agaroz pedlerinin kalitesine ve görüntüleme boyunca stabilitelerine bağlı olduğunu bulduk. Paslanmaz çelik hazne ile çevrili agaroz pedlerinin hazırlanması nispeten kolaydır, bu da düzinelerce saat boyunca istikrarlı bir şekilde görüntülenebilen tutarlı bir şekilde düzlemsel numunelerle sonuçlanır. Bu, tek bir deneyde on binlerce hücrenin görüntülenmesini sağlar ve bir popülasyonda kalıcı hücreler gibi nadir fenotipik varyantları tespit etme olasılığını artırır.
Bu agaroz ped hazırlama yöntemi, daha önce yayınlanmış yöntemlere kolayca uygulanabilir bir alternatif sunar. Protokolümüz, mikroakışkan cihaz imalatının teknik hassasiyetini veya agaroz "sandviç" yöntemlerinin hünerli manipülasyonlarını gerektirmez, bu da koşudankoşuya tutarlı hazırlıklar elde etmeyi kolaylaştırır 14,16,36. Ayrıca, sistem uygun maliyetlidir. Paslanmaz çelik hazne sterilize edilebilir ve tekrar kullanılabilir (tek kullanımlık plastik haznelerin aksine) ve kurulum özel ekipman gerektirmez16,37. Oda, piyasada bulunan sahne ekleri kullanılarak farklı mikroskopi sistemlerine kolayca sığdırılır. Ek olarak, bakteriler agaroz kaplı cam arayüzde hareketsiz hale getirildiğinden, morfolojik değişikliklere izin verirken P. aeruginosa gibi oldukça hareketli bakterileri izlemede başarılı olduk (Şekil 4, Ek Video 4). "Ana makine" gibi diğer tek hücreli görüntüleme teknikleri, hücreleri filamentasyon dışındaki morfolojik değişikliklerin gözlemlenmesini engelleyen kanallarla sınırlar36.
Bu protokolde başarılı olmak için akılda tutulması gereken bazı kritik adımlar ve parametreler vardır. Ped hazırlığı için, agarozu iyice ısıtmak ve eritmek önemlidir, çünkü kalan agaroz kristalleri ışık kırınımına neden olacak ve görüntü kalitesini etkileyecektir. Benzer şekilde, agarozu hava kabarcıkları sokmadan hazneye pipetlemeye özen gösterilmelidir. Agaroz pedlerinin kalınlığının tutarlı kalmasını sağlamak ve numune kaymasını sınırlamak için, görüntüleme başlamadan önce pedin nemlendirilmiş, sıcaklık kontrollü muhafaza içinde tipik olarak 15 dakika boyunca dengelenmesine izin vermek önemlidir. Düşük görüntü kalitesine neden olabilecek bir diğer faktör de nem kontrolüdür: düşük nem, agaroz pedin kurumasına ve büzülmesine neden olurken, yüksek nem (veya haznede yanlış numune ısınması), sıcak havanın numune üzerinde yoğunlaşmasına ve görüntülemenin bozulmasına neden olabilir. Yoğuşma nedeniyle optimal olmayan hızlandırılmış görüntülemenin bir örneği Ek Video 8'de bulunabilir.
Mevcut kurulumun bir sınırlaması, kültür ortamının değiştirilememesidir, bu da antibiyotik tedavisi öncesinde, sırasında ve sonrasında tek tek bakterilerin sürekli izlenmesini önler. Agaroz pedinin, kültür ortamı değişimine izin veren akış hücreleri veya mikroakışkan cihazlarla birleştirilmesinin, popülasyonların beslenme veya çevresel değişim sırasında izlenmesini sağlayabileceğini tahmin ediyoruz. Mevcut tasarımın geliştirilebilecek bir diğer parametresi de numune havalandırmasıdır. O-ring conta, değiştirilebilir lamel çanağının vidalı tasarımı, pedleri16 kapatmak için mum veya gres bazlı dolgu macunu kullanılmasını gerektiren kurulumlara kıyasla daha iyi numune havalandırması sağlar. Bununla birlikte, kapalı odadaki havalandırma hala sınırlı olabilir ve zorunlu aerobların büyümesini desteklemeyebilir, ancak bu test edilmeye devam etmektedir.
Bu makalede sunduğumuz hızlandırılmış görüntüleme örneği hazırlama protokolü, binlerce bakterinin antibiyotik tedavisine yanıt verirken veya antibiyotik tedavisinden iyileşirken izlenmesini sağlar. Bu yöntem aynı zamanda oldukça genelleştirilebilir ve kalıcı biyolojinin ötesinde çeşitli potansiyel uygulamalara sahiptir. Örneğin, agaroz pedi ve bölücü kurulumu, uzamsal olarak ayrılmış hücre örneklerinin tohumlanmasına izin verir, ancak agaroz ped boyunca difüzyon yoluyla hücre-hücre iletişimine izin verir. Şu anda, bu kurulumun, salgılanan ürünlerin değişiminin çok türlü topluluklarda hücre büyümesini nasıl etkilediğini test etme potansiyelini araştırıyoruz. Bu protokolün, yeni araştırmacı için hızlandırılmış mikroskopiye düşük bir giriş engeli ve deneyimli mikrobiyologun keşfetmesi için sınırsız varyasyonlar sağlayacağını tahmin ediyoruz.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
UConn Hücre Analizi ve Modelleme Mikroskobu Tesisi Sağlık Merkezi'nden Bayan Susan Staurovsky'ye mikroskopi deneylerindeki yardımları için teşekkür ederiz. Dr. Mona Wu Orr ve Staphylococcal Genetics and Metabolism'in Temelleri Çalıştayı'na sırasıyla P. aeruginosa ve S. aureus'ta klonlama konusundaki protokolleri ve tavsiyeleri için teşekkür ederiz. Bu çalışma, Ulusal Sağlık Enstitüleri (NIH; DP2GM146456-01 ve 1R01AI167886-01A1'den W.W.K.M.'ye, 1F30DE032598-01A1'den P.J.H.'ye ve 1F31DK136259-01A1'den T.J.L.'ye). Fon sağlayıcıların deneylerimizin tasarımında veya bu el yazmasının hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BaSiC | GitHub | https://github.com/marrlab/BaSiC | |
| Certified Molecular Biology Agarose | Biorad | 1613101 | |
| Fiji-ImageJ | NIH | https://imagej.net/software/fiji/downloads | |
| Interchangeable Coverglass Dish | Bioptechs | 190310-35 | 35 mm ICD for preparing agarose pads; comes with 30 mm (#1.5) coverslips |
| Lumencor Spectra 7 LED light engine | Lumencor | https://lumencor.com/products/spectra-light-engine | Spectra 7 LED light engine |
| MetaMorph | Molecular Devices | Premier version 7.10.5 | |
| pco.edge 4.2 bi sCMOS camera | Excelitas | https://www.excelitas.com/product/pcoedge-42-bi-usb-scmos-camera | sCMOS camera |
| PeCon live cell incubation chamber | peCon | https://www.pecon.biz/ | |
| Thomas Scientific Round cover glass, #1.5 thickness, 25 mm, 100 pack | Fisher Scientific | NC1272770 | 25 mm (#1.5) coverslips |
| Zeiss Axiovert 200M microscope | Zeiss | https://www.zeiss.com/microscopy/en/products/light-microscopes/widefield-microscopes/axiovert-for-materials.html | Inverted microscope with Plan-Apochromat 63x/1.40 Oil Ph3 M27 objective, Lumencor Spectra 7 LED light engine, and pco.edge 4.2 bi sCMOS camera (6.5 mm pixel size) |
Referanslar
- Brauner, A., Fridman, O., Gefen, O., Balaban, N. Q. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nat Rev Microbiol. 14, 320-330 (2016).
- Balaban, N. Q., et al. Definitions and guidelines for research on antibiotic persistence. Nat Rev Microbiol. 17 (7), 441-448 (2019).
- Conlon, B. P. Staphylococcus aureus chronic and relapsing infections: evidence of a role for persister cells. Bioessays. 36 (10), 991-996 (2014).
- Mulcahy, L. R., Burns, J. L., Lory, S., Lewis, K. Emergence of Pseudomonas aeruginosa strains producing high levels of persister cells in patients with cystic fibrosis. J Bacteriol. 192 (23), 6191-6199 (2010).
- Verstraete, L., Van den Bergh, B., Verstraeten, N., Michiels, J. Ecology and evolution of antibiotic persistence. Trends Microbiol. 30 (5), 466-479 (2021).
- Sett, A., Dubey, V., Bhowmik, S., Pathania, R. Decoding bacterial persistence: Mechanisms and strategies for effective eradication. ACS Infect Dis. 10 (8), 2525-2539 (2024).
- Mempin, R., et al. Release of extracellular ATP by bacteria during growth. BMC Microbiol. 13, 301 (2013).
- Lewis, K. Persister cells, dormancy and infectious disease. Nat Rev Microbiol. 5 (1), 48-56 (2006).
- Fauvart, M., De Groote, V. N., Michiels, J. Role of persister cells in chronic infections: clinical relevance and perspectives on anti-persister therapies. J Med Microbiol. 60 (pt 6), 699-709 (2011).
- Van den Bergh, B., Fauvart, M., Michiels, J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters. FEMS Microbiol Rev. 41, 219-251 (2017).
- Levin, B. R., Rozen, D. E. Non-inherited antibiotic resistance. Nat Rev Microbiol. 4 (7), 556-562 (2006).
- Davis, K. M., Isberg, R. R. Defining heterogeneity within bacterial populations via single cell approaches. Bioessays. 38 (8), 782-790 (2016).
- Hare, P. J., LaGree, T. J., Byrd, B. A., DeMarco, A. M., Mok, W. W. K. Single-cell technologies to study phenotypic heterogeneity and bacterial persisters. Microorganisms. 9 (11), 2277 (2021).
- de Jong, I. G., Beilharz, K., Kuipers, O. P., Veening, J. W. Live cell imaging of Bacillus subtilis and Streptococcus pneumoniae using automated time-lapse microscopy. J Vis Exp. 53, e3145 (2011).
- Hare, P. J., Gonzalez, J. R., Quelle, R. M., Wu, Y. I., Mok, W. W. K. Metabolic and transcriptional activities underlie stationary-phase Pseudomonas aeruginosa sensitivity to levofloxacin. Microbiol Spectr. 12 (1), e0356723 (2024).
- Young, J. W., et al. Measuring single-cell gene expression dynamics in bacteria using fluorescence time-lapse microscopy. Nat Protoc. 7 (1), 80-88 (2011).
- Pang, Y. Y., et al. agr-Dependent interactions of Staphylococcus aureus USA300 with human polymorphonuclear neutrophils. J Innate Immun. 2 (6), 546-559 (2010).
- Bose, J. L., Fey, P. D., Bayles, K. W. Genetic tools to enhance the study of gene function and regulation in Staphylococcus aureus. Appl Environ Microbiol. 79 (7), 2218 (2013).
- Schenk, S., Laddaga, R. A. Improved method for electroporation of Staphylococcus aureus. FEMS Microbiol Lett. 73, 133-138 (1992).
- Grosser, M. R., Richardson, A. R. Method for Preparation and Electroporation of S. aureus and S. epidermidis. The Genetic Manipulation of Staphylococci. Methods Molecular Biology. , (2016).
- Krausz, K. L., Bose, J. L. Bacteriophage Transduction in Staphylococcus aureus: Broth-Based Method. The Genetic Manipulation of Staphylococci. Methods Molecular Biology. , (2016).
- Olson, M. E. Bacteriophage Transduction in Staphylococcus aureus. The Genetic Manipulation of Staphylococci. Methods Molecular Biology. , (2016).
- Fey, P. D., et al. A genetic resource for rapid and comprehensive phenotype screening of nonessential Staphylococcus aureus genes. mBio. 4 (1), e00537-e00612 (2013).
- Coe, K. A., et al. Multi-strain Tn-Seq reveals common daptomycin resistance determinants in Staphylococcus aureus. PLoS Pathog. 15 (11), e1007862 (2019).
- Figurski, D. H., Helinski, D. R. Replication of an origin-containing derivative of plasmid RK2 dependent on a plasmid function provided in trans. Proc Natl Acad Sci U S A. 76 (4), 1648 (1979).
- Shee, C., et al. Engineered proteins detect spontaneous DNA breakage in human and bacterial cells. eLife. 2, e01222 (2013).
- Kowalska-Krochmal, B., Dudek-Wicher, R. The minimum inhibitory concentration of antibiotics: methods, interpretation, clinical relevance. Pathogens. 10 (2), 165 (2021).
- Robinson, J. L., Jaslove, J. M., Murawski, A. M., Fazen, C. H., Brynildsen, M. P. An integrated network analysis reveals that nitric oxide reductase prevents metabolic cycling of nitric oxide by Pseudomonas aeruginosa. Metab Eng. 41, 67-81 (2017).
- Wolff, J. A., MacGregor, C. H., Eisenberg, R. C., Phibbs, P. V. Isolation and characterization of catabolite repression control mutants of Pseudomonas aeruginosa PAO. J Bacteriol. 173 (15), 4700-4706 (1991).
- Batchelder, J. I., Taylor, A. J., Mok, W. W. K. Metabolites augment oxidative stress to sensitize antibiotic-tolerant Staphylococcus aureus to fluoroquinolones. mBio. , e0271424 (2024).
- Power, A. D., Mok, W. W. K. Agar and agarose used for Staphylococcus aureus biofilm cultivation impact fluoroquinolone tolerance. J Appl Microbiol. 135 (8), lxae191 (2024).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Peng, T., et al. A BaSiC tool for background and shading correction of optical microscopy images. Nat Commun. 8, 14836 (2017).
- Ducret, A., Quardokus, E., Brun, Y. V. MicrobeJ, a tool for high throughput bacterial cell detection and quantitative analysis. Nat Microbiol. 1 (7), 16077 (2016).
- Paintdakhi, A., et al. Oufti: an integrated software package for high-accuracy, high-throughput quantitative microscopy analysis. Mol Microbiol. 99 (4), 767-777 (2016).
- Wang, P., et al. Robust growth of Escherichia coli. Curr Biol. 20 (12), 1099-1103 (2010).
- Moffitt, J. R., Lee, J. B., Cluzel, P. The single-cell chemostat: an agarose-based, microfluidic device for high-throughput, single-cell studies of bacteria and bacterial communities. Lab Chip. 12 (8), 1487-1494 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır