Method Article
הדמיה וניתוח לכימות תירס (Zea mays) פנוטיפים של מתח אביוטי
In This Article
Summary
מוצגת שיטה להדמיה בעלות נמוכה של צמחים למדידת פנוטיפים, יחד עם שיטות עבודה מומלצות ללכידת תמונות וצינור ניתוח תמונה לכימות תכונות הצמח. שיטות אלה יושמו למדידת פנוטיפים של תירס (Zea mays) תחת חום, בצורת ותנאי עקה אביוטיים משולבים.
Abstract
מדידת פנוטיפים כמותיים של צמחים, או תכונות, חיונית להבנת תגובות הצמח לגורמים סביבתיים, כולל מתחים ביוטיים וא-ביוטיים. עם זאת, שיטות מסורתיות למדידת צמחים עלולות להיות גוזלות זמן, לא מדויקות והרסניות, במיוחד כאשר מעריכים תכונות כמו ביומסה וגובה על בסיס אינדיבידואלי. ניתוח מבוסס תמונה מציע הזדמנות להפחית את העבודה, לשפר את הדיוק והדיוק ולאפשר מדידות חוזרות ונשנות של אותו מפעל על פני מספר נקודות זמן. בעוד שמתקני פנוטיפ בעלי תפוקה גבוהה מספקים פתרון, הם לרוב יקרים מאוד ומוגבלים בזמינותם ברחבי העולם. מתוארת שיטה לצילום תמונות צמחים באמצעות מחשבי לוח יחיד ומצלמות דיגיטליות בעלות נמוכה בתוך מערך סטודיו לצילום, מלווה בצינור ניתוח תמונות המבוסס על חבילת הקוד הפתוח החינמית PlantCV. שיטה זו מציעה פרוטוקול מהיר ומדויק ללכידה, תיוג והעברה של תמונות, יחד עם שיטות עבודה מומלצות להבטחת רכישת תמונות באיכות גבוהה. באמצעות ניתוח תמונה, יותר מ-10 פנוטיפים כומתו עבור כל התמונות בניסוי בו זמנית, כולל תכונות כמו גודל הצמח, גובהו וצבעו. שיטות אלה שימשו לאפיון התגובה של זן התירס B73 לחום, בצורת ותנאי עקה אביוטיים משולבים של חום ובצורת.
Introduction
מדידת תכונות צמחים, או פנוטיפים, היא קריטית למענה על שאלות בסיסיות ויישומיות במדעי הצמח. לדוגמה, חוקר המבקש להבין את ההשפעה של מוטציה גנטית על גודל הצמח יצטרך למדוד כמותית את גובה הצמח ואת שטח העלים1. חוקר שמפעיל עקה ביוטית (כמו למשל זיהום חיידקי, ויראלי או פטרייתי) או עקה אביוטית (כמו למשל בצורת, חום, קור או דלדול חומרי מזון) יצטרך לחקור את השפעת העקה על צבע הצמח, או "ירוקות", כדי למדוד כלורוזיס 2,3.
בעוד שמדידת תכונות אלו חיונית לביולוגיה בסיסית של הצמח כמו גם לגידול צמחים יישומי, מדידות של תכונות אלו ביד יכולות להיות גוזלות זמן, לא מדויקות ולא מדויקות 4,5,6,7. לדוגמא, מדידת גובה של צמחים כוללת שימוש ידני בסרגל לכל צמח, לעתים קרובות בתנאי סביבה חמים או לחים, והיא נתונה לטעויות מנקודת מבטו של האדם המודד, כמו גם איזו נקודה נחשבת ל"טופ" של הצמח. יתר על כן, מדידות כגון ביומסה ותכולת פיגמנט הן הרסניות, ולא ניתן למדוד את אותו צמח לשינוי לאורך זמן או להשתמש בו לדגימות מרובות מכיוון שיש להשמיד אותו בתהליך ביצוע מדידות אלה 4,5,6,7. האופי הגוזל זמן ונוטה לטעויות של מדידות אלה מעכב את ההתקדמות בהערכת הצמחים לתגובות הלחץ הפנוטיפיות והפיזיולוגיות שלהם.
לכידת תמונות של צמחים ומדידת תכונות כמותיות מהתמונה מספקת פתרונות לבעיות אלו 4,5,6,7. ניתוח תמונה משפר את הדיוק והדיוק, תוך הפחתת הזמן שיש לחוקר לבצע את המדידות, וניתן לדמות את אותו צמח מספר פעמים או להשתמש בו לדגימות אחרות בשל כימות התכונה הלא הרסנית 4,5,6,7. יתר על כן, ניתן לאחסן ולנתח מחדש תמונות זמן רב לאחר השלמת הניסוי והשלכת צמחים מ-4,5,6,7. ניתן להשלים ניתוח תמונות בנפרד עם כלי עריכת תמונות בעלי תפוקה נמוכה, כגון ImageJ (פיג'י)8, או בתפוקה גבוהה יותר באמצעות ראייה ממוחשבת ולמידת מכונה עם פלטפורמות כגון PlantCV9. PlantCV היא פלטפורמת ניתוח תמונות חינמית בקוד פתוח המאפשרת לחוקרים להסוות (או להפריד) תחילה צמח או אובייקט אחר מהרקע של תמונה, ולבצע מדידות של גודל, מורפולוגיה, צבע ועוד מאותו צמח או אובייקט9. באמצעות זרימת עבודה מודולרית, חוקר בונה תחילה זרימת עבודה גמישה (או צינור) של מודולים שונים עם תמונה לדוגמה, ולאחר מכן מכניס את התמונות הנותרות לזרימת העבודה בתפוקה גבוהה מבלי לקיים אינטראקציה עם כל תמונה בודדת9. תכונות כמותיות מוצגות ומנותחות עבור הבדלים מובהקים סטטיסטית בין הקבוצות. ניתן לפתח צינורות למידה עמוקה לניתוח תמונה יעיל ואוטומטי לאחר שמספיק תמונות נלכדו ותויגו עם מדידות תכונות מתאימות או מטא נתונים10.
פנוטיפ "תפוקה גבוהה" יכול להגביר את המהירות ולהפחית את העבודה האנושית במהלך איסוף הנתונים, ו/או במהלך ניתוח נתונים 4,5,6,7. מתקני פנוטיפ בעלי תפוקה גבוהה אפשרו אוטומציה של איסוף תמונות בסביבות מבוקרות, שבהן צמחים נעים על מסוע או באמצעות רובוטים לתחנת הדמיה, ומתויגים אוטומטית בשם (כלומר, תווית עם מטא נתונים) המשויך למפעל 6,11,12,13,14 . בעוד שהמסועים הללו או המתקנים המופעלים על ידי רובוטים מאפשרים לכידה ותיוג של כמויות גדולות של תמונות ללא התערבות אנושית, יש מעטים בעולם, והם יכולים לעלות מיליוני דולרים, מה שהופך אותם לבלתי נגישים לחוקרים רבים. כדי ליישם את המושגים הללו של הדמיה אוטומטית בעלות נמוכה יותר, Raspberry Pi (המכונה כאן מחשבי לוח יחיד, SBC) הם מחשבים בעלות נמוכה (פחות מ-35 דולר כל אחד) ששימשו לצילום, מתן שם, אחסון והעברת תמונות של צמחים הגדלים בסביבות מבוקרות. הגדרות אלה לוכדות תמונות במרווחי זמן אוטומטיים ומתוזמנים באמצעות מערך של עד 72 Raspberry Pi 12,15,16. אמנם חסכוניים יותר ממערכות מסועים שיכולות לעלות מיליוני דולרים, תאי גידול SBC שתוארו קודם לכן ישימים ביותר לתצוגה מלמעלה למטה של גידול צמחים קטנים ועדיין דורשים SBC15 רבים. בסביבות שדה, גנטריים, כטב"מים (מערכות אוויריות לא מאוישות) כגון רחפנים ולוויינים כולם מצלמים תמונות לניתוח תכונות הצמח17,18. הן מערכות שדה והן מתקני סביבה מבוקרת בעלי תפוקה גבוהה יכולים להיות מונעים בעלות הראשונית, התחזוקה והידע המקצועי הדרוש לבנייה ותחזוקה של המערכות, כמו גם ניתוח תמונות17,18. טלפונים סלולריים ומצלמות דיגיטליות המשמשות לבד לצילום צמחים מציבים אתגרים גוזלי זמן של העברת תמונות ושמות עם מטא נתונים, החיוניים לניתוח תמונה במורד הזרם.
השיטות המתוארות כאן מציגות פתרון בעלות נמוכה להדמיית צמחים לאתגרים שאינם מטופלים על ידי מערכות אחרות. מערך צילום, שבו צמחים מועברים בנפרד לסטודיו, מאפשר מדידה יעילה של צמחים בכל הגדלים בעציצים. באמצעות SBC המחובר למצלמה דיגיטלית, שיטה זו מספקת תחילה לכידה, תיוג והעברה סטנדרטיים של תמונות. שימוש במקלדת או בסורק QR/ברקוד כדי לתת שמות לתמונות בזמן שהן נלכדות עוקף את הפעילות הגוזלת זמן ונוטה לשגיאות של שינוי שמות תמונות עם מטא נתונים לאחר שנלכדו ואחסנו. הרכב התמונה והגדרות המצלמה המומלצות חשובים לאפשר ניתוח תמונה במורד הזרם, וההנחיות מפורטות כאן. לבסוף, מסופק צינור ניתוח תמונות ב-PlantCV כדי לחלץ תכונות כמותיות מהתמונות שצולמו, כגון שטח העלה, גובה הצמח, רוחב וצבע.
יחסית למערכות מסועים, שיטה זו היא בעלות נמוכה ודורשת SBC יחיד. מערך הפנוטיפ המתואר כאן נבנה כדי להסיר את האילוצים והעלויות של מסוע או מערכות רובוטיות - ניתן למדוד כל גודל של מפעל מכיוון שניתן להפריד את ההתקנה ממרחב הגידול, יש צורך רק ב-SBC יחיד, והוא עובד עם סוגי מצלמות רבים לגמישות מקסימלית ובמחיר סביר. גישות דומות לזו המוצגת כאן כוללות את PhenoBox או PhenoRig 12,19. בהשוואה למדידות ידניות, שיטה זו חוסכת זמן, מפחיתה שגיאות ואינה הורסת את הצמחים 4,12,15,19.
Protocol
הפרטים על הריאגנטים והציוד המשמש בפרוטוקול זה מפורטים בטבלת החומרים.
1. הכנת סטודיו לצילום
- תלו בד שחור בדרגת צילום מקיר או מהתקרה להדמיה מהצד. עטפו בד לפחות 0.5 מ' על הרצפה כך שהצמח מונח על גבי הבד (איור 1).
הערה: הבד צריך להיות לפחות 100 ס"מ גבוה ורחב יותר מהצמח שיש לצלם. - הניחו כרטיס צבע על הרקע, נתמך על אובייקט כמו קופסה כך שהוא יהיה גלוי במסגרת (איור 1). עבור צמחים שגובהם או רוחבם עולה על 30 ס"מ, השתמשו בכרטיס צבעוני ברוחב של 20 ס"מ לפחות. עבור צמחים שגובהם או רוחבם קטן מ-30 ס"מ, השתמשו בכרטיס צבעוני שרוחבו בין 4-8 ס"מ.
- חבר כרטיס SD למחשב נייד או שולחני. הורד את Raspberry Pi Imager ממדור התוכנה באתר (https://www.raspberrypi.com/software/), והורד את קובץ raspberrypi-image-capture.img.gz המצורף (https://github.com/danforthcenter/photo-maize-paper) למחשב הנייד או למחשב השולחני.
- הפעל את ה-Imager על ידי פתיחת קובץ ההדמיה (.exe) שהורדת. לחץ על כפתור בחר מערכת הפעלה ובחר בלחצן השתמש בהתאמה אישית בתחתית. בחר את קובץ image-capture.img.gz.
- לאחר מכן, לחץ על כפתור בחר אחסון ובחר את כרטיס ה-SD המחובר למחשב. לחץ על כפתור הכתיבה .
הערה: ודא שנבחר כרטיס ה-SD הנכון, מכיוון שתהליך זה ימחק את כל הנתונים המאוחסנים בכרטיס.
- לאחר מכן, לחץ על כפתור בחר אחסון ובחר את כרטיס ה-SD המחובר למחשב. לחץ על כפתור הכתיבה .
- חבר את הגירסה העדכנית ביותר של SBC למקלדת באמצעות כבל USB, לצג חיצוני באמצעות כבל HDMI ולמפצל חשמל באמצעות כבל חשמל עם מתג. חבר את הצג לרצועת החשמל באמצעות כבל החשמל המצורף לצג. הכנס את כרטיס ה-SD לתוך ה-SBC. ראה איור 1 לסכימה מסומנת של ההגדרה.
- הפעל את מפצל החשמל על ידי לחיצה על המתג ברצועה, הפעל את הצג באמצעות הכפתור בצג, ולאחר מכן הפעל את ה-SBC על ידי היפוך המתג בכבל החשמל למצב "מופעל".
- חבר את ה-SBC לאינטרנט המקומי באמצעות WIFI או כבל אתרנט.
- אם יש להעביר תמונות ישירות לשרת או לאחסון בענן:
- ערוך את הקובץ "CAPTURE-PHOTO.py" ב- SBC כך שיכיל את נתיב הקובץ להשלמת ההעברה.
- ערוך את קובץ ה-win-credentials עם הנתיב והסיסמה עבור השרת או אחסון הענן באמצעות הפקודה הבאה בטרמינל: sudo nano /etc/win-credentials.
הערה: פנה למנהל מערכת האינטרנט כדי לוודא שלתיקייה יש הרשאה להעברת קבצים.
- חבר סורק ברקוד אלחוטי ל- SBC באמצעות הוראות היצרן המצורפות לסורק הברקוד, באמצעות USB או Bluetooth.
- כבה את SBC על ידי לחיצה על כפתור Raspberry Pi בפינה השמאלית העליונה של המסך, לחיצה על התנתקות ולאחר מכן לחיצה על כיבוי כדי לכבות את SBC בבטחה. לאחר הכיבוי, העבר את מתג ההפעלה SBC "הפעל" את כבל החשמל למצב "כבוי" ואת פס החשמל למצב "כבוי".
2. צמיחת צמחים וטיפול במתח
הערה: כל צמח מתאים לשיטת פנוטיפ זו; שיטות גידול צמחים אלה ישימות לתוצאות המייצגות המוצגות כאן.
- השג זרעים של B73 או זן תירס אחר ממרכז מלאי.
- הכן אמצעי קרקע ותנאי גידול:
- מלאו עציצים בגודל 3.5 אינץ' (0.7 ליטר) בתערובת נפח של 1:1 בנפח של Turface MVP וברגר BM7-35 עם 3 פאונד/מטר מעוקב של דשן בשחרור איטי 14-14-14 (N-P-K). מניחים סירים במגש עם חורים ומים היטב עם מי אוסמוזה הפוכה (RO).
- הגדר תא גידול לתנאים הסביבתיים הבאים: 30 מעלות צלזיוס ביום/20 מעלות צלזיוס בלילה, אורך יום של 16 שעות, 60% לחות ו-500 מילימול-מ"ר לשנייה של אור בגובה העציץ במהלך היום. הגדר תא גידול נפרד עם אותם תנאים, למעט 38 מעלות צלזיוס ביום/28 מעלות צלזיוס בלילה למתח חום.
- שתלו 20 זרעי תירס, כל אחד בעציץ בגודל 3.5 אינץ', על ידי הנחת עומק ~2 ס"מ באדמה וכיסויה באדמה שנעקרה. השקה היטב במי RO והנח בתא גידול הבקרה. יש להשקות מדי יום עם דשן נוזלי (מעורבב לפי הוראות היצרן; ראה טבלת חומרים).
הערה: שתילת צמחים נוספים הדרושים לניסוי תסביר נביטה לקויה וחוסר אחידות לפני תחילת יישום הלחץ. קצב הנביטה ישתנה בהתאם למגוון. - לאחר 21 ימי צמיחה, השתלו 16 מהצמחים האחידים ביותר (n = 4 צמחים לטיפול) לעציצים של 3.79 ליטר מלאים באותה תערובת אדמת עציצים, רטובים מראש במי RO. החזר צמחים לתא הגידול של הבקרה.
- ביום 25 (4 ימים לאחר ההשתלה) העבירו מחצית מהצמחים (n = 8) לתא מתח החום בזמן שהאורות נדלקים בתא. הפסק להשקות את הצמחים בלחץ בצורת בשני התאים (n = 4 לכל תא).
הערה: ייתכן שיהיה צורך להשקות צמחים בעקת בצורת כדי שהצמחים ישרדו עד סוף הניסוי; כאן, צמחי בצורת הושקו ביום ה-31 וביום ה-37 במי דשן. - ביום ה-38 (13 ימים לאחר תחילת הלחץ), הוציאו צמחים מתאי הגידול לצורך הדמיה.
3. הדמיית צמחים
- הפעל את SBC (ראה איור 2):
- הפעל את מפצל החשמל באמצעות המתג במפצל החשמל.
- הפעל את הצג באמצעות הכפתור שעל הצג.
הערה: אם SBC מופעל לפני הפעלת הצג, הוא לא יופעל כהלכה. - סובב את המתג בכבל החשמל SBC למצב "מופעל".
הערה: פעולה זו תפעיל את SBC, והוא יאתחל על הצג; אין מתג "הפעלה" ב- SBC עצמו, רק בכבל החשמל.
- הנח את המצלמה על חצובה או שולחן יציב.
הערה: כל הצמח וכרטיס הצבע צריכים להיות מוצגים על מסך המצלמה. המצלמה צריכה להיות בניצב לקרקע ובעלת תצוגה ישירה (ללא זווית) של מרכז הצמח. המצלמה חייבת להיות תואמת לחבילת gphoto2, וניתן למצוא רשימה כאן: http://www.gphoto.org/proj/libgphoto2/support.php. - ספק חשמל למצלמה באמצעות כבל חשמל עם המצלמה או הסוללות. הפעל את המצלמה באמצעות הכפתור במצלמה.
- חבר את המצלמה ליציאת ה-USB ב-SBC באמצעות כבל העברת הנתונים המצורף למצלמה.
- סדר צמח במערך צילום:
- הניחו פיסת סרט בצבע כהה על הבד המתאים לצילום שבו יונח העציץ כדי להבטיח שהמיקום יהיה זהה לכל צמח. ודא שכרטיס הצבע תואם את פיסת הסרט.
הערה: הנח את כרטיס הצבע לפחות 10 ס"מ מקצה הצמח. במהלך בקרת איכות בזרימת העבודה של PlantCV (להלן), יש לחתוך את התמונה כך שתכלול רק את הצמח והעציץ אך לא את כרטיס הצבע כדי להבטיח ששבבי הצבע לא ייכללו במיצוי התכונה האולטימטיבית. ראה איור 2 לדוגמאות של תמונות באיכות גבוהה ובאיכות נמוכה. - מניחים את הסיר על פיסת הסרט. עבור צמחים הגדלים במישור, כגון תירס (Zea mays) ודורה (Sorghum bicolor), פנו לזווית הרחבה ביותר של הצמח לכיוון המצלמה. עבור צמחים שאינם גדלים במישור, לכוד זוויות של 0 ו-90 מעלות של הצמח, וממוצע המדידות הכמותיות המתקבלות לאחר השלמת ניתוח התמונה.
- הניחו פיסת סרט בצבע כהה על הבד המתאים לצילום שבו יונח העציץ כדי להבטיח שהמיקום יהיה זהה לכל צמח. ודא שכרטיס הצבע תואם את פיסת הסרט.
- במסך שולחן העבודה SBC המוצג על הצג, פתח את הטרמינל על ידי לחיצה על כפתור הטרמינל בשורת התפריטים השמאלית העליונה.
- אם אתה שומר ישירות בשרת או באחסון בענן, הרכיב את האחסון באמצעות הפקודה הבאה על ידי עריכה לנתיב האחסון הדרוש בענן (נתיב אחסון בענן בדוגמה למטה) וסיסמה, הקלדת שורת הקוד בחלון הטרמינל הפתוח ולחיצה על Enter במקלדת. אם לא ישתנה מהגדרות היצרן, מזהה המשתמש (UID) יהיה "pi".
הערה:
sudo mount -t cifs -o credentials=/etc/win-credentials,uid=pi //cloud-storage-path /mnt/cloud-storage - הקלד את הקוד הבא בטרמינל ולחץ על Enter במקלדת. יופיע חלון חדש.
./RUN-PHOTOSTUDIO-SHELL.sh
הערה: קובץ RUN-PHOTOSTUDIO-SHELL.sh קורא לקובץ CAPTURE-PHOTO.py, שנטען מראש על ה-pi אם הוא נטען בשיטה לעיל. לחלופין, סקריפטים אלה סופקו ב-GitHub להכנסה לכרטיס Raspberry Pi SD קיים. - ייפתח חלון ממשק משתמש גרפי. הקלידו את שם התמונה, או סרקו את הברקוד או קוד ה-QR של המפעל באמצעות סורק ברקוד.
- בחר אפשרות לשמירת התמונה באופן מקומי או בשרת/אחסון ענן שנטען.
- לחץ כאן כדי לצלם תמונה! כפתור.
- אם נבחר אחסון מקומי, פתחו את התיקייה PHOTOS בשולחן העבודה כדי לבחון את התמונה. אם נבחר שרת או אחסון בענן, פתח את התמונה במיקום זה.
- במידת הצורך, כוונן את ההגדרות במצלמה על-ידי ניתוקה מה- SBC, כוונון באמצעות הוראות היצרן וחיבורה בחזרה ל- SBC.
הערה: ייתכן שיהיה צורך להתאים הגדרות כגון חשיפה, בהירות, ניגודיות וכו', בהתאם לתאורה בחדר ולאובייקט המצולם. טעות נפוצה היא חשיפת יתר של התמונות. כדי לבדוק את החשיפה של תמונת בדיקה, המשך עם תמונת הבדיקה באמצעות זרימת העבודה של ניתוח תמונות PlantCV, הכוללת בדיקת בקרת איכות לחשיפה. התאימו את הגדרות המצלמה לפי הצורך כדי להפחית או להגדיל את החשיפה עד לפיזור הולם של ההיסטוגרמות - לאחר צילום כל התמונות, העבר את התמונות מה-SBC למחשב מקומי או לאחסון בענן בשיטה המועדפת, כגון אחסון USB, דפדפן אינטרנט או העברת SSH.
4. חילוץ תכונות מתמונות
- הורד את הקבצים הבאים למחשב או לשרת מקומי: "photo-studio-SV-notebook.ipynb", "workflow.py" ו- "photo-studio-SV-config.json". כל הקבצים זמינים ב-GitHub (https://github.com/danforthcenter/photo-maize-paper).
- התקן את PlantCV במחשב או בשרת המקומי באמצעות השלבים המתוארים (https://plantcv.readthedocs.io/en/latest/installation/).
- פתח את הקובץ photo-studio-SV-notebook.ipynb באמצעות עורך הקוד המועדף, כגון JupyterLab או Visual Studio Code.
- הפעל כל בלוק קוד, ערוך לפי הצורך בהתחשב בפרמטרים המתוארים בבלוק הקוד כדי לקבל מסכה נקייה של הצמח בתמונה.
- כאשר אתה מרוצה מניתוח התמונה לדוגמה, פתח את workflow.py הקובץ בעורך הקוד המועדף. ערוך קובץ זה עם כל הפרמטרים שהשתנו ב- "photo-studio-SV-notebook.ipynb" ושמור אותו.
- פתח את photo-studio-SV-config.json הקובץ וערוך את נתיבי הקובץ כדי להפנות לתיקיה של תמונות קלט, תיקיית פלט רצויה וכו', כפי שמצוין בקובץ.
- פתח מסוף והפעל את הקוד הבא כדי להפעיל את PlantCV. לשם כך, הקלד את הקוד conda activate plantcv בטרמינל ולחץ על Enter במקלדת.
- שנה את שורת הקוד הבאה לנתיב הקובץ של הקובץ "photo-studio-SV-config.json" (זהו השינוי היחיד שיש לבצע בקוד שלהלן).
- בטרמינל, הקלד את הקוד הערוך ולחץ על Enter במקלדת. זה יפעיל את זרימת העבודה על כל התמונות שצולמו בניסוי.
הערה:
plantcv-run-workflow --config /Users/USERNAME/photo-studio-SV-config.json
- בטרמינל, הקלד את הקוד הערוך ולחץ על Enter במקלדת. זה יפעיל את זרימת העבודה על כל התמונות שצולמו בניסוי.
- בדוק את תמונות הפלט כדי לקבוע אם הקוד מתאים לכל התמונות.
הערה: קווי המתאר הכחולים והוורודים של הצמח צריכים להיות סביב קצוות הצמח, ולא אמורים להיות אובייקטים אחרים בתמונה. במידת הצורך, חזור ל-"photo-studio-SV-analysis.ipynb" ובדוק תמונות בעייתיות וערוך את הקוד, במיוחד את שלבי המיסוך והפחתת הרעש, כדי להשיג את התוצאות הרצויות. ראה איור 3 לדוגמאות של פילוח תמונות גבוה, מקובל ובאיכות נמוכה. - קובץ הפלט יהיה בצורת קובץ .json. חזור לטרמינל (ודא ש-conda activate plantcv כבר הופעל), הקלד את הקוד הבא ולחץ על Enter במקלדת כדי להמיר את הקובץ ל-.csv לניתוח סטטיסטי במורד הזרם, ולשנות את נתיב הקובץ לזה של הקובץ "results-photo-studio.json".
plantcv-utils json2csv -j /Users/USERNAME/results-photo-studio.json -c /Users/USERNAME/results-photo-studio.csv
הערה: כדי להמיר את המדידות מפיקסלים ליחידת מידה סטנדרטית, כגון ס"מ, השתמש בהמרה המסופקת מהפונקציה find_color_card בזרימת העבודה של PlantCV. - לבצע ניתוח סטטיסטי של התכונות הכמותיות של הפלט כדי לקבוע הבדלים בפנוטיפים של צמחים עקב מיני צמחים, זנים, טיפולים ונקודות זמן שונות.
הערה: חבילת ה-pcvr ב-R Studio נוסחה כדי לנתח את התפוקות מ-PlantCV עבור מובהקות סטטיסטית והתוויית תוצאות20. ראה סיכום וייצוג חזותי של תכונות שנאספו באיור 4.
תוצאות
כדי לפתח שיטה זו, צמחי תירס B73 הוערכו עבור פנוטיפים כמותיים תחת טמפרטורות בקרה, טמפרטורות חום, השקיה טובה ותנאי בצורת, כמו גם השילובים שלהם, בסך הכל ארבעה טיפולים. B73 הוא זן תירס מולד ידוע עם שפע של נתונים גנטיים21.
ניתוח תמונות ב-PlantCV תיקן בהצלחה את התמונות, תייג את התוצאות הכמותיות עם המטא-נתונים של הצמח, ופילח (במילים אחרות, הפריד) את הצמח מהרקע, כפי שמודגם באיור 3. ניתוח לא מוצלח יספק תמונות פלט שאינן מציגות את קווי המתאר הכחולים או הצורה הוורודה סביב החלק החיצוני של הצמח, אלא כוללות רעש נוסף או חלקים חסרים של הצמח (איור 3, דוגמה באיכות נמוכה). היה צורך בסף דו-ערוצי כדי לכלול כמה שיותר מהצמח במסכה (ראה אסטרטגיות חלופיות של ערוץ יחיד ב-"photo-studio-SV-notebook.ipynb"). אולם לחלק מהצמחים, במיוחד אלה עם גבעולים בצבע סגול, לא היה סגמנטציה מושלמת, אך היו מספיקים לניתוח במורד הזרם (איור 3).
ניתוח PlantCV סיפק 16 תכונות כמותיות, חד-ערכיות, מסוכמות באיור 4. תכונה בעלת ערך יחיד מספקת ערך אחד לכל צמח - לדוגמה, שטח העלה, הגובה, הרוחב והממוצע המעגלי של הגוון. שטח העלים נלקח בחשבון באמצעות הפונקציה "analyze.shape" (איור 4) ונלקח בחשבון הצמח כולו. גובה ורוחב, לעומת זאת, נלקחו בחשבון באמצעות "פונקציית analyze.bound_horizontal", עם כריכה משורטטת בקו אדמת הצמח. הסיבה לכך היא שצמחים שצונחים על דופן העציץ יהיו בעלי גובה גדול יותר בהתחשב בצמח כאובייקט שלם, ובמקום זאת יש למדוד רק מבסיס הצמח שבו הוא פוגש את האדמה. בנוסף לתכונות החד-ערכיות, PlantCV מוציא תכונות מרובות ערכים, שהן היסטוגרמות, במיוחד של ערכי הצבע, המייצגים כל פיקסל של הצמח. ממוצע הגוון המעגלי הוא תכונה בעלת ערך יחיד שהיא ערך הגוון הממוצע עבור הצמח כולו.
כדי לקבוע אילו תכונות הן המעניינות ביותר, חושבה השונות המוסברת על ידי הטיפול עבור כל תכונה, כמו גם המתאם בין התכונות השונות באמצעות פונקציית "frem" בחבילת pcvr R Studio20 (איור 5A). שטח העלה, הגובה, הרוחב והממוצע המעגלי של הגוון נבחרו לניתוח במורד הזרם מכיוון שהם הסבירו יותר מ-50% מהשונות עקב הטיפול, והם מדדים רלוונטיים של צמיחת הצמח (שטח, גובה ורוחב) ובריאות (גוון). תמונות מייצגות של הצמח עם שטח העלים הגדול והקטן ביותר מדגימות את השונות בפנוטיפים שנאספו בניסוי הזה (איור 5B,C, בהתאמה). הצמח עם שטח העלים הגדול ביותר היה גם בעל הגוון הממוצע הגבוה ביותר, והיה צמח B73, מושקה היטב ונמצא בסטרס חום (איור 5B). לאזור העלים הקטן ביותר היה הגוון הממוצע הקטן ביותר (איור 5C), והוא היה צמח B73, בסטרס בצורת ובסטרס חום.
לטיפול במים הייתה השפעה משמעותית בקביעת שטח העלים (F(1,13) = 226.5, p = 1.32 x 10-9), גובה (F(1,13) = 21.1, p = 0.0005), רוחב (F(1,13) = 75.5, p = 8.92 x 10-7) וממוצע מעגלי גוון (F(1,13) = 27.8, p = 0.0002), שנקבע באמצעות מודל רגרסיה ליניארית לאפקט הטיפול ו-ANOVA דו-כיווני בסטודיו R (תוצאות מלאות בטבלה 1). לטיפול בטמפרטורה הייתה השפעה משמעותית על הגובה (F(1,13) = 5.94, p = 0.03), אך לא על שטח העלה, הרוחב או הממוצע המעגלי של הגוון (p > 0.05, טבלה 1). האינטראקציה בין הטמפרטורה למצב המים לא הייתה גורם משמעותי באף אחת מהתכונות שנמדדו (עמ' > 0.05, טבלה 1).
לאחר מכן, הושוו טיפולים בודדים לביקורת וזה לזה באמצעות רגרסיה ליניארית ומבחן פוסט-הוק (ממוצע שולי משוער) עם תיקון סידק להשוואות מרובות (איור 6). שטח העלה, גובה הצמח, רוחב הצמח והממוצע המעגלי של הגוון הצטמצמו באופן משמעותי בצמחים בלחץ בצורת בהשוואה להשקיה טובה בשני תנאי הטמפרטורה (עמ ' < 0.05, איור 6). עקת חום בזמן השקיה טובה רק הפחיתה את גובה הצמח (עמ ' < 0.05, איור 6), אך לא הפחיתה באופן משמעותי את שטח העלה, רוחב הצמח או ממוצע מעגלי הגוון. ניתן לחקור את ההבדל הזה בגוון על ידי הערכת גוון תכונת הצבע הרב-ערכית, המשורטט כהיסטוגרמה באיור 7, ולא רק כממוצע. הירידה בגוון הממוצע עקב בצורת נבעה ממעבר מפיקסלים ירוקים לצהובים, שידועים בשם כלורוזיס (איור 7). בעוד שהחום לא הראה הבדל משמעותי בגוון הממוצע, הוא הראה ירידה ועלייה עקב הצהבה (כלורוזיס) והתכהות של הצבע הירוק (איור 7).
לאחר ההדמיה, הצמחים נחתכו בצומת שורש-יורה ונרשם משקל הרקמה מעל הקרקע. השורשים נשטפו בעדינות ויובשו במגבת, ולאחר מכן נשקלו, כדי לחשב את הביומסה הכוללת של הצמח (המכונה גם משקל) לצורך השוואה לשיטת הפנוטיפ מבוססת התמונה המתוארת. שטח העלים שנמדד באמצעות ניתוח תמונה נמצא בקורלציה חזקה לביומסה של הצמח (R2 = 0.84, איור 8).

איור 1: תמונה של מערך סטודיו הצילום עם רכיבים מתויגים עבור איסוף תמונות צמחים. (A) בד בדרגת צילום, (B) כרטיס צבעוני, (C) קו סרט להצבת עציצים באופן אחיד, (D) מצלמה דיגיטלית, (E) מחשב לוח יחיד, (F) צג המציג את תהליך לכידת התמונה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: סקירה כללית של זרימת העבודה של ההדמיה. מסופקת תמונה מייצגת "באיכות גבוהה" ו"באיכות נמוכה". אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
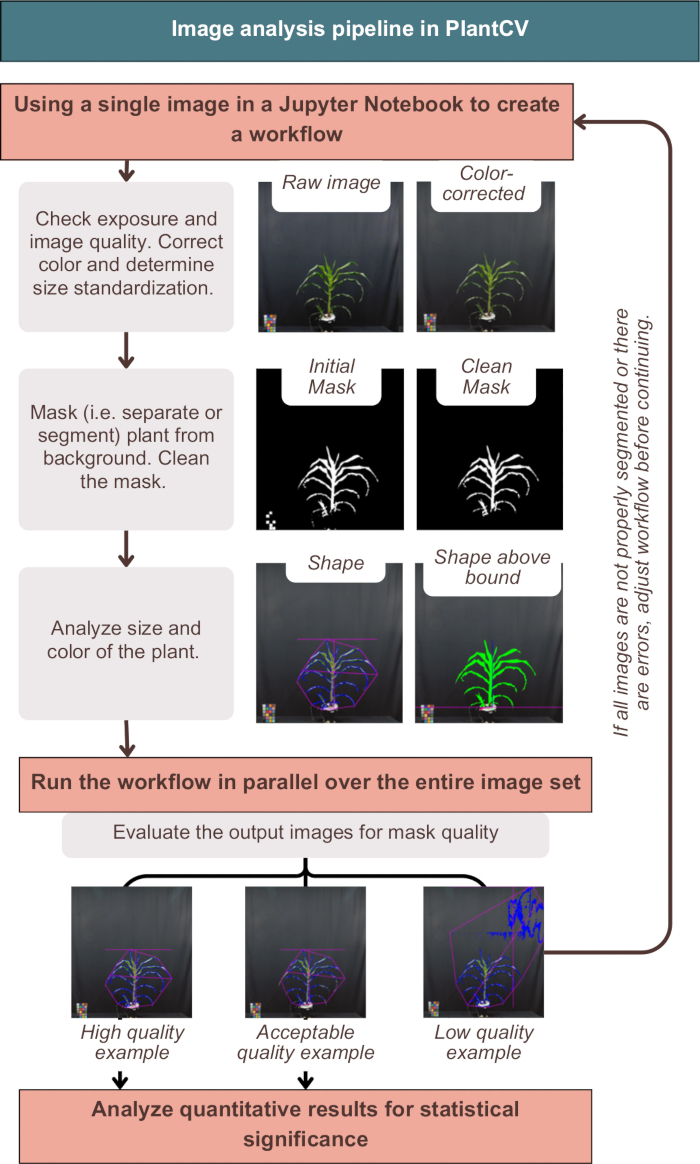
איור 3: סקירה כללית של זרימת העבודה של ניתוח תמונות ב-PlantCV. מוצגות תמונות מייצגות של פילוח באיכות "גבוהה", "מקובלת" ו"נמוכה"; תכונות PlantCV מיוצגות באמצעות מתאר ורוד של צורת הצמח השלם, ומתאר כחול של אזור הצמח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
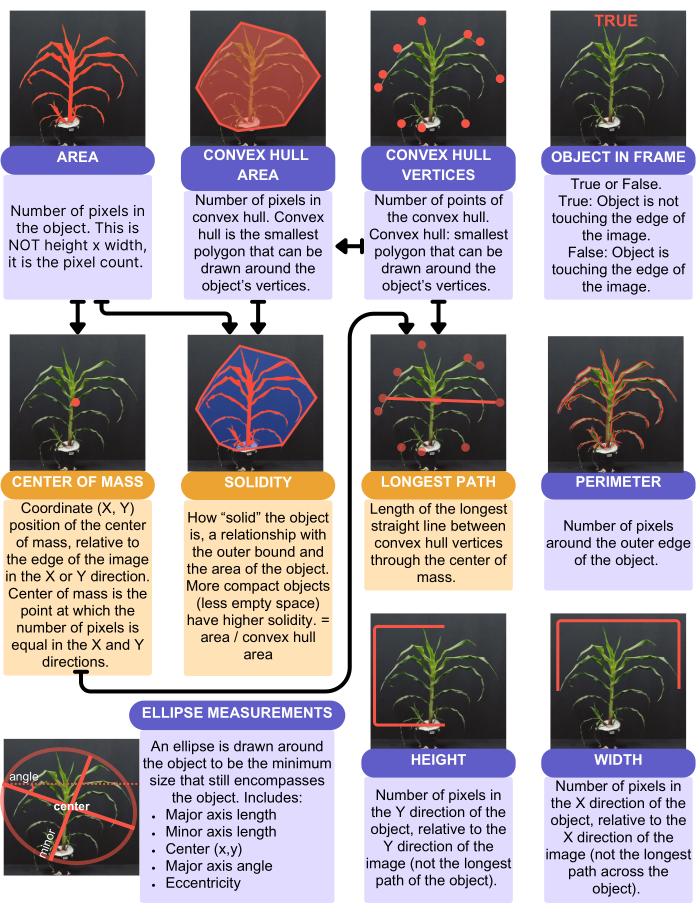
איור 4: סיכום וייצוג חזותי של תכונות הצורה שנלכדו מהניתוח. פונקציית צורה ב- PlantCV. קופסאות סגולות מייצגות תכונות שאינן משתמשות בתכונה אחרת בחישובן. קופסאות כתומות מייצגות תכונות המשתמשות בתכונות אחרות בחישובן; חיצים מציינים אילו תכונות משמשות בחישובים אלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
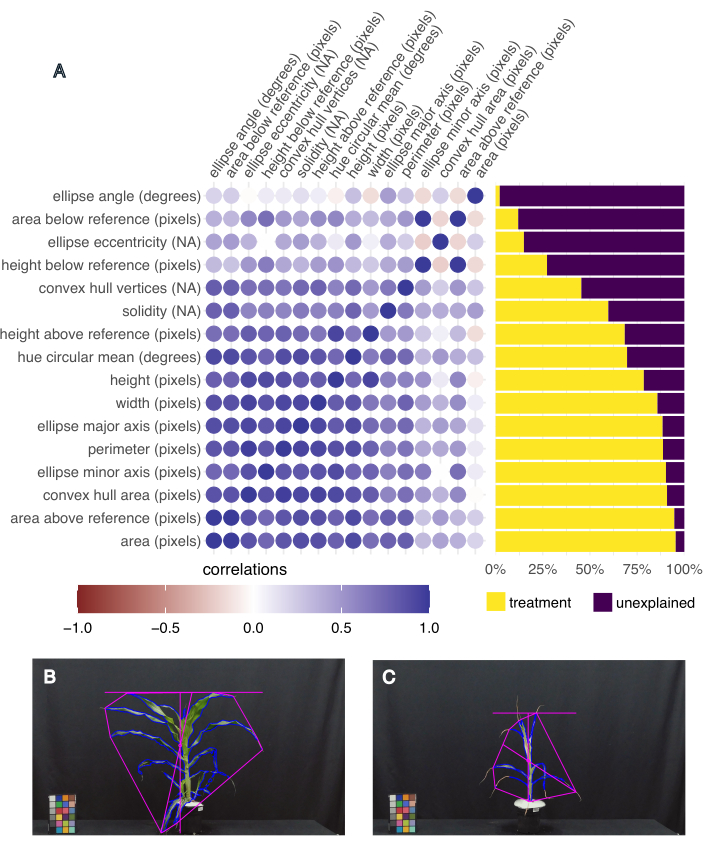
איור 5: פנוטיפ מבוסס תמונה לוכד שונות פנוטיפית ותכונות מתואמות. (A) שונות של תכונות המוסברות על ידי טיפול (מימין), ומתאם של תכונות זו לזו (משמאל). כל תכונה מסומנת, ואחריה יחידת המדידה שלה; "NA" פירושו שזו מדידה ללא יחידות. (B) תמונה של הצמח שהיה לו שטח העלים הגבוה ביותר והממוצע המעגלי (מעלות) בגוון הגבוה ביותר. (C) תמונה של הצמח שהיה לו שטח העלים הקטן ביותר וממוצע מעגלי בגוון הנמוך ביותר (מעלות). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
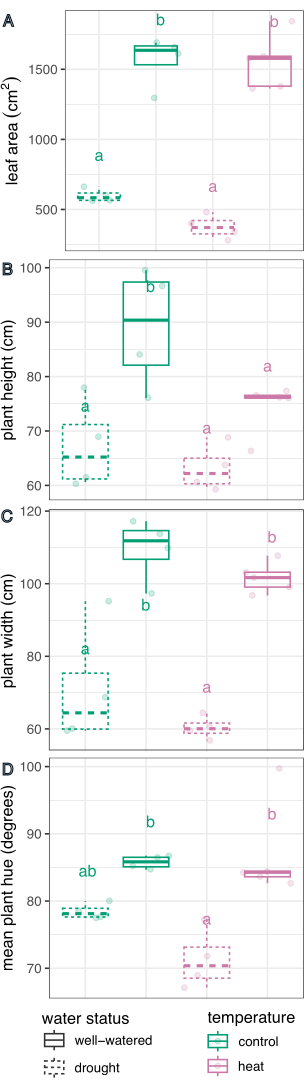
איור 6: השוואת Boxplot של השפעות הטיפול על פנוטיפים של צמחים. שטח העלה (A), הגובה (B), הרוחב (C) והממוצע המעגלי של הגוון (D) מושווים עבור השפעת הבצורת, החום והלחצים המשולבים. n = 4. אותיות מייצגות הבדלים מובהקים סטטיסטית בין טיפולים (p < 0.05); הטיפולים הושוו באמצעות רגרסיה ליניארית ומבחן פוסט-הוק (ממוצע שולי משוער) עם תיקון סידק להשוואות מרובות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
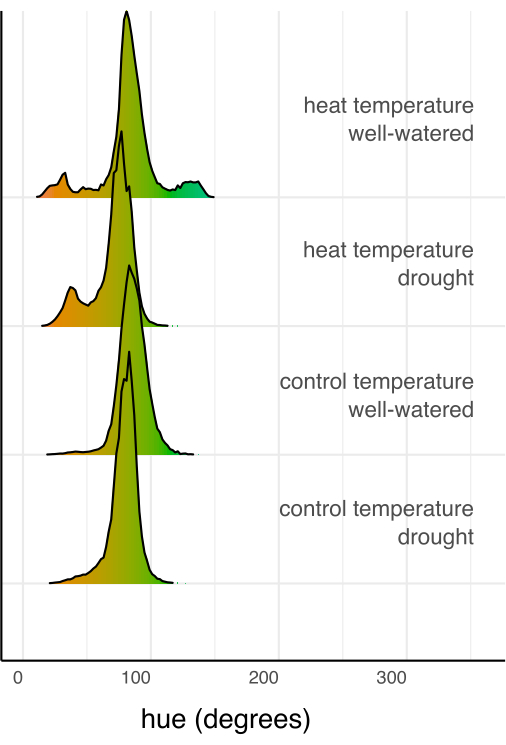
איור 7: היסטוגרמות של צבע (גוון) מסוכמות של כל הפיקסלים של כל שילוב טיפולים, מנורמלות על ידי המספר הכולל של פיקסלים בשילוב הטיפול. היסטוגרמות נצבעות לפי ערך הצבע של דרגת הגוון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
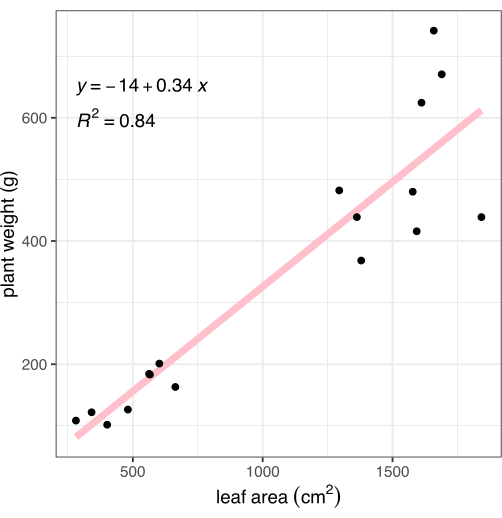
איור 8: מתאם של שטח העלים שנמדד מתמונות לביומסה של צמח שלם. כל נקודה שחורה מייצגת צמח אחד. הקו הוורוד מייצג את המתאם הליניארי בין שטח העלה (X) לביומסה (Y). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| תכונה | גורם | דרגות חופש | ערך F | ערך p |
| שטח העלה (ס"מ^2) | טמפרטורה | 1 | 0.5372 | 0.4766 |
| שטח העלה (ס"מ^2) | מים | 1 | 226.5318 | 1.32ה-09 |
| שטח העלה (ס"מ^2) | טמפרטורה: מים | 1 | 2.1526 | 0.1661 |
| שטח העלה (ס"מ^2) | שאריות | 13 | ||
| גובה (ס"מ) | טמפרטורה | 1 | 5.9426 | 0.0298935 |
| גובה (ס"מ) | מים | 1 | 21.107 | 0.0005029 |
| גובה (ס"מ) | טמפרטורה: מים | 1 | 2.1752 | 0.1640545 |
| גובה (ס"מ) | שאריות | 13 | ||
| רוחב (ס"מ) | טמפרטורה | 1 | 2.2495 | 0.1575 |
| רוחב (ס"מ) | מים | 1 | 75.5474 | 8.92ה-07 |
| רוחב (ס"מ) | טמפרטורה: מים | 1 | 0.0839 | 0.7766 |
| רוחב (ס"מ) | שאריות | 13 | ||
| גוון ממוצע מעגלי (מעלות) | טמפרטורה | 1 | 0.9154 | 0.3561432 |
| גוון ממוצע מעגלי (מעלות) | מים | 1 | 27.7988 | 0.0001509 |
| גוון ממוצע מעגלי (מעלות) | טמפרטורה: מים | 1 | 3.4792 | 0.0848724 |
| גוון ממוצע מעגלי (מעלות) | שאריות | 13 |
טבלה 1: תוצאות מודל הרגרסיה הליניארית וניתוחי ANOVA דו-כיווניים הבוחנים את ההשפעות של טיפול במים, טיפול בטמפרטורה והאינטראקציה ביניהם על תכונות הצמח.
Discussion
פנוטיפ מבוסס תמונה מספק מדידות מדויקות, מהירות וכמותיות של פנוטיפים של צמחים 4,5,6,7. שיטה זו מהירה יותר, מדויקת יותר, מדויקת יותר באופן משמעותי ומספקת מספר רב יותר של מדידות מאשר שימוש ידני בסרגל לרישום גובה הצמח, או מדדים איכותיים של תכונות צבע הצמח שעשויות להיות קשורות לבריאות 4,5,6,7. שטח העלים נראה כאן, ובמחקר קודם10, כמתאם חזק לביומסה של הצמח (איור 8), מה שמצביע על כך שמדד זה יכול להחליף באופן אמין את התהליך הגוזל זמן, הרסני ונוטה לטעויות של שקילה ידנית של ביומסה של צמח שלם. בעוד שמצלמה לבדה יכולה לשמש לצילום התמונות, התוספת של SBC בעלות נמוכה הגדילה את התפוקה באמצעות אוטומציה של איסוף תמונות ותיוג תמונות עם מטא נתונים נחוצים15. שיטה זו מתאימה לאחד עד ~ 300 צמחים המצולמים פעם ביום (או בתדירות נמוכה יותר). עבור מספר גדול יותר של צמחים בניסוי, מערכת הדמיה מבוססת מסוע, עילית או מבוססת רובוט מתאימה יותר מכיוון שהזמן להזיז את הצמחים בנפרד להדמיה עשוי להיות ארוך יותר מיום עבודה11,13. עבור נקודות זמן תכופות יותר (לדוגמה, תמונה כל שעה ולא פעם ביום או בתדירות נמוכה יותר), הגדרות מצלמה בתוך תא גידול מתאימות יותר מכיוון שהן מצלמות תמונות באופן אוטומטי, אך מוגבלות על ידי גודל הצמחים, וזקוקות ל-SBC15 נוסף.
בעוד ש-PlantCV מוצגת כאפשרות ניתוח התמונה כאן, קיימות תוכנות אחרות. ImageJ (פיג'י) היא חבילת תוכנה חינמית לניתוח תמונות שיכולה לשמש גם לתמונות של צמחים באמצעות ממשק משתמש גרפי (GUI)8; עם זאת, הוא אינו מפותח במיוחד לניתוח תמונות של מפעל שלם, פחות ניתן להתאמה למחשוב בעל תפוקה גבוהה, וניתן לחזור עליו פחות בקלות מצינורות שכבר עובדים כמו אלה ב-PlantCV שניתן ליישם בקלות על תמונות חדשות9. שיטות למידה עמוקה (כגון BioDock, ראה טבלת חומרים) ו-Segment Anything22) אטרקטיביות ביכולתן לפלח בקלות צמחים מהרקע, וניתן להשתמש בהן למשימות הפילוח המתוארות כאן. עם זאת, מודלים אלה של למידה עמוקה אינם מספקים את מדידות הפנוטיפ של הצמח המתוארות כאן10, וכדי לבצע מדידות מורכבות יותר של פנוטיפים כמותיים עשויות לדרוש כמות גדולה של תמונות אימון (לעתים קרובות יותר מ-10,000) וכוח מחשוב מעבר למחשב נייד או שולחני בסיסי10. מודלים אלה דורשים גם זיכרון מחשב משמעותי וכוח עיבוד, שאינם זמינים לחוקרים רבים10.
השלב הקריטי ביותר בפרוטוקול הוא סידור מערך ההדמיה של המפעל והבטחה שאין אובייקטים (כגון צמחים אחרים, כרטיס צבע או פסולת צמחים) קרוב למפעל המעניין14. אם התמונות אינן מוגדרות כראוי, או שלא נעשה שימוש בכרטיס צבעוני, לא ניתן יהיה לנתח אותן מאוחר יותר מכיוון שאין מנגנון לסטנדרטיזציה. אמנם אין צורך בשלבי כיול בפרוטוקול זה, אך תיקון צבע וסטנדרטיזציה של גודל במהלך העיבוד הם חיוניים. ודא תמיד שכל כרטיס הצבע נמצא במסגרת, אך לא חופף לצמח (איור 2). מלכודת נפוצה נוספת היא תאורה לא אחידה, שעלולה לגרום לצללים או לצילומים בהירים; אנו ממליצים להשתמש באור עילי בהיר ומפוזר ולכסות חלונות בחדר כדי למנוע תאורה לא אחידה (איור 2). ניתן להוסיף מנורות נוספות בזווית פנים למפעל אם אורות עיליים גורמים לצללים. סוג הנורה אינו מהווה דאגה, בהתחשב בכך שהצבע יתוקן בתמונה באמצעות כרטיס צבע. תמונות מטושטשות אינן קבילות לניתוח - השתמש בפוקוס אוטומטי במצלמה, או בהוראות היצרן למיקוד ידני כדי להבטיח שהתמונות ברורות.
באופן דומה, הבטחה שתמונות אינן חשופות יתר על המידה (טעות נפוצה) מאפשרת ניתוח מתאים (איור 2); לא ניתן לתקן תמונות עם חשיפת יתר בתיקון צבע במהלך ניתוח תמונה מכיוון שערכי הפיקסלים הם מעבר לטווח הזיהוי של המצלמה עם ההגדרות הנוכחיות14. כדי למנוע חשיפת יתר, הערך את היסטוגרמות הצבע או ערכי ה-RGB עבור תמונת בדיקה באמצעות זרימת העבודה של PlantCV המתוארת כאן (איור 3), והפחת את הגדרת הבהירות במצלמה אם בדיקת החשיפה קובעת שהתמונה חשיפת יתר. ערכי RGB (ולכן ההיסטוגרמות) לא צריכים לכלול ערכים ב- 0 או ב- 255, שהוא טווח הערכים מכיוון שייתכן שערכים אלה נמצאים מעל או מתחת לטווח הזיהוי ויכולים לרשום רק את המינימום או המקסימום ולא את הערך האמיתי. תמיד יש להעריך תמונת בדיקה באמצעות שיטות אלה לחשיפת יתר (איור 2 ואיור 3); אנו מציעים להשתמש בבקרת איכות החשיפה של PlantCV המסופקת בפרסום זה כבדיקה, הקובעת שתמונה איכותית כוללת פחות מ-5 אחוזים מהפיקסלים ב-0 או 255 עבור כל צבע. ככלל אצבע, מצלמות ותוכנות ניתוח מספקות היסטוגרמות, שאמורות להיות בעלות זנבות היסטוגרמה שווים ושלמים; יש לצלם מחדש ערכים שנחתכו מתחת ל-0 (תת-חשיפה) או מעל 255 (חשיפת יתר) עם הגדרות מצלמה מותאמות. אנו ממליצים לבחור מיקום עם תאורה מלאכותית בהירה ואחידה ללא חלונות לתאורה, מכיוון שחלונות יכולים להיות בהירים מדי, לא אחידים ולשנות לעתים קרובות את חשיפת האור לחלל. התמונות צריכות להיראות מוארות באופן שווה, והריבועים האפורים של כרטיס צבע לא צריכים להופיע בלבן, מה שמרמז על חשיפת יתר.
ייתכן שיהיה צורך בפתרון בעיות עבור קוד לכידת התמונה בהתאם ל-IP ולהגדרות האבטחה של המוסד של המשתמש. כדי לפתור בעיות, פנה למחלקת ה-IT עבור בעיות קישוריות לאינטרנט והעברת קבצים. טעות נפוצה היא שימוש בכרטיס SD בגודל שגוי עבור SBC, או הפעלת SBC לפני הפעלת הצג המחובר. כדי לפתור בעיות, עקוב אחר הפרוטוקול לעיל במדויק וטען מחדש את תוכנת SBC. פורומים מקוונים הם משאב מצוין לפתרון בעיות ומציאת פתרונות למצלמה הספציפית הנבחרת בעת שימוש ב-gphoto2. כדי לפתור בעיות בניתוח תמונות של PlantCV ולהשתמש בגרסאות העדכניות ביותר, השתמש בדף התיעוד (https://plantcv.readthedocs.io/en/latest/), או פרסם בעיה ב-GitHub (https://github.com/danforthcenter/plantcv/issues). בפרט, אם שיטת הסף בפרוטוקול זה אינה מפרידה מספיק את הצמח מהרקע, השתמש בשיטות סף חלופיות המסופקות ב-"photo-studio-SV-notebook.ipynb" או בדף התיעוד.
ניתן ליישם שיטה זו על כל מיני צמחים וטיפול שניתן להעביר למערך הפוטוטוגרפיה המורכב המתואר. לדוגמה, זה לא ישים לצמחים הגדלים בשדה, מכיוון שלא ניתן להעביר אותם למערך הצילום מבלי לחפור את הצמח. במצב זה, ניתן לכרות צמחים ולאחר מכן לצלם אותם באמצעות הפרוטוקול, אם כי המדידה תהיה הרסנית. ניתן ללכוד צמחים רבים בתמונה אחת ולנתח אותם, אולם המשתמש צריך להיזהר מלמנוע מצמחים לגעת זה בזה (איור 2), וצמחים ממוקמים באותו מיקום על הרקע בכל פעם כדי להבטיח שזרימת העבודה יכולה להיות מופעלת באופן אוטומטי על פני כל סט התמונות. אם יש צורך בתצוגה מלמעלה למטה עבור צמחים כגון Arabidopsis thaliana, השתמש בחצובה כדי להזיז את המצלמה לחלק העליון של הצמחים המונחים על הבד בדרגת צילום; שאר השיטות ללכידת וניתוח תמונות נשארות זהות.
כפי שהודגם כאן עם תירס, שיטה זו חשובה הן לגידול צמחים והן לתובנות בסיסיות לגבי האופן שבו צמחים סובלים עקות אביוטיות, כגון חום ובצורת. עקת חום ובצורת משולבים תורמים לאובדן יבול של 15%-20% בתירס מדי שנהברחבי העולם 23. אובדן היבול צפוי רק לגדול עם שינויי האקלים העולמיים, שכן הטמפרטורות צפויות לעלות ב-1.4-4.4 מעלות צלזיוס עד שנת 210024. הערכת מגוון התירס לסבילות ללחץ, כמו גם קביעת המנגנונים הפנוטיפיים, הפיזיולוגיים והמולקולריים של עמידות ללחץ אביוטי, הם מטרות מחקר קריטיות לביטחון תזונתי עולמי25. כדי לענות על שאלות אלה, חוקרים בכל התחומים הסמוכים - פיזיולוגים, גנטיקאים, מגדלים, ביולוגים מולקולריים וכו' - חייבים להיות מסוגלים להעריך במהירות, ביעילות ולעתים קרובות באופן לא הרסני את הפנוטיפים של צמחי תירס תחת לחץ אביוטי25. השיטה ותוצאות הדוגמה המוצגות כאן עונות על צורך זה, ומהוות כלי חשוב לחוקרים להתמודד עם אתגרים חקלאיים בעולם האמיתי.
הפנוטיפים שנצפו כאן היו משוערים, בהתחשב בשפע של מחקרים קודמים - עקת בצורת מפחיתה את גודל הצמח ואת הירוק (נמדד על ידי ממוצע מעגלי גוון)26 (איור 6, איור 7 וטבלה 1). הפנוטיפ של עקת חום עם השקיה טובה באופן בלתי צפוי לא הפחית באופן משמעותי את שטח העלה, אם כי עם יותר שכפולים, ניתן היה להעריך טוב יותר את הקשר הזה מבחינה סטטיסטית, והגובה הצטמצם כצפוי (איור 6). בעוד שהממוצע המעגלי של הגוון לא השתנה עקב חום, פרופיל הצבע אכן השתנה כדי לכלול גם יותר פיקסלים צהובים וגם ירוקים כהים יותר, מה שמראה שהערכה של הגוון הממוצע בלבד אינה מספקת, ויש לקחת בחשבון את ההיסטוגרמה הרב-ערכית של הצבע (איור 7). שינויים פנוטיפיים אלה מתארים את תגובת הצמח לסביבה, וניתן להשתמש בטכניקות נוספות כגון מדידות של חילופי גזים, הדמיית מיקרוסקופיה ועוד כדי להעריך את השינויים הפיזיולוגיים המתרחשים בתגובה ללחץ. תוצאה זו מדגימה את כוחן של מדידות כמותיות מדויקות שאחרת היו מתפספסות באמצעות מדדים ידניים או איכותיים של בריאות הצמח. תובנות אלו קריטיות לגידול והנדסה של יבולים עמידים לשינויי אקלים, מה שמפחית משמעותית את תפוקת היבולים העולמית וצפוי להחמיר בשנים הבאות.
Disclosures
ללא.
Acknowledgements
עבודה זו נערכה במתקן הליבה של פנוטייפינג, מרכז דונלד דנפורת' למדעי הצמח (RRID: SCR_019049), שסיפק תמיכה כספית ל-K.M.M. ו-J.G.D. עבודה זו נתמכה על ידי מענק מכון המחקר Enterprise Rent-A-Car של מרכז דונלד דנפורת' למדעי הצמח. D.S. מומן על ידי מענק בלוק של המכון הגיאו-מרחבי טיילור ומענק של המרכז לפיתוח כלכלי של ארה"ב למדע וטכנולוגיה של אג-טק ומיקום יישומי (CATALST) (ED21HDQ0240072). אנו מודים לקווין ריילי ולקריס היינס (מתקן גידול צמחים משולב, מרכז דונלד דנפורת' למדעי הצמח, RRID: SCR_024902) על המומחיות והסיוע שלהם בגידול צמחים. אנו מודים לנואה פלגרן, מאליה גהאן והיילי שול על עצותיהם לגבי PlantCV.
Materials
| Name | Company | Catalog Number | Comments |
| 15W USB-C Power Supply | CanaKit | DCAR-RSP-3A5-C | |
| 25604 UC-E6 USB Cable | Nikon | 18208256044 | |
| 3.5 inch pots | Hummert International | 13006000 | |
| Berger BM7 35% Bark HP | Hummert International | 10121500 | |
| Biodock 2024 | AI Software Platform | www.biodock.ai. | |
| Code editing software | Jupyter | https://jupyter.org/install | |
| Code editing software | Visual Studio Code | https://code.visualstudio.com/download | |
| Color Card ColorChecker Classic | Calibrite | CCC | |
| Color Card ColorChecker Passport | Calibrite | CCPP2 | |
| Conviron Growth Chamber | Conviron | BDW80 model | |
| Dell 22 Monitor | Dell | SE2222H | |
| EH-67 AC Adapter | Nikon | AZ185 | |
| Image analysis software | PlantCV | https://plantcv.readthedocs.io/en/latest/installation/ | |
| Jack's Water Soluble Fertilizer 15-5-15 | Hummert International | 7590200 | liquid fertilizer |
| Keyboard and Mouse | Logitech | 1440638 | MK270 wireless keyboard and mouse |
| Maize seed | USDA-ARS Germplasm Resources Information Network (GRIN) | B73 | https://www.ars-grin.gov/ |
| Micro HDMI to HDMI cable | Amazon | B07KSDB25X | |
| Nikon Coolpix B500 camera | Nikon | ||
| Nikon D7200 camera | Nikon | ||
| Osmocote 14-14-14 | Hummert International | 7630000 | |
| Photography-grade fabric | Yayoya | Polyester Fabric Black Photo Backdrop for Photo Video Studio Televison | |
| Raspberry Pi 4 Case with heatsink | iUniker | B07ZVKN262 | |
| Raspberry Pi 4 Model B Rev 1.1 | Raspberry Pi Foundation | RP4B4GB_BP | |
| Raspberry Pi 4 PiSwitch (USB-C) | CanaKit | RSP-PISWITCH-USBC | |
| Raspberry Pi software | Raspberry Pi Imager | https://www.raspberrypi.com/software/ | |
| Statistical analysis software | Rstudio | https://posit.co/downloads/ | |
| Tripod | K&F Concept | T255A3+BH-28L | |
| Turface MVP | Hummert International | 10240000 | |
| Wireless Barcode Scanner | Netumscan | B08X4NMX2M | 1D and 2D barcode scanner |
References
- Xiao, Q., Bai, X., Zhang, C., He, Y. Advanced high-throughput plant phenotyping techniques for genome-wide association studies: A review. J Adv Res. 35, 215-230 (2022).
- Mutka, A. M., et al. image-based phenotyping methods provide insight into spatial and temporal dimensions of plant disease. Plant Physiol. 172 (2), 650-660 (2016).
- Mutka, A. M., Bart, R. S. Image-based phenotyping of plant disease symptoms. Front Plant Sci. 5, 734 (2014).
- Fahlgren, N., Gehan, M. A., Baxter, I. Lights, camera, action: High-throughput plant phenotyping is ready for a close-up. Curr Opin Plant Biol. 24 (2), 93-99 (2015).
- Das Choudhury, S., Samal, A., Awada, T. Leveraging image analysis for high-throughput plant phenotyping. Front Plant Sci. 10, 508 (2019).
- Yang, W., et al. Crop phenomics and high-throughput phenotyping: Past decades, current challenges, and future perspectives. Mol Plant. 13 (2), 187-214 (2020).
- Omari, M. K., et al. Digital image-based plant phenotyping: A review. Korean J Agric Sci. 47 (1), 119-130 (2020).
- Schindelin, J., et al. Fiji: An open-source platform for biolFiogical-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Gehan, M. A., et al. PlantCV v2: Image analysis software for high-throughput plant phenotyping. PeerJ. 5, e4088 (2017).
- Murphy, K. M., Ludwig, E., Gutierrez, J., Gehan, M. A. Deep learning in image-based plant phenotyping. Annu Rev Plant Biol. 75 (1), 771-795 (2024).
- Fahlgren, N., et al. A versatile phenotyping system and analytics platform reveals diverse temporal responses to water availability in Setaria. Mol Plant. 8 (3), 1520-1535 (2015).
- Yu, L., et al. Development of a mobile, high-throughput, and low-cost image-based plant growth phenotyping system. bioRxiv. , (2023).
- Atefi, A., Ge, Y., Pitla, S., Schnable, J. Robotic technologies for high-throughput plant phenotyping: Contemporary reviews and future perspectives. Front Plant Sci. 12, 611940 (2021).
- Berry, J. C., Fahlgren, N., Pokorny, A. A., Bart, R. S., Veley, K. M. An automated, high-throughput method for standardizing image color profiles to improve image-based plant phenotyping. PeerJ. 6, e5727 (2018).
- Tovar, J. C., et al. Raspberry Pi-powered imaging for plant phenotyping. Appl Plant Sci. 6, e1031 (2018).
- Jolles, J. W. Broad-scale applications of the Raspberry Pi: A review and guide for biologists. Methods Ecol Evol. 12 (5), 1562-1579 (2021).
- Watt, M., et al. Phenotyping: New windows into the plant for breeders. Annu Rev Plant Biol. 71 (1), 689-712 (2020).
- Xie, C., Yang, C. A review on plant high-throughput phenotyping traits using UAV-based sensors. Comput Electron Agric. 178, 105731 (2020).
- Czedik-Eysenberg, A., et al. The "PhenoBox", a flexible, automated, open-source plant phenotyping solution. New Phytol. 219 (4), 808-823 (2018).
- Sumner, J., Fahlgren, N., Murphy, K. M. PCVR: An R package and tutorials for guided statistical analysis of plant phenotyping data. Authorea Preprints. , (2023).
- Schnable, P. S., et al. The B73 maize genome: complexity, diversity, and dynamics. Science. 326 (5956), 1112-1115 (2009).
- Kirillov, A., et al. Segment Anything. , 3992-4003 (2023).
- Gabaldón-Leal, C., et al. Modelling the impact of heat stress on maize yield formation. Field Crops Res. 198 (3), 226-237 (2016).
- Intergovernmental Panel on Climate Change. . SYNTHESIS REPORT OF THE IPCC SIXTH ASSESSMENT REPORT (AR6). , (2023).
- Quiñones, A., et al. Optimized methods for applying and assessing heat, drought, and nutrient stress of maize seedlings in controlled environment experiments. Cold Spring Harb Protoc. , (2024).
- Murphy, K. M., et al. Maize abiotic stress treatments in controlled environments. Cold Spring Harb Protoc. , (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved