Method Article
Maize (Zea mays) 비생물적 스트레스 표현형을 정량화하기 위한 이미징 및 분석
요약
표현형을 측정하기 위한 저비용 식물 이미징 방법과 이미지 캡처를 위한 모범 사례 및 식물 형질을 정량화하기 위한 이미지 분석 파이프라인이 제시됩니다. 이러한 방법은 더위, 가뭄 및 결합된 비생물적 스트레스 조건에서 옥수수(Zea mays) 표현형을 측정하는 데 적용되었습니다.
초록
정량적 식물 표현형 또는 형질을 측정하는 것은 생물 및 비생물적 스트레스를 포함한 환경 요인에 대한 식물의 반응을 이해하는 데 필수적입니다. 그러나 식물을 측정하는 전통적인 방법은 시간이 많이 걸리고 부정확하며 파괴적일 수 있으며, 특히 바이오매스 및 키와 같은 특성을 개별적으로 평가할 때 그렇습니다. 이미지 기반 분석은 노동력을 줄이고, 정확도와 정밀도를 개선하며, 여러 시점에서 동일한 플랜트를 반복적으로 측정할 수 있는 기회를 제공합니다. 고처리량 표현형 분석 시설이 솔루션을 제공하지만, 종종 엄청나게 비싸고 전 세계적으로 가용성이 제한적입니다. 무료 오픈 소스 패키지인 PlantCV를 기반으로 하는 이미지 분석 파이프라인과 함께 사진 스튜디오 설정 내에서 저렴한 단일 보드 컴퓨터 및 디지털 카메라를 사용하여 식물 이미지를 캡처하는 방법이 설명되어 있습니다. 이 방법은 고품질 이미지 획득을 보장하기 위한 모범 사례와 함께 이미지 캡처, 라벨링 및 전송을 위한 빠르고 정확한 프로토콜을 제공합니다. 이미지 분석을 통해 식물 크기, 높이 및 색상과 같은 특성을 포함하여 실험의 모든 이미지에 대해 10개 이상의 표현형을 동시에 정량화했습니다. 이러한 방법은 열, 가뭄, 열과 가뭄 무생물적 스트레스 조건에 대한 Zea mays (옥수수) 근친 품종 B73의 반응을 특성화하는 데 사용되었습니다.
서문
식물 형질 또는 표현형을 측정하는 것은 식물 과학의 기본 및 응용 질문에 답하는 데 매우 중요합니다. 예를 들어, 유전적 돌연변이가 식물 크기에 미치는 영향을 이해하려는 연구자는 식물 높이와 잎 면적1을 정량적으로 측정해야 합니다. 생물적 스트레스(예: 박테리아, 바이러스 또는 진균 감염) 또는 비생물적 스트레스(예: 가뭄, 더위, 추위 또는 영양 고갈)를 적용하는 연구자는 백화증 2,3을 측정하기 위해 스트레스가 식물 색상 또는 "녹색"에 미치는 영향을 조사해야 합니다.
이러한 형질을 측정하는 것은 기본적인 식물 생물학과 응용 식물 육종에 필수적이지만, 이러한 형질을 직접 측정하는 것은 시간이 많이 걸리고 부정확하며 부정확할 수 있습니다 4,5,6,7. 예를 들어, 식물의 높이를 측정하는 것은 종종 덥거나 습한 환경 조건에서 각 식물에 대해 자를 사용하여 수동으로 측정하는 것을 포함하며, 측정하는 사람의 관점과 식물의 "상단"으로 간주되는 지점에 오류가 있을 수 있습니다. 더욱이, 바이오매스와 색소 함량과 같은 측정은 파괴적이며, 동일한 식물은 이러한 측정 과정에서 파괴되어야 하기 때문에 시간 경과에 따른 변화를 측정하거나 여러 샘플링에 사용할 수 없습니다 4,5,6,7. 이러한 측정의 시간 소모적이고 오류가 발생하기 쉬운 특성은 식물의 표현형 및 생리학적 스트레스 반응을 평가하는 데 방해가 됩니다.
식물의 이미지를 캡처하고 이미지에서 정량적 형질을 측정하면 이러한 문제에 대한 해결책을 얻을 수 있습니다 4,5,6,7. 이미지 분석은 정확성과 정밀도를 향상시키는 동시에 연구자가 측정해야 하는 시간을 줄여주며, 비파괴 형질 정량화 4,5,6,7로 인해 동일한 식물을 여러 번 이미지화하거나 다른 샘플링에 사용할 수 있습니다. 또한 실험이 완료되고 식물이 폐기된 후에도 오랫동안 이미지를 저장하고 다시 분석할 수 있습니다 4,5,6,7. 이미지 분석은 ImageJ(Fiji)8과 같은 저처리량 이미지 편집 도구를 사용하여 개별적으로 완료하거나 PlantCV9와 같은 플랫폼에서 컴퓨터 비전 및 머신 러닝을 사용하여 더 높은 처리량으로 완료할 수 있습니다. PlantCV는 무료 오픈 소스 이미지 분석 플랫폼으로, 연구자가 이미지 배경에서 식물이나 기타 물체를 먼저 마스킹(또는 분리)하고 해당 식물 또는 물체의 크기, 형태, 색상 등을 측정할 수 있습니다9. 연구자는 모듈식 워크플로우를 사용하여 먼저 샘플 이미지를 사용하여 서로 다른 모듈의 유연한 워크플로우(또는 파이프라인)를 구축한 다음 각 개별 이미지와 상호 작용하지 않고 나머지 이미지를 고처리량 워크플로우에 적용합니다9. 정량적 트레이트가 출력되고 그룹 간에 통계적으로 유의미한 차이에 대해 분석됩니다. 딥 러닝 파이프라인은 충분한 이미지를 캡처하고 적절한 특성 측정 또는 메타데이터로 라벨링한 후 효율적이고 자동화된 이미지 분석을 위해 개발할 수 있습니다10.
"고처리량" 표현형은 데이터 수집 및/또는 데이터 분석 중 속도를 높이고 인력을 줄일 수 있습니다 4,5,6,7. 고처리량 표현형 분석 시설을 통해 플랜트가 컨베이어 벨트 또는 로봇을 통해 이미징 스테이션으로 이동하고 플랜트와 관련된 이름(즉, 메타데이터가 있는 라벨)으로 자동 라벨링되는 통제된 환경에서 이미지 수집을 자동화할 수 있게 되었습니다 6,11,12,13,14 . 이러한 컨베이어 벨트 또는 로봇 지원 시설을 통해 사람의 개입 없이 많은 양의 이미지를 캡처하고 레이블을 지정할 수 있지만 전 세계적으로 그런 경우는 거의 없으며 구축하는 데 수백만 달러의 비용이 들 수 있어 많은 연구자가 액세스할 수 없습니다. 저렴한 비용으로 자동화된 이미징이라는 이러한 개념을 적용하기 위해 Raspberry Pi(여기서는 단일 보드 컴퓨터, SBC라고 함)는 통제된 환경에서 자란 식물의 이미지를 캡처, 이름 지정, 저장 및 전송하는 데 사용되는 저가형 컴퓨터(개당 35달러 미만)입니다. 이러한 설정은 최대 72개의 Raspberry Pi 12,15,16 배열을 사용하여 자동화된 시간 간격으로 이미지를 캡처합니다. 수백만 달러의 비용이 들 수 있는 컨베이어 벨트 시스템보다 비용 효율적이지만, 앞서 설명한 SBC 성장 챔버는 작은 식물을 재배하는 하향식 보기에 가장 적합하며 여전히 많은 SBC15가 필요합니다. 현장 환경에서 갠트리, 드론과 같은 UAS(무인 항공 시스템) 및 위성은 모두 식물 형질 분석을 위해 이미지를 캡처합니다17,18. 현장 시스템과 고처리량 제어 환경 시설 모두 시스템을 구축 및 유지 관리하고 이미지를 분석하는 데 필요한 초기 비용, 유지 관리 및 전문 지식 측면에서 엄두를 낼 수 없습니다17,18. 식물 사진 촬영에 단독으로 사용되는 휴대폰과 디지털 카메라는 다운스트림 이미지 분석에 필수적인 메타데이터를 사용한 이미지 전송 및 이름 지정에 시간이 많이 걸리는 문제를 야기합니다.
여기에 설명된 방법은 다른 시스템으로는 해결할 수 없는 문제에 대한 식물 이미징에 대한 저비용 솔루션을 제시합니다. 식물을 개별적으로 스튜디오로 운반하는 사진 설정을 통해 화분에 있는 모든 크기의 식물을 효율적으로 측정할 수 있습니다. 디지털 카메라에 연결된 SBC를 사용하는 이 방법은 먼저 이미지의 표준화된 캡처, 라벨링 및 전송을 제공합니다. 키보드 또는 QR/바코드 스캐너를 사용하여 캡처되는 이미지의 이름을 지정하면 캡처하고 저장한 후 메타데이터로 이미지 이름을 바꾸는 시간이 많이 걸리고 오류가 발생하기 쉬운 작업을 피할 수 있습니다. 이미지의 구성과 권장 카메라 설정은 다운스트림 이미지 분석을 가능하게 하는 데 중요하며, 지침은 여기에 자세히 설명되어 있습니다. 마지막으로, 캡처된 이미지에서 잎 면적, 식물 높이, 너비 및 색상과 같은 정량적 특성을 추출하기 위해 PlantCV의 이미지 분석 파이프라인이 제공됩니다.
컨베이어 벨트 시스템에 비해 이 방법은 비용이 저렴하며 단일 SBC가 필요합니다. 여기에 설명된 표현형 설정은 컨베이어 벨트 또는 로봇 시스템의 제약과 비용을 제거하기 위해 구성되었습니다 - 설정을 성장 공간과 분리할 수 있기 때문에 모든 크기의 플랜트를 측정할 수 있고, 단일 SBC만 필요하며, 최대의 유연성과 경제성을 위해 다양한 카메라 유형과 함께 작동합니다. 여기에 제시된 것과 유사한 접근 방식으로는 PhenoBox 또는 PhenoRig12,19가 있습니다. 수동 측정과 비교했을 때, 이 방법은 시간을 절약하고 오류를 줄이며 플랜트를 파괴하지 않습니다 4,12,15,19.
프로토콜
이 프로토콜에 사용된 시약 및 장비에 대한 자세한 내용은 Table of Materials(재료 표)에 나열되어 있습니다.
1. 사진관 준비
- 측면 이미징을 위해 벽이나 천장에 사진 등급의 검은색 천을 걸어두세요. 식물이 천 위에 놓이도록 바닥에 최소 0.5m 두께의 천을 드레이핑합니다(그림 1).
참고: 직물은 이미지를 만들 식물보다 최소 100cm 더 크고 넓어야 합니다. - 컬러 카드를 배경막에 놓고 상자와 같은 물체에 기대어 프레임에서 볼 수 있도록 합니다(그림 1). 높이가 30cm보다 크거나 너비가 큰 식물의 경우 너비가 20cm 이상인 컬러 카드를 사용합니다. 높이가 30cm 또는 너비보다 작은 식물의 경우 너비가 4-8cm 사이인 컬러 카드를 사용하십시오.
- SD 카드를 랩톱 또는 데스크톱 컴퓨터에 연결합니다. 웹 사이트(https://www.raspberrypi.com/software/)의 소프트웨어 섹션에서 Raspberry Pi Imager를 다운로드하고 제공된 raspberrypi-image-capture.img.gz 파일(https://github.com/danforthcenter/photo-maize-paper)을 랩톱 또는 데스크톱 컴퓨터에 다운로드합니다.
- 다운로드한 이미저(.exe) 파일을 열어 이미저를 실행합니다. OS 선택 버튼을 클릭하고 하단의 사용자 지정 사용 버튼을 선택합니다. image-capture.img.gz 파일을 선택합니다.
- 그런 다음 저장소 선택 버튼을 클릭하고 컴퓨터에 연결된 SD 카드를 선택합니다. 쓰기 버튼을 클릭합니다.
알림: 이 프로세스는 카드에 저장된 모든 데이터를 삭제하므로 올바른 SD 카드를 선택했는지 확인하십시오.
- 그런 다음 저장소 선택 버튼을 클릭하고 컴퓨터에 연결된 SD 카드를 선택합니다. 쓰기 버튼을 클릭합니다.
- USB 코드를 사용하여 최신 버전의 SBC를 키보드에 연결하고, HDMI 코드를 사용하여 외부 모니터에 연결하고, 스위치가 있는 전원 코드를 사용하여 멀티탭에 연결합니다. 모니터와 함께 제공된 전원 코드를 사용하여 모니터를 멀티탭에 연결합니다. SD 카드를 SBC에 넣습니다. 그림 1에서 설정의 레이블이 지정된 회로도를 참조하십시오.
- 스트립의 스위치를 눌러 멀티탭을 켜고 모니터의 버튼을 사용하여 모니터를 켠 다음 전원 코드의 스위치를 "켜기"로 전환하여 SBC를 켭니다.
- WIFI 또는 이더넷 케이블을 사용하여 SBC를 로컬 인터넷에 연결합니다.
- 사진을 서버 또는 클라우드 스토리지로 직접 전송해야 하는 경우:
- SBC에서 파일 경로를 포함하도록 "CAPTURE-PHOTO.py" 파일을 편집하여 전송을 완료합니다.
- 터미널에서 sudo nano /etc/win-credentials 명령을 사용하여 서버 또는 클라우드 스토리지의 경로와 비밀번호로 win-credentials 파일을 편집합니다.
참고: 인터넷 시스템 관리자에게 문의하여 폴더에 파일을 전송할 수 있는 권한이 있는지 확인하십시오.
- USB 또는 Bluetooth를 사용하여 바코드 스캐너와 함께 제공된 제조업체의 지침에 따라 무선 바코드 스캐너를 SBC에 연결합니다.
- 화면 왼쪽 상단의 Raspberry Pi 버튼을 클릭하고 로그아웃을 클릭한 다음 종료 를 클릭하여 SBC를 안전하게 종료하여 SBC를 끕니다. 종료 후 SBC 전원 스위치를 "켜기"로 전환하고 전원 코드를 "끄기"로 전환하고 멀티탭을 "끄기"로 전환합니다.
2. 식물 성장 및 스트레스 치료
참고 : 모든 식물이이 표현형 분석에 적합합니다. 이러한 식물 성장 방법은 여기에 제시된 대표적인 결과에 적용할 수 있습니다.
- 재고 센터에서 B73 또는 다른 옥수수 품종의 씨앗을 얻습니다.
- 토양 매체 및 성장 조건 준비:
- 3.5인치 냄비(0.7L)에 Turface MVP와 Berger BM7-35의 1:1 부피 혼합물을 3lb/입방 야드의 서방형 비료 14-14-14(NPK)로 채웁니다. 구멍이 있는 쟁반에 냄비를 놓고 역삼투압(RO) 물로 물을 철저히 줍니다.
- 성장 챔버를 다음과 같은 환경 조건으로 설정하십시오 : 30 ° C 낮 / 20 ° C, 16 시간 낮 길이, 60 % 습도 및 500 mmol.m-2 s-1 낮 동안 냄비 수준에서 빛. 열 스트레스를 위해 낮 38°C/밤 28°C를 제외하고 동일한 조건으로 별도의 성장 챔버를 설정합니다.
- 20 인치 화분에 각각 3.5 개의 옥수수 씨앗을 심고 토양에 ~ 2cm 깊이를 놓고 옮겨진 흙으로 덮습니다. RO 물로 물을 철저히 주고 제어 성장 챔버에 넣습니다. 액체 비료로 매일 물을 주십시오(제조업체의 지침에 따라 혼합, 재료표 참조).
참고: 실험에 필요한 추가 식물을 심으면 응력 적용을 시작하기 전에 발아가 불량하고 균일성이 부족한 것을 설명할 수 있습니다. 발아 속도는 품종에 따라 다릅니다. - 21일의 성장 후 가장 균일한 식물 16개(처리당 n = 4개의 식물)를 RO 물로 미리 적신 동일한 화분 토양 혼합물로 채워진 3.79L 화분에 이식합니다. 식물을 제어 성장 챔버로 되돌립니다.
- 25일째(이식 후 4일)에 챔버의 조명이 켜질 때 식물의 절반(n = 8)을 열 스트레스 챔버로 이동합니다. 양쪽 챔버에서 가뭄 스트레스를 받은 식물에 물을 주지 마십시오(챔버당 n = 4).
참고: 가뭄 스트레스 식물은 실험이 끝날 때까지 식물이 생존할 수 있도록 물을 주어야 할 수도 있습니다. 여기에서 가뭄 식물은 31일과 37일에 비료로 물을 주었습니다. - 38일째(스트레스가 시작된 후 13일)에 이미징을 위해 성장 챔버에서 식물을 제거합니다.
3. 식물 이미징
- SBC를 시작합니다( 그림 2 참조).
- 멀티탭의 스위치를 사용하여 멀티탭을 켭니다.
- 모니터의 버튼을 사용하여 모니터를 켭니다.
참고: 모니터를 켜기 전에 SBC를 켜면 올바르게 시작되지 않습니다. - SBC 전원 코드의 스위치를 "켜기"로 돌립니다.
알림: 이렇게 하면 SBC가 켜지고 모니터에서 부팅됩니다. SBC 자체에는 "켜기" 스위치가 없고 전원 코드에만 있습니다.
- 카메라를 삼각대나 안정된 테이블 위에 놓습니다.
알림: 전체 식물과 컬러 카드가 view카메라 화면에서. 카메라는 지면과 수직이어야 하며 식물 중심을 직접 볼 수 있어야 합니다(각도 없음). 카메라는 gphoto2 패키지와 호환되어야 하며 목록은 http://www.gphoto.org/proj/libgphoto2/support.php 에서 찾을 수 있습니다. - 카메라 또는 배터리와 함께 전원 코드를 통해 카메라에 전원을 공급합니다. 카메라의 버튼을 사용하여 카메라를 켭니다.
- 카메라와 함께 제공된 데이터 전송 케이블을 사용하여 카메라를 SBC의 USB 포트에 연결합니다.
- 사진 설정에서 식물 배치:
- 화분을 놓을 사진 등급 천에 어두운 색의 테이프 조각을 놓고 각 식물에 대해 배치가 동일한지 확인합니다. 컬러 카드가 테이프 조각과 일치하는지 확인하십시오.
알림: 컬러 카드를 식물 가장자리에서 최소 10cm 떨어진 곳에 놓습니다. PlantCV 워크플로우(아래)에서 품질을 관리하는 동안 색상 칩이 최종 특성 추출에 포함되지 않도록 하기 위해 식물과 화분만 포함하되 색상 카드는 포함하지 않도록 이미지를 자를 수 있어야 합니다. 그림 2 에서 고품질 및 저품질 이미지의 예를 참조하십시오. - 테이프 조각에 냄비를 놓습니다. 옥수수(Zea mays) 및 수수(Sorghum bicolor)와 같이 평면에서 자라는 식물의 경우 식물의 가장 넓은 각도를 카메라 쪽으로 향하게 합니다. 평면에서 자라지 않는 식물의 경우 식물의 0도 및 90도 각도를 캡처하고 이미지 분석이 완료된 후 결과 정량적 측정값의 평균을 구합니다.
- 화분을 놓을 사진 등급 천에 어두운 색의 테이프 조각을 놓고 각 식물에 대해 배치가 동일한지 확인합니다. 컬러 카드가 테이프 조각과 일치하는지 확인하십시오.
- 모니터에 표시된 SBC 데스크탑 화면에서 왼쪽 상단 메뉴 표시줄의 터미널 버튼을 클릭하여 터미널을 엽니다.
- 서버 또는 클라우드 스토리지에 직접 저장하는 경우 필요한 클라우드 스토리지 경로(아래 예제의 cloud-storage-path) 및 암호를 편집하여 다음 명령을 사용하여 스토리지를 마운트하고 열려 있는 터미널 창에 코드 줄을 입력한 다음 키보드에서 Enter 키를 누릅니다. 공장 설정에서 변경되지 않은 경우 사용자 ID(UID)는 "pi"가 됩니다.
메모:
sudo 마운트 -t cifs -o 자격 증명=/etc/win-credentials,uid=pi //클라우드 스토리지 경로 /mnt/cloud-storage - 터미널에 다음 코드를 입력하고 키보드에서 Enter 키를 누릅니다. 새 창이 나타납니다.
./RUN-PHOTOSTUDIO-SHELL.sh
참고: RUN-PHOTOSTUDIO-SHELL.sh 파일은 CAPTURE-PHOTO.py 파일을 호출하며, 위의 방법을 사용하여 로드된 경우 pi에 미리 로드됩니다. 또는 이러한 스크립트는 기존 Raspberry Pi SD 카드에 넣기 위해 GitHub에 제공되었습니다. - 그래픽 사용자 인터페이스 창이 열립니다. 이미지 이름을 입력하거나 바코드 스캐너를 사용하여 식물의 바코드 또는 QR 코드를 스캔합니다.
- 이미지를 로컬에 저장하거나 마운트된 서버/클라우드 스토리지에 저장하는 옵션을 선택합니다.
- 사진을 찍으려면 여기를 클릭하세요! 단추.
- 로컬 저장소를 선택한 경우 바탕 화면에서 PHOTOS 폴더를 열어 이미지를 검사합니다. 서버 또는 클라우드 스토리지를 선택한 경우 해당 위치에서 이미지를 엽니다.
- 필요한 경우 SBC에서 카메라를 분리하고 제조업체의 지침에 따라 조정한 다음 SBC에 다시 연결하여 카메라 설정을 조정합니다.
참고: 노출, 밝기, 대비 등과 같은 설정은 실내의 조명과 이미지화되는 물체에 따라 조정해야 할 수 있습니다. 일반적인 실수는 이미지를 과도하게 노출하는 것입니다. 테스트 이미지의 노출을 확인하려면 노출에 대한 품질 관리 확인이 포함된 PlantCV 이미지 분석 워크플로를 통해 테스트 이미지를 진행합니다. 히스토그램이 적절하게 분포될 때까지 노출을 줄이거나 늘리려면 필요에 따라 카메라 설정을 조정합니다. - 모든 이미지를 캡처한 후 USB 저장소, 인터넷 브라우저 또는 SSH 전송과 같은 선호하는 방법을 사용하여 SBC에서 로컬 컴퓨터 또는 클라우드 저장소로 이미지를 전송합니다.
4. 이미지에서 트레이트 추출
- "photo-studio-SV-notebook.ipynb", "workflow.py" 및 "photo-studio-SV-config.json" 파일을 로컬 컴퓨터 또는 서버에 다운로드합니다. 모든 파일은 GitHub(https://github.com/danforthcenter/photo-maize-paper)에서 사용할 수 있습니다.
- 설명된 단계(https://plantcv.readthedocs.io/en/latest/installation/)를 사용하여 로컬 컴퓨터 또는 서버에 PlantCV 를 설치합니다.
- 기본 코드 편집기(예: JupyterLab 또는 Visual Studio Code)를 사용하여 photo-studio-SV-notebook.ipynb 파일을 엽니다.
- 코드 블록에 설명된 매개변수에 따라 필요에 따라 편집하여 이미지에 있는 식물의 깨끗한 마스크만 얻으면서 각 코드 블록을 실행합니다.
- 샘플 이미지의 분석이 만족스러우면 기본 코드 편집기에서 파일 workflow.py 엽니다. "photo-studio-SV-notebook.ipynb"에서 변경 한 매개 변수로이 파일을 편집하고 저장하십시오.
- 파일 photo-studio-SV-config.json 열고 파일 경로를 편집하여 파일에 표시된 대로 입력 이미지 폴더, 원하는 출력 폴더 등으로 이동합니다.
- 터미널을 열고 다음 코드를 실행하여 PlantCV를 활성화합니다. 이렇게 하려면 터미널에 conda activate plantcv 코드를 입력하고 키보드에서 Enter 키를 누릅니다.
- 다음 코드 줄을 "photo-studio-SV-config.json" 파일의 파일 경로로 변경합니다(아래 코드에서 변경할 수 있는 유일한 내용임).
- 터미널에서 편집된 코드를 입력하고 키보드에서 Enter 키를 누릅니다. 이렇게 하면 실험에서 캡처된 모든 이미지에 대해 워크플로가 실행됩니다.
메모:
plantcv-run-workflow --config /Users/USERNAME/photo-studio-SV-config.json
- 터미널에서 편집된 코드를 입력하고 키보드에서 Enter 키를 누릅니다. 이렇게 하면 실험에서 캡처된 모든 이미지에 대해 워크플로가 실행됩니다.
- 출력 이미지를 검사하여 코드가 모든 이미지에 적합한지 확인합니다.
참고: 식물의 파란색과 분홍색 윤곽선은 식물의 가장자리 주위에 있어야 하며 이미지에 다른 개체가 없어야 합니다. 필요한 경우 "photo-studio-SV-analysis.ipynb"로 돌아가서 문제가 있는 이미지를 테스트하고 코드, 특히 마스킹 단계 및 노이즈 감소를 편집하여 원하는 결과를 얻습니다. 그림 3 에서 high, acceptable, low-quality image segmentation의 예를 참조하십시오. - 출력 파일은 .json 파일 형식입니다. 터미널로 돌아가서 ( conda activate plantcv 가 이미 실행되었는지 확인) 다음 코드를 입력 한 다음 키보드에서 Enter 키를 눌러 파일을 다운 스트림 통계 분석을 위해 .csv로 변환하고 파일 경로를 "results-photo-studio.json"파일의 경로로 변경합니다.
plantcv-utils json2csv -j /Users/USERNAME/results-photo-studio.json -c /Users/USERNAME/results-photo-studio.csv
참고: 픽셀의 측정값을 cm와 같은 표준 측정 단위로 변환하려면 PlantCV 워크플로의 find_color_card 함수에서 제공하는 변환을 활용합니다. - 출력 정량적 형질에 대한 통계 분석을 수행하여 다양한 식물 종, 품종, 처리 및 시점으로 인한 식물 표현형의 차이를 확인합니다.
참고: R Studio의 pcvr 패키지는 통계적 유의성 및 결과 플로팅을 위해 PlantCV의 출력을 분석하기 위해 공식화되었습니다20. 그림 4에 수집된 형질에 대한 요약 및 시각적 표현을 참조하십시오.
결과
이 방법을 개발하기 위해 B73 옥수수 식물은 총 4가지 처리에 대해 제어 온도, 열 온도, 물 공급 및 가뭄 조건 및 이들의 조합에서 정량적 표현형을 평가했습니다. B73은 풍부한 유전 데이터를 가진 잘 알려진 근친 옥수수 품종입니다21.
PlantCV의 이미지 분석은 그림 3에서 볼 수 있듯이 이미지의 색상을 성공적으로 보정하고, 식물 메타데이터로 정량적 결과를 레이블링하고, 배경에서 식물을 분할(즉, 분리)했습니다. 분석에 실패하면 플랜트 외부에 파란색 윤곽선이나 분홍색 모양이 표시되지 않고 추가 노이즈 또는 플랜트 조각이 누락된 출력 이미지가 제공됩니다(그림 3, 저품질 예). 마스크에 가능한 한 많은 식물을 포함하기 위해 이중 채널 임계값이 필요했습니다("photo-studio-SV-notebook.ipynb"의 대체 단일 채널 전략 참조). 그러나 일부 식물, 특히 자주색 줄기를 가진 식물은 완벽한 분할을 갖지 못했지만 다운스트림 분석에는 충분했습니다(그림 3).
PlantCV 분석은 그림 4에 요약된 16개의 정량적 단일 값 형질을 제공했습니다. 단일 값 특성은 식물당 하나의 값(예: 잎 면적, 높이, 너비 및 색조 원형 평균)을 제공합니다. 잎 면적은 "analyze.shape" 기능(그림 4)을 사용하여 고려하고 전체 식물을 고려했습니다. 그러나 높이와 너비는 식물 토양 선에 경계가 그려진 "analyze.bound_horizontal 함수"를 사용하여 고려되었습니다. 이는 화분 옆으로 처진 식물은 식물 전체를 대상으로 고려할 때 더 큰 높이를 가지며 대신 토양과 만나는 식물 바닥에서만 측정해야 하기 때문입니다. 단일 값 트레이트 외에도 PlantCV는 히스토그램, 특히 식물의 각 픽셀을 나타내는 색상 값인 다중 값 트레이트를 출력합니다. 색조 원형 평균은 전체 식물의 평균 색조 값인 단일 값 특성입니다.
어떤 형질이 가장 흥미로운지 결정하기 위해, 각 형질에 대한 처리로 설명된 분산을 계산하고, pcvr R Studio 패키지20 의 "frem" 기능을 사용하여 서로 다른 형질 간의 상관관계를 계산했습니다(그림 5A). 잎 면적, 높이, 너비 및 색조 원형 평균은 처리로 인한 분산의 50% 이상을 설명하고 식물 성장(면적, 높이 및 너비) 및 건강(색조)의 관련 측정값이기 때문에 다운스트림 분석을 위해 선택되었습니다. 가장 큰 잎 면적과 가장 작은 잎 면적을 가진 식물의 대표적인 이미지는 이 실험에서 수집된 표현형의 변화를 보여줍니다(각각 그림 5B, C). 잎 면적이 가장 큰 식물은 평균 색조도 가장 높았으며 물이 많고 열 스트레스를 받는 B73 식물이었습니다(그림 5B). 가장 작은 잎 면적은 평균 색조가 가장 작았으며(그림 5C), 가뭄과 열에 스트레스를 받은 B73 식물이었습니다.
수처리는 잎 면적(F(1,13) = 226.5, p=1.32 x 10-9), 높이(F(1,13) = 21.1, p =0.0005), 너비(F(1,13) = 75.5, p=8.92 x 10-7), 색조 원평균(F(1,13) = 27.8, p =0.0002)을 결정하는 데 유의한 영향을 미쳤으며, 이는 R Studio에서 처리 효과에 대한 선형 회귀 모델과 이원 ANOVA( 전체 결과 표 1)를 사용하여 결정되었습니다. 온도 처리는 높이(F(1,13) = 5.94, p = 0.03)에 유의한 영향을 미쳤지만, 잎 면적, 너비 또는 색조 원형 평균(p > 0.05, 표 1)에는 유의한 영향을 미치지 않았습니다. 온도와 수중 상태 사이의 상호 작용은 측정된 형질 중 어느 것에서도 중요한 요인이 아니었습니다(p > 0.05, 표 1).
다음으로, 선형 회귀 분석과 사후 검정 (추정된 한계 평균)을 사용하여 개별 처리를 대조군 및 서로 비교하고 다중 비교를 위해 Sidak 보정을 수행했습니다(그림 6). 잎 면적, 식물 높이, 식물 너비 및 색조 원형 평균은 두 온도 조건 모두에서 물을 잘 준 식물에 비해 가뭄 스트레스를 받은 식물에서 유의하게 감소했습니다(p < 0.05, 그림 6). 물을 잘 주는 동안 열 스트레스는 식물 높이만 감소시켰지만(p < 0.05, 그림 6), 잎 면적, 식물 너비 또는 색조 원형 평균은 크게 감소시키지 않았습니다. 이러한 색조의 차이는 단순한 평균이 아닌 그림 7에 히스토그램으로 표시된 다중 값 색상 특성 색조를 평가하여 추가로 조사할 수 있습니다. 가뭄으로 인한 평균 색조의 감소는 백화증(chlorosis)으로 알려진 녹색 픽셀에서 노란색 픽셀로의 전환 때문이었습니다(그림 7). 열은 평균 색조에서 큰 차이를 보이지 않았지만 황변(백화)과 녹색의 어두워짐으로 인해 감소 및 증가를 보였습니다(그림 7).
이미징 후, 뿌리-싹 접합부에서 식물을 절단하고 지상 조직의 무게를 기록했습니다. 뿌리를 부드럽게 씻고 수건으로 말린 다음 무게를 측정하여 설명된 이미지 기반 표현형 분석법과 비교하기 위해 총 식물 바이오매스(중량이라고도 함)를 계산했습니다. 이미지 분석을 통해 측정된 잎 면적은 식물 바이오매스와 밀접한 상관관계가 있었습니다(R2 = 0.84, 그림 8).

그림 1: 식물 이미지를 수집하기 위해 레이블이 지정된 구성 요소가 있는 사진 스튜디오 설정 이미지. (A) 사진 등급 패브릭, (B) 컬러 카드, (C) 화분을 균일하게 배치하기 위한 테이프 라인, (D) 디지털 카메라, (E) 단일 보드 컴퓨터, (F) 이미지 캡처 프로세스를 표시하는 모니터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 이미징 워크플로우 개요. 대표적인 "고화질" 및 "저화질" 이미지가 제공됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
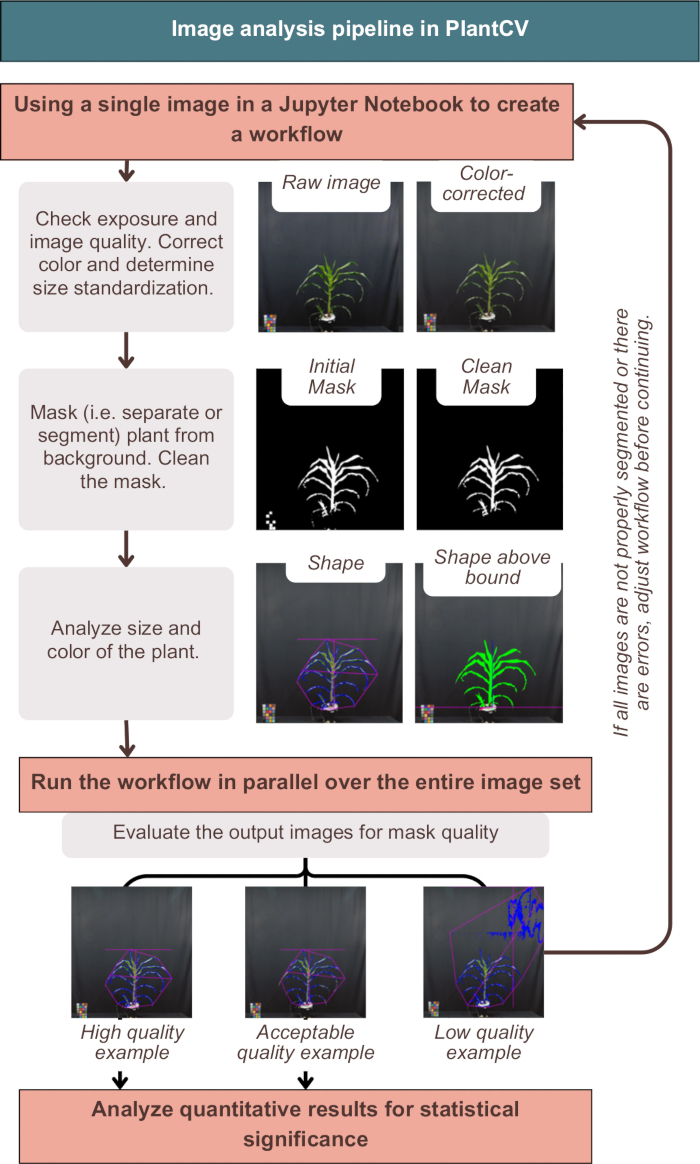
그림 3: PlantCV의 이미지 분석 워크플로우 개요. "높음", "수용 가능" 및 "낮음" 품질 세분화의 대표적인 이미지가 제공됩니다. PlantCV 특성은 전체 식물 모양의 분홍색 윤곽선과 식물 영역의 파란색 윤곽선을 사용하여 표현됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
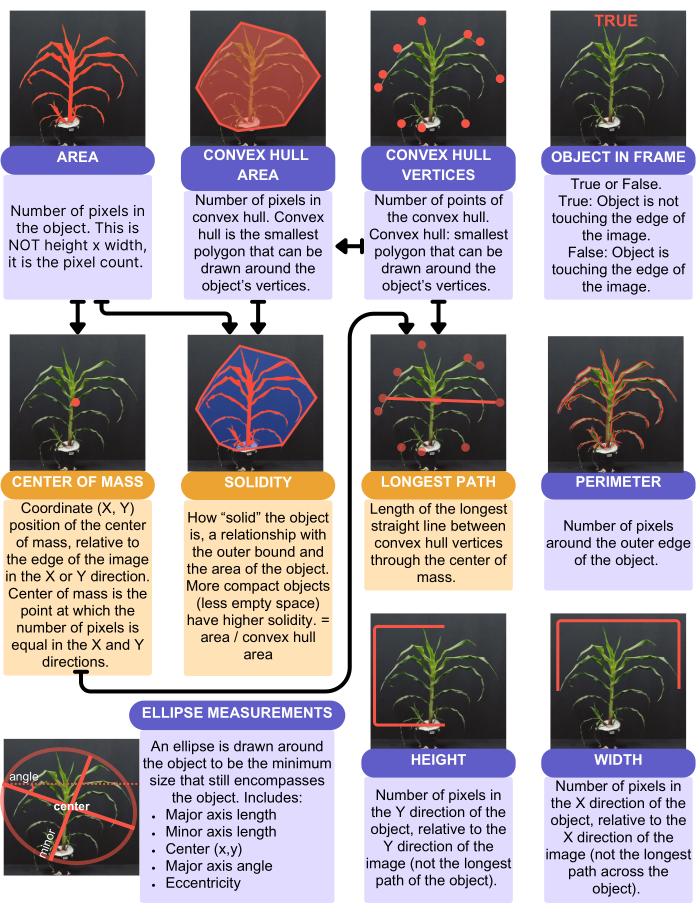
그림 4: 분석에서 캡처한 형상 특성의 요약 및 시각적 표현. PlantCV의 형상 함수. 보라색 상자는 계산에 다른 트레이트를 사용하지 않는 트레이트를 나타냅니다. 주황색 상자는 계산에 다른 특성을 사용하는 특성을 나타냅니다. 화살표는 이러한 계산에 사용되는 트레이트를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
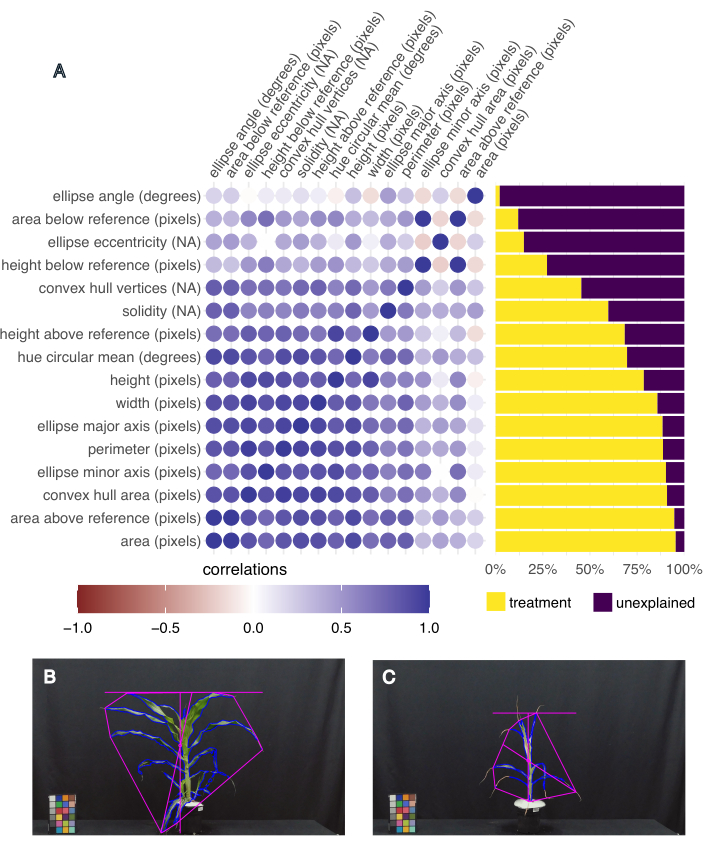
그림 5: 이미지 기반 표현형은 표현형 분산과 상관 형질을 캡처합니다. (A) 처리에 의해 설명되는 형질의 분산(오른쪽)과 형질 간의 상관관계(왼쪽). 각 형질에는 레이블이 지정되고 그 뒤에 측정 단위가 표시됩니다. "NA"는 단위 없는 측정임을 의미합니다. (B) 가장 높은 잎 면적과 가장 높은 색조 원형 평균(도)을 가진 식물의 이미지. (C) 잎 면적이 가장 작고 색조 원형 평균(도)이 가장 낮은 식물의 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
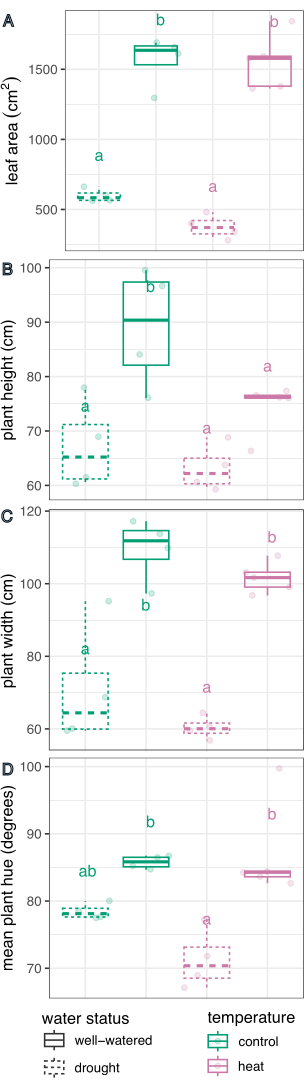
그림 6: 식물 표현형에 대한 처리 효과의 상자 그림 비교. 잎 면적(A), 높이(B), 너비(C) 및 색조 원형 평균(D)을 비교하여 가뭄, 열 및 결합된 응력의 영향을 비교합니다. n = 4입니다. 문자는 처리 간에 통계적으로 유의한 차이를 나타냅니다(p < 0.05). 선형 회귀 분석과 사후 검사(추정된 한계 평균)를 사용하여 다중 비교를 위한 Sidak 보정을 사용하여 처리를 비교했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
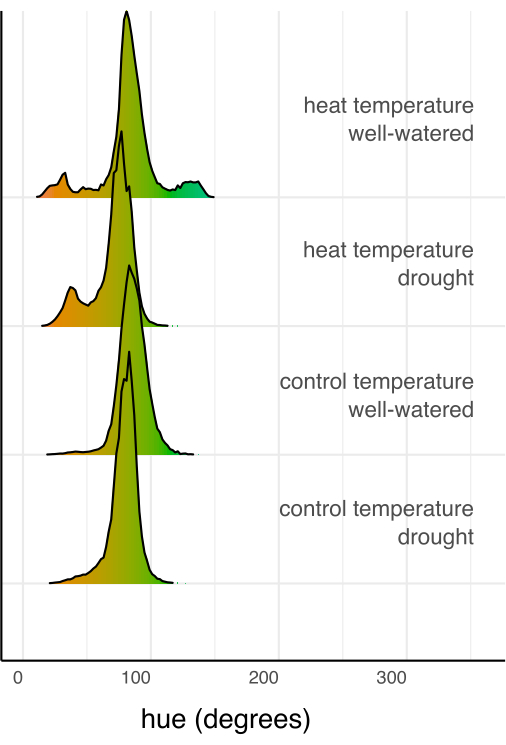
그림 7: 각 처리 조합의 모든 픽셀을 합산한 색상(색조)의 히스토그램으로, 처리 조합의 총 픽셀 수로 정규화되었습니다. 히스토그램은 색조 정도의 색상 값으로 색상이 지정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
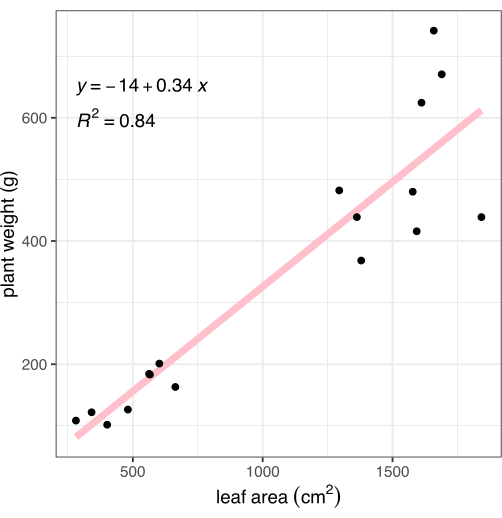
그림 8: 이미지에서 측정한 잎 면적과 전체 식물 바이오매스의 상관관계. 각 검은 점은 하나의 식물을 나타냅니다. 분홍색 선은 잎 면적(X)과 바이오매스(Y) 사이의 선형 상관관계를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 특징 | 요소 | 자유도 | F-값 | p-값 |
| 잎 면적 (cm ^ 2) | 온도 | 1 | 0.5372 | 0.4766 |
| 잎 면적 (cm ^ 2) | 물 | 1 | 226.5318 | 1.32E-09 |
| 잎 면적 (cm ^ 2) | 온도:물 | 1 | 2.1526 | 0.1661 |
| 잎 면적 (cm ^ 2) | 오차 | 13 | ||
| 높이 (cm) | 온도 | 1 | 5.9426 | 0.0298935 |
| 높이 (cm) | 물 | 1 | 21.107 | 0.0005029 |
| 높이 (cm) | 온도:물 | 1 | 2.1752 | 0.1640545 |
| 높이 (cm) | 오차 | 13 | ||
| 폭(cm) | 온도 | 1 | 2.2495 | 0.1575 |
| 폭(cm) | 물 | 1 | 75.5474 | 8.92E-07 |
| 폭(cm) | 온도:물 | 1 | 0.0839 | 0.7766 |
| 폭(cm) | 오차 | 13 | ||
| 색조 원형 평균(도) | 온도 | 1 | 0.9154 | 0.3561432 |
| 색조 원형 평균(도) | 물 | 1 | 27.7988 | 0.0001509 |
| 색조 원형 평균(도) | 온도:물 | 1 | 3.4792 | 0.0848724 |
| 색조 원형 평균(도) | 오차 | 13 |
표 1: 수처리, 온도 처리 및 상호 작용이 식물 형질에 미치는 영향을 조사한 선형 회귀 모델 및 양방향 분산 분석 분석의 결과.
토론
이미지 기반 표현형은 식물 표현형 4,5,6,7에 대한 정확하고 빠른 정량적 측정을 제공합니다. 이 방법은 식물 높이를 기록하기 위해 자를 수동으로 사용하거나 건강과 관련될 수 있는 식물 색상 특징의 정성적 측정보다 훨씬 빠르고 정확하며 더 많은 측정 횟수를 제공합니다 4,5,6,7. 잎 면적은 여기에서 확인되었으며, 이전 연구10에서는 식물 바이오매스와 밀접한 상관관계가 있는 것으로 나타났으며(그림 8), 이 측정법이 전체 식물 바이오매스를 수동으로 계량하는 시간이 많이 걸리고 파괴적이며 오류가 발생하기 쉬운 프로세스를 안정적으로 대체할 수 있음을 시사합니다. 카메라 하나만으로 이미지를 캡처할 수 있지만, 저비용 SBC를 추가함으로써 이미지 수집의 자동화와 필요한 메타데이터로 이미지 라벨링을 통해 처리량을 증가시켰다15. 이 방법은 하루에 한 번(또는 덜 자주) 이미지화되는 1~300개의 식물에 적합합니다. 실험에서 더 많은 수의 식물의 경우, 이미징을 위해 식물을 개별적으로 이동하는 시간이 작업일보다 길 수 있기 때문에 컨베이어 기반, 오버헤드 갠트리 또는 로봇 지원 이미징 시스템이 더 적합합니다11,13. 더 빈번한 시점(예: 하루에 한 번 또는 덜 자주 이미지)의 경우 성장 챔버 내부의 카메라 설정이 이미지를 자동으로 캡처하기 때문에 더 적합하지만 식물의 크기에 따라 제한되며 추가 SBC15가 필요합니다.
PlantCV는 여기에서 이미지 분석 옵션으로 제공되지만 다른 소프트웨어가 있습니다. ImageJ(피지)는 그래픽 사용자 인터페이스(GUI)8를 통해 식물 이미지에도 사용할 수 있는 이미지 분석을 위한 무료 소프트웨어 패키지입니다. 그러나 전체 플랜트 이미지 분석을 위해 특별히 개발되지 않았고, 고처리량 컴퓨팅에 덜 적응하며, 새로운 이미지에 쉽게 적용할 수 있는 PlantCV와 같이 이미 작동 중인 파이프라인보다 쉽게 반복할 수 없습니다9. 딥 러닝(예: BioDock, Table of Materials) 및 Segment Anything22) 방법은 백그라운드에서 식물을 쉽게 분할할 수 있다는 점에서 매력적이며, 여기에 설명된 세분화 작업에 사용할 수 있습니다. 그러나, 이러한 딥러닝모델은 여기에 기술된 식물 표현형 측정을 제공하지 않으며, 이러한 정량적 표현형을 보다 복잡하게 측정하기 위해서는 많은 양의 훈련 이미지(종종 10,000개 이상)와 기본 노트북 또는 데스크톱 컴퓨터(10)를 초과하는 컴퓨팅 파워가 필요할 수 있다. 또한 이러한 모델에는 상당한 컴퓨터 메모리와 처리 능력이 필요한데, 많은 연구자들이 이를 사용할 수 없다10.
프로토콜의 가장 중요한 단계는 식물 이미징 설정을 준비하고 관심 식물14 근처에 물체(예: 다른 식물, 컬러 카드 또는 식물 잔해)가 없는지 확인하는 것입니다. 이미지가 적절하게 설정되지 않았거나 컬러 카드를 사용하지 않으면 표준화 메커니즘이 없기 때문에 나중에 분석할 수 없습니다. 이 프로토콜에서는 보정 단계가 필요하지 않지만 처리 중 색상 보정 및 크기 표준화는 필수적입니다. 항상 전체 컬러 카드가 프레임 안에 있지만 식물과 겹치지 않는지 확인하십시오(그림 2). 또 다른 일반적인 함정은 그림자나 밝은 샷을 유발할 수 있는 고르지 않은 조명입니다. 불균일한 조명을 방지하기 위해 밝고 확산되는 오버헤드 조명을 사용하고 방의 창문을 덮는 것이 좋습니다(그림 2). 추가 램프는 오버헤드 조명이 그림자를 유발하는 경우 공장에 정면이 향하는 각도로 추가할 수 있습니다. 전구의 유형은 색상 카드를 사용하여 이미지에서 색상이 수정된다는 점을 감안할 때 문제가 되지 않습니다. 흐릿한 이미지는 분석에 사용할 수 없습니다 - 카메라의 자동 초점 또는 수동 초점에 대한 제조업체의 지침을 사용하여 이미지가 선명한지 확인하십시오.
마찬가지로, 이미지가 과다 노출되지 않도록(일반적인 실수) 적절한 분석이 가능합니다(그림 2). 과다 노출된 이미지는 이미지 분석 중 색 보정으로 수정할 수 없는데, 그 이유는 픽셀 값이 현재 설정(14)으로 카메라의 감지 범위를 벗어나기 때문이다. 과다 노출을 방지하려면 여기에 설명된 PlantCV 워크플로(그림 3)를 사용하여 테스트 이미지의 색상 히스토그램 또는 RGB 값을 평가하고, 노출 테스트에서 이미지가 과다 노출된 것으로 판단되면 카메라의 밝기 설정을 줄이십시오. RGB 값(및 히스토그램)은 0 또는 255의 값을 가져서는 안 되며, 이러한 값이 감지 범위보다 높거나 낮을 수 있고 실제 값이 아닌 최소값 또는 최대값만 기록할 수 있기 때문에 값 범위입니다. 테스트 이미지는 항상 이러한 방법을 사용하여 과다 노출에 대해 평가해야 합니다(그림 2 및 그림 3). 이 간행물에 제공된 PlantCV 노출 품질 관리를 검사로 활용하여 각 색상에 대해 0 또는 255에서 픽셀의 5% 미만을 결정하는 고품질 이미지를 확인하는 것이 좋습니다. 일반적으로 카메라와 분석 소프트웨어는 히스토그램을 제공하며, 히스토그램 꼬리는 동일하고 완전한 히스토그램 꼬리를 가져야 합니다. 0 미만(노출 부족) 또는 255 이상(노출 과다)으로 잘린 값은 조정된 카메라 설정으로 다시 촬영해야 합니다. 창문이 너무 밝고 고르지 않으며 공간에 대한 빛 노출이 자주 변경될 수 있으므로 조명을 위한 창문이 없는 밝고 균일한 인공 조명이 있는 위치를 선택하는 것이 좋습니다. 이미지는 균일하게 조명으로 표시되어야 하며 컬러 카드의 회색 사각형이 흰색으로 표시되어서는 안 되며, 이는 과도한 노출을 나타냅니다.
사용자 기관의 IP 및 보안 설정에 따라 이미지 캡처 코드에 대한 문제 해결이 필요할 수 있습니다. 문제를 해결하려면 인터넷 연결 및 파일 전송 문제에 대해 IT 부서에 문의하십시오. 일반적인 실수는 SBC에 잘못된 크기의 SD 카드를 사용하거나 연결된 모니터를 켜기 전에 SBC를 켜는 것입니다. 문제를 해결하려면 위의 프로토콜을 정확하게 따르고 SBC 소프트웨어를 다시 로드하십시오. 온라인 포럼은 gphoto2를 사용할 때 선택한 특정 카메라에 대한 문제를 해결하고 솔루션을 찾을 수 있는 훌륭한 리소스입니다. PlantCV 이미지 분석 문제를 해결하고 최신 버전 관리를 사용하려면 설명서 페이지(https://plantcv.readthedocs.io/en/latest/)를 활용하거나 GitHub(https://github.com/danforthcenter/plantcv/issues)에 문제를 게시하십시오. 특히, 이 프로토콜의 임계값 지정 방법이 플랜트를 백그라운드에서 충분히 분리하지 못하는 경우 "photo-studio-SV-notebook.ipynb" 또는 설명서 페이지에 제공된 대체 임계값 지정 방법을 활용합니다.
이 방법은 설명된 조립된 사진 촬영 설정으로 운반할 수 있는 모든 식물 종 및 처리에 적용할 수 있습니다. 예를 들어, 들판에서 자라는 식물에는 식물을 파내지 않고는 사진 촬영장으로 운반할 수 없기 때문에 적용할 수 없습니다. 이 상황에서는 식물을 절단한 후 프로토콜을 사용하여 이미지화할 수 있지만 측정은 파괴적일 수 있습니다. 단일 이미지에 여러 식물을 캡처하고 분석할 수 있지만, 사용자는 식물이 서로 닿지 않도록 주의해야 하며(그림 2), 식물은 전체 이미지 세트에 대해 워크플로우가 자동으로 실행될 수 있도록 매번 배경의 동일한 위치에 배치됩니다. 애기장대(Arabidopsis thaliana)와 같은 식물에 대해 하향식 보기가 필요한 경우 삼각대를 사용하여 카메라를 사진 등급 천에 배치된 식물 상단으로 이동합니다. 이미지 캡처 및 분석을 위한 나머지 방법은 동일하게 유지됩니다.
옥수수에서 볼 수 있듯이 이 방법은 식물 육종과 식물이 더위와 가뭄과 같은 비생물적 스트레스를 어떻게 견디는지에 대한 근본적인 통찰력 모두에 중요합니다. 더위와 가뭄 스트레스가 결합되어 전 세계적으로 매년 옥수수의 수확량 손실이 15%-20% 감소합니다23. 수확량 손실은 지구 기후 변화로 인해 증가할 것으로 예상되며, 2100년까지 기온이 1.4-4.4°C 증가할 것으로 예상됩니다24. 스트레스 내성을 위해 옥수수의 다양성을 평가하고, 비생물적 스트레스 내성의 표현형적, 생리학적, 분자적 메커니즘을 결정하는 것은 세계 식량 안보를 위한 중요한 연구 목표이다25. 이러한 질문에 답하기 위해 생리학자, 유전학자, 육종가, 분자생물학자 등 모든 인접 분야의 연구자들은 비생물적 스트레스 하에서 옥수수 식물의 표현형을 빠르고 효과적이며 종종 비파괴적으로 평가할 수 있어야 한다25. 여기에 표시된 방법과 예시 결과는 이러한 요구를 해결하며, 연구자들이 실제 농업 문제를 해결하는 데 중요한 도구입니다.
여기에서 관찰된 표현형은 가뭄 스트레스가 식물 크기와 녹색을 감소시킨다(색조 원형 평균으로 측정)26 (그림 6, 그림 7 및 표 1)와 같은 풍부한 이전 연구를 감안할 때 가설화되었습니다. 물을 잘 주는 것에 따른 열 스트레스의 표현형은 예기치 않게 잎 면적을 크게 감소시키지 않았지만, 더 많은 복제로 이 관계를 통계적으로 더 잘 평가할 수 있었고 높이가 예상대로 감소했습니다(그림 6). 색조 원형 평균은 열로 인해 변경되지 않았지만 실제로 색상 프로파일은 더 많은 노란색 픽셀과 더 어두운 녹색 픽셀을 모두 포함하도록 변경되어 평균 색조에 대한 평가만으로는 충분하지 않으며 색상의 다중 값 특성 히스토그램을 고려해야 함을 보여줍니다(그림 7). 이러한 표현형 변화는 환경에 대한 식물의 반응을 설명하며, 가스 교환 측정, 현미경 이미징 등과 같은 추가 기술을 사용하여 스트레스에 대한 반응으로 발생하는 생리적 변화를 평가할 수 있습니다. 이 결과는 식물 건강에 대한 수동 또는 정성적 측정을 사용하여 놓칠 수 있는 정밀한 정량적 측정의 힘을 보여줍니다. 이러한 통찰력은 기후 변화에 저항하는 작물을 육종하고 엔지니어링하는 데 매우 중요하며, 기후 변화는 전 세계 작물 수확량을 크게 감소시키고 향후 몇 년 동안 악화될 것으로 예상됩니다.
공개
없음.
감사의 말
이 작업은 K.M.M. 및 J.G.D.에 자금 지원을 제공한 Donald Danforth Plant Science Center(RRID: SCR_019049)의 표현형 핵심 시설에서 수행되었습니다. 이 작업은 Donald Danforth Plant Science Center Enterprise Rent-A-Car Research Institute Grant의 지원을 받았습니다. D.S.는 Taylor Geospatial Institute Block Grant와 미국 경제개발청 CATALST(Center for AgTech and Applied Location Science and Technology) ED21HDQ0240072(Grant)의 지원을 받았습니다. 식물 성장에 대한 전문 지식과 도움을 주신 Kevin Reilly와 Kris Haines(Integrated Plant Growth Facility, Donald Danforth Plant Science Center, RRID: SCR_024902)에게 감사드립니다. PlantCV에 대한 조언을 해주신 Noah Fahlgren, Malia Gehan 및 Haley Schuhl에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 15W USB-C Power Supply | CanaKit | DCAR-RSP-3A5-C | |
| 25604 UC-E6 USB Cable | Nikon | 18208256044 | |
| 3.5 inch pots | Hummert International | 13006000 | |
| Berger BM7 35% Bark HP | Hummert International | 10121500 | |
| Biodock 2024 | AI Software Platform | www.biodock.ai. | |
| Code editing software | Jupyter | https://jupyter.org/install | |
| Code editing software | Visual Studio Code | https://code.visualstudio.com/download | |
| Color Card ColorChecker Classic | Calibrite | CCC | |
| Color Card ColorChecker Passport | Calibrite | CCPP2 | |
| Conviron Growth Chamber | Conviron | BDW80 model | |
| Dell 22 Monitor | Dell | SE2222H | |
| EH-67 AC Adapter | Nikon | AZ185 | |
| Image analysis software | PlantCV | https://plantcv.readthedocs.io/en/latest/installation/ | |
| Jack's Water Soluble Fertilizer 15-5-15 | Hummert International | 7590200 | liquid fertilizer |
| Keyboard and Mouse | Logitech | 1440638 | MK270 wireless keyboard and mouse |
| Maize seed | USDA-ARS Germplasm Resources Information Network (GRIN) | B73 | https://www.ars-grin.gov/ |
| Micro HDMI to HDMI cable | Amazon | B07KSDB25X | |
| Nikon Coolpix B500 camera | Nikon | ||
| Nikon D7200 camera | Nikon | ||
| Osmocote 14-14-14 | Hummert International | 7630000 | |
| Photography-grade fabric | Yayoya | Polyester Fabric Black Photo Backdrop for Photo Video Studio Televison | |
| Raspberry Pi 4 Case with heatsink | iUniker | B07ZVKN262 | |
| Raspberry Pi 4 Model B Rev 1.1 | Raspberry Pi Foundation | RP4B4GB_BP | |
| Raspberry Pi 4 PiSwitch (USB-C) | CanaKit | RSP-PISWITCH-USBC | |
| Raspberry Pi software | Raspberry Pi Imager | https://www.raspberrypi.com/software/ | |
| Statistical analysis software | Rstudio | https://posit.co/downloads/ | |
| Tripod | K&F Concept | T255A3+BH-28L | |
| Turface MVP | Hummert International | 10240000 | |
| Wireless Barcode Scanner | Netumscan | B08X4NMX2M | 1D and 2D barcode scanner |
참고문헌
- Xiao, Q., Bai, X., Zhang, C., He, Y. Advanced high-throughput plant phenotyping techniques for genome-wide association studies: A review. J Adv Res. 35, 215-230 (2022).
- Mutka, A. M., et al. image-based phenotyping methods provide insight into spatial and temporal dimensions of plant disease. Plant Physiol. 172 (2), 650-660 (2016).
- Mutka, A. M., Bart, R. S. Image-based phenotyping of plant disease symptoms. Front Plant Sci. 5, 734 (2014).
- Fahlgren, N., Gehan, M. A., Baxter, I. Lights, camera, action: High-throughput plant phenotyping is ready for a close-up. Curr Opin Plant Biol. 24 (2), 93-99 (2015).
- Das Choudhury, S., Samal, A., Awada, T. Leveraging image analysis for high-throughput plant phenotyping. Front Plant Sci. 10, 508 (2019).
- Yang, W., et al. Crop phenomics and high-throughput phenotyping: Past decades, current challenges, and future perspectives. Mol Plant. 13 (2), 187-214 (2020).
- Omari, M. K., et al. Digital image-based plant phenotyping: A review. Korean J Agric Sci. 47 (1), 119-130 (2020).
- Schindelin, J., et al. Fiji: An open-source platform for biolFiogical-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Gehan, M. A., et al. PlantCV v2: Image analysis software for high-throughput plant phenotyping. PeerJ. 5, e4088 (2017).
- Murphy, K. M., Ludwig, E., Gutierrez, J., Gehan, M. A. Deep learning in image-based plant phenotyping. Annu Rev Plant Biol. 75 (1), 771-795 (2024).
- Fahlgren, N., et al. A versatile phenotyping system and analytics platform reveals diverse temporal responses to water availability in Setaria. Mol Plant. 8 (3), 1520-1535 (2015).
- Yu, L., et al. Development of a mobile, high-throughput, and low-cost image-based plant growth phenotyping system. bioRxiv. , (2023).
- Atefi, A., Ge, Y., Pitla, S., Schnable, J. Robotic technologies for high-throughput plant phenotyping: Contemporary reviews and future perspectives. Front Plant Sci. 12, 611940 (2021).
- Berry, J. C., Fahlgren, N., Pokorny, A. A., Bart, R. S., Veley, K. M. An automated, high-throughput method for standardizing image color profiles to improve image-based plant phenotyping. PeerJ. 6, e5727 (2018).
- Tovar, J. C., et al. Raspberry Pi-powered imaging for plant phenotyping. Appl Plant Sci. 6, e1031 (2018).
- Jolles, J. W. Broad-scale applications of the Raspberry Pi: A review and guide for biologists. Methods Ecol Evol. 12 (5), 1562-1579 (2021).
- Watt, M., et al. Phenotyping: New windows into the plant for breeders. Annu Rev Plant Biol. 71 (1), 689-712 (2020).
- Xie, C., Yang, C. A review on plant high-throughput phenotyping traits using UAV-based sensors. Comput Electron Agric. 178, 105731 (2020).
- Czedik-Eysenberg, A., et al. The "PhenoBox", a flexible, automated, open-source plant phenotyping solution. New Phytol. 219 (4), 808-823 (2018).
- Sumner, J., Fahlgren, N., Murphy, K. M. PCVR: An R package and tutorials for guided statistical analysis of plant phenotyping data. Authorea Preprints. , (2023).
- Schnable, P. S., et al. The B73 maize genome: complexity, diversity, and dynamics. Science. 326 (5956), 1112-1115 (2009).
- Kirillov, A., et al. Segment Anything. , 3992-4003 (2023).
- Gabaldón-Leal, C., et al. Modelling the impact of heat stress on maize yield formation. Field Crops Res. 198 (3), 226-237 (2016).
- Intergovernmental Panel on Climate Change. . SYNTHESIS REPORT OF THE IPCC SIXTH ASSESSMENT REPORT (AR6). , (2023).
- Quiñones, A., et al. Optimized methods for applying and assessing heat, drought, and nutrient stress of maize seedlings in controlled environment experiments. Cold Spring Harb Protoc. , (2024).
- Murphy, K. M., et al. Maize abiotic stress treatments in controlled environments. Cold Spring Harb Protoc. , (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유