A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת פוטנציאל הממברנה המיטוכונדריאלית in vivo באמצעות מחוון מתח מקודד גנטית
In This Article
Summary
פרוטוקול זה מתאר את היישום של מחווני מתח מקודדים גנטית (GEVIs) ממוקדי מיטוכונדריה. GEVIs אלה מציעים יתרון משמעותי על פני צבעים פוטנציאליים מסורתיים של ממברנה מיטוכונדריאלית על ידי מתן אפשרות לניטור ספציפי, in vivo ובזמן אמת של פוטנציאל הממברנה המיטוכונדריאלית.
Abstract
פוטנציאל הממברנה המיטוכונדריאלית (MMP, ΔΨm) הוא קריטי לתפקודים מיטוכונדריאלים, כולל סינתזת ATP, הובלת יונים, יצירת מיני חמצן תגובתיים (ROS) וייבוא חלבונים המקודדים על ידי הגרעין. שיטות קיימות למדידת ΔΨm משתמשות בדרך כלל בצבעי קטיון ליפופיליים, כגון רודמין 800 וטטרמתילרודמין מתיל אסטר (TMRM), אך אלה מוגבלות על ידי ספציפיות נמוכה ואינן מתאימות היטב ליישומי in vivo . כדי להתמודד עם מגבלות אלה, פיתחנו פרוטוקול חדשני המשתמש במחווני מתח מקודדים גנטית (GEVIs). מחווני מתח מקודדים גנטית (GEVIs), המייצרים אותות פלואורסצנטיים בתגובה לשינויים בפוטנציאל הממברנה, הוכיחו פוטנציאל משמעותי לניטור ממברנת הפלזמה והפוטנציאלים העצביים. עם זאת, היישום שלהם על ממברנות מיטוכונדריאליות נותר לא נחקר. כאן, פיתחנו GEVIs ממוקדי מיטוכונדריה מבוססי חלבון המסוגלים לזהות תנודות ΔΨm בתאים ובקליפת המוח המוטורית של בעלי חיים חיים. אינדיקטור הפוטנציאל המיטוכונדריאלי (MPI) מציע גישה לא פולשנית לחקר דינמיקת ΔΨm בזמן אמת, ומספק שיטה לחקירת תפקוד המיטוכונדריה בתנאים נורמליים ופתולוגיים כאחד.
Introduction
מיטוכונדריה הם אברונים חיוניים בתאים אוקריוטיים, המשמשים כספקי האנרגיה העיקריים באמצעות ייצור אדנוזין טריפוספט (ATP) תוך ביצוע מגוון פונקציות חיוניות אחרות, כגון סינתזת מטבוליטים, חציצה של יוני סידן, ייצור חום וויסות הישרדות התאים1. תפקידיהם קריטיים במיוחד ברקמות מטבוליות מאוד כמו המוח והלב, שם הם מסייעים בשמירה על הומאוסטזיס תאי. פוטנציאל הממברנה המיטוכונדריאלית (MMP, Ψm) הוא מרכזי בתהליכים אלה, כולל הנעת סינתזת ATP באמצעות זרחון חמצוני, הקלה על הובלת מטבוליטים ויונים על פני הממברנות המיטוכונדריאליות ותרומה ליצירת מיני חמצן תגובתיים (ROS)2,3. MMP משפיע גם על המורפולוגיה והדינמיקה המיטוכונדריאלית4, כולל מיטופגיה (פירוק סלקטיבי של המיטוכונדריה)5ואפופטוזיס (מוות תאי מתוכנת)6. שמירה על Ψm מתאים חיונית לתפקוד התאי; חוסר הוויסות שלו קשור לפתולוגיות רבות, כולל מחלות ניווניות, אי ספיקת לב וסרטן. השיטות הנוכחיות למדידת Ψm התבססו בעיקר על שימוש בצבעים קטיוניים ליפופיליים, כולל TMRM (טטרמתילרודמין מתיל אסטר), TMRE (טטרמתילרודמין אתיל אסטר), רודמין 123, ספרנין O, רודמין 800, DiOC6, JC-1 וכו'7. עם זאת, למולקולות פלואורסצנטיות אלו יש מספר מגבלות. צבעים אלה חסרים ספציפיות לתאים, רגישים למרווה, וחלקם רעילים. בנוסף, הם יכולים להתפזר עם הזמן, וכאשר ΔΨ המיטוכונדריאלי אובד, הם דולפים החוצה, מה שהופך אותם לבלתי מסוגלים להצביע על פוטנציאל הממברנה של מיטוכונדריה דה-פולריזציה. יתר על כן, צבעים מבוססי רודמין כמו TMRM ו-TMRE רגישים לטמפרטורה8, מה שמחייב התייחסות מדוקדקת להשפעות הטמפרטורה על הקרינה של הצבע, במיוחד בעת מדידת מתח הממברנה המיטוכונדריאלית במהלך פעילויות פיזיולוגיות הכוללות תרמוגנזה תאית.
מחווני מתח מקודדים גנטית (GEVIs), חלבונים המסוגלים לזהות שינויים בפוטנציאל הממברנה באמצעות אותות פלואורסצנטיים 9,10, התגלו ככלים רבי עוצמה לניטור פוטנציאל הממברנה במגוון הקשרים תאיים11. בעוד ש-GEVIs יושמו בהרחבה לחקר ממברנות פלזמה, חלה התקדמות מועטה בהתאמתם למדידת פוטנציאל הממברנה התוך-תאית, במיוחד עבור מיטוכונדריה. פרוטוקול זה מבקש לטפל בפער זה על ידי שימוש ב-GEVIs ממוקדי מיטוכונדריה שיכולים לנטר את פוטנציאל הממברנה המיטוכונדריאלית במבחנה וב-vivo. על ידי הוספת רצף אותות מיטוכונדריאלי ל-GEVIs הקיימים, ניתן למקד GEVI מתאים למיטוכונדריה12. אינדיקטורים פוטנציאליים מיטוכונדריאלים אלה (MPI) יספקו תובנות חדשות לגבי הפיזיולוגיה המיטוכונדריאלית ויציעו פוטנציאל משמעותי לחקר תפקוד המיטוכונדריה במצבי מחלה שונים in vivo, וישפרו את ההבנה שלנו כיצד דינמיקה מיטוכונדריאלית תורמת לתהליכים תאיים נורמליים ופתולוגיים כאחד.
Protocol
כל הטיפול והניסויים בבעלי חיים בוצעו בהתאם להנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת ג'נגג'ואו. עקר את כל המכשירים הכירורגיים לפני השימוש. עקוב אחר טכניקות אספטיות למניעת זיהום. לאחר שכל הנתונים נרכשו, החיות הומתו באמצעות מנת יתר של הרדמה ממליצה ואחריה עריפת ראשים.
1. יישומי מבחנה
- בניית פלסמיד
- השג את החיישן המואץ של פוטנציאל הפעולה 1 (ASAP1) וגנים ASAP3 מ-Addgene או סינתזה מהרצף. (ASAP1, מזהה הצטרפות NCBI: AHV90412.1, מזהה Addgene: 52519; ASAP3, מזהה Addgene: 132331).
- השתמש בפריימרים המפורטים בטבלה 1 עבור מבני פלסמיד.
- לביטוי בתאים, השתמש בווקטור EGFPN1 לבנייה.
- בתחילה, סנתז את רצף הגנים cox8 (NP_004065, חומצות אמינו 1-29) עם ארבע חזרות טנדם (4cox8) משני צדי אתרי הגבלה של NheI ו-XhoI. עכל גם את מקטע 4cox8 המסונתז וגם את וקטור EGFPN1 עם NheI ו-XhoI, ואחריו קשירה ליצירת וקטור 4cox8-EGFP.
- לאחר מכן, בצע הגברת PCR של רצף ASAP1 עם פריימר 1 ופריימר 2. עכל את שבר ה-ASAP1 ואת וקטור 4cox8-EGFP עם SalI ו-NotI, ואחריו קשירה ליצירת וקטור MPI-1 הסופי (MPI מייצג אינדיקטור פוטנציאל מיטוכונדריאלי).
הערה: המפה הווקטורית של CMV-MPI-1 מתוארת באיור 1. ניתן לגשת לרצף המפורט מ-NCBI (מזהה הצטרפות: PQ678920).
- לביטוי ספציפי בנוירונים, בצע הגברת PCR של רצף מקדם hSyn מפלסמיד AAV-hSyn-EGFP (NCBI Accession ID: MH458079, Addgene ID: 50465) באמצעות פריימר 3 ופריימר 4.
- עכל גם את רצף hSyn וגם את וקטור 4cox8-EGFP עם AseI ו-NheI, ואחריו קשירה ליצירת וקטור hSyn-4cox8-EGFP. לאחר מכן, בצע הגברת PCR של רצף ASAP3 עם פריימר 1 ופריימר 2.
- עכל את וקטור hSyn-4cox8-EGFP ואת רצף ASAP3 עם SalI ו-NotI, ואחריו קשירה ליצירת וקטור hSyn-MPI-2.
הערה: תנאי ה-PCR ישתנו בהתאם לאנזימים הספציפיים וטמפרטורות ההיתוך של הפריימר (Tm). תגובת PCR טיפוסית כוללת שלב דנטורציה ראשוני ב-95 מעלות צלזיוס למשך 30 שניות, ואחריו 25-35 מחזורי דנטורציה (95 מעלות צלזיוס, 10 שניות), חישול (55 מעלות צלזיוס, 30 שניות) והארכה (72 מעלות צלזיוס, 30 שניות/קילו-בייט). שלב הארכה אחרון ב-72 מעלות צלזיוס למשך 5 דקות מבטיח סינתזה מלאה של המוצר, ואחריו החזקה ב-4 מעלות צלזיוס. טמפרטורת החישול צריכה להיות כ-5 מעלות צלזיוס מתחת ל-Tm של הפריימרים. עיין בהוראות היצרן לקבלת פרמטרי PCR אופטימליים. הפריימרים עבור ASAP1 ו-ASAP3 זהים.
- הדמיה בתאים חיים
- הכן מדיום תרבית DMEM על ידי הוספת 10% סרום בקר עוברי ו-100 מ"ג/ליטר פניצילין/סטרפטומיצין למדיום.
- הכן ריאגנטים של טרנספקציה Ca2+ : 2.5 מול/ליטר CaCl2, 2x HEBS (274 מילימול/ליטר NaCl, 10 ממול/ליטר KCl, 1.4 ממול/ליטר Na2HPO4, 15 מילימול/ליטר D-גלוקוז, 42 מילימול/ליטר HEPES, pH 7.07).
- הכן את המאגר של Tyrode לשמירה על התאים במהלך ההדמיה (145 ממול/ליטר NaCl, 3 ממול/ליטר KCl, 10 ממול/ליטר HEPES, 10 ממול/ליטר גלוקוז, pH 7.4).
- תרבית תאי הלה בצלחת תרבית 35 מ"מ המוזנת במדיום תרבית DMEM באינקובטור עם טמפרטורה של 37 מעלות צלזיוס ואווירה של 5% CO2/95% אוויר. הוסף 2-3 כיסויים לכל מנה כדי לאפשר לתאים לצמוח עליהם.
- העבירו את תאי הלה בשיטת משקעי סידן פוספט.
- כדי להעביר תאים, התחל בהחלפת מדיום התרבות הישן ב-2 מ"ל של DEM ללא סרום. לאחר 35 דקות, הכינו את תמיסת ה-DNA/Ca2+ על ידי ערבוב של 10 מיקרוגרם של DNA, 4 מיקרוליטר של CaCl2 ו-ddH2O לנפח סופי של 40 מיקרוליטר בצינור מיקרו-צנטריפוגה.
- הוסף 40 מיקרוליטר של 2x HEBS לתמיסת DNA/Ca2+ טיפתית תוך ערבוב נמרץ. בועות אוויר עם פיפטה לתערובת כדי להקל על משקעי סידן פוספט.
- לאחר 25 דקות, הוסיפו 80 מיקרוליטר מתמיסת המשקעים הזו לצלחת עם התאים והחזירו אותה לחממה למשך 1-2 שעות נוספות. לאחר מכן, הסר את ה-DMEM שאינו בסרום ושטוף את התאים ב-15% גליצרול (מומס ב-PBS) למשך 2 דקות.
- לאחר שאיבת הגליצרול, הוסף 2 מ"ל של DMEM המכיל 10% FBS והמשך בתרבית התאים למשך 16-24 שעות.
- מניחים כיסויים עם תאים בתבנית תרבית של 35 מ"מ עם 2 מ"ל של מאגר טירוד וצובעים את התאים בצבע רודמין 800 על ידי הוספת 20 מיקרומול/ליטר רודמין 800 (מומס ב-ddH2O) לצלחת לריכוז סופי של 50 ננומול/ליטר.
- הכן מיקרוסקופ פלואורסצנטי והגדר אותו עם המסננים המתאימים ומקור האור כדי לעורר את החלבון עם מקור אור של 488 ננומטר ולאסוף את הפליטה בין 490-540 ננומטר. עורר את צבע הרודמין 800 עם מקור אור של 633 ננומטר ואסוף את הפליטה בין 650-720 ננומטר.
- הכינו תמיסת קרבוניל ציאניד m-chlorophenyl hydrazone (CCCP) ב-500 מיקרומטר (מלאי) והוסיפו לתאים לריכוז סופי של 5 מיקרומטר במהלך ההדמיה.
הערה: ה-pH של תמיסת 2x HEBS הוא חיוני ליעילות הטרנספקציה. יש להתאים בזהירות את ה-pH ל-7.07 עם נתרן הידרוקסיד מוצק. ה-pH לא יכול להיות נמוך מ-7.01 או גבוה מ-7.12.
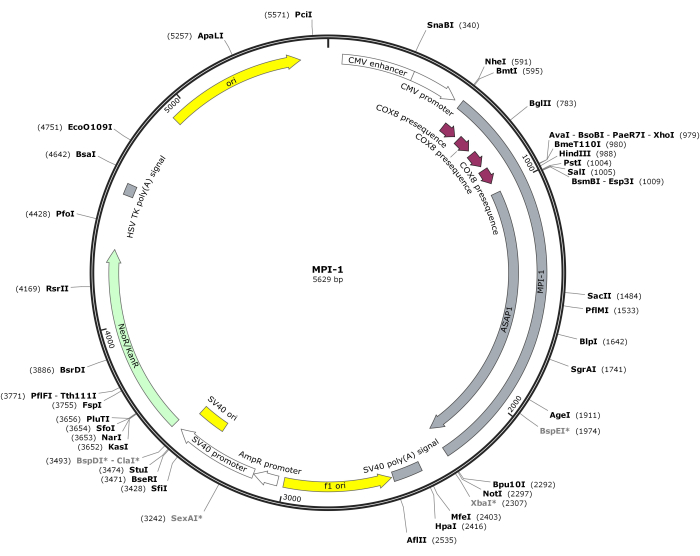
איור 1: מפה וקטורית של CMV-MPI-1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. יישומי in vivo
- מבנה פלסמיד
- לביטוי in vivo , השתמש בנגיף AAV לצורך התמרה. השג את עמוד השדרה המבטא עבור אריזות AAV (מזהה Addgene: 46954 או 26968), המכיל רצפי חזרות טרמינל הפוכות (ITR) עבור אריזת נגיף AAV.
- בצע הגברת PCR של וקטור hSyn-MPI-2 (משלב 1.1.4) באמצעות פריימרים 5 ו-7 בטבלה 1.
- בצע הגברת PCR שנייה באמצעות אותה תבנית ופריימרים 6 ו-8 בטבלה 1.
- בצע PCR סופי באמצעות המוצר מה-PCR הראשון והשני (שלבים 2.1.2 ו-2.1.3) כתבנית ופריימרים 5 ו-8 בטבלה 1, ויצירת רצף hSyn-MPI-2 הסופי.
- עכל את רצף hSyn-MPI-2 ואת עמוד השדרה של pAAV עם MluI ו-EcoRI, ולאחר מכן קשירה כדי ליצור את המבנה הסופי של pAAV-hSyn-MPI-2. המפה הווקטורית של pAAV-hSyn-MPI-2 מודגמת באיור 2. ניתן לגשת לרצף המפורט מ-NCBI (מזהה הצטרפות: PQ678919).
הערה: וקטור hSyn-MPI-2 מכיל אתר EcoRI פנימי שמקורו בעמוד השדרה המקורי של EGFPN1, אשר מוסר באמצעות פריימרים ששונו באסטרטגיית PCR חופפת (שלבים 2.1.2-2.1.4).
- הכנה והתמרה של וירוסים
- תרבית תאי HEK293t בצלחת תרבית של 100 מ"מ המוזנת במדיום תרבית DMEM של 10% FBS בחממה עם טמפרטורה של 37 מעלות צלזיוס ואטמוספירה של 5% CO2/95% אוויר כדי להגיע למפגש של 70%.
- העברה משותפת של תאי HEK293t עם פלסמיד גן AAV, קפסיד (pAAV-DJ או pAAV9), ופלסמידים מסייעים (pHelper) בשיטת משקעי סידן פוספט. כמות ה-DNA עבור כל פלסמיד הייתה כדלקמן: גן: 10 מיקרוגרם, pHelper: 11 מיקרוגרם, קפסיד: 9 מיקרוגרם. כמות מגיב הטרנספקציה: 12 מיקרוליטר של CaCl2, 120 מיקרוליטר של 2x HEBS.
- דגרו על התאים שעברו טרנספטציה לתקופה של 72 שעות כדי לאפשר ייצור נגיף.
- לאחר תקופת הדגירה, קצרו את התאים על ידי צנטריפוגה ב -400 גרם. שוטפים את התאים עם PBS פעמיים ומשרים את התא ב -400 מיקרוליטר של PBS.
- קצור וירוסים מתרחיף תאים בארבעה מחזורים של שיטות הקפאה-הפשרה (37 מעלות צלזיוס ו-80 מעלות צלזיוס). צנטריפוגה את הליזאט ב-13,500 × גרם ב-4 מעלות צלזיוס והשליכו את הגלולה. הסופרנטנט מכיל את נגיף ה-AAV.
- בצע PCR בזמן אמת כדי לקבוע את הטיטרציה של הנגיף המוכן. פרוטוקול מפורט לקביעת טיטרציה של AAV ניתן למצוא בכתובת https://www.addgene.org/protocols/aav-titration-qpcr-using-sybr-green-technology/.
- יש לאחסן את נגיף ה-AAV המוכן בטמפרטורה של -80 מעלות צלזיוס.
- הזרקת וירוס סטריאוטקטית
- להרדים עכבר זכר C57/BL בוגר במשקל 24-26 גרם עם 3% נתרן פנטוברביטל באמצעות הזרקה תוך-צפקית במינון של 30 מ"ג/ק"ג. לאחר ההרדמה, קבע את העכברים על מכשיר סטריאוטקסי כדי לשמור על מיקום יציב לאורך כל ההליך.
- יש למרוח משחת עיניים וטרינרית כדי להגן על העיניים מפני נזקי אור ולשמור על לחות העיניים.
- השתמש בקרם הסרת שיער כדי להסיר שיער על ראש העכבר ולחשוף את הקרקפת.
- פתח את הקרקפת באמצעות מספריים לניתוח וחשוף את הגולגולת. טפלו בגולגולת עם 3% מי חמצן כדי לעקר ולדמיין ציוני דרך מרכזיים כמו אתרי ברגמה ולמבדה.
- כוונן את מיקום ראש העכבר כדי להבטיח שהגולגולת אופקית.
- השתמש במושך מיקרופיפטות הניתן לתכנות כדי למשוך פיפטות זכוכית לצורה ולגודל הרצויים להזרקות מדויקות. מלאו את המיקרופיפטה מזכוכית בשמן פרפין.
- מקם את המיקרו-פיפטה באתר היעד. בפרוטוקול זה, המטרה היא אזור M2 בצד ימין, תוך שימוש בקואורדינטות הבאות: AP (קדמי-אחורי), +1.94 מ"מ; ML (בינוני), +0.75 מ"מ; DV (דורסובנטרלי), -1.5 מ"מ.
- השתמש במקדחה חשמלית כדי ליצור חור קטן בגולגולת באתר המטרה.
- שאפו 500 נ"ל של וירוס בטיטר של 1.5 x 1011 עותקי גנום למיליליטר (GC/mL) דרך קצה המיקרופיפטה. הזרקת 500 nL של וירוס לאתר היעד באמצעות משאבת הזרקה בקצב זרימה של 100 nL/min.
- לאחר ההזרקה, השאירו את הפיפטה במקומה למשך כ-5 דקות כדי לאפשר דיפוזיה לפני שתחזירו אותה בזהירות.
- השתלת סיב אופטי (קוטר 200 מיקרומטר, צמצם מספרי 0.37, אורך 2 מ"מ) לאתר ההזרקה.
- אבטח את הסיב האופטי במקומו באמצעות מלט דנטלי.
- לתפור את קרקפת העכבר בחוט ניילון 5-0 (מחט אסתטית Δ1/2 4x12) ולהחזיר אותו לכלוב הביתי שלו.
- הנח את כלוב הבית על כרית חימום כדי לשמור על טמפרטורת הגוף של העכבר עד שהוא מתאושש לחלוטין מההרדמה.
- כבה את כרית החימום ברגע שהחיה מתחילה להסתובב. אפשר עוד שעתיים של הסתגלות לטמפרטורת החדר (RT) לפני העברת העכבר למתקן הדיור.
- עכבר הבית במחזור אור של 12 שעות/חושך של 12 שעות בטמפרטורה של 22 מעלות צלזיוס עם גישה אד ליביטום למזון ומים למשך 2-3 שבועות כדי לאפשר ביטוי ויראלי.
- פוטומטריית סיבים
- חבר את הסיב האופטי המושתל בעכבר לכבל אופטי.
- חבר את הקצה השני של הכבל האופטי לגלאי שישמש ללכידת נתוני ההדמיה.
- לצורך הדמיה, השתמש במקור אור כדי לעורר את החלבונים באורך גל של 488 ננומטר. הגדר את הגלאי לאיסוף האור הנפלט באורכי גל הנעים בין 490 ננומטר ל-540 ננומטר.
- התאם את עוצמת אור העירור כדי לייעל את האות מבלי לגרום נזק לרקמת המוח.
- שנה את הרווחים של אות הפלואורסצנט כדי להבטיח אות ברור וחזק שנלכד על ידי הגלאי.
- כדי למנוע הלבנה מהירה של הקרינה, שתפחית את איכות ההדמיה, כוונן את עוצמת האור ואת הרווח של האות הפלואורסצנטי לפי הצורך.
- ערכו מבחן התנהגות עכברים.
- עקוב באופן רציף אחר תהליך ההדמיה במהלך בדיקת ההתנהגות.
- ניתוח נתונים
- השתמש ב-Python וב-GNUplot כדי ליצור מפת חום של ניסויים ניסיוניים לייצוג חזותי של הנתונים. קודי המקור מסופקים בקובץ משלים 1.
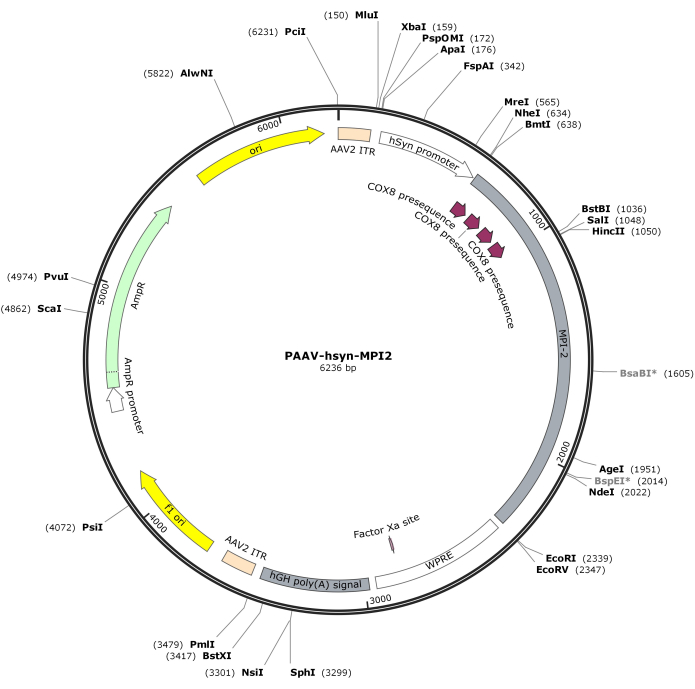
איור 2: מפה וקטורית של AAV-hSyn-MPI-2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
לאחר בניית הפלסמיד CMV-MPI-1, יכולתו למקד את המיטוכונדריה נבדקה בתאי הלה באמצעות הסמן המיטוכונדריאלי רודמין 800 לצביעה. ניסויי קו-לוקליזציה הראו רמה גבוהה של חפיפה בין אות הקרינה של MPI-1 לבין האות מרודאמין 800, מה שמצביע על כך ש-MPI-1 ממוקם בהצלחה במיטוכונדריה (איור 3
Discussion
מתח הממברנה המיטוכונדריאלית נשמר על -120--180 mV בתנאי מנוחה ומשתנה עם שינויים במצב המטבולי. נכון לעכשיו, ניתן לבצע מדידה של פוטנציאל הממברנה המיטוכונדריאלית בשיטות אלקטרופיזיולוגיות ושיטות צבע פלואורסצנטיות. הידוק טלאי מיטוכונדריה דורש בידוד של מיטוכונדריה והרס מבנים תא?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לתמיכה של הקרן הלאומית למדעי הטבע (NSF) של סין: JSK (32071137 ו-92054103) ולמימון צוות המחקר והחדשנות המדעי של בית החולים המסונף הראשון של אוניברסיטת ג'נגג'ואו: JSK (ZYCXTD2023014).
Materials
| Name | Company | Catalog Number | Comments |
| BamHI | Thermo | FD0054 | |
| Calcium chloride | Sigma | C4901 | |
| CCCP | Sigma | C2759 | |
| Centrifuge | eppendorf | 5430R | |
| Centrifuge (cell culture) | eppendorf | 5810R | |
| CO2 cell incubator | ESCO | 170L IR Sensor | |
| Coverslips | Glaswarenfabrik Karl Hecht GmbH & Co.KG | 92100100030 | |
| Dental adhensive resin cement | Sun medical company, LTD. | Super-Bond C&B Kit | |
| D-glucose | Sigma | G7021 | |
| DNA Ligation Kit Ver. 2.1 | Takara | 6022 | |
| Dulbecco's modified Eagle medium | Gibco | 11965092 | |
| Electric drill | RWD Instruments | 78001 | |
| Fetal bovine serum | Gibco | A5670701 | |
| Fiber optic cannula | RWD Instruments | R-FOC-L200C-39NA | |
| Fiber photometry detector | Thinker | QAXK_FPS-TC-MC-LED | |
| Fluorescence microscope | Olympus | IX83 | |
| Glass pipette (for injection) | Drummond Scientific company | 3.5" Drummond # 3-000-203-G/X | |
| HEK293t | ATCC | Cat# CRL-3216 | |
| Hela cells | ATCC | Cat# CCL-2 | |
| HEPES | Sigma | H3375 | |
| Injection pump | Drummond Scientific company | 3-000-207 | |
| Isoflurane | RWD Instruments | R510-22 | |
| Laser scanning confocal microscope | Zeiss | LSM980 | |
| MluI | Thermo | FD0564 | |
| NheI | Thermo | FD0974 | |
| Optical fibers | RWD Instruments | R-FC-L-N3-200-L1 | |
| Paraffin oil | Sangon | B500301 | |
| PCR thermal Cycler | analytik jena | Biometra Tone 96G | |
| Pentobarbital sodium | Sinopharm Chemical Reagent Co.LTD | 57-33-0 | |
| Potassium chloride | Sigma | P5405 | |
| PrimeSTAR HS DNA Polymerase | Takara | R010A | |
| Programmable micropipette puller | Sutter Instruments | P2000 | |
| Quick self-curing acrylic resin | Yamahachi | V-PINK | |
| Real-time PCR thermal Cycler | analytik jena | qTOWER³ auto | |
| Rhodamine 800 | Sigma | 83701 | |
| SalI | Thermo | FD0644 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium phosphate dibasic | Sigma | S9763 | |
| Stereotaxic apparatus | RWD Instruments | E06354 | |
| Veterinary ophthalmic ointment | Puralube | NA | |
| XhoI | Thermo | FD0694 |
References
- Vyas, S., Zaganjor, E., Haigis, M. C. Mitochondria and cancer. Cell. 166 (3), 555-566 (2016).
- Dzbek, J., Korzeniewski, B. Control over the contribution of the mitochondrial membrane potential (ΔΨ) and proton gradient (ΔpH) to the protonmotive force (Δp): IN SILICO STUDIES. J Biol Chem. 283 (48), 33232-33239 (2008).
- O'Rourke, B., Cortassa, S., Aon, M. A. Mitochondrial ion channels: Gatekeepers of life and death. Physiology. 20 (5), 303-315 (2005).
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol. 22 (1), 79-99 (2006).
- Jin, S. M., Lazarou, M., Wang, C., Kane, L. A., Narendra, D. P., Youle, R. J. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. J Cell Biol. 191 (5), 933-942 (2010).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Meng, X. -. Y., et al. A sensitive mitochondrial thermometry 2.0 and the availability of thermogenic capacity of brown adipocyte. Front Physiol. 13, 977431 (2022).
- Kaestner, L., et al. Genetically encoded voltage indicators in circulation research. Int J Mol Sci. 16 (9), 21626-21642 (2015).
- Yang, H. H., St-Pierre, F. Genetically encoded voltage indicators: Opportunities and challenges. J Neurosci. 36 (39), 9977 (2016).
- Sepehri Rad, M., Cohen, L. B., Braubach, O., Baker, B. J. Monitoring voltage fluctuations of intracellular membranes. Sci Rep. 8 (1), 6911 (2018).
- Yang, R. -. Z., Wang, D. -. D., Li, S. -. M., Liu, P. -. P., Kang, J. -. S. Development and application of a mitochondrial genetically encoded voltage indicator in narcosis. Neurosci Bull. 40 (10), 1529-1544 (2024).
- Kumari, A., Nguyen, D. M., Garg, V. Patch-clamp technique to study mitochondrial membrane biophysics. J Gen Physiol. 155 (8), e202313347 (2023).
- Bayne, A. N., Dong, J., Amiri, S., Farhan, S. M. K., Trempe, J. -. F. MTSviewer: A database to visualize mitochondrial targeting sequences, cleavage sites, and mutations on protein structures. PLoS One. 18 (4), e0284541 (2023).
- Kim, B. B., et al. A red fluorescent protein with improved monomericity enables ratiometric voltage imaging with ASAP3. Sci Rep. 12 (1), 3678 (2022).
- Evans, S. W., et al. A positively tuned voltage indicator for extended electrical recordings in the brain. Nat Methods. 20 (7), 1104-1113 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved