Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mitokondriyal Membran Potansiyelinin İn Vivo Olarak Genetik Olarak Kodlanmış Bir Voltaj Göstergesi Kullanılarak Ölçülmesi
Bu Makalede
Özet
Bu protokol, mitokondri hedefli genetik olarak kodlanmış voltaj göstergelerinin (GEVI'ler) uygulamasını açıklar. Bu GEVI'ler, mitokondriyal membran potansiyelinin spesifik, in vivo ve gerçek zamanlı olarak izlenmesini sağlayarak geleneksel mitokondriyal membran potansiyel boyalarına göre önemli bir avantaj sunar.
Özet
Mitokondriyal membran potansiyeli (MMP, ΔΨm), ATP sentezi, iyon taşınması, reaktif oksijen türleri (ROS) üretimi ve çekirdek tarafından kodlanan proteinlerin içe aktarılması dahil olmak üzere mitokondriyal fonksiyonlar için kritik öneme sahiptir. ΔΨm'yi ölçmek için mevcut yöntemler tipik olarak Rhodamine 800 ve tetrametilrodamin metil ester (TMRM) gibi lipofilik katyon boyaları kullanır, ancak bunlar düşük özgüllük ile sınırlıdır ve in vivo uygulamalar için pek uygun değildir. Bu sınırlamaları ele almak için, genetik olarak kodlanmış voltaj göstergelerini (GEVI'ler) kullanan yeni bir protokol geliştirdik. Membran potansiyel değişikliklerine yanıt olarak floresan sinyaller üreten genetik olarak kodlanmış voltaj göstergeleri (GEVI'ler), plazma membranı ve nöronal potansiyelleri izlemek için önemli bir potansiyel göstermiştir. Bununla birlikte, mitokondriyal zarlara uygulamaları keşfedilmemiştir. Burada, hücrelerdeki ve canlı hayvanların motor korteksindeki ΔΨm dalgalanmalarını tespit edebilen protein bazlı mitokondriyal hedefli GEVI'ler geliştirdik. Mitokondriyal potansiyel göstergesi (MPI), hem normal hem de patolojik koşullar altında mitokondriyal fonksiyonu araştırmak için bir yöntem sağlayarak, ΔΨm dinamiklerini gerçek zamanlı olarak incelemek için invaziv olmayan bir yaklaşım sunar.
Giriş
Mitokondri, ökaryotik hücrelerde temel organellerdir ve adenozin trifosfat (ATP) üretimi yoluyla birincil enerji tedarikçileri olarak hizmet ederken aynı zamanda metabolit sentezi, kalsiyum iyonları tamponlama, ısı üretimi ve hücre sağkalımının düzenlenmesi gibi çeşitli diğer önemli işlevleri yerine getirir1. Rolleri, hücresel homeostazın korunmasına yardımcı oldukları beyin ve kalp gibi yüksek metabolik dokularda özellikle kritiktir. Mitokondriyal membran potansiyeli (MMP, Ψm), oksidatif fosforilasyon yoluyla ATP sentezini yönlendirmek, metabolitlerin ve iyonların mitokondriyal membranlar boyunca taşınmasını kolaylaştırmak ve reaktif oksijen türlerinin (ROS) oluşumuna katkıda bulunmak dahil olmak üzere bu süreçlerin merkezinde yer alır2,3. MMP ayrıca mitofaji (mitokondrinin seçici bozunması)5ve apoptoz (programlanmış hücre ölümü)6 dahil olmak üzere mitokondriyal morfolojiyi ve dinamikleri4 etkiler. Hücresel fonksiyon için uygun bir Ψm'nin korunmasıesastır; Düzensizliği, nörodejeneratif hastalıklar, kalp yetmezliği ve kanser dahil olmak üzere çok sayıda patoloji ile bağlantılıdır. Ψm ölçümü için mevcut yöntemler esas olarak TMRM (tetrametilrodamin metil ester), TMRE (tetrametilrodamin etil ester), Rhodamine 123, Safranin O, Rhodamine 800, DiOC6, JC-1 vb. dahil olmak üzere lipofilik katyonik boyaların kullanımına dayanıyordu.7. Bununla birlikte, bu floresan moleküllerinin çeşitli sınırlamaları vardır. Bu boyalar hücre özgüllüğünden yoksundur, söndürmeye karşı hassastır ve bazıları toksiktir. Ek olarak, zamanla yayılabilirler ve mitokondriyal ΔΨ kaybolduğunda dışarı sızarlar ve depolarize mitokondrinin zar potansiyelini gösteremezler. Ayrıca, TMRM ve TMRE gibi rodamin bazlı boyalar sıcaklığaduyarlıdır 8, bu da özellikle hücresel termojenezi içeren fizyolojik aktiviteler sırasında mitokondriyal membran voltajını ölçerken, boya floresansı üzerindeki sıcaklık etkilerinin dikkatli bir şekilde değerlendirilmesini gerektirir.
Genetik olarak kodlanmış voltaj göstergeleri (GEVI'ler), floresan sinyaller 9,10 aracılığıyla zar potansiyel değişikliklerini tespit edebilen proteinler, çeşitli hücresel bağlamlarda zar potansiyellerini izlemek için güçlü araçlar olarak ortaya çıkmıştır11. GEVI'ler plazma zarlarını incelemek için yaygın olarak uygulanmış olsa da, özellikle mitokondri için hücre içi zar potansiyellerini ölçmek için bunların uyarlanmasında çok az ilerleme kaydedilmiştir. Bu protokol, in vitro ve in vivo olarak mitokondriyal membran potansiyelini izleyebilen mitokondriyal hedefli GEVI'leri kullanarak bu boşluğu gidermeyi amaçlamaktadır. Mevcut GEVI'lere mitokondriyal sinyal dizisi ekleyerek, mitokondri12'ye uygun GEVI hedeflenebilir. Bu mitokondriyal potansiyel göstergeleri (MPI), mitokondriyal fizyolojiye yeni bakış açıları sağlayacak ve mitokondriyal dinamiklerin hem normal hem de patolojik hücresel süreçlere nasıl katkıda bulunduğuna dair anlayışımızı geliştirerek, in vivo olarak çeşitli hastalık durumlarında mitokondriyal fonksiyonu keşfetmek için önemli bir potansiyel sunacaktır.
Protokol
Tüm hayvan bakımı ve deneyleri, Zhengzhou Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi yönergelerine uygun olarak gerçekleştirildi. Kullanmadan önce tüm cerrahi aletleri sterilize edin. Enfeksiyonu önlemek için aseptik teknikleri izleyin. Tüm veriler elde edildikten sonra, hayvanlara aşırı dozda inhalan anestezi kullanılarak ötenazi yapıldı ve ardından dekapitasyon yapıldı.
1. İn vitro uygulamalar
- Plazmid yapımı
- Addgene'den hızlandırılmış aksiyon potansiyelleri 1 (ASAP1) ve ASAP3 genleri sensörünü elde edin veya diziden sentezleyin. (ASAP1, NCBI Erişim Kimliği: AHV90412.1, Addgene Kimliği: 52519; ASAP3, Addgene ID: 132331).
- Plazmid yapıları için Tablo 1'de listelenen primerleri kullanın.
- Hücrelerde ifade için, inşaat için EGFPN1 vektörünü kullanın.
- Başlangıçta, cox8 gen dizisini (NP_004065, amino asitler 1-29) NheI ve XhoI kısıtlama bölgeleri ile çevrili dört tandem tekrarı (4cox8) ile sentezleyin. Hem sentezlenen 4cox8 fragmanını hem de EGFPN1 vektörünü NheI ve XhoI ile sindirin, ardından 4cox8-EGFP vektörünü oluşturmak için ligasyon yapın.
- Daha sonra, primer 1 ve primer 2 ile ASAP1 dizisinin PCR amplifikasyonunu gerçekleştirin. ASAP1 fragmanını ve 4cox8-EGFP vektörünü SalI ve NotI ile sindirin, ardından son MPI-1 vektörünü oluşturmak için ligasyon yapın (MPI, mitokondriyal potansiyel göstergesi anlamına gelir).
NOT: CMV-MPI-1'in vektör haritası Şekil 1'de gösterilmiştir. Ayrıntılı diziye NCBI'den (Erişim Kimliği: PQ678920) erişilebilir.
- Nöronlarda spesifik ekspresyon için, primer 3 ve primer 4 kullanarak AAV-hSyn-EGFP plazmidinden (NCBI Katılım Kimliği: MH458079, Addgene ID: 50465) hSyn promotör dizisinin PCR amplifikasyonunu gerçekleştirin.
- Hem hSyn dizisini hem de 4cox8-EGFP vektörünü AseI ve NheI ile sindirin, ardından hSyn-4cox8-EGFP vektörünü oluşturmak için ligasyon yapın. Daha sonra, primer 1 ve primer 2 ile ASAP3 dizisinin PCR amplifikasyonunu gerçekleştirin.
- hSyn-4cox8-EGFP vektörünü ve ASAP3 dizisini SalI ve NotI ile sindirin, ardından hSyn-MPI-2 vektörünü oluşturmak için ligasyon yapın.
NOT: PCR koşulları, spesifik enzimlere ve primer erime sıcaklıklarına (Tm) bağlı olarak değişecektir. Tipik bir PCR reaksiyonu, 30 saniye boyunca 95 ° C'de bir ilk denatürasyon adımını, ardından 25-35 döngü denatürasyon (95 ° C, 10 sn), tavlama (55 ° C, 30 s) ve uzatma (72 ° C, 30 s / kb) içerir. 72 °C'de 5 dakika boyunca son bir uzatma adımı, tam ürün sentezi sağlar ve ardından 4 °C'de bekletme yapılır. Tavlama sıcaklığı, astarların Tm'sinin yaklaşık 5 °C altında olmalıdır. Optimum PCR parametreleri için üreticinin talimatlarına bakın. ASAP1 ve ASAP3 için primerler aynıdır.
- Canlı hücrelerde görüntüleme
- Ortama %10 fetal sığır serumu ve 100 mg/L penisilin/streptomisin ekleyerek DMEM kültür ortamını hazırlayın.
- Ca2+ transfeksiyon reaktifleri hazırlayın: 2,5 mol/L CaCl2, 2x HEBS (274 mmol/L NaCl, 10 mmol/L KCl, 1,4 mmol/L Na2HPO4, 15 mmol/L D-glikoz, 42 mmol/L HEPES, pH 7.07).
- Görüntüleme sırasında hücreleri korumak için Tyrode tamponunu hazırlayın (145 mmol/L NaCl, 3 mmol/L KCl, 10 mmol/L HEPES, 10 mmol/L Glikoz, pH 7.4).
- 37 °C sıcaklıkta ve %5 CO2/95 hava atmosferinde bir inkübatörde DMEM kültür ortamı ile beslenen 35 mm'lik bir kültür kabında Hela hücrelerinin kültürü. Hücrelerin üzerlerinde büyümesine izin vermek için tabak başına 2-3 lamel ekleyin.
- Hela hücrelerini kalsiyum fosfat çökeltme yöntemiyle transfekte edin.
- Hücreleri transfekte etmek için, eski kültür ortamını 2 mL serumsuz DMEM ile değiştirerek başlayın. 35 dakika sonra, bir mikrosantrifüj tüpünde 10 μg DNA, 4 μLCaCl2 ve ddH2O'yu 40 μL'lik bir nihai hacme karıştırarak DNA / Ca2 + çözeltisini hazırlayın.
- Kuvvetlice karıştırırken DNA/Ca 2+ çözeltisine damla damla 40 μL2x HEBS ekleyin. Kalsiyum fosfat çökelmesini kolaylaştırmak için karışıma bir pipetle hava püskürtün.
- 25 dakika sonra, bu çökelti çözeltisinden 80 μL'yi hücrelerle birlikte tabağa ekleyin ve 1-2 saat daha inkübatöre geri koyun. Daha sonra, serum olmayan DMEM'i çıkarın ve hücreleri 2 dakika boyunca% 15 gliserol (PBS'de çözülmüş) ile durulayın.
- Gliserolü aspire ettikten sonra,% 10 FBS içeren 2 mL DMEM ekleyin ve hücreleri 16-24 saat boyunca kültürlemeye devam edin.
- Hücreli lamelleri 2 mL Tyrode tamponu içeren 35 mm'lik bir kültür kabına yerleştirin ve tabağa 20 μmol/L rodamin 800 (ddH 2 O içinde çözülmüş) ekleyerek hücreleri rodamin800boyası ile 50 nmol/L'lik bir nihai konsantrasyona kadar boyayın.
- Bir floresan mikroskobu hazırlayın ve proteini 488 nm ışık kaynağı ile uyarmak ve 490-540 nm arasındaki emisyonu toplamak için uygun filtreler ve ışık kaynağı ile ayarlayın. Rodamin 800 boyasını 633 nm ışık kaynağı ile uyarın ve 650-720 nm arasındaki emisyonu toplayın.
- 500 μM'de (stok) bir karbonil siyanür m-klorofenil hidrazon (CCCP) çözeltisi hazırlayın ve görüntüleme sırasında hücrelere 5 μM'lik bir nihai konsantrasyona ekleyin.
NOT: 2x HEBS çözeltisinin pH'ı, transfeksiyon verimliliği için çok önemlidir. PH, katı sodyum hidroksit ile dikkatlice 7.07'ye ayarlanmalıdır. PH 7.01'den düşük veya 7.12'den yüksek olamaz.
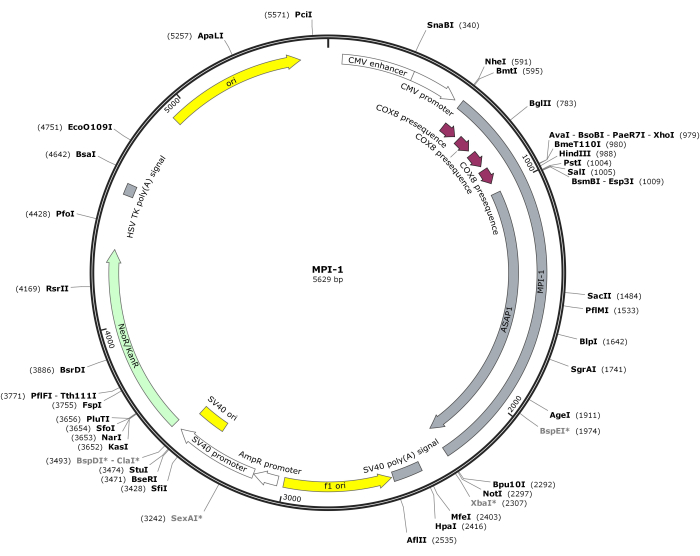
Resim 1: CMV-MPI-1'in vektörel haritası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. İn vivo uygulamalar
- Plazmid yapısı
- In vivo ekspresyon için, iletim için AAV virüsü kullanın. AAV virüsü paketlemesi için ters terminal tekrarları (ITR) dizileri içeren AAV paketlemesi için ifade etme omurgasını edinin (Addgene ID: 46954 veya 26968).
- Tablo 2'deki 5 ve 7 primerlerini kullanarak hSyn-MPI-2 vektörünün (adım 1.1.4'ten itibaren) PCR amplifikasyonunu gerçekleştirin.
- Aynı şablonu ve Tablo 6'deki 8 ve 1 numaralı primerleri kullanarak ikinci bir PCR amplifikasyonu gerçekleştirin.
- Şablon olarak birinci ve ikinci PCR'den (adım 2.1.2 ve 2.1.3) ürünü ve Tablo 5'deki 8 ve 1 numaralı primerleri kullanarak son hSyn-MPI-2 dizisini oluşturarak son bir PCR gerçekleştirin.
- hSyn-MPI-2 dizisini ve pAAV omurgasını MluI ve EcoRI ile sindirin, ardından son pAAV-hSyn-MPI-2 yapısını oluşturmak için ligasyon yapın. pAAV-hSyn-MPI-2'nin vektör haritası Şekil 2'de gösterilmiştir. Ayrıntılı diziye NCBI'den (Erişim Kimliği: PQ678919) erişilebilir.
NOT: hSyn-MPI-2 vektörü, orijinal EGFPN1 omurgasından kaynaklanan dahili bir EcoRI bölgesi içerir ve bu, örtüşen bir PCR stratejisinde modifiye edilmiş primerler kullanılarak çıkarılır (adım 2.1.2-2.1.4).
- Virüs hazırlama ve iletimi
- 37 °C sıcaklıkta ve %5 CO2/95 hava atmosferinde bir inkübatörde %10 FBS DMEM kültür ortamı ile beslenen 100 mm'lik bir kültür kabında HEK293t hücrelerinin kültürlenmesi, %70'lik bir birleşmeye ulaşır.
- Kalsiyum fosfat çökeltme yöntemini kullanarak HEK293t hücrelerini AAV gen plazmidi, kapsid (pAAV-DJ veya pAAV9) ve yardımcı plazmitler (pHelper) ile birlikte transfekte edin. Her bir plazmit için DNA miktarı şu şekildedir: gen: 10 μg, pHelper: 11 μg, kapsid: 9 μg. Transfeksiyon reaktif miktarı: 12 μL CaCl2, 120 μL 2x HEBS.
- Virüs üretimini sağlamak için transfekte edilmiş hücreleri 72 saatlik bir süre boyunca inkübe edin.
- Kuluçka döneminden sonra, hücreleri 400 g'da santrifüj ile hasat edin. Hücreleri PBS ile 2 kez durulayın ve hücreyi 400 μL PBS'de yeniden süspanse edin.
- Dört döngü donma-çözülme yöntemiyle (37 ° C ve -80 ° C) hücre süspansiyonundan virüsleri hasat edin. Lizatı 4 °C'de 13.500 × g'da santrifüjleyin ve peleti atın. Süpernatant, AAV virüsünü içerir.
- Hazırlanan virüsün titrasyonunu belirlemek için gerçek zamanlı PCR gerçekleştirin. AAV titrasyon tayini için ayrıntılı protokol https://www.addgene.org/protocols/aav-titration-qpcr-using-sybr-green-technology/ adresinde bulunabilir.
- Hazırlanan AAV virüsünü alın ve -80 ° C'de saklayın.
- Stereotaktik virüs enjeksiyonu
- 30 mg / kg'lık bir dozda intraperitoneal enjeksiyon yoluyla% 3 pentobarbital sodyum ile 24-26 g ağırlığındaki yetişkin bir C57 / BL erkek fareyi anestezikleştirin. Anestezi uygulandıktan sonra, prosedür boyunca sabit bir pozisyon sağlamak için fareleri stereotaksik bir cihaza sabitleyin.
- Gözleri ışık hasarından korumak ve gözleri nemli tutmak için veteriner oftalmik merhem sürün.
- Farenin kafasındaki tüyleri almak ve kafa derisini ortaya çıkarmak için tüy dökücü krem kullanın.
- Ameliyat makası kullanarak kafa derisini açın ve kafatasını ortaya çıkarın. Bregma ve lambda bölgeleri gibi önemli yer işaretlerini sterilize etmek ve görselleştirmek için kafatasına %3 hidrojen peroksit uygulayın.
- Kafatasının yatay olduğundan emin olmak için fare kafasının konumunu ayarlayın.
- Hassas enjeksiyonlar için cam pipetleri istenen şekil ve boyuta çekmek için programlanabilir bir mikropipet çektirme kullanın. Cam mikropipeti parafin yağı ile doldurun.
- Mikropipeti hedef bölgeye yerleştirin. Bu protokolde hedef, aşağıdaki koordinatları kullanarak sağ taraftaki M2 bölgesidir: AP (ön-arka), +1.94 mm; ML (mediolateral), +0.75 mm; DV (dorsoventral), -1.5 mm.
- Hedef bölgedeki kafatasında küçük bir delik açmak için elektrikli bir matkap kullanın.
- Mikropipetin ucundan mililitre (GC / mL) başına 1.5 x 10 11 Genom Kopyası titresinde500 nL virüs aspire edin. 100 nL / dak akış hızında bir enjeksiyon pompası kullanarak hedef bölgeye 500 nL virüs enjekte edin.
- Enjeksiyondan sonra, dikkatlice geri çekmeden önce difüzyona izin vermek için pipeti yaklaşık 5 dakika yerinde bırakın.
- Enjeksiyon bölgesine optik fiber (200 μm çap, 0.37 sayısal açıklık, 2 mm uzunluk) implante edin.
- Optik fiberi diş çimentosu kullanarak yerine sabitleyin.
- Farenin kafa derisini 5-0 naylon iplikle (estetik iğne Δ1/2 4x12) dikin ve ev kafesine geri koyun.
- Anesteziden tamamen iyileşene kadar farenin vücut ısısını korumak için ev kafesini bir ısıtma yastığının üzerine yerleştirin.
- Hayvan hareket etmeye başladığında ısıtma yastığını kapatın. Fareyi muhafaza tesisine aktarmadan önce oda sıcaklığına (RT) 2 saat daha alışmaya izin verin.
- 22 ° C'de 12 saat aydınlık / 12 saat karanlık döngüsünde ev faresi, viral ekspresyona izin vermek için 2-3 hafta boyunca yiyecek ve suya ad libitum erişimi ile.
- Fiber fotometri
- Fareye implante edilen optik fiberi bir optik kabloya bağlayın.
- Optik kablonun diğer ucunu, görüntüleme verilerini yakalamak için kullanılacak bir dedektöre takın.
- Görüntüleme için, proteinleri 488 nm dalga boyunda uyarmak için bir ışık kaynağı kullanın. Dedektörü, yayılan ışığı 490 nm ile 540 nm arasında değişen dalga boylarında toplayacak şekilde ayarlayın.
- Beyin dokusuna zarar vermeden sinyali optimize etmek için uyarma ışığının yoğunluğunu ayarlayın.
- Dedektör tarafından net ve güçlü bir sinyalin yakalandığından emin olmak için floresan sinyalin kazançlarını değiştirin.
- Görüntülemenin kalitesini düşürecek olan floresansın hızlı bir şekilde ağartılmasını önlemek için, ışık yoğunluğuna ve floresan sinyalinin kazancına gerektiği gibi ince ayar yapın.
- Fare davranış testi yapın.
- Davranış testi sırasında görüntüleme sürecini sürekli olarak izleyin.
- Veri analizi
- Verilerin görsel bir temsili için deneysel denemelerin bir ısı haritasını oluşturmak için Python ve GNUplot kullanın. Kaynak kodları Ek Dosya 1'de verilmiştir.
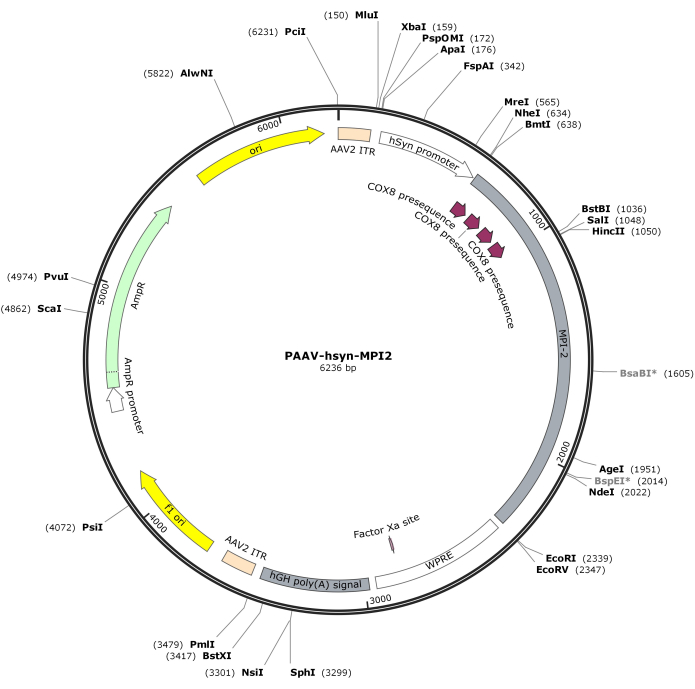
Resim 2: AAV-hSyn-MPI-2'nin vektör haritası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
CMV-MPI-1 plazmidini oluşturduktan sonra, mitokondriyi hedefleme yeteneği, boyama için mitokondriyal markör Rhodamine 800 kullanılarak Hela hücrelerinde test edildi. Kolokalizasyon deneyleri, MPI-1'in floresan sinyali ile Rhodamine 800'den gelen sinyal arasında yüksek derecede örtüşme gösterdi, bu da MPI-1'in mitokondriye başarılı bir şekilde lokalize olduğunu gösterdi (Şekil 3).
Tartışmalar
Mitokondriyal membran voltajı, dinlenme koşulları altında -120-180 mV'de tutulur ve metabolik durumdaki değişikliklerle dalgalanır. Şu anda, mitokondriyal membran potansiyelinin ölçümü elektrofizyolojik yöntemler ve floresan boya yöntemleri kullanılarak gerçekleştirilebilmektedir. Mitokondriyal yama klemplemesi, mitokondrinin izolasyonunu ve hücresel yapıların tahrip edilmesini gerektirir13. Bu yaklaşım, fizyolojik koşullardan sapan ölçüm...
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Çin Ulusal Doğa Bilimleri Vakfı'nın (NSF) desteğine teşekkür ederiz: JSK (32071137 ve 92054103) ve Zhengzhou Üniversitesi Birinci Bağlı Hastanesi JSK (ZYCXTD2023014) Bilimsel Araştırma ve İnovasyon Ekibi için Finansman.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BamHI | Thermo | FD0054 | |
| Calcium chloride | Sigma | C4901 | |
| CCCP | Sigma | C2759 | |
| Centrifuge | eppendorf | 5430R | |
| Centrifuge (cell culture) | eppendorf | 5810R | |
| CO2 cell incubator | ESCO | 170L IR Sensor | |
| Coverslips | Glaswarenfabrik Karl Hecht GmbH & Co.KG | 92100100030 | |
| Dental adhensive resin cement | Sun medical company, LTD. | Super-Bond C&B Kit | |
| D-glucose | Sigma | G7021 | |
| DNA Ligation Kit Ver. 2.1 | Takara | 6022 | |
| Dulbecco's modified Eagle medium | Gibco | 11965092 | |
| Electric drill | RWD Instruments | 78001 | |
| Fetal bovine serum | Gibco | A5670701 | |
| Fiber optic cannula | RWD Instruments | R-FOC-L200C-39NA | |
| Fiber photometry detector | Thinker | QAXK_FPS-TC-MC-LED | |
| Fluorescence microscope | Olympus | IX83 | |
| Glass pipette (for injection) | Drummond Scientific company | 3.5" Drummond # 3-000-203-G/X | |
| HEK293t | ATCC | Cat# CRL-3216 | |
| Hela cells | ATCC | Cat# CCL-2 | |
| HEPES | Sigma | H3375 | |
| Injection pump | Drummond Scientific company | 3-000-207 | |
| Isoflurane | RWD Instruments | R510-22 | |
| Laser scanning confocal microscope | Zeiss | LSM980 | |
| MluI | Thermo | FD0564 | |
| NheI | Thermo | FD0974 | |
| Optical fibers | RWD Instruments | R-FC-L-N3-200-L1 | |
| Paraffin oil | Sangon | B500301 | |
| PCR thermal Cycler | analytik jena | Biometra Tone 96G | |
| Pentobarbital sodium | Sinopharm Chemical Reagent Co.LTD | 57-33-0 | |
| Potassium chloride | Sigma | P5405 | |
| PrimeSTAR HS DNA Polymerase | Takara | R010A | |
| Programmable micropipette puller | Sutter Instruments | P2000 | |
| Quick self-curing acrylic resin | Yamahachi | V-PINK | |
| Real-time PCR thermal Cycler | analytik jena | qTOWER³ auto | |
| Rhodamine 800 | Sigma | 83701 | |
| SalI | Thermo | FD0644 | |
| Sodium chloride | Sigma | S9888 | |
| Sodium phosphate dibasic | Sigma | S9763 | |
| Stereotaxic apparatus | RWD Instruments | E06354 | |
| Veterinary ophthalmic ointment | Puralube | NA | |
| XhoI | Thermo | FD0694 |
Referanslar
- Vyas, S., Zaganjor, E., Haigis, M. C. Mitochondria and cancer. Cell. 166 (3), 555-566 (2016).
- Dzbek, J., Korzeniewski, B. Control over the contribution of the mitochondrial membrane potential (ΔΨ) and proton gradient (ΔpH) to the protonmotive force (Δp): IN SILICO STUDIES. J Biol Chem. 283 (48), 33232-33239 (2008).
- O'Rourke, B., Cortassa, S., Aon, M. A. Mitochondrial ion channels: Gatekeepers of life and death. Physiology. 20 (5), 303-315 (2005).
- Chan, D. C. Mitochondrial fusion and fission in mammals. Annu Rev Cell Dev Biol. 22 (1), 79-99 (2006).
- Jin, S. M., Lazarou, M., Wang, C., Kane, L. A., Narendra, D. P., Youle, R. J. Mitochondrial membrane potential regulates PINK1 import and proteolytic destabilization by PARL. J Cell Biol. 191 (5), 933-942 (2010).
- Ly, J. D., Grubb, D. R., Lawen, A. The mitochondrial membrane potential (deltapsi(m)) in apoptosis; an update. Apoptosis. 8 (2), 115-128 (2003).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Meng, X. -. Y., et al. A sensitive mitochondrial thermometry 2.0 and the availability of thermogenic capacity of brown adipocyte. Front Physiol. 13, 977431 (2022).
- Kaestner, L., et al. Genetically encoded voltage indicators in circulation research. Int J Mol Sci. 16 (9), 21626-21642 (2015).
- Yang, H. H., St-Pierre, F. Genetically encoded voltage indicators: Opportunities and challenges. J Neurosci. 36 (39), 9977 (2016).
- Sepehri Rad, M., Cohen, L. B., Braubach, O., Baker, B. J. Monitoring voltage fluctuations of intracellular membranes. Sci Rep. 8 (1), 6911 (2018).
- Yang, R. -. Z., Wang, D. -. D., Li, S. -. M., Liu, P. -. P., Kang, J. -. S. Development and application of a mitochondrial genetically encoded voltage indicator in narcosis. Neurosci Bull. 40 (10), 1529-1544 (2024).
- Kumari, A., Nguyen, D. M., Garg, V. Patch-clamp technique to study mitochondrial membrane biophysics. J Gen Physiol. 155 (8), e202313347 (2023).
- Bayne, A. N., Dong, J., Amiri, S., Farhan, S. M. K., Trempe, J. -. F. MTSviewer: A database to visualize mitochondrial targeting sequences, cleavage sites, and mutations on protein structures. PLoS One. 18 (4), e0284541 (2023).
- Kim, B. B., et al. A red fluorescent protein with improved monomericity enables ratiometric voltage imaging with ASAP3. Sci Rep. 12 (1), 3678 (2022).
- Evans, S. W., et al. A positively tuned voltage indicator for extended electrical recordings in the brain. Nat Methods. 20 (7), 1104-1113 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır