Method Article
In vivo centrifugazione di embrioni di Drosophila
In questo articolo
Riepilogo
Descriviamo un metodo per separare gli organelli dalla densità del vivere Drosophila Embrioni. Gli embrioni sono inseriti in agar e centrifugato. Questa tecnica produce separazione riproducibile organuli principali lungo l'asse antero-posteriore dell'embrione. Questo metodo facilita esperimenti colocalizzazione e rendimenti frazioni organello per analisi biochimiche e di esperimenti di trapianto.
Abstract
Una strategia importante per purificare e isolare i diversi tipi di organelli intracellulari è quello di separare gli uni dagli altri sulla base di differenze di densità di galleggiamento. Tuttavia, quando le cellule sono interrotte prima della centrifugazione, proteine e organelli in questo non-native ambiente spesso impropriamente unirsi tra di loro. Qui si descrive un metodo per separare gli organelli dalla densità in intatto, embrioni vivi Drosophila. Embrioni precoci prima cellularization vengono raccolte dalle gabbie della popolazione, e la loro gusci d'uovo esterni vengono rimossi dal trattamento con il 50% di candeggina. Gli embrioni vengono poi trasferiti ad una piastra di agar piccole e inserito, estremità posteriore prima in piccoli fori verticali in agar. Le piastre contenenti embrioni incorporati vengono centrifugati per 30 minuti a 3000g. L'agar supporta gli embrioni e li mantiene in un orientamento definito. In seguito, gli embrioni sono scavate nella agar con un ago smussato.
Centrifugazione separa organuli principali in strati distinti, una stratificazione facilmente visibile da campo chiaro microscopia. Un certo numero di marcatori fluorescenti sono disponibili per confermare stratificazione successo in embrioni vivi. Proteine associate con alcuni organelli sarà arricchita da uno strato particolare, dimostrando colocalizzazione. Singoli strati possono essere recuperati per l'analisi biochimiche o il trapianto in uova donatore. Questa tecnica è applicabile per la separazione degli organelli in altre cellule di grandi dimensioni, comprese le uova e ovociti di specie diverse.
Protocollo
1) Preparazione di piastre di agar
Descrizione: Questo protocollo utilizza piastre di agar per due usi distinti. In primo luogo, le piastre di agar servire come superficie di raccolta di uova, succo di mela in agar stimola la deposizione delle uova. In secondo luogo, gli embrioni incorporati nel agar si svolgono in un orientamento fisso, quando i piatti vengono centrifugati; una concentrazione sufficientemente elevata di agar è necessaria per evitare che le piastre di disintegrarsi durante la centrifugazione. Per ragioni di semplicità, un unico tipo di agar succo di mela è utilizzata per entrambi gli usi.
Materiale
- Agar (25 g)
- Saccarosio (25 g)
- Succo di mela (250 ml)
- Nipagin M soluzione madre (5 g di metil-p-idrossi-benzoato in 50 ml di etanolo), agisce come conservante
- Piastre di Petri: per centrifugazione (60x15mm) e per la raccolta delle uova (60x15 mm o 100x15 millimetri, a seconda delle gabbie volo utilizzato nel passaggio 2)
Attrezzatura
- Placca di cottura
- Due beute
- In una beuta, unire 25 g di agar e 750 ml di dH 2 O. Autoclave per 50 minuti su ciclo liquido. Nel frattempo, preparare la soluzione di succo di mela (punto 1.2).
- In un'altra beuta, unire 25 g di saccarosio e 250 ml di succo di mela. Calore sulla piastra calda (a circa 55 ° C) per sciogliere saccarosio. Poi aggiungere 15 ml di soluzione M Nipagin. Evitare temperature più elevate, in quanto causerà Nipagin ad abbattere.
- Una volta che la soluzione di agar è raffreddato a sufficienza che il pallone può essere gestita a mano, combinare le due soluzioni e mescolare accuratamente. Mescolare su piastra calda fino mescolata in modo omogeneo.
- Versare la soluzione in piastre di Petri (~ 0.5 cm di altezza). 1 litro di soluzione è sufficiente per circa 100 piccoli (diametro 60 mm) o 40 grandi (100 mm di diametro) piatti.
- Piastre di agar deve asciugare per diverse ore o tutta la notte a temperatura ambiente, altrimenti sarà troppo umido per l'uso. Per la conservazione a lungo termine, tenerli avvolti (in bidoni di plastica o maniche capsula di Petri) a 4 ° C.
2) raccolta embrioni
Descrizione: Durante le prime 3 ore di sviluppo (a temperatura ambiente), gli embrioni di Drosophila sono singole cellule (non contando la linea germinale precursori, le cellule polo situato posteriormente). Quando gli embrioni correttamente orientato di queste fasi vengono centrifugati, gli organuli principali separata densità lungo l'asse dell'uovo. Nella fase cellularization, questo a grandi cellule singolo viene convertito in migliaia di piccole celle, le forze di centrifugazione impiegato non la rottura di queste cellule. Per la segregazione di successo di organuli principali, è quindi fondamentale per centrifuga embrioni che non hanno ancora completato cellularization.
Materiale
- Succo di mela piastre di agar
- Lievito di pasta (lievito secco mescolato con acqua di burro di arachidi coerenza)
Attrezzatura
- Vola gabbie: disponibile in commercio (vedi sotto) o fatti in casa 1
- Mosche adulte vengono tenuti in gabbie a cui piastre di agar succo di mela sono apposto in basso. Utilizzare una dimensione di Petri appropriato per le gabbie in uso.
- Per iniziare una raccolta delle uova, preparare un piatto fresco succo di mela e agar coprire una porzione di pasta lieviti. Moscerini della frutta mangiare lievito, in particolare, lievito fornisce alimentazione per la produzione di uova. La presenza di lievito e succo di mela in agar induce anche la deposizione delle uova.
- Per scambiare il vecchio con il nuovo piastra di agar, la gabbia mosca è invertita e sbattuto sul banco un paio di volte. Le mosche cadrà verso il basso e sono brevemente disorientati. Che ti dà pochi secondi per rimuovere rapidamente una piastra agar e sostituirlo con uno nuovo. Questo scambio ha una certa pratica, e dettagli dipendono dal tipo di gabbia impiegato.
- Femmina vola sperma negozio da accoppiamenti precedenti in buste interne (spermathecae) da cui viene rilasciato lo sperma per consentire la fecondazione di uova. Quando ben nutriti e indisturbato, le femmine depongono le uova poco dopo la fecondazione, e così il periodo di deposizione delle uova segna il momento della fecondazione e l'inizio dello sviluppo. Quando le condizioni non sono ottimali, le femmine tenere uova fecondate per tempi variabili prima della posa. Per ridurre al minimo il numero di tali errori di scena embrioni, si consiglia di scartare la prima collezione della giornata di lavoro (un "pre-collezione" di 30 a 60 minuti è sufficiente). La presenza del lievito fresco induce le donne a porre queste uova tenute, e le collezioni d'uovo successive tendono ad essere dominati da uova depositate subito dopo la fecondazione.
- Raccogliere le uova per un massimo di 3 ore, a seconda di quale si desidera fase embrionale. Dal momento che a cellularization temperatura ambiente si completa dopo circa 3.5 ore, tempi di incasso più lunghi non sono utili. Stratificazione più consistente è realizzato in embrioni di giovani, quindi per gli esperimenti di routine abbiamo favore tempi di incasso più brevi (1 orao meno).
- A volte le mosche si blocca al lievito o per la superficie della piastra di agar. Rimuoverle con una pinzetta.
3) Rimozione del guscio d'uovo dal embrioni
Panoramica: embrioni di Drosophila sono coperti da due strati di protezione: uno strato esterno (corion) fatta di proteine e uno strato interno (membrana vitellina) prevalentemente fatto di cera. Proteggono l'embrione contro gli insulti meccanici ed essiccazione. Il corion ha due estensioni (i filamenti uovo o appendici dorsali) che sono facilmente visibili come strutture distinte. In questa fase, rimuoveremo il corion immergendo le uova nel 50% di candeggina. Una volta che il corion è stato rimosso, l'embrione diventa trasparente a luce trasmessa, che consente la selezione di specifiche fasi embrionali per la centrifugazione. Come il corion anche interferire con molti post-centrifugazione procedure (ad esempio, la fissazione al punto 6), la rimozione del corion ora permette l'elaborazione veloce tardi.
Il trattamento candeggina 50% sciogliere il corion in pochi minuti, ma non danneggiare l'embrione. La membrana vitellina mantiene il fuori candeggina. Noi continueremo il trattamento fino a quando la candeggina filamenti d'uovo non sono più visibili. In seguito, ci separerà gli embrioni dalla candeggina versando l'embrione / candeggina liquami attraverso un setaccio piccolo (un cesto in rete metallica). E 'fondamentale non affrettare il passo candeggina esposizione. Se la candeggina è lavato via prematuramente, fasi successive (ad esempio, la rimozione della fissazione membrana vitellina seguente) potrebbe essere compromessa.
Materiali:
- Spruzzatore con il 50% di candeggina (un volume dH 2 O ad un volume di candeggina commerciale)
- Spruzzatore con dH 2 O
- Tovagliolo di carta
Attrezzatura:
- Cestelli in casa di lamiera di maglia di acciaio fili di acciaio. Per fare cesti, tagliare quadrati di circa 2 x 2 cm dalla lamiera piana e li trattino in mezzo.
- Pinzette per tenere cestelli
- Microscopio da dissezione impostato per transilluminazione
- Posizionare la piastra di agar sotto un microscopio da dissezione e osservare gli embrioni da transilluminazione. Assicurati di identificare i filamenti di uova (vedi Figura 2A).
- Bagnate candeggina al 50% sulla piastra di agar, che copre gli embrioni. Agitare la piastra di agar tanto in tanto per agitare il embrioni in giro per la candeggina.
- Una volta che i filamenti di uova non sono più visibili (tipicamente dopo 3-5 minuti, ma i tempi possono variare), il corion è stato rimosso con successo.
- Nella fase successiva, un cestino di rete metallica sarà utilizzato come setaccio per separare gli embrioni dalla candeggina. Afferra il cestello con le pinzette e tenerlo sopra il coperchio rovesciato della piastra di agar. La copertina servirà come serbatoio per catturare la candeggina stillicidio attraverso la rete metallica.
- Versare la candeggina / embrione liquami dalla piastra di agar attraverso la rete metallica.
- Se un numero significativo di embrioni rimangono sulla piastra di agar, squirt dH 2 O sul piatto e versare il liquame O DH 2 / dell'embrione attraverso la rete metallica. Se un numero significativo di embrioni sconfini nel serbatoio, versare il contenuto serbatoio attraverso la rete metallica.
- Toccare il fondo della rete metallica di un tovagliolo di carta a cancellare via il liquido in eccesso. Poi squirt dH 2 O sulla rete metallica a sciacquare candeggina rimanenti. Come descritto sopra, il coperchio può essere usato come serbatoio di recuperare eventuali embrioni accidentalmente lavato via. È possibile ridurre la perdita di embrioni puntando il flusso di acqua dalla bottiglia squirt lungo il perimetro del cestello. Frequentemente macchia eliminare il liquido in eccesso.
- Ripetere questa fase di lavaggio cinque a dieci volte, fino a quando tutti candeggina è stato rimosso. Se il cestello odora ancora di candeggina, il lavaggio deve continuare.
Embrioni 4) Montaggio in agar
Panoramica: le uova di Drosophila sono molto più lunghi (~ 500 micron) che largo (~ 180 micron). Per ottenere la massima separazione e coerente di organelli durante la centrifugazione, abbiamo embrioni orientare in modo tale che il loro punto anteriore estremità verso il centro di rotazione (Figura 1, 3). In questo modo, il più leggero strutture intracellulari (gocce lipidiche) si accumulano al termine anteriore in tutti gli embrioni, mentre le strutture molto denso (componenti tuorlo) si accumulano vicino all'estremità posteriore. Gli embrioni vengono inseriti in piccoli fori verticali in agar succo di mela, con le estremità anteriore spuntava. L'agar mantiene l'embrione in un orientamento fisso durante la centrifugazione.
Attrezzatura:
- Porta aghi
- Aghi di tungsteno, gli aghi sono montati nel supporto all'indietro dall'orientamento tipici, in modo che l'estremità smussata sporge ed è disponibile per manipolare gli embrioni
- P200 pipettatore
- Microscopio da dissezione impostato per transillumination
- Vola pennello (pennello piccolo utilizzato per ordinare adulti Drosophila)
Materiali:
- Triton Salt Solution (TSS): 4g NaCl, 0,3 ml di Triton X-100, si riempiono di DDH 2 O a 1000 ml (può essere fatto come una soluzione madre 10x)
- Lavare gli embrioni fuori dal cestello con TSS e in un piatto vuoto Petri. Gli embrioni devono depositano sul fondo. Trasferire la piastra Petri contenente gli embrioni in TSS su un ambito sezionare e osservare da transilluminazione (embrioni saranno simili a quelli raffigurati nella Figura 4).
- Usando una pipetta P200, selezionare gli embrioni di fasi desiderate e trasferirle ad una piccola piastra di agar. Fasi specifiche possono essere facilmente riconosciuti visivamente (Figura 4, per maggiori dettagli, vedi 1). Lavorare velocemente dato che gli embrioni stanno invecchiando e prolungata immersione (più di 30 minuti) in TSS possono influenzare lo sviluppo.
- Rimuovere la maggior parte TSS con una pipetta e un Kimwipe. La superficie del agar deve essere leggermente umido che rende più facile spingere gli embrioni in giro. Tuttavia, non ci dovrebbero essere pozze di liquido restante in qualsiasi punto della piastra in quanto il liquido in eccesso durante la centrifugazione farà sì che gli embrioni di scivolare fuori dei fori.
- Utilizzando un ago, poke fori verticali nell'agar vicino ovunque un embrione si trova. E 'difficile colpire i fori che sono perfettamente verticali, perché si deve tenere l'ago in un angolo per essere in grado di guardare contemporaneamente sotto il microscopio. Una minore inclinazione dell'ago è in realtà vantaggioso perché questo crea una leggera depressione / boschetto su un lato del foro in modo che l'embrione sarà facile scivolare lungo e nel foro. E 'sufficiente per forare la superficie del dato che l'agar agar è abbastanza morbida che una volta che un embrione è parzialmente inserito in un foro che può essere spinta in più senza danni.
- Assicurati di riconoscere le estremità anteriore e posteriore degli embrioni, in quanto gli embrioni devono essere spinto nei fori in un orientamento coerente, di solito con l'estremità anteriore up. La membrana vitellina alla fine anteriore è caratterizzato da una struttura specializzata, il micropilo (Figura 2), attraverso la quale lo spermatozoo entra durante la fecondazione.
- Utilizzando la punta smussata dell'ago, si può spingere contro l'embrione di muoversi lungo la agar e di orientare / manovrare la sua estremità posteriore verso un buco forato. Quindi spingere contro l'estremità anteriore verso il buco. Questo dovrebbe facilmente scivolare l'embrione nel foro lungo la lieve depressione generata durante pungere. Come l'embrione inclina verso l'alto, spingerla più giù nel buco.
- Quando è completamente premuto, l'embrione è di solito già abbastanza verticale. In caso contrario, è possibile allineare l'embrione inserito più in verticale premendo su di esso lateralmente. Se il buco non è troppo grande, la posizione embrione sarà stabilmente detenuti dal agar in tutto centrifugazione.
- Con la pratica, è possibile incorporare 100-250 embrioni per piastra. Dipenderà l'applicazione specifica quanti sono necessari: se gli embrioni sono utilizzati per l'imaging dal vivo o come donatori per esperimenti di trapianto, solo pochi sono obbligatori. Se gli embrioni devono essere fissi e immunoistochimica, una frazione verranno persi durante la post-elaborazione centrifugazione, e si deve iniziare con numeri più alti. Tieni presente che gli embrioni continuare a sviluppare durante il montaggio, quindi se uno stadio di sviluppo stretto è desiderato, il tempo complessivo per esigenze di montaggio di essere tenute corte.
- Se ci sono residui di embrioni che non sono stati incorporati, toglierli dalla piastra con uno spazzolino inumidito volare. Immergere il pennello volare in liquidi (1xTSS ad esempio), asciugare con cura tutta la parte superiore della piastra (mentre si guarda nell'ambito di applicazione dissezione) per spazzare via ogni residuo di embrioni, e lavare gli embrioni fuori dal pennello immergendo il pennello nel liquido di nuovo.
5) centrifugazione e recupero degli embrioni
Sommario: Le piastre vengono trasferiti secchi oscillante di un Sorvall RT7 Inoltre centrifuga e centrifugati per 30 min a 4000 giri, che corrisponde a ~ 3000 g. Dopo centrifugazione, le piastre sono ricoperte di TSS. Con un ago, gli embrioni vengono scavate le buche nelle agar e trasferito in recipienti appropriati attraverso una pipetta.
Attrezzatura:
- Porta aghi con ago (come prima)
- Sorvall RT7 Plus con RTH750 rotore oscillante e secchi, o equivalente 2
- Microscopio da dissezione impostato per transilluminazione
- P200 pipettatore
Materiali:
- TSS
- Trasferire le piastre a secchi oscillante del lato centrifuga, agar giù. Assicurarsi centrifuga è in equilibrio.
- Impostazioni per centrifugazione: temperatura = 4-10 ° C, = 4000 rpm, tempo = 30 min.
- Dopo l', piastra agar centrifugazione posto sotto il microscopio da dissezione di nuovo e coprire la piastra con uno strato di TSS.
- Con la BLunt fine dell'ago, scavare gli embrioni dai loro buchi. Si galleggia in TSS, ma rimarrà sommersa.
- Gli embrioni apparirà ovviamente a strati, con un berretto marrone alla fine anteriore, una regione centrale chiaro e scuro, zona grigia al termine posteriore (Figura 2, 5A). Scartare gli embrioni che non riescono a mostrare stratificazione distinte.
- Usando una pipetta P200, il trasferimento di ben stratificato embrioni in TSS ad un nuovo peschereccio, ad esempio, una fiala di scintillazione o provetta, a seconda dell'applicazione.
6) L'ulteriore lavorazione
A seconda dell'applicazione, gli embrioni verranno successivamente trattate in vari modi.
- Per l'osservazione diretta al microscopio luminoso-campo o epifluorescenza, gli embrioni vengono trasferiti in buffer su un vetrino, e montato sotto di mm 22x22 # 1.5 coprioggetto, da mm 18x18 # 1 coprioggetto come distanziatori. Per le osservazioni a lungo termine, può essere necessario sostituire il tampone con l'olio alocarburi 27.
- Se gli embrioni devono essere fissati, dovrebbero essere trasferiti al passo 5,6 a una fiala di scintillazione. Possono quindi essere fissato utilizzando tecniche di fissazione standard 1. Queste tecniche tipicamente impiegano agitazione in un eptano-metanolo emulsione per rimuovere la membrana vitellina. Si noti che per gli embrioni centrifugati l'efficienza di questo passo devitellinization è bassa. E 'quindi consigliabile iniziare con embrioni ben pratica o per rimuovere la membrana vitellina manualmente 1.
- Se gli embrioni saranno utilizzati in esperimenti di trapianto (ad esempio, per rimuovere uno strato particolare organello dagli embrioni centrifugati), vengono trasferiti in piastre di agar e montati su vetrini coprioggetto, utilizzando le procedure standard come per gli embrioni non centrifugati 3. La stratificazione indotta dalla centrifugazione è stabile per decine di minuti.
7) Rappresentante risultati
Se la centrifugazione ha funzionato come previsto, gli organuli principali embrionali risolvere la densità 2. Per esempio, la bassa densità di gocce lipidiche si accumulano al termine anteriore, ad alta densità vescicole tuorlo si accumulano alla fine posteriore (Figura 1, 2). Gocce lipidiche e vescicole tuorlo sono organelli di stoccaggio per i lipidi e le proteine.
La conferma della densità-dipendente stratificazione avviene tramite ispezione visiva degli embrioni da vivere transilluminazione sotto un microscopio da dissezione o composti. Gli embrioni dovrebbe apparire come in Figura 5A: Le goccioline lipidiche formerà uno strato solido marrone sulla punta molto anteriore (un "tetto di lipidi"); accumulo tuorlo si tradurrà in una zona grigio scuro alla fine posteriore. Questi due strati scuri sono separati da una ampia zona chiara che rappresenta altri organelli e nel citoplasma. Se gli embrioni vengono centrifugati dopo cellularization, stratificazione sarà minima (Figura 5C).
Se un microscopio a epifluorescenza è disponibile, questi, gli embrioni viventi centrifugati può essere esaminato sotto eccitazione UV. In queste condizioni, il tuorlo mostra intenso autofluorescenza blu (Figura 5B). Uno strato compatto di materiale autofluorescenti al polo posteriore indica centrifugazione successo e serve come un marcatore per la fine posteriore.
Si noti che l'aspetto di questi livelli cambieranno drasticamente se gli embrioni sono fissi. Per esempio, quando gli embrioni sono fissati dalla norma fissazione al calore o formaldeide seguita da eptano-metanolo devitellinization 1, gocce lipidiche diventano traslucidi e lo strato lipidico appare biancastro e spumoso dalla luce intensa microscopia, piuttosto che marrone scuro (Figura 5D). Tuorlo autofluorescenza è parzialmente o completamente distrutte da fissazione, diventando molto meno intenso o addirittura non rilevabili.
Se in vivo centrifugazione viene utilizzato per evidenziare una particolare organello, è utile per etichettare organello che con un marcatore fluorescente per la conferma. Per esempio, proteine di fusione YFP mirati ai mitocondri, al pronto soccorso o il Golgi sono state descritte 4. Negli embrioni centrifugati, questi marcatori si accumulano in posizioni caratteristiche lungo l'asse antero posteriore (Figura 1). Infine, alcune proteine di fusione degli istoni sia per localizzare gocce lipidiche e nuclei 2, e quindi può essere usato per marcare questi compartimenti cellulari (Figura 5 E, F), nonché di monitorare la fase dell'embrione (in base al numero di nuclei etichettate) . Vola ceppi che esprimono i marcatori di cui al presente paragrafo sono disponibili presso il magazzino centrale Bloomington Drosophila (http://flystocks.bio.indiana.edu/). Per H2Av istone, entrambe le varianti GFP e MRFP sono disponibili 5, 6

Figura 1. Separazione di organelli mediante centrifugazione (modificato dopo 2). Centrifugazione del orientata risultati embrioni nella stratificazione distinte(Luce). Organuli principali accumularsi in posizioni caratteristiche lungo la parte anteriore (up) - posteriore (in basso) Asse: gocce lipidiche (rilevato in embrioni stabilito dalla colorazione rossa del Nilo), reticolo endoplasmatico, Golgi, e mitocondri (rilevati in embrioni vivi attraverso i marcatori YFP descritto nella il testo principale), tuorlo (rilevato da autofluorescenza). Le immagini di fluorescenza sono state acquisite al microscopio confocale.

Figura 2. Rappresentazione schematica degli embrioni.
A. uovo con il guscio d'uovo e dei filamenti d'uovo prominente (appendici dorsali). Come il guscio d'uovo non è trasparente, l'uovo appare uniformemente scuro.
B. Uovo con corion rimosso. Al termine anteriore (a sinistra), il micropilo è visibile. A seconda della fase di sviluppo, l'embrione all'interno della membrana vitellina apparirà uniformemente marrone scuro o mostrare le varie strutture. Vedi Figura 4 per gli esempi.
C. Centrifugato embrione, orientato come nel protocollo qui descritto. Gocce lipidiche si accumulano come un marrone "cappello" alla fine micropilo; tuorlo forma uno strato grigio in corrispondenza o in prossimità del lato opposto.
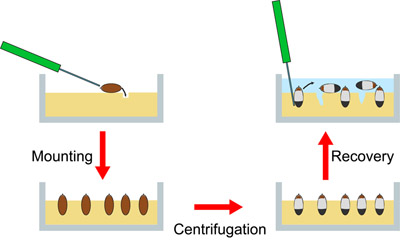
Figura 3. Descrizione schematica della procedura. A sinistra: embrioni, senza corion sono posti sulla parte superiore di una piastra di agar e spinto con un ago nei buchi in agar. Questo montaggio traduce in un orientamento coerente di tutti gli embrioni, con anteriore finisce. A destra: Dopo la centrifugazione, gli embrioni sono stratificati. Agar è ricoperto di TSS (blu), e gli embrioni vengono recuperati dal agar con l'ago. Una volta sospeso in TSS, gli embrioni possono essere raccolti con una pipetta.
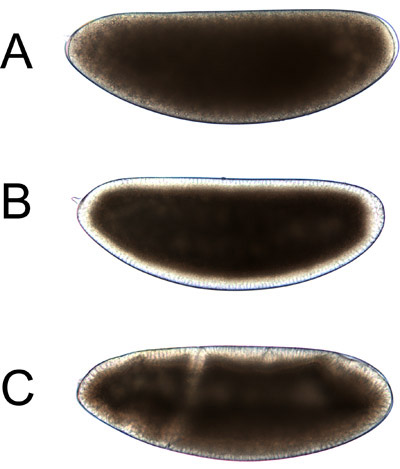
Figura 4. Bright-luce immagini di embrioni di Drosophila vivente, simile a come appariranno al punto 4.1. Gli embrioni sono mostrati in orientamento standard: estremità anteriore a sinistra, estremità posteriore a destra, a lato dorsale e ventrale laterale verso il basso. Un time-lapse film di embriogenesi precoce è disponibile come parte del video che accompagna questo protocollo.
A. embrioni fase Cleavage appare uniformemente marrone. Fasi come questa sono l'ideale per in-vivo centrifugazione.
Embrioni Blastoderm B. hanno un bordo chiaro che appare simile su tutti i lati. Questo periferia chiaro è in parte causata da accumulo di nuclei a livello della membrana plasmatica e in parte a causa di trasporto interno di vescicole tuorlo e gocce lipidiche 7. Questo periferia chiaro espande fino verso la fine del cellularization 1. Gli embrioni possono essere ancora successo stratificato per centrifugazione fino alla fine del cellularization 8, anche se la stratificazione di tuorlo e dei nuclei non è così costante come nelle fasi scissione.
C. Dopo cellularization, embrioni appaiono asimmetrici; lati dorsale e ventrale diventano distinte e diverse pieghe si sviluppano. L'embrione è mostrato nei primi germi banda d'estensione. In queste fasi, centrifugazione è più efficace nel stratificando gli organelli importanti.
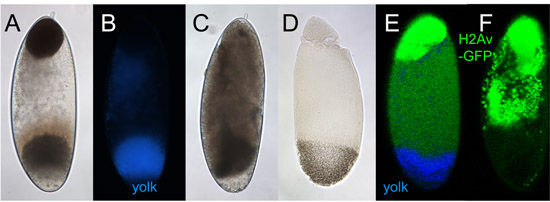
Figura 5. Embrioni centrifugato. Tutti gli embrioni in questa cifra sono stati centrifugati con le loro estremità anteriore e sono mostrati in questa posizione.
A. Bright-luce immagine di un embrione con successo centrifugato. Uno strato bruno alla fine anteriore è a causa di accumulo di lipidi goccia. Un ampio strato grigio verso la fine posteriore è a causa di vescicole tuorlo. C'è spesso una zona chiara di sotto dello strato d'uovo, di origine sconosciuta. Una zona giallognolo è spesso apparente sopra il livello di tuorlo e rappresenta probabilmente mitocondri. Proteine solubili si trovano in tutto lo strato chiaro tra gocce lipidiche e tuorlo 2.
B. L'embrione in una visione al microscopio in epifluorescenza eccitazione UV. La caratteristica autofluorescenza blu di tuorlo aiuta a identificare la fine posteriore.
Embrione C. centrifugati durante germi banda d'estensione, cioè dopo cellularization. Tuorlo può ancora accumulare alla fine posteriore, ma per il resto stratificazione è minimo.
D. embrione stratificato con successo, dopo la fissazione di calore. La goccia lipidica-strato appare bianca e soffice, piuttosto che marrone scuro come in embrioni non fissate (A).
Embrioni E. & F. esprimendo His2Av-GFP e ripreso al microscopio confocale (modificato dopo 2). E: centrifugato a fasi scissione; His2Av-GFP sembra segnare solo la goccia lipidica-strato dato che pochi sono i nuclei formati da questo momento. In base al piano focale, i nuclei possono essere visibili appena sotto lo strato di goccia (non mostrati qui). F: centrifugato a fasi Blastoderm; His2Av-GFP segna sia la goccia strato di lipidi (in alto) e nuclei (in una zona ampia sotto lo strato di goccia).
Discussione
Passaggi critici
Assicurarsi che la concentrazione di agar è abbastanza alta. Se è troppo basso, l'agar-agar si disintegrerà durante la centrifugazione, e gli embrioni saranno scoppiare o essere orientati in modo casuale. Se la concentrazione di agar è solo un po 'troppo basso o se l'agar è bagnato (rimozione sufficientemente secchi o insufficiente di TSS eccesso al punto 4.3), gli embrioni galleggerà dai loro buchi durante la centrifugazione e diventare impropriamente oriented. Se l'agar è versato troppo sottilmente, sarà anche il collasso o crack durante la centrifugazione.
Assicurarsi che gli embrioni non hanno superato le fasi cellularization. In caso contrario, la separazione di organelli non funziona (Fig. 5C) dal organelli sarà sequestrato all'interno di migliaia di singole cellule. Nei giovani embrioni allo stadio di una cellula, organuli sono liberi di migrare grandi distanze e si accumulano in base alla loro densità caratteristica. Per evitare di analizzare gli embrioni che sono troppo vecchio, assicurarsi di (i) comportare un pre-raccolta per permettere alle femmine di deporre le uova vecchie (passo 2,4), (ii) raccogliere embrioni per 3 ore o meno (punto 2.5), (iii) visivamente selezionare gli embrioni prima di fasi cellularization per includerle in agar (punto 4.2), (iv) tenere incorporando poco tempo per prevenire lo sviluppo fino alla fine di cellularization (punto 4.6), e (v) scartare gli embrioni che non hanno strato correttamente (passo 5.6) .
Non lesinare sul tempo di centrifugazione. Anche se alcuni degli embrioni mostrerà stratificazione piacevole anche dopo soli 10 minuti di centrifugazione, la separazione è incoerente dall'embrione embrione. 30 giri min dare risultati altamente coerenti. Inoltre, più lungo è il tempo di centrifugazione, più a lungo i livelli sono stabili dopo la centrifugazione è terminata. Questo è importante per quelle applicazioni in cui ci vuole tempo per elaborare gli embrioni prima di essere utilizzati (per esempio, se hanno bisogno di essere trattati per esperimenti di trapianto o montato per l'analisi confocale).
Eventuali modifiche
Raccolta degli ovuli e corion rimozione Molti protocolli differenti esistono per i punti 2 e 3 1, 3, 9, e funzionerà così come quelli descritti qui fino a quando gli embrioni utilizzati sono giovani, resa uovo è alto, e la frazione di mis- embrioni in scena è ridotta al minimo.
Antero-posteriore allineamento Il protocollo orienta tutti gli embrioni tale che l'estremità posteriore è sepolto nel agar e la fine anteriore è alto (Fig. 3). Questo orientamento è un bene per coerenza, in modo che sia possibile utilizzare il micropilo come punto di riferimento che finiscono rivolta verso l'alto durante la centrifugazione (Fig. 1, 5). Tuttavia, con la pratica, è facile individuare l'orientamento degli embrioni centrifugati dalla comparsa distinte del lipidi goccia e strati tuorlo da campo chiaro microscopia. Allora diventa possibile montare sia con gli embrioni finiscono, questa flessibilità accelera il processo di montaggio.
Centrifugazione Unoriented L'aspetto più-in termini di tempo e tecnicamente impegnativo del protocollo è di montaggio degli embrioni in agar (punto 4). Si richiede di toccare ogni embrione due volte (una volta per inserirlo nel foro e una volta per recuperarlo dopo la centrifugazione). In alternativa, si può trasferire gli embrioni a passo 4,1 in provette da microcentrifuga pieno di TSS. Quando questi tubi vengono centrifugati in una microcentrifuga (13.000 giri al minuto, 10-30 min), gli embrioni anche tipicamente strato di ben 10-13. Questa variante permette di processare centinaia di embrioni, allo stesso tempo molto rapidamente. Tuttavia, la stratificazione non è così consistente, una parte degli embrioni non si sviluppano strati distinti, nonostante le forze di centrifugazione molto più alta (~ 16.000 g) che applicato il protocollo di cui sopra. Più impegnativo è il fatto che l'orientamento degli embrioni è variabile, e si può osservare la separazione a vari angoli rispetto all'asse principale embrione. Questa variabilità richiede lo sperimentatore di risolvere dopo la centrifugazione come un embrione particolare è stato organizzato nella provetta da centrifuga. Con l'uso del tuorlo autofluorescenza come marker per la maggior parte alta densità dell'embrione, questo è spesso possibile, anche se richiede molta pratica e giudizio di farlo in modo affidabile. Se ci sono embrioni sufficiente nel campione, si può essere in grado di risolvere quei casi in cui gli embrioni capitato di essere disposti come in fig. 1.
Centrifugazione degli embrioni nel loro guscio dell'uovo E 'possibile incorporare gli embrioni in agar per il passaggio 4 senza rimuovere il corion primi 2. In questo approccio, gli embrioni sulla piastra di raccolta sono coperti con olio alocarburi invece del 50% di candeggina al punto 3.2 (alocarburi trasforma il traslucido corion). Embrioni di stadi appropriati vengono selezionati e trasferito in una nuova piastra di agar con pinzette; afferrando solo i filamenti d'uovo con le pinze, danniil corretto embrione è evitato. Gli embrioni sono incorporati come nel passo 4,4 per 4,8, con i filamenti d'uovo anteriore attaccare fuori dal buco nel agar. Il guscio d'uovo viene rimosso da un trattamento di candeggina al 50% dopo che gli embrioni sono stati centrifugati e scavato nella agar come al punto 5.4. Centrifugazione, alla presenza del guscio dell'uovo può migliorare il tasso di devitellinization dopo fissazione (passo 6.2), ma la selezione degli stadi corretti per centrifugazione (passo 4.2) è più impegnativo.
Applicazioni
Centrifugazione embrione è particolarmente utile per gli esperimenti di colocalizzazione, cioè, per verificare se una particolare proteina localizza a un certo organello importante. Per esempio, la proteina Klar è presente sui primi gocce lipidiche embrionale, ma questa localizzazione è difficile da dimostrare in embrioni intatto. In parte, ciò è dovuto sia puncta Klar e gocce lipidiche sono abbondanti nella periferia embrione 10, rendendo colocalizzazione spurie difficili da escludere. Tuttavia, centrifugazione concentra gocce lipidiche in uno strato distinto, e, quindi, colocalizzazione con segnale Klar diventa evidente 10.
Un'analisi simile è dimostrato in modo inequivocabile la localizzazione di altre proteine di gocce lipidiche 8, 13-15, con esempi sorprendente come alcuni istoni 2 e nei casi in cui una proteina è presente ubiquitariamente, ma arricchito di gocce lipidiche 8. Come gli embrioni possono essere selezionate visivamente da stadio di sviluppo (punto 4.2), è anche possibile rilevare l'assunzione di proteine evolutivamente regolata a gocce lipidiche 8, 15. Test per colocalizzazione con gocce lipidiche è particolarmente semplice, visto che si accumulano gocce lipidiche in una visivamente distinte "cap", in modo che nessun ulteriore marker o macchia è necessario per identificare questo strato. Infatti, a causa della sua facilità e risultati visivi potenzialmente sorprendenti (Fig. 1, Fig. 5. D, E), il nostro laboratorio utilizza questa tecnica ormai di routine come un primo test se una proteina è localizzata per il candidato gocce lipidiche. In linea di principio, gli studi di colocalizzazione simile dovrebbe lavorare per il organelli altri mostrato in fig. 1, e probabilmente per gli altri (compresi i parassiti intracellulari), la cui distribuzione negli embrioni centrifugati deve ancora essere documentati.
Dal centrifugazione concentra organelli in bande strette, facilita l'isolamento di una frazione arricchita in questi organelli. Questo approccio è già stato utilizzato per il recupero gocce lipidiche per il trapianto in embrioni di donatori 2. Può anche essere possibile analizzare biochimicamente la frazione arricchito (ad esempio, tagliando strati off embrioni dopo la fissazione 15).
Il metodo descritto qui ha applicazioni che vanno oltre gli embrioni di Drosophila, la centrifugazione può essere utilizzata per stratificare le uova di diverse specie (tra cui le rane, nematodi, tunicati, anellidi, ricci di mare, molluschi e Cnidari) 16. Nel nostro laboratorio, abbiamo usato il protocollo di cui sopra per gli embrioni di Musca domestica mosca 2 e hanno impiegato centrifugazione unoriented per l'analisi di embrioni dal moscerino fungo Sciara coprophila 17 e la lumaca Ilyanassa obsoleta 17. Infine, questo metodo non è limitato agli embrioni: centrifugazione può anche essere utile per stratificare altre cellule di grandi dimensioni, come gli ovociti (ad esempio, in Drosophila 2, 18 e l'euforbia bug Oncopeltus fasciatus 17). Per diversi esemplari, le condizioni di centrifugazione esatti devono essere ottimizzati: per esempio, 10 minuti a 3000 g è sufficiente per stratificare efficacemente embrioni di Musca domestica 2, e se centrifugati molto più lungo, gli embrioni tendono a rompersi durante la fissazione e immunocolorazione.
Divulgazioni
Riconoscimenti
Ringraziamo Susan Gerbi, Heidi Smith e David Lambert per la fornitura di materiale per testare in vivo sui centrifugazione Sciara coprophila e Ilyanassa obsoleta, rispettivamente. Ringraziamo i membri del laboratorio Welte per commenti sulla tecnica e manoscritto. Sviluppo e la raffinatezza del test in vivo centrifugazione è stato sostenuto da NIGMS concedere GM64687 a MAW. Le immagini mostrate in fig. 1 e fig. 5E, F sono stati precedentemente pubblicato 2 e sono ristampato qui con il permesso.
Materiali
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 60x15 mm Petri dishes | Becton Dickinson | #35-1007 | From Falcon | |
| Wire mesh | Small Parts | CX-0150 | stainless steel type 304; mesh size #150 x150, wire diameter: 0.0026 inches | |
| Tungsten needles | Fine Science Tools | 10130-10 | 0.25 mm | |
| Moria Nickel Plated Pin/Needle Holder | Fine Science Tools | 26016-12 | ||
| Fly Cages | Genesee Scientific | 59-100 or 59-101 | For 65 mm or 100 mm diameter Petri dishes, respectively | |
| Halocarbon Oil 27 | Sigma | H8773 |
Riferimenti
- Wieschaus, E., Nüsslein-Volhard, C., Roberts, D. B. Looking at embryos. Drosophila: A Practical Approach. , 179-214 (1998).
- Cermelli, S., Guo, Y., Gross, S. P., Welte, M. A. The lipid droplet proteome reveals that droplets are a protein storage depot. Curr Biol. 16, 1783-1795 (2006).
- Kiehart, D. P., Crawford, J. M., Montague, R. A., Sullivan, W., Ashburner, M., Hawley, R. S. Quantitative microinjection of Drosophila embryos. Drosophila Protocols. , 345-359 (2000).
- LaJeunesse, D. R. Three new Drosophila markers of intracellular membranes. Biotechniques. 36 (784-788), 790-790 (2004).
- Schuh, M., Lehner, C. F., Heidmann, S. Incorporation of Drosophila CID/CENP-A and CENP-C into centromeres during early embryonic anaphase. Curr Biol. 17, 237-243 (2007).
- Clarkson, M., Saint, R. A His2AvDGFP fusion gene complements a lethal His2AvD mutant allele and provides an in vivo marker for Drosophila chromosome behavior. DNA Cell Biol. 18, 457-462 (1999).
- Welte, M. A., Gross, S. P., Postner, M., Block, S. M., Wieschaus, E. F. Developmental regulation of vesicle transport in Drosophila embryos: forces and kinetics. Cell. 92, 547-557 (1998).
- Tran, S. L., Welte, M. A. unpublished observations. , .
- Rothwell, W. F., Sullivan, W., Sullivan, W., Ashburner, M., Hawley, R. S. Fluorescent analysis of Drosophila embryos. Drosophila Protocols. , 141-157 (2000).
- Guo, Y., Jangi, S., Welte, M. A. Organelle-specific Control of Intracellular Transport: Distinctly Targeted Isoforms of the Regulator Klar. Mol Biol Cell. 16, 1406-1416 (2005).
- Meyer, W. J. Overlapping Functions of Argonaute Proteins in Patterning and Morphogenesis of Drosophila Embryos. PLoS Genet. 2, 1224-1239 (2006).
- Shubeita, G. T. Consequences of motor copy number on the intracellular transport of kinesin-1-driven lipid droplets. Cell. 135, 1098-1107 (2008).
- Welte, M. A. Regulation of lipid-droplet transport by the Perilipin homologue LSD2. Curr. Biol. 15, 1266-1275 (2005).
- Phadnis, N., Welte, M. A. Unpublished Observations. , .
- Phadnis, N., Welte, M. A. Unpublished Observations. , .
- Morgan, T. H. Chapter XXII: The redistribution of the visible materials of the egg by centrifuging. Experimental Embryology. , (1927).
- Welte, M. A. Unpublished Observations. , .
- Bownes, M. Abnormal oogenesis and embryogenesis resulting from centrifuging Drosophila melanogaster females. J Embryol Exp Morphol. 40, 65-81 (1977).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon